Геморрагические лихорадки – это группа острых инфекционных заболеваний, вызванных представителями четырех видов вирусов: аренавирусами, буньявирусами, флавивирусами и филовирусами. Общим для этих заболеваний является тяжелая интоксикация и характерный тромбогеморрагический синдром.
Вирусы, вызывающие геморрагические лихорадки, широко распространены во многих странах мира. Некоторые встречаются и в развитых странах, однако эндемичными районами для большинства видов возбудителей являются Африка, Азия и Южная Америка.
Течение геморрагической лихорадки, в зависимости от возбудителя, может варьироваться от умеренного до крайне тяжелого. Смертность от отдельных вариантов инфекции составляет от 10 до 90 %. Определенные варианты геморрагической лихорадки приводят к тяжелому поражению внутренних органов и нередко к летальному исходу.
Прогноз заболевания зависит от типа вируса, возраста и общего состояния пациента, в частности от активности его иммунной системы.
Viral hemorrhagic fevers, hemorrhagicfevers, VHF, VHFs.
Симптомы геморрагических лихорадок различаются в зависимости от типа вируса, вызвавшего заболевание. Общими проявлениями для всех инфекций являются сама сильная лихорадка и повышенная кровоточивость. Симптомы в начальной стадии болезни чаще всего неспецифичны, однако в процессе дальнейшего развития патологического процесса могут появляться признаки поражения определенных органов и систем организма.
Основные симптомы геморрагических лихорадок:
- лихорадка;
- слабость, головокружение;
- мышечные боли;
- гиперемия кожи;
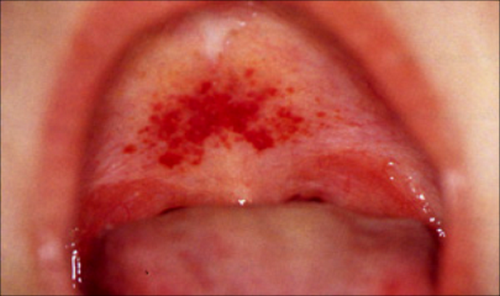
- петехиальная сыпь на коже и слизистых оболочках;
- нарушение сознания;
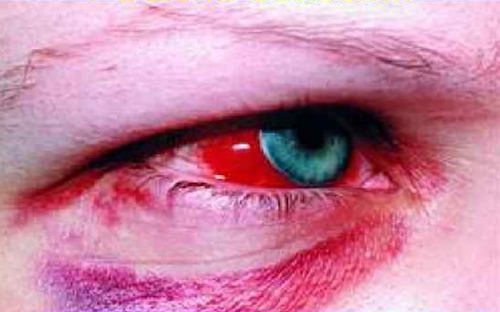
- покраснение глаз;
- кровь в стуле, рвота с кровью;
- падение артериального давления.
Общая информация о заболевании
Геморрагические лихорадки могут быть вызваны представителями четырех семейств РНК-содержащих вирусов: аренавирусами (Arenaviridae), буньявирусами (Bunyaviridae), филовирусами (Filoviridae) и флавивирусами (Flaviviridae). Аренавирусы вызывают лихорадку Ласса, аргентинскую, бразильскую, венесуэльскую и боливийскую лихорадку, буньявирусы – лихорадку Крым-Конго, лихорадку долины Рифт, геморрагическую лихорадку с почечным синдромом, филовирусы – лихорадку Эбола, флавивирусы – желтую лихорадку, лихорадку Денге и др.
«Резервуарами» вирусов служат некоторые животные и насекомые, чаще всего мелкие грызуны, летучие мыши, москиты, клещи. Как правило, определенные типы геморрагических лихорадок встречаются в основном на территории обитания тех животных, которые являются источником конкретного возбудителя. Например, источник вируса лихорадки долины Рифт, которая распространена на территории Африки, – это москиты. Геморрагическая лихорадка Крым-Конго встречается в Европе, Азии, Африке, ее распространяют клещи. Источник некоторых заболеваний, например лихорадки Эбола, остается неизвестен, предполагают, что им могут быть летучие мыши. Некоторые типы вирусов передаются через кровь или семенную жидкость зараженного животного или человека, через нестерильные иглы. Определенными возбудителями геморрагических лихорадок можно инфицироваться при вдыхании микрочастиц фекалий и мочи животных-переносчиков.
Все представители вирусов, вызывающих геморрагические лихорадки, объединены общим патогенезом. Они склонны поражать эндотелий сосудов, что объясняет развитие геморрагического синдрома при большинстве геморрагических лихорадок. После проникновения вируса в кровь через укусы насекомых, расчесы, ссадины, инъекции, слизистую дыхательных путей сначала формируется локальная реакция на инфекцию, вслед за которой быстро развивается вирусемия и генерализованное поражение системы микроциркуляции (вирус поражает также клетки сосудистой стенки). При проникновении возбудителя в кровь он прилипает к мембране клетки, проникает внутрь нее, активно размножается и распространяется по другим тканям организма. Это сопровождается выделением биологически активных веществ, которые нарушают проницаемость сосудов, реологические свойства крови. Проявлением этого процесса является сыпь, гиперемия кожи, покраснение сосудов склер, могут возникать внутренние кровотечения, сопровождаемые резким падением артериального давления, шоком. Ряд вирусов вызывает поражение костного мозга, в частности мегакариоцитов. Ослабление иммунной системы организма, слабый или запоздалый ответ защитных механизмов может приводить к стремительному развитию патологического процесса, сопровождаемому массивными кровотечениями, полиорганным поражением.
- Работающие с инфицированными людьми или животными, в частности медицинские работники, биологи, дератизаторы, работники скотоводческих ферм.
- Проживающие в эндемичных районах.
- Употребляющие внутривенные наркотики.
- Те, кто пренебрегает барьерными способами контрацепции.
Диагностика основана на анамнезе, осмотре, результатах лабораторных и инструментальных исследований. При опросе пациента обращается внимание на возможный контакт с возбудителем – путешествие в эндемичные по заболеванию регионы, контакт с животными-переносчиками или инфицированными людьми. Инкубационный период большинства геморрагических лихорадок составляет 10-21 день, поэтому болезнь может развиться уже после возвращения из путешествия в опасный район. При подозрении на наличие геморрагической лихорадки необходимо в условиях стационара в кратчайшие сроки провести ряд исследований, позволяющих дифференцировать болезнь от других заболеваний и установить тип возбудителя:
- Общий анализ крови (без лейкоцитарной формулы и СОЭ). В общем анализе крови при геморрагических лихорадках могут быть выявлены лейкопения и тромбоцитопения. В некоторых случаях, например при лихорадке Ласса, эти изменения отсутствуют. Уровень гемоглобина может понижаться.
- Скорость оседания эритроцитов (СОЭ). Может быть повышена.
- Протромбиновый индекс (ПИ),активированное частичное тромбопластиновое время (АЧТВ) бывают увеличены.
- Фибриноген. Контроль уровня фибриногена и тромбоцитов используется для выявления возможного процесса диссеминированного внутрисосудистого свертывания.
- . Анализ используется при подозрении на инфекцию мочевыделительной системы.
- Посев биологических жидкостей: крови, мочи, мазка из зева и носа. Используется для выявления возможных возбудителей инфекции.
- Выявление возбудителя инфекции в крови методом полимеразной цепной реакции (ПЦР).
- Выявление в крови антител к возбудителю инфекции.
Оставьте ваш E-mail и получайте новости, а также эксклюзивные предложения от лаборатории KDLmed
источник
Э.В. ЕФИМОВА,
Т.А. АНИСИМОВА, С.В. ЕФИМОВ
АНАЛИЗ ОШИБОК В ДИАГНОСТИКЕ ГЕМОРРАГИЧЕСКОЙ ЛИХОРАДКИ
С ПОЧЕЧНЫМ СИНДРОМОМ
Чувашский государственный университет им. И.Н.Ульянова,
Городская больница скорой медицинской помощи, Чебоксары
Проанализированы 225 случаев расхождения направительного и клинического диагнозов при геморрагической лихорадке с почечным синдромом (ГЛПС) у пациентов, пролеченных в инфекционном отделении МУЗ «ГБ СМП» в 2001-2009 гг. Выявлено, что чаще всего диагностические затруднения наблюдались в разграничении ГЛПС от острых респираторных вирусных инфекций (ОРВИ), острых кишечных заболеваний (ОКЗ), острых и хронических пиелонефритов в стадии обострения и пневмонией. Проведен клинический разбор наиболее типичных ошибок в этой категории больных на примерах историй болезни.
Ключевые слова: геморрагическая лихорадка с почечным синдромом, ошибки диагностики, эпидемические предпосылки.
ГЛПС занимает первое место среди природно–очаговых заболеваний в России, причем наиболее активные ее очаги регистрируются в Поволжском регионе [1, 2].
В основе заболевания лежит системное вирусное повреждение мелких кровеносных сосудов, приводящее к их повышенной проницаемости, ломкости с последующей плазморреей и серозно–геморрагическим отеком тканей. Одновременно повреждаются все звенья гемостаза, прежде всего, тромбоцитарное, что ведет к системному тромбообразованию и геморрагиям с развитием ДВС – синдрома (в тяжелых случаях). В итоге эти процессы вызывают нарушение микроциркуляции, гипоксию тканей, расстройство системного кровообращения и нарушение функции всех жизненно важных органов. Наибольшие изменения наблюдаются в почках, что выражается снижением клубочковой фильтрации и канальцевой реабсорбции, клинически проявляется поясничными болями, гематурией протеинурией, олигурией с азотемией и острой почечной недостаточностью (ОПН) [1 — 3]. Известно, что повышение остаточного азота в крови происходит, когда функционирующей оказывается менее 40% паренхимы почек (Тареев Е.М., 1958). Из этого следует, что кратковременная азотемия при легких формах ГЛПС свидетельствует о глубоких изменениях в почках и что ОПН всегда сопутствует ГЛПС [1].
ГЛПС характеризуется четкой цикличностью течения, при этом выделяют 4 периода: лихорадочный (первые 3-8 дней болезни) с симптомами общей интоксикации, олигоанурический (с 3 – 5 по 8 – 11 дни) с полиорганной патологией, прежде всего с почечным и геморрагическим синдромом, полиурический (с 9 — 11 дня) и реконвалесценции. В связи с неспецифичностью начальных проявлений и полиморфизмом симптомов ГЛПС относится к числу поздно и трудно распознаваемых болезней [1].
Цель: обратить внимание врачей амбулаторного звена на наиболее типичные ошибки в диагностике ГЛПС.
Материалы и методы. Нами проанализированы совпадения и расхождения направительного и клинического диагнозов с подозрением на ГЛПС у 551 больного, пролеченного в инфекционном отделении МУЗ «ГБ СМП» в 2001 – 2009 гг. За этот период через инфекционный стационар прошли 388 больных с диагнозом “ГЛПС” – 328 мужчин (84,5%) и 60 женщин (15,5%) в возрасте от 18 до 65 лет. Легкая форма отмечалась у 10 (2,6%), среднетяжелая у 295 (76%) и тяжелая у 83 больных (21,4%). Большинство из них (256 человек – 66%) были госпитализированы на 4 – 7-й день болезни, 81 (20,8%) — в первые 3 дня, 51 (13,2%) – позже 7-го дня от начала заболевания.
Наш анализ показал, что за эти годы в инфекционный стационар было направлено 449 больных с подозрением на ГЛПС, из которых у 306 (68,1%) диагноз в последующем подтвердился, а у 143 (31,8%) выявлены другие заболевания (рис.1).
Рис. 1. Доля подтверждения диагноза «ГЛПС» у больных,
направленных в инфекционное отделение
Вместе с тем 82 пациента с установленным в дальнейшем диагнозом «ГЛПС» направлены в стационар с другими диагнозами: “грипп” и “ОРВИ“ – 19, “ОРВИ, осложненное пиелонефритом” – 10, “лихорадка неясной этиологии” – 6, “ОКЗ” – 5, у 35 больных был двойной направительный диагноз – “ОРВИ? ГЛПС?”, у 5 – “ОРВИ? пиелонефрит?”. Двое больных первоначально поступили в общее приемное отделение ГБ СМП с диагнозами “острый холецистит” и “острый панкреатит”, но после консультаций хирурга и инфекциониста госпитализированы в инфекционное отделение с подозрением на ГЛПС, что в дальнейшем подтвердилось.
Таким образом, расхождения в направительном и клиническом диагнозах («гипо»- и «гипердиагностика» ГЛПС) на догоспитальном этапе имели место у 225 больных из 551, что составило 42,4%. Структура этих расхождений была следующая: 65,7% (148 больных) составили инфекционные болезни (5 нозологических форм), 31,3% (71) – терапевтические заболевания (14 нозологических форм) и 2,7% (6) – острая хирургическая патология (4 нозологические формы) (рис.2).
Рис. 2. Структура расхождений направительного и клинического диагнозов при ГЛПС
Структура расхождений направительного и клинического диагнозов по нозологическим формам отражена на рис. 3, из которого видно, что больше всего ошибочных диагнозов приходится на грипп, ОРВИ, диффузные воспалительные заболевания почек и ОКЗ (55,5%), что соответствует литературным данным [3].
Рис. 3. Структура расхождений клинического и направительного диагнозов при ГЛПС
по нозологическим формам
Другие инфекционные болезни, за которые первоначально принимали ГЛПС, были единичными: гнойный менингит (два случая), менингококковая инфекция и описторхоз (по одному случаю).
Ошибки в дифференциальной диагностике ГЛПС с гриппом и другими ОРВИ были двоякие. Среди больных, направленных в инфекционное отделение с подозрением на ГЛПС, у 59 (26,2%) в дальнейшем диагностированы «ОРВИ» или «ОРВИ, осложненные пиелонефритом», а у 68 (29,3%) геморрагическая лихорадка первоначально принималась за грипп и другие ОРВИ. Дифференцировать эти заболевания было трудно, тем более в поликлинических условиях, однако с 4 – 5-го дня болезни опорные пункты для правильного диагноза имелись и их надо было учитывать.
Приводим клинические примеры.
Больной Б., 25 лет, направлен в инфекционное отделение 10.06. на 4-й день болезни (д. б.) с диагнозом «ОРВИ», с жалобами на повышение температуры, головную боль, першение в горле, тошноту, рвоту, общую разбитость и слабость. Заболел остро 7.06., когда повысилась температура тела до 37,5 о С, на второй день и последующие дни – 39 о С., появились головная боль, слабость, першение в горле. С 3-го дня болезни присоединились тошнота, рвота до 4-5 раз в сутки, сухость во рту. На фоне обильного приема жидкости заметил уменьшение количества мочи.
При поступлении: состояние средней тяжести, вялый. Лицо и шея гиперемированы, лицо одутловатое, склеры инъецированы, выраженная гиперемия конъюнктив и ротоглотки. Дыхание жесткое. Живот мягкий, чувствительный в верхних отделах. Печень +2 см из-под края реберной дуги. При сборе эпиданамнеза установлено, что в течение мая неоднократно был в лесу с ночевкой. На основании этих данных заподозрена ГЛПС. На следующий день при совместном осмотре с заведующим отделением это предположение подтвердилось, дополнительно обнаружены «синяки» в местах инъекций и положительный симптом поколачивания. Лабораторные исследования выявили следующее: в общем анализе мочи (ОАМ) белок 0,066 — 0,132 г/л, в осадке – эритроциты (Э) от 5-6 до 10-12 в поле зрения (п. з.), единичные гиалиновые и зернистые цилиндры; в общем анализе крови (ОАК) лейкоциты (Л) 12,1×10 9 /л, палочкоядерные (п/я) 10%, сегментоядерные (с) 74%, лимфоциты (л) 11%, моноциты (м) 5%, СОЭ — 22 мм/час. В сыворотке крови на 6-й д. б. — креатинин 155 мкмоль/л, АЛАТ – 445 нмоль/л/с.
Назначено патогенетическое лечение. Течение болезни было благоприятным. С 10-го д. б. суточный диурез увеличился до полиурии (4 л в сутки). Проба Зимницкого (11-й д. б.) выявила гипоизостенурию с уд. весом мочи 1000 — 1005. Реакция непрямой иммунной флюористенции (РНИФ) на ГЛПС (12-й д. б.) оказалась положительной в титре 1:256 ++++. Выписан по клиническому выздоровлению на 22-й день пребывания в стационаре. Заключительный диагноз: ГЛПС, среднетяжелое течение.
Симптомы, наблюдаемые у данного больного (лихорадка, головная боль, першение в горле, гиперемия лица, шеи, конъюнктив и ротоглотки) давали определенные основания для первичного диагноза «ОРВИ». Однако с 3-го д. б. к ним присоединились другие, несвойственные ОРВИ симптомы – тошнота, рвота, уменьшение диуреза на фоне приема жидкости большого объема; при внешнем осмотре выявлены «синяки» в местах инъекций, увеличение размеров печени, положительный симптом поколачивания, что в сочетании с эпиданамнезом позволило инфекционисту приемного покоя предположить ГЛПС.
Причинами ошибочного первичного диагноза в данном случае были не только особенности клинического течения ГЛПС, но и неполный опрос и осмотр больного в поликлинике.
Больной К., 26 лет, заболел остро 26.05., когда после озноба повысилась температура до 40 о С, появились головная боль, общая слабость, боли в суставах. К участковому врачу обратился на 3-й д. б. и был направлен в общее приемное отделение ГБ СМП с диагнозом «ОРВИ?», «Пневмония?» осмотрен терапевтом и инфекционистом, выявлены гиперемия ротоглотки, инъекция сосудов склер, жесткое дыхание, сухие и единичные влажные хрипы в легких. ОАМ: Л 0 — 2, Э – 2 — 3 в п. з., уд. вес 1023. При проведенном срочно рентгенологическом исследовании легких выявлено усиление легочного рисунка, расширение корней легких, данных за пневмонию не найдено. Как лихорадящий больной помещен в инфекционное отделение. В дальнейшем температура в пределах 38,5-39 о С держалась еще два дня, затем нормализовалась, но лучше больному не стало: сохранялась слабость, полностью исчез аппетит, присоединились боли в пояснице, тошнота и рвота. При физикальном осмотре выявлены брадикардия, увеличение печени (+ 2 см), слабоположительный симптом поколачивания. Заподозрена ГЛПС, которая в дальнейшем подтвердилась лабораторными тестами..
ОАМ (4-й д. б.): белок – 0,132-0,33 г/л, клетки почечного эпителия 3-4, Л — единичные, Э от 6-7 до 15-20 в п. з. ОАК: Л — 12 × 10 9 , тромбоциты (Т) – 155 × 10 9 , п/я 11%, с 42%, л 26%, м 14%, СОЭ 25 мм/час. Биохимический анализ крови (БАК) (4-й д. б.): мочевина 8,5 ммоль/л, креатинин 125 мкмоль/л, АЛАТ 445 нмоль/л/c, АСАТ 220 нмоль/л/c. БАК (7-й д. б.): мочевина 11,5 ммоль/л, креатинин 148 мкмоль/л. Проба Зимницкого (10 – 11-й д. б.) – уд.вес 1000-1009. РНИФ на ГЛПС (10-й д. б.) положительная в титре 1:256 ++++. На фоне проводимой терапии наступило клиническое выздоровление, выписан на 25-й день пребывания в стационаре. Диагноз при выписке: ГЛПС, среднетяжелое течение.
В данном случае клинических данных за ОРВИ не было никаких. Выявленные у больного жесткое дыхание, единичные влажные хрипы в легких на фоне лихорадки и общей интоксикации могли быть следствием развивающейся пневмонии, но она не подтвердилась рентгенологически. В первые три дня для установления диагноза «ГЛПС» также не было клинических и лабораторных данных. Особенностью течения ГЛПС в данном случае было раннее вовлечение в процесс органов дыхания, что наводило мысль врача прежде всего на возможность пневмонии. Для установления правильного диагноза потребовались наблюдение в динамике и дополнительные лабораторные исследования.
Следует отметить, что в связи с достаточно широким распространением ГЛПС врачи амбулаторного звена имеют определенную настороженность в отношении возможности этого заболевания у лихорадящих больных. Как показали наши исследования, чаще наблюдается обратная ситуация, когда за ГЛПС первоначально принимают другие лихорадочные заболевания (прежде всего ОРВИ и пиелонефрит).
Больной П., 29 лет, поступил в инфекционное отделение на 4-е сутки болезни с направительным диагнозом «ГЛПС», с жалобами на повышение температуры до 39 о C, головную боль, першение в горле, боль при движении в глазных яблоках, тяжесть в поясничной области, общую слабость. Заболел остро с повышения температуры и появления вышеперечисленных симптомов. К врачу обратился на 2-й д. б., первичный диагноз «ОРВИ», принимал арбидол два дня, но улучшения не было, лихорадка 38-38,8 о С держалась 4-й день. Из эпиданамнеза выяснено, что две недели назад работал на даче в погребе (перебирал картошку), заподозрена ГЛПС.
При поступлении состояние средней тяжести, температура тела 38,2 о С. Лицо гиперемировано, конъюнктивы красные, яркая гиперемия ротоглотки. Дыхание жесткое. Печень +1,5 см из-под края реберной дуги. Остальные органы без особенностей. Диагноз в приемном покое оставлен тот же.
При совместном осмотре с заведующим отделением (5-й д. б.) отмечено улучшение состояния, новых проявлений болезни нет. При осмотре, помимо гиперемии, выявлены зернистость конъюнктив, отечность век, увеличение и разрыхление миндалин, зернистость задней стенки глотки. Передне- и заднешейные лимфатические узлы увеличены, чувствительны.
Органы без особенностей. Диурез за сутки 1,5 л. Высказаны сомнения в диагнозе «ГЛПС», больше данных за ОРВИ (аденовирусная инфекция).
Общие анализы крови, мочи, показатели креатинина, мочевины сыворотки крови (6-й д. б.) без отклонений от нормы. АЛАТ – 306 нмоль/л/с, АСАТ – 124 нмоль/л/с. В дальнейшем симптомы болезни пошли на убыль: температура тела нормализовалась к 6-му д. б., признаки тонзиллита, фарингита исчезли к 10-му, конъюнктивита – к 12-му д. б. Диурез оставался адекватным количеству выпитой жидкости. С помощью МФА в соскобах из носа обнаружены антигены аденовирусов. РНИФ на ГЛПС (8-й д. б.) отрицательная. Выписан по выздоровлению на 11-й день пребывания в стационаре. Диагноз при выписке: ОРВИ (аденовирусная инфекция), среднетяжелое течение.
Первичный диагноз участкового врача «ОРВИ» был правильным, однако отсутствие эффекта от арбидола в течение двух дней и эпидемиологические данные привели к ошибочному диагнозу «ГЛПС». Следует отметить, что в первые 2 — 3 д. б. установить клинический диагноз «ГЛПС» невозможно в связи с неспецифичностью всех проявлений [1 – 3]. Более типичные ее симптомы (почечный, геморрагический, нарушение зрения, изменения в периферической крови) развиваются с 4 – 5-го д. б. Основанием для постановки диагноза «ГЛПС» на догоспитальном этапе является сочетание картины острого лихорадочного заболевания с нарастающей ОПН [3]. У данного больного подобных клинических признаков не было. В то же время был четко выраженный катаральный синдром (тонзиллит, фарингит, конъюнктивит, шейный лимфаденит), которые детально не выявил или неправильно интерпретировал участковый врач. Эпидемиологические данные были явно переоценены. Простейшие лабораторные исследования (ОАМ, ОАК), УЗИ почек могли бы помочь исключить ГЛПС в амбулаторных условиях, но они не проводились.
Трудности в разграничении ГЛПС от острых кишечных заболеваний (ОКЗ), по нашим данным, отмечались у 19 больных (8,4% всех ошибочных диагнозов), при этом у 5 из них ГЛПС первоначально принималась за ОКЗ, а 12 больных с установленным в стационаре диагнозом «ОКЗ» (в том числе 5 — с бактериологически подтвержденными диагнозами “Дизентерия” и “Сальмонеллез”) были направлены с подозрением на ГЛПС.
Больной Е., направлен в инфекционное отделение 10.10. на 5-й д. б. с диагнозом «ГЛПС?», «ОКЗ?». Заболел остро 6.10., когда вечером появились озноб, жар, головная боль, на следующий день присоединились тошнота, рвота, жидкий стул, боли в животе. Самостоятельно принимал активированный уголь, но-шпу. Улучшения не было, вызвал «скорую помощь» и был доставлен в инфекционное отделение.
При поступлении: состояние средней тяжести, температура тела 38,2 о С, вялый, в зеве спокойно. Тоны сердца приглушены, пульс 90 в мин, АД 125/90 мм рт. ст. Живот мягкий, урчание и болезненность в околопупочной области. Симптом поколачивания положительный с обеих сторон. Из эпиданамнеза: за 3 дня до заболевания ел яичницу. Диагноз при поступлении «ОКЗ, сальмонеллёз».
На следующий (воскресный) день температура нормализовалась, стула с момента поступления не было, но состояние больного ухудшилось: сильная слабость, тошнота, головная боль, анорексия, поясничные боли. При осмотре: лицо гиперемировано, склеры инъецированы, АД 140/90 мм рт. ст., пульс 48 в мин. Живот несколько вздут, болезненный в боковых отделах. Несмотря на в/в введение солевых растворов и 5% раствора глюкозы (2,5 л), диурез за сутки составил 100 мл. Уточнен эпиданамнез: систематически работал в гараже, расположенном в районе Чапаевского поселка. Заподозрена ГЛПС. Срочно взяты ОАК, ОАМ, БАК. В моче: уд. вес 1011, белок 1,32 г/л, Л 3 – 4, Э до 6 – 8, гиалиновые цилиндры 1 – 2 в п. з. ОАК: Л 11,4 × 10 9 , миелоциты 1%, ю 1%, СОЭ 16 мм/час. БАК: креатинин 551 мкмоль/л, мочевина 22,9 ммоль/л. УЗИ почек (7-й д. б.) – признаки отечности паренхимы обеих почек.
Далее картина ОПН у больного нарастала, отмечались брадикардия (44 в мин), тенденция к артериальной гипертензии (140/90 мм рт. ст.), анурия – 40 мл мочи в сутки. Креатинин в сыворотке крови достиг 612 мкмоль/л. В связи с отсутствием эффекта от консервативной терапии больной переведен в Республиканский почечный центр для гемодиализа. Переводной диагноз: ГЛПС, тяжелое течение. Осложнение: ОПН.
Затруднения при дифференциальной диагностике ГЛПС и ОКЗ были не только у врача «скорой помощи», но и у инфекциониста приемного покоя. Произошла абсолютизация имеющихся у больного диспепсических расстройств. Спутан и факт употребления больным за 3 дня до заболевания яичницы (хотя максимальный инкубационный период при сальмонеллёзе составляет 2 суток). Диагностическая ошибка связана с особенностями течения тяжелой формы ГЛПС (раннее вовлечение многих органов и систем, в т.ч. ЖКТ). Но были и субъективные причины: врачом не отражены последовательность и степень выраженности симптомов, характер стула, не было указаний на диурез. Не насторожило отсутствие симптомов обезвоживания, нормальные показатели гемодинамики у больного с нелеченной в течение 5 дней «кишечной инфекцией», не были учтены эпидемиологические предпосылки в пользу ГЛПС (мужчина активного возраста в осенний период систематически работал в гараже на окраине города), хотя направительный диагноз врача «скорой помощи» был двойным: «ГЛПС?», «ОКЗ?».
В 71 случае (31,6% всех ошибочных диагнозов) за ГЛПС принимали различные терапевтические заболевания. Подавляющее большинство (67,6%) первичных ошибочных диагнозов при ГЛПС по терапевтическим болезням приходилось на острые и хронические диффузные воспалительные заболевания почек и пневмонию (рис. 4).
Рис. 4. Структура терапевтических заболеваний, за которые первоначально принимали ГЛПС
Больная Ж., 65 лет, поступила в инфекционное отделение 25.12 на 5-й д. б. с направительным диагнозом «ГЛПС». Заболела остро 21.12. когда после озноба повысилась температура, появились головная боль, слабость, потливость, тошнота, заложенность носа. С 22.12. находилась на больничном листе с диагнозом «ОРВИ», принимала арбидол, антигриппин. Улучшения не наблюдалось. ОАМ (5-й д. б.): белок 0,033 г/л, Л до 20 — 25 в п. з. ОАК: Л 11 × 10 9 , СОЭ – 45 мм/час. Заподозрена ГЛПС.
При поступлении состояние средней тяжести, вялая, бледная. температура тела 38,2 о С. В зеве гиперемия и разрыхленность задней стенки глотки, гиперемия и отечность миндалин. Из носа слизистые выделения. По органам без особенностей. Снижения диуреза не отмечала. Заключение врача приемного покоя: диагноз «ГЛПС» сомнителен, больше данных за ОРВИ, осложненную пиелонефритом.
Дальнейшее течение болезни и результаты обследования подтвердили это предположение. В анамнезе – хронический пиелонефрит. Сохранялась бледность кожных покровов, выраженные воспалительные изменения в ротоглотке. Диурез соответствовал количеству принятой жидкости. В последующем в анализе мочи (6-й д. б.) выявлены лейкоцитурия, слизь, бактериурия, оксалаты. ОАК: Л 9,9 × 10 9 , п/я 6%, СОЭ 50 мм/час. Моча по Нечипоренко: Л 12000, Э 2200 в 1 мл. Показатели креатинина и мочевины в сыворотке крови без отклонений от нормы. УЗИ почек (8-й д. б.) — признаки хронического пиелонефрита, мелкие гиперэхогенные включения в чашечно-лоханочная система левой почки. РНИФ на ГЛПС (10-й д. б.) – отрицательная.
На фоне дезинтоксикационной и антибактериальной терапии температура тела нормализовалась через 2 дня, симптомы болезни пошли на убыль. Выписана с улучшением на 14-й день пребывания в стационаре. Диагноз при выписке: ОРВИ, среднетяжелое течение. Сопутствующие заболевания: хронический пиелонефрит, обострение. Мочекаменная болезнь.
Поводом для направления этой больной в инфекционный стационар с диагнозом «ГЛПС» послужила лихорадка в течение 5 дней с симптомами интоксикации. Каких-либо других, свойственных ГЛПС, признаков или симптомов не отмечено. Анамнестические данные о наличии хронического пиелонефрита не получены. Заболевание началось с ОРВИ, затем наступило обострение хронического пиелонефрита (умеренная лихорадка с познабливанием и потливостью, бледность кожных покровов, слабость, изменения в моче в виде выраженной лейкоцитурии).
При дифференциальной диагностике этих заболеваний, помимо клинических признаков, необходимо учитывать анамнестические данные и эпидемиологические предпосылки. При ГЛПС преобладают лица мужского пола активного возраста, выражена четкая летне-осенняя сезонность, прослеживается связь с пребыванием на природе и контакт с грызунами. При пиелонефрите — женщины старшего возраста, нет сезонности, в анамнезе могут быть указания на эпизоды подобных клинических проявлений или установленный диагноз хронического пиелонефрита, отмечается связь с простудой или ОРЗ. Причинами ошибочного направительного диагноза в данном случае послужили неполный опрос больной и недостаточная осведомленность врача поликлиники в вопросе дифференциальной диагностики ГЛПС и хронического пиелонефрита.
Больной В., 33 года, переведен из терапевтического отделения на 10-й д. б. с жалобами на сильную головную боль (держится за голову), слабость, тяжесть в поясничной области, ухудшение зрения. Выяснено, что с 29 по 31 мая повышалась температура тела до 39 о С. Беспокоила слабость, затем стало чуть лучше, вышел на работу. Но с 4.05. наступило ухудшение – озноб, жар, головная боль, тяжесть в пояснице. Госпитализирован в терапевтическое отделение, где находился с 4.05. по 7.05. с подозрением на пневмонию. При рентгенологическом обследовании легкие без очаговых и инфильтративных теней. ОАМ: белок от 2,84 до 4,72 г/л, Л 10 – 15, Э 50 – 100, гиалиновые цилиндры 4 – 5, зернистые цилиндры 15 – 20 в п. з. ОАК: Л 13,9 × 10 9 , п/я 26%, с 51%, л 21%, м 8%, СОЭ 42 мм/час. С подозрением на ГЛПС переведен в инфекционное отделение.
При поступлении состояние средней тяжести. Температура тела 37,1 о С, вялый. Отмечена умеренная гиперемия ротоглотки, сыпи нет, пульс 76 в мин, АД 140/90 мм рт. ст. Симптом поколачивания отрицательный с обеих сторон. По органам без особенностей. Снижения диуреза не отмечено. В анамнезе – хроническое заболевание почек. Диагноз «ГЛПС» вызвал сомнение, больше данных за обострение почечной патологии.
В динамике заболевания зафиксированы субфебриллитет, бледность кожных покровов, вялость, сильная головная боль. АД держалось на уровне 140-145/90 мм рт. ст. Диурез адекватен введенной жидкости. ОАМ (11-й, 15-й, 20-й д. б.): уд. вес 1007-1013, белок 0,33-0,66-0,99 г/л, в осадке – Л 0 – 2, Э 25 – 35 в п. з. Моча по Нечипоренко: Л 4500 — 5000, Э 50000 – 10000 в 1 мл. ОАК: Л 12,2 – 18, 6 × 10 9 , СОЭ 45 — 50 мм/час. Креатинин крови (12-й д. б.) в пределах нормы. УЗИ почек (12-й д. б.): эхогенность обеих почек неравномерно снижена. РНИФ на ГЛПС (15-й д. б.) отрицательная.
На основании вышеперечисленного «ГЛПС» исключена. Заключительный диагноз: «Хронический гломерулонефрит, смешанный вариант, обострение». Для дальнейшего лечения больной переведен в нефрологическое отделение.
Поводом для ошибочного диагноза в данном случае послужила лихорадка с последующим типичным для ГЛПС мочевым синдромом. Дифференцировать эти заболевания только по анализам мочи невозможно, т. к. на определенном этапе они сходны. Необходимо учитывать особенности их клинического течения, совокупность, динамику и степень выраженности различных симптомов.
Общая лихорадка в течение 5-7 дней с общей интоксикацией.
Цикличность течения, когда с конца первой недели развивается полиорганная патология, прежде всего нефритический синдром с олигурией, азотемией. При благоприятном течении с 10 — 12-го д. б. – полиурия с гипоизостенурией.
Типичные изменения в моче наблюдаются с 4 — 5-го д. б., максимально они выражены в олигоанурической стадии. С появлением полиурии белок в моче исчезает, осадок нормализуется. Наличие изменений в моче позже 11 — 13-го д. б. не может быть отнесено за счет ГЛПС [3].
При ГЛПС СОЭ столь значительно не повышается.
В данном случае при обострении хронического гломерулонефрита:
Лихорадка имела двугорбый характер, вероятно, первая волна была связана с интеркуррентной инфекцией, после которой наступило обострение основного заболевания.
Не отмечено цикличность болезни, не было свойственной ГЛПС динамики диуреза.
В клинике отмечена почечный синдром и гипертензия, других симптомов, свойственных ГЛПС, не было.
Несмотря на выраженные патологические изменения в моче, не было признаков ОПН.
Изменения в моче (протеинурия, эритроцитурия) и высокие цифры СОЭ отличались стабильностью.
В анамнезе – хроническое заболевание почек.
У 23 больных с предварительным диагнозом «ГЛПС» в инфекционном отделении выявлено 11 нозологических форм различных терапевтических заболеваний: сепсис, токсический гепатит, обострение хронического холецистопанкреатита, системный васкулит, ревматоидный полиартрит, экссудативный плеврит, аллергический дерматит, острый лейкоз, опухоль желудка, отравление суррогатами алкоголя, спондиллез с полирадикулопатией. На их долю пришлось 10,2% всех ошибочных диагнозов. У 6 больных, направленных в инфекционное отделение с подозрением на ГЛПС, определена острая хирургическая патология: острый аппендицит, острый холецистит, абсцесс печени, карбункул почки.
Симптомы, выявляемые при различных сочетаниях у этой категории больных (лихорадка, боли в животе и пояснице, тошнота, рвота, увеличение печени, диарея, боли в суставах, сухой кашель, высыпания на коже, изменения в моче), закономерно наблюдались при ГЛПС в связи с многообразием ее клинических проявлений. При установлении диагноза и проведении дифференциальной диагностики, помимо выявления тех или иных признаков болезни, необходимо клиническое мышление: учет начала и развития болезни, последовательности появления и выраженности различных симптомов, их сочетание и диагностическая ценность каждого из них, характер и длительность лихорадки, наличие и степень выраженности общей интоксикации. В основе диагностических ошибок у этой категории больных преимущественно были субъективные причины: неполноценно собранный анамнез, невнимательный, неполный, поспешный (в связи с дефицитом времени в амбулаторных условиях) осмотр больных и бессистемность клинического мышления.
Больной А., 18 лет, направлен в инфекционный стационар 1.06. на 3-й д. б. с диагнозом «ГЛПС», с жалобами на общую слабость, повышение температура тела до 37,5 о С, тупые боли в пояснице, боли в суставах, обильные высыпания на руках и ногах. Болен 2 день, повысилась температура тела до 37,5 – 38 о С, появились боли в суставах и пояснице, исчез аппетит.
При поступлении состояние средней тяжести, активный. Т тела 37,4 о С. Кожные покровы физиологической окраски, в зеве умеренная гиперемия. На боковых поверхностях туловища, паховой области, верхних и нижних конечностях, преимущественно вокруг суставов и локтевых сгибов, обильная яркая геморрагическая (петехиальная) сыпь. Со стороны внутренних органов без особенностей. Пульс 78 в мин, АД 110/70 мм рт. ст. Пальпируется край печени. Симптом поколачивания резко положительный с обеих сторон. Диурез достаточный. Диагноз «ГЛПС» вызвал сомнения у дежурного врача. Предположен геморрагический васкулит (болезнь Шенлейн – Геноха), что в дальнейшем и подтвердилось в стационаре.
В первые дни пребывания в отделении сохранялись те же жалобы, сыпь оставалась яркой. ОАК и БАК (креатинин, мочевина, АЛАТ, АСАТ) на 4-й и 10-й д. б. — без отклонений от нормы. ОАМ (4-й, 6-й и 10-й д. б.): белка нет, уд. вес 1015 – 1020, Л 4 – 5, Э 1 — 2 – 3 в п. з. Моча по Нечипоренко (4-й д. б.): Л 7000, Э 3000 в 1 мл. РНИФ на ГЛПС (7-й д. б.) отрицательная.
На фоне проводимой терапии (дезинтоксикация, преднизолон внутрь и в/в, гепарин в/в и п/к, пентоксифиллин в/в) симптоматика пошла на убыль. температура тела оставалась нормальной, диурез соответствовал количеству вводимой жидкости. Сыпь стала бледнеть и исчезла к 7-му дню пребывания в стационаре (10-й д. б.). Другие симптомы болезни исчезли на 11 – 12-й дни лечения. Диагноз при выписке: Геморрагический васкулит (болезнь Шенлейн – Геноха), острое течение с поражением кожи, почек и суставов.
Имеющиеся у больного симптомы в сочетании с эпидемическими предпосылками могли навести врача на мысль о возможности ГЛПС. Однако при внимательном опросе, осмотре больного и анализе полученных данных указанное заболевание можно было исключить сразу. Лихорадка была субфебрильной и продолжалась всего два дня, общая интоксикация слабо выражена, не отмечено цикличности течения (все симптомы появились в первые два дня болезни), своеобразной динамики диуреза, других проявлений геморрагического синдрома, свойственных ГЛПС. Главным проявлением болезни у данного больного была обильная петехиальная сыпь, появившаяся в 1 день болезни и имеющая нехарактерную для ГЛПС локализацию.
Клиническая диагностика ГЛПС затруднена в связи с неспецифичностью ее проявлений в первые дни болезни и их полиморфизмом в последующем.
Чаще всего дифференциально–диагностические трудности возникают при разграничении ГЛПС от гриппа и других ОРВИ, острого и обострения хронического пиелонефрита и пневмонии.
В основе диагностических ошибок при ГЛПС на догоспитальном этапе лежат как объективные причины, связанные с особенностями ее клинического течения, так и субъективные факторы (неполноценный опрос и осмотр больного, бессистемность клинического мышления).
СПИСОК ЛИТЕРАТУРЫ
Геморрагическая лихорадка с почечным синдромом / под ред. Ф.Б. Колпачихина. – Ч. 2. — Казань, 1989. — С. 8 – 13.
Инфекционные болезни. Национальное руководство. — М.:ГЭОТАР – Мед, 2009. — С. 832 – 844.
Суздальцев А.А. Трудности диагностики стертых и атипичных форм геморрагической лихорадки с почечным синдромом / А.А. Суздальцев, В.Г. Мороз, В.И. Рощупкин // Эпидемиология и инфекционные болезни. – 2003. — № 4. — С. 52 – 53.
СВЕДЕНИЯ ОБ АВТОРАХ:
Ефимова Эльвира Васильевна
доцент кафедры детских болезней с курсом инфекционных болезней ФГОУ ВПО «Чувашский государственный университет им. И.Н. Ульянова»
Анисимова Татьяна Анатольевна
ассистент кафедры детских болезней с курсом инфекционных болезней ФГОУ ВПО «Чувашский государственный университет им. И.Н. Ульянова»
Ефимов Сергей Витальевич
заведующий инфекционным отделением МУЗ «Городская больница скорой медицинской помощи»
Адрес для переписки:
428015, Чувашская Республика, г. Чебоксары, Московский пр., д. 45
E.V. EFIMOVA,
T.A. ANISIMOVA, S.V. EFIMOV
THE ANALYSIS OF ERRORS IN THE DIAGNOSIS OF HEMORRHAGIC FEVER
WITH RENAL SYNDROME
The following was analyzed: 225 cases of discrepancy between directional and clinical diagnosis in hemorrhagic fever with renal syndrome (HFRS) in the patients cured at the infectious department of MIHC “MH UMS” in 2001-2009. It was revealed that there were more frequent difficulties in differentiation HFRS from acute respiratory viral infections (ARVI), acute intestinal diseases (AID), acute and chronic pyelonephritis in acute stage and pneumonia. The clinical analysis of the most typical errors of these clinical cases was made.
Key words: hemorrhagic fever with renal syndrome, errors in diagnosis, epidemic conditions.
© Все права защищены. Использование материалов без письменного согласия — запрещено.
источник
Геморрагические лихорадки – это группа острых инфекционных заболеваний, вызванных представителями четырех видов вирусов: аренавирусами, буньявирусами, флавивирусами и филовирусами. Общим для этих заболеваний является тяжелая интоксикация и характерный тромбогеморрагический синдром.
Вирусы, вызывающие геморрагические лихорадки, широко распространены во многих странах мира. Некоторые встречаются и в развитых странах, однако эндемичными районами для большинства видов возбудителей являются Африка, Азия и Южная Америка.
Течение геморрагической лихорадки, в зависимости от возбудителя, может варьироваться от умеренного до крайне тяжелого. Смертность от отдельных вариантов инфекции составляет от 10 до 90 %. Определенные варианты геморрагической лихорадки приводят к тяжелому поражению внутренних органов и нередко к летальному исходу.
Прогноз заболевания зависит от типа вируса, возраста и общего состояния пациента, в частности от активности его иммунной системы.
Viral hemorrhagic fevers, hemorrhagicfevers, VHF, VHFs.
Симптомы геморрагических лихорадок различаются в зависимости от типа вируса, вызвавшего заболевание. Общими проявлениями для всех инфекций являются сама сильная лихорадка и повышенная кровоточивость. Симптомы в начальной стадии болезни чаще всего неспецифичны, однако в процессе дальнейшего развития патологического процесса могут появляться признаки поражения определенных органов и систем организма.
Основные симптомы геморрагических лихорадок:
- лихорадка;
- слабость, головокружение;
- мышечные боли;
- гиперемия кожи;
- петехиальная сыпь на коже и слизистых оболочках;
- нарушение сознания;
- покраснение глаз;
- кровь в стуле, рвота с кровью;
- падение артериального давления.
Общая информация о заболевании
Геморрагические лихорадки могут быть вызваны представителями четырех семейств РНК-содержащих вирусов: аренавирусами (Arenaviridae), буньявирусами (Bunyaviridae), филовирусами (Filoviridae) и флавивирусами (Flaviviridae). Аренавирусы вызывают лихорадку Ласса, аргентинскую, бразильскую, венесуэльскую и боливийскую лихорадку, буньявирусы – лихорадку Крым-Конго, лихорадку долины Рифт, геморрагическую лихорадку с почечным синдромом, филовирусы – лихорадку Эбола, флавивирусы – желтую лихорадку, лихорадку Денге и др.
«Резервуарами» вирусов служат некоторые животные и насекомые, чаще всего мелкие грызуны, летучие мыши, москиты, клещи. Как правило, определенные типы геморрагических лихорадок встречаются в основном на территории обитания тех животных, которые являются источником конкретного возбудителя. Например, источник вируса лихорадки долины Рифт, которая распространена на территории Африки, – это москиты. Геморрагическая лихорадка Крым-Конго встречается в Европе, Азии, Африке, ее распространяют клещи. Источник некоторых заболеваний, например лихорадки Эбола, остается неизвестен, предполагают, что им могут быть летучие мыши. Некоторые типы вирусов передаются через кровь или семенную жидкость зараженного животного или человека, через нестерильные иглы. Определенными возбудителями геморрагических лихорадок можно инфицироваться при вдыхании микрочастиц фекалий и мочи животных-переносчиков.
Все представители вирусов, вызывающих геморрагические лихорадки, объединены общим патогенезом. Они склонны поражать эндотелий сосудов, что объясняет развитие геморрагического синдрома при большинстве геморрагических лихорадок. После проникновения вируса в кровь через укусы насекомых, расчесы, ссадины, инъекции, слизистую дыхательных путей сначала формируется локальная реакция на инфекцию, вслед за которой быстро развивается вирусемия и генерализованное поражение системы микроциркуляции (вирус поражает также клетки сосудистой стенки). При проникновении возбудителя в кровь он прилипает к мембране клетки, проникает внутрь нее, активно размножается и распространяется по другим тканям организма. Это сопровождается выделением биологически активных веществ, которые нарушают проницаемость сосудов, реологические свойства крови. Проявлением этого процесса является сыпь, гиперемия кожи, покраснение сосудов склер, могут возникать внутренние кровотечения, сопровождаемые резким падением артериального давления, шоком. Ряд вирусов вызывает поражение костного мозга, в частности мегакариоцитов. Ослабление иммунной системы организма, слабый или запоздалый ответ защитных механизмов может приводить к стремительному развитию патологического процесса, сопровождаемому массивными кровотечениями, полиорганным поражением.
- Работающие с инфицированными людьми или животными, в частности медицинские работники, биологи, дератизаторы, работники скотоводческих ферм.
- Проживающие в эндемичных районах.
- Употребляющие внутривенные наркотики.
- Те, кто пренебрегает барьерными способами контрацепции.
Диагностика основана на анамнезе, осмотре, результатах лабораторных и инструментальных исследований. При опросе пациента обращается внимание на возможный контакт с возбудителем – путешествие в эндемичные по заболеванию регионы, контакт с животными-переносчиками или инфицированными людьми. Инкубационный период большинства геморрагических лихорадок составляет 10-21 день, поэтому болезнь может развиться уже после возвращения из путешествия в опасный район. При подозрении на наличие геморрагической лихорадки необходимо в условиях стационара в кратчайшие сроки провести ряд исследований, позволяющих дифференцировать болезнь от других заболеваний и установить тип возбудителя:
- Общий анализ крови (без лейкоцитарной формулы и СОЭ). В общем анализе крови при геморрагических лихорадках могут быть выявлены лейкопения и тромбоцитопения. В некоторых случаях, например при лихорадке Ласса, эти изменения отсутствуют. Уровень гемоглобина может понижаться.
- Скорость оседания эритроцитов (СОЭ). Может быть повышена.
- Протромбиновый индекс (ПИ),активированное частичное тромбопластиновое время (АЧТВ) бывают увеличены.
- Фибриноген. Контроль уровня фибриногена и тромбоцитов используется для выявления возможного процесса диссеминированного внутрисосудистого свертывания.
- Анализ используется при подозрении на инфекцию мочевыделительной системы.
- Посев биологических жидкостей: крови, мочи, мазка из зева и носа. Используется для выявления возможных возбудителей инфекции.
- Выявление возбудителя инфекции в крови методом полимеразной цепной реакции (ПЦР).
- Выявление в крови антител к возбудителю инфекции.
Все диагностические манипуляции следует выполнять с особой осторожностью в связи с высокой болезнетворностью возбудителей.
Лечение данной группы заболеваний должно проводиться в условиях стационара. Специфическая терапия большинства возбудителей геморрагических лихорадок отсутствует. Лечебная тактика определяется состоянием пациента и направлена на поддержание жизненных функций и предотвращение возможных осложнений. Такие противовирусные препараты, как рибавирин, могут снизить активность возбудителя.
- Контроль популяции мелких грызунов;
- использование средств индивидуальной защиты против укусов москитов, клещей;
- своевременная вакцинация против определенных видов геморрагических лихорадок, например желтой лихорадки, перед посещением эндемичных районов;
- соблюдение гигиенических правил.
источник
Изобретение относится к области медицины, в частности к вирусологии, и может быть использовано в диагностике геморрагической лихорадки с почечным синдромом /ГЛПС/. Цель — повышение точности диагностики, проводимой с 5-й по 13-й дни болезни, и упрощения способа. Диагностику ГЛПС проводят путем однократного определения в одном и том же образце свежесобранной мочи больного антигена вируса ГЛПС с помощью твердофазного иммуноферментного анализа /ИФА/ и антител к нему с помощью непрямого метода флюоресцирующих антител /НМФА/ в ранний период болезни /с 5-й по 13-й дни/. 2 табл.
Изобретение относится к медицине, в частности к вирусологии, и может быть использовано в диагностике геморрагической лихорадки с почечным синдромом (ГЛПС) тяжелого вирусного природно-очагового заболевания, широко распространенного на территории СССР и в других странах Европы, Азии и Америки.
Известен способ диагностики ГЛПС путем определения антител в крови. Однако он недостаточно точен, поскольку диагноз ставится на основании сероконверсии четырехкратного нарастания титров антител при использовании парных сывороток, полученных в первые дни болезни и повторно на 14-й 21-й дни.
В последнее время появились сведения о получении результатов реакции в начале второй недели болезни, в связи с чем появляется необходимость более раннего взятия крови. Однако это затруднено, так как больные обычно поступают в стационар не ранее 4-го дня болезни. Таким образом, нарушается принцип четырехкратного нарастания титров антител.
Также известен способ ранней диагностики ГЛПС путем определения антигена вируса в составе иммунного комплекса в крови больных с помощью твердофазного иммуноэнзиматического метода. Однако определение антигена этим способом достигается опосредованно через специфический иммунный комплекс и нуждается в подтверждении, также не уточнены сроки диагностики заболевания.
Все способы диагностики, где в качестве образца для исследования используется кровь, связаны с определенной степенью риска заражения другими заболеваниями (гепатит, СПИД).
В настоящее время известен способ ранней диагностики ГЛПС путем определения антигена в моче больных с помощью прямого твердофазного иммуноферментного анализа (ИФА) [1] Однако диагностика этим способом нуждается в уточнении в связи с возможным получением ложноположительных результатов (2%). Кроме того, известны способы диагностики по содержанию антител в моче с помощью иммуноблотинга и ИФА при СПИДе; обнаружению цитомегаловирусных антигенов и антител в моче новорожденных и детей с помощью ИФА; цитомегаловируса в моче с использованием амплификации ДНК в цепной полимеразной реакции.
Диагностика же по содержанию антител в моче больных ГЛПС ранее не проводилась. Для определения антител в моче при других заболеваниях не использовался НМФА.
Целью изобретения является повышение надежности, точности диагностики заболевания и упрощения способа.
Указанная цель достигается тем, что диагностику ГЛПС проводят путем однократного определения в одном и том же образце свежесобранной мочи больного антигена вируса с помощью твердофазного иммуноферментного анализа (ИФА) и антител к нему с помощью непрямого метода флюоресцирующих антител (НМФА) в ранний период болезни (с 5-й по 13-й день).
Способ осуществляется следующим образом.
В образце свежесобранной утренней порции мочи определяют антиген вируса ГЛПС с помощью ИФА и антитела к нему с помощью НМФА. 1. При определении антигена вируса в каждую лунку полистироловой панели для иммунологических реакций вносят по 75 мкл иммуноглобулина, выделенного из сыворотки переболевшего ГЛПС человека, в рабочем разведении согласно указанного титра. Контакт 18 часов при 4 o С. После трехкратной отмывки 0,1 М фосфатно-буферным раствором (ФБР) рН 7,4 с 0,05% твина панель заполняют раствором 1% альбумина на ФБР и помещают в термостат при 37 o С на 30 минут. Панель трижды отмывают и добавляют исследуемую нативную мочу в объеме 50 мкл на лунку с иммунным покрытием.
В качестве контроля используют мочу здоровых людей и больных другими заболеваниями. После контакта в течение 2 часов при 37 o С панель трижды отмывают ФБР с твином и в каждую лунку добавляют по 50 мкл меченного пероксидазой хрена иммуноглобулина. Панель помещают в термостат на 1 час, отмывают и добавляют в каждую лунку по 10 мкл субстрата, содержащего ортофенилендиамин в 0,1 М цитратнофосфатном буфере рН 5,0 и перекись водорода (0,06%). После 50-минутного контакта в темной камере при комнатной температуре реакцию останавливают добавлением 2 М раствора H2SO4.
Учитывают реакцию визуально, сравнивая окраску исследуемых образцов с контролем. По появлению желтой окраски в исследуемом образце судят о наличии антигена вируса ГЛПС.
2. С целью определения специфических антител в этом же образце мочи используется культуральный поливалентный диагностикум геморрагической лихорадки с почечным синдромом производства Института полиомиелита и вирусных энцефалитов АМН СССР.
На первом этапе каждое разведение исследуемого образца, начиная с максимального, наносят на отдельную каплю мазок фиксированного антиген-содержащего диагностикума. Серийные 2-кратные разведения исследуемого материала предварительно готовят на микропанелях, начиная с разведения 1:5. В опыте на каждом стекле присутствуют контрольные сыворотки: анти-ГЛПС иммунные сыворотки 1-го и 2-го серотипов в рабочем разведении соответственно указанного титра. После инкубации во влажной камере при 37 o С в течение 30 минут препараты 2-кратно по 2 минуты выдерживают в ФБР рн 7,2-7,4, промывают дистиллированной водой и высушивают при комнатной температуре.
На втором этапе окрашивают люминесцирующей сывороткой против глобулинов человека (производства ИЭМ им.Гамалеи) в рабочем разведении, указанном на этикетке. С целью контрастирования специфического сведения добавляют краситель «Голубой Эванс» в конечной концентрации 1:10000. Экспозиция и обработка окрашенного препарата аналогична первому этапу.
Препараты просматривают в люминесцентном микроскопе марки ЛЮМАМ с масляной системой (объектив х 90, окуляр х 7, светофильтры ФС 1-2, БС 8-3, СЭС 24-4).
За титр антител в исследуемом образце принимают последнее наибольшее разведение, дающее специфическое свечение.
Пример. Больной К-о О.В. 42 года.
Диагноз: ГЛПС, средней тяжести.
Антиген вируса ГЛПС и антитела к нему в моче больного определяли на 6-й, 9-й, 13-й, 16-й дни болезни.
Антиген вируса ГЛПС с помощью ИФА обнаружен во всех исследуемых образцах мочи.
Антитела к вирусу ГЛПС с помощью НМФА обнаружены в образце мочи, взятой на 6-й день болезни, в титре 1:160; на 9-й день в титре 1:20, на 13-й день — в титре 1:5. В образцах мочи, взятой на 16-й и 23-й день болезни, антитела не обнаружены.
При обследовании 44 проб мочи от 20 больных ГЛПС, собранных в различные сроки заболевания, антиген к вирусу ГЛПС и специфические антитела обнаруживались в сроки от 5-го по 13-й день болезни у 100% обследуемых. У больных другими заболеваниями и клинически здоровых людей антигены вируса и специфические антитела не обнаружены (табл.1, табл.2).
В ранний период заболевания вследствие нарушения проницаемости кровеносных сосудов почек в мочу больных ГЛПС из крови проникают с белками (пропотевание в мочеточник) антитела, которые и выявляются с помощью НМФА. Ранее антитела в моче НМФА никем не определялись.
Согласно проведенным исследованиям, антигены вируса ГЛПС с помощью ИФА и специфические антитела с помощью НМФА в моче выявляются у всех обследованных больных с 5-й по 13-й дни болезни.
Таким образом, по сравнению с известными способами диагностики преимуществом заявленного способа является впервые обнаруженные антитела в моче НМФА и их использование в комплексе с определением антигена в одном и том же образце свежеполученной мочи для диагностики ГЛПС в ранние сроки болезни (с 5-й по 13-й дни).
Одновременное однократное определение антигена вируса ГЛПС и антител к нему в одной и той же пробе мочи больного упрощает способ, позволяет установить окончательный диагноз в первые дни болезни, поскольку обнаружение антигена вируса и специфических антител в моче однозначно свидетельствует о протекающей в данный момент острой инфекции ГЛПС.
Одновременное определение в одном и том же образце мочи антигена вируса и антител к нему двумя различными методами (ИФА и НМФА) повышает точность, надежность способа позволяет избежать ошибок при постановке диагноза.
Преимуществом предлагаемого способа является также использование в качестве материала для исследования мочи, а не крови, что исключает дополнительный риск заражения другими заболеваниями (гепатит, СПИД). Необходимое для диагностики количество мочи (0,5-1,0 мл) столь невелико, что его возможно получить у больного даже при анурии (катетором).
Способ ранней диагностики геморрагической лихорадки с почечным синдромом путем определения специфического антигена в моче с помощью иммуноферментного анализа, отличающийся тем, что, с целью повышения точности диагностики, проводимой в сроки с 5 по 13 дни болезни, и упрощения способа, одновременно ведут определение специфических антител в другом образце этой же пробы мочи с помощью непрямого метода флюоресцирующих антител и при наличии антигена и антител диагностируют геморрагическую лихорадку с почечным синдромом.
источник
Геморрагическая лихорадка с почечным синдромом (ГЛПС, мышиная лихорадка) – заболевание, которое вызывает контакт с выделениями грызунов. Инфицирование происходит группой вирусов, принадлежащих к роду Hantavirus семейства Bunyaviridae.
Патогенез неизвестен, но по данным исследований установлено, что иммунные механизмы играют важную роль.
Тяжелые формы ГЛПС регистрируют в странах Востока. Количество заболевших в Китае составляет примерно 100-250 тысяч в год. Мягкая форма чаще встречается в скандинавских странах Скандинавии. Заболеть ГЛПС можно в течение года, но заболеваемость зависит от динамики популяции грызунов-носителей.
Сезонные вспышки ГЛПС весной и осенью происходят из-за активного размножения мышей и связаны с увеличением контактов с грызунами на фоне садово-полевых работ. Наиболее тяжелая форма геморрагической лихорадки с синдромом почечной недостаточности вызвана вирусом Хантаан (HTNV) в Азии. Пуумала – наиболее распространенный хантавирус, но заболевание протекает легче. Встречается в Европе, России, и Балканах. Вирус Dobrava инициирует более тяжелую форму ГЛПС. Причины различий в клинической тяжести неизвестны. Смертность и заболеваемость варьируются от 5-15% в зависимости от патогенности штамма возбудителя.
Повышенная заболеваемость у мужчин обусловлена их более высокой активностью на открытом воздухе, что приводит к контакту с инфицированными грызунами.
Геморрагическая лихорадка с синдромом почечной недостаточности обычно развивается у лиц старше 15 лет (20-60). У детей и подростков младше 15 лет болезнь является легкой и часто протекает в субклинической форме.
Вирусы рода Hantavirus (семейство Bunyaviridae) вызывают различные формы геморрагической лихорадки с синдромом почечной недостаточности. Тяжесть заболевания зависит от штамма вируса и географического распределения. Хантавирусы, связанные с ГЛПС, включают вирус Хантаан (HTNV), Добрава / Белград (DOBV), Сеул (SEOV), Пуумала (PUUV) и Сааремаа (SAAV).
• Корейская геморрагическая лихорадка – тяжелый тип болезни, наблюдаемый в Азии, вызван хантавирусом и передается зараженной полосатой полевой мышью A agrarius mouse.
• Балканская геморрагическая лихорадка, тяжелый тип, встречается в балканских странах, вызван вирусом Добрава, грызун — A flavicollis.
• Легкая и умеренная форма геморрагической лихорадки с синдромом почечной недостаточности вызвана вирусом Сеула и передается зараженными грызунами рода Раттусратута и Rattusnovergicus.
• Умеренная форма геморрагической лихорадки с синдромом почечной недостаточности, наблюдаемая в Европе, вызвана вирусом Puumala и передается грызунами Clethrionomysglariolus.
Вирус обычно попадает к человеку через вдыхание экскрементов зараженных животных (например, мочи, фекалий, слюны). Укус грызуна может также привести к инфицированию человека. На сегодняшний день не существует подтверждения для передачи болезни между людьми.
В группу риска входят лица, связанные с сельскохозяйственной деятельностью, военные (полевые учения), любители походов, дачники и пр.
Проживание в зонах обитания грызунов, вероятность контакта с продуктами их жизнедеятельности (например, уборка дачи после зимы), клиническая картина и лабораторные данные, включая положительный анализ крови на ГЛПС, позволяют поставить окончательный диагноз.
Выполнение биопсии почек не является необходимой мерой.
• ПЦР-тест;
• ИФА в динамике;
• ОАМ и ОАК;
• проба Зимницкого;
• суточная протеинурия;
• мочевина, креатинин;
• коагулогоамма;
• показатели кислотно-основного состояния;
• электролиты крови и пр.
Инструментальная диагностика проводится по показаниям и включает:
• УЗИ почек;
• ЭКГ;
• ФГДС;
• рентгенографию органов грудной клетки или КТ;
• МРТ и пр.
Клинические особенности при геморрагической лихорадке с синдромом почечной недостаточности состоят из триады:
• повышение температурной реакции;
• кровоизлияния;
• почечная недостаточность.
К распространенным симптомам на начальном этапе заболевания относят:
• низкое артериальное давление;
• головную боль;
• миалгию и костно-суставные боли;
• озноб;
• жажду;
• абдоминальную и поясничную боль;
• диспепсию.
Инкубационный период – 12-16 дней.
У детей ГЛПС чаще протекает в субклинической форме и при тяжелом течении может осложниться гиповолемическим шоком. Период с момента инфицирования до клинических проявлений – 4-42 дня.
Болезнь имеет 5 прогрессирующих стадий:
• инкубационная;
• фебрильная,
• олигоурия;
• полиурия;
• выздоравление.
Только 1/3 пациентов проходит через все стадии.
Фебрильная стадия типична для всех пациентов и продолжается 3-7 дней. Болезнь характеризуется резким повышением температуры до 40° C. Пациенты предъявляют жалобы на головную боль, озноб, боль в животе и пояснице, недомогание, снижение остроты зрения.
На фоне лихорадки появляется геморрагическая сыпь на грудной клетке, в подмышечных впадинах, шее. На слизистой мягкого неба визуализируются петехии.
Субконъюнктивальное кровоизлияние отмечено у 30% пациентов. Брадикардия и пастозность лица встречаются достаточно часто. Тахикардия может указывать на предстоящий шок.
С почечной недостаточностью и низким давлением сталкиваются 11% пациентов.
При тяжелом течении осложнением присоединяется острый живот на фоне пареза кишечника. Повышенный уровень амилазы и липазы в сыворотке крови, в сочетании с острой болью в животе, указывает на острый панкреатит. Диагноз можно подтвердить при компьютерной томографии поджелудочной железы, которая показывает отек самого органа и окружающих тканей. У пациентов могут быть судороги или бесцельные движения.
• повышенный уровень гематокрита, вызванный гемоконцентрацией;
• тромбоцитопения (определяет прогноз и тяжесть почечной недостаточности);
• нормальное количество лейкоцитов или лейкоцитоз с атипичными лимфоцитами;
• нарушения в работе свертывающей системы крови (удлинение времени свертывания и пр.).
В моче временная протеинурия (как правило, разрешается в течение 2 недель) и микрогематурия.
Олигурическая стадия происходит у 65% пациентов и длится около 3-6 дней.
Для нее характерно острое поражение почек, характеризующееся резким снижением выработки мочи, гипертонией, склонностью к кровотечениям, вызванной уремией, отеками. На этом этапе мочевина и сывороточный креатинин крови достигают наивысшего уровня.
Гипонатриемия, гиперфосфатемия и гиперкалиемия также могут возникать во время олигурической фазы. Серьезное осложнение при неадекватной терапии – отек легких. На данной стадии уровень тромбоцитов возвращается к норме.
Выделение большого количества мочи обычно происходит в течение 2-3 недель. Суточный диурез составляет 3-6 литров, симптомы предыдущих стадий исчезают.
На данном этапе может возникнуть обезвоживание, если инфузионная терапия недостаточна.
Реконвалесценция продолжается до 3-6 месяцев.
Клиническое выздоровление обычно начинается в середине второй недели с постепенным разрешением симптомов и азотемии.
Важно! Концентрационная способность почечных канальцев восстанавливается в течение многих месяцев, поэтому необходимо соблюдать все рекомендации врача и сдавать анализы.
Жалобы пациентов на стадии выздоровления:
• слабость;
• утомляемость;
• мышечные боли;
• снижение аппетита.
Во время выздоровления постепенно восстанавливается привычная масса тела.
Терапия зависит от стадии заболевания, уровня дегидратации и состояния гемодинамики. Самый важный шаг в лечении геморрагической лихорадки с почечным синдромом – поддержание гемодинамики пациента и регидратация. Во время активной стадии болезни жизненно необходимо восполнение баланса жидкости и электролитов.
Показания к различным лекарствам основаны на клинике в разные стадии заболевания.
При шоковом состоянии используют препараты, повышающие давление и внутривенно вводят альбумин. Чрезмерная инфузионная терапия может привести к экстравазации, состоянию, когда стенки капилляров начинают пропускать кровь.
Во время олигоурической стадии показаны диуретики (Фуросемид), в случае неэффективности – проведение заместительной почечной терапии, особенно, если есть перегрузка жидкостью, гиперкалиемия и ацидоз.
Если повышено артериальное давление, используют гипотензивные препараты.
Антибиотики показаны только при подозрении на вторичное инфицирование.
При кровотечении переливают кровь и ее компоненты и назначают антагонисты Н 2 –рецепторов.
В случае диссеминированной внутрисосудистой коагуляции вводят свежую плазму или плазмозаменители.
Рекомендуется питание с низким содержанием натрия и с ограничением жидкости во время олигурической фазы. В период полиурии потребление жидкости свободное.
Из рациона исключают все острые, кислые, копченые, соленые продукты. Пищу готовят с щадящей термической обработкой. Питание – частое, дробное, малыми порциями.
Восстановление обычно начинается с 10-11 дня. Период ранней реконвалесценции может продолжаться от нескольких суток до нескольких недель, поэтому необходим тщательный контроль электролитных нарушений и признаков обезвоживания.
Фаза выздоровления длится 3-6 месяцев. Гломерулярные повреждения, как правило, проходят, и концентрационная способность почечных канальцев постепенно улучшается. Последующее наблюдение проводят еженедельно, пока состояние не нормализуется. В последующем анализы контролируют 1 раз в месяц, так как у некоторых пациентов сохраняется протеинурия и повышенное артериальное давление.
У 10-12 % пациентов может развиться пиелонефрит (при присоединении бактериальной флоры), нефросклероз, поэтому наблюдение нефролога обязательно.
Поведение человека может увеличить заболеваемость, поэтому основные превентивные меры включают следующее:
• Правильное хранение пищи и борьба с грызунами.
• Соблюдение мер предосторожности во время проведения садово-полевых работ, в походах, сборах и пр.
• Избегание кемпинга в полях, засаженных зерновыми культурами.
• Хранение соломы вдали от жилища.
Разработка недорогой, безопасной, эффективной и многовалентной вакцины против этой группы вирусов могла бы стать лучшей формой профилактики в эндемичных регионах. Однако высокое генетическое и антигенное разнообразие патогенных хантавирусов в сочетании со спорадическим характером вспышек заболеваний создают серьезные проблемы для разработки эффективных профилактических вакцин.
ГЛПС в редких случаях может привести к развитию следующих состояний:
• забрюшинное кровотечение:
• кровоизлияние в ткани внутренних органов;
• желудочно-кишечное кровотечение;
• отек легких;
• гипопитуитаризм;
• дисфункция гипофиза на фоне атрофии передней доли.
ГЛПС является самоограничивающейся болезнью, и большинство пациентов восстанавливается без осложнений; однако у некоторых людей могут сохраняться симптомы неблагополучия со стороны нервной системы и почек.
Нарушение реабсорбции натрия наблюдается через 12 месяцев после болезни, вызывая его повышенную экскрецию с мочой.
В ряде случаев диагностируют гиперкальциурию и гиперфосфатурию. Приблизительно у 1 из 10 взрослых с терминальной стадией почечной недостаточности в крови присутствуют специфичные к хантавирусу антитела.
В литературе есть данные, что панкреатит и орхит могут быть осложнениями при ГЛПС.
источник