Гепатиты и циррозы печени
Гепатитом называется воспалительное заболевание печени. Клинически выделяют острые и хронические гепатиты.
Чаще всего острые гепатиты имеют вирусную этиологию, хотя нередко встречаются острые токсические (в том числе лекарственные и алкогольные), аутоиммунные билиарные и генетические гепатиты,
Острые вирусные гепатиты имеют наибольший удельный вес по частоте встречаемости. На сегодня идентифицировано достаточно много вирусов гепатита: А, В, С, D, Е, TTV и ряд вирусов, проходящих идентификацию. Каждый из этих вирусов имеет различные пути заражения, сроки инкубации и, главное, последствия заражения.
Вирус гепатита А является возбудителем так называемого эпидемического гепатита. Он передаётся обычно фекально-оральным путём и распространяется, обычно в коллективах, особенно детских, в семьях. Инкубационный период заболевания составляет 14 — 45 дней. В хроническую форму заболевание не переходит и более чем в 99% случаев наступает полное выздоровление. Однако после перенесенного острого вирусного гепатита А у больных нередко развиваются хронический холецистит или желчекаменная болезнь.
Вирус гепатита В чрезвычайно распростанён во всём мире. Ежегодно только регистрируется 250.000 новых случаев инфицирования вирусом гепатита В. Вирус гепатита В передаётся парэнтеральным путём (инъекции, гемотрансфузии, введение препаратов из крови, например иммуноглобулинов), половым путём (как гетеросексуальным, так и гомосексуальным) или вертикальным путём (мать — дитя). Инкубационный период заболевания составляет 30 — 100 дней. При заражении новорождённых вирусоносительство развивается почти у 90% больных. При заражении детей младшего возраста вирусоносительство развивается у половины заболевших. При заболевании детей старшего возраста вирусоносительство развивается почти у 20 % заболевших. При остром заболевании взрослых людей выздоровление наступает более чем у 85% больных. Хронизация заболевания наступает почти у 10% больных с исходом в цирроз печени у 1% из них. Следует отметить, что при вертикальной передаче вируса (мать — ребёнок) риск развития первичной гепатоцеллюлярной карциномы (рак печени) возрастает в 200 раз по сравнению с горизонтальным путём передачи инфекции.
Вирус гепатита С передаётся также, как и вирус гепатита В. Срок инкубации заболевания составляет 14 — 180 дней. При остром заболевании клиническое выздоровление наступает только у 50 — 70% больных. При этом следует уточнить, что элиминация, то есть удаление вируса из организма человека происходит только у 20% больных. У 80% больных развивается персистирование, то есть скрытое течение патологического процесса. Более чем у половины больных заболевание приобретает хроническую форму с исходом в цирроз печени более чем у 10% заболевших. Основная масса больных — вирусоносителей, около 75%, страдает хроническим гепатитом. У примерно 10% больных развивается гепатоцеллюлярная карцинома, или рак печени.
Вирус гепатита D как самостоятельное заболевание не встречается. Обычно он выступает в качестве так называемого дельта(Δ)-агента, отягощающего течение гепатита В. Инкубационный период заболевания составляет 14 — 60 дней. Путь передачи такой же, как и при гепатите В. Выздоровление после острого заболевания наступает у 50 — 80% больных. При этом вариант дельта — вируса С вызывает хронизацию у 2 % больных, а вариант дельта-вируса S вызывает хронизацию у 75% больных с исходом в цирроз печени более чем у 10% заболевших.
Вирус гепатита Е передаётся фекально-оральным путём. Срок его инкубации пока не известен. Выздоровление наступает у 95% остро заболевших людей. Остальные характеристики заболевания, также как и характеристики вируса TTV, находятся в процессе изучения.
Эпидемиологическими исследованиями установлено, что среди всех больных хроническим вирусным гепатитом вирус гепатита В выделяется у 55% больных, вирус гепатита С выделяется у 41% больных, вирусы гепатита В + С выделяются у 3% больных и вирусы гепатита В + D выделяются у 2% больных.
Клинически острый вирусный гепатит может протекать как в желтушном, так и в безжелтушном вариантах.
Заболевание начинается с появления общей слабости, недомогания, тошноты. У больного повышается до 38- 39 о С температура тела. У больного может появиться горечь во рту, вздутие живота, урчание и переливание в животе. Кроме того, появляются тупые, ноющие боли в правом подреберье, боли в мышцах и суставах. При желтушном варианте заболевания у больного появляется моча «цвета пива», появляется иктеричность, или желтушность, склер, мягкого нёба, а затем и кожи.
При пальпации печень болезненная, увеличенная, гладкая, мягкая, с закруглённым краем.
Хронические гепатиты. В повседневной практике приходится встречаться чаще всего с хроническими гепатитами вирусной, алкогольной, токсикоаллергической лекарственной, токсической, паразитарной и аутоиммунной этиологии.
Как уже обсуждалось, чаще хроническое течение гипатита вызывают вирусы В, С, D, возможно, Е, TTV и их комбинации.
Алкогольные гепатиты, также как и вирусные подразделяются на острые и хронические. Понятно, что острые алкогольные гапатиты возникают после однократного употребления алкогольных напитков, а хронические — при их длительном, обычно регулярном, употреблении.
Токсикоаллергические гепатиты обычно являются следствием приёма лекарственных препаратов, прежде всего антибиотиков тетрациклинового ряда, антидепрессантов, транквилизаторов, нейролептиков и контрацептивов.
Токсические гепатиты, обычно острые, развиваются при отравлении грибами, парами ацетона.
Морфологически гепатиты подразделяют на паренхиматозные гепатиты с поражением печёночной паренхимы и мезенхимальные гепатиты с преимущественным поражением соединительнотканных элементов печени и ретикулоэндотелиальной системы.
По клиническому прогнозу все хронические гепатиты подразделяют на персистирующие, активные и холестатические варианты заболевания.
Персистирующий, или малоактивный, гепатит протекает без выраженной активности. Он отличается благоприятным течением и редко переходит в цирроз печени. Чётко очерченные обострения не характерны для этой формы заболевания.
Хронический активный гепатит отливается высокой активностью воспаления с выраженным нарушением всех функций печени. Хронический активный гепатит часто переходит в цирроз печени.
Холестатический гепатит протекает с явлениями выраженного холестаза, то есть во внутрипечёночных протоках образуется масса мелких конкрементов, затрудняющих нормальный отток желчи.
Хронический гепатит протекает с периодами ремиссии и обострения. При этом больные жалуются на общую слабость, недомогание, боли ноющего, тупого характера в правом подреберье. Боли обычно постоянные. У больных хроническим гепатитом выражены и диспептические явления: горечь во рту, особенно по утрам, отрыжка, тошнота, метеоризм, расстройства стула со склонностью к поносам, особенно после приёма жирной пищи. Нередко, особенно при обострении холестатического гепатита, появляется желтуха склер, слизистых оболочек и кожи, становится обесцвеченным кал, темнеет моча. У большинства больных желтуха умеренно выражена. Обратите внимание, что если желтуха существует достаточно давно, то кожа у больных приобретает сероватый оттенок. При обострении хронического активного гепатита повышается до субфебрильных или фебрильных цифр температура тела.
Во время осмотра больного кроме желтухи покровов обнаруживаются «печёночные ладони» и «сосудистые звёздочки». При пальпации печени выявляется болезненность и увеличение печени. Увеличение печени чаще диффузное, хотя может увеличиваться только одна доля печени, чаще левая. Край пальпирующейся печени гладкий, закруглён и плотноват. Следует отметить, что увеличение размеров печени является наиболее постоянным симптомом хронического гепатита. В отличие от циррозов печени при хроническом гепатите обычно увеличение размеров печени не сопровождается одновременным и значительным увеличением селезёнки.
У некоторых больных, особенно у лиц, страдающих хроническим вирусным гепатитом В могут обнаруживаться системные аутоаллергические проявления заболевания: полиартралгия, кожные высыпания, признаки гломерулонефрита (появление белка и эритроцитов в моче), васкулит, узловатая эритема, ангионевротический отёк. Это связано с тем, что у больных хроническим гепатитом В аутоаллергический компонент намного выше, чем при других формах этого заболевания, в том числе при хроническом гепатите С.
Большое значение в диагностике хронических гепатитов имеют лабораторные исследования. Во всех случаях диагностику гепатита следует начинать с определения вирусного генеза заболевания. Типирование вирусов проводится исследованием крови на маркеры вирусов гепатитов методом иммуноферментного анализа (ИФА). Эта методика позволяет выявлять циркулирующие в крови вирусные антигены и антитела к различным видам вирусов гепатита.
В настоящее время определяют следующие антигены: для диагностики гепатита А — HAAg, для диагностики гепатита В — Hbs(surface)Ag, HbeAg, Hbc(core)Ag, NS4, для диагностики гепатита С — HCAg, для диагностики гепатита D — HDAg(δAg), для диагностики гепатита Е — HEAg.
Однако чаще встречается диагностика вирусных гепатитов по наличию в крови больного антител к вирусам гепатита. Это связано с тем, что у больных хроническим гепатитом вирионы в крови могут в какой-то момент отсутствовать. Для диагностики гепатита А определяют следующие антитела: anti-HAV IgG/IgM; для диагностики гепатита В – anti-HBs, anti-Hbe, anti-Hbc IgG/IgM, anti-NS5; для диагностики гепатита С — anti-HCV, anti-c100, anti-c22-3, anti-c33c; для диагностики гепатита D — anti-HDV(δAg) IgG/IgM
Обнаружение иммуноглобулинов класса М указывает на остроту заболевания, выявление иммуноглобулинов класса G указывает на хронический процесс. В том случае, если у больного имеются иммуноглобулины классов M и G одновременно, то, вероятнее всего, это инфекция двумя подтипами или начало сероконверсии.
Значительно надёжнее диагностика вирусных гепатитов с использованием методики полимеразной цепной реакции (ПЦР). При исследовании крови больного ПЦР позволяет диагностировать виремию, а при исследовании биоптата печени с помощью этого теста можно установить наличие и плотность (количество) вирионов в клетке.
Неспецифическими симптомами хронического гепатита являются повышение СОЭ, снижение содержания альбуминов и увеличение α- и γ-глобулинов в крови. Становятся положительными белковые осадочные пробы — тимоловая, сулемовая и другие. В сыворотке крови повышается содержание ферментов: трансаминаз, прежде всего аланинаминотрансферазы, лактатдегидрогеназы. Задерживается экскреция бромсульфалеина. При явлениях холестаза в крови повышается активность щелочной фосфатазы. Едва ли не у половины больных хроническим гепатитом выявляется гипербилирубинемия, прежде всего за счёт конъюгированного (связанного) билирубина. У больных с хроническим активным гепатитом могут иметься признаки синдрома гиперспленизма — анемия, лейкопения, тромбоцитопения
Многообразие клинических проявлений хронических гепатитов вызвало необходимость применения определённой группы тестов для оценки преимущественной направленности морфологических процессов в печени при различных вариантах этого заболевания.
Синдром «недостаточности гепатоцитов» проявляется снижением содержания в крови веществ, синтезируемых этими клетками: альбумина, протромбина, фибриногена, холестерина.
Синдром «повреждения гепатоцитов» проявляется повышением в крови активности ферментов — трансаминаз, прежде всего аланинаминотрансферазы, и лактатдегидрогеназы.
Синдром «воспаления» проявляется диспротеинемией (увеличение α- и γ-глобулинов), положительными реакциями осадочных проб (тимоловой и сулемовой), увеличением в крови уровня иммуноглобулинов, особенно IgG.
Синдром «холестаза» проявляется провышением активности в крови щелочной фосфатазы, увеличением содердания холестерина, желчных кислот, конъюгированного (связанного) билирубина и меди.
Наилучшим способом диагностики хронического гепатита, определения прогноза течения заболевания является пункционная биопсия печени с гистологическим исследованием биоптата.
Цирроз печени (cirrhosis hepatis) — хроническое прогрессирующее заболевание, характеризующееся поражением паренхимы и стромы печени с дистрофией печёночных клеток, узловой регенерацией печёночной ткани, развитием соединительной ткани, диффузной перестройкой дольчатой структуры и сосудистой системы печени.
Термин «цирроз печени» впервые применил Рене Лаэнек в 1819 году. Он описал больного с асцитом и резким уменьшением размеров печени, которая на разрезе была рыжего цвета (греч. kirros — рыжий) и необычно плотной. В дальнейшем этот вид цирроза печени получил название «атрофический цирроз».
В 1875 году Hanot описал гипертрофический цирроз с желтухой и значительным увеличением печени. Этот вид цирроза в настоящее время, вероятнее всего, описывается как билиарный цирроз печени.
В 1894 году Banti описал больного гипертрофическим циррозом печени с резким увеличением селезёнки, то есть цирроз печени с явлениями спленомегалии.
Цирроз печени является повсеместно распространённым заболеванием. Мужчины страдают им в 3 — 4 раза чаще женщин.
В настоящее время существует рад классификаций циррозов на основании морфологических, этиологических и клинических признаков.
Международная классификация болезней 10 пересмотра выделяет: алкогольные циррозы, токсические циррозы, первичный и вторичный билиарные циррозы печени, кардиальный цирроз печени, другие формы циррозов печени — криптогенный, макронодулярный, микронодулярный, портальный, смешанного типа.
1) Циррозы, вызванные инфекционным фактором — вирусами (В, С, их сочетаниями и их комбинациями с Δ-агентом), лептоспирой, бруцеллой, малярийным плазмодием, лейшманиями.
2) Циррозы, вызваенные длительным дефицитом в пищевом рационе белков и витаминов группы В (заболевание «квашиоркор», распространённое в странах Африки и в Индии и встречающееся у детей).
3) Интоксикации (алкоголем, хлороформом, мышьяком, грибами и др.).
4) Паразитарные циррозы (эхинококкоз, шистозоматоз, фасциолёз).
5) У больных с заболеваниями сердца и тяжёлой сердечной недостаточностью, слипчивым перикардитом возникает вторичный, застойный цирроз печени.
6) Вторичные циррозы у больных сахарным диабетом, коллагенозами, рядом заболеваний крови и др.
Возникает обычно либо у лиц длительно злоупотребляющих алкоголем (алкогольный цирроз), либо вследствие хронической вирусной инфекции.
Алкогольные циррозы составляют около 50 — 70% всех циррозов. Размеры печени при этом циррозе уменьшены, она имеет мелкозернистую структуру вследствие равномерного образования мелких паренхиматозных узлов. Ведущими в клинике этой формы цирроза печени является синдром портальной гипертонии. Синдром печёночно-клеточной недостаточности присоединяется позже. Желтуха присоединяется тоже в относительно поздних сроках заболевания. Часто встречаются синдром гиперспленизма и геморрагический синдром. Явлений холестаза и холемии обычно не бывает.
Вид больных портальным циррозом довольно характерен. У них при осмотре отмечается кахексия (исхудание), бледность покровов. Выраженной желтухи обычно не бывает. Обычно желтуха развивается уже в поздние сроки болезни. На коже ладоней — пальмарная эритема, а на коже туловища имеются «сосудистые звёздочки. При осмотре живота — «голова медузы» на передней брюшной стенке, асцит. Из-за асцита пальпация печени бывает затруднительна. В этих случаях удобно использовать толчкообразную пальпацию печени. Для врача ставит пальпирующую руку кончиками пальцев на брюшную стенку вертикально в области правого подреберья и проводит короткие толчкообразные движения. В момент касания печени возникает ощущение, что она как бы уплывает из-под пальцев и возвращается вновь. Это ощущение называют симптомом плавающей льдины.
После абдоминальной пункции или лечения мочегонными препаратами печень пальпируется хорошо. Она плотная, безболезненная, в ранних стадиях заболевания печень увеличена, а в поздних стадиях — уменьшенная, с острым краем и гладкой поверхностью. Селезёнка большая и плотная. При исследовании крови выявляются анемия, лейкопения, тромбоцитопения, гипопротеинемия, гипопротромбинемия, увеличение активности «печёночных ферментов».
Постнекротический цирроз. Наиболее частой причиной его возникновения являются вирусные гепатиты, тяжёлые токсические поражения печени. Встречается эта форма заболевания в 20 — 30% всех циррозов.
Печени несколько уменьшена в размерах, но грубо деформирована крупными соединительнотканными узлами, возникшими вследствие некрозов гепатоцитов с заменой их фиброзными образованиями. Отсюда существует второе название постнекротических циррозов — «макронодулярные циррозы»
Ведущими в клинике этой формы цирроза являются синдромы печёночно-клеточной недостаточности, желтухи, портальной гипертонии с асцитом. Печёночно-клеточная недостаточность и портальная гипертония с асцитом возникают рано и периодически нарастают.
При осмотре этих больных желтуха выявляется периодически при обострении заболевания. На коже видны следы множественных расчёсов, кровоизлияния, «сосудистые звёздочки» и «печёночные ладони». Из-за некротических процессов в печени может повышаться температура тела. При осмотре живота выявляется асцит. Пальпация живота выявляет увеличенную, плотную, безболезненную, бугристую печень с острым неровным краем. На поздних сроках заболевания печень уменьшается в размерах
В анализах крови выявляются резкие изменения всех «печёночных проб», гипербилирубинемия, прежде всего, за счёт конъюгированного билирубина (прямая реакция).
Билиарный цирроз встречается приблизительно в 5% случаев всех видов цирроза печени. Болеют этой формой цирроза печени чаще женщины. Встречается две формы заболевания — первичный и вторичный билиарный цирроз печени. Он обусловлен закупоркой внепечёночных, а нередко и внутрипечёночных, желчных протоков, что затрудняет отток желчи. Вокруг холангиол происходит активное разрастание соединительной ткани.
Первичный билиарный цирроз печени обычно является следствием вирусного гепатита, лекарственной интоксикации, особенно вследствие приёма гормональных контрацептивов.
Вторичный билиарный цирроз печени является следствием желчекаменной болезни, опухоли фатерова соска.
В клинике заболевания доминируют синдромы желтухи и холемии. Портальная гипертония и печёночно-клеточная недостаточность возникают относительно поздно.
При осмотре больного обращает на себя внимание интенсивная желтуха. Она возникает в ранние сроки заболевания и отличается большой стойкостью. На теле множественные следы расчёсов, ксантелязмы на веках, локтях, ягодицах. При этом циррозе печени нередки костные изменения — пальцы в виде барабанных палочек, остеопороз костей. Кал ахоличный, моча интенсивного тёмного цвета. У больных длительно сохраняется лихорадка из-за сопутствующего холангита.
Асцит появляется в поздние сроки болезни. При пальпации живота выявляется большая, плотная, болезненная, с ровным, острым краем печень. Селезёнка тоже резко увеличена, плотная.
При аускультации сердца отмечается брадикардия. Артериальное давление снижено.
В анализах крови отмечаются гипербилирубинемия и гиперхолестеринемия.
Течение циррозов печени различно. Периоды активности заболевания сменяются периодами ремиссии. Во всех случаях гибель больных наступает либо при явлениях печёночной комы, либо от массивных кровотечений из варикозно расширенных вен пищевода.
МЕТАБОЛИЧЕСКИЕ ЗАБОЛЕВАНИЯ ПЕЧЕНИ
Гемохроматоз (бронзовый диабет). Заболевание это сравнительно редкое и встречается преимущественно у мужчин. Гемохроматоз связан с нарушением обмена железа, избыточным отложением его в тканях внутренних органов — коже, печени, поджелудочной железе, миокарде с нарушением их функции. Поражение этих органов и определяет диагностическую триаду бронзового диабета: сахарный диабет, цирроз печени, бронзовая (серо-бурая или коричневая) окраска кожи. Диагноз устанавливается, в том числе, и по анализу крови — резкому повышению уровня сывороточного железа.
Болезнь Вильсона-Коновалова (гепатолентикулярная дистрофия). Заболевание связано с нарушением обмена меди — избыточным всасыванием её в кишечнике и избыточным отложением в печени, в нервных ганглиях, в тканях других внутренних органов. В клинике заболевания имеется сочетание симптомов цирроза печени и глубоких поражений нервной системы — тремор конечностей, скандированная речь, гипертонус мышц и нарушения психики.
Диагноз подтверждается биопсией тканей, прежде всего пункционной биопсией печени, с окраской на медь, выявлением сниженного уровня фермента церулоплазмина в крови, повышением уровня меди в крови и моче.
источник
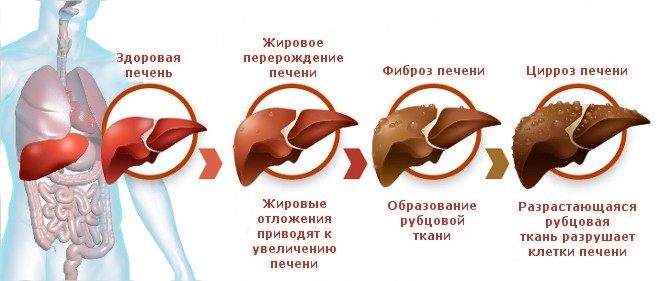
Цирроз печени – это последняя стадия различных хронических заболеваний, которые приводят к прогрессирующей гибели ее клеток. Этот диагноз ставят, когда изменения уже необратимы и затрагивают большую площадь.
Кратко процесс развития заболевания заключается в гибели гепатоцитов, организм замещает погибшие клетки печени соединительной тканью, которая не выполняет функции по очистке организма от различных токсинов и наступает тяжелая интоксикация.
Гибель клеток печени – это процесс не одного месяца, заболевание прогрессирует постепенно, захватывая новые участки здоровых тканей. Длительное время патологические изменения могут никак себя не проявлять, особенно если развивается цирроз, причиной которого стал гепатит С. Клинически протекание гепатита и цирроза тесно взаимосвязано. Цирроз печени – это осложнение после перенесенного гепатита С.
Наиболее распространенными причинами возникновения цирроза печени можно считать:
- хронический вирусный гепатит С и В;
- алкоголизм;
- гепатоз (жировая болезнь печени);
- бесконтрольный прием противоревматических медикаментов.
Гепатит С с исходом в цирроз печени – это причина более 27% случаев патологического изменения печени по всему миру.
Пациент при циррозе печени и гепатите С может жаловаться на:
- вялость, быструю утомляемость;
- снижение работоспособности;
- во рту появляется горечь и сухость, особенно по утрам;
- сонное состояние в дневное время суток, ощущение постоянного недосыпа;
- нарушение когнитивных функций – забывчивость, потеря концентрации при выполнении рабочих задач.
- расстройства пищеварения – диспепсия, боли и чувство тяжести в животе периодического характера, повышенное газообразование;
- потеря веса;
- бесцветные ногтевые пластины;
- субфебрильная температура.
Внешние проявления, симптомы цирроза:
- покраснения кожных покровов на ладонях и стопах;
- сосудистые звездочки;
- наблюдается потеря волос в подмышечной и лобковой области;
- фаланги пальцев становятся похожи на барабанные палочки.
Диагноз цирроз ставиться на основании не только симптомов, но и после получения результатов исследований, при подозрении на вирусную инфекцию – хронический гепатит и цирроз печени, проводятся лабораторные исследования:
- Общий анализ крови – определение уровня лейкоцитов, гемоглобина, СОЭ. По показателям можно будет дать оценку общего состояния организма.
- Биохимия крови – помогает понять на какой стадии находится разрушение печени, помогают в этом показатели билирубина, фосфатазы, определение трансминаз (АЛТ, АСТ).
- Исследование уровня гамма-глобулина – повышенный уровень говорит о циррозе.
- Анти-HCV, анти-HBV – дает понимание о присутствии вируса гепатита Ц в организме.
- ПЦР – анализ полимеразной цепной реакции, помогает выявить присутствие РНК вируса гепатита С, который и стал причиной цирроза печени.
Кроме лабораторных анализов крови используются следующие аппаратные методики:
- Компьютерная томография – дает наиболее точное представление о состоянии печени.
- Биопсия – из печени берется небольшая ее часть, этот метод позволяет в полной мере оценить стадию развития заболевания (наличие некроза и фиброза), ее причины.
- УЗИ – помогает оценить размеры печени и селезенки, увидеть есть ли фиброзная ткань.
Принято выделять три основные стадии в прогрессировании цирроза печени и гепатита С:
- Компенсированная – яркая симптоматика цирроза отсутствует, уцелевшие клетки активно работают, стараясь заменить погибшие.
- Субкомпенсированная – появляются первые признаки цирроза, описанные выше.
- Декомпенсированная – поражены уже значительные области печени, компенсационные механизмы небольшого числа здоровых клеток уже не справляются со своей работой. На этой стадии печеночная недостаточность нарастает, сильнее проявляются признаки энцефалопатии, асцита, желтухи, анемии и атрофии мышц. Этой стадии присущи такие осложнения как: печеночная кома, тромбозы вен, кровотечения, инфекционные процессы, связка гепатит – цирроз – рак здесь проявляется в полной мере.
Основное отличие компенсированного от декомпенсированного цирроза печени и гепатита С – это то, что на первой стадии процесс разрушения печени можно довольно быстро повернуть вспять. Для этого нужно вначале полностью вылечить гепатит, а затем уже заниматься восстановлением функций печени.
Прогноз длительности жизни при компенсированном циррозе и гепатите С в стадии ремиссии обычно благоприятный.
Декомпенсированный цирроз отличает развитие осложнений, протекающих в тяжелой форме – гипертензия портальных вен, увеличение селезенки, как следствие, кровотечения, накопление лишней жидкости в брюшине.
Последствия прогрессирующего цирроза, отягощенного гепатитом С могут проявляться как:
- Острая печеночная недостаточность – необходима интенсивная терапия, внутривенное введение альбумина.
- Асцит – жидкость просачивается в брюшину из-за портальной гипертензии.
- Бактериальный перитонит – когда скопившаяся жидкость в брюшной полости инфицируется патогенной микрофлорой. Температура тела может подниматься до опасных 40 градусов, пациент ощущает сильный болевой синдром в абдоминальной области.
- Печеночная энцефалопатия – вначале головная боль, усталость, заторможенность, затем может прогрессировать и закончиться комой.
- Кровотечение варикозных вен пищевода.
Цирроз при наличии гепатита С можно скорректировать, но все зависит от стадии заболевания. Однако в любом случае нужно вылечить гепатит С, затем начинать восстановление работоспособности печени.
Интересно знать! В Шотландии с апреля 2014 по март 2017 было проведено исследование, которое нашло поддержку на государственном уровне. Пациентам общим числом 4800 человек с хроническим гепатитом С и компенсированным циррозом было назначено лечение прямыми противовирусными препаратами. В итоге у 94% был зарегистрирован устойчивый вирусологический ответ. И по сравнению со статистикой предыдущих лет на 29% снизилось число случаев развития декомпенсированного цирроза, среди больных с диагнозом – хронический гепатит С.
Полностью избавиться от присутствия в организме вирусных вирионов гепатита можно при помощи комбинированной терапии прямыми противовирусными препаратами – Софосбувир, Даклатасвир, Велпатасвир, Ледиспавир.
При компенсированном циррозе и гепатите С, в стадии ремиссии, используется следующее терапевтическое лечение:
- назначение лекарственных средств на основе уродезоксихолевой кислоты;
- применение фосфолипидных препаратов;
- при асците используются диуретики;
- энцефалопатия предполагает коррекцию состояния седативными и противосудорожными медикаментами.
Кроме медикаментозной терапии, назначается диета при циррозе и гепатите С. Ее основу составляет ограничение белка и соли. Чтобы в организм поступало достаточное количество питательных веществ в рационе должны присутствовать овощи, фрукты, злаки и крупяные продукты. Привычное меню – жареное, консервированное, жирное, бобовые, кислые ягоды и фрукты, кофе, чай, находятся под запретом.
Необходимо придерживаться здорового образа жизни (прогулки, плавание), полностью отказаться от алкоголя и табачных изделий.
При декомпенсированном циррозе и гепатите 100% поможет трансплантация донорской печени, до проведения операции ее работу нужно поддерживать такими же методами как при компенсированной стадии.
Сколько живут при циррозе и гепатите С? Ответом на этот вопрос будет – долгие годы, при своевременном начале лечения прямыми противовирусными препаратами и соблюдении рекомендаций специалистов.
Как вылечиться от гепатита C навсегда?
Препараты нового поколения Софосбувир и Даклатасвир, а также Велпатасвир, Ледипасвир способны с 98-100% вероятностью навсегда излечить вас от гепатита C. Современные лекарства можно приобрести в России у официального представителя индийской фармкомпании Zydus Heptiza.
Получите бесплатную консультацию по применению новейших препаратов и узнайте о способах приобретения на официальном сайте поставщика Zydus в России. Читать далее. >>
источник
Цирроз печени — одно из наиболее распространенных заболеваний, которое ежегодно уносит жизни около 40 млн человек. Чаще всего причиной развития патологии является длительная алкогольная интоксикация. Вторую позицию в данном списке занимают вирусные гепатиты В, С и D. Отмечено, что у пациентов, страдающих гепатитом С и D, цирроз печени развивается в 97-99% случаев. Кроме этого, причинами развития заболевания может стать застой венозной крови, а также наличие у пациента генетических нарушений иммуномодуляции.
Несмотря на то, что цирроз печени может быть вызван различными причинами, симптомы заболевания всех типов практически идентичны.
На начальной стадии заболевание протекает бессимптомно. О развитии патологии свидетельствует снижение билирубина в крови, а также уменьшение протромбинового индекса. Симптомы появляются у пациента на второй стадии цирроза. В этот период наиболее характерными признаками заболевания является общая слабость, снижение трудоспособности, повышение температуры тела, появление дискомфорта в правом подреберье. Указанные симптомы могут сопровождаться диареей при употреблении жирной пищи, болью в суставах. При отсутствии лечения и коррекции образа жизни цирроз прогрессирует и переходит в третью стадию, при которой у пациента появляется желтушность кожных покровов, развиваются анемия и мышечная атрофия. На данном этапе возможно развитие серьезных осложнений, которые нередко приводят к смерти.
Долгое время о взаимосвязи между наличием у пациента гепатита С и развитием цирроза печени не было известно практически ничего. Сегодня тот факт, что пациенты, страдающие гепатитом С, относятся к группе риска в данном вопросе, уже ни у кого не вызывает сомнений. На фоне ВГС развивается ряд серьезных осложнений. К ним относится застой крови, появление асцита, нарушение баланса соли и жидкости в организме. Сочетание гепатита С и цирроза печени становится причиной нервных расстройств, снижения иммунитета, ухудшения показателей свертываемости крови, что приводит к появлению кровоточивости десен, носовым и внутренним кровотечениям.
При подозрении на цирроз печени пациенту назначается комплексная диагностика, так как только в этом случае можно гарантировать получение полной клинической картины.
В настоящее время для диагностики цирроза печени используется несколько методов. Наиболее востребованным является ультразвуковое исследование органов брюшной полости. При помощи УЗИ удается определить контуры и размеры печени и селезенки, а также структуру печеночной ткани. На третьей стадии заболевания определяется неравномерность долей. Для уточнения диагноза пациенту может быть назначено МРТ-исследование, допплерография, компьютерная томография и биопсия печени.
Диагностика начинается с назначения пациенту общего анализа крови. Свидетельством цирроза печени в данном случае может стать снижение уровня гемоглобина, концентрации эритроцитов в сыворотке крови, увеличение лейкоцитов и СОЭ. Максимальной информативностью обладает биохимический анализ крови, в ходе проведения которого изучается содержание ферментов АЛТ и АСТ, щелочной фосфотазы и билирубина. Кроме этого, пациенту назначается анализ на гепатит С, благодаря которому удается установить причину развития цирроза и назначить комбинированную схему лечения.
Печень по праву считается одним из наиболее удивительных органов человеческого организма, так как она способна самовосстанавливаться. Этот фактор дает шанс многим пациентам достичь длительной ремиссии. Тем не менее, исход лечения в большинстве случаев зависит от стадии заболевания, а также выбранной схемы лечения как самого заболевания, так и вызвавшего его гепатита С. Основой лечения любых стадий цирроза является диета. Индивидуальное меню разрабатывает диетолог, опирающийся на данные исследований и состояние пациента. В активной стадии заболевания используется медикаментозная терапия, включающая применение гормональных препаратов, иммунодепрессантов, гепатопротекторов и т.д.
При вирусном циррозе печени залогом результативного лечения является устранение причины заболевания – гепатита С. Для этого рекомендуется использовать препараты нового поколения, к которым относятся софосбувир и даклатасвир, или их аналогов, обладающих высокой эффективностью и гораздо более низкой ценой. Продукция индийских фирм, получивших патент на производство дженериков, прошла все стадии медицинских исследований и международной сертификации. Эффективность препаратов доказана в лабораторных условиях, подтверждена мнением специалистов и пациентов, избавившихся от страшного заболевания навсегда!
источник
Вирусные гепатиты и циррозы печени считаются одними из самых опасных заболеваний органов желудочно-кишечного тракта. Они часто приводят к структурным изменениям строения гепатоцитов, снижению их функциональной активности и развитию стойкой прогрессирующей недостаточности. Долгое время склеротическое поражение печеночных клеток считалось необратимым и быстро приводило к серьезным проблемам со здоровьем. Современные средства позволяют контролировать цирротические изменения, тормозить течение болезни и значительно повышать качество жизни больных. Лечатся ли различные стадии цирроза печени при гепатите С: попробуем разобраться.
Клинико-морфологические особенности цирроза печени и гепатита тесно связаны между собой. Первый часто осложняет течение второго, становясь терминальной стадией заболевания. Почему так происходит, и можно ли избежать развития необратимых изменений? Чтобы ответить на эти вопросы, стоит больше узнать о физиологии печени и основных синдромах, возникающих при ее воспалении.
Гепатит С – воспалительное поражение печени вирусной природы. Его возбудителем является вирус гепатита С (HCV), который передается от человека к человеку преимущественно парентеральным путем при манипуляциях с кровью, незащищенном сексе, использовании общих медицинских или режущих (бритвы, щипчики) бытовых инструментов.
Обратите внимание! В мире около 150 мл человек инфицированы вирусом HCV. Даже при отсутствии клинических проявлений хронического гепатита цирроз печени и рак среди таких пациентов диагностируется в 3-5 раз чаще, чем у неинфицированных.
От момента заражения вирусом до появления первых клинических признаков болезни в среднем проходит 1,5-2 месяца. Течение вирусного гепатита С не отличается яркой симптоматикой: часто больные десятилетиями не подозревают о своём диагнозе и узнают о проблемах с печенью в ходе профилактического медицинского обследования. На фоне практически незаметного разрушения клеток печени гепатит может проявляться:
- общей слабостью, утомляемостью;
- снижением работоспособности;
- сонливостью в дневное время;
- умеренным нарушением когнитивных (познавательных) функций – снижением памяти, способности концентрировать внимание на важных деталях.
Часто эти признаки не являются поводом для обращения пациента к врачу, и вирус годами размножается в организме, вызывая воспалительные изменения и деструкцию клеток печени. Конечной формой поражения органа считается цирроз: гепатит в его развитии играет не последнюю роль.
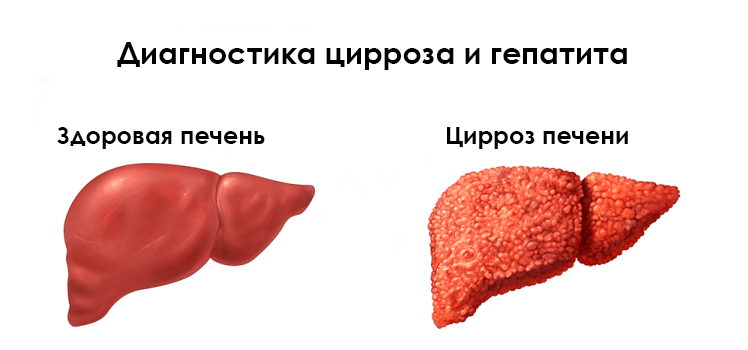
Циррозом в медицине принято называть хроническое поражение печени, сопровождающееся необратимым замещением функционально активных клеток «не работающей» соединительной тканью (стромой). Это приводит к изменению органа в размерах (возможно как увеличение, так и уменьшение) и консистенции. Цирротическая печень становится очень плотной, бугристой, иногда сморщенной. Она все хуже справляется со своими функциями:
- метаболическими;
- депонирующими;
- секреторными;
- детоксикационными;
- выделительными;
- гомеостатическими.
В патогенезе развития заболевания выделяют несколько последовательных стадий. Под действием этиологического фактора – вирусного воспаления печени – происходит активация специфических клеток Ито. Они провоцируют разрастание соединительной ткани и приводят к перицеллюлярному фиброзу.
Ещё один важный момент в механизме развития заболевания – нарушение кровоснабжения функциональной (паренхиматозной) ткани печени, ишемические изменения и некроз. Это в ещё большей степени усиливает склеротические процессы и приводит к необратимому замещению повреждённых клеток печени соединительной тканью.
Таким образом, гепатит С и цирроз тесно связаны друг с другом. Без первичных воспалительных изменений такое осложнение развивается крайне редко.
Но всегда ли развитие цирроза – единственно возможный вариант прогрессирования вирусного гепатита С? Каковы шансы у больных вирусным воспалением печени столкнуться с этим грозным осложнением?
- примерно у половины пациентов HCV сначала вызывает стеатогепатоз; цирроз печени развивается вторично, на фоне имеющейся жировой инфильтрации;
- гепатит С является причиной 27% случаев цирротического поражения печени по всему миру;
- 10-30% инфицированных сталкиваются с этим тяжёлым осложнением в течение ближайших 30 лет после заражения;
- в группе особого риска – пациенты с сопутствующим гепатитом В, шистосомозом, ВИЧ-инфекцией;
- злоупотребление алкоголем больным гепатитом С увеличивает риск развития цирроза в 100 раз.
В России возможность развития цирроза у больных гепатитом С в течение 20-30 лет после заражения колеблется от 5 до 45%. Прогрессирование заболевания, как правило, происходит очень медленно (20-40 лет). Если больные успешно лечатся, принимая противовирусные, дезинтоксикационные и симптоматические препараты, этот процесс можно замедлить ещё больше.
Клиническая картина цирроза, развившегося на фоне вирусного гепатита С, имеет стадийное течение. Каждый этап болезни характеризуется определенной симптоматикой, подходами к диагностике и лечению. Чем раньше будет выявлена патология, тем выше шансы пациента на благоприятный исход.
Обратите внимание! В развитых странах цирроз замыкает пятерку лидеров среди причин смертности людей среднего возраста (35-60 лет). Ежегодно его жертвами становятся до 40 миллионов человек.
Первая стадия патологии практически не имеет субъективных проявлений. Больной не предъявляет жалоб и чувствует себя удовлетворительно, так как в этот период активно работают компенсаторные механизмы.
На второй стадии цирроза обращают на себя внимание первые неспецифические проявления болезни:
- апатия;
- слабость;
- ухудшение работоспособности;
- непривычная для пациента утомляемость;
- приступы головной боли;
- ухудшение аппетита;
- тошнота, реже рвота;
- расстройство стула, поносы;
- тяжесть, дискомфорт в области правого подреберья;
- выпадение волос;
- гинекомастия у мужчин;
- асцит.
Эта стадия сопровождается начальными признаками энцефалопатии печеночного генеза – нервно-психического синдрома, сопровождающегося различными расстройствами высшей нервной деятельности – сознания, поведения, когнитивных функций.
Таблица: Проявления печеночной энцефалопатии
| Стадия | Характерные клинические симптомы |
|---|---|
| I | Рассеянность |
| Ухудшение памяти | |
| Нарушения сна | |
| Невозможность сосредоточиться, проблемы с концентрацией внимания | |
| Апраксия – расстройство выполнения целенаправленных действий | |
| II | Заметное изменение личности |
| Неадекватное поведение | |
| Лёгкие нарушения в ориентации во времени и/или пространстве | |
| Монотонность речи | |
| Бессонница | |
| Определение патологических рефлексов (хоботкового, сосательного) | |
| III | Угнетение сознания (вплоть до сопора) |
| Выраженная дезориентация: больной не представляет себя ни во времени, ни в пространстве | |
| Агрессивное поведение | |
| Громкая, бессвязная речь | |
| Нежелание вступать в контакт с окружающими | |
| Бред | |
| Признаки острого психоза (делирия) | |
| Тремор, клонико-тонические судороги | |
| Развязывание патологических рефлексов | |
| IV | Признаки печеночной комы |
| Отсутствие сознания | |
| Угнетениереакции на болевые и другие виды раздражителей | |
| Отсутствие реакции зрачков на свет | |
| Мышечная ригидность | |
| Определение патологических рефлексов (Жуковского, Бабинского, Гордона) |
На второй стадии цирротических изменений печени диагностируется l-ll стадия печеночной энцефалопатии.
Третья (терминальная, декомпенсированная) стадия цирроза характеризуется полным срывом всех компенсаторных механизмов и развитием печеночной недостаточности. Среди симптомов заболевания на первый план выступают прогрессирование энцефалопатии и асцита, признаки паренхиматозной желтухи, мышечной атрофии, анемии. Именно на этом этапе значительно возрастает риск развития осложнений и детального исхода.
Среди распространенных осложнений цирроза выделяют:
- печеночно-клеточную кому;
- тромбоз воротной вены;
- рак;
- наружные и внутренние кровотечения из варикозно расширенных вен;
- присоединение инфекционных процессов.
Диагностика цирроза печени требует комплексного подхода. В ней могут принимать участие терапевт, инфекционист, гепатолог (гастроэнтеролог), невропатолог и другие специалисты.
Обследование пациента начинается с тщательного сбора жалоб и анамнеза. Со слов больного можно очертить ведущие синдромы патологии, выявить один или несколько этиологических факторов, составить план дальнейшего обследования. Anamnesis morbi позволит предположить срок давности заболевания. При установленной инфекционной природе цирроза особое внимание следует уделить эпидемиологическому анамнезу.
Клиническое обследование включает в себя внешний осмотр, измерение артериального давления, аускультацию сердца и лёгких, поверхностную и глубокую пальпацию живота. В ходе осмотра врач может приблизительно определить размеры печени, выявить ее повышенную плотность, неровные очертания края, болезненность. Также при осмотре обращают на себя внимание признаки скопления свободной жидкости в полостях организма при гидротораксе, асците.
При подозрении на цирроз печени вирусной этиологии показано следующее лабораторное обследование:
- Общий анализ крови – для оценки основных функций организма. При рассматриваемом заболевании наблюдается повышение СОЭ, лейкоцитоз, снижение уровня гемоглобина и красных кровяных телец (признаки воспаления и анемии).
- Биохимический анализ крови с определением прямого и непрямого билирубина, щелочной фосфатазы, трансаминаз (АЛТ, АСТ) – в активной фазе гепатита наблюдается повышение этих значений, вызванное разрушением печеночных клеток. При развитии печеночной недостаточности снижается уровень общего холестерина и его фракций, протромбина, альбуминов (гипопротеинемия).
- Определение уровня гамма-глобулинов — при циррозе наблюдается их повышение.
- Анализ крови на анти-HCV, анти-HBV: так как хронические гепатиты часто провоцируют развитие сочетанной инфекции, следует проводить комплексное обследование на их наличие в организме.
- Полимеразная цепная реакция (ПЦР) – максимально диагностически точный тест, который проводится с целью выявления РНК возбудителя в организме.
Инструментальная диагностика цирроза заключается в проведении УЗИ и биопсии печени (назначается по показаниям).
При ультразвуковом исследовании органов брюшной полости наблюдается увеличение размеров печени и селезенки. Структура пораженного органа часто неоднородна за счёт воспалительных изменений. Отмечаются участки фиброза – плотные соединительнотканные тяжи, постепенно замещающие паренхиматозную ткань печени.
Важную роль в диагностике гепатита и цирроза играют биопсия печени с гистологическим исследованием полученных материалов. В результатах отмечаются признаки воспаления гепатоцитов, инфильтрации их клеточных стенок, наличие участков некроза и фиброза.
Возможна оценка состояния печени и расчет прогноза заболевания для каждого конкретного пациента и без проведения биопсии. С помощью международной системы METAVIR и ее активно применяемых в практической медицине алгоритмов определяется степень некроза и воспаления гепатоцитов (оценка выставляется по буквенно-цифровой шкале от А0 до А3) и стадию фибропластических изменений (F0-F4). Для этого необходимо учесть шесть индивидуальных показателей:
- возраст больного;
- ИМТ;
- уровень глюкозы в крови;
- уровень тромбоцитов;
- уровень альбумина;
- соотношение между ферментами-трансаминазами АЛТ и АСТ.
В зависимости от выраженности цирротических изменений определяется прогноз заболевания. Так, 50%больных с компенсированной формой цирроза показывают 10-летнюю выживаемость. Субкомпенсированная стадия патологии гарантирует пятилетнюю выживаемость около 40% пациентов. При декомпенсированном циррозе более трёх лет живут всего 10-40%.
В первую очередь стоит обратить внимание на существование профильных сайтов о гепатите С. На тематических сайтах о Гепатите С люди делятся актуальными новостями, публикуют информацию о приобретении современных препаратов. Самый крупный русскоязычный ресурс, работающий в этом направлении и неоднократно доказавший свою социальную значимость – это гепатит-форум, именуемый «На остановке» . Здесь можно получить свой «курс на выздоровление», бесплатную консультацию специалистов, почитать отзывы о препаратах и «терапийные» дневники пользователей. Обратите внимание, что на больших порталах вся информация проходит модерацию и получает объективную общественную оценку, поэтому здесь, как правило, не встречаются случаи обмана.
Обнаружение цирроза печени часто является шокирующей новостью для пациента. Однако паниковать не стоит: ранняя диагностика и своевременное комплексное лечение заболевания приводит к отличным результатам. Несмотря на то, что полностью излечиться от склеротического поражения гепатоцитов в настоящее время нельзя, значительно замедлить прогрессирование болезни и улучшить качество жизни пациента можно с помощью современных медикаментозных средств и высокой приверженности больного терапии.
Главной целью лечения цирроза остаётся компенсация состояния больного и профилактика вторичных изменений в печени. Прежде всего, терапевтические мероприятия касаются изменения образа жизни и коррекции диеты.
Всем больным рекомендуется:
- вести здоровый образ жизни;
- отказаться от вредных привычек – курения, употребления алкоголя и наркотических веществ;
- соблюдать режим труда и отдыха;
- поддерживать высокий уровень физической активности, заниматься ЛФК, пешими прогулками, плаванием или другим видом спорта, согласованным с лечащим врачом;
- регулярно проходить диспансеризацию;
- избегать переохлаждения, своевременно санировать хронические очаги инфекции.
Как и другие заболевания печени, цирроз является показанием для назначения лечебной диеты 5. Ее главными целями является нормализация функций больного органа и стимуляция процессов отделения желчи. Для этого следует питаться часто, 5-6 раз в день, но небольшими порциями. Полностью исключаются из рациона жирные и жареные блюда, оптимальными методами приготовления пищи считаются варка на пару и запекание. Важно употреблять достаточное количество чистой негазированной воды – до 1,3-1,5 л в день.
При развитии декомпенсированного цирроза с явлениями асцита больные переводятся на строгую безбелковую и бессолевую диету. До нормализации состояния из меню исключаются мясо, птица, рыба, молочные продукты, яйца. Допустимое содержание белка в ежедневном рационе – не более 40-60 г. Основой для завтраков, обедов, ужинов и перекусов должны стать и овощи, фрукты, крупы, злаковые. Пищу употребляют без соли.
Также исключаются из рациона:
- пища, богатая химическими добавками (ароматизаторами, усилителями вкуса) и консервантами;
- газированные напитки;
- мясные, рыбные консервы, паштет, тушёнка;
- жареная пища;
- соленья, маринады;
- копчености, колбасы, сосиски, сардельки;
- продукты с высоким содержанием животного жира;
- насыщенные бульоны из мяса птицы, рыбы, грибов;
- маргарин, кулинарный жир;
- жирное молоко, сливки, сметана;
- зрелые солёные сыры твердых сортов;
- бобовые: горох, фасоль, нут, чечевица, маш;
- зелень (можно есть в ограниченно количестве);
- редька;
- щавель;
- редис;
- лук, чеснок;
- кислые ягоды и фрукты;
- крепкий чай и кофе.
Продолжительность лечебной диеты устанавливается врачом индивидуально. Для достижения стойкой клинической ремиссии важно следовать ее принципам на протяжении нескольких месяцев и даже лет.
На протяжении нескольких десятилетий наиболее успешной схемой лечения вирусного гепатита С считалось применение комбинации из интерферона и рибавирина. Ее эффективность оценивалась в 40-80%, и результаты терапии во многом зависели от генотипа HCV, возраста, пола пациента, наличия у него осложнений гепатита и сопутствующих заболеваний.
Стандартный курс лечения составляет 24-48 недель и выполняется по схеме: 6 МЕ интерферона — до нормализации показателей трансаминаз (АЛТ), затем 6 МЕ интерферона через день – 12 недель, затем 3 МЕ интерферона через день – до окончания курса. Дополнительно принимается рибавирин в дозировке 800-1200 мг 1 раз в сутки.
Терапия комбинацией препаратов интерферона и рибавирина не лишена недостатков. Среди них – недостаточная эффективность, длительность, наличие побочных эффектов.
Начиная с 2011 года в мире, в том числе и в России, для лечения гепатита С активно используются препараты нового поколения с прямым противовирусным действием.
Важно! Благодаря средствам нового поколения сегодня гепатит С является полностью излечимым заболеванием.
Представителями этой фармакологической группы являются:
Среди их несомненных преимуществ – возможность достичь полной элиминации вируса из организма в 87-95% случаев, значительное снижение риска развития и прогрессирования цирротических изменений в печени, уменьшение продолжительности лечения.
Большинство препаратов, назначаемых при циррозе печени, направлены на устранение симптомов и негативных последствий заболевания.
Цирроз печени часто сопровождается биларной недостаточностью. Для ее устранения, а также нормализации процессов пищеварения стандартный план терапии заболевания включает назначение препаратов уродезоксихолевой кислоты (Урсофальк, Урсосан) из расчета 10-15 мг/кг веса один раз в сутки (в вечернее время).
Большим успехом пользуется клеточная терапия, направленная на защиту гепатоцитов от повреждающего действия, стимуляцию функциональной активности органа и коррекцию метаболизма. Наряду с фосфолипидными препаратами (Эссенциале форте) назначаются современные средства на основе стволовых клеток.
При развитии асцита (гидроторакса) показано назначение диуретиков (Фуросемида, Лазикса) в терапевтических дозировках. Коррекция неврологических нарушений при печеночной энцефалопатии проводится с помощью дезинтоксикационных, по показаниям — седативных, противосудорожных средств. Продолжительность лечения зависит от многих факторов и в среднем составляет 3-4 месяца.
Таким образом, современная медицина гарантирует достаточную продолжительность жизни пациентам с циррозом печени, развившемся на фоне хронического вирусного гепатита С. Чем раньше будет диагностировано заболевание и начата терапия, тем выше шансы пациента на благоприятный исход. Большинство больных, инфицированных HCV, продолжают жить полной жизнью на протяжении десяти и более лет после того, как им был поставлен диагноз «цирроз».
источник
Ретроспективное изучение хронического гепатита С (ХГ С) позволяет говорить, что в среднем у 20% больных в течение 20–30 лет развивается цирроз печени (ЦП). Скорость формирования цирроза зависит от ряда факторов.
Ретроспективное изучение хронического гепатита С (ХГ С) позволяет говорить, что в среднем у 20% больных в течение 20–30 лет развивается цирроз печени (ЦП). Скорость формирования цирроза зависит от ряда факторов. Медленное нарастание фиброза при ХГ С наблюдается у женщин молодого возраста в отсутствие таких факторов, как стеатоз печени, синдром перегрузки железом, злоупотребление алкоголем. Ряд причин обусловливает быстрое формирование ЦП: пожилой возраст при инфицировании, мужской пол, систематическое употребление алкоголя более 50 г/сут, наличие коинфекции вирусов гепатита В и/или ВИЧ, избыточная масса тела (> 28 кг/мІ), гетерогенность по гену гемохроматоза, полиморфизм генов ряда цитокинов, играющих ключевую роль в фиброгенезе. Среднее время развития ЦП у лиц, инфицированных в возрасте после 40 лет и злоупотребляющих алкоголем, составляет 13 лет, а у молодых женщин в отсутствие приема алкоголя ЦП формируется через 42 года. У 32% больных ХГ С протекает стабильно и не сопровождается прогрессированием болезни.
Важным фактором фиброгенеза является сохраняющаяся активность ХГ С по лабораторным данным и морфологическим признакам. У больных со стойко нормальным уровнем трансаминаз сыворотки риск развития ЦП С составляет 5%, в то время как наличие 3–5-кратного повышения АЛТ сыворотки ассоциируется с быстрым формированием ЦП С у 50% больных. Показано также, что факторами риска прогрессирования фиброза являются: наличие фиброза в ткани печени при первой биопсии, стеатоз печени и возраст больных. Быстрота прогрессирования фиброза определяется предшествующим фиброзом, стеатозом и лобулярным гепатитом [1]. При ХГ С низкой степени активности (ИГА по Knodell 4–8 баллов) риску развития ЦП С подвержены 7–10% больных, при ХГ С высокой степени активности (ИГА — более 13 баллов) у 71% больных цирроз может развиться уже через 7 лет. Проспективное изучение 404 больных компенсированным ЦП С показало, что за 85,7±36 мес наблюдения у 28% больных развивается хотя бы одно осложнение ЦП С, в том числе гепатоцеллюлярная карцинома (ГЦК) — у 19%, асцит — у 17%, кровотечение из варикозно расширенных вен пищевода (ВРВП) — у 5%, декомпенсация ЦП С (Чайлд В/С) — у 17%, энцефалопатия — у 2% [2].
Высокая частота развития ЦП С при хронической HCV-инфекции и риск серьезных осложнений в этой группе больных определяют задачи противовирусной терапии (ПВТ). Основная задача лечения — эрадикация вируса гепатита С и достижение стойкой ремиссии ХГ С, однако возможности достижения устойчивого вирусологического ответа (УВО) у больных ЦП С значительно ниже, чем при ХГ С. Исследования последних лет показали, что ПВТ способствует уменьшению выраженности фиброза, поэтому у больных ЦП С без вирусологического ответа целью противовирусного лечения является замедление прогрессирования болезни, снижение риска декомпенсации ЦП и развития его осложнений, в том числе ГЦК, В-клеточной лимфомы, криоглобулинемии, внепеченочных проявлений, портальной гипертензии и печеночно-клеточной недостаточности.
Представляют интерес исследования M. Curry и соавторов (2005), изучивших влияние длительной терапии пегинтерфероном α-2b в малых дозах на динамику портальной гипертензии у больных ХГ С со стадией фиброза F3 и ЦП С (F4). В исследование COPILOT были включены 267 больных, получавших колхицин 0,6 мг 2 раза в день, и 270 больных, которым проводится лечение пегинтроном 0,5 мкг/кг 1 раз в неделю в течение 4 лет. Обе группы были представлены больными, не ответившими на комбинированную терапию интерфероном и рибавирином. 83% больных в каждой группе имели ЦП С, у 40% из них имелись признаки портальной гипертензии, выявленные при эндоскопии (ВРВП или портальная гастропатия). ЭГДС проводилась с интервалом в 2 года. Опубликованы предварительные результаты исследования.
У 5 больных ЦП С, не получавших β-блокаторы с целью коррекции портальной гипертензии, до лечения пегинтроном провели измерение портального давления. Спустя 2 года лечения при повторной ЭГДС новые ВРВП появились у 11 из 66 больных, получавших колхицин, и сохранялись у 5 из 66 больных, получавших монотерапию пегинтроном. У всех 5 больных первоначальное портальное давление составляло 15 мм рт. ст., через 24 нед лечения составило в среднем 6 мм рт. ст. Кровотечение из ВРВП через 2 года отмечено у 11 (9%) больных, получавших колхицин, и у одного (1%) больного, получавшего пегинтрон. Асцит и печеночно-клеточная недостаточность также чаще выявлялись при лечении колхицином (20 больных), чем пегинтроном (13 больных). Таким образом, длительное лечение малыми дозами пегинтрона больных ЦП С может замедлить формирование ВРВП, снизить портальное давление, предотвратить кровотечение из ВРВП и другие осложнения портальной гипертензии у больных ЦП С, не достигших УВО на предшествующую комбинированную терапию интерфероном и рибавирином [3].
В последние годы ПВТ претерпела существенные изменения: с 2000 г. комбинированная терапия пегилированными интерферонами α-2a и 2b и рибавирином заняла ведущие позиции в лечении ХГ С и компенсированного ЦП С. Изучены прогностические факторы ответа на лечение, появились возможности коррекции ряда побочных эффектов ПВТ, что позволило достичь УВО у 56–63% больных ХГ С, включенных в лечение. Приверженность больных к лечению, адекватные дозы препаратов и длительность ПВТ позволяют повысить УВО до 72–75% [4, 5]. Наибольший эффект комбинированной терапии ХГ С отмечается у больных с генотипами 2 или 3 HCV: непродолжительный курс лечения (24 нед) при высокой приверженности к лечению пегилированными ИФН α и рибавирином позволяет достичь успеха в 84–94% случаев.
Повышению эффективности ПВТ способствуют обязательное назначение комбинированной ПВТ (ИФН α и рибавирин) первичным больным, выбор оптимальных доз препаратов и длительности лечения в зависимости от генотипа HCV и вирусной нагрузки. Кроме того, необходима коррекция факторов неблагоприятного ответа на лечение (стеатоз, холестаз, синдром перегрузки железом) и побочных эффектов ПВТ (депрессия, гемолитическая анемия при применении рибавирина, лейко- и тромбоцитопения при лечении ИФН α, дисфункция щитовидной железы). Субоптимальные дозы препаратов, используемых при проведении ПВТ, и недостаточная продолжительность лечения способствуют формированию группы резистентных к противовирусной терапии больных ХГ С, что делает необходимым проведение повторных курсов ПВТ. Так, было показано, что при 48-недельной комбинированной ПВТ УВО достигалось у 72% больных с генотипом 1b HCV и низкой вирусной нагрузкой. Последующее обострение ХГ С отмечалось у 3% пациентов. В то же время при 24-недельной ПВТ УВО отмечался только у 51% больных указанной категории, причем обострение ХГ С и возобновление виремии через 6–18 мес после окончания ПВТ наблюдались у 40% пациентов.
Несмотря на достижения последних лет, остаются категории трудных для лечения больных ХГ С, к которым относятся пациенты с генотипом 1 HCV и высокой вирусной нагрузкой и больные ЦП С.
Генотип 1 HCV и высокая вирусная нагрузка оказались независимыми прогностическими факторами слабого ответа на лечение. Причины этого до конца не ясны. Изучается значение мутаций в E2 и NS5A генах HCV (неструктурный регион NS5A определяет чувствительность к интерферону). Элиминация гепатоцитов, инфицированных генотипом 1 HCV, в процессе ПВТ происходит медленнее, чем при других генотипах. В первые 1–2 нед терапии вирусная нагрузка снижается на 1,6 log копий/мл при генотипе 1 HCV и на 2,9 log копий/мл при генотипе 2. Скорость гибели инфицированных гепатоцитов составляет 0,1 в день у больных с генотипом 1 и 0,26 в день при генотипе 2, что объясняется различиями в иммунном ответе у больных и дает основание для обсуждения необходимости более агрессивной и, возможно, более длительной ПВТ при генотипе 1 HCV [5].
Стратегия лечения больных ЦП и ХГ С, инфицированных генотипом 1 HCV и имеющих высокую вирусную нагрузку, тесно связана. УВО при лечении ИФН α в стандартном режиме больных ХГ С с генотипом 1 HCV не превышает 10% независимо от сроков лечения — 24 или 48 нед. При использовании комбинированной терапии (ИФН α/рибавирин) в течение 48 нед УВО у таких больных возрастает до 28–36%, оставаясь значительно ниже УВО при генотипах 2 и 3 HCV (64–79%). Лечение ХГ С с генотипом 1 HCV в течение 48 нед дает более высокие результаты (46–52%), чем 24 нед (29–42%). Таким образом, генотип вируса HCV определяет стратегию ПВТ ХГ С и ЦП С.
Уровень вирусной нагрузки, как и генотип вируса, не влияет на вариант и тяжесть течения ХГ C. Высокая вирусная нагрузка (более 2х10 6 копий/мл или более 800 000 МЕ/мл) может быть выявлена при хроническом гепатите низкой, умеренной, высокой степени активности, при минимальных изменениях в печени или при ЦП С. Однако уровень виремии отчетливо влияет на частоту достижения УВО: пегилированный ИФН α-2b 1,5 мкг/кг 1 раз в неделю в комбинации с рибавирином в дозе 800 мг/сут при высокой вирусной нагрузке обеспечивает УВО в 42% случаев, а при низкой — в 78%.
В последние годы разработан метод оценки успеха терапии на основании изучения вирусной кинетики на ранней стадии ПВТ. Ранний вирусологический ответ позволяет прогнозировать УВО. Высокая приверженность больных ХГ C к лечению и оценка прогноза ПВТ на основании данных раннего вирусологического ответа на 4-й или 12-й неделе позволили повысить результативность терапии в группе всех леченных больных ХГ С до 90%. Отказ от стандартных схем лечения ИФН α (3 млн МЕ 3 раза в нед) с переходом на комбинированную ПВТ также способствует повышению количества больных с ранним вирусологическим ответом.
Изучение раннего вирусологического ответа на основании количественного анализа HCV-РНК с помощью высокочувствительной ПЦР позволяет идентифицировать больных, которые не ответят на ПВТ. Если после 12-недельной ПВТ пегилированными ИФН α и рибавирином уровень HCV-РНК снизился на два и более десятичных логарифмов, но РНК вируса по-прежнему выявляется в крови, то целесообразно продолжить ПВТ еще в течение 12 нед, а затем провести повторное исследование HCV-РНК. При его отрицательном результате УВО колеблется от 42 до 78% в зависимости от вирусной нагрузки. Представляется целесообразным 72-недельный курс ПВТ, т. е. продление лечения до 1,5 лет, что позволяет значительно улучшить результаты лечения. При сохраняющейся виремии с падением ее уровня на 12-й неделе менее чем на два десятичных логарифма УВО составляет от 0 до 5%, что позволяет уже на ранних этапах либо отказаться от бесперспективной терапии при генотипе 1 HCV, либо модифицировать ее, либо перейти на поддерживающую терапию пегилированным ИФН α-2а (90 мкг) или ИФН α-2b (0,5 мкг/кг) с целью замедления прогрессирования ЦП С и профилактики развития ГЦК и лимфомы.
Таким образом, генотип 1b и высокая вирусная нагрузка определяют категорию «трудных» для лечения больных ХГ C. В отношении этой группы пациентов необходимо строго следовать правилу применения максимально эффективных доз пегилированных ИФН α-2b (1,5 мкг/кг) или ИФН α-2a (180 мкг) в сочетании с рибавирином в дозе выше 13 мг/кг при продолжительности лечения 48–52 нед. Известно, что пегилированные ИФН α-2a и 2b отличаются друг от друга по фармакокинетике и фармакодинамике. Была проведена независимая сравнительная оценка кинетики вирусологического ответа на пегилированные ИФН α-2a в дозе 180 мкг/нед и ИФН α-2b в дозе 1,5 мкг/кг/нед при их сочетании с рибавирином в дозе 15 мг/кг/сут у первичных больных ХГ C. В конце курса лечения вирусологический ответ на комбинированную терапию пегИФН α-2a/рибавирином и пегИФН α-2b/рибавирином у пациентов с генотипом 1 HCV составил 55% и 76% соответственно, что позволяет рекомендовать применение пегИФН α-2b в составе комбинированной ПВТ у данной категории больных [6]. В настоящее время ряд авторов предлагают оценивать ранний вирусологический ответ на 4-й неделе и при отсутствии вирусологического ответа модифицировать лечение. Используется индукционная терапия пегилированным ИФН α-2b в дозе 3 мкг/кг/нед в течение 4 неделе или 2 мкг/кг/нед в течение 8 нед с последующим применением препарата в дозе 1,5–1,0 мкг/кг/нед.
Тройная схема комбинированной ПВТ с включением помимо пегилированного ИФН α и рибавирина 200 мг амантадина не имеет преимуществ перед обычной схемой в лечении ХГ C генотипа 1b с высокой вирусной нагрузкой.
В 2004 г. опубликованы предварительные результаты лечения больных с генотипом 1 HCV и высокой вирусной нагрузкой, не ответивших на первый курс ПВТ ИФН α и рибавирином, комбинацией α-тимозина-1 (1,6 мг 2 раза в неделю подкожно), пегилированного ИФН α-2a (180 мкг в неделю) и рибавирина (1000–1200 мг/сут) в течение 24 недель. Ранний вирусологический ответ на 12-й неделе лечения достигнут у 47,8% больных, вирусологический ответ после 24 нед терапии сохранялся у 39,1% пациентов ХГ C, представляющих «трудную» для лечения группу. Дополнительный препарат (α-тимозин-1) не добавлял новых побочных эффектов и хорошо переносился больными.
Новые стратегии в лечении «трудных» больных с генотипом 1 HCV и высокой вирусной нагрузкой включают продление сроков комбинированной ПВТ до 72 нед у пациентов, не достигших раннего вирусологического ответа на 4-й неделе, что позволяет повысить УВО с 22% (при 48-недельной терапии) до 51% и снизить частоту обострений [7].
Обоснованием для лечения ХГ C с продвинутой стадией фиброза или сформировавшимся ЦП С стали данные о снижении риска декомпенсации ЦП и развития ГЦК, а также регрессе фиброза у 60% больных, получающих ПВТ. Наличие портального фиброза или ЦП С считается независимым фактором низкой частоты УВО у HCV-инфицированных больных. Пациенты с ЦП C обычно плохо отвечают на стандартную монотерапию ИФН α: УВО составляет от 5 до 20%. Эффективность комбинированной терапии ИФН α и рибавирином составила в этой группе 5–29%. Применение пегилированных ИФН α в составе комбинированной терапии компенсированного ЦП C или ХГ С с мостовидным фиброзом позволило повысить УВО до 44–50%.
Следует отметить, что даже при монотерапии пегилированным ИФН α можно достигнуть гистологического улучшения у 54% больных компенсированным ЦП С. В сравнительном исследовании эффективности пегилированных ИФН α-2a и 2b у больных ЦП C наличие мостовидного фиброза являлось отрицательным прогностическим фактором достижения раннего вирусологического ответа. В конце 24-недельной ПВТ вирусологический ответ в 1-й группе больных ЦП C составил 83%, во 2-й — 60%. Таким образом, пегилированный ИФН α-2a может быть препаратом выбора в комбинированной терапии ЦП C [8]. Даже при отсутствии вирусологического ответа на комбинированную ПВТ при ЦП C отмечается улучшение гистологической картины в печени (снижение ИГА и ГИС).
Наиболее значимое улучшение морфологических данных имеет место при достижении УВО, что сопровождается улучшением качества жизни больных ЦП С, несмотря на наличие продвинутой стадии болезни. Интерес представляют данные Poynard и соавторов (2000), наблюдавших 3010 больных ХГ С с повторной биопсией печени (до начала ПВТ и спустя 6–12 мес после ее окончания) при использовании различных режимов лечения: монотерапии ИФН α-2b, комбинированной ПВТ ИФН α или пегилированным ИФН α-2b и рибавирином в течение 48 нед. Более чем у трети больных, у которых был достигнут УВО, улучшилась гистологическая картина (ГИС и ИГА) в печени, морфологическая динамика отмечена также у трети больных без вирусологического ответа [9]. Анализ биопсий печени у больных ХГ С, участвовавших в четырех многоцентровых исследованиях, показал, что у 75 (49%) из 153 пациентов ЦП С после окончания терапии ГИС (уровень фиброза) снизился на 1–3 балла, что позволяет говорить о возможности регресса фиброза при ЦП С под влиянием настойчивой целенаправленной ПВТ [10].
В последние годы предпринимаются попытки противовирусного лечения декомпенсированного ЦП С (Чайлд В и С). Известно, что 40% всех ортотопических трансплантаций печени проводится в связи с ЦП С. Больные с сохраняющейся виремией имеют высокий риск реакций отторжения трансплантата и инфицирования донорской печени вирусом гепатита С с быстрым развитием (в течение 5–7 лет) ЦП С и/или ГЦК в пересаженной печени. В 2003–2004 гг. появились первые публикации использования ПВТ малыми дозами интерферона и рибавирина при декомпенсированном ЦП С у кандидатов на трансплантацию печени. Предлагается начинать лечение ИФН α 3 млн МЕ ежедневно и рибавирином 800 мг/сут за 4 мес до предполагаемой операции. Режим ежедневного введения интерферона позволяет уменьшить частоту гриппоподобного синдрома, лечение в течение 4 мес позволяет добиться максимального снижения виремии (до операции). У 9 (30%) из 30 больных декомпенсированным ЦП С (Чайлд В или С) удалось достичь вирусологического ответа на 12-й неделе, у 6 из них (20%) авиремия сохранялась после трансплантации печени [11]. Аналогичные данные о возможности развития УВО в 18–20% случаев декомпенсированного ЦП С опубликованы рядом авторов, длительность наблюдения за такими больными продолжается более 3,9 лет.
Известно, что употребление алкоголя значительно повышает смертность при вирусных ЦП: пятилетняя выживаемость больных достигает лишь 43%, значительно отличаясь в группах ЦП Чайлд А (66%), Чайлд В (50%) и Чайлд С (25%). При продолжающемся приеме алкоголя риск смерти у больных ЦП С повышается в случае наличия таких факторов, как пожилой возраст, печеночно-клеточная дисфункция (Чайлд В или С), желудочно-кишечное кровотечение, коинфекция (HBV, HCV), курение и отсутствие признаков острого алкогольного гепатита при биопсии печени. Среди механизмов влияния алкоголя на прогрессирование HCV-инфекции отмечают активацию репликации, повышение разнообразия квазивидов и мутаций вируса, усиление апоптоза гепатоцитов, подавление иммунного ответа хозяина, нарастание стеатоза и уровня железа в печени. Все это ведет к быстрому развитию болезни, высокой частоте формирования ЦП С и ГЦК и низкой эффективности интерферонотерапии. Эффективность ПВТ при ХГ С у лиц, употребляющих алкоголь, в 3 раза ниже стандартных показателей УВО: при монотерапии ИФН УВО снижается до 7–8% по сравнению с 25% у больных, не употребляющих алкоголь; при комбинированной терапии — до 12–4% по сравнению с 41%. Не существует безопасных доз алкоголя для больных ХГ С. Рекомендуется полный отказ от его приема за 6 мес до предполагаемой ПВТ, что улучшает результаты противовирусного лечения, однако УВО не достигает показателей, свойственных больным, не употреблявшим алкоголь в прошлом. Возврат к приему алкоголя после окончания ПВТ повышает риск обострения ХГ С и возврата виремии.
У больных ХГ С на стадии цирроза или при наличии мостовидного фиброза (F3) риск развития побочных эффектов интерферонотерапии выше, чем при менее продвинутых стадиях фиброза. Показано, однако, что частота их выявления и необходимость прекращения ПВТ существенно не отличаются в группах больных, леченных пегилированным ИФН α или ИФН α в стандартном режиме. Пегилированный ИФН α-2а обладает более выраженным миелосупрессивным действием, чем ИФН α-2b. Гематологическая токсичность при применении пегилированных ИФН α проявляется в первые 4 нед лечения, затем достигается устойчивый уровень лейкоцитов и тромбоцитов. Особенно быстро их число снижается после первой дозы препаратов. ПВТ назначают больным компенсированным ЦП С с уровнем лейкоцитов 3000/ммЁ и тромбоцитов 50 000/ммЁ. При снижении уровня нейтрофилов до 600/ммЁ, а уровня тромбоцитов до 20 000/ммЁ ИФН α отменяют.
Модификация дозы пегилированного ИФН α или рибавирина (снижение дозы или отмена препарата) в связи с побочными эффектами отмечена у 50% больных ЦП С. В зависимости от достижения раннего вирусологического ответа на 12-й неделе лечения предложены различные варианты лечения ЦП С: продолжение комбинированной терапии в максимально эффективных дозах в течение 36 нед при достижении раннего вирусологического ответа; лечение небольшими дозами пегилированного ИФН α-2b (0,5 мкг/кг) в течение 5 лет при отсутствии такого ответа на 4-й нед (EPIC3) или малыми дозами пегилированного ИФН α-2а (90 мкг) в течение 4 лет (HALT-С).
Определены показания к повторным курсам ПВТ: наличие генотипов 2 или 3 НСV; частичный ответ при предшествующем курсе ПВТ, F3- и F4-стадии фиброза. Противопоказаниями к повторным курсам лечения являются: пожилой возраст, генотип 1, ЦП С с гипербилирубинемией, высокая вирусная нагрузка, высокий индекс массы тела, минимальные изменения в печени при биопсии (ИГА менее 4 баллов) и продолжающееся употребление алкоголя или наркотиков.
Таким образом, ПВТ компенсированного и декомпенсированного ЦП при ХГ С решает ряд следующих задач: замедление декомпенсации цирроза, снижение смертности от его осложнений (кровотечение из варикозно расширенных вен, печеночно-клеточная недостаточность и т. д.), предотвращение развития ГЦК и профилактику реактивации инфекции после трансплантации печени, а также улучшение качества жизни больных и обеспечение их социальной реабилитации. Несомненно, что на ранних стадиях HCV-инфекции ПВТ дает лучшие результаты: частота УВО при лечении острого гепатита С достигает 90%, ХГ С — 60–70%, что превышает эффективность лечения ЦП С пегилированными ИФН α и рибавирином (30–50%). Наш опыт ПВТ ХГ С низкой степени активности позволяет говорить о высокой эффективности лечения данной категории больных. Используя пегилированный ИФН α-2b (1,5 мкг/кг) и рибаверин (более 10,6 мг/кг) при лечении первичных больных с небольшим сроком заболевания (5,9±5,7 лет), преимущественно низкой степени активности и слабым фиброзом (F1), а также низкой вирусной нагрузкой, мы получили устойчивый вирусологический ответ в 86 % случаев, в том числе у 77% пациентов с генотипом 1 HCV, включая 5 больных на стадии ЦП С [12].
- Collier J. D., Woodall T., Wight D. G. D. et al. Predictiv of progressive hepatic fibrosis stage on sabsequent liver biopsy in chronic hepatitis C virus infection. J. Viral Hepatitis, 2005; 12: 74-80.
- Niederau C., Lange S., Heintgest T. et al. Prognosis of chronic Hepatitis C: Results of a Large, Prospective Cohort Study. Hepatology, 1998; 28: 1687-1695.
- Curry M., Cardenas A., Afdhal N. H. Effect of maintenance Peg-Intron therapy on portal hypertension and its complications: results from the COPILOT study. J. Hepatol., 2005; 42 (2): 95.
- Fried M. W., Shiffman M., Reddy R. et al. Peginterferon alfa-2a plus ribavirin for chronic hepatitis C virus infection. N Engl J. Med., 2002; 347: 975-982.
- Manns M., McHutchison J., Gordon S. et al. Peginterferon alfa-2b plus ribavirin compared with interferon alfa-2b plus ribavirin for initial treatment of chronic hepatitis C: a randomized trial. Lancet, 2001; 358: 958-965.
- Luise S., Bernardinello E., Cavalletto L. et al. Kinetic of Virolological Response Duning Peg-IFNS in Chronic Hepatitis C. J. Hepatol 2004; 40 (1): A 490.
- Berg T., von Wagner M., Hinrichsen H. et al. Comparison of 48 or 72 weeks of treatment with pegiterferon alfa-2a (40 KD) (Pegasys) plus ribavirin (Copegus) in treatment-naive patients with chronic hepatitis C infected with HCV genotype 1 [Abstract]. Hepatology 2003; 38 (1): 317A.
- Hadziyannis S. J., Papatheodoridis G. V. Peginterferon-(2a (40 kDa) for chronic hepatitis C. Expert Opin. Pharmacother. 2003; 4:541-551.
- Poynard T., Marcellin P., Lee S. S. et al. Randomised trial of interferon alpha 2b plus ribavirin for 48 weeks or for 24 weeks versus interferon alpha 2b plus placebo for 48 weeks for treatment of chronic infection with hepatitis C virus. Lancet 1998; 352:1426-1432.
- Poynard T., McHutchison J., Manns M. et al. Impact of Pegylated Interferon Alpha-2b and Ribavirin on Liver Fibrosis in Patients with Chronic Hepatitis C. Gastroenterol. 2002; 122: 1303-1313.
- Forns X., Navasa M., Rodes J. Treatment of HCV Infection in Patients With Advanced Cirrhosis. Hepatology, 2004; 40: 498.
- Никулкина Е. Н., Крель П. Е., Лопаткина Т. Н. и др. Комбинированная терапия пегинтерфероном альфа-2b (пегинтроном) и рибавирином (Ребетолом) у первичных больных хроническим гепатитом C // Клиническая фармакология и терапия. — 2004. — № 13 (2). — С. 48-52.
Т. Н. Лопаткина, кандидат медицинских наук, доцент
источник