Необходимо отметить, что среди всей инфекционной патологии в России ВГ наносят наибольший экономический ущерб на 1 случай заболевания, а по суммарному экономическому ущербу уступают только гриппу и ОРЗ. Последнее десятилетие, с одной стороны, характеризовалось новейшими достижениями в молекулярной биологии, вирусологии, генной инженерии, что позволило открыть новые гепатотропные вирусы, более детально изучить патогенез, значительно усовершенствовать систему диагностики и разработать новые подходы к противовирусной терапии и специфической профилактике вирусных гепатитов. С другой стороны, в частности в России, происходило изменение этиологической структуры ВГ вследствие влияния нескольких процессов: подверженного резким колебаниям уровня заболеваемости гепатитом А, увеличения заболеваемости гепатитом В, введения методов диагностики и регистрации гепатита С, возникновения и прогрессирующего увеличения числа микст-гепатитов, 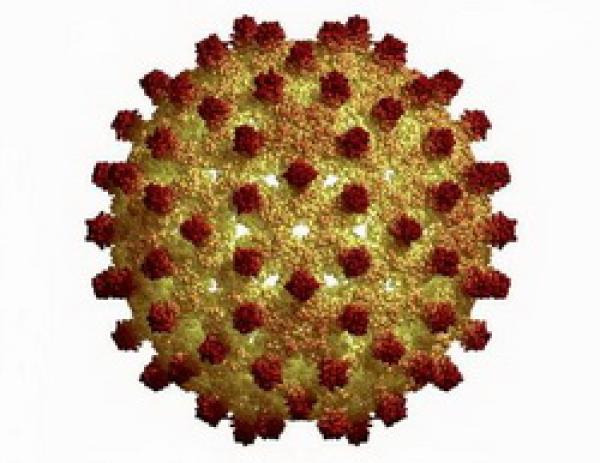
Вирусные гепатиты (ВГ) — группа инфекционных заболеваний, характеризующихся преимущественным поражением печени. В настоящее время выделяют вирусный гепатит А (ГА), вирусный гепатит В (ГВ), С (ГС), D(ГD), Е(ГЕ), возбудители которых различаются по таксономическим признакам, а заболевания — по эпидемиологическим, патогенетическим особенностям и по вероятности перехода в хронические формы. Недавно открыт ВГ гепатит G (rG), а также новые вирусы (TTV, SEN), роль которых в поражении печени еще малоизучена.
Гепатиты В, С, D и G распространяются парентеральным путем. Это предполагает более низкую активность механизмов передачи инфекции, осуществляемых при переливаниях крови или ее компонентов, при инвазивных диагностических и лечебных процедурах, при внутривенном введении наркотиков и т. п. Возможны половой, анте-, пери- или постнатальный, а также ге-моперкутанный пути заражения. Более низкая активность механизмов передачи возбудителей этой группы заболеваний компенсируется длительной вирусемией инфицированных, недостаточной манифестацией заболевания (ГС) и хронизацией патоло гического процесса, что в конечном итоге ведет к увеличению численности популяции «вирусоносителей».
Гепатотропность возбудителей ВГ объясняет сходность клинических проявлений, общность методов диагностики и патогенетической терапии, а также систем реабилитации и диспансерного наблюдения реконвалесцентов. Для всех ВГ характерны общие патогенетические процессы в печени в виде цитолитиче-ского, холестагического и иммуновоспалительного синдромов.
Цитолиз гепатоцитов различной степени выраженности закономерно развивается при ВГ разной этиологии. Он может быть обусловлен прямым цитопатическим либо иммуноопосре-дованным (ГВ) действием вирусов. В основе цитолиза лежит нарушение внутриклеточных метаболических процессов, активация прооксидантных и угнетение антиоксидантных систем клеток. В результате на мембранах гепатоцитов происходит накопление свободных радикалов, усиливается перекисное окисление липидов, что приводит к повышению их проницаемости, выходу из гепатоцитов внутриклеточных ферментов (аминотрансфераз и др.), ионов калия. Последние заменяются натрием и кальцием, что ведет к задержке жидкости и набуханию клеток, изменению их pH, нарушению окислительного фосфорилирова-ния со снижением биоэнергетического потенциала гепатоцитов. В результате нарушаются их весьма разнообразные функции, в том числе детоксицирующая, синтетическая, ухудшаются утилизация глюкозы, эстерификация холестерина, процессы переами-нирования и дезаминирования аминокислот.
Наиболее ранним проявлением цитолитического синдрома является повышение активности в сыворотке крови таких внутриклеточных ферментов, как аланинаминотрансфераза (АлАТ), аспартатаминотрансфераза (АсАТ), холинэстераза, сорбитде-гидрогеназа, аргиназа и др. Повышенный уровень сывороточного железа также рассматривается как маркер цитолиза при заболеваниях печени.
Клинически значимым отражением нарушения пигментного обмена, детоксицирующей и секреторной функции печени является гипербилирубинемия, обусловленная снижением процессов захвата свободного билирубина гепатоцитами, его глюкурониди-рования и экскреции в желчные пути.
Угнетение синтетической функции печеночных клеток приводит к гипоальбуминемии, уменьшению практически всех факторов свертывания крови, особенно протромбина, ингибиторов коагуляции и фибринолиза. При критическом падении коагуляционного потенциала появляются кровоизлияния, а в тяжелых случаях — массивные кровотечения (геморрагический синдром).
В случаях тяжелого цитолитического синдрома процесс дезинтеграции мембран распространяется на внутриклеточные органеллы. В результате нарушения целостности лизосом-ных мембран происходит массивный выход протеолитических ферментов — гидролаз, что ведет к саморазрушению клеток, которое может приобрести характер своеобразной цепной реакции с развитием острой печеночной недостаточности.
Холестаз отражает нарушение оттока желчи, как правило, в результате снижения секреторной функции печеночных клеток (гепатоцеллюлярный холестаз) и причем в сочетании с цитолизом. В крови накапливаются не только различные фракции билирубина, но и желчные кислоты, холестерин, экскреторные ферменты (щелочная фосфатаза, гамма-глутамилтранспептидаза — ГГТП и др.) и некоторые микроэлементы, в частности, медь.
Синдром общей инфекционной интоксикации не всегда соответствует уровню гипербилирубинемии. В начальном (преджелтуш-ном) периоде он может быть отражением фазы вирусемии и проявляться лихорадкой, недомоганием и другими свойственными ему общими симптомами. В периоде разгара существенное значение имеет цитолитический синдром с нарушением детоксицирующей функции гелатоцитов (анорексия, тошнота, рвота, слабость, вялость и т. п.). С его углублением и развитием острой печеночной недостаточности интоксикация приобретает черты специфических нарушений функций центральной нервной системы, проявляющихся в так называемой инфекционно-токсической или печеночной энцефалопатии.
Общность патофизиологических процессов позволяет классифицировать ВГ (табл. 1) по клинической форме, степени тяжести и характеру течения. В последние годы нередко диагностируются микст-гепатиты (чаще гепатиты В+С), что обусловлено общими механизмами инфицирования. По клиническим проявлениям гепатиты могут быть манифестными (желтушные, безжелтушные) и латентными, или бессимптомными (субклинические, инаппарантные).
источник
Тяжелые вирусные поражения печени проявляются практически одинаково, имеют сходную симптоматику, поэтому установить точный диагноз можно исключительно после результатов лабораторных анализов, исследования крови. При этом заболевания по-разному влияют на организм и, соответственно, имеют индивидуальные рекомендации к лечению, поэтому важно уметь различать гепатиты – классификация болезней сначала включала всего три вида, но в последнее время стало известно, что их намного больше.
Прежде чем начинать лечение и диагностику, нужно знать, какие бывают гепатиты – все виды недугов протекают с характерными клиническими симптомами и похожи между собой.
Существуют такие типы описываемой патологии:
- вирусный или инфекционный гепатит;
- токсический гепатит;
- лучевой гепатит.
В свою очередь, первая форма заболевания имеет собственные подтипы. Встречаются даже множественные вирусные гепатиты – классификация включает семь разновидностей болезни: А, В, С, D, E, F и G. Более того, они могут развиться на фоне:
- лептоспироза;
- вируса Эпштейна-Барра;
- сифилиса;
- краснухи;
- цитомегаловирусной инфекции;
- герпеса;
- СПИДа;
- эпидемического паротита;
- лихорадки Ласа.
Токсические гепатиты, как правило, возникают вследствие отравления алкоголем, наркотиками и лекарственными препаратами. Также причиной интоксикации могут стать любые ядовитые химические соединения.
Лучевой тип заболевания представляет собой симптом лучевой болезни и довольно трудно поддается терапии.
Виды вирусных гепатитов включают и редкую форму, которая развивается из-за тяжелых аутоиммунных патологий. Обычно улучшение состояния защитной системы организма позволяет снизить последствия поражения печени.
Как таковой, отдельной классификации хронических видов рассматриваемого заболевания не существует. Причина в том, что любой из указанных выше типов гепатита может приобрести вялотекущий характер, кроме болезни Боткина (острая вирусная форма А).
Хронизация процесса происходит вследствие нарушений терапевтического распорядка, несоблюдения лечебных мероприятий, специальной диеты. Кроме того, вирус гепатита С очень тяжело выводится из организма и, как правило, его редко удается устранить полностью. При малейших перегрузках печени наступает рецидив и обострение воспалительных процессов. К сожалению, нередко гепатит становится причиной отмирания паренхимы органа и замены клеток соединительной тканью (цирроза).
Хронические вирусные заболевания делятся на следующие разновидности:
- С минимальной степенью активности. Симптоматика слабо выражена, самочувствие больного удовлетворительное.
- С низкой степенью активности. Признаки также почти незаметны, но концентрация белков в крови гораздо выше.
- С умеренной степенью активности. Явные клинические проявления и симптомы, высокий уровень билирубина в плазме крови, поражения почек, увеличение размеров печени.
- С высокой степенью активности. Тяжелые поражения организма, внутренних органов, иммунной системы.
- С холестазом. Самочувствие без изменений, никаких симптомов и признаков. При этом отмечается резкое ухудшение биохимических показателей крови, быстро развивается цирроз.
Последний тип хронического вирусного гепатита встречается очень редко, но является самым опасным. Заболевание почти невозможно диагностировать вовремя, поэтому оно становится причиной разложения печени, острых приступов, приводящих к впадению в кому и летальному исходу.
источник
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
В 1968 г. De Groot и соавт. в журнале Lancet опубликовали классификацию хронического гепатита, которая была одобрена Европейской ассоциацией по изучению печени. В основе классификации лежит выделение морфологических вариантов хронического гепатита. Авторы предложили выделять следующие морфологические варианты хронического гепатита.
- Хронический персистирующий гепатит — характеризуется выраженной инфильтрацией лимфоидными клетками портальных полей (портальный гепатит). Эти инфильтраты не проникают в печеночную дольку, не вызывают нарушений целостности пограничной пластинки (слоя гепатоцитов, отделяющего портальное поле от печеночной дольки). В гепатоцитах могут наблюдаться дистрофические изменения. Возможна пролиферация купферовских клеток, развитие портального фиброза.
- Хронический агрессивный гепатит (в дальнейшем термин агрессивный был заменен на активный гепатит из деонтологических соображений).
При этом варианте хронического гепатита воспалительный инфильтрат захватывает портальные тракты и далее, разрушая пограничную пластинку, вторгается в печеночную дольку, отмечается воспалительная реакция от умеренной до резко выраженной. В зависимости от этого в последующем стали выделять хронический гепатит с умеренной и выраженной активностью.
При хроническом гепатите с умеренной активностью характерны ступенчатые мелкоочаговые некрозы гепатоцитов в паренхиме, примыкающей к портальным полям. Как правило, воспалительные инфильтраты и ступенчатые некрозы проникают не далее середины долек.
При хроническом гепатите с выраженной активностью развиваются мультилобулярные, мостоввдные портоцентральные (соединяющие портальные поля с центральной зоной гепатоцита) и порто-портальные (соединяющие соседние портальные поля) некрозы. Создаются все предпосылки для нарушения архитектоники долек печени и развития в дальнейшем цирроза печени.
В последующем многими авторами была выделена так называемая некротизирующая форма хронического гепатита.
В 1971 г. Popper и всЬаЯпегдоказали существование лобулярной формы хронического гепатита. Она характеризуется мелкими некрозами во второй или третьей зонах ацинусов и внутридольковой лимфовдно-клеточной инфильтрацией, которая выражена значительно больше, чем инфильтрация портальных трактов (выраженное преобладание внутридольковых поражений над портальными и перипортальными).
В 1974 г в г. Акапулько (Мексика) была принята международная классификация хронических заболеваний печени. В этой классификации сохранен тот же морфологический принцип разделения хронического гепатита на персистирующий и активный. Однако утверждалось, что этиология хронического гепатита — это перенесенный острый вирусный гепатит В или А, другие этиологические факторы считались недоказанными.
В 1994 г. Всемирным конгрессом гастроэнтерологов в Лос-Анджелесе были приняты рекомендации Международной рабочей группы по новой номенклатуре и терминологии хронических гепатитов и циррозов печени. Рекомендуется включать этиологическую составляющую в диагноз хронического гепатита и цирроза печени во всех возможных случаях.
Номенклатура и определение хронических гепатитов
(Всемирный конгресс гастроэнтерологов, Лос-Анджелес, 1994)
- Хронический гепатит В — воспалительное заболевание печени, вызываемое вирусом гепатита В (HBV), длящееся 6 месяцев или более и способное привести к циррозу или быть ассоциированным с циррозом.
Выражение быть ассоциированным с циррозом наиболее вероятно означает следующие возможности:
- хронический гепатит В присоединяется к уже имеющемуся циррозу другой этиологии;
- хронический гепатит В протекает параллельно с циррозом одноименной природы и определяет степень активности процесса.
- Хронический гепатит D — воспалительное заболевание печени, вызываемое вирусом гепатита D (HDV) в сочетании с HBV-инфекцией, длящееся 6 месяцев или более и способное привести к циррозу или быть ассоциированным с циррозом.
- Хронический гепатит С — воспалительное заболевание печени, вызываемое вирусом гепатита С, длящееся 6 месяцев и более и способное привести к циррозу или быть ассоциированным с циррозом.
- Хронический вирусный гепатит, не характеризуемый иным образом — воспалительное заболевание печени, длящееся 6 месяцев и более и вызываемое неидентифицированным или неизвестным вирусом.
- Аутоиммунный гепатит — неразрешающийся, преимущественно перипортальный гепатит (обычно с гипергамма-глобулинемией и тканевыми аутоантителами), который в большинстве случаев поддается иммуно-супрессивной терапии.
- Хронический гепатит, не классифицируемый как вирусный или как аутоиммунный — воспалительное заболевание печени, длящееся 6 месяцев или более, которое имеет черты вирусного и/или аутоиммунного гепатита, но при этом невозможно ясно установить вирусный или аутоиммунный этиологический фактор.
- Хронический лекарственный гепатит — воспалительное заболевание печени, длящееся 6 месяцев и более, обусловленное побочным действием лекарственного препарата. В основе побочного действия лекарственного препарата могут лежать:
- прямое токсическое действие препарата или его метаболитов;
- реакция идиосинкразии к препарату или его метаболиту.
- Болезнь недостаточности a2-антитрипсина печени — хроническое заболевание печени, сопряженное с или вызываемое аутосомно-рецессивным расстройством белкового метаболизма, протекающее в типичных случаях с ненормально низкими значениями сывороточного а-антитрипсина (ингибитора сывороточной а-протеазы). Болезнь печени может приводить к хроническому гепатиту или циррозу печени или быть ассоциированной с этими осложнениями.
- Первичный биллиарный цирроз.
- Первичный склврозирующийхолангит.
- Заболевание печени Вильсона-Коновалова.
Термины, которые устарели и которые не целесообразно употреблять — это:
- хронический персистирующий гепатит;
- хронический активный гепатит;
- хронический негнойный деструктивный холангит;
- перихолангит;
- портальный цирроз печени;
- постнекротический цирроз печени;
- постгепатитный цирроз печени;
- лаэннековский цирроз печени;
- нугритивный цирроз.
Рекомендации не употреблять термины хронический персистирующий гепатит, хронический активный гепатит и хронический лобулярный гепатит объясняются тем, что эти категории по существу представляют систему оценки степени активности воспалительного процесса в печени. Морфологические варианты хронического гепатита коррелируют с его степенью активности.
Desmet, Gerber, Hoofiiagle.Manus, Schneuerв 1995 г. предложили классификацию хронического гепатита, которая, по их мнению, позволяет реализовать всю имеющуюся клиническую, этиологическую и гистологическую информацию. В классификации выделены три основных раздела: этиология, степень активности и стадия заболевания.
Авторы выделяют следующие этиологические формы хронического гепатита: хронический гепатит В, хронический гепатит С, хронический гепатит D, аутоиммунный гепатит (типы 1-й, 2-й, 3-й), лекарственно-индуцированный хронический гепатит, хронический гепатит неустановленной этиологии (криптогенный гепатит).
Степень активности хронического гепатита определяется тяжестью, выраженностью и глубиной некротического и воспалительного процессов.
Для определения степени активности хронического гепатита авторы предлагают использовать гистологический индекс Knodell (HAI-индекс).
источник
(академик Н.И.Нисевич, академик В.Ф.Учайкин)
| Этиология | Тип | Форма тяжести | Течение |
| Вирусный гепатит А Вирусный гепатит Е Вирусный гепатит В Вирусный гепатит D (Дельта-инфекция) Вирусный гепатит С Вирусный гепатит G (GBV-A,GBV-B,GBV-C) Вирусный гепатит TTV (transfusen transmissen virus) Вирусный гепатит неуточненной этиологии | Типичный Атипичный: — безжелтушный; — стертый; — субклинический | Легкая Среднетяжелая Тяжелая Фульминантная (злокачественная) | Острое (до 3 мес.) Затяжное (до 6 мес.) Хроническое (более 6 мес.) |
ЭНТЕРАЛЬНЫЕ ВИРУСНЫЕ ГЕПАТИТЫ У ДЕТЕЙ.
КЛАССИФИКАЦИЯ.
Международная классификация болезней (М.К.Б. – Х.)
В. 15.0 Гепатит А с печеночной комой
В. 15.9 Гепатит А без печеночной комы
В. 17 Другие острые вирусные гепатиты
В. 17.8 Другие уточненные острые вирусные гепатиты
В. 19 Вирусный гепатит неуточненный
В. 19.0 Неуточненный вирусный гепатит с печеночной комой
В. 19.9 Неуточненный вирусный гепатит без печеночной комы
ВИРУСНЫЙ ГЕПАТИТ А.
Вирусный гепатит А (ВГА) – острое инфекционное заболевание, вызываемое РНК-содержащим вирусом, относящимся к семейству пикорнавирусов рода энтеровирусов с фекально-оральным механизмом заражения, характеризующееся острым началом, кратковременными симптомами интоксикации, быстро преходящими нарушениями печеночных функций, циклическим течением и, как правило, доброкачественным течением.
Возбудитель – вирус гепатита А (Hepatitis A virus, НАV)– энтеровирус тип 72, относится к роду Enterovirus, семейству Picornaviridae, имеет диаметр около 28 нм (от 28 до 30 нм).
Рис. Вирус гепатита А при электронной микроскопии.
РНК вируса гепатита А упакована в безоболочечный икосаэдральный нуклеокапсид, сформированный структурными белками VP1, VP2, VP3, VP4.
Рис. Строение вируса гепатита А.
Геном ВГА представлен однонитчатой РНК позитивной полярности, протяженностью около 7500 нуклеотидов, имеющей одну открытую рамку считывания, кодирующую структурные и нечтруктурные белки.
Рис.Строение генома вируса гепатита А.
Установлено наличие, по крайней мере, 7 различных генотипов вируса гепатита А (I-VII), при этом у человека встречаются генотипы I, II, III и VII.
НАV выявляется в сыворотке крови, желчи, фекалиях и цитоплазме гепатоцитов у зараженных лиц в конце инкубации, продромальном и начальной фазе периода разгара болезни и крайне редко в более поздние сроки. НАV устойчив во внешней среде: при комнатной температуре может сохраняться в течение нескольких недель или месяцев, а при 4°С – несколько месяцев или лет. НАV инактивируется при кипячении в течение 5 мин, чувствителен к формалину и ультрафиолетовому облучению, относительно устойчив к хлору.
Эпидемиология.
Источником инфекции чаще всего являются больные с бессимптомной (субклинический и инаппарантный варианты) формой, безжелтушным и стертым течением инфекции или больные, находящиеся в инкубационном, продромальном периодах и начальной фазе периода разгара болезни, в фекалиях которых обнаруживаются HAV.
Ведущий механизм заражения ВГА – фекально–оральный, реализуемый водным, пищевым и контактно–бытовым путями передачи.
Восприимчивость к ВГА всеобщая. Наиболее часто заболевание регистрируют у детей старше 1 года (особенно в возрасте 3-12 лет и в организованных коллективах) и у молодых лиц (20-29 лет). Дети до 1 года маловосприимчивы к заражению ввиду сохранения у них пассивного иммунитета, переданного от матери. У людей в возрасте старше 30-35 лет вырабатывается активный иммунитет, подтверждаемый обнаружением антител к вирусу (Anti–HAV IgG) в сыворотке крови 60-97% доноров.
Рис. Распространенность гепатита А.
ВГА свойственно сезонное повышение заболеваемости в летне-осенний период. Наряду с сезонным отмечается и циклическое повышение заболеваемости ВГА через 3-5, 7-20 лет, что связано с изменением иммунной структуры популяции хозяев вируса.
ВГА – острая циклическая инфекция, характеризующаяся четкой сменой периодов.После заражения НАV из кишечника проникает в кровь и далее в печень, где после фиксации к рецепторам гепатоцитов проникает внутриклеточно. На стадии первичной репликации отчетливых повреждений гепатоцитов не обнаруживается. Новые поколения вирусов выделяются в желчные канальцы и далее поступают в кишечник и выделяются с фекалиями во внешнюю среду. Часть вирусной массы проникает в кровь, обусловливая развитие интоксикационной симптоматики продромального периода. Повреждения гепатоцитов, возникающие в ходе дальнейшего течения ВГА, обусловлены не репликацией вируса, а иммуноопосредованным цитолизом. В периоде разгара ВГА морфологическое исследование позволяет выявить воспалительные и некробиотические процессы, происходящие преимущественно в перипортальной зоне печеночных долек и портальных трактах. Эти процессы лежат в основе развития основных клинико-биохимических синдромов: нарушения пигментного обмена (обмена билирубина), цитолитического, мезенхимально-воспалительного и холестатического.
При вирусных гепатитах нарушения в пигментном обмене развиваются, прежде всего, на этапе экскреции гепатоцитом конъюгированного (связанного) билирубина. Главной причиной нарушения экскреции билирубина следует считать поражение ферментных систем и снижение энергетического потенциала гепатоцитов. Образующийся в гепатоцитах конъюгированный билирубин в конечном итоге поступает не в желчный капилляр, а непосредственно в кровь.
К лабораторным признакам цитолитическского синдрома относят повышение активности ферментов АлАТ и АсАТ (аланинамино- и аспартатаминотрансферазы), уровня железа в сыворотке крови, снижение синтеза альбумина, протромбина и других факторов свертывания крови, эфиров холестерина. Начальным этапом цитолитического синдрома является повышение проницаемости мембраны гепатоцитов. Это обусловливает выход в кровь прежде всего АлАТ – фермента, находящегося в цитоплазме печеночной клетки. Повышение активности АлАТ – ранний и надежный индикатор повреждения гепатоцита. Однако следует подчеркнуть, что цитолитический синдром развивается в ответ на любое повреждающее воздействие (токсины вирусов, микробов, гипоксия, медикаменты, яды и пр.), поэтому повышение активности АлАТ характерно не только для вирусных гепатитов.
Мезенхимально–воспалительный синдром характеризуется повышением уровня α и γ-глобулинов всех классов, изменением коллоидных проб (снижение сулемового титра и повышение показателя тимоловой пробы). Холестатический синдром проявляется повышением в крови уровня связанного билирубина, желчных кислот, холестерина, меди, активности щелочной фосфатазы, а также билирубинурией, уменьшением (исчезновением) уробилиновых тел в моче.
Благодаря действию комплексных иммунных механизмов (усиление интерферонопродукции, активизация естественных киллеров, антителопродукция и активность антителозависимых киллеров) репликация вируса прекращается, и происходит его элиминация из организма человека. Для ВГА не характерны ни длительное присутствие вируса в организме, ни развитие хронической формы болезни. Однако иногда течение заболевания может быть модифицировано в случаях коинфекции или суперинфекции другими гепатотропными вирусами. У лиц с генетической предрасположенностью возможно развитие хронического активного аутоиммунного гепатита 1-го типа.
Различают следующие формы ВГА:
– по степени выраженности клинических проявлений: бессимптомная (субклиническая и инаппарантная), манифестная (желтушная), безжелтушная, стертая;
– по длительности течения: острая, затяжная;
– по степени тяжести течения: легкая, средней тяжести, тяжелая;
– осложнения: рецидивы, обострения, поражения желчевыводящих путей;
– исходы: выздоровление без остаточных явлений, с остаточными явлениями – постгепатитный синдром, затяжная реконвалесценция, поражение желчных путей (дискинезия, холецистит).
В манифестных случаях болезни выделяют: инкубационный, преджелтушный (продромальный), желтушный периоды и период реконвалесценции.
Клиника.Инкубационный период ВГА составляет в среднем 35 дней (от 7 до 50 дней). Продромальный (преджелтушный) период, продолжительностью в среднем 5–7 дней, характеризуется острым началом с повышения температуры тела до 38-40°С в течение 1-3 дней, головной болью, снижением аппетита, тошнотой и чувством дискомфорта в эпигастральной области. Спустя 2-4 дня отмечается изменение окраски мочи, приобретающей цвет темного пива или крепкого чая. В этот период увеличивается печень, пальпация которой становится весьма чувствительной, и иногда (у 10-20 % больных) – селезенка. При биохимическом исследовании выявляют повышение активности АлАТ.
Период разгара продолжается в среднем 2-3 недели. Как правило, возникновение желтухи сопровождается ахолией кала, снижением температуры тела до нормального или субфебрильного уровня, уменьшением головной боли и других общетоксических проявлений, что служит важным дифференциально-диагностическим признаком ВГА. В первую очередь приобретают желтушное окрашивание слизистая оболочка полости рта (уздечка языка, твердое небо) и склеры, в дальнейшем — кожа; при этом, как правило, степень желтушности соответствует тяжести болезни. При обследовании больных в этот период, наряду с желтухой, отмечаются астенизация, тенденция к брадикардии и гипотензии, глухость сердечных тонов, обложенностъ языка, увеличение печени, край которой закруглен и болезнен при пальпации. В 20% случаев имеет место небольшое увеличение селезенки. Фаза угасания желтухи протекает обычно медленнее, чем фаза нарастания, и характеризуется постепенным исчезновением признаков болезни.
Рис. Клинические проявления вирусного гепатита, типичного.
Период реконвалесценции, продолжительность которого весьма вариабельна: от 1-2 до 6-12 мес. В это время у больных нормализуется аппетит, ликвидируются астеновегетативные нарушения, восстанавливаются размеры печени, селезенки и функциональные печеночные тесты. У 5-10% больных наблюдается затяжное течение болезни, продолжительностью до нескольких месяцев, характеризующееся монотонной динамикой клинико-лабораторных показателей. Затяжное течение у подавляющего большинства больных заканчивается выздоровлением.
В период угасания симптомов у отдельных пациентов наступают обострения болезни, проявляющиеся ухудшением клинических и лабораторных показателей. Рецидивы возникают в период реконвалесценции через 1-3 мес. после клинического выздоровления и нормализации функциональных тестов, характеризуются повторными клинико-биохимическими изменениями. Больные с затяжным течением ВГА, обострениями и рецидивами болезни нуждаются в тщательном обследовании для исключения возможной сочетанной инфекции (ВГВ и др.) и связанной с ней хронизацией процесса.
Исход ВГА. Обычно благоприятный. Полное выздоровление наблюдается у 90% больных, у остальных отмечаются остаточные явления в виде гепатофиброза, астеновегетативного (постгепатитного) синдрома, поражения билиарной системы при неизмененных функциональных печеночных тестах. После перенесенного ВГА иногда наблюдается синдром Жильбера, характеризующийся повышением в сыворотке крови уровня свободного билирубина при отсутствии изменений в других биохимических тестах.
ВИРУСНЫЙ ГЕПАТИТ Е.
Синонимы: вирусный гепатит ни А ни В с фекально-оральным механизмом передачи.
Вирусный гепатит Е (ВГЕ) – антропонозное вирусное заболевание с фекально-оральным механизмом заражения, склонное к эпидемическому распространению, протекающее преимущественно в доброкачественных циклических формах, но с большой частотой неблагоприятных исходов у беременных.
Возбудитель – вирус гепатита Е (Hepatitis Е virus, НЕV), относится к семейству Hepeviridae, роду Hepevirus. Частицы вируса представляют собой округлые образования диаметром около 32 нм (от 27 до 34 нм) без наружной оболочки.
Рис. Вирус гепатита Е при электронной микроскопии.
Геном ВГЕ представлен однонитчатой РНК позитивной полярности, протяженностью около 7500 нуклеотидов. Вирус гепатита Е генетически неоднороден: по мнению разных авторов, существует от 4 до 8 генотипов ВГЕ.
Эпидемиологические данные указывают на значительно меньшую вирулентность возбудителя по сравнению с НАV, что объясняет необходимость больших доз НЕV для заражения.
Эпидемиология.
Резервуаром и источником возбудителя инфекции является больной человек, выделяющий вирусы с фекалиями преимущественно в ранние сроки заболевания. Механизм заражения фекально–оральный. Основное значение имеет водный путь передачи инфекции, что определяет в основном эпидемическое распространение инфекции. Значительно реже, чем при ВГА, наблюдается спорадическая заболеваемость, обусловленная алиментарным и контактно-бытовым путями передачи возбудителя.
Восприимчивость к НЕV всеобщая. Преимущественно поражаются взрослые, особенно в возрасте 15-29 лет, представляющие наиболее активную часть трудоспособного населения. НЕV наиболее опасен в плане прогноза летального исхода для беременных женщин.
Для ВГЕ эндемичны районы с жарким климатом и крайне плохим водоснабжением населения. Заболевание широко распространено в Азии и Африке. Известны эндемичные районы в Туркмении, Узбекистане, Кыргызстане, Таджикистане.
Заболевание может протекать в виде исключительно мощных водных эпидемий, охватывающих в течение сравнительно короткого периода времени многие десятки тысяч людей (взрывной характер эпидемии). Первое предположение о существовании вирусного гепатита с фекально-оральным механизмом передачи, этиологически отличающегося от ВГА, возникло при ретроспективном расследовании крупной водной вспышки гепатита в Индии в 1955-1956гг. Вспышка охватила 35 тыс. жителей. Отличительной особенностью вспышек ВГЕ является избирательная и высокая летальность среди беременных во второй половине беременности.
После перенесенного заболевания, по-видимому, формируется напряженный типоспецифический иммунитет.
источник
Согласно международной классификации гепатиты классифицируются:
По этиологии и патогенезу:
Вирусные гепатиты с пероральным — HAV, HEV и парентеральным — HBV, HCV, HDV путем заражения. Роль других гепатотропных вирусов — HGV, SEN, TTV в развитии ХГ изучается
Лекарственные (смотри выше)
Криптогенные (неустановленной этиологии)
По морфологической картине: выделяют последовательные стадии
1 – слабовыраженный перипортальный фиброз
2 – умеренный фиброз с портопортальными септами
3 — выраженный фиброз с портоцентральными сетами
По степени активности воспалительного процесса:
Минимальная (персистирующий гепатит)
Выраженная (активный гепатит)
По фазам (при вирусном гепатите)
Хронический вирусный гепатит В, выраженная активность, фаза репликации, с умеренно выраженным фиброзом.
Основой морфологической картины хронического гепатита является воспалительная инфильтрация паренхимы различной степени выраженности.
При слабовыраженной активности процесса (хронический персистирующий гепатит) наблюдается инфильтрация одноядерными клетками в области воротной вены и портальных трактов, белковая дистрофия гепатоцитов, реже некроз.
Высокая активность гепатита (хронический активный гепатит) сопровождается выраженной воспалительной инфильтрацией портальных трактов и печеночных долек , более выраженными дистрофией и некрозом гепатоцитов, возможен умеренный склероз портальных и перипортальных полей, обнаруживаются тельца Куссмауля. Воспалительные инфильтраты в портальных трактах и ацинусах представлены лимфоцитами, плазматическими и антиген содержащими клетками.
На морфологической стадии, соответствующей хроническому гепатиту, несмотря на наличие умеренного фиброза, архитектоника печени не нарушена.
Клинические проявления гепатита обусловлены степенью выраженности активности воспалительного процесса, в случае вирусного гепатита фазой заболевания (репликация, интеграция). При минимальной активности – течение может быть латентным, гепатит может быть выявлен при случайном обследовании больного. Напротив, при выраженной активности воспаления, клиника заболевания может быть представлена рядом синдромов с большей или меньшей специфичностью.
К неспецифическим синдромам относятся:
Астеновегетативный – характеризуется слабостью, повышенной утомляемостью;
Мезенхимально-воспалительный – субфебрильная температура, лимфаденит, воспалительные сдвиги в общем и биохимическом анализе крови (лейкоцитоз, ускорение СОЭ; рост СРБ, серомукоидов);
Болевой – редко, может быть обусловлен гепатомегалией;
Диспепсический – как правило, связан с сопутствующей патологией желудка и желчевыводящих путей;
Более специфичным считается холестатический синдром, связанный с внутрипеченочным холестазом. Характеризуется иктеричностью кожи и слизистых, гипербилирубинемией, повышением в крови уровня щелочной фосфатазы, ГГТП.
Важнейшим специфичным синдромом гепатита является цитолитический, характеризующийся потерей веса, повышенным уровнем ферментов АЛТ, АСТ в крови (более чем в 2 раза). Появление у больного признаков цитолиза гепатоцитов является ведущим показателем активности гепатита, а в случае вирусной этиологии маркером репликации.
В большинстве случаев гепатит протекает малосимптомно или латентно (70%).
Диагностика хронического гепатита
Диагноз ХГ достаточно сложен, несмотря на наличие современных и достаточно специфичных методов обследования и состоит из нескольких этапов.
Первым этапом является анализ вышеприведенных симптомов и синдромов, тщательный сбор анамнеза. Необходимо собрать сведения о перенесенном ранее остром гепатите, приеме лекарственных препаратов, инъекциях, оперативных вмешательствах, переливаниях крови и кровезаменителей, применении наркотических средств, социальном статусе больного и т.д.
При объективном осмотре обратить внимание на цвет кожных покровов и слизистых, характер питания, наличие следов внутривенных инъекций, при пальпации печени определить её размеры (гепатомегалия), характер края (гладкий), при тяжелом течении гепатита могут выявляться телеангиоэктазии и пальмарная эритема (более характерно для цирроза печени).
На этом же этапе диагностики необходимо провести биохимическое исследование крови с определением её На белкового состава, АЛТ, АСТ, билирубиновых фракций, ЩФ, ГГТП и др. Ультразвуковое и другие дополнительные методы исследования — сканирование, компьютерная томография, лапароскопия, ФГДС позволяют подтвердить наличие воспалительных изменений в паренхиме печени и провести дифференциальный диагноз.
Вторым и наиболее важным этапом верификации диагноза является обследование больного на маркеры вирусных гепатитов. Ими считаются специфичные для каждого гепатотропного вируса антигены, антитела, вирусные ДНК (РНК), обнаруживаемые в крови (или других биологических жидкостях, гепатоцитах при биопсии). Для этого используются современные иммунологические и молекулярно-биологические методы: ИФА, в случае определения антигенов и антител, ПЦР при выявлении фрагментов ДНК, РНК вирусов.
Например, при гепатите В маркерами являются HBs Ag; anti- HBcor IgG, Ig M; HbeAg; anti HbeIgG, IgM; DNA, DNA-p HBV.
Третьим этапом диагностики, в случае подтверждения вирусного гепатита является определение его активности. Так, маркерами активности HBV являются anti- HBcor Ig M; HbeAg; anti Hbe IgM; DNA; DNA-p HBV (при репликативной фазе гепатита В).
При отсутствии маркеров вирусных гепатитов в результате проведенного иммунологического исследования, необходимо провести исследования, подтверждающие другие виды ХГ. Для аутоиммунного гепатита – выявление аутоиммунных противопеченочных и других антител в сыворотке.
Клинические особенности различных видов ХГ
Исходя из патогенеза (наличие фаз репликации, интеграции), — может протекать с различной степенью активности, характеризуясь в период обострения цитолитическим, общевоспалительным и другими синдромами. Часто протекает малосимптомно, у большинства больных – безжелтушные формы заболевания.
При ХГВ чаще всего выявляется четкий эпидемиологический анамнез – перенесенный ранее острый гепатит, переливание крови и её заменителей, парентеральные вмешательства, наркомания и др.
Основным методом диагностики ХГВ является лабораторный (см маркеры ХГ).
Гистологически при вирусном гепатите В часто выявляются ступенчатые некрозы в перипортальных зонах, внутридольковая и портальная лимфоцитарная инфильтрация.
Этот вид гепатита дает частый исход в макронодулярный или смешанный цирроз печени, особенно при сочетанном поражении печени вирусом и алкоголем.
Характерными особенностями вирусного гепатита С являются:
Частая заболеваемость в группах риска (наркоманы, гомосексуалисты и т.д.).
Известна малосимптомность заболевания, чаще проявляющегося только астеновегетативным синдромом или выявление ХГС при случайном обследовании. Для подтверждения диагноза обязательно выявление серологических маркеров, которыми являются — антитела к HCV, фрагменты РНК HCV (в активный период гепатита).
У 40- 50 % больных могут быть внепеченочные проявления — артралгии, миалгии, аутоимммунный тиреоидит др.). Для данной формы вирусного гепатита характерны длительные периоды клинико-лабораторных ремиссий, но при этом относительно благоприятном течении наблюдается частый исход в микронодуллярный цирроз печени.
Хронический гепатит D отличается возможностью формирования только при дополнительном инфицировании HBV (ко- или супер- инфекция), более тяжелым течением, наличием ярких клинических проявлений заболевания. При HDV часто выраженный цитолитический синдром, гепатомегалия, спленомегалия, может быть геморрагический синдром.
При лабораторном исследовании крови может быть сочетание маркеров HDV и HBV, часто с нивелированием показателей последнего.
Этот вирусный гепатит характеризуется быстропрогрессирующим течением с развитием цирроза печени или гепатоцеллюлярной карциномы.
Этот вид гепатита встречается достаточно редко. Более высокая заболеваемость зарегистрирована в странах Северной Европы. ХАГ чаще болеют женщины молодого возраста.
Этиология неизвестна, хотя обсуждается возможная роль неизвестных вирусов, преонов, наследственных нарушений иммунитета.
Ведущим механизмом патогенеза ХАГ является формирование аутоантител к видоизмененным гепатоцитам.
К особенностям клинических проявлений этого гепатита относят наличие внепеченочных системных проявлений: полисерозитов, тиреоидитов, аутоиммунной гемолитической анемии, гломерулонефрита, синдрома Рейно, миозитов. При этом часто наблюдается непрерывно прогрессирующее течение заболевания.
Лабораторными характеристиками ХАГ являются значительная гипергаммаглобулинемия, гиперпротеинемия (90-100 г/л), высокие показатели трансаминаз (> 10 раз). Для верификации диагноза необходимо предварительное обследование на маркеры вирусных гепатитов, с целью исключения последних.
Специальное иммунологическое исследование позволяет выявить гладкомышечные (SMA)и антиядерные (ANA) АТ при I типе заболевания, печеночно-почечные микросомальные АТ при II типе ХАГ, антитела к растворимому печеночному АГ и печеночно-панкреатические АТ (LP) при III типе аутоиммунного гепатита.
Что касается лекарственных гепатитов, то следует отметить отсутствие специфической клинической картины заболевания. Диагноз в данном случае выставляется на основании анамнеза (как правило, длительный прием гепатотоксичных препаратов) и во многом опирается на данные проведенных предварительных исследований, исключающих вышеуказанные формы ХГ.
Таким образом, диагностика и дифференциальная диагностика ХГ требует разграничения различных форм заболевания между собой, а также с циррозами, метаболическими заболеваниями печени, ее алкогольным поражением.
Важнейшей составляющей комплексной терапии гепатитов является этиотропное лечение, направленное на устранение или сдерживание причины заболевания и предрасполагающих факторов– вирусы, гепатотоксичные лекарственные препараты, алкоголь, холестаз и др. Пути лекарственной этиотропной терапии совершенно противоположны в случаях вирусной и аутоиммунной природы заболевания.
При активных вирусных гепатитах показано проведение противовирусной терапии препаратами группы интерферонов и (или) нуклеозидами, обладающим как прямым ингибирующим вирус эффектом, так и иммуностимулирующей активностью (альфа-интерфероны).
Напротив, при аутоиммунной этиологии ХГ, назначаются препараты с иммунносупрессивной направленностью — глюкокортикостероиды и цитостатики.
Лечение противовирусными препаратами показано в репликативную фазу заболевания, подтвержденную лабораторно повышением уровня АЛТ не менее, чем в 2 раза, наличием серологических маркеров активности гепатита. Эффект от противовирусной терапии наиболее выражен у пациентов молодого возраста, чаще женщин, не имеющих вредных привычек. В остальных случаях эффективность интерферонов значительно ниже, побочные эффекты интерферонотерапии перекрывают основные. Кроме того, имеет место индивидуальная чувствительность к препаратам интерферона (обусловленная активностью специальных рецепторов).
При вирусном гепатите В назначается
— интерферон (реаферон, интрон А, роферон А, велферон и др.) по 5-6 млн. МЕ в/м 3 раза в неделю в течение 6 месяцев или по 10 млн. МЕ 3 раза в неделю в течение 3 мес.;
Ламивудин (зеффикс) – 100 мг 1 раз в день в течение 12 мес. (монотерапия)
При хроническом гепатите С препараты интерферонов изначально назначаются в меньших дозах
— интерферон по 3 млн. МЕ в/м 3 раза в неделю 3 месяца, при наличии эффекта в той же или более высокой дозе до 12 мес;
— интерферон в той же дозе и рибаверин 100-1200 мг/сут. в течение 6 мес.
Возможна индукционная высокодозная терапия, в последние годы используются пегилированные интерфероны — пегасис и др.
Хронический гепатит D в активной фазе также требует проведения противовирусной терапии, при этом назначаются более высокие дозы интерферона (5-6, или 10 млн. МЕ) на длительный срок.
Особенностью терапии аутоиммунного гепатита, исходя из патогенеза заболевания, является назначение с иммуносупрессивной целью глюкокортикостероидов – преднизолона в среднетерапевтических дозировках (30 мг/сут.) с постепенным снижением дозы до поддерживающей (10-15 мг/сут.) в течение нескольких лет.
С той же целью оправдано и эффективно назначение цитостатических препаратов, например азатиоприна в начальной дозе 50 мг/сут., до поддерживающей дозы 25 мг/сут.
Обосновано в качестве базисной терапии применение гепатопротекторов, повышающих резистентность гепатоцитов к действию вируса и других патогенных факторов – эссенциале, карсила, гептрала; назначение инфузий глюкозы, физиологического раствора и других с метаболической и дезинтоксикацинной целью.
Для коррекции сопутствующего дисбиоза кишечника, эффективно использование эубиотиков, лактулозы, ферментных препаратов.
Учитывая значение холестаза в патогенезе ХГ, целесообразно применение в комплексной терапии препаратов урсодезоксихолевой кислоты (урсофальк и др.)
Профилактика хронического гепатита
Большое значение для профилактики гепатитов имеют противоэпидемические мероприятия, включающие дезинфекцию хирургического, стоматологического оборудования, строгий взвешенный подход к вопросам переливания крови и её заменителей, бытовые меры профилактики и другие санитарно-гигиенические меры.
Высока эффективность вакцинопрофилактики, которая разработана для двух форм гепатитов А и В.
В соответствии с федеральным законом с 2002 г. вакцинация должна осуществляться в первые 12 часов жизни ребенка, введена иммунизация детей в возрасте 13 лет, проводится иммунизация медицинских работников.
Прогноз заболевания неоднозначен и зависит от вида гепатита, стадии, активности процесса, гистологических признаков, наличия вредных привычек и др.
Возможны следующие варианты:
Стойкая клиническая ремиссия – отсутствие симптомов, нормализация лабораторных показателей в течение 1,5-2х лет
Переход в цирроз печени в 30-50% случаев
Развитие гепатоцеллюлярной карциномы
Хронический гепатит в любом случае является предметом длительной диспансеризации с применением современных специальных методов серологической иммунологической диагностики и объективной оценкой эффективности проводимых лечебных и противоэпидемических мероприятий.
источник
11.Хронический гепатит: определение, классификация, современные представления об этиологии и патогенезе. Диагностика. Критерии ремиссии и активности процесса с позиции доказательной медицины.
Несколько слов о рекомендуемых экспертами дефинициях хронического гепатита. Хронический гепатит рекомендуется рассматривать «не как единую болезнь, а как клинический и морфологический синдром» (Desmet V. и соавт., 1994), с чем нельзя согласиться, так как в таком толковании происходит подмена нозологии синдромом, чем зачастую грешит медицина Запада. Трактовку же сущности процесса при хроническом гепатите можно принять полностью. Эта группа болезней печени, вызываемая разными причинами, характеризуется различной степенью выраженности гепатоцеллюлярного некроза и воспаления, причем в инфильтрате преобладают лимфоциты и макрофаги. Некротические изменения могут быть представлены очаговыми некрозами паренхимы, перипортальными и перисептальными ступенчатыми некрозами, обширными лобулярными некрозами с образованием мостовидных связей или без них. Понятие «хронический гепатит» обусловлено длительностью заболевания: условная граница хронизации составляет 6 мес, как в прежней классификации. Однако эксперты справедливо пишут, что во многих случаях, особенно при аутоиммунном гепатите, диагноз «хронический гепатит»может быть поставлен и раньше 6 мес. Современная классификация хронического гепатита учитывает следующие четыре основных критерия оценки: этиологию, патогенез, степень активности и стадию хронизации заболевания.
По этиологии и патогенезу:
Хронический вирусный гепатит В
Хронический вирусный гепатит С
Хронический вирусный гепатит D (деьта)
Хронический вирусный гепатит неопределённый (вирусы F, G, агент G В?)
а) тип 1 (анти SMA, анти ANA позитивный)
б) тип 2 (анти LKM 1 позитивный)
в) тип 3 (анти SLА позитивный)
Криптогенный (неустановленной этиологии)
По клинико — биохимическим и гистологическим критериям:
По активности (определяется тяжестью некровоспалительного процесса в печени)
Стадия ХГ (определяется распространённостью фиброза и развитием ЦП)
1 — слабо выраженный перипортальный фиброз
2 — умеренный фиброз с портопортальными септами
3 — выраженный фиброз с портоцентральными септами
Цирроз печени (степень тяжести и стадия цирроза определяются выраженностью портальной гипертензии и печёночно — клеточной недостаточности)
Примечание: анти ANA — антиядерные антитела; анти SMA — аутоантитела к гладкомышечным элементам печени (анти F — актиновые и др.); анти LKM 1- аутоантитела к микросомам печени и почек; анти SLА — антитела к солюбилизированому печёночному антигену.
При вирусных гепатитах нужно установить фазу вирусной инфекции:
Из этой классификации исключены врождённые заболевания печени (гемахроматоз, гепатоцеребральная дистрофия, дефицит a антитрипсина). Не включены в классификацию и хронический холестатический гепатит, хронический реактивный гепатит, хронический алкогольный гепатит, который может протекать в различных клинико — морфологических формах. Исключение хронического алкогольного гепатита вызывает много споров. По новой классификации рекомендуется отказаться от терминов ХАГ, ХПГ, ХЛГ, исключив их из номенклатуры, так как они являются не обозначением разных болезней, а отражают степень активности патологического процесса в печени: ХПГ — мягкая форма с минимальной активностью, ХАГ — с умеренной или выраженной активностью, ХЛГ это ХАГ в стадии относительной ремиссии.
Тяжесть течения определяется стадией ХГ критерием которой служит распространённость фиброза в печени и развитие цирроза печени.
Современное представление об иммунных механизмах развития патологии печени неразрывно связано с представлением об антигенах главного комплекса гистосовместимости, кодируемых у человека генами, локализованными на коротком плече 6 хромосомы и обозначаемых аббревиатурой HLA (human leucocyte antigen).Выделяют три класса молекул HLA.
Молекулы главного комплекса гистосовместимости выполняют важную функцию в селекции Т-лимфоцитов, необходимых для иммунного ответа на чужеродные антигены.Отсутствие иммунного ответа на собственные антигены обеспечивается клональной
делецией (удалением), приводящей к выработке иммунологической толерантности к антигенам, не презентированным в тимусе. Четкой ассоциации вирусных гепатитов В, С и D с антигенами главного комплекса гистосовместимости выявить не удалось.
Однако установлена повышенная частота системных иммунных проявлений HBV- и HCV-инфекции у лиц с гаплотипами DR3 и DR4, то есть ассоциированных с аутоиммунным поражением печени. В настоящее время признано, что иммунные механизмы являются ведущими в формировании хронического гепатита. Для реализации клеточных иммунных механизмов в деструкции гепатоцитов требуется экспозиция на поверхность клеток-мишеней вирусных белков при вирусном хроническом гепатите. В прикреплении эффекторных клеток к клеткам-мишеням и их деструкции участвуют лимфокины и внутриклеточные адгезивные молекулы, индуцированные провоспалительным и цитокинами.
В развитии и течении вирусных поражений печени важная роль принадлежит цитокинам —эндогенным биологически активным веществам,реализующим межклеточное взаимодействие. Цитокины представляют собой обширную гетерогенную группу белков, продуцируемых клетками организма разных типов, в первую очередь активированными лимфоцитами, моноцитами, тканевыми макрофагами,в ответ на действие внешнего стимула и обозначаемых как лимфокины, монокины,интерлейкины. Цитокины регулируют интенсивность воспалительных, иммунных,аутоиммунных реакций, пролиферацию и апоптоз клеток, обмен белков, липидов и
углеводов, поддерживают постоянство внутренней среды организма. Цитокины могут стимулировать либо ингибировать указанные процессы, действовать как синергисты «и антагонисты, вызывать каскад цепных реакций. Цитокины, в частности,обеспечивают взаимодействие клеток внутри печени и связь печени с другими органами, как в физиологических условиях, так и при действии различных патогенных факторов, в том числе вирусной инфекции. Следовательно, цитокины характеризуются широким спектром биологических свойств, многофункциональностью,универсальностью, плейотропностью.
Конечный результат биологического эффекта цитокинов определяется их количественным содержанием, временной последовательностью синтеза различных Цитокины, взаимодействием между собой и с другими биологически активными
веществами, такими, как гормоны, факторы роста.Нарушение сенсибилизации лимфоцитов к антигенам вируса гепатита В (в первую
очередь HBcAg) приводит к неэффективной элиминации возбудителя путем разрушения пораженных гепатоцитов и развитию хронического воспаления печени.
При снижении супрессорной активности (первичной или вторичной) нарушается клональная делеция лимфоцитов, направленных против аутоантигенов, и развиваются аутоиммунные процессы. Важно указать на тот факт, что если при вирусном гепатите мишенью иммунного ответа являются антигены вируса, то при аутоиммунных болезнях печени — антигены собственных тканей.
К чему ведет обратная ситуация — преобладание Т-супрессорной активности над Т-хелперной, что наблюдается при хроническом вирусном гепатите? В субпопуляции Т-хелперов выделяют два основных типа клеток: Т-хелперы 1-го типа; (Tx-1) — стимуляторы клеточного ответа и Т-хелперы 2-го типа (Тх2)-стимуляторы гуморального ответа.Спектр продуцируемых ими цитокинов также различен:Тх-1 секретируют интерферон-7, интерлейкин-2, факторы некроза опухоли α и β в то время как Тх-2 — интерлейкины 4, 5, 6, 9, 10, 13. Ряд из них, в частности интерлейкины 4 и 10, оказывают противовоспалительное действие преимущественно за счет подавления действия интерферона у, усиливающего экспрессию антигенов HLA II класса на поверхности антигенпрезентируюших клеток.
Проведенные недавно исследования показали относительное преобладание количества Тх-2 над количеством Tx-l в воспалительных клеточных инфильтратах при хронизации острого гепатита С и обратное соотношение числа данных типов хелперных лимфоцитов и продуцируемых ими цитокинов в случае выздоровления.Сходные данные получены при изучении клеточных инфильтратов в печени больных хронической HBV-инфекцией.Дисбаланс провоспалительных и противовоспалительных цитокинов в пользу
последних может приводить к нарушению лизиса зараженных гепатоцитов и элиминации вирусных частиц с развитием хронического воспаления. Этим же можнообъяснить редкое возникновение при гепатите С гиперергической реакции иммунной системы с развитием фульминантной формы болезни. В то же время при аутоиммунном гепатите Tx-l доминируют в воспалительных тканевых нфильтратах
над Тх-2. Нарушение иммунорегуляторных механизмов — первичное, то есть возникающее вследствие генетических дефектов, или вторичное (под влиянием экзогенных факторов) — ведет к дисбалансу иммунной системы, что в свою очередь предопределяет развитие той или иной формы патологического иммунного ответа.
Печень осуществляет синтез и секрецию первичных медиаторов воспаления-цитокинов, среди которых основным провоспалительным действием обладают следующие:
• туморнекротизирующий фактор (TNF-α).
• интерлейкин-6 (ИЛ-6); интерлейкин-8 (ИЛ-8); интерлейкин-1β (ИЛ-1β)
В соответствии с современными представлениями ИЛ-lβ, ИЛ-6, ФНО-α относятся к группе провоспалительных цитокинов, инициирующих и стимулирующих воспаление. ИЛ-lβ — эндогенный биологический активный медиатор неспецифического действия, один из первых включается в ответную защитную реакцию организма при вирусной инфекции. ИЛ-lβ активирует Т- и В-лимфоциты, усиливает их цитотоксические свойства, инициирует синтез ИЛ-6,ФНО-a и др. ИЛ-6 по своим биологическим свойствам сходен с ИЛ-lβ,продуцируется в основном лимфоцитами, однако в его синтезе могут принимать участие гепатоциты, клетки Купфера, эпителиальные клетки внутрипеченочных желчных протоков. ИЛ-6 стимулирует воспалительные, иммунные, метаболические
процессы, играет важную роль в пролиферации клеток и др. Печень способна продуцировать большое количество TNF- α.
ФНО-α — многофункциональный ЦК с выраженной плейотропностью, играет ключевую роль в развитии местных и общих, системных патологических процессов.ФНО-α регулирует интенсивность воспаления иммунного ответа, активирует Т- и В-лимфоциты, естественные клетки-киллеры, дает гепатотоксический эффект,принимает участие в апоптозе поврежденных (в том числе вирусом) клеток.Поэтому всякая реакция воспаления сопровождается его выходом в системнуюциркуляцию.Помимо выработки цитокинов в печени происходят следующие реакции:
• нарушается печеночный кровоток, обусловленный высвобождением мощного вазоконстриктора эндотелина-1;
• очаговые окклюзии печеночных синусоидов тромбоцитами, активированными купферовскими клетками;
• гибель эндотелиальных клеток и лейкоцитов, формируются фибриновые микротромбы в синусоидах;
• массивные некрозы печени (как следствие ишемии).
Гепатоциты, эндотелиальные клетки синусоидов и купферовские клетки являются клеточной триадой, составляющей основу воспалительных реакций. Купферовские клетки — основные продуценты TNF- α, IL-6 и IL-8. При избытке продукции TNF-α выходит из печени в системную циркуляцию крови. На поверхности эндотелиальных, купферовских, синусоидальных, звездчатых клеток Ито и непосредственно гепатоцитов осуществляется экспрессия межклеточных адгезионных молекул — intracellular adhesion molecule (ICAM-1). Экспрессия этих молекул индуцируется цитокинами TNF-α, IL-6, IL-8, секретируемые купферовскими клетками. Помимо межклеточных адгезионных молекул в процессе воспалительной реакции на цитоплазматической мембране нейтрофилов и других клеток экспонируются нейтрофильные адгезионные интегрины,связывающиеся с ICAM-1 на поверхности клеток печени. Индуктором
этого процесса также является TNF-α, занимающий ключевую позицию в развитии воспалительной реакции печени независимо от этиологической причины. Он является ключевым медиатором воспалительных процессов и клеточных иммунных реакций.
Второй медиатор воспаления, который высвобождается купферовскими клетками и гепатоцитами,-IL-8. Его индукция аблюдается при эндотоксемии,реперфузионном синдроме и алкогольных эксцессах. Важно, что молекула IL-8 является потентным хемоаттрактантом нейтрофилов.Молекулы эндотоксинов и TNF-α индуцируют нейтрофилы к высвобождению ряда биологически активных молекул. Высвобождается и концентрируется в зоне воспаления большое количество перекиси водорода (Н2О2),
активных радикалов кислорода (Оз), эластазы. В результате ингибируется активность каталазы пероксисом (прежде всего в гепатоцитах) и угнетается гепатоцеллюлярная активность нейтрализации перекиси водорода и других активных радикалов кислорода, образующихся в реакции пероксидации.Купферовские клетки индуцируют ускоренный апоптоз циркулирующих и попадающих
в синусоиды нейтрофилов. Освобождающиеся продукты апоптотически разрушенных нейтрофилов поступают в циркуляцию и воздействуют на синусоидальные клетки и гепатоциты. Под влиянием токсинов купферовские клетки и гепатоциты выделяют
IL-8, который стимулирует нейтрофилы. На поверхности нейтрофилов под влиянием TNF-α и IL-1R происходит экспрессия интегринов. На поверхности купферовских клеток, гепатоцитов и липоцитов (звездчатых клеток Ито)происходит экспозиция межклеточных адгезионных молекул. В последующем TNF-α стимулирует высвобождение нейтрофилами перекиси водорода и активных радикалов кислорода. Взаимодействие интегринов и межклеточных адгезионных молекул обеспечивает дальнейшее высвобождение цитокинов, в частности IL-8. По сути, это замкнутая система, поддерживающая воспалительную реакцию.
Таким образом, с самого начала воспаления типа I (воспаление в ответ на первичное повреждение) в зоне печеночного синусоида формируется сложная цепь клеточных взаимодействий. Воспаление начинается с примирования, или подготовки к воспалению синусоидных клеток —печеночных макрофагов и эндотелия. В этом процессе участвуют продукты распада печени, активные фракции комплемента,образуемые под действием протеаз поврежденных клеток, иммунные комплексы и лимфокины. Примированные синусоидные клетки приобретают высокую чувствительность к вторичным стимулам, прежде всего к эндотоксину,
превращаясь в основной инструмент воспаления. Они «подтягивают» к процессу лейкоциты крови, в первую очередь нейтрофилы с высоким цитопатогенным потенциалом, который «срабатывает» под действием эндотоксина.Избыточное количество ЦК, их чрезмерный выброс может стать фактором прогрессирования патологического процесса, оказывать прямое повреждающее
действие на паренхиматозные клетки, вызывая пирогенный эффект, диарею,снижение массы тела, анемию Таким образом можно отметить, что определение цитокинового спектра при хронических заболеваниях печени вирусной этиологии имеет прогностическое значение, поскольку позволяет судить об активности заболевания, его прогрессировании, а также об эффективности проводимой
противовирусной и иммунокорригирующей терапии.
По мере развития гепатита в печени накапливаются не только медиаторы, но и ингибиторы воспаления. В частности, те же клетки Купфера вместе с гепатоцитами усиленно нарабатывают простагландины группы Е и белки острой фазы (БОФ), такие как α2-макроглобулины, нейтрализующие протеазы,тормозящее респираторный взрыв фагоцитов и генерацию ЛФК (активные формы
кислорода). К тому же IL-6 клеток Купфера с определенного этапа процесса индуцирует секрецию кортикотропин-рилизинг фактора в гипоталамусе, запуская гипоталамо-гипофизарно-надпочечниковую ось и лимитируя воспаление. Иными словами, клетки Купфера выступают не только в роли триггера гепатита типа I, но и его модулятора.Следует остановиться на некоторых новых данных, касающихся различных механизмов гибели печеночных клеток. Еще 5 лет назад аксиомой являлось то, что механизм
гибели гепатоцитов при вирусной инфекции заключается в развитии некроза.Основные стадии некробиотических изменений хорошо изучены. Клетка претерпевает определенные изменения: появляется цитоплазматическая складчатость. Набухают органеллы, пикнотизируется хроматин, клеточные органеллы концентрируются вокруг ядра и, наконец, происходят лизис цитоплазматической оболочки и гибель клеточных органелл (митохондрии, лизосомы и т.д.). Как правило, вокруг гибнущих клеток возникает воспаление, которое затем трансформируется в фиброзные изменения.
В настоящее время активно изучается другой механизм гибели клетки-
апоптоз (самопрограммируемая клеточная смерть). В случае патологии апоптоз может индуцироваться интерлейкинами, лимфокинами и др. Наиболее изучен трансформирующий фактор роста (TGF), Под действием TGF появляются цитоплазматические выросты, хроматин распределяется по краям ядра, ядро фрагментируется, органеллы распределяются по цитоплазматическим складкам. Затем клетка фрагментируется с образованием апопотических телец, которые длительное время могут сохранять жизнеспособность. Вокруг таких фрагментированных частиц клетки,Уже не вызывает сомнений, что апоптоз — очень частое проявление патологии печени. Ему принадлежит ведущая роль в развитии острых и хронических вирусных гепатитов, гепатоцеллюлярной карциномы, алкогольных поражений. Апоптоз участвует в морфогенезе аутоиммунных гепатитов, первичного билиарного цирроза. При вирусном гепатите апоптоз может быть результатом как прямого воздействия вируса, так и опосредованным иммунной реакцией.
Развитие апоптоза при попадании в гепатоцит вируса следует рассматривать как своего рода защитный механизм, гак как в мертвой клетке репликация вируса становится невозможной.Однако чаще причиной апоптозов при вирусных инфекциях печен) служит не прямая дитотоксичность вируса, а иммунная реакция на его антигены, расположенные на инфицированных гепатоцитами осуществляемая Т-лимфоцитами.Т-лимфоциты могут вызывать апоптоз в печеночных клетках двумя путями. Первый реализуется за счет выброса из Т-клеток гранул перфорина, который, каксвидетельствует его название, образует поры в плазматических мембранах
гепатоцитов. Через них в клетки проникают гранзимы — Т-лимфопитарные гранулы,содержащей» протеазы, которые являются одним из важных проапоптозных факторов. Второй путь образования апоптоза с участием Т-лимфоцитов связан с их действием на Fas-антигены, экспрессия которых происходит поверхности инфицированных гепатоцитов. Fas-антиген принадлежит к большому семейству рецепторов факторов роста и факторов некроза опухолей. В печени он служит рецептором для Fas-лигандов, вырабатываемых, в свою очередь, активированными Т-клетками. Присоединение лиганда к Fas-репептору на гепатоцитах и служит
причиной апоптоза клетки-мишени. Fas-антигены обнаружены в печеночных клетках при хронических гепатитах, особенно часто в гепатоцитах, окруженных лимфоцитами на границе ступенчатого некроза и паренхимы. Следует отметить, что в таких лимфоцитах значительно усилена экспрессия Fas-лигандов. О связи экспрессии Fas и последующего апоптоза с действием вируса гепатита С свидетельствует и то, что после лечения противовирусным препаратом интерфероном количество Fas-положительных клеток резко снижается и коррелирует как со снижением активности аминотрансфераз в крови, так и с уменьшением выраженности портальной
и лобулярной инфильтрации в ткани печени. Характерно, что при слабых повреждениях ткани характерно преобладание апоптоза, при более сильных -некроза. При острых и хронических гепатитах вирусной этиологии возникают повреждения мембранного аппарата гепатоцитов.
Синтез вирусных нуклеокапсидов сопровождается одновременным включением в плазматическую мембрану клетки-хозяина белков и гликопротеидов, которые впоследствии войдут в состав оболочки вируса. Эти белки и гликопротеиды формируют в мембране небольшие области, в которых не содержится обычных белковых компонентов плазматической мембраны клетки-хозяина. Когда
нуклеокапсиды синтезированы, они «заселяют» области цитоплазматической мембраны, сформированные из вирусных белков. Эти области мембраны и образуют в дальнейшем оболочку вируса. Вирусы отпочковываются от плазматической мембраны и уходят во внеклеточное пространство, унося с собой часть мембранного материала клетки.
Связь цитокинов и гепатоцеллюлярных функций. Прежде всего, IL-6 стимулирует синтез и высвобождение в циркуляцию белков острой фазы. В эту фазу воспаления мы имеем возможность регистрировать следующие белки — фибриноген,гаптоглобин, α2-макроглобулин и орозомукоид. В период активной секреции цитокинов печень превращается из органа, который должен удалять
органические анионы из циркуляции, в орган, увеличивающий их содержание. По существу печень превращается в основной источник образования кислых валентностей (лактата), приводящих к снижению рН артериальной крови.Избыточная секреция TNF-α ведет к увеличению объема гепатоцитов приблизительно на 20% и обусловливает быстрое формирование гепатомегалии,которую мы и наблюдаем в клинике. TNF- α стимулирует захват гепатоцитами аминокислот, IL-6 стимулирует синтез белков острой фазы. В результате воздействия TNF- α нарушается митохондриальное дыхание (разобщаются окисление и фосфорилирование) и происходит индукция гепатоцеллюлярного апоптоза -второго наряду с некрозом пути гибели клеток.
Высвобождение купферовскими клетками TNF-a и IL-6 стимулируется IL-lβ.Совместно TNF- α и IL-1(3 ведут к угнетению захвата гепатоцитами желчных кислот и их каналикулярной секреции. Развивается холестаз без деструкции гепатоцитов. Одновременно угнетается активность канальцевого транспортера с МОАТ/МКР, и каналикулярной секреции органических анионов, в том числе
конъюгатов билирубина. Развивается гипербилирубинемия.TNF- α стимулирует захват аминокислот Na + зависимыми
переносчиками. Накопление натрия приводит к отеку клетки.TNF- α совместно с IL-6 стимулирует синтез белков острой фазы, которые выходят в циркуляцию. Нарушается продукция энергии клеткой, индуцируетсяапоптоз. TNF- α в сочетании с IL-8 нарушает захват Na + -зависимым транспортером желчных кислот и секрецию солей желчных кислот и органических анионов в желчные канальцы.
Эндотоксемия и холестаз. Вирусы, аутоантитела и холестаз. Холестаз -ключевая проблема гепатологии. Любые нарушения синтеза, секреции или тока желчи, приводящие к биохимическим, патофизиологическим, патоанатомическим и,наконец, клиническим изменениям, обозначаются клиническим термином холестаз. В случае внутрипеченочного холестаза нарушения тока желчи локализуются внутри гепатоцитов или в межклеточном пространстве между клетками печени.Внутрипеченочный холестаз анатомически классифицируют на две главные подгруппы:печеночно-канальцевый (внутридольковый) и протоковый (междольковый) холестаз.Различные типы в значительной степени перекрываются между собой.Внутридольковый холестаз вызывается недостаточной секрецией желчи клетками печени из-за повреждений клеточных органелл. Междольковый холестаз связан с прогрессирующей деструкцией и сокращением малых междольковых желчных протоков.TNF-α и IL-1β угнетают гепатоцеллюлярное образование желчи и вызывают холестаз. Холестаз при обструкции холедоха (экспериментальный и клинический)сопряжен с подъемом плазменных уровней эндотоксина и TNF-α. Это приводит к угнетению Na + -зависимого транспорта желчных кислот. Высокий уровень
желчных кислот вызывает генерализованную иммуносупрессию. TNF-α угнетает секрецию цитокинов купферовскими клетками, обусловливая торможение реакций мобилизации нейтрофилов и их маргиналию в печени. В дальнейшем это блокирует
миграцию лейкоцитов в очаги воспаления, нарушает функцию изоляции и элиминации инфекционных агентов, повышает вероятность септических осложнений.Под влиянием цитокинов развивается внутриклеточный холестаз. Экспозиция интегринов и адгезионных молекул на поверхности желчных канальцев,хемоапрактанты привлекают сюда большое количество Т-клеток и нейтрофилов.
Индукция цитокинов, в частности TNF-α, осуществляется самими эпителиоцитами желчных канальцев. Это способствует деструкции их эпителиальной выстилки и выходу желчных кислот и компонентов желчи в просвет и циркуляцию. Накопление желчных кислот внутри клеток печени может в конечном итоге вести к их гибели. Таким образом, возникает порочный круг, в котором внутрипече-ночный холестаз, вызванный различными типами повреждений печени, в свою очередь усугубляет эти нарушения.
Подводя итог всему вышеизложенному можно отметить: исходно воспаление паренхимы печени является результатом цитокинопосредуемой активации синусоидальных клеток, экспрессии ими адгезионных молекул, дальнейшего локального высвобождения провоспалительных цитокинов и мобилизации циркулирующих лейкоцитов.Ключевую роль в распространении паренхиматозного воспаления играюткупферовские клетки.• Синусоидальные эндотелиальные клетки, перисинусоидальные звездчатые клетки. Ито и резидентные киллерные клетки (pit-клетки) расширяют провоспалительное микроокружение. Гепатоциты самостоятельно экспрессируют адгезионные молекулы и выделяют провоспалительные цитокины.
• Экзогенные лейкоциты (нейтрофилы),Т-лимфоцитыи циркулирующие макрофаги «маргинируют», «прилипают» к синусоидальному эпителию и могут проникать в паренхиматозное пространство.
• Указанные клетки дополнительно высвобождают провоспалительные цитокины и обладающие повреждающим действием химические радикалы, вызывая локальное скопление потенциальных патогенов.
• Мишенью «цитокиновой атаки» служат преимущественно гепатоциты. Нарушается механизм гепатоцеллюлярного образования желчи с развитием холестаза. В тяжелых случаях цитокины вызывают апоптоз гепатоцитов.
• Цитокины обусловливают появление сладжа тромбоцитов в, синусоидах и венулах, окклюзию микроваскулярного ложа с последующим ишемическим гепатоцеллюлярным некрозом.
Хронизация процесса в значительной мере определяется тем, что:
• блокируются хемотаксис и фагоцитоз;
• нарушается выделение иммунных комплексов;
• высвобождаются мезосомальные элементы пищеварительной клетки;
• происходит гибель этой клетки;
• образуются микротромбозы в печени и других органах.
Таким образом, механизмы хронизации гепатита разнообразны, но по существующему мнению, в ее основе — генетическая предрасположенность и дефект иммунной системы.
Диагностика хронических гепатитов.
Диагностические критерии ХГ, как и любого другого заболевания, выявляются в ходе 3 этапов обследования и включают данные вирусологического, клинико — лабораторного и морфологического исследований. Клинические проявления ХГ определяются в первую очередь функциональным состоянием печени.
На 1 этапе диагностического поиска необходимо выявить астеновегетативный, болевой, и диспептический синдромы. Следует заметить, что астеновегетативный и диспептический синдромы ранее традиционно связываемые с печёночно — клеточной недостаточностью, в наше время объясняются моторно — эвакуационными расстройствами двенадцатиперстной кишки, сопровождающимися повышением интрадуоденального давления (дуоденостаз), нестерильностью дуоденального содержимого, дисбактериозом кишечника, моторными расстройствами толстого кишечника. Все эти явления объясняются изменением биохимического состава желчи, снижением концентрации желчных кислот.
Выраженность этих синдромов при различных формах гепатита варьирует и зависит от активности процесса и функционального состояния печени.
На 1 этапе также выявляется кожный зуд как признак холестаза, полиартралгии — боли преимущественно в крупных суставах.
На этом этапе также анамнестически удаётся пролить свет на этиологию заболевания: предшествующий острый вирусный гепатит, переливания крови или её компонентов, донорство, частые прививки, наличие заболеваний печени у родителей, постоянное употребление алкоголя, медикаментов обладающих гепатотоксичными свойствами. Среди этих лекарств следует назвать наиболее часто употребляемые: индометацин, тетрациклин, допегит, ноотропил, тубазид, метотрексат и др.Важнейшие синдромы ХГ:
источник
