Хронический вирусный гепатит С с исходом в цирроз и гепатоцеллюлярную карциному (клиническое наблюдение)
*Импакт фактор за 2017 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
В статье представлен клинический случай пациента с диагнозом «цирроз печени, класс В по Чайлд — Пью» в исходе хронического гепатита С, пролеченного препаратами интерферона и рибавирина в течение 18 мес. На фоне противовирусной терапии РНК вируса гепатита С стала отрицательной через 8 нед. и оставалась стойко отрицательной на протяжении 2-х лет. В последующем на фоне стресса, через 3 мес. после окончания лечения возник рецидив хронического гепатита С с умеренной биохимической и вирусологической активностью. Через 6 мес. после рецидива при ультразвуковом исследовании был заподозрен рак печени, было получено гистологическое подтверждение. Через несколько месяцев у пациента развилось кровотечение из варикозно расширенных вен пищевода (ВРВП), а еще через 1 мес. возникло повторное кровотечение из ВРВП. Пациент наблюдался и лечился в реанимационном отделении. Появились асцит, двусторонняя пневмония, лихорадка, лейкоцитоз. Состояние больного прогрессивно ухудшалось, и при нарастающем психомоторном возбуждении, прогрессирующей дыхательной и сердечно-сосудистой недостаточности была зафиксирована биологическая смерть.
Имело место расхождение диагнозов, категория II. Причиной летального исхода стала гнойная интоксикация в результате перфорации язв пищевода, гнойного медиастинита с эмпиемой плевры слева.
Ключевые слова: хронический гепатит С, цирроз печени, гепатоцеллюлярная карцинома.
Для цитирования: Макашова В.В., Омарова Х.Г., Хохлова О.Н., Лукашенко Т.Н. Хронический вирусный гепатит С с исходом в цирроз и гепатоцеллюлярную карциному (клиническое наблюдение) // РМЖ. Медицинское обозрение. 2018. №8(II). С. 92-96
Chronic hepatitis C virus with the outcome of cirrhosis and hepatocellular carcinoma (clinical observation)
V.V. Makashova 1,2 , H.G. Omarova 1 , O.N. Hohlova 1 , T.N. Lukashenko 3
1 Central Research Institute of Epidemiology, Moscow
2 Clinical Hospital for the Infectious Diseases, Moscow
3 Outpatient Clinic № 5, Moscow
The article presents a clinical case of a patient with a diagnosis of liver cirrhosis of Child-Pugh class B in the outcome of chronic hepatitis C, treated with interferon and ribavirin for 18 months. In the course of antiviral therapy, RNA of the hepatitis C virus became negative after 8 weeks and remained steadily negative for 2 years. Subsequently, on the background of stress, 3 months after the end of treatment, a relapse of chronic hepatitis C appeared with moderate biochemical and virological activity. 6 months after the relapse, a liver cancer was suspected during an ultrasound examination and histological confirmation was obtained. After a few months, hemorrhage from esophageal varicose veins dilatation (EVVD) occurred in the patient, and after another 1 month, there was repeated hemorrhage from EVVD. The patient was monitored and treated in the intensive care department. Ascites, bilateral pneumonia, fever, leukocytosis appeared. The patient’s condition progressively worsened and with increasing psychomotor agitation, progressive respiratory and cardiovascular insufficiency, biological death was recorded.
There was a divergence of diagnoses, category II. The cause of the fatal outcome was purulent intoxication, as a result of ulcers perforation of the esophagus, purulent mediastinitis with pleural empyema on the left.
Key words: chronic hepatitis C, cirrhosis, hepatocellular carcinoma.
For citation: Makashova V.V., Omarova H.G., Hohlova O.N., Lukashenko T.N. Chronic hepatitis C virus with the outcome of cirrhosis and hepatocellular carcinoma (clinical observation) // RMJ. Medical Review. 2018. № 8(II). P. 92–96.
В статье представлен клинический случай пациента с диагнозом «цирроз печени, класс В по Чайлд — Пью» в исходе хронического гепатита С с развитием гепатоцеллюлярной карциномы
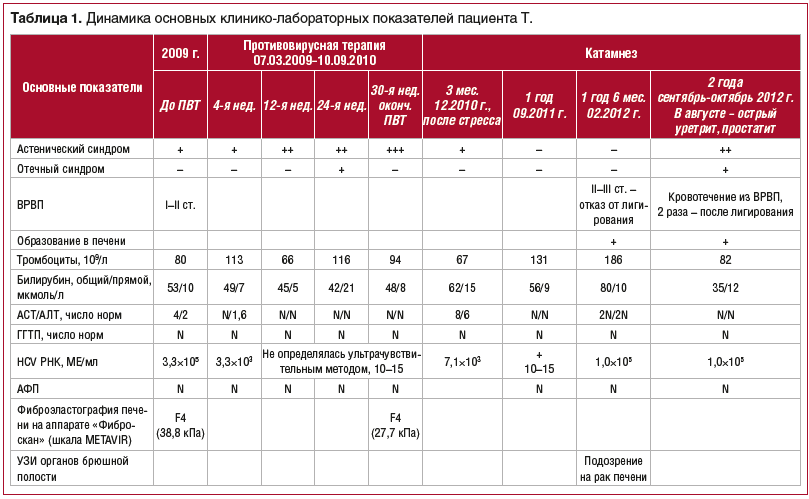
Пациент Т., 1948 г. р., 22.01.2009 г. обратился в поликлинику к инфекционисту в связи с лейкопенией (до 3,2×10 9 /л), тромбоцитопенией (60–120×10 9 ). Со слов пациента, антитела к HCV впервые выявлены в 1998 г. Не обследовался, не лечился. Впервые обследовался в поликлинике ФСБ № 5 в 2009 г., выявлена РНК HCV+, 1в генотип, вирусная нагрузка — 1,3×10 6 коп/мл.
Жалобы на периодически возникающую слабость и утомляемость.
Перенесенные заболевания: 1972 г. — аппендэктомия, 1992 г. — острый вирусный гепатит А, 1995 г. — оперирован по поводу синдрома Меллори — Вейса. В это же время были гемотрансфузии. 1996 г. — грыжесечение, 1997 г. — повторное грыжесечение, 2004 г. — язвенная болезнь 12-перстной кишки, 2005 г. — правостороннее воспаление легких, хронический бронхит, 2007 г. — повторная пневмония, 2007 г. — сильное кровотечение при удалении зубов, гипертоническая болезнь, сахарный диабет 2-го типа.
Аллергоанамнез — не отягощен.
Наследственность: у отца — цирроз печени алкогольного генеза, у матери — инсульт, у брата — хронический вирусный гепатит В.
Вредные привычки: не курит, алкоголь употреблял часто, но немного (со слов), крепкие напитки (виски, коньяк).
Объективно при осмотре: сосудистые звездочки в области грудной клетки, умеренная пальмарная эритема, иктеричность склер. Печень пальпаторно и перкуторно увеличена — выступает на 4–5 см ниже реберной дуги, селезенка не пальпируется.
Рост — 173 см, вес — 80 кг.
Динамика основных показателей общего и биохимического анализов крови, данные ПЦР-диагностики представлены в таблице 1.
02.02.2009 г. проведено ультразвуковое исследование (УЗИ), выявлены диффузные изменения в печени, увеличение левой доли печени (8,4 см, норма — до 7,0 см), хронический бескаменный холецистит, желчный пузырь деформирован с перегибом в теле; умеренное увеличение селезенки (13,8×6,9 см), киста правой почки.
11.03.2009 г. Фиброэластография печени: F4 по шкале METAVIR (кПа — 38,8).
Эзофагогастродуоденоскопия (ЭГДС) 20.03.2009 г. — варикозно расширенные вены пищевода (ВРВП) 1–2 ст., эрозивный бульбит.
С 07.03.2009 г. по 10.09.2010 г. проводилось противовирусное лечение препаратами интерферон альфа-2b 1 млн через день и рибавирин 800 мг/сут (по весу); постоянно получал урсодезоксихолевую кислоту 750 мг/сут.
Через 8 нед. противовирусной терапии РНК HCV не определялась (менее 500 МЕ/мл), аланинаминотрансфераза (АЛТ) и аспартатаминотрансфераза (ACT) — в норме, билирубин общий — до 42 мкм/л.
Через 6 мес. после начала противовирусной терапии состояние ухудшилось, в связи с чем был госпитализирован в ГБУЗ ИКБ № 2 ДЗМ, где находился с 08.09.2009 г. по 27.09.2009 г. Впервые выявлен асцит, по данным УЗИ увеличены печень (15 см — правая доля), селезенка (143×67 мм), Vena portae — 15 мм, селезеночная вена — 10 мм. Проведено лечение: альбумин 100 мл № 3, адеметионин, мочегонные препараты (спиронолактон, фуросемид), пропранолол 20 мг. Самочувствие и состояние значительно улучшились. В последующий период наблюдения асцит не отмечался.
Через 1,5 года стандартной противовирусной терапии (интерферон короткого действия и рибавирин) пациент жалоб не предъявлял, достигнута положительная динамика по данным УЗИ, фиброэластографии печени (эластичность печени снизилась с 38,8 до 27,7 кПа), печеночные трансаминазы и количество тромбоцитов нормализовались. РНК HCV стойко не определялась.
У пациента через 2 мес. после окончания противовирусной терапии был стресс, а через 3 мес. однократно была обнаружена РНК HCV (7,1×10 3 МЕ/мл) от 02.12.2010 г., повысилась активность ферментов (8 N).
Назначен гепатопротектор (расторопши пятнистой плодов экстракт 140 мг/сут). Через 1 мес. активность трансаминаз стала нормальной, РНК HCV не определялась ультрачувствительным методом в течение 1 года 3 мес. В марте 2012 г. при повышении активности ферментов в 2,5 раза вновь была обнаружена РНК вируса гепатита С — 1,0×10 5 МЕ/мл.
Были проанализированы показатели иммунного статуса в динамике — на фоне противовирусного лечения при декомпенсации ЦП, при окончании противовирусной терапии и в катамнезе. Выявлено, что на фоне противовирусной терапии в период декомпенсации ЦП отмечалось увеличение Т-хелперной активности при снижении цитотоксических Т-лимфоцитов, при этом иммунорегуляторный индекс оставался выше нормы. Одновременно отмечалось снижение показателей В-лимфоцитов, натуральных киллеров (NK-клеток) и TNK-клеток (Т-клетки с функциями NK-клеток), что говорит о нарушении не только гуморального, но и клеточного звена иммунного ответа и может свидетельствовать о формировании иммунодефицита. На фоне длительной противовирусной терапии пациент был обследован повторно через 1 год 3 мес. Обнаружено, что показатели всех субпопуляций Т-лимфоцитов нормализовались. Кроме этого, отмечалось выраженное увеличение показателей В-лимфоцитов (до 30%) и антител класса IgG (увеличены в 2 раза по сравнению с показателями после 6-месячного лечения). Однако клеточное (NK-клетки) звено иммунитета оставалось несостоятельным. Показатели катамнестического третьего иммунологического статуса не отличались от таковых при предыдущем исследовании. Такое медленное восстановление иммунной системы можно объяснить вновь обнаруженной репликацией HCV и ухудшением биохимических показателей.
Планировался курс повторной противовирусной терапии ХГС.
Однако 28.02.2011 г. возникла клиническая картина кровотечения из ВРВП (на фоне астенических явлений: резкое снижение уровня гемоглобина — до 92 г/л, эритроцитов — до 3,6×10 12 /л). Пациент отказался от консультации и госпитализации в отделение портальной гипертензии, необходимой для склерозирования ВРВП.
При ЭГДС от 04.03.2011 г. — ВРВП 2–3 ст., на момент осмотра — без признаков состоявшегося кровотечения или картины нестабильного местного гемостаза. Поверхностный гастродуоденит, очаговый эрозивный гастрит выходного отдела без геморрагического компонента.
Пациент постоянно получал урсодезоксихолевую кислоту 750 мг, карведилол 125 мг.
На УЗИ от 10.04.2012 г. (предыдущее — от 06.09.2011 г.)
впервые выявлено образование в правой доле печени до 3 см, смешанной эхогенности, с нечеткими контурами.
13.04.2012 г. Компьютерная томография (КТ): при и после в/в болюсного контрастирования: в артериальную фазу контрастирования на границе 7–8 сегмента и в 6 сегменте печени определяются 3 округлой формы зоны активного и равномерного накопления контрастного препарата: 1,2×0,9 см, 1,9×1,7 см и 0,8×0,7 см соответственно. Заключение: основное заболевание — ЦП в исходе ХГС. КТ-признаки 3 образований правой доли печени на фоне жирового гепатоза (дифференцировать между узлами регенерации и бластоматозным процессом); умеренно выраженная портальная гипертензия (спленомегалия, умеренное расширение воротной вены (1,4 см), вен желудка и селезенки), аномалия развития почек (подковообразная почка), псевдокисты поджелудочной железы.
24.04.2012 г. Магнитно-резонансная томография органов брюшной полости. Контрастное усиление: гадобутрол. Заключение: косвенные признаки ЦП, портальная гипертензия, спленомегалия. Зоны измененного MP-сигнала в правой доле печени, вероятно, узлы-регенераты. Образование тела поджелудочной железы, вероятно, серозная цистаденома.
В период обследования пациент жалоб не предъявлял, осмотр — без динамики.
Для исключения бластоматозных образований печени на фоне ЦП в исходе ХГС (стадия репликации вируса) и решения вопроса о возможности продолжения противовирусной терапии пациент был направлен на биопсию печени.
С 23.05.2012 г. по 28.05.2012 г. находился в хирургическом отделении ГКБ им. С.П. Боткина для проведения биопсии образования печени под УЗ-наведением.
Макроскопическое описание материала от 24.05.2012 г.:
дифференциальный диагноз между гепатоцеллюлярной аденомой и высокодифференцированным гепатоцеллюлярным раком (ГЦР). Микроскопическое описание материала от 07.06.2012 г.: фрагмент ткани печени с признаками цирротической трансформации и микроскопическая фрагментированная частица, крайне подозрительная по высокодифференцированной ГЦК с очагами некроза (проконсультировано профессором Г.А. Франком).
Для определения тактики дальнейшего ведения пациент направлен на консультацию в НИИ скорой помощи им. Склифосовского.
В июле пациент уехал в отпуск, в Крым. 18.07.2012 г. отметил подъем температуры до 39 °С, озноб, боли и увеличение правого яичка, рези и боли при мочеиспускании, кровь в конце акта мочеиспускания. Обратился к урологу. Диагноз: острый уретрит, острый простатит. Получал амоксициллин и клавулановую кислоту в течение 5 дней. Состояние улучшилось — уменьшились боли при мочеиспускании и отек яичка.
При возвращении госпитализирован в урологическое отделение ЦВКГ, где находился с 14.08.2012 г. по 31.08.2012 г. с диагнозом «острый простатит, уретрит». В урологическом отделении было кровотечение из ВРВП, остановленное консервативно. После выписки кровотечение из ВРВП повторилось. Был повторно госпитализирован в хирургическое отделение ЦКВГ, где находился с 31.08.2012 г. по 17.09.2012 г. В отделении состояние стабильное, проводилась консервативная терапия: гемостатики (этамзилат, менадиона натрия бисульфит), октреотид, противоязвенная терапия, гепатопротекторы, препараты железа. Рецидива кровотечения не отмечалось. Состояние улучшилось, стул — без признаков мелены, сохранялась анемия, уровень гемоглобина — в пределах 83–92 г/л.
Больной выписан на амбулаторное наблюдение с диагнозом «ЦП, класс В по Чайлд — Пью в исходе ХГС. Портальная гипертензия: ВРВП 4 ст., гепатомегалия. Подозрение на ГЦК в 5 сегменте печени. Состоявшееся кровотечение из ВРВП от 31.08.2012 г. Хроническая анемия смешанного генеза. Гастропатия. Доброкачественная гиперплазия предстательной железы. Аномалия развития верхних мочевых путей: подковообразная почка, без нарушения уродинамики ВМП».
В начале октября 2012 г. в ГКБ № 57 проведено эндоскопическое лигирование вен пищевода по поводу ВРВП.
12.10.2012 г. у больного появилась клиническая картина желудочно-кишечного кровотечения, в связи с чем в экстренном порядке был госпитализирован в ЦКВГ ФСБ РФ.
При поступлении — состояние средней тяжести. Кожные покровы бледные, сухие, теплые. Тошноты, рвоты нет. Температура — 36,5 °С. В сознании, адекватен, ориентирован в пространстве и времени. ЧСС — 90 уд/мин. АД — 120/70 мм рт. ст. ЧДД — 17/мин. Дыхание проводится во все отделы. Язык влажный, обложен белым налетом. Живот мягкий, не вздут, не увеличен, симметричный, участвует в акте дыхания. При пальпации — безболезненный во всех отделах. Перистальтика ослаблена. Дизурии нет. Газы отходят.
Вечером этого же дня пациент отметил рвоту кровью, установлен зонд Блэкмора. В связи с тяжестью состояния больной был переведен в реанимационное отделение. Проводилась инфузионная, спазмолитическая, гемостатическая, антисекреторная терапия. После стабилизации состояния больной переведен в хирургическое отделение. Зонд Блэкмора удален. Состояние пациента оставалось стабильным. Но 19.10.2012 г. появились боли в животе. Проведено УЗИ органов брюшной полости, отмечалось расширение общего печеночного протока, панкреатического протока. При рентгенографии органов брюшной полости патологии не выявлено. На фоне проводимой инфузионно-спазмолитической терапии боли в животе были купированы. Однако 21.10.2012 г. у пациента возник рецидив кровотечения из ВРВП. Переведен повторно в реанимационное отделение, установлен зонд Блэкмора. При динамическом УЗИ органов брюшной полости выявлено большое количество свободной жидкости. Выполнена КТ органов брюшной полости: Заключение: асцит, киста поджелудочной железы, гемангиома 4 сегмента правой доли печени. Двусторонний гидроторакс. Нижнедолевая пневмония. Инфильтрации парапанкреатической клетчатки поджелудочной железы не выявлено. Отмечалось большое количество свободной жидкости в брюшной полости.
В анализе крови — лейкоцитоз до 27×10 9 /л. Для исключения острого панкреатита с ферментативным перитонитом, воспалительных заболеваний органов брюшной полости, пареза кишечника 23.10.2012 г. проведена диагностическая лапароскопия. Интраоперационно выявлен асцит. Другой патологии не выявлено. Выполнены санация и дренирование брюшной полости. На фоне проводимого лечения у пациента отмечались эпизоды рецидива кровотечения из ВРВП. Проводились плазмо- и гемотрансфузии. Несмотря на последующую интенсивную терапию, направленную на коррекцию волемических нарушений, состояние больного прогрессивно ухудшалось. Отмечались психомоторное возбуждение, прогрессирующая дыхательная недостаточность, гипотония. 26.10.2012 г. в 18:30 пациент переведен на ИВЛ, к лечению добавлены вазопрессоры. На фоне прогрессирующей сердечно-сосудистой недостаточности в 19:00 зафиксирована асистолия. Начаты реанимационные мероприятия в полном объеме, интенсивная терапия. Все мероприятия в течение 45 мин были неэффек-
тивны. В 19:45 зафиксирована биологическая смерть.
В отделении причиной смерти указана острая сердечно-сосудистая недостаточность, развившаяся на фоне прогрессирующей полиорганной, сердечно-сосудистой недостаточности.
Основной диагноз: ЦП, класс С по Чайлд — Пью.
Осложнение основного диагноза: портальная гипертензия: ВРВП 4 ст., гепатомегалия. Состоявшееся кровотечение из варикозно расширенных вен пищевода от 12.10.2012 г., 21.10.2012 г., 25.10.2012 г. Постгеморрагическая анемия тяжелой степени. Гастропатия. Асцит. Печеночная недостаточность.
Сопутствующие заболевания: двусторонняя нижнедолевая пневмония. Двусторонний гидроторакс. ИБС: атеросклеротический кардиосклероз, гипертоническая болезнь 2 ст. Язвенная болезнь 12-перстной кишки. Киста поджелудочной железы. Гемангиома 4 сегмента печени.
Патологоанатомический диагноз (после гистологического исследования).
Основное комбинированное заболевание:
Мелкоузловой ЦП.
Операция диагностической лапароскопии 23.10.2012 г.
по поводу подозрения на острый панкреатит с санацией и дренированием брюшной полости.
Фоновые заболевания:
Сахарный диабет (по клиническим данным).
ХГС (по клиническим данным).
Осложнения: варикозное изменение вен пищевода. Эрозивно-язвенный эзофагит нижней трети пищевода с перфорацией в ткани заднего средостения. Гнойный
медиастинит заднего средостения. Эмпиема плевры слева — 3,3 л гнойного экссудата (по данным посмертного бактериологического исследования от 31.10.2012 г.). — Klebsiella pneumoniae, Enterococcus faecalis, Staphylococcus epidermidis. Ателектаз левого легкого. Правосторонний гидроторакс — 0,5 л. Мелкоочаговая бронхопневмония в нижней доле правого легкого. Малокровие оболочек головного мозга и внутренних органов. Асцит (0,4 л). Гепато- и спленомегалия (1375 и 355 г). Мелкоочаговые инфаркты в печени и предстательной железе. Отек правого легкого. Отек головного мозга. Паренхиматозная дистрофия миокарда, почек.
Сопутствующие заболевания: атеросклероз аорты (IV стадия, 3 степень). Мелкоочаговый кардиосклероз миокарда стенок левого желудочка, атеросклероз венечных артерий (IV стадия, 3 степень). Гипертоническая болезнь: эксцентрическая гипертрофия миокарда, стенок левого желудочка (стенка левого желудочка — 1,3 см, масса сердца — 395 г), артерио-артериоло-нефросклероз. Мелкоузловая гиперплазия коркового слоя надпочечников. Железистый тип нодозной гиперплазии предстательной железы. Киста поджелудочной железы. Сахарный диабет 2-го типа (по клиническим данным). Давние операции: аппендэктомия (1972 г.), верхнесрединная лапаротомия (по поводу синдрома Меллори — Вейса, 1995 г.).
Таким образом, при аутопсийном исследовании подтвердился диагноз ЦП и обнаружены: гнойный медиастинит, левосторонняя эмпиема плевры, развившиеся в исходе эрозивно-язвенного эзофагита на фоне сахарного диабета.
Непосредственной причиной смерти больного явилась гнойная интоксикация.
Сличение диагнозов: расхождение диагнозов. Категория II. Причина субъективная — не учтена роль сахарного диабета в развитии гнойных осложнений. Не диагностированы смертельные осложнения: перфорация язв пищевода, гнойный медиастинит с эмпиемой плевры слева. Эндоскопическое исследование проводилось однократно в день поступления, рентгенологически не выявлены тяжелые гнойно-деструктивные изменения в левой плевральной полости и заднем средостении. Причина объективная — тяжесть состояния больного.
источник
Цирроз печени (ЦП) — хроническое прогрессирующее диффузное заболевание разнообразной этиологии с поражением гепатоцитов, выраженными в различной степени признаками их функциональной недостаточности, фиброзом и перестройкой нормальной архитектоники печени, приводящей к образованию структурно-аномальных регенераторных узлов и портальной гипертензии, а в ряде случаев — к развитию печеночной недостаточности.
Смертность от ЦП занимает не последнее место в структуре общей смертности населения, и ее показатели в разных странах составляют 15 — 30 на 100 000 населения.
Классификация.В настоящее время Всемирной ассоциацией по изучению заболеваний печени (г. Акапулько, 1974) и ВОЗ (1978) рекомендовано использовать классификацию, основанную на этиологическом и морфологическом принципах.
• По этиологии различают циррозы: а) вследствие вирусного поражения печени; б) вследствие недостаточности питания; в) вследствие хронического алкоголизма; г) холестатические; д) как исход токсических или токсико-аллергических гепатитов; е) конституционально-семейные; ж) вследствие хронических инфильтраций печени некоторыми веществами с последующей воспалительной реакцией (ге-мохроматоз, гепатоцеребральная дистрофия, или болезнь Вильсона-Коновалова); з) развивающиеся на фоне хронических инфекций (туберкулез, сифилис, бруцеллез); и) прочей этиологии, в том числе возникающие вследствие невыясненных причин (криптоген-ные).
• По морфологическим и отчасти клиническим признакам выделяют
микронодулярный, или мелкоузловой, цирроз (в основном соответ
ствует портальному циррозу прежних классификаций); макроноду-
лярный, или крупноузловой, цирроз (по многим признакам соот
ветствует постнекротическому циррозу); смешанный и, наконец,
билиарный цирроз (первичный и вторичный).
Для микронодулярного цирроза характерны узлы регенерации преимущественно одинакового размера диаметром менее 3 мм и перегородки (септы) одинаковой ширины. При макронодулярном циррозе узлы регенерации крупные, намного больше 3 мм (некоторые из них достигают 5 см), перегородки имеют неправильную форму и разную ширину.
• По активности процесса различают циррозы: а) активные, прогрес
сирующие и б) неактивные.
• По степени функциональных нарушений различают циррозы: а) ком
пенсированные; б) субкомпенсированные; в) декомпенсированные.
Этиология.Из представленной классификации следует, что ЦП является полиэтиологическим заболеванием, однако частота выявления той или иной причины болезни весьма различна. Так, примерно 75 — 80 % ЦП имеют вирусную и алкогольную природу, остальные этиологические факторы встречаются гораздо реже. Частота ЦП невыясненной этиологии составляет, по данным некоторых авторов, до 26 % и более.
Патогенез.Пусковым моментом патологического процесса при ЦП является повреждение гепатоцита, обусловленное воздействием различных этиологических факторов. Гибель паренхимы вызывает активную реакцию соединительной ткани (мезенхимы), что в свою очередь оказывает вторичное повреждающее воздействие на интактные гепатоциты и приводит к формированию ступенчатых некрозов — признаки перехода хронического гепатита в цирроз печени. Гибель гепатоцитов является также основным стимулом регенерации клеток печени, которая протекает в виде концентрического увеличения сохранившегося участка паренхимы; это ведет к образованию псевдодолек.
Некроз гепатоцитов является также одной из основных причин воспалительной реакции (действие продуктов распада клеток). Значительную роль играют воспалительные инфильтраты, распространяющиеся из портальных полей до центральных отделов долек и приводящие к развитию постсинусоидального блока.
Особенностью воспалительного процесса при ЦП является высокая фибропластическая активность, способствующая новообразованию колла-геновых волокон. Важным следствием этих процессов является нарушение кровоснабжения печеночных клеток: формирующиеся соединительнотканные септы, соединяющие центральные вены с портальными трактами, содержат сосудистые анастомозы, по которым происходит сброс крови из центральных вен в систему печеночной вены, минуя паренхиму долек. Кроме того, развивающаяся фиброзная ткань механически сдавливает венозные сосуды в ткани печени; такая перестройка сосудистого русла печени обусловливает развитие портальной гипертензии.
Вышеописанные процессы, способствуя нарушению печеночной гемодинамики и развитию портальной гипертензии, приводят к повторным некрозам, замыкая порочный круг: некроз — воспаление — неофиб рил логе-
нез — нарушение кровоснабжения гепатоцитов — некроз. В развитии портальной гипертензии наибольшее значение имеет сдавление разветвлений воротной вены узлами регенерирующих гепатоцитов или разросшейся фиброзной тканью.
Портальная гипертензия является причиной развития портокавально-го шунтирования, асцита и спленомегалии.
Коллатерали развиваются между бассейном воротной вены и системным венозным кровотоком (портокавальные анастомозы). Из них наибольшее клиническое значение имеют анастомозы в области кардиальной части желудка и пищевода, поскольку кровотечение из варикозно-расши-ренных вен этой области является одним из самых тяжелых осложнений портальной гипертензии, приводящих к летальному исходу.
В развитии асцита, помимо собственно портальной гипертензии, играют роль и другие факторы: 1) падение коллоидно-осмотического давления плазмы в результате снижения синтеза альбумина в печени; 2) гиперальдо-стеронизм, развивающийся как за счет пониженной инактивации альдосте-рона в печени, так и за счет повышенной его выработки в ответ на гиповоле-мию; 3) нарушение функции почек вследствие сниженного почечного кровотока; 4) повышенная лимфопродукция в печени; 5) повышенная секреция вазопрессина, АДГ в ответ на повышение внеклеточной осмолярности.
Спленомегалия также развивается вследствие портальной гипертензии. Помимо застойных явлений, увеличению селезенки способствуют разрастание соединительной ткани и гиперплазия ретикулогистиолимфоци-тарных элементов. Спленомегалия на этом этапе сочетается с гиперспле-низмом: анемией, лейкопенией и тромбоцитопенией, обусловленными повышенным разрушением и частичным депонированием форменных элементов крови в селезенке.
Портальная гипертензия ведет также к значительному отеку слизистой оболочки кишечника (нарушение всасывания и экссудативная энтеро-патия).
Шунтирование в обход паренхимы печени приводит к частичному функциональному отключению ее и развитию бактериемии, эндотоксине-мии, гиперантигенемии, недостаточной инактивации в печени ряда биологически активных веществ (в частности, гормонов альдостерона, эстрогенов, гистамина и др.), недостаточному поступлению в печень гепатотроф-ных веществ (глюкагон, инсулин и пр.).
Серьезным осложнением шунтирования является портокавальная «шунтовая» энцефалопатия, которая может закончиться развитием комы.
Помимо шунтовой (портокавальной, или экзогенной) комы, при ЦП возможно развитие так называемой печеночно-клеточной (собственно печеночной, или эндогенной) комы. Этот вид комы является проявлением гепатоцеллюлярной (печеночно-клеточной) недостаточности. При ЦП может развиться и смешанная кома вследствие обеих названных причин.
Клиническая картина.Проявления ЦП варьируют в зависимости от этиологии, выраженности развития цирротического процесса, степени нарушения функции печени, выраженности портальной гипертензии и активности воспалительного процесса.
При ЦП, как и при гепатитах, отмечаются синдромы: астеновегета-тивный, диспепсический, цитолитический, мезенхимально-воспалитель-ный, или синдром иммунного воспаления, холестатический, геморрагический, синдром гиперспленизма.
Наличие и выраженность всех этих синдромов при различных циррозах печени колеблются в больших пределах, что будет показано при описании клинической картины различных форм цирроза. Общим признаком, с той или иной частотой встречающимся при различных формах ЦП на определенной стадии его развития, является портальная гипертензия.
Из ранних симптомов портальной гипертензии наблюдаются: 1) метеоризм; 2) диспепсические расстройства (снижение аппетита, тошнота); 3) расширение вен брюшной стенки в боковых отделах живота, а в последующем и в области пупка (вплоть до развития «головы медузы»).
Другие клинические проявления выражены при отчетливых проявлениях портальной гипертензии: спленомегалия, асцит, варикозное расширение вен пищевода, желудка, геморроидальных вен, кровотечения из них (ректальные кровотечения нечасты).
При ЦП в большей степени, чем при ХГ, выражен синдром печеноч-но-клеточной недостаточности, проявляющийся геморрагическим диатезом, желтухой, печеночной энцефалопатией.
Заболевание в своем развитии проходят ряд определенных стадий. В начальной стадии (компенсированной), нередко протекающей латентно, без признаков печеночной недостаточности, портальная гипертензия не выражена. Внепеченочные признаки болезни выражены слабо или отсутствуют, лабораторные показатели изменены незначительно или находятся в пределах нормы. Вместе с тем при морфологическом исследовании биоптатов печени обнаруживается характерная картина. В стадии выраженных клинических проявлений (субкомпенсированной) внепеченочные признаки выражены отчетливо, что сочетается с отчетливыми изменениями лабораторных исследований и явными признаками портальной гипертензии.
В терминальной стадии (декомпенсированной) наряду с портальной гипертензией, выраженными внепеченочными признаками имеются клини-ко-лабораторные проявления печеночной недостаточности.
В клинической картине ЦП (вне зависимости от его этиологии и формы) принято выделять активность цирротического процесса, что морфологически выражается в лимфогистиоцитарной инфильтрации портальных трактов, увеличении количества некрозов гепатоцитов, усилении ци-толитического и иммуновоспалительного синдромов, появлении признаков печеночной недостаточности.
Клиническая картина ЦП эволюционирует в зависимости от развития осложнений:
кровотечения из верхних отделов пищеварительного тракта;
печеночные прекома и кома;
вторичная инфекция (главным образом пневмонии);
трансформация в цирроз-рак;
образование конкрементов в желчных путях (при первичном били-
источник
На сегодняшний день, на территории Российской Федерации становится явным тенденция к появлению пациентов с вирусным гепатитом С. Согласно статистике за 5 лет, в 2013 году первично было зарегистрировано 2,1 тысяч человек, в 2014году – 2,2 тысяч человек населения, 2015 году – 2,1 тысяч человек, в 2016 году -1,8 тысяч человек, в 2017 году – 1,8 тысяч. Как можно наблюдать, начиная с 2014 года начинается тенденция к снижению (2,2 тысяч за 2014, против 1,8 тысяч за 2017 года)[1]. Это связано с тем, что, начиная с 2016 года, начинает внедряться экспериментальная противовирусная терапия против гепатита С.
Гепатит С – это вирусное, парентеральное, антропонозное заболевание, поражающее печень, и приводящее к необратимым изменениям печени – цирроз.
Одним из главных осложнений в развитии вирусного гепатита С, или как его еще называют «Ласковый убийца», является цирроз печени[4].
Основной социальной проблемой в распространенности гепатита С является неосведомленность населения о способах передачи болезни, её симптомах, особенно первых проявлений, осложнениях и самое главное способах лечения. С 2014 года на территории Российской Федерации начали внедрять новое лечение против гепатита С, направленное не на ликвидацию симптомов, а на причину болезни – вирус.
Вирус гепатита С может попасть в организм через кровь, так как на воздухе вирус оказывается не активным. На организменном уровне, гепатит С, попадая в кровь, начинает распространяться в печени, попадая через веточки брюшной аорты: правую и левые печеночные артерии. Возбудитель вируса может находиться в печени десятки лет, не вызывая никаких симптомов.
При появлении первых симптомов гепатита С площадь поражения печени может достигать свыше 50%. Частыми проявлениями являются тяжесть в правом подреберье, привкус желчи во рту, желтушность кожных покровов, склер, множественные экскориации из-за отложения желчных кислот в коже, нарушения стула.
Гистологически, все проявления болезни делятся на 3 типа: альтеративные, экссудативные и пролиферативные изменения. Исходя из исследований, было заключено, что первоначальными изменениями являются экссудативные[4]. На гистологическом уровне диагноз гепатит С можно заподозрить при наличии хотя бы одного из следующих признаков:
· Тельца Консильмана – ацидофильные образования, представляющие собой гепатоциты на стадии апоптоза, с пикнотическим ядром. Сам процесс апоптоза запускается гепатоцитами с целью самозащиты, предотвращая дальнейшее развитие вируса, так как вирус жить вне клетки не может[6].
· Отсутствие полиморфноядерных лейкоцитов, но преобладание Т-лимфоцитов.
· Нарушение пролиферации клеток Купфера, что снижает фагоцитарную активность макрофагов печени[7].
· Нарушается упорядоченное строение балок. В свою очередь при регенерации клеточных балок новые элементы могут связывать несколько клеток на разных уровнях. Нарушается цитоархитектоника печени (рис.2)[4].
· Происходит постепенное увеличение печени, за счет расширения междольковых вен и артерий, задержки выведения жидкости и развитие балонной дистрофии печени.
· Неправильное сращение балок, апоптическое состояние гепатоцитов и увеличение междольковых артерий и вен приводит к задержке выведения желчи[6].
· При поздних стадиях гепатоциты начинают терять ядро, цитоплазма может содержать зерна, заполненные каплями желчных пигментов или жира. Возникает жировая дистрофия, характерная для людей с лишним весом[4].
По своему интересен механизм образования телец Консильмана, или гепатоцитов при апоптозе(рис.1). Как уже упоминалось, по одной из теорий, гепатоциты сами запускают процесс апоптоза, с целью предотвратить репликацию вируса, но, в свою очередь, вирус старается подавить данный процесс. В подтверждение данной теории было определено то, что некоторые кодируемые вирусом Гепатита С белки обладают антиапоптозной активностью, подавляющий действие белка р53 – полипептид – активатор апоптоза гепатоцитов[10].
Однако по другой версии, разрушение клетки вызывается действием NK – и Т- лимфоцитами на антигены, локализующиеся на мембране пораженных гепатоцитов. Вторая теория апоптоза является наиболее распространенной. Первый путь, по которому Т-лимфоциты — киллеры вызывают апоптоз, это их непосредственная активность на вирусы. В таких случаях они выделяют перфорин, растворяя стенку гепатоцита, и запускают гранзимы, которые запускают цитолитическую роль лизосом, что приводит к растворению органелл и гибели клетки[9].
Второй путь Т-лимфоцитарного апоптоза направлен на повышенную экспрессию Fas-R (CD 95) на мембране гепатоцитов, что приводит к активации адапторного полипептида FADD, который в свою очередь активирует каспазу 8, активирующая апоптоз гепатоцитов[10].
Рисунок 1. Тельца Консильмана
Рисунок 2. Участки сединительной ткани
Дальнейшее течение вирусного гепатита С зависит от ряда факторов, которые можно разделить на две группы: социальные и гистологические. К социальным факторам можно отнести следующее:
· Наличие вредных привычек: курение, алкоголизм, наркотики. При наличии таких факторов скорость распространения гепатита С и перерождение печени в цирроз происходит значительно быстрее.
· Стрессовые факторы. Активация симпатической нервной системы приводит к повышенной работе гепатоцитов, что приводит к их выработке и гибели.
· Профессия. Работа на вредных производствах, такие как, шахты, цементные заводы, сталелитейные производства, химические и фармацевтические фабрики своими выбросами могут усугубить течение болезни.
· Не соблюдение личной гигиены. Токсины, попадающие в организм через желудочно – кишечный тракт, попадают в печень через систему воротной вены и проявляют токсическое действие на печень, усугубляя болезнь.
· Питание. Соблюдение диеты (рекомендуется лечебный стол №5) щадит печень от вредных факторов: холестерин, канцерогенные факторы, различные минералы и тяжелые металлы.
На гистологическом уровне важными моментами для регенерации является наличие четырех типов клеток:
· Овальные клетки. Считаются производными клеток костного мозга. Увеличение данных клеток является характерным для гепатита С. Овальные клетки могут дифференцироваться как в гепатоциты, так и холангиоциты, что является основой для восстановления цитоархитектоники печени[6].
· Эпителиальные клетки (канал Геринга). Популяция данных клеток способна дифференцироваться в гепатоциты, холангиоциты и эндотелиоциты сосудов. Данные клетки могут полностью вернуть цитоархитектонику печени[3].
· Мезинхимоподобные клетки. Обладают высокой пролиферативной активностью. Образуют островки регенерации, направленные на выполнение функции[6].
· Малые гепатоциты. Клетки меньших размеров, чем зрелые гепатоциты. При больших поражениях печени могут размножаться и вырастать до зрелых размеров[3].
Пролиферация зрелых гепатоцитов играет одну из первых ролей в регенерации печени. Количество бинуклеарных гепатоцитов демонстрируют регенераторные потенции клеток печени. После деления, гепатоцит может либо снова иметь два ядра, либо один. Только клетки с двумя ядрами могут снова делиться. Количество бинуклеарных клеток зависит от степени развитости процесса при гепатите С, так же социальных факторах, которые были указаны выше[9].
На макро уровне цирроз печени представляет собой увеличение печени, особенно правой доли (известны случаи определения нижней границы печени в области гребня подвздошной кости), дряхлость левой доли, повышенная желтушность органа, множественные фиброзные изменения органа. На организменном уровне наблюдаются нарушения липидного, углеводного, белкового обменов, снижение уровня форменных элементов крови, белков плазмы. Объективными признаками являются желтушность кожных покровов, множественные экскориации на коже, малиновый язык, асцит; на поздних стадиях наблюдаются «карамельный», или «фиалковый» запах изо рта, гепатоспленомегалия, гепаторенальная недостаточность, появление «головы медузы» на передней брюшной стенке, печеночный делирий, портальная гипертензия, множественные геморагии.
На гистологическом уровне можно наблюдать следующие изменения:
1. Появление портальной гипертензии из-за разрастания соединительной ткани, изменения архитектоники печени. Наличие лимфо – эозинофильного инфильтраций, располагающиеся в толще паренхимы[10].
2. На поверхности и на разрезе наличие множественных узлов – очаги регенерации гепатоцитов. Такие разрастания приводят к объединению гепатоцитов в неправильные балки, что приводит к повышенному нарушению оттока желчи, и как следствие – застой вывода печеночной порции желчи[11].
3. Снижение макрофагальной активности клеток Купфера, нарушение коллагенового равновесия печени в сторону коллагенизации.
4. Множественные фиброзные изменения – наличие некротизированных гепатоцитов, замещенные соединительной тканью(рис.3)[4].
5. Образование соединительнотканных прослоек между дольками и по ходу выведения желчи, что приводит к закупорке вывода желчи. Гидропическая дистрофия печени[6].
6. Повышенная активность клеток Ито, что приводит к фиброзу печени(рис.4)[11].
Рисунок 3. Фиброзные изменения
Исходом цирроза печени является смерть. Лечения цирроза нет. Единственное лечение – это трансплантация. Все, что можно сделать – это проводить симптоматический прием препаратов, которые не будут оказывать массивного токсического действия на печень.
С недавнего времени, на территории Российской Федерации проводят лечение вирусного гепатита С, что обозначает, что это уже не приговор, как был раньше. В группу по лечению данной болезни включены следующие схемы препаратов[5]:
1. Глицириновая кислота+ Фосфолипиды – 175мг + 325мг ежесуточная доза
2. Гепатопротекторы: Эссенциале, Карсил и так далее.
3. «Золотой стандарт» 2-х фазной терапии: Альфа интерферон – 3 млн. ед. ежесуточно («Реаферон – ЕС», «Роферон», «Интрон» и другие) + Рибавирин
4. 3-х фазная схема терапии: «Рибафирин» + Интерферон пролонгированного действия + Боцепривир(Телапревир) = 6 – 18 месяцев
5. Другие препараты, направленные на симптоматическое лечение.
На сегодняшний день разработаны и внедрены препараты по лечению гепатита С, полностью лишенные побочных эффектов и достигающие 99% эффективность в лечении. Подобные препараты начинают внедряться в России, но через покупки на иностранных рынках. К таким препаратам относятся[4.5]:
1. Ледипасвир – препарат, разработанный на территории Америки. В нашей стране используются более доступные дженерики (аналоги с точно таким же действующим веществом), которые можно приобрести из Индии:
2. Софосбувир – влияет непосредственно на протеазу вируса, тем самым нарушая его репликацию. Так же разработан на территории Америки. В России так же можно найти индийские дженереки:
3. Велпатасвир. Новый препарат для этиологического лечения вирусного гепатита С, что делает препарат не эффективным против других штаммов, в отличие от вышеуказанных лекарств. Особенностью Велпатасвира является то, что он должен применяться только в сочетании с Софосбувиром. Препарат был разработан на территории Германии вместе с учеными из Соединенных Штатов Америки. Индийскими дженериками на территории России являются:
Для таких препаратов существует определенная схема, при приеме которой достигается наилучшая терапия вирусного гепатита С. Наблюдается тенденция к отказу от приема интерферона:
1. Собосбуфир + Рибавирин – 12 недель без перерывов во днях.
2. Ледипасвир + Софосбувир – 12 — 24 недель в зависимости от степени пораженности печени
3. Велпатасвир + Софосбуфир – до 36 недель в зависимости от степени поражения печени вирусом и признаков цирроза печени. Были положительные тенденции к излечению в момент 25% поражения органа циррозом.
На территории Соединенных Штатов Америки схемами лечения для терапии гепатита С используются такие препараты[9]:
1. Софосбувир + Велпатасвир – в течение 12 недель
2. Глекапревир + Пибрентасвир – в течение 12 недель
3. Даклатасвир + Софосбувир – в течение 12 недель как альтернативный вариант лечения.
Изложенные схемы лечения используются для лечения вирусного гепатита С при наличии очагов цирроза печени.
В Соединенных Штатах Америки, где были разработаны непосредственно все вышеизложенные лекарства, уровень больных с гепатитом С не уменьшается, так как остается монополия фармацевтических фирм. В Российской Федерации подобные схемы лечения пациентов с гепатитом С, основанные на индийских дженериках, сочетаются с вышеизложенными препаратами для поддержания иммунитета, общего метаболизма и нормальной функции печени.
На данный момент подобные схемы лечения используются только в высокотехнологических больницах, а пациенты могут получить помощь только по специальным федеральным программам лечения. Ежегодно, на территории России обновляются рекомендации по диагностике и лечению взрослых пациентов с гепатитом С [2].
Приведенные схемы лечения не используются в городах Крыма по причине отсутствия препаратов, неосведомлённости населения и медицинского персонала лечебно–профилактических учреждений. Наличие большого количества дженериков на фармакологическом производстве дает надежду на то, что лечение пациентов с гепатитом С будет доступно всем нуждающимся, включая маленькие города Крыма.
источник
Ретроспективное изучение хронического гепатита С (ХГ С) позволяет говорить, что в среднем у 20% больных в течение 20–30 лет развивается цирроз печени (ЦП). Скорость формирования цирроза зависит от ряда факторов.
Ретроспективное изучение хронического гепатита С (ХГ С) позволяет говорить, что в среднем у 20% больных в течение 20–30 лет развивается цирроз печени (ЦП). Скорость формирования цирроза зависит от ряда факторов. Медленное нарастание фиброза при ХГ С наблюдается у женщин молодого возраста в отсутствие таких факторов, как стеатоз печени, синдром перегрузки железом, злоупотребление алкоголем. Ряд причин обусловливает быстрое формирование ЦП: пожилой возраст при инфицировании, мужской пол, систематическое употребление алкоголя более 50 г/сут, наличие коинфекции вирусов гепатита В и/или ВИЧ, избыточная масса тела (> 28 кг/мІ), гетерогенность по гену гемохроматоза, полиморфизм генов ряда цитокинов, играющих ключевую роль в фиброгенезе. Среднее время развития ЦП у лиц, инфицированных в возрасте после 40 лет и злоупотребляющих алкоголем, составляет 13 лет, а у молодых женщин в отсутствие приема алкоголя ЦП формируется через 42 года. У 32% больных ХГ С протекает стабильно и не сопровождается прогрессированием болезни.
Важным фактором фиброгенеза является сохраняющаяся активность ХГ С по лабораторным данным и морфологическим признакам. У больных со стойко нормальным уровнем трансаминаз сыворотки риск развития ЦП С составляет 5%, в то время как наличие 3–5-кратного повышения АЛТ сыворотки ассоциируется с быстрым формированием ЦП С у 50% больных. Показано также, что факторами риска прогрессирования фиброза являются: наличие фиброза в ткани печени при первой биопсии, стеатоз печени и возраст больных. Быстрота прогрессирования фиброза определяется предшествующим фиброзом, стеатозом и лобулярным гепатитом [1]. При ХГ С низкой степени активности (ИГА по Knodell 4–8 баллов) риску развития ЦП С подвержены 7–10% больных, при ХГ С высокой степени активности (ИГА — более 13 баллов) у 71% больных цирроз может развиться уже через 7 лет. Проспективное изучение 404 больных компенсированным ЦП С показало, что за 85,7±36 мес наблюдения у 28% больных развивается хотя бы одно осложнение ЦП С, в том числе гепатоцеллюлярная карцинома (ГЦК) — у 19%, асцит — у 17%, кровотечение из варикозно расширенных вен пищевода (ВРВП) — у 5%, декомпенсация ЦП С (Чайлд В/С) — у 17%, энцефалопатия — у 2% [2].
Высокая частота развития ЦП С при хронической HCV-инфекции и риск серьезных осложнений в этой группе больных определяют задачи противовирусной терапии (ПВТ). Основная задача лечения — эрадикация вируса гепатита С и достижение стойкой ремиссии ХГ С, однако возможности достижения устойчивого вирусологического ответа (УВО) у больных ЦП С значительно ниже, чем при ХГ С. Исследования последних лет показали, что ПВТ способствует уменьшению выраженности фиброза, поэтому у больных ЦП С без вирусологического ответа целью противовирусного лечения является замедление прогрессирования болезни, снижение риска декомпенсации ЦП и развития его осложнений, в том числе ГЦК, В-клеточной лимфомы, криоглобулинемии, внепеченочных проявлений, портальной гипертензии и печеночно-клеточной недостаточности.
Представляют интерес исследования M. Curry и соавторов (2005), изучивших влияние длительной терапии пегинтерфероном α-2b в малых дозах на динамику портальной гипертензии у больных ХГ С со стадией фиброза F3 и ЦП С (F4). В исследование COPILOT были включены 267 больных, получавших колхицин 0,6 мг 2 раза в день, и 270 больных, которым проводится лечение пегинтроном 0,5 мкг/кг 1 раз в неделю в течение 4 лет. Обе группы были представлены больными, не ответившими на комбинированную терапию интерфероном и рибавирином. 83% больных в каждой группе имели ЦП С, у 40% из них имелись признаки портальной гипертензии, выявленные при эндоскопии (ВРВП или портальная гастропатия). ЭГДС проводилась с интервалом в 2 года. Опубликованы предварительные результаты исследования.
У 5 больных ЦП С, не получавших β-блокаторы с целью коррекции портальной гипертензии, до лечения пегинтроном провели измерение портального давления. Спустя 2 года лечения при повторной ЭГДС новые ВРВП появились у 11 из 66 больных, получавших колхицин, и сохранялись у 5 из 66 больных, получавших монотерапию пегинтроном. У всех 5 больных первоначальное портальное давление составляло 15 мм рт. ст., через 24 нед лечения составило в среднем 6 мм рт. ст. Кровотечение из ВРВП через 2 года отмечено у 11 (9%) больных, получавших колхицин, и у одного (1%) больного, получавшего пегинтрон. Асцит и печеночно-клеточная недостаточность также чаще выявлялись при лечении колхицином (20 больных), чем пегинтроном (13 больных). Таким образом, длительное лечение малыми дозами пегинтрона больных ЦП С может замедлить формирование ВРВП, снизить портальное давление, предотвратить кровотечение из ВРВП и другие осложнения портальной гипертензии у больных ЦП С, не достигших УВО на предшествующую комбинированную терапию интерфероном и рибавирином [3].
В последние годы ПВТ претерпела существенные изменения: с 2000 г. комбинированная терапия пегилированными интерферонами α-2a и 2b и рибавирином заняла ведущие позиции в лечении ХГ С и компенсированного ЦП С. Изучены прогностические факторы ответа на лечение, появились возможности коррекции ряда побочных эффектов ПВТ, что позволило достичь УВО у 56–63% больных ХГ С, включенных в лечение. Приверженность больных к лечению, адекватные дозы препаратов и длительность ПВТ позволяют повысить УВО до 72–75% [4, 5]. Наибольший эффект комбинированной терапии ХГ С отмечается у больных с генотипами 2 или 3 HCV: непродолжительный курс лечения (24 нед) при высокой приверженности к лечению пегилированными ИФН α и рибавирином позволяет достичь успеха в 84–94% случаев.
Повышению эффективности ПВТ способствуют обязательное назначение комбинированной ПВТ (ИФН α и рибавирин) первичным больным, выбор оптимальных доз препаратов и длительности лечения в зависимости от генотипа HCV и вирусной нагрузки. Кроме того, необходима коррекция факторов неблагоприятного ответа на лечение (стеатоз, холестаз, синдром перегрузки железом) и побочных эффектов ПВТ (депрессия, гемолитическая анемия при применении рибавирина, лейко- и тромбоцитопения при лечении ИФН α, дисфункция щитовидной железы). Субоптимальные дозы препаратов, используемых при проведении ПВТ, и недостаточная продолжительность лечения способствуют формированию группы резистентных к противовирусной терапии больных ХГ С, что делает необходимым проведение повторных курсов ПВТ. Так, было показано, что при 48-недельной комбинированной ПВТ УВО достигалось у 72% больных с генотипом 1b HCV и низкой вирусной нагрузкой. Последующее обострение ХГ С отмечалось у 3% пациентов. В то же время при 24-недельной ПВТ УВО отмечался только у 51% больных указанной категории, причем обострение ХГ С и возобновление виремии через 6–18 мес после окончания ПВТ наблюдались у 40% пациентов.
Несмотря на достижения последних лет, остаются категории трудных для лечения больных ХГ С, к которым относятся пациенты с генотипом 1 HCV и высокой вирусной нагрузкой и больные ЦП С.
Генотип 1 HCV и высокая вирусная нагрузка оказались независимыми прогностическими факторами слабого ответа на лечение. Причины этого до конца не ясны. Изучается значение мутаций в E2 и NS5A генах HCV (неструктурный регион NS5A определяет чувствительность к интерферону). Элиминация гепатоцитов, инфицированных генотипом 1 HCV, в процессе ПВТ происходит медленнее, чем при других генотипах. В первые 1–2 нед терапии вирусная нагрузка снижается на 1,6 log копий/мл при генотипе 1 HCV и на 2,9 log копий/мл при генотипе 2. Скорость гибели инфицированных гепатоцитов составляет 0,1 в день у больных с генотипом 1 и 0,26 в день при генотипе 2, что объясняется различиями в иммунном ответе у больных и дает основание для обсуждения необходимости более агрессивной и, возможно, более длительной ПВТ при генотипе 1 HCV [5].
Стратегия лечения больных ЦП и ХГ С, инфицированных генотипом 1 HCV и имеющих высокую вирусную нагрузку, тесно связана. УВО при лечении ИФН α в стандартном режиме больных ХГ С с генотипом 1 HCV не превышает 10% независимо от сроков лечения — 24 или 48 нед. При использовании комбинированной терапии (ИФН α/рибавирин) в течение 48 нед УВО у таких больных возрастает до 28–36%, оставаясь значительно ниже УВО при генотипах 2 и 3 HCV (64–79%). Лечение ХГ С с генотипом 1 HCV в течение 48 нед дает более высокие результаты (46–52%), чем 24 нед (29–42%). Таким образом, генотип вируса HCV определяет стратегию ПВТ ХГ С и ЦП С.
Уровень вирусной нагрузки, как и генотип вируса, не влияет на вариант и тяжесть течения ХГ C. Высокая вирусная нагрузка (более 2х10 6 копий/мл или более 800 000 МЕ/мл) может быть выявлена при хроническом гепатите низкой, умеренной, высокой степени активности, при минимальных изменениях в печени или при ЦП С. Однако уровень виремии отчетливо влияет на частоту достижения УВО: пегилированный ИФН α-2b 1,5 мкг/кг 1 раз в неделю в комбинации с рибавирином в дозе 800 мг/сут при высокой вирусной нагрузке обеспечивает УВО в 42% случаев, а при низкой — в 78%.
В последние годы разработан метод оценки успеха терапии на основании изучения вирусной кинетики на ранней стадии ПВТ. Ранний вирусологический ответ позволяет прогнозировать УВО. Высокая приверженность больных ХГ C к лечению и оценка прогноза ПВТ на основании данных раннего вирусологического ответа на 4-й или 12-й неделе позволили повысить результативность терапии в группе всех леченных больных ХГ С до 90%. Отказ от стандартных схем лечения ИФН α (3 млн МЕ 3 раза в нед) с переходом на комбинированную ПВТ также способствует повышению количества больных с ранним вирусологическим ответом.
Изучение раннего вирусологического ответа на основании количественного анализа HCV-РНК с помощью высокочувствительной ПЦР позволяет идентифицировать больных, которые не ответят на ПВТ. Если после 12-недельной ПВТ пегилированными ИФН α и рибавирином уровень HCV-РНК снизился на два и более десятичных логарифмов, но РНК вируса по-прежнему выявляется в крови, то целесообразно продолжить ПВТ еще в течение 12 нед, а затем провести повторное исследование HCV-РНК. При его отрицательном результате УВО колеблется от 42 до 78% в зависимости от вирусной нагрузки. Представляется целесообразным 72-недельный курс ПВТ, т. е. продление лечения до 1,5 лет, что позволяет значительно улучшить результаты лечения. При сохраняющейся виремии с падением ее уровня на 12-й неделе менее чем на два десятичных логарифма УВО составляет от 0 до 5%, что позволяет уже на ранних этапах либо отказаться от бесперспективной терапии при генотипе 1 HCV, либо модифицировать ее, либо перейти на поддерживающую терапию пегилированным ИФН α-2а (90 мкг) или ИФН α-2b (0,5 мкг/кг) с целью замедления прогрессирования ЦП С и профилактики развития ГЦК и лимфомы.
Таким образом, генотип 1b и высокая вирусная нагрузка определяют категорию «трудных» для лечения больных ХГ C. В отношении этой группы пациентов необходимо строго следовать правилу применения максимально эффективных доз пегилированных ИФН α-2b (1,5 мкг/кг) или ИФН α-2a (180 мкг) в сочетании с рибавирином в дозе выше 13 мг/кг при продолжительности лечения 48–52 нед. Известно, что пегилированные ИФН α-2a и 2b отличаются друг от друга по фармакокинетике и фармакодинамике. Была проведена независимая сравнительная оценка кинетики вирусологического ответа на пегилированные ИФН α-2a в дозе 180 мкг/нед и ИФН α-2b в дозе 1,5 мкг/кг/нед при их сочетании с рибавирином в дозе 15 мг/кг/сут у первичных больных ХГ C. В конце курса лечения вирусологический ответ на комбинированную терапию пегИФН α-2a/рибавирином и пегИФН α-2b/рибавирином у пациентов с генотипом 1 HCV составил 55% и 76% соответственно, что позволяет рекомендовать применение пегИФН α-2b в составе комбинированной ПВТ у данной категории больных [6]. В настоящее время ряд авторов предлагают оценивать ранний вирусологический ответ на 4-й неделе и при отсутствии вирусологического ответа модифицировать лечение. Используется индукционная терапия пегилированным ИФН α-2b в дозе 3 мкг/кг/нед в течение 4 неделе или 2 мкг/кг/нед в течение 8 нед с последующим применением препарата в дозе 1,5–1,0 мкг/кг/нед.
Тройная схема комбинированной ПВТ с включением помимо пегилированного ИФН α и рибавирина 200 мг амантадина не имеет преимуществ перед обычной схемой в лечении ХГ C генотипа 1b с высокой вирусной нагрузкой.
В 2004 г. опубликованы предварительные результаты лечения больных с генотипом 1 HCV и высокой вирусной нагрузкой, не ответивших на первый курс ПВТ ИФН α и рибавирином, комбинацией α-тимозина-1 (1,6 мг 2 раза в неделю подкожно), пегилированного ИФН α-2a (180 мкг в неделю) и рибавирина (1000–1200 мг/сут) в течение 24 недель. Ранний вирусологический ответ на 12-й неделе лечения достигнут у 47,8% больных, вирусологический ответ после 24 нед терапии сохранялся у 39,1% пациентов ХГ C, представляющих «трудную» для лечения группу. Дополнительный препарат (α-тимозин-1) не добавлял новых побочных эффектов и хорошо переносился больными.
Новые стратегии в лечении «трудных» больных с генотипом 1 HCV и высокой вирусной нагрузкой включают продление сроков комбинированной ПВТ до 72 нед у пациентов, не достигших раннего вирусологического ответа на 4-й неделе, что позволяет повысить УВО с 22% (при 48-недельной терапии) до 51% и снизить частоту обострений [7].
Обоснованием для лечения ХГ C с продвинутой стадией фиброза или сформировавшимся ЦП С стали данные о снижении риска декомпенсации ЦП и развития ГЦК, а также регрессе фиброза у 60% больных, получающих ПВТ. Наличие портального фиброза или ЦП С считается независимым фактором низкой частоты УВО у HCV-инфицированных больных. Пациенты с ЦП C обычно плохо отвечают на стандартную монотерапию ИФН α: УВО составляет от 5 до 20%. Эффективность комбинированной терапии ИФН α и рибавирином составила в этой группе 5–29%. Применение пегилированных ИФН α в составе комбинированной терапии компенсированного ЦП C или ХГ С с мостовидным фиброзом позволило повысить УВО до 44–50%.
Следует отметить, что даже при монотерапии пегилированным ИФН α можно достигнуть гистологического улучшения у 54% больных компенсированным ЦП С. В сравнительном исследовании эффективности пегилированных ИФН α-2a и 2b у больных ЦП C наличие мостовидного фиброза являлось отрицательным прогностическим фактором достижения раннего вирусологического ответа. В конце 24-недельной ПВТ вирусологический ответ в 1-й группе больных ЦП C составил 83%, во 2-й — 60%. Таким образом, пегилированный ИФН α-2a может быть препаратом выбора в комбинированной терапии ЦП C [8]. Даже при отсутствии вирусологического ответа на комбинированную ПВТ при ЦП C отмечается улучшение гистологической картины в печени (снижение ИГА и ГИС).
Наиболее значимое улучшение морфологических данных имеет место при достижении УВО, что сопровождается улучшением качества жизни больных ЦП С, несмотря на наличие продвинутой стадии болезни. Интерес представляют данные Poynard и соавторов (2000), наблюдавших 3010 больных ХГ С с повторной биопсией печени (до начала ПВТ и спустя 6–12 мес после ее окончания) при использовании различных режимов лечения: монотерапии ИФН α-2b, комбинированной ПВТ ИФН α или пегилированным ИФН α-2b и рибавирином в течение 48 нед. Более чем у трети больных, у которых был достигнут УВО, улучшилась гистологическая картина (ГИС и ИГА) в печени, морфологическая динамика отмечена также у трети больных без вирусологического ответа [9]. Анализ биопсий печени у больных ХГ С, участвовавших в четырех многоцентровых исследованиях, показал, что у 75 (49%) из 153 пациентов ЦП С после окончания терапии ГИС (уровень фиброза) снизился на 1–3 балла, что позволяет говорить о возможности регресса фиброза при ЦП С под влиянием настойчивой целенаправленной ПВТ [10].
В последние годы предпринимаются попытки противовирусного лечения декомпенсированного ЦП С (Чайлд В и С). Известно, что 40% всех ортотопических трансплантаций печени проводится в связи с ЦП С. Больные с сохраняющейся виремией имеют высокий риск реакций отторжения трансплантата и инфицирования донорской печени вирусом гепатита С с быстрым развитием (в течение 5–7 лет) ЦП С и/или ГЦК в пересаженной печени. В 2003–2004 гг. появились первые публикации использования ПВТ малыми дозами интерферона и рибавирина при декомпенсированном ЦП С у кандидатов на трансплантацию печени. Предлагается начинать лечение ИФН α 3 млн МЕ ежедневно и рибавирином 800 мг/сут за 4 мес до предполагаемой операции. Режим ежедневного введения интерферона позволяет уменьшить частоту гриппоподобного синдрома, лечение в течение 4 мес позволяет добиться максимального снижения виремии (до операции). У 9 (30%) из 30 больных декомпенсированным ЦП С (Чайлд В или С) удалось достичь вирусологического ответа на 12-й неделе, у 6 из них (20%) авиремия сохранялась после трансплантации печени [11]. Аналогичные данные о возможности развития УВО в 18–20% случаев декомпенсированного ЦП С опубликованы рядом авторов, длительность наблюдения за такими больными продолжается более 3,9 лет.
Известно, что употребление алкоголя значительно повышает смертность при вирусных ЦП: пятилетняя выживаемость больных достигает лишь 43%, значительно отличаясь в группах ЦП Чайлд А (66%), Чайлд В (50%) и Чайлд С (25%). При продолжающемся приеме алкоголя риск смерти у больных ЦП С повышается в случае наличия таких факторов, как пожилой возраст, печеночно-клеточная дисфункция (Чайлд В или С), желудочно-кишечное кровотечение, коинфекция (HBV, HCV), курение и отсутствие признаков острого алкогольного гепатита при биопсии печени. Среди механизмов влияния алкоголя на прогрессирование HCV-инфекции отмечают активацию репликации, повышение разнообразия квазивидов и мутаций вируса, усиление апоптоза гепатоцитов, подавление иммунного ответа хозяина, нарастание стеатоза и уровня железа в печени. Все это ведет к быстрому развитию болезни, высокой частоте формирования ЦП С и ГЦК и низкой эффективности интерферонотерапии. Эффективность ПВТ при ХГ С у лиц, употребляющих алкоголь, в 3 раза ниже стандартных показателей УВО: при монотерапии ИФН УВО снижается до 7–8% по сравнению с 25% у больных, не употребляющих алкоголь; при комбинированной терапии — до 12–4% по сравнению с 41%. Не существует безопасных доз алкоголя для больных ХГ С. Рекомендуется полный отказ от его приема за 6 мес до предполагаемой ПВТ, что улучшает результаты противовирусного лечения, однако УВО не достигает показателей, свойственных больным, не употреблявшим алкоголь в прошлом. Возврат к приему алкоголя после окончания ПВТ повышает риск обострения ХГ С и возврата виремии.
У больных ХГ С на стадии цирроза или при наличии мостовидного фиброза (F3) риск развития побочных эффектов интерферонотерапии выше, чем при менее продвинутых стадиях фиброза. Показано, однако, что частота их выявления и необходимость прекращения ПВТ существенно не отличаются в группах больных, леченных пегилированным ИФН α или ИФН α в стандартном режиме. Пегилированный ИФН α-2а обладает более выраженным миелосупрессивным действием, чем ИФН α-2b. Гематологическая токсичность при применении пегилированных ИФН α проявляется в первые 4 нед лечения, затем достигается устойчивый уровень лейкоцитов и тромбоцитов. Особенно быстро их число снижается после первой дозы препаратов. ПВТ назначают больным компенсированным ЦП С с уровнем лейкоцитов 3000/ммЁ и тромбоцитов 50 000/ммЁ. При снижении уровня нейтрофилов до 600/ммЁ, а уровня тромбоцитов до 20 000/ммЁ ИФН α отменяют.
Модификация дозы пегилированного ИФН α или рибавирина (снижение дозы или отмена препарата) в связи с побочными эффектами отмечена у 50% больных ЦП С. В зависимости от достижения раннего вирусологического ответа на 12-й неделе лечения предложены различные варианты лечения ЦП С: продолжение комбинированной терапии в максимально эффективных дозах в течение 36 нед при достижении раннего вирусологического ответа; лечение небольшими дозами пегилированного ИФН α-2b (0,5 мкг/кг) в течение 5 лет при отсутствии такого ответа на 4-й нед (EPIC3) или малыми дозами пегилированного ИФН α-2а (90 мкг) в течение 4 лет (HALT-С).
Определены показания к повторным курсам ПВТ: наличие генотипов 2 или 3 НСV; частичный ответ при предшествующем курсе ПВТ, F3- и F4-стадии фиброза. Противопоказаниями к повторным курсам лечения являются: пожилой возраст, генотип 1, ЦП С с гипербилирубинемией, высокая вирусная нагрузка, высокий индекс массы тела, минимальные изменения в печени при биопсии (ИГА менее 4 баллов) и продолжающееся употребление алкоголя или наркотиков.
Таким образом, ПВТ компенсированного и декомпенсированного ЦП при ХГ С решает ряд следующих задач: замедление декомпенсации цирроза, снижение смертности от его осложнений (кровотечение из варикозно расширенных вен, печеночно-клеточная недостаточность и т. д.), предотвращение развития ГЦК и профилактику реактивации инфекции после трансплантации печени, а также улучшение качества жизни больных и обеспечение их социальной реабилитации. Несомненно, что на ранних стадиях HCV-инфекции ПВТ дает лучшие результаты: частота УВО при лечении острого гепатита С достигает 90%, ХГ С — 60–70%, что превышает эффективность лечения ЦП С пегилированными ИФН α и рибавирином (30–50%). Наш опыт ПВТ ХГ С низкой степени активности позволяет говорить о высокой эффективности лечения данной категории больных. Используя пегилированный ИФН α-2b (1,5 мкг/кг) и рибаверин (более 10,6 мг/кг) при лечении первичных больных с небольшим сроком заболевания (5,9±5,7 лет), преимущественно низкой степени активности и слабым фиброзом (F1), а также низкой вирусной нагрузкой, мы получили устойчивый вирусологический ответ в 86 % случаев, в том числе у 77% пациентов с генотипом 1 HCV, включая 5 больных на стадии ЦП С [12].
- Collier J. D., Woodall T., Wight D. G. D. et al. Predictiv of progressive hepatic fibrosis stage on sabsequent liver biopsy in chronic hepatitis C virus infection. J. Viral Hepatitis, 2005; 12: 74-80.
- Niederau C., Lange S., Heintgest T. et al. Prognosis of chronic Hepatitis C: Results of a Large, Prospective Cohort Study. Hepatology, 1998; 28: 1687-1695.
- Curry M., Cardenas A., Afdhal N. H. Effect of maintenance Peg-Intron therapy on portal hypertension and its complications: results from the COPILOT study. J. Hepatol., 2005; 42 (2): 95.
- Fried M. W., Shiffman M., Reddy R. et al. Peginterferon alfa-2a plus ribavirin for chronic hepatitis C virus infection. N Engl J. Med., 2002; 347: 975-982.
- Manns M., McHutchison J., Gordon S. et al. Peginterferon alfa-2b plus ribavirin compared with interferon alfa-2b plus ribavirin for initial treatment of chronic hepatitis C: a randomized trial. Lancet, 2001; 358: 958-965.
- Luise S., Bernardinello E., Cavalletto L. et al. Kinetic of Virolological Response Duning Peg-IFNS in Chronic Hepatitis C. J. Hepatol 2004; 40 (1): A 490.
- Berg T., von Wagner M., Hinrichsen H. et al. Comparison of 48 or 72 weeks of treatment with pegiterferon alfa-2a (40 KD) (Pegasys) plus ribavirin (Copegus) in treatment-naive patients with chronic hepatitis C infected with HCV genotype 1 [Abstract]. Hepatology 2003; 38 (1): 317A.
- Hadziyannis S. J., Papatheodoridis G. V. Peginterferon-(2a (40 kDa) for chronic hepatitis C. Expert Opin. Pharmacother. 2003; 4:541-551.
- Poynard T., Marcellin P., Lee S. S. et al. Randomised trial of interferon alpha 2b plus ribavirin for 48 weeks or for 24 weeks versus interferon alpha 2b plus placebo for 48 weeks for treatment of chronic infection with hepatitis C virus. Lancet 1998; 352:1426-1432.
- Poynard T., McHutchison J., Manns M. et al. Impact of Pegylated Interferon Alpha-2b and Ribavirin on Liver Fibrosis in Patients with Chronic Hepatitis C. Gastroenterol. 2002; 122: 1303-1313.
- Forns X., Navasa M., Rodes J. Treatment of HCV Infection in Patients With Advanced Cirrhosis. Hepatology, 2004; 40: 498.
- Никулкина Е. Н., Крель П. Е., Лопаткина Т. Н. и др. Комбинированная терапия пегинтерфероном альфа-2b (пегинтроном) и рибавирином (Ребетолом) у первичных больных хроническим гепатитом C // Клиническая фармакология и терапия. — 2004. — № 13 (2). — С. 48-52.
Т. Н. Лопаткина, кандидат медицинских наук, доцент
источник