Болезни печени: гепатозы, гепатиты, цирроз печени. Осложнения и причины смерти при циррозах печени. Алкогольная болезнь: ее виды и патоморфологические проявления.
Уровень современной медицины требует от врача максимально точной диагностики заболеваний с указанием (там, где это возможно) их этиологии. Это полностью относится к диагностике заболеваний печени, поскольку метод биопсийного исследования открывает большие возможности в раскрытии этиологии болезней печени и назначении высокоэффективного этиотропного лечения. В настоящее время одним из основных методов прижизненной диагностики заболеваний печени является гистологическое исследование печеночного биоптата. Широкое применение этого метода в клинике сформировало новое направление в медицине — клиническую гепатологию.
Классификация болезней печени.
5. Врожденные аномалии строения (кистозная печень)
ГЕПАТОЗЫ — группа острых и хронических заболеваний печени, преобладающими при которых являются дегенеративные изменения паренхимы. Среди гепатозов выделяют наследственные формы, которые не так редки: наследственные липидозы, наследственные гликогенозы, наследственный пигментный гепатоз (болезнь Вильсона-Коновалова). Многие из этих болезней заканчиваются циррозом печени. Приобретенные гепатозы делятся на острые и хронические.
ОСТРЫЙ ГЕПАТОЗ: токсическая дистрофия печени (прогрессирующий массивный некроз печени; острая желтая дистрофия печени). Развивается при экзогенных отравлениях гепатотропными ядами (ядовитые грибы, гелиотроп, соединения фосфора, мышьяка), а также при эндогенных интоксикациях (сепсис, тиреотоксикоз, токсикоз беременных). Токсическая дистрофия печени может иногда развиваться при острых вирусных гепатитах — т.н. острый вирусный гепатит с массивными некрозами печени. Токсическая дистирофия печени не всегда является острым процессом — она может быть подострой или даже хронической, растягиваясь на месяцы до одного года и более.
Патологическая анатомия. Выделяют начальную стадию желтой дистрофии, когда происходит жировая дистрофия гепатоцитов в центрах долек, далее развивается их некроз с аутолитическим распадом и резорбцией, печень имеет желтый цвет, вначале может несколько увеличиваться в размерах, затем, с 3-4 дня, ее размеры быстро уменьшаются (почти вдвое), цвет становится серовато-глинистым. Данная стадия продолжается в течение 2 недель. Нередко развивается асцит. С 3-й недели цвет печени меняется и она становится красной (стадия красной дистрофии). Это связано с тем, что некротический детрит в центре долек резорбируется, а освободившиеся от давления клеток капиллярные синусоиды переполняются
кровью. При большом объеме поражения печени больные умирают от острой печеночной недостаточности. Если смерть не наступает, в дальнейшем формируется постнекротический мультилобулярный цирроз печени. ХРОНИЧЕСКИЙ ГЕПАТОЗ: жировая дистрофия печени (жировой стеатоз печени). Развивается при хроническом токсическом воздействии на печень (алкоголь, инсектициды, хлороформ, некоторые лекарственные препараты), при сахарном диабете и общем ожирении, при кишечных инфекциях (дизентерия, сальмонеллезы, кишечная колиинфекция, кишечная стафилококковая инфекция).
Алкогольный стеатоз печени (ожирение печени) развивается под воздействием на гепатоциты этанола. Этанол вызывает гиперлипидемию и одновременно стимулирует синтез в гепатоцитах жирных кислот и их эстерификацию с образованием триглицеридов. Отложение несгораемых жиров в гепатоцитах облегчается также и низким потреблением алкоголиками липотропных веществ (белковая пища). Основным морфогенетическим механизмом алкогольного стеатоза является инфильтрация. Макроскопически печень увеличена, часто неравномерно, преимущественно за счет правой доли. Цвет ткани от коричневатого до желтого. Липиды при алкогольном стеатозе накапливаются преимущественно в центральных и промежуточных отделах дольки, при выраженном стеатозе липиды распределяются повсеместно. Жировая дистрофия гепатоцитов при алкогольной болезни обычно сочетается с различными видами белковой дистрофии — гидропической, баллонной, зернистой. Иногда несколько рядом расположенных гепатоцитиов с крупными жировыми вакуолями сливаются и образуют жировую кисту; вокруг нее развивается воспалительная реакция, иногда с наличием гигантских клеток.
Жировая дистрофия печени при алкогольной болезни процесс обратимый и через 2-4 недели после полного прекращения приема алкоголя жир из печени исчезает. Исчезновение жира начинается с центральных отделов
долек. Для алкогольного стеатоза характерно развитие перивенулярного фиброза (склероз вокруг центральных вен) — начальной стадии цирроза печени. Этим признаком алкогольный стеатоз отличается от жировой дистрофии печени при сахарном диабете и ожирении. Другой особенностью алкогольного стеатоза является сидероз купферовых клеток печени.
Гепатиты — группа острых и хронических заболеваний печени, преобладающими при которых являются очаговые или диффузные воспалительные изменения печеночной ткани. Различают первичные и вторичные гепатиты. Первичные инфекционные гепатиты в основном представлены вирусными и лептоспирозными. К первичным неинфекционным гепатитам можно отнести токсические гепатиты — алкогольный, медикаментозный. Вторичные инфекционные гепатиты развиваются при многих тяжелых инфекционных заболеваниях — пневмонии, перитониты, сепсис, малярия и др.
В настоящее время насчитывают 7 типов вирусных гепатитов: А,B,C,D,E,F,G. Из них 3 типа — А, Е и F передаются алиментарным путем (эпидемический гепатит, болезнь Боткина), все же остальные — это сывороточные гепатиты, передающиесчя парентерально. Среди сывороточных гепатитов наибольшую актуальность имеют 2 типа — В и С, которые часто ассоциируются друг с другом, вызывая тяжелые прогрессирующие поражения печени, плохо поддающиеся лечению, и имеющие высокую вероятность трансформации в цирроз и рак.
Различают следующие формы острого вирусного гепатита (эпидемического и сывороточного): классическая циклическая с желтухой, безжелтушная, холестатическая и гепатит с массивными некрозами печени (см. острую токсическую дистрофию печени).
Маркеры вирусного поражения печени: наличие частиц вируса (при электронной микроскопии); присутствие вирусных антигенов (обычно HBs-Ag), выявляемое гистологически и иммуногистохимически; белковая дистрофия гепатоцитов (гидропическая и баллонная), коагуляционный некроз гепатоцитов с появлением телец Каунсильмена, воспалительный инфильтрат из макрофагов и лимфоцитов, появление матово-стекловидных гепатоцитов, «песочные» ядра, мультилобулярный цирроз печени в финале.
Хронические вирусные гепатиты делятся на хронические активные (агрессивные) и хронические неактивные (персистирующие). Хронический активный (агрессивный) гепатит (ХАГ) обычно связан с вирусами гепатита В и С — отмечается белковая дистрофия гепатоцитов, некроз гепатоцитов на периферии долек, воспалительная инфильтрация проникает в центр долек, окружая и разрушая гепатоциты. В исходе формирование цирроза печени.
Хронический неактивный гепатит (ХНГ) — дистрофические изменения гепатоцитов имеются, но некрозы отсутствуют, воспалительная инфильтрация сосредоточена только в перипортальных трактах, отмечаются склеротические изменения долек. Вероятность трансформации в цирроз мала.
Считается доказанным, что развитие алкогольного гепатита начинается с появления в гепатоцитах алкогольного гиалина (тельца Мэллори). Алкогольный гиалин представляет собой результат извращенного синтеза гепатоцитами фибриллярных цитоплазматических белков (возможно, имеющих отношение к цитоскелету клетки). Алкогольный гиалин обладает антигенными и хемотаксическими свойствами, стимулирует лимфоциты и макрофаги, активирует коллагенообразование фибробластами, вызывает хемотаксис ПМЯЛ. Появление большого количества алкогольного гиалина в гепатоцитах является плохим прогностическим признаком. Помимо этого для алкогольного гепатита характерны гидропическая и жировая дистрофия гепатоцитов, некрозы групп гепатоцитов, в дальнейшем центролобулярные некрозы, наличие среди клеток воспалительных инфильтратов большого количество ПМЯЛ, сидероз купферовых клеток. При длительном течении алкогольного гепатита может сформироваться монолобулярный септальный цирроз печени. Однако есть данные, согласно которым цирроз при алкогольном поражении печени возникает лишь при наличии сопутствующего хронического вирусного гепатита В (или С).
Маркеры алкогольного поражения печени: жировая дистрофия гепатоцитов, очаги колликвационного некроза гепатоцитов, воспалительный инфильтрат, содержащий большую примесь ПМЯЛ, гемосидероз купферовых клеток, перивенулярный фиброз, монолобулярный септальный цирроз печени.
Развиваются при длительном употреблении гепатотоксических медикаментов: тетрациклин, пуромицин, анаболические стероиды, противозачаточные стероидные гормоны, изониазид, ипрониазид. Установлено, что среди всех больных с желтухами у 2-5% имеется медикаментозное поражение печени.
Морфологические маркеры лекарственного поражения печени: жировая дистрофия гепатоцитов, очаги колликвационного некроза вокруг центральных вен, наличие большого количества эозинофилов в воспалительных инфильтратах, образование неспецифических гранулем, поражение желчных капилляров с развитием холестаза в периферических отделах долек, монолобулярный цирроз печени.
Хроническое заболевание печени, основой которого является извращенная регенерация печеной ткани в ответ на ее острые или хронические повреждения. В зависимости от этиологических факторов циррозы делят на инфекционные (в первую очередь вирусные), токсические (в первую очередь алкоголь и его суррогаты, а также лекарственные препараты), обменно-алиментарный (недостаточность белков, витаминов, липотропных факторов,
циррозы при тезаурисмозах), холестатический, застойный (кардиогенный) цирроз. Могут быть врожденные циррозы у детей, связанные с внутриутробной инфекцией вирусами гепатита В, цитомегалии или герпеса. Среди наших больных наиболее часто встречаются вирусные и алкогольные циррозы печени.
Общая патоморфология циррозов печени.
Независимо от вида цирроза и стадии заболевания печень с поверхности и на разрезе всегда бугриста, узловата или зерниста, а на ощупь
плотная. В начале процесса печень может быть увеличена в размерах, в дальнейшем она может уменьшаться из-за нарастания атрофических процессов. Наиболее крупная по размерам цирротическая печень — при алкогольном циррозе, атрофические формы цирроза более характерны для постнекротических его форм. Величина узловатых разрастаний в печени при циррозе зависит от его вида, соответственно чему различают 2 основных морфологических вида циррозов — мелкоузловой и крупноузловой. Данные узловатые разрастания представляют собой узлы-регенераты, которые построены преимущественно из ложных долек и соединительной ткани. Образование при циррозе печени ложных долек является основным морфогенетическим событием.
Что такое ложная долька и чем она отличается от истинной печеночной дольки ? Ложная долька представляет собой продукт извращенной регенерации печеночной ткани и в отличие от истинной дольки лишена нормальной архитектоники своего строения (нет радиального расположения печеночных балок, центральные вены могут отсутствовать или располагаться эксцентрично, триады неполные и могут также отсутствовать). Ввиду нарушенного строения ложные дольки не могут нормально функционировать: из-за нарушения притока крови нет полноценной конъюгации гепатоцитами токсичного первичного билирубина и нет качественной детоксикации кишечных метаболитов (отсюда печеночноклеточная недостаточность при циррозах с клинической картиной прогрессирующей хронической токсической энцефалопатии), из-за нарушения архитектоники желчных капилляров образующаяся желчь не выводится полностью из дольки в кровь и развивается паренхиматозная (печеночная) желтуха. Недостаточное поступление в кишечник желчи приводит к нарушению эмульгирования и всасывания жиров, развивается вторичная мальабсорбция с потерей веса, гиповитаминозами А,Д,Е, К, замедлением свертывания крови, появлением сосудистых «звездочек» на коже.
Существует 2 основных морфогенетических механизма образования ложных долек при циррозе печени. Первый — при хронических активных гепатитах, когда воспалительная инфильтрация проникает в глубину долек, соединительная ткань по стихании воспаления также врастает вглубь дольки и как бы отхватывает, «откусывает» часть дольки. Из этого отделившегося фрагмента формируется в дальнейшем ложная долька, которая лишена собственных сосудов и желчных капилляров. Таким же путем формируются ложные дольки при хроническим венозном застое в печени (застойный кардиогенный цирроз печени через стадию «мускатной» печени). Разрастающаяся в печени соединительная ткань имеет вид тонких прослоек. Данный морфогенетический механизм лежит в основе формирования монолобулярного мелкоузлового (микронодулярного) цирроза печени (септальный цирроз печени), который является сравнительно доброкачественным по своему течению.
Второй механизм реализуется при развитии в печени массивных некрозов паренхимы (т.н. постнекротический цирроз печени). При этом происходит гибель обширных участков печеночной паренхимы, и источником ее последующей регенерации (если больной не умирает в стадию острой печеночной недостаточности) являются сохранившиеся небольшие островки из уцелевших гепатоцитов, часто расположенных друг от друга на значительном расстоянии. Сохранившиеся гепатоциты, лишенные стромального каркаса (который управляет регенерацией гепатоцитов), начинают регенерировать хаотично, что приводит к формированию ложных долек (мультилобулярный цирроз). Отличием данной формы цирроза от предыдущей является образование крупных узлов-регенератов (макронодуляный цирроз) с грубыми прослойками соединительной ткани. Разрастающаяся при циррозах печени соединительная ткань резко нарушает внутрипеченочную гемодинамику и выведение желчи по желчным протокам (кровеносные сосуды и желчные протоки сдавливаются и склерозируются). В результате возникают печеночная желтуха и что особенно важно — портальная гипертензия. Последняя сопровождается компенсаторным расширением коллатеральных венозных сосудов — портокавальные и кавакавальные анастомозы (вены передней стенки живота, вены слизистой желудка и нижней трети пищевода, вены париетальной брюшины, геморроидальные вены) и образованием асцита. Расширенные вены пищевода и слизистой желудка могут быть источником тяжелых пищеводно-желудочных кровотечений, скапливающаяся в полости брюшины асцитическая жидкость может инфицироваться из кишечника и приводить к развитию асцит-перитонита. Таким образом, при циррозах печени в стадию декомпенсации процесса развиваются: печеночная недостаточность, желтуха, портальная гипертензия с асцитом и асцит-перитонитом, пищеводно-желудочные кровотечения. Возможна также трансформация узлов-регенератов в гепатому — рак печени.
Хронический алкоголизм — понятие больше социальное и социально-юридическое. Медицинским эквивалентом этому является термин «алкогольная болезнь».
Клинико-морфологические формы алкогольной болезни.
1. Алкогольные поражения печени (гепатическая — стеатоз, гепатит, цирроз);
2. Алкогольная кардиомиопатия (кардиальная — жировая дистрофия миокарда с его умеренной гипертрофией и дилатация полостей сердца и сердечной недостаточностью);
3. Алкогольная энцефалопатия (мозговая) и нейропатия (алкогольные полиневриты).
4. Алкогольная нефропатия (ренальная — хронические гломерулонефриты и гломерулопатии, острый и хронический тубуло-интерстициальный нефрит, острая почечная недостаточность при отравлении суррогатами алкоголя — «токсическая почка»);
5. Поражения поджелудочной железы и ЖКТ (гастро-панкреатическая — хронический атрофический гастрит, хронический калькулезный панкреатит);
Этиологическими факторами гепатитов являются многие из тех, которые вызывают гепатозы: алкоголь, лекарственные препараты. Вместе с тем имеется большое количество инфекционных гепатитов, среди которых основное значение имеют вирусные гепатиты.
Не нашли то, что искали? Воспользуйтесь поиском:
источник
Некроз печени – это опасное патологическое состояние, которое возникает на фоне заболеваний органа, сильной интоксикации организма, нарушения кровообращения или травмы и сопровождается гибелью печеночных клеток – гепатоцитов. Недуг быстро прогрессирует, что приводит к развитию полиорганной недостаточности или коме.
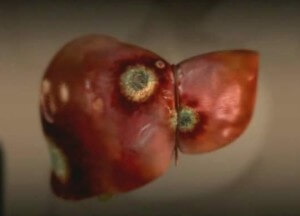
- Сверхострая – диагностируется в течение 7 суток после развития желтухи.
- Острый – период проявления симптомов составляет 8-28 суток.
- Подострый – энцефалопатия возникает на 2-3 месяце течения болезни.
Диагностируется некроз печени достаточно редко. Выявляется заболевание преимущественно у людей молодого и среднего возраста. У более старшего поколения, как правило, диагностируется подострая форма патологии.
В зависимости от степени распространенности некроза по органу выделяют:
- Фокальный некроз – поражает несколько близ расположенных гепатоцитов (часто выявляется при вирусных гепатитах).
- Центролобулярный (зональный) – погибают гепатоциты на определенных долях печени.
- Массивный некроз печени – поражается вся доля органа.
Некроз печени – это не самостоятельное заболевание, а результат патологических процессов, протекающих в организме. Причиной острой формы болезни чаще всего является гепатит, как правило, вирусной этиологии. Провоцирующим фактором может выступать прием некоторых медикаментозных препаратов или токсических веществ.
Некроз печени может развиваться на фоне патологий сердечно-сосудистой системы, которые связаны с нарушением процесса кровообращения. Недостаточность кровообращения провоцирует развитие некроза, вызывает тотальное поражение паренхимы, что ведет к печеночной недостаточности.
Стать причиной гибели гапетоцитов может радиационное воздействие на организм, сильные травмы органа или влияние на тело высоких/низких температур.
Клиническая картина заболевания зависит от формы некроза и степени поражения органа. Основной признак патологии – постепенно нарастающая печеночная недостаточность, которая провоцирует развитие печеночной энцефалопатии и приводит к коме.
По мере прогрессирования заболевания происходит активизация иммунной системы, которая ограничивает очаг повреждения, не допуская распространения патологического процесса на другие органы. Результатом таких изменений является появление отечности, значительное увеличение печени в размере и растяжение ее капсулы. Больного мучают сильные боли, которые локализуются не только в правом подреберье, но распространяются на лопатку, грудину и живот. Если после появления таких симптомов у пациента уменьшается печень и проходить боль – это первый признак гибели значительной части паренхимы, что является крайне неблагоприятным прогнозом.
В предкоматозном состоянии пациент плохо ориентируется в пространстве и во времени, наблюдается потеря памяти, повышение тонуса мышц и спазмов. Постепенное нарастание отека головного мозга может спровоцировать нарушение дыхание, развитие брадикардии и артериальной гипотензии.
При поражении токсинами почек возникает некроз органов. При этом они не справляются со своей работой, следствием чего является накопление азотистых шлаков в крови. Это ведет к еще большей интоксикации организма и ускоряет развитие энцефалопатии.
Некроз печени провоцирует развитие ДВС-синдрома, который возникает в результате нарушение синтеза белков и ферментов, отвечающих за свертываемость крови. При этом переливание факторов свертывания не дает положительного результата, поскольку для их активизации требуется работа печени.
Высокая концентрация токсинов в крови провоцирует развитие язвы желудка и двенадцатиперстной кишки, а плохая свертываемость провоцирует желудочно-кишечное кровотечение.
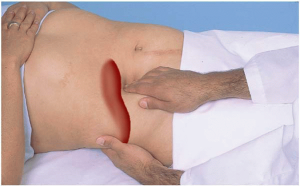
Во время первой консультации врач собирает анамнез и изучает историю болезни пациента, чтобы установить возможные причины гибели гепатоцитов. Специалист выполняет визуальный осмотр, выявляя наличие желтухи и пальпирует печень для оценки размеров органа.
С целью получения полной картины о состоянии печени и других внутренних органов выполняется ряд лабораторных тестов и инструментальных видов исследования:
- Ультразвуковое исследование и МРТ печени и желчного пузыря. Однофотонная эмиссионная КТ печени. Данные исследования позволяют оценить поражения паренхимы.
- Пункция печени с дальнейшим морфологическим исследованием биоптатов, что позволяет оценить общее состояние органа и степень повреждения гепатоцитов.
- Биохимические пробы печени, во время которых исследуется уровень азотистых шлаков.
- ЭЭГ для выявления энцефалопатии.
- Определение уровня антител к основным антигенам гепатитов В, С и D.
Лечение некроза печени проводится в отделении интенсивной терапии. Главная цель – устранение печеночной недостаточности, нормализация функционирования органа и предотвращение развития осложнений. Во время лечения регулярно исследуется уровень азотистых шлаков и электролитов в крови. Это дает возможность оценивать динамику терапии и при необходимости корректировать его.
Лечение некроза печени включает следующие мероприятия:
-
Регулярное внутривенное введение витамина К, который позволяет избежать кровотечений. При этом переливание факторов крови не приносит должного эффекта, поэтому не применяется в лечебных целях.
- Прием препаратов, подавляющих выработку соляной кислоты, что позволяет снизить риск возникновения язвы желудка и 12-перстной кишки.
- Для снятия спазмов назначается Диазепам.
- В особо сложных случая применяется парентеральное питание с применением аминокислотных растворов.
Нормализовать работу почек можно только путем восстановления здоровья печени. При этом диализ может привести к сильным кровотечениям или генерализации инфекционного процесса, поэтому он не проводится.
Для борьбы с печеночной энцефалопатией применяются антибактериальные препараты – Метронидахол или Неомицин, а для восстановления кишечной микрофлоры используется Лактулоза. При прогрессировании патологии спасти жизнь пациенту поможет только трансплантация органа в течение 24 часов. Но даже проведение экстренной операции не дает 100% гарантии. После оперативного вмешательства выживаемость пациентов составляет 65%.
Симптоматическое лечение включает прием жаропонижающих препаратов, противорвотных и обезболивающих медикаментов, а также иммуномодуляторов.
Прогноз при некрозе печени зависит от множества факторов. Прежде всего это возраст пациента и его общее состояние здоровья; причины, спровоцировавшие патологию; запущенность болезни; наличие осложнений и др. Крайне неблагоприятный прогноз при развитии некроза печени у пациентов младше 10 лет или старше 45, наличие метаболического ацидоза, длительной желтухи и повышении билирубина свыше 300 мкмоль/л.
Снижают шансы на выздоровление неврологические расстройства, сильные кровотечения, сепсис и нарушение витальных функций. У выживших пациентов возможно полное или частичное восстановление печени, при этом часто развивается постнекротический цирроз.
Предотвратить развитие некроза печени поможет своевременное лечение заболеваний и патологий, которые его провоцирует (прежде всего гепатитов).
источник
87.Массивный прогрессирующий некроз(токсическая дистрофия)печени.Этиология,патогенез,патанатомия ,осложнения,исходы.
Токсичеч.дистрофия-острое,реже,хроническое,заболевание,характерезирующее прогрессирующим массивным некрозом печени и печеночной недостаточностью.
Этиология ипатогенез:МПН чаще развив-ся при экзогенных(отр-я продуктами,грибами,фосфором и тд)и эндогенных(токсикоз беременных,тиреотоксикоз)интокцикациях.
Патан:В 1ые дни печень несколько увеличена,плотная и дряблая,приобретает ярко-желтую окраску,затем резко уменьшается,капсулапорщиниста,на разрезе серая и гнилистого вида.На 2ой нед почти все отделы долек кроме переферии в состоянии жировой дистрофии-это стадия желтой дистрофии.На 3ей нед печень прод-т уменьшаться и стан-сякрасной,стадия красной дистрофии.
Осложнения: Соровождается заб-е желтухой, гиреплазией лимф. узлов и селезенки, множеств. кровоизлияния ,дистроф-е изм-я в поджелуд.железе, миокарде, ЦНС.
Исход: Больные умирают от острой почечн. илипеченочн. нед-ти, также в исходе может развиться постнекротический цирроз печени.
88.Жировой гепатоз(стеатоз) печени.Этиология,патогенез,патанатомия,осложнения,исходы. Роль алкоголя в развитии жирового гепатоза.
ЖГ-хроническое заболевание, хар-ся повышенным накоплением жира в гепатоцитах.
Этиология ипатогенез:К ЖГ ведут токсические воздействия на печень(алкоголь,нек-е лекарства),эндокринно-метаболические нарушения(сах.диабет,ожирение),нарушение питания и гипоксия(анемии,сс и легочная нед-ть).Осн-е значение имеет хронич.алкогольнаяинтоксикация,развивается алкогольный стеатоз.
Патан:печень большая ,желтая,поверхностьгладкая.Вгепатоцитахжир,ожирениегепатоцитовмбпылевидным,мелко-и крупнокапельным.Жировая инфильтрация может охватывать единичные гепатоциты(дессеминированное ожирение),гр.гепатоцитов(зоональное ожирение) или всю паренхиму печени(диффузное ожирение.
Различают 3 стадии:простое ожирение(деструкция не выражена,мезенхемально-клеточная реакция отсутствует),ожирение в сочетании с некробиозом и мезенхем-клет. реакцией,ожирение с нач-ся перестройкой дольковой структурой печени(эта стадия рассматривается как предцирротическая).
Вирусный гепатит-вирусное заболевание,хар-ся преимущественно поражением печени и пищеварительного тракта. Этиология и патогенез:Вызываются вирусами гепатита А,В ,С и дельта.1)Гепатит А (эпидемический гепатит, болезнь Боткина), РНК-вирус. Путь заражения фекально-оральный. Инкубационный период 15 — 45 дней. Характерны циклическая желтушная или безжелтушная формы. Заболевание заканчивается выздоровлением и полной элиминацией вируса. 2)Гепатит В, ДНК-вирус.Путь передачи парентеральный (при инъекциях, переливаниях крови, любых медицинских манипуляциях), трансплацентарный, половой. Инкубационный период 40— 180 дней. Часто сопровождается носительством вируса и переходом в хронический гепатит. 3) Гепатит С. Вызывается РНК-вирусом. Путь передачи парентеральный; составляет основную массу «трансфузионного» вирусного гепатита. Инкубационный период 15 — 150 дней. Быстро прогрессирует с развитием хроничес-1сих форм гепатита. 4) Гепатит D. Вирус гепатита D — дефектный РНК-вирус, который может реплицироваться (а следовательно, вызывать заболевание) только при наличии вируса гепатита В. Рассматривается как суперинфекция. Заболевание протекает более тяжело, чем просто гепатит В. Морфология :Макроскопически: печень становится большой красной.Микроскопически:гидропическая и баллонная дистрофия гепатоцитов; некроз отдельных клеток или больших или меньших групп клеток — ступенчатые, мостовидные некрозы;образование телецКаунсильмена (путем апоптоза);инфильтрация портальной и дольковой стромы преимущественно лимфоцитами, макрофагами с незначительной примесью ПЯЛ;пролиферация звездчатых ретикулоэндотелиоцитов;холестаз (различной степени выраженности).регенерация гепатоцитов.Клинико-морфологические формы: циклическая желтушная (классическое проявление гепатита А);безжелтушная (морфологические изменения выражены минимально); молниеносная, или фульминантная (с массивными некрозами);холестатическая (характерно вовлечение в процесс мелких желчных протоков).
Исходы:выздоровление с полным восстановлением структур;смерть от острой печеночной или печеночно-почечной недостаточности (при молниеносной форме В, С); переход в хронический гепатит и цирроз (В, С, D).
90.Хронические вирусные гепатиты.Этология,патогенез,морфхар-ка,признакиактивности,исходы,патогенез.Хронический вирусный гепатит. Характеризуется деструкцией паренхиматозных элементов, клеточной инфильтрацией стромы, склерозом и регенерацией печеночной ткани. Эти процессы могут присутствовать в различных сочетаниях, что позволяет определить степень активности процесса. Выраженная дистрофия гепатоцитов— белковая, гидропическая, балонная, отмечается при вирусном гепатите. В случае сочетания вируса В с D-вирусом, а также при вирусе С отмечается белковая и жиро-вая дистрофия.
Очаги некроза могут также располагаться перипортально в некоторых либо во всех портальных трактах. Характерны внутридольковые мелкие очаги на территории большинства долек. Большие очаги некроза гепатоцитов всегда пронизаны большим количеством лим-фомакрофагальных элементов, мелкие очаги некроза (1—3 гепа-тоцита) могут быть окружены клетками (лимфоциты, макрофа¬ги.При хроническом гепатите отмечаются изменения в синусоидах — гиперплазия звездчатых ретикулоэндотелиоцитов и эндотелия, скопление лимфоцитов в виде цепочек в синусоидах, что также более выражено при вирусе С. Не остаются интактными при гепатите и желчные протоки, иногда видна деструкция стенок и пролиферация эпителия. При хроническом воспалительном процессе в результате межклеточных коопераций среди клеток инфильтрата появляются фибробласты и нарастают явления фиброза и склероза. Определяются фиброз портальной стромы внутри долек, склероз стромы большинства портальных трактов, перипортальный склероз в дольках, в ряде случаев с образованием портопортальных или портокавальныхсепт, разделяющих дольки на части, с образованием ложных долек. Степень выраженности всех описанных процессов оценивается в баллах и свидетельствуетпрогрессировании заболевания вплоть до начала перестройки печеночной ткани и развития цирроза.
В лимфатических узлах и селезенке отмечаются признаки гиперплазии. При наличии системных проявлений при вирусном гепатите развивается продуктивныйваскулит мелких сосудов практически во всех органах и тканях, что делает разнообразной клиническую картину. Васкулит появляется вследствие иммуно-комплексного повреждения стенок мелких сосудов. Возможно также иммунное воспаление в тканях экзокринных органов, в эпителии которых репродуцируется вирус.
91. Цирроз печени- хроническое заболевание, при котором в печени происходит диффузное разрастание соединительной ткани, приводящее к нарушению строения долек (долька-физиологическая структурная единица) и перестройке органа
1) инфекционный цирроз, чаще всего в исходе вирусного гепатита В,
2) токсический цирроз на фоне алкогольного гепатита,
3) обменно-алиментарный цирроз при нарушенном обмене веществ,
4) билиарный цирроз в результате застоя желчи или воспаления желчных путей,
5) криптогенный цирроз – этиология болезни неизвестна.
Макроскопически: по размера м узлов-регенератов различают
• мелкоузловой (узлы до 1 см) цирроз,
• крупноузловой (узлы более 1 см) цирроз,
Микроскопически: по особенностям строения ложных печеночных долек выделяют
• монолобулярный (ложные дольки построены на основе одной неизмененной дольки),
• мультилобулярный (ложные дольки построены на основе нескольких долек),
Поверхность бугристая вследствие разрастания соединительной ткани и наличия ложных долек, в которых наблюдается дистрофия, некроз гепатоцитов
Портальный цирроз характеризуется разрастанием портальных септ (перегородок) появляются дистрофия и очаги некроза
Постнекротический цирроз основные признаки — это массивные очаги некроза и спадение стромы (коллапс), что ведет к склерозу и образованию крупных узлов-регенератов.
Смешанный обладает признаками портального и постнекротического цирроза
Смерть наступает от печеночной комы, печеночно-почечной недостаточности.
источник
Вирусный гепатит А. При нем заражение происходит фе-кально-оральным путем. Инкубационный период 25—40 дней. Вирус поражает чаще коллективы молодых людей (детские сады, школы, воинские подразделения). Вирус обладает прямым цитотоксическим действием, не персистирует в клетке. Элиминация вируса макрофагами происходит вместе с клеткой. Вирус вызывает острые формы гепатита, которые заканчиваются выздоровлением. Для диагностики этого заболевания существуют только серологические маркеры, морфологических маркеров вируса нет. Данную форму гепатита описал С.П.Боткин (1888), который доказал, что это заболевание инфекционное, обосновал концепцию этиологии и патогенеза, назвав его инфекционной желтухой. В настоящее время вирусный гепатит А иногда называют болезнью Боткина.
Мозговидное набухание пейеровой бляшки при брюшном тифе.
-скопления макрофагов со светлой цитоплазмой
Брюшной тиф. Основные структурные изменения, вызванные Salmonella typhi abdominalis, наблюдаются в тонкой кишке; наряду с ними обычно развиваются (хотя и слабее выраженные) изменения других отделов желудочно-кишечного тракта.
В течение первой недели заболевания развиваются изменения в собственной пластине слизистой оболочки кишки (катаральное воспаление) и изменения ее лимфоидного аппарата — «мозговидное набухание» пейеровых бляшек, условно расцениваемые как проявления I стадии брюшного тифа.
При гистологическом исследовании в лимфоидном аппарате обнаруживаются характерные тифозные узелки (гранулемы), состоящие в основном из крупных одноядерных мононуклеарных клеток («тифозных»).
Макроскопически поражения особенно отчетливо определяются на протяжении 1—1,5 м терминального отдела подвздошной кишки и достигают максимума у самой бау-гиниевой (илеоцекальной) заслонки. В просвете кишки обнаруживаются полужидкие или кашицеобразные массы с небольшой примесью слизи. Слизистая оболочка пораженных отделов кишечника умеренно полнокровна. Групповые и солитарные фолликулы, брыжеечные лимфатические узлы заметно увеличены в размерах, сочные, мягко-эластичные, красноватого цвета. Рельеф поверхности групповых фолликулов (пейеровых бляшек) напоминает в миниатюре поверхность больших полушарий головного мозга.
В случае выздоровления на этой стадии болезни (которое может наступать гораздо чаще, чем принято думать, в том числе и у детей), вышеописанные клетки рассасываются, а катаральное воспаление стихает. ^ При ином течении брюшного тифа происходит дальнейшее прогрессиро-вание болезни с развитием, чаще всего на 2—3-й неделе, некротических изменений лимфоидного аппарата кишки, а также в регионарных лимфатических узлах и в селезенке.
Макроскопически некрозы вначале возникают в поверхностных участках групповых фолликулов. Некротизированные участки имеют грязно-серый цвет, при пропитывании их желчными питментами они становятся коричнево-зелеными. Эти изменения обозначаются как проявления II стадии брюшного тифа.
В конце 2-й или в начале 3-й недели происходит постепенное отторжение некротизированных масс (III «стадия образования язв»). Вследствие этого здесь возникают изъязвления, очертания которых повторяют размеры лимфатических фолликулов. Края свежих язв имеют форму валика и нависают над ее дном. Дно язвы неровное, на нем видны остатки некротизированной ткани. Образование язв может сопровождаться аррозивным кровотечением.
Подострый гломерулонефрит.
-лимфогистиоцитарные инфильтраты в строме
Быстро прогрессирующий (подострый, злокачественный) подострый гломерулонеф-рит. Его наиболее типичной чертой являются пролиферативные изменения. В клубочках они заключаются в пролиферации эндотелия и клеток мезангия, что приводит к увеличению гломерул в размерах. Наряду с этим имеется небольшая примесь нейтрофильных лейкоцитов. Эти изменения сочетаются с фибриноидным некрозом отдельных петель капилляров и их тромбозом. Кроме того, отмечается компенсаторная гипертрофия сохранившихся интактных клубочков. Характерной чертой подострого гломерулонефрита являются выраженные экстракапиллярные изменения — пролиферация эпителия капсулы, который образует полулуния (рис. 155В). Последние, сдавливая капилляры гломерул, приводят к их коллапсу, что наряду с тромбозом капиллярных петель ведет к склерозированию клубочков.; Происходит и организация клеточных полулуний. Диагноз быстропрогрессирующего гломерулонефрита ставится при обнаружении полулуний не менее, чем в 50% клубочках, т.к. отдельные полулуния могут формироваться и при других гломерулопатиях.
При ультраструктурном исследовании выявляются повреждения базаль-ной мембраны. У части больных с помощью иммунофлюоресценции определяются субэпителиальные отложения Ig G и СЗ компонента комплемента. В других случаях депозиты не обнаруживаются.
Изменения гломерул могут сопровождаться развитием нефротического синдрома и дистрофическими изменениями нефротелия канальцев.
Макроскопически почки несколько увеличены в размерах, пестрые с мелким желтым (за счет отложения липидов) крапом, при наличии же кровоизлияний отмечается и красный крап («большая пёстрая почка»).
Прогноз серьёзный и зависит от количества полулуний. Неблагоприятным считается наличие полулуний в 80% клубочков и более.
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
Папиллярные узоры пальцев рук — маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.
Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ — конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
источник
Заболевание, протекающее остро (редко хронически), при котором в ткани печени появляются большие очаги некроза; клинически проявляются синдромом большой печеночной недостаточности.
Этиология.Основное значение имеет воздействие токсичных веществ как экзогенного (грибы, пищевые токсины, мышьяк), так и эндогенного (токсикоз беременных — гестозы, тиреотоксикоз) происхождения.
Патогенез.Токсичные вещества непосредственно воздействуют на гепатоциты в основном центральных отделов долек; определенную роль играют аллергические факторы.
Патологическая анатомия.На первой неделе заболевания печень большая, желтая, дряблая, в гепатоцитах выявляется жировая дистрофия. Затем в центрах долек появляются различные по площади очаги некроза. В них происходит аутолитический распад и выявляется жиробелковый детрит, а по периферии долек сохраняются гепатоциты в состоянии жировой дистрофии. Это стадия желтой дистрофии. На третьей неделе заболевания жиробелковый детрит подвергается резорбции, в результате чего оголяются тонкая ретикулярная строма долек и полнокровные синусоиды. Ретикулярная система спадается, происходит коллапс стромы, все оставшиеся части долек сближаются. Вследствие этого печень быстро уменьшается в размерах. Это стадия красной дистрофии. Клинически эти стадии проявляются большой печеночной недостаточностью, больные умирают от печеночной комы или от печеночно-почечной недостаточности. Если больные не умирают, то развивается постнекротический цирроз. На месте массивных некрозов разрастается соединительная ткань, что нарушает строение физиологической структурной единицы печени — дольки.
Очень редко болезнь, рецидивируя, приобретает хроническое течение.
Жировой гепатоз
Хроническое заболевание, при котором в гепатоцитах накапливается нейтральный жир в виде мелких и крупных капель.
Этиология.Длительные токсические воздействия на печень (алкоголь, лекарственные вещества), нарушения метаболизма при сахарном диабете, нарушение питания (неполноценное белковое) либо избыточное употребление жира и др.
Патологическая анатомия.Печень большая, дряблая, желтая, поверхность ее гладкая. В гепатоцитах виден нейтральный жир. Ожирение бывает пылевидным, мелко- и крупнокапельным. Капли жира оттесняют органеллы клетки, последняя приобретает вид перстневидной. Жировая дистрофия может появляться в единичных гепатоцитах (диссеминированное ожирение), в группах гепатоцитов (зональное ожирение) или поражать всю паренхиму (диффузное ожирение). При интоксикации, гипоксии развивается ожирение центролобулярных гепатоцитов, при общем ожирении и белково-витаминной недостаточности — преимущественно перипортальных. В случае резко выраженной жировой инфильтрации печеночные клетки погибают, жировые капли сливаются и образуют расположенные внеклеточно жировые кисты. Вокруг них возникает клеточная реакция и разрастается соединительная ткань.
Различают три стадии жирового гепатоза:
▲ простое ожирение, когда деструкция гепатоцитов не выражена и отсутствует клеточная реакция вокруг;
▲ ожирение в сочетании с некрозом отдельных гепатоцитов и мезенхимально-клеточной реакцией;
▲ ожирение гепатоцитов, некроз отдельных гепатоцитов, клеточная реакция и разрастание соединительной ткани с начинающейся перестройкой дольковой структуры печени. Третья стадия стеатоза печени необратима и рассматривается как прецирроти-ческая.
Развитие цирроза печени в исходе жирового гепатоза прослежено с помощью повторных биопсий. Клинически жировой гепатоз проявляется малой печеночной недостаточностью.
• Гепатит — заболевание печени воспалительного характера. Гепатит может быть первичным, т.е. развиваться как самостоятельное заболевание, или вторичным, т.е. развиваться как проявление другого заболевания. По характеру течения гепатит бывает острым и хроническим. В этиологии первичного гепатита выделяют три фактора: вирусы, алкоголь, лекарственные вещества, — образно назь1вая их тремя китами. Руководствуясь патогенезом, выделяют аутоиммунный гепатит.
Вирусный гепатит
Этиология.Вирусный гепатит вызывается несколькими вирусами: А, В, С, D.
Вирусный гепатит А. При нем заражение происходит фекально-оральным путем. Инкубационный период 25—40 дней. Вирус поражает чаще коллективы молодых людей (детские сады, школы, воинские подразделения). Вирус обладает прямым цитотоксическим действием, не персистирует в клетке. Элиминация вируса макрофагами происходит вместе с клеткой. Вирус вызывает острые формы гепатита, которые заканчиваются выздоровлением. Для диагностики этого заболевания существуют только серологические маркеры, морфологических маркеров вируса нет. Данную форму гепатита описал С.П.Боткин (1888), который доказал, что это заболевание инфекционное, обосновал концепцию этиологии и патогенеза, назвав его инфекционной желтухой. В настоящее время вирусный гепатит А иногда называют болезнью Боткина.
Вирусный гепатит В. Путь передачи парентеральный — при инъекциях, переливаниях крови, любых медицинских манипуляциях. В связи с этим заболевание образно называют «медицинской интервенцией». В настоящее время в мире насчитывается около 300 млн носителей вируса гепатита В. В 1958 г. был найден антиген в крови австралийского аборигена. В дальнейшем у этого вируса было обнаружено несколько антигенных детерминант: 1) HBsAg — поверхностный антиген вируса, который репродуцируется в цитоплазме гепатоцита и служит показателем носитель-ста вируса; 2) HBcAg — глубинный антиген, репродуцируется в ядре, содержит ДНК — показатель репликации; 3) HBeAg, который появляется в цитоплазме, отражает репликационную активность вируса. Вирус имеет морфологические и серологические маркеры. Его частицы видны в электронном микроскопе в ядре и цитоплазме, а поверхностный антиген выявляется с помощью гистохимических методов (окраска орсеином по Шиката и альде-гидфуксином). Кроме того, имеются косвенные морфологические признаки присутствия поверхностного антигена вируса в клетке — «матовостекловидные гепатоциты», а также сердцевидного антигена — «песочные ядра» (мелкие эозинофильные включения в ядрах). Вирус гепатита В не оказывает прямого цитопатического действия на гепатоциты, репродуцируется в гепатоците и при определенных условиях в других клетках (лимфоциты, макрофаги). Разрушение гепатоцита и элиминация вируса осуществляются клетками иммунной системы.
Вирусный гепатит D (дельта-гепатит). Дельта-вирус — дефектный РНК-вирус, который вызывает заболевание только при наличии поверхностного антигена вируса В, поэтому может рассматриваться как суперинфекция. Если заражение вирусом В и дельта-вирусом происходит одновременно, то возникает сразу острый гепатит. Если происходит заражение дельта-вирусом на фоне уже существующего у человека гепатита В, то эта ситуация клинически проявляется обострением и быстрым прогрессирова-нием заболевания вплоть до развития цирроза печени.
Вирусный гепатит С. Возбудитель долгое время не был идентифицирован, был известен как возбудитель гепатита ни А ни В. Только в 1989 г. благодаря методу рекомбинантной ДНК удалось клонировать ДНК-копию вируса. Это РНК-содержащий вирус, имеющий липидную оболочку. Существуют серологические реакции, позволяющие диагностировать HCV-инфекцию; прямых морфологических маркеров вируса нет. Вирус реплицируется в гепатоците и в других клетках (лимфоциты, макрофаги), обладает цитопатическим действием и вызывает иммунные нарушения. Заболевание часто встречается у алкоголиков и наркоманов. В настоящее время 500 млн человек на земном шаре являются носителями HCV. У 6 % доноров вирус С определяется в крови, по данным разных источников от 0,6—1,1—3,8 % у здоровых людей. Основной путь передачи парентеральный, риск заражения 20—80 %, что подобно СПИДу, однако в 40 % случаев путь передачи не установлен (схема 43).
источник
Фульминантный гепатит — особая клиническая форма острого гепатита, возникающая в результате субмассивного или массивного некроза печени, вызванного этиологическим агентом, и характеризующаяся комплексом клинико-биохимических симптомов прогрессирующей печеночной недостаточности.
Злокачественная форма гепатита описывается под разными названиями: острый некроз печени, токсическая дистрофия печени, массивный или субмассивный некроз печени, гепатодистрофия, острая желтая атрофия печени и др. Все существующие названия нельзя считать вполне удачными, так как они либо отражают морфологические изменения (некроз печени), либо вообще не охватывают патогенетическую сущность изменений в печени (токсическая дистрофия печени). В зарубежной литературе для обозначения таких форм используется термин «фульминантный гепатит», то есть гепатит с молниеносным течением. Принципиально такая терминология не вызывает возражений, но термин «фульминантный», или «молниеносный», звучит слишком фатально, особенно если учесть, что в последние годы заболевание нередко заканчивается выздоровлением.
Не удовлетворяют клиницистов и такие термины, как «гепатодистрофия», «печеночная недостаточность», «портальная энцефалопатия», «печеночная энцефалопатия», «гепатаргия, «гепатонекроз» и др.
По мнению большинства клиницистов, например, вирусный гепатит, сопровождающийся массивным или субмассивным некрозом печени и прогрессирующей печеночной недостаточностью, правильнее называть злокачественным, учитывая тяжесть клинических проявлений и высокую летальность. Злокачественную форму нельзя отождествлять с тяжелой формой болезни. Это два качественно различных состояния — как по клиническим проявлениям (при злокачественной форме наблюдаются симптомы, отсутствующие при других формах гепатита), так и по морфологическим (массивный, иногда тотальный, некроз печени обнаруживается только при злокачественной форме). С другой стороны, злокачественную форму нельзя отождествлять с понятием «печеночная недостаточность» или «печеночная кома». Термин «злокачественная форма» служит для обозначения отдельной клинической формы вирусного гепатита, тогда как понятие «печеночная недостаточность» отражает нарушение функций печени. Принято различать печеночную недостаточность I, II, III степени, а также компенсированную, субкомпенсированную и декомпенсированную формы злокачественного гепатита. В тех случаях, когда печеночная недостаточность сопровождается поражением ЦНС, принято говорить о печеночной коме. Следовательно, печеночная кома является крайне тяжелым проявлением печеночной недостаточности, ее конечной стадией.
Злокачественную форму нельзя трактовать как осложнение вирусного гепатита. Еще С. П. Боткин выдвинул положение о том, что острая желтая атрофия вполне укладывается в понятие «катаральная желтуха» в качестве наиболее тяжелой формы, единой с ней по этиологии и сущности. По современным представлениям, в каждом, даже легчайшем, случае вирусного гепатита гибнут печеночные клетки, то есть имеется «атрофия печени в миниатюре». С учетом этого злокачественную форму следует рассматривать как наиболее тяжелую форму вирусного гепатита.

Среди факторов, способных обусловить развитие фульминантного процесса в печени, выделяют прежде всего гепатотропные вирусы — возбудители гепатитов А, В, С, D и Е, при этом их доля в возникновении злокачественного гепатита составляет 60-70%.
В качестве причинных агентов фульминантного гепатита могут быть выделены герпетические вирусы 1, 2, 4, 5 и 6 типов.
Фульминантный гепатит может возникнуть при токсических поражениях печени вследствие отравления алкоголем, грибами, промышленными ядами, а также лекарственными средствами (антидепрессантами, противотуберкулезными препаратами, парацетамолом и др.). Некоторые болезни обмена» например болезнь Вильсона-Коновалова, стеатогепатит, в ряде случаев становятся причиной фульминантного гепатита. Следует отметить, что, по данным различных авторов, в 20-40% случаев этиология фульминатного гепатита остается неустановленной.

По степени выраженности и распространенности некроз печени при злокачественной форме гепатита может быть массивным или субмассивным. При массивном некрозе гибнет почти весь эпителий или сохраняется незначительная кайма клеток по периферии долек. При субмассивном некрозе разрушению подвергается большинство гепатоцитов. преимущественно в центре долек.
Некроз печени может возникать остро или подостро. При вирусных гепатитах он обычно наблюдается на высоте клинических проявлений, от 5-го до 14-то дня болезни. Реже массивный некроз печени развивается в начале заболевания, еще до появления желтухи (молниеносные формы), или в позднем периоде — на 3-4-й неделе от начала заболевания (подострые формы).
При патологоанатомическом исследовании выявляется острый некроз печени, уменьшение массы почти вдвое, отмечается морщинистая капсула дряблой консистенции; печень как бы расплывается на столе, ткань легко рвется. На разрезе определяются обширные участки охряно-желтого или темно-красного цвета за счет пропитывания ткани желчью и нарушения кровообращения (подчеркнутый мускат). При гистологическом исследовании обнаруживаются обширные поля опустошенной, спавшейся стромы с сохранением лишь небольшой каймы печеночного эпителия по периферии долек; регенеративные процессы отсутствуют или незначительны. Строма и ретикулоэндотелий обычно не подвергаются некрозу. Некротические изменения бывают настолько велики, что препарат напоминает картину полного трупного аутолиза печени.
Такая картина обычно наблюдается в случаях летального исхода на 6-8-й день болезни. При более позднем наступлении смерти печень также уменьшена в размерах и дряблая, но несколько более эластичной консистенции и на разрезе представляется пестрой за счет чередования множества мелких западающих красных и несколько выбухаюших желтых участков. При гистологическом исследовании определяются обширные поля различной степени распространенности дистрофических изменений в печеночной паренхиме с постепенной элиминацией клеточного детрита, вплоть до полного опустошения паренхимы.
При подостром некрозе печень обычно плотноватая, без существенного уменьшения массы органа. Микроскопически обнаруживается неоднородность морфологических изменений в различных ее участках, обусловленная постепенным вовлечением долек в некротический процесс: наряду с массивным и субмассивньш некрозом в одних дольках видна активная регенерация сохранившихся гепатоцитов с локализацией регенерирующих клеток преимущественно вокруг портальных тракт ов, с разрастанием соединительной ткани и нарушением архитектоники паренхимы. В зонах клеточной регенерации наблюдается своеобразное мелкокапельное ожирение гепатоцитов с увеличением их размеров и сохранением ядра в центре. Процессы в разных отделах печени протекают различно. В центральных, особенно пригилюсньтх, участках вблизи крупных сосудов развитие патологического процесса опережает изменения в периферических участках органа. Кроме того, левая доля печени поражается обычно больше правой. Если под острый некроз печени затягивается на длительный срок (5-6 мес и более), то развивается картина постнекротического цирроза печени.
При злокачественных формах гепатита дистрофические изменения обнаруживаются не только в печени, но и в почках, селезенке, мозге и других органах. У больных, умерших от печеночной комы, в почках обнаруживают различной степени выраженности жировую и белковую дистрофию, вплоть до распространенного некроза почечного эпителия; в селезенке — гиперемию, ретикулярную гиперплазию и миелоз пульпы: в мозге — тяжелые дистрофические изменения нервных клеток, стенок сосудов глии с преимущественной локализацией в коре, подкорково-стволовых отделах и мозжечке. В отдельных случаях при гистологическом исследовании мозга детей, умерших от печеночной комы, обнаруживаются клеточные периваскулярные инфильтраты вокруг базальных ганглиев, в мягкой мозговой оболочке и белом подкорковом веществе. Обычно наблюдаются циркуляторные нарушения, стазы, периваскулярный отек, тяжелые дистрофические изменения макроглии, приводящие к ее гибели, а также микроглии. В части случаев подострой дистрофии регистрируют пролиферативные изменения в макроглии. Морфологические изменения в мозгу принято связывать с токсическими воздействиями, развивающимися в связи с бурным распадом печеночной ткани.
Вопрос весьма сложный. Учитывая, что фульминантный гепатит развивается почти исключительно у детей раннего возраста, и особенно часто — у недоношенных в возрасте 2-6 мес., можно думать, что определяющими факторами становятся несовершенство иммунокомпетентных систем и особая чувствительность обменных процессов, проходящих в условиях недостаточно дифференцированной печеночной паренхимы
Приходится учитывать и то обстоятельство что в возрасте до 1 года отмечаются особенно бурный рост ребенка и увеличение массы печени, что, в свою очередь, предопределяет напряженность обменных процессов и, следовательно, их повышенную ранимость.
Фактором, неблагоприятно влияющим на течение вирусного гепатита, может быть также высокая инфекциозность возбудителя. Важно подчеркнуть, что у всех детей, умерших от массивного некроза печени, диагностированы гепатит В или гепатиты В и D; инфицирование у них происходило при внутривенном переливании плазмы или крови, иногда многократном, то есть инфицирование было массивным.
Парадоксальным на первый взгляд представляется отсутствие НВsАg в сыворотке крови у детей со злокачественной формой гепатита. Из 36 обследованных нами больных с массивным некрозом печени НВsАg был обнаружен у 9 детей. Причем антиген у этих больных определялся только впервые дни болезни; при последующих исследованиях в прекоматозном и коматозном периодах уже не определялся. Эти данные можно объяснить тотальным разрушением печеночной паренхимы, служащей морфологическим субстратом репликации вируса.
По-видимому, при фульминантном гепатите из-за слабого синтеза НВsАg в глубоко поврежденных гепатоцитах и недостаточного поступления его в кровь вместо избытка антигена (как это бывает при легких и среднетяжелых формах) имеется избыток соответствующих антител (анти-НВe;, анти-НВs и анти-НВV).
Таким образом проведенные нами исследования позволили углубить представления об иммунопатогенезе вирусных гепатитов. Они в известной степени позволили считать, что в развитии злокачественной формы заболевания играет роль гипериммунная атака на инфицированную печень. Имеются также основания расценивать действие вируса и его комплексов с антителами как определяющий фактор развития массивного некроза печени. В интимном механизме взаимодействия вируса с гепатоцитами ведущее значение имеют активированные процессы перекисного окисления липидов и действие лизосомальных гидролаз.
Предложенная нами гипотеза может служить основанием для построения патогенетической терапии тяжелых форм вирусного гепатита и стать отправной точкой и для дальнейшего углубленного изучения патогенеза заболевания.
Вопрос патогенеза злокачественных форм остается трудным и малоизученным. Прежде всего непросто ответить на вопрос, что лежит в основе лавинообразного неуправляемого распада печеночной паренхимы, какова в нем роль вирусов и факторов аутоиммунной агрессии, каковы движущие механизмы цитолиза и аутолиза.
Ответить на эти вопросы мы попытались на основе комплексного изучения персистенции гепатотропных вирусов, изучения перекисного окисления липидов, активности лизосомальных гидролаз, фиксации специфических антител и аутоантител на ткани печени.
В лзолятах HBV, полученных от больных с фульминантной формой гепатита В, достоверно чаше, чем у больных с доброкачественным вариантом болезни, обнаруживаются множественные и уникальные мутации в рrе-соrе и core регионах С-гена, а также в полимеразном гене. Кроме того, с большой частотой при фульминантном гепатите В в геноме HBV отмечается нарушение синтеза полноценной области рrе-82.
Имеются данные о преимущественном обнаружении у больных фульминантным гепатитом В мутантного штамма HBVe-минус.
В возникновении злокачественной формы при острых вирусных гепатитах, помимо мутантных штаммов возбудителей, большое значение придается микст-инфицированию. Например, коинфекция вирусами гепатитов В и D, а также суперинфекния вирусом гепатита D на хроническое носительство HBV или хронический гепатит В могут с большой частотой приводит к формированию фульминантных форм гепатита.
Как показали исследования, при коинфекции гепатитами В и D легкая форма заболевания была регистрирована у 14%, среднетяжелая — у 18, тяжелая — у 30, а злокачественная — у 52% больных.
Суперинфекпия гепатита D у хронических носителей НВ-вируса в фульминантной форме была установлена в 42% наблюдений.
По общему мнению гепатологов, фульминантный гепатит развивается преимущественно при гепатитах В и D, но имеются единичные сообщения о возникновении злокачественной формы и при гепатите С. Все же чаше при фульминантных гепатитах геном НCV обнаруживают одновременно с вирусом гепатита В.
Энтеральные гепатиты А и Е могут развиваться в фульминантной форме относительно редко.
С вирусом гепатита Е ассоциируется высокая частота фульминантного гепатита у беременных в эндемичных по гепатиту Е регионах, достигающая 20-40%.
Гепатит А в плане возможного развития злокачественной формы наиболее опасен для пожилых людей.
Механизм развития острого или подострого массивного или субмассивного некроза печени относится к числу наиболее сложных и наименее изученных в гепатологии. Большинство современных гепатологов возникновение массивного некроза печени связывают с цитолитическим синдромом, под которым принято понимать совокупность всех изменений в гепатоцитах, отражающих гистологические, биохимические и гуморальные нарушения в печени, возникающие в ответ на повреждение печеночных клеток агрессивными факторами (преимушественно гепатотропными вирусами).
В данной сатье сделана попытка представить патогенез некроза печени на основании изучения перекисного окисления липидов, роли лизосомальных протеиназ, иммунологи чес кого статуса и аутоиммунных процессов.
Известно, что первичным и наиболее ранним признаком различных повреждений клетки служат изменения в клеточных мембранах, а среди причин, вызывающих эти нарушения, на одном из первых мест стоит перекисное окисление липидов.
Перекисное окисление происходит в любой клетке и в различных мембранных структурах. Этот процесс носит цепной, свободнорадикальный характер при патологических состояниях. В физиологических условиях этого не происходит, так как существует целая система, регулирующая перекисное окисление. Стационарно низкий уровень эндогенного процесса в норме регулируется прежде всего тканевыми антиоксидантами (токоферол, глюкокортикоиды и др.), наличием глугатион-пероксидазы, разлагающей гидроперекиси липидов без образования свободных радикалов, строго упорядоченной структурой клетки. Однако при различных патологических состояниях, когда снижается сдерживающее влияние антиоксидантов или изменяется структурная организация клетки, перекисное окисление может резко ускоряться, приобретая «взрывной», опасный характер.
Для изучения перекисного окисления липидов был использован кинетический метод измерения хемилюминисценции сыворотки крови, то есть сверхслабого свечения, инициированного ионами двухвалентного железа. По мнению Ю.А Владимирова с соавт. (1969), такое свечение обусловлено рекомбинацией перекисных радикалов, поэтому его интенсивность характеризует скорость процесса перекисного окисления липидов. Активность последнего оценивалась и по количеству образовавшегося конечного продукта — малонового диальдегида (МДА). Липидный спектр сыворотки крови исследовали с помощью тонкослойной хроматографии на закрепленном геле в модификации Ю.А. Бырышкова с соавт (1966); Ю.Е. Вельтишева ссоавт. (1974). Эта методика позволяет идентифицировать фосфолипиды, свободный холестерин, моно-, ди- и триглицериды эфиры холестерина, а также НЭЖК. Простым сложением можно рассчитать уровень общего холестерина и общих липидов, а также вывести коэффициент этерификации холестерина.
Оказалось, что в остром периоде вирусного гепатита в сыворотке крови резко возрастает количество значительно повышенных показателей перекисного окисления липидов и усиливается сверхслабое свечение сыворотки крови. Степень выраженности выявленных нарушений прямо зависит от тяжести заболевания.
Высокие показатели перекисного окисления липидов отмечаются и во время развития гепатодистрофии, в периоде острого уменьшения размеров печени. При развитии печеночной комы эти показатели у некоторых больных обнаруживают тенденцию понижения. При этом в периоде глубокой печеночной комы интенсивность хемилюминесценции резко падала (в 3 раза по сравнению с таковой при прекоме), а содержание МДА после некоторого снижения вновь увеличивалось, приближаясь к величинам, отмеченным при тяжелых формах, вначале развития некроза печени. Эти сдвиги в терминальной фазе некроза печени связаны, по-видимому, с полным распадом и опустошением паренхимы этого органа. Процессы перекисного окисления липидов при вирусном гепатите усиливаются на фоне значительных изменений в липидном спектре сыворотки крови. В остром периоде при всех формах заболевания увеличивается содержание триглицеридов, фосфолипидов, НЭЖК, бета-липопротеидов, свободного холестерина при одновременном снижении коэффициента этерификации холестерина.
Степень выраженности этих нарушений, как и показатели перекисного окисления, находится в прямой зависимости от тяжести заболевания. Если при легкой форме содержание триглицеридов, фосфолипидов, моно- и диглиттеридов, свободного холестерина и общих липидов увеличивается на 44-62%, то при среднетяжелой и тяжелой формах — на 70-135% по сравнению с нормой. Еще более значительно увеличивается содержание ПЭЖК. При легкой форме их количество превышает нормальное в 2,8 раза., а при тяжелой форме — в 4,3 раза. Иная зависимость характеризует динамику эфиров холестерина; при легкой форме их содержание в пределах нормы, при тяжелой — ниже нормы на 40,2%. Уровень общего холестерина не коррелирует с тяжестью заболевания. При всех формах он увеличивается на 16-21% преимущественно за счет нарастания свободной фракции, чье содержание при легкой форме повышается в 1,6 раза, а при тяжелой форме — в 2,2 раза против нормы. Коэффициент этерификации холестерина падает тем больше, чем тяжелее форма болезни.
При развитии массивного некроза печени резко уменьшается содержание бета-липопротеидов, эфиров холестерина и триглицеридов с одновременным умеренным снижением других липидных фракций, кроме фосфолипидов и ПЭЖК, чье содержание с развитием печеночной комы еще больше увеличивается.
При сопоставлении показателей перекисного окисления липидов с липидным спектром сыворотки крови в динамике заболевания отмечается прямая коррелятивная зависимость между интенсивностью перекисного окисления липидов, с одной стороны, и содержанием НЭЖК, моно- и диглицеридов, фосфолипидов, триглицеридов — с другой, то сеть показатели этих липидных фракций тем выше, чем интенсивнее свечение сыворотки крови и выше содержание МДА.
К факторам, усиливающим процессы перекисного окисления липидов, многие авторы относят и явления гипоксии.
При гипоксии происходит частичное нарушение структуры мембран, накапливается восстановленное железо и создаются условия для повышения перекисного окисления липидов.
Исследования показали наличие гипоксии и у больных вирусным гепатитом. Характер гипоксии не является окончательно установленным. Предполагают развитие циркулярной гипоксии с местным расстройством кровообращения в печени и тканевой гипоксии в связи с палением активности окислительно-восстановительных процессов. М.В. Мельк установил прямую зависимость между степенью интоксикации и выраженностью гипоксии.
Явления гипоксии, накопление железа, ненасыщенных жирных кислот и выраженные изменения в спектре липидов создают необходимые условия для усиления перекисного окисления липидов при вирусном гепатите.
Не менее существенное значение в усилении перекисного окисления липидов могут иметь нарушения антиоксидантных систем — гасителей процесса. В физиологических условиях антиоксиданты уменьшают интенсивность перекисного окисления липидов. Некоторые исследователи связывают антиокислительные свойства с определенными веществами, например с токоферолом, стероидными гормонами. Другие считают, что антиокислительные свойства присущи сумме липидных компонентов, взаимное влияние которых ведет к изменению антиокислительных свойств.
Было показано, что вещества, богатые сульфгидрильными (SН) группами, могут купировать повреждающий эффект продуктов перекисного окисления липидов. Однако этот механизм нейтрализации токсичны перекисей не может возникать при вирусном гепатите, так как содержание сульфгидрильных групп при данном заболевании резко уменьшается. Особенно низкий уровень SН-групп в сыворотке крови наблюдается при массивном некрозе печени с летальным исходом. Следовательно, усиление перекисного окисления липидов и накопление токсичны перекисей, обусловливающих повреждение клеточных мембран при вирусном гепатите, связаны со снижением активности антиоксидантпых систем.
Таким образом, проведенные исследования позволили установить значительные нарушения в липидном обмене при вирусном гепатите, сущность которых заключается в увеличении в сыворотке крови содержания НЭЖК, моно- ди- и триглицеридов и свободного холестерина, усилении процессов перекисного окисления липидов. Эти нарушения пропорциональны тяжести патологического процесса в печени. Можно полагать, что в результате проникновения вируса в эпителиальные клетки печени и его последующего взаимодействия с субстратами клетки возникают цепные радикальные реакции, выступающие в качестве инициаторов перекисного окисления липидов — важнейших компонентов клеточных мембран. Образующиеся при этом гидроксильные группы обусловливают появление «дыр» в гидрофобном барьере биологическом мембраны. В первую очередь увеличивается проницаемость мембран для ионов водорода, калия, натрия и кальция. Клетки теряют биологически активные вещества, в том числе ферменты. Падает биологический потенциал гепатоцита. Активируются лизосомальные протеиназы, что может стать заключительным этапом гибели печеночной паренхимы.
В лизосомах сосредоточено более 60 гидролитических ферментов (в том числе катепсины А, В, D, С), способных расщеплять биологически активные соединения всех основных классов и служить, таким образом, причиной гибели клетки. Однако сегодня доминирует представление о лизосомах как о «мешке», содержащем все необходимое для жизни клетки.
Внутриклеточный протеолиз играет важную роль в реакциях иммунитета, синтезе и распаде физиологически активных веществ. Показано, например, участие кислых гидролаз в образовании изоформ некоторых ферментов, а также гормональных веществ белковой природы (тироксин, инсулин и др.). Реакции, происходящие в лизосомах в физиологических условиях, можно охарактеризовать как ограниченный аутолиз, являющийся составной частью непрерывного процесса обновления клеток. Получено много данных о роли лизосом и лизосомальных ферментов в ускорении процессов слущивания и лизиса функционально непригодных клеток. Высвобождающийся при этом энергетический и пластический материал используется в построении новых клеточных структур. Таким образом, лизосомы «расчищают дорогу» для внутриклеточной регенерации, освобождая клетку от продуктов распада. Структурная обособленность кислых гидролаз внутри лизосом имеет большое биологическое значение, так как обеспечивает физиологическую защиту внутриклеточных белков от разрушающего действия собственных ферментов. Дополнительной защитой становится присутствие в клетке ингибиторов протеолиза. В настоящее время известны ингибиторы катепсинов В, С, D и других протеолитических ферментов.
Большую роль могут играть pH среды, концентрация ионов кальция и натрия. Лизосомальные гидролазы особенно легко активизируются при сдвиге pH в кислую сторону, так как в кислой среде не только активируются гидролазы, но это способствует и денатурации белковых субстратов, тем самым облегчается их расщепление ферментами лизосом. Особенно большое значение для активации лизосомальных гидролаз имеет состояние лизосомальных мембран. При повышенной проницаемости последних или в случае их разрыва особенно легко может осуществляться контактирование ферментов с субстратами. При этом кислые гидролазы могут диффундировать в цитоплазму и вызвать гидролитический распад клеток. Можно предполагать, что подобные условия создаются при вирусном гепатите, особенно в случаях, сопровождающихся массивным некрозом печени
Проведенные исследования позволили выявить весьма важные сдвиги в системе протеолитической и антипротеолитической активности сыворотки крови при вирусном гепатите у детей. Сущность этих сдвигов заключается в том, что в остром периоде заболевания отмечается закономерное увеличение активности кислой РНК-азы, лейцинаминопептидазы, катепсинов D, С и в меньшей степени — катепсина В. При этом активность их ингибитора — а2-макроглобулина — обнаруживает выраженную тенденцию снижения.
Отмеченные сдвиги больше выражены при тяжелых формах болезни, чем при легких. По мере уменьшения клинических проявлений болезни и восстановления функциональной способности печени активность лизосомальных ферментов снижается, активность же а2-макроглобулина повышается, приближаясь к нормальным величинам в периоде реконвалесценции, но только при легких формах заболевания.
Увеличение активности лизосомальных ферментов указывает на резкое повышение проницаемости мембран лизосом — «хранилищ» протеолитических ферментов. Создаются условия для разрушающего действия ферментов на пораженную вирусом паренхиму печени. Однако в случаях, протекающих без массивного некроза, разрушающее действие лизосомальных гидролаз ограничено сохраняющейся структурной организацией клетки и, по-видимому, отсутствием оптимальных условий окружающей среды (pH, концентрация К+, Са2+, Nа2+ и др.), а также сдерживающим влиянием ингибирующих систем.
При массивном и субмассивном некрозе вследствие глубоких дистрофических процессов в паренхиме печени особенно резко снижается синтез ингибитора лизосомальных протеиназ — а2-макроглобулина и отмечается сдвиг pH в кислую сторону, возникают оптимальные условия для активации и выхода кислых гидролаз из лизосомальных вакуолей. Завершающей фазой их действия может стать аутолиз печеночной паренхимы.
На ранних стадиях некробиоза в периоде «живая клетка»-«мертвая клетка» интенсификация аутолитичееких процессов происходит как за счет повышения «атакуемости» белков ферментами, так и в результате увеличения активности протеолитических ферментов. При более глубоком некробиозе (главным образом в периоде «мертвая клетка»-«некротизированная клетка») активность протеолитических ферментов снижается в связи с их собственным распадом, кроме того, резко уменьшается возможность воздействия на белки протеиназ, так как происходит коагуляция белков и могут образоваться стойкие, труднорастворимые соединения. Очевидно, что и при вирусном гепатите между процессами некробиоза, коагуляции и протеолиза существуют сложные взаимодействия. Некробиоз и протеолиз в клетках, по-видимому, развиваются одновременно, усиливая друг друга. При этом протеолитические ферменты, вероятно, могут изменять физико-химическое состояние клеточных структур, вызывая их дегенерацию, а это, в свою очередь, способствует усилению протеолиза. Создается замкнутый крут — гепатоцит становится «жертвой» своих собственных протеолитических систем.
Важные выводы вытекают из анализа результатов определения активности трипсиноподобных протеиназ крови,
При вирусном гепатите в остром периоде заболевания активность трипсиноподобных протеиназ ниже нормальной, а при тяжелой форме болезни она вообще не определяется. Снижение активности трипсиноподобных протеиназ можно объяснить особенно резким повышением содержания в сыворотке крови их ингибитора — а 1-антитрипсина, чья активность при легких формах превышает норму в 0,5-2 раза, а при тяжелых — в 2-3 раза.
По мере стихания клинических проявлений вирусного гепатита и нормализации функциональных проб печени активность ингибитора трипсиноподобных протеин аз уменьшается, в то время как активность сывороточных протеолитичесыгх ферментов увеличивается, приближаясь к норме. Полная нормализация трипсиноподобных протеиназ наступает к 15-20-му дню болезни, независимо от тяжести, а их ингибитора — на 25-30-й день болезни и только при легких формах.
У больных фульминантным гепатитом в прекоматозном и особенно коматозном периоде активность трипсиноподобных протеиназ начинает резко увеличиваться, в то время как активность ингибитора быстро падает.
Повышение активности а1-антитрипсина при благоприятном течении вирусного гепатита мы склонны расценивать как защитную реакцию, направленную на подавление активности трипсиноподобных протеиназ — трипсина, калликреина, плазмина и др. Это положение подтверждается низкими показателями активности сывороточных протеиназ при легких, среднетяжелых и тяжелых формах, не сопровождающихся некрозом печени.
Иная картина отмечается у больных с массивным некрозом печени, развитием печеночной комы и последующим летальным исходом. В этих случаях резкое падение активности ингибитора сопровождается не менее резким увеличением активности трипсиноподобных протеиназ крови создаются оптимальные условия для их патологического действия. Известно, что увеличение активности трипсиноподобных протеиназ ведет к усиленному образованию их предшественников — биологически активных веществ кининов (брадикинина, калидина), которые резко повышают проницаемость сосудистой стенки, понижают артериальное давление и диурез, вызывают болевой синдром, приступ удушья и сердцебиения. Есть все основания считать, что в патогенезе печеночной комы и особенно в генезе геморрагического синдрома при вирусном гепатите кинины, активированные протеолитическими ферментами крови, играют важную роль. Таким образом, в результате повышения проницаемости мембран лизосом в остром периоде вирусного гепатита в сыворотке крови резко увеличивается активность тканевых кислых протеиназ — РНК-азы. лейцин-аминопептидазы (ЛАП), катепсинов В и С При благоприятном течении вирусного гепатита разрушающее действие протеиназ ограничено сохраняющейся структурной организацией гепатоцитов, достаточной продукцией а 1-антитрипсина и а2-макроглобулина и, возможно, отсутствием оптимальных условии окружающей среды (pH, концентрация ионов и др.).
При злокачественной форме вследствие глубоких деструктивных процессов в паренхиме печени, нарушения организации субклеточных структур, резкого снижения содержания ингибиторов протеолиза создаются оптимальные условия для выхода кислых гидролаз из лизосомальных вакуолей и их разрушающего действия на белковые субстраты внутри гепатоцитов. Этому в известной степени способствуют сдвиг pH в кислую сторону, накопление ионов натрия и кальция в гепатоцитах. Завершающей фазой действия лизосомальных гидролаз у больных фульминантным гепатитом становится аутолиз печеночной паренхимы с распадом собственных белков на более простые вещества — аминокислоты и пептиды. Клинически это проявляется уменьшением размеров печени и массы печеночной паренхимы, бурным нарастанием симптомов интоксикации, развитием печеночной комы. Снижение активности лизосомальных ферментов до нуля вслед за острым сокращением размеров печени в периоде глубокой печеночной комы указывает на полное разрушение лизосомального аппарата гепатоцита с последующим прекращением его функциональной деятельности.
В этом видится основное патогенетическое значение лизосомальных гидролаз при вирусном гепатите, сопровождающемся массивным или субмассивным некрозом печени.
Клеточные иммунные реакции, как известно, имеют существенное значение в определении характера течения вирусного гепатита. Высказывается предположение, что в результате поражения вирусом печеночных клеток и перестройки последних на синтез вирусных белков возникают аутоиммунные реакции против печеночных клеток, при этом патологический процесс развивается как гиперчувствительность замедленного типа с преобладанием клеточных аутоиммунных реакций. Сущность последних заключается в том, что вследствие взаимодействия вируса и гепатоцитов на поверхности последних появляются вирусиндуцированные антигены; Т-клетки, узнающие эти новые детерминанты, разрушают инфицированные гепатоциты. Вирус освобождается из клеток и, в свою очередь, инфицирует другие гепатоциты. Следовательно, печеночные клетки освобождаются от вируса ценой собственной гибели. Помимо этого, в результате стимуляции Т-клеток поврежденными гепатоцитами происходит активация В-клеток, реагирующих на поверхностные антигены гепатоцитов, включая специфический для печени липопротеин. Происходит синтез антител к этому макролипопротеиду, считающемуся нормальным компонентом мембран интактных гепатоцитов. Эти антитела, достигая печени, связываются с поверхностью гепатоцитов. Поскольку наиболее вероятным механизмом, ведущим к некрозу, является связывание комплемента, то предполагается также активация К-клеток. Согласно этим представлениям, патологический процесс при тяжелых формах вирусного гепатита обусловлен не столько репликацией и цитотоксическим действием вируса, сколько реакцией иммунокомпетентных клеток на антигенные детерминанты.
Х.М. Векслер и соавт. исследовали цитотоксическую функцию лимфоцитов на модели регенерирующих гепатоцитов культивируемого эксплантата биопсированной ткани печени больных гепатитом В (1973). Проведенные исследования позволили выявить отчетливое цитотоксическое действие лимфоцитов на клетки печени у 55% больных острым вирусным гепатитом и у 67% больных с циррозом печени. Наряду с этим сыворотка крови, богатая НВsАg, и очищенный препарат НВsАg стимулировали пролиферацию клеток культур биопсийной ткани печени и желчных путей.
Основываясь на результатах этих исследований, гепатологи стали полагать важнейшим, если не решающим, фактором развития массивных некрозов печени активность и ммунокомпетентных клеток по отношению к иммуногенным антигенным детерминантам вируса. Следовательно, вирусный гепатит, в том числе его тяжелые формы, можно рассматривать как иммунологическое заболевание, обусловленное реакцией иммунокомпетентных клеток. Надо полагать, что у больных с массивным некрозом печени в гепатоцитах преобладают особо активные полноценные частицы вируса. Согласно данной точке зрения, основным механизмом развития некроза печени является иммунный цитолиз, вызывающий гибель массы печеночной паренхимы. Поскольку признаки сенсибилизации к специфическому для печени липопротеину обнаруживаются у большинства больных гепатитом, механизм сенсибилизации к антигену мембраны клеток печени стали считать основным аутоиммунным процессом, общим для всех разновидностей заболевания, и, скорее всего, он становится причиной длительного повреждения печени.
Однако, несмотря на эти данные, многие гепатологи проявляют сдержанность в интерпретации полученных результатов в отношении цитотоксичности. Дело в том, что феномен цитотоксичности лимфоцитов — универсально распространенный процесс и необязательно должен рассматриваться как ведущее звено в патогенезе болезни. Приходится учитывать и то обстоятельство, что у умерших пациентов с молниеносным течением массивного некроза печени на вскрытии и при морфологическом исследовании не удается обнаружить массивную лимфоцитарную инфильтрацию; в то же время выявляются сплошные поля некротизированного печеночного эпителия без явлений резорбции и лимфомоноцитарной агрессии.
Результаты исследования показали, что в остром периоде гепатита В в крови обнаруживается как поверхностный НВs-антиген, так и Е-антиген, относящийся к внутренней оболочке вируса. Циркуляция Е-антигена бывает непродолжительной (в течение первых 2 нед болезни), а позднее появляются антитела — анти-НВЕ. В целом компоненты е-системы, то есть НВeAg и анти-НВe, обнаруживались у 33,3% обследованных. Циркулирование НВsАg в крови оказалось более продолжительным (в среднем 31 сут); при этом титры НВsАg у больных со среднетяжелой формой были выше, чем у больных с легкой формой. Антитела к НВsАg не выявлялись. При злокачественном варианте гепатита у большинства обследованных на е-систему в самом начале заболевания отмечено появление в крови наряду с НВeAg и НВsАg, но по мере развития прекомы и комы антигены вируса в крови уже не обнаруживаются. На фоне циркуляции вирусных компонентов в динамике гепатита В наблюдаются изменения количественных соотношений субпопуляций лимфоцитов. Так, в первой и второй декадах болезни, то есть на высоте заболевания, уровень Е-РОК при всех формах болезни существенно снижается как в процентном, так ив абсолютном значении. В четвертой декаде при легкой и среднетяжелой формах количество Е-РОК увеличивается до нормального значения, при тяжелой форме заболевания содержание Е-РОК в этот период еще не нормализуется, составляя 47,5±6,2% (1354,9±175,3 кл/мм 3 ). Содержание В-клеток достоверно повышается в разгар гепатита лишь при легкой форме и колеблется в границах нормы при среднетяжелой и тяжелой формах. К периоду ранней реконвалесценции у больных с тяжелой формой содержание В-клеток нарастает до 525,4±98,9 кл/мм 3 против 383,9+33,2 кл/мм 3 в разгар болезни (р
источник

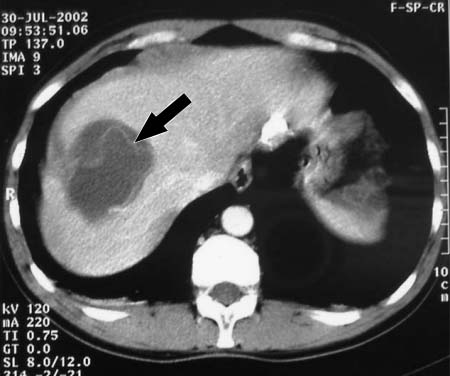
 Регулярное внутривенное введение витамина К, который позволяет избежать кровотечений. При этом переливание факторов крови не приносит должного эффекта, поэтому не применяется в лечебных целях.
Регулярное внутривенное введение витамина К, который позволяет избежать кровотечений. При этом переливание факторов крови не приносит должного эффекта, поэтому не применяется в лечебных целях.