Геморрагическая лихорадка с почечным синдромом (ГЛПС) — вирусное заболевание зоонозной природы с аэрогенным механизмом передачи возбудителя, характеризующееся системным поражением мелких сосудов, геморрагическим диатезом, гемодинамическими расстройствами и своеобразным поражением почек (интерстициальный нефрит с развитием острой почечной недостаточности).
Начиная с 1978 г., когда была введена официальная регистрация заболеваемости ГЛПС М3 РФ, по 2015 г. включительно зарегистрировано более 245 тыс. клинически диагностированных случаев ГЛПС. Более 98% от общего числа случаев ГЛПС выявлено в европейской части страны и около 2% — в азиатской части, главным образом на Дальнем Востоке.
По данным Роспотребнадзора, только за последние 16 лет, начиная с 2000 г., в 58 субъектах РФ, относящихся к семи федеральным округам, было зарегистрировано 117 433 случая ГЛПС, в т. ч. у 2 880 детей (2,5%) в возрасте до 14 лет. 516 случаев (0,5%) заболевания ГЛПС закончились летальным исходом.
В дальневосточных регионах Российской Федерации ГЛПС вызывается вирусами Хантаан, Амур и Сеул, природными резервуарами для которых являются восточный подвид полевой мыши (Apodemus agrarius mantchuricus), восточноазиатская мышь (Apodemus peninsulae) и серая крыса (Rattus norvegicus) соответственно.
На территории европейской части России ГЛПС вызывается вирусами Пуумала, Куркино и Сочи, природными резервуарами для которых являются рыжая полевка (Myodes glareolus), западный подвид полевой мыши (Apodemus agrarius agrarius) и кавказская лесная мышь (Apodemus ponticus) соответственно.
Эпидемиологический анализ заболеваемости ГЛПС в России показал, что 97,7% всех случаев ГЛПС этиологически обусловлены вирусом Пуумала, 1,5% — вирусами Хантаан, Амур, Сеул и 0,8% — вирусами Куркино и Сочи, что указывает на ведущую этиологическую роль вируса Пуумала в структуре заболеваемости ГЛПС в РФ.
Основным путем заражения является воздушно-пылевой, при котором вирус, содержащийся в биологических выделениях зверьков, в виде аэрозоля попадает через верхние дыхательные пути в легкие человека, где условия для его размножения наиболее благоприятны, и затем с кровью переносится в другие органы и ткани. Заражение возможно также через поврежденную кожу при контакте с экскрементами инфицированных грызунов или со слюной в случае покуса зверьком человека. Случаев заражения и передачи возбудителя ГЛПС от человека к человеку за всю историю изучения этой инфекции не зафиксировано.
Сложность клинической диагностики ГЛПС заключается в том, что в первые 3 дня болезни симптоматика не является специфической. Подозрительной на ГЛПС можно считать любую острую лихорадку у пациентов, проживающих на территориях природных очагов ГЛПС или посещавших очаги в течение 46 дней до начала заболевания (инкубационный период — от 7 до 46 дней, в среднем — от 2 до 4 нед.).
С 4-5-го дня болезни при ее типичном течении и достаточной квалификации медицинского персонала диагностика ГЛПС не вызывает значительных затруднений. Диагноз ГЛПС можно считать вероятным, когда клинические признаки соответствуют характерному течению болезни при наличии эпидемиологического анамнеза. При этом лабораторно подтвержденный случай необязательно должен отвечать клиническому определению случая (атипичные формы).
За 2-3 дня до появления основных симптомов заболевания могут отмечаться продромальные явления в виде незначительной общей слабости и катаральных симптомов. В дальнейшем инфекционный процесс протекает циклично и в своем развитии проходит несколько периодов.
Начальный период (1-3-й день болезни). Как правило, заболевание начинается остро, повышается температура тела, появляются озноб, головная боль, ломота в мышцах и суставах, общая слабость, сухость во рту и жажда. Могут наблюдаться катаральные проявления. У части больных в первые дни болезни на высоте лихорадки и интоксикации появляются тошнота и рвота, иногда жидкий стул до 2-3 раз в сутки без патологических примесей.
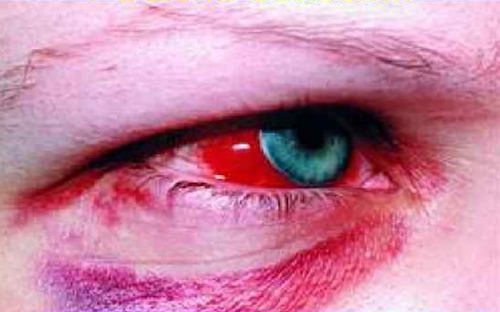
Патогномоничным для ГЛПС является нарушение зрения. Больные отмечают «туман», «сетку перед глазами» (двоение в глазах нетипично). Пациенты имеют характерный внешний вид — у них отмечаются гиперемия кожи лица, шеи, верхней половины туловища, пастозность век, инъекция сосудов склер.
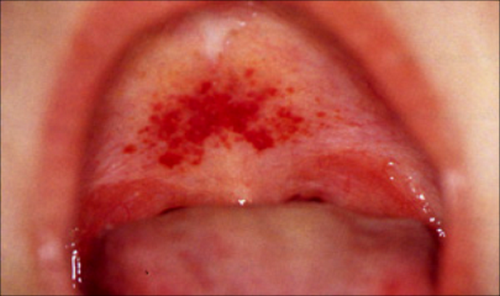
Уже в начальном периоде болезни могут появляться геморрагические проявления в виде кровяных корок в носовых ходах, непродолжительные носовые кровотечения, единичные петехиальные элементы в над- и подключичных областях, на передней поверхности грудной клетки. На фоне выраженной интоксикации у некоторых больных возможно появление менингеальных симптомов.
Регистрируется относительная брадикардия или тахикардия. У части больных на 3-4-й день болезни фиксируется артериальная гипотония с падением АД до неопределяемых значений (ОССН)! Болей в пояснице и животе в начальном периоде, как правило, не наблюдается.
В анализах крови имеются признаки сгущения крови (увеличивается содержание эритроцитов и гемоглобина крови в единице объема), у части пациентов может наблюдаться лейкоцитоз, характерна тромбоцитопения, СОЭ значительно не повышается, а при тяжелом течении даже снижается до 5 мм/ч и менее.
Олигурический период (4-11-й день болезни). К 4-5-му дню от начала заболевания отмечается тенденция к снижению температуры тела, но состояние больных не улучшается. Кардинальным признаком наступления олигурического периода является появление болей в пояснице или/и в животе у большинства пациентов. Интенсивность болей может быть от незначительной до выраженной, купируемой только наркотическими анальгетиками.
Отсутствие болевого синдрома или локализация болей только в животе характеризует атипичное течение болезни. Одновременно снижается диурез, вплоть до анурии, развивается острая почечная недостаточность (ОПН). Появляются тошнота, рвота, при выраженной уремии — икота.
Беспокоят общая слабость, бессонница или сонливость, головная боль. Гиперемия кожи лица и верхней половины грудной клетки может сохраняться или сменяться бледностью при значительных проявлениях ОПН. Выраженных отеков не бывает, но пастозность на лице, как правило, сохраняется.
Интенсивность геморрагических проявлений зависит от тяжести течения болезни. Характерными являются кровоизлияния в склеру (симптом «красной вишни»), носовые кровотечения, геморрагическая сыпь на коже, кровоизлияния под кожу, кишечные кровотечения, кровоизлияния во внутренние органы. У женщин могут быть маточные кровотечения.
Со стороны сердечно-сосудистой системы чаще фиксируются относительная или абсолютная брадикардия. В начале и первой половине олигурического периода чаще регистрируется артериальная гипотензия, во второй половине — артериальная гипертензия. В легких иногда выслушиваются сухие хрипы, при тяжелом течении — одышка. Язык суховат, обложен серым или коричневым налетом.
При пальпации живота определяются вздутие, локальная или разлитая болезненность, иногда с симптомами раздражения брюшины. У части больных появляется жидкий стул 2-3 раза в сутки без патологических примесей. У некоторых больных может пальпироваться незначительно увеличенная печень. Определяется положительный симптом Пастернацкого, чаще с обеих сторон.
В анализах крови у большинства пациентов (при тяжелом течении — почти у всех больных) в крови наблюдается лейкоцитоз от 9-10 х 10х9/л до 30 х 10х9/л и выше. Часто фиксируется сдвиг лейкоцитарной формулы влево. Характерным является появление плазматических клеток в формуле крови, наблюдается тромбоцитопения, которая при тяжелых формах может быть весьма значительной (до 5,0 х 10х9/л). Увеличение СОЭ незначительное.
Концентрации мочевины и креатинина сыворотки крови начинают увеличиваться с начала олигурического периода и достигают своего максимума к 8-9-му дню болезни. Повышение показателей может быть незначительным при легких формах и достигать значений 60,0 ммоль/л для мочевины и 2000,0 мкмоль/л для креатинина при тяжелых формах болезни.
При выраженной ОПН повышается концентрация калия, снижаются концентрации натрия и хлора в сыворотке крови. В общем анализе мочи с первого дня олигурии у 90-95% больных наблюдаются протеинурия (иногда до 33 г/л), у большинства пациентов — микрогематурия, иногда — макрогематурия и цилиндрурия. Патогномоничным для ГЛПС является обнаружение в моче клеток вакуолизированного почечного эпителия. Нередко фиксируется лейкоцитурия.
Практически постоянным признаком болезни является снижение к середине олигурического периода относительной плотности мочи (Опл) мочи. Показатели Опл в пробе мочи по Зимницкому могут колебаться на протяжении суток в пределах 1000-1005 (изогипостенурия).
Полиурический период (12-30-й день болезни). Состояние больных улучшается, уменьшается интенсивность болей, увеличивается диурез. У части больных сохраняются общая слабость, жажда, умеренно выраженная артериальная гипертензия, брадикардия, иногда — тахикардия, тяжесть или боли в пояснице. Развивается полиурия — максимальный суточный диурез наблюдается к 15-16-му дню болезни и достигает 8-10 л в сутки при тяжелых формах, характерна никтурия. Общий анализ крови нормализуется, снижаются показатели мочевины и креатинина. Патологические изменения в осадке мочи исчезают, но сохраняется изогипостенурия.
Реконвалесцентный период (с 20-30-го дня болезни). Состояние больных существенно улучшается, полностью исчезают тошнота и рвота, больные становятся активными, нормализуется диурез. Данный период в основном характеризуется астеновегетативными проявлениями, которые могут сохраняться и после выписки больного из стационара. Лабораторные показатели крови приходят в норму, в моче сохраняется изогипостенурия, которая иногда фиксируется несколько месяцев после выписки больного из стационара.
Обычно весь острый период болезни занимает 25-30 дней. У части больных астенический синдром сохраняется от нескольких месяцев до 1 года. Нередко в течение длительного периода времени наблюдаются гипотония, лабильность пульса, одышка при физической нагрузке, снижение полового влечения. Восстановление концентрационной способности почек может затягиваться до нескольких месяцев.
В зависимости от тяжести ГЛПС разделяется на легкую, среднетяжелую и тяжелую формы. При легкой форме интоксикация незначительная, температура тела не выше 38 °С, умеренное уменьшение диуреза, мочевина крови — в норме, креатинин — до 130 мкмоль/л, нормоцитоз, незначительная протеинурия, микрогематурия.
При среднетяжелой форме интоксикация выражена, температура тела до 39,5 °С, умеренно выраженный геморрагический синдром, олигурия — 300-900 мл в сутки, мочевина — 8,5-19 ммоль/л, креатинин — 131-299 мкмоль/л, лейкоцитоз — 8,0-14,0 х 109/л, протеинурия, микрогематурия.
При тяжелой форме значительная интоксикация, температура тела выше 39,5 °С, геморрагический синдром, уремия, суточный диурез — 200-300 мл, мочевина — выше 19 ммоль/л, креатинин — выше 300 мкмоль/л, лейкоцитоз — выше 14,0 х 109/л, выраженная протеинурия, микро- или макрогематурия.
Осложнения при ГЛПС: кровотечения и кровоизлияния, инфекционно-токсический шок (ИТШ), острая сердечно-сосудистая недостаточность (ОССН), отек легких, уремическая кома, почечная эклампсия, разрыв почечной капсулы, вторичные бактериальные инфекции.
По этиологии заболевание разделяют на ГЛПС, вызываемую вирусами Пуумала (ГЛПС-Пуумала), Хантаан (ГЛПС-Хантаан), Сеул (ГЛПС-Сеул), Амур (ГЛПС-Амур), Куркино (ГЛПС-Куркино), Сочи (ГЛПС-Сочи). Этиологические формы имеют особенности клинического течения.
ГЛПС-Пуумала — наиболее часто встречающаяся форма заболевания на территории РФ. Примерно у четверти больных ГЛПС-Пуумала протекает в легкой форме, у половины больных — в среднетяжелой и еще у четверти — в тяжелой форме. Геморрагический синдром встречается у 14-20% пациентов с ГЛПС-Пуумала. Другие клинико-лабораторные проявления достаточно типичны. Существенным является факт снижения относительной плотности мочи почти у 99,0% больных. Летальность при ГЛПС-Пуумала составляет 0,4-1%.
ГЛПС-Хантаан регистрируется в дальневосточных регионах РФ. Заболевание протекает тяжелее, чем ГЛПС-Пуумала: более чем у трети пациентов заболевание протекает в тяжелой форме, геморрагический синдром наблюдается почти у половины пациентов. Летальность при ГЛПС-Хантаан составляет 5-10%.
ГЛПС-Амур описана относительно недавно и регистрируется только в дальневосточных очагах. На основании наблюдения за небольшим количеством пациентов можно говорить о схожести клинической картины с ГЛПС- Хантаан с тенденцией к более частой регистрации абдоминальных симптомов и тяжелых форм болезни.
ГЛПС-Сеул регистрируется преимущественно в городских очагах на территории Дальнего Востока РФ. Имеет относительно благоприятное течение, количество тяжелых форм болезни составляет 11-12%. Геморрагический синдром встречается примерно у каждого десятого пациента. Особенностью данной формы является частое поражение печени. Повышение концентрации билирубина в сыворотке крови обнаруживается почти у каждого пятого больного, повышение активности АЛТ и ACT — более чем у половины пациентов.
ГЛПС-Куркино регистрируется в очагах, расположенных в регионах Центральной России. Заболевание протекает подобно ГЛПС-Пуумала — тяжелые формы наблюдаются примерно у четверти пациентов. Геморрагические проявления фиксируются относительно редко — у 8-9% больных. К особенностям клинического течения ГЛПС- Куркино следует отнести редкое появление у больных жажды, нарушения зрения, гиперемии лица, ротоглотки и развития полиурии. Лабораторные изменения характеризуются чаще встречающейся лимфопенией и сдвигом лейкоцитарной формулы влево с редким обнаружением плазматических клеток, более значительным увеличением СОЭ и менее выраженным снижением относительной плотности мочи. Летальность при данной форме не превышает 0,5%.
ГЛПС-Сочи регистрируется в субтропической зоне Краснодарского края и представляет собой наиболее тяжелую форму ГЛПС из регистрируемых к настоящему времени этиологических форм болезни. Более половины пациентов с ГЛПС-Сочи переносят заболевание в тяжелой форме и имеют выраженные геморрагические проявления. У большинства больных ГЛПС-Сочи отмечаются признаки поражения желудочно-кишечного тракта в виде болей в животе, тошноты, рвоты и диареи. У каждого десятого пациента отмечаются признаки поражения печени — повышение показателей билирубина и транс- аминаз. Летальность при ГЛПС-Сочи составляет 11-14%.
Следует отметить, что все описанные формы ГЛПС могут протекать атипично (безболевой и абдоминальный варианты болезни).
ГЛПС дифференцируют с гриппом и другими острыми респираторными инфекциями, сепсисом, лептоспирозом, менингококковой инфекцией, инфекционным мононуклеозом, клещевым энцефалитом и боррелиозом, острыми кишечными инфекциями.
Зачастую возникает необходимость проводить дифференциальную диагностику с рядом терапевтических и хирургических заболеваний: пиелонефритом, пневмонией, панкреатитом, аппендицитом, почечной коликой, гломерулонефритом, заболеваниями крови (острый лейкоз), отравлением токсическими веществами.
В процессе дифференциальной диагностики следует обращать внимание на следующие обстоятельства:
- в первые 3-4 дня болезни следует активно выявлять характерные для ГЛПС симптомы (сухость во рту, жажда, нарушение зрения, субсклеральные гематомы);
- боли в пояснице (и/или в животе) появляются на 3 —5-й день болезни, температура тела снижается, но состояние больных ухудшается на фоне развития ОПН;
- при большинстве инфекционных заболеваний, в отличие от ГЛПС, поражение почек (инфекционно-токсическая почка) наблюдается в первые дни болезни на высоте лихорадки;
- в первые 5-6 дней болезни в общем анализе крови характерно увеличение концентрации эритроцитов и гемоглобина за счет сгущения крови без внешних потерь жидкости, в дальнейшем характерны лейкоцитоз (до 25 и более на 10х9/л клеток) со сдвигом лейкоцитарной формулы влево, обнаружение плазматических клеток и тромбоцитопения со значительным снижением числа тромбоцитов в объеме крови при тяжелых формах;
- в общем анализе мочи существенные изменения возникают с 3—4-го дня болезни: протеинурия (от 0,33 до 33 г/л), микро- или макрогематурия, лейкоцитурия (редко значительная), часто цилиндрурия;
- к середине олигурического периода происходит снижение относительной плотности мочи (изогипостенурия), которое может сохраняться несколько месяцев после выписки больного из стационара.
Применение специфической лабораторной диагностики ГЛПС позволяет выявлять легкие и стертые формы течения инфекции. Легкие формы ГЛПС протекают с 3—4-дневной лихорадкой, умеренным синдромом интоксикации и незначительным поражением почек. Стертые формы ГЛПС представляют собой короткие лихорадочные состояния без каких-либо патогномоничных симптомов. Диагностика таких форм, как правило, осуществляется на основе эпидемиологических и лабораторных серологических данных.
Заключительный диагноз должен быть верифицирован с помощью лабораторных методов специфической диагностики. Особенно это важно при определении стертых и легких форм заболевания. Для диагностики используют сертифицированные тест-системы, прошедшие регистрацию в России.
К наиболее широко применяемым методам специфической диагностики ГЛПС относится метод флуоресцирующих антител (МФА) с использованием набора реагентов «Диагностикум ГЛПС культуральный поливалентный для непрямого метода иммунофлюоресценции» производства ФГБНУ «Федеральный научный центр исследований и разработки иммунобиологических препаратов им. М.П. Чумакова РАН».
Диагностикум выявляет специфические антитела в сыворотках крови больных людей ко всем известным к настоящему времени вирусам — возбудителям ГЛПС, обеспечивает высокую эффективность выявления больных ГЛПС, независимо от региона и источников заражения, позволяет уже к концу 1-й нед. заболевания выявлять диагностическое нарастание титров специфических антител. Наиболее качественным показателем выявления и этиологической обусловленности заболевания ГЛПС является установление 4- или более кратного нарастания титров специфических антител в парных сыворотках крови больных, взятых в динамике болезни.
При обследовании больных с явными клиническими проявлениями ГЛПС и соответствующим эпиданамнезом в 1-2% случаев антитела к вирусам — возбудителям ГЛПС могут быть не обнаружены. Это свидетельствует о возможном существовании серонегативных форм при этом заболевании.
Кроме МФА для специфической диагностики ГЛПС применяется непрямой метод иммуноферментного анализа (ИФА) с использованием «Набора реагентов для иммуноферментного выявления иммуноглобулинов класса G и класса М к хантавирусам в сыворотке (плазме) крови человека» производства ЗАО «Вектор-Бест». Чувствительность непрямого ИФА в формате использования рекомбинантного нуклеокапсидного белка, сорбированного непосредственно на иммунопанель, оказалась несколько ниже на ранних сроках болезни, о чем свидетельствуют более высокие титры флюоресцирующих антител, а также отдельные отрицательные результаты выявления IgM и IgG антител методом ИФА при положительных результатах их выявления непрямым МФА в этих же образцах.
Вирусологическая лабораторная диагностика, направленная на выделение хантавируса от больных ГЛПС, малоэффективна и практически в настоящее время не применяется.
Появление методов индикации генетического материала возбудителя непосредственно в биоматериалах в определенных случаях упростило и ускорило исследования по обнаружению хантавирусов и ихтипированию. Это особенно актуально при выявлении новых хантавирусных инфекций, принимая во внимание трудности с выделением вируса in vitro. Однако из-за отсутствия коммерческих тест-систем говорить в настоящее время об эффективности применения методов генетического анализа (ПЦР, секвенирование, ПЦР в реальном времени) для специфической диагностики ГЛПС является преждевременным.
Госпитализация обязательна. Режим в начальном и олигурическом периодах — строгий постельный. Диета — с ограничением белка, без значительного ограничения соли и жидкости.
В патогенетическую терапию включаются кристаллоидные растворы внутривенно (раствор глюкозы 5-10%, раствор натрия хлорида 0,9% и др.) с контролем концентрации микроэлементов (Na, Cl, К) в сыворотке крови. При этом суточный объем инфузионной терапии не должен превышать суточного количества выделяемой жидкости более чем на 500-700 мл.
Мочегонные препараты не назначаются. Коллоидные растворы (реополиглюкин, плазма) применяются только по жизненным показаниям (ИТШ, кровотечения и др.). Назначаются препараты, укрепляющие сосудистую стенку (рутин, аскорбиновая кислота). Целесообразно назначение антигистаминных препаратов (димедрол, пипольфен, супрастин) в среднесуточных дозировках.
Глюкокортикоиды (преднизолон) назначаются парентерально в дозе 90-120 мг/сут при тяжелом течении болезни, выраженном геморрагическом синдроме, анурии более 1 сут, олигурии дольше 11-12 дней от начала болезни, ИТШ; в последнем случае суточные дозы определяются состоянием гемодинамики.
При тяжелом течении ОПН возможно назначение допамина в/в в области низких доз (100-250 мкг/мин или 1,5-3,5 мкг/кг/мин) в течение 6-12 ч под контролем АД (3-4 дня); при развитии ИТШ доза допамина увеличивается.
Опубликованы данные о положительном эффекте при тяжелых формах ГЛПС селективного конкурентного антагониста брадикининовых В2-рецепторов (икатибант). При ДВС-синдроме в фазу гиперкоагуляции вводят гепарин 1000-5000 ед п/к каждые 4 ч, ингибиторы протеаз (контрикал, гордокс) в/в, в гипокоагуляционную фазу — антиагреганты (дицинон, трентал, курантил). Купирование тяжелых геморрагических проявлений (внутренние и наружные кровотечения и др.) осуществляется по общим правилам.
В качестве симптоматической терапии используют спазмолитики (эуфиллин 2,4%, но-шпа и др.), обезболивающие препараты (наркотические анальгетики при выраженном болевом синдроме). Антибактериальные средства назначаются в случаях присоединения вторичных бактериальных инфекций. Препараты не должны быть нефротоксичными. Суточные дозы корригируются с учетом выделительной функции почек.
В олигурическом периоде возможно проведение индуктотермии на область почек при силе анодного тока 180-200 миллиампер по 30-40 мин 1 р/сут в течение 2-5 дней. При выраженных явлениях ОПН — очистительные клизмы 1-2 р/сут.
Лечение осложнений ГЛПС (ИТШ, отек мозга и др.) — патогенетическое, согласно общим принципам. При надрыве почечной капсулы тактика консервативная, при разрыве — хирургическая.
Гемодиализ проводится при анурии более 2 сут, олигурии и отсутствии четкой тенденции к увеличению диуреза к 12-13 дню от начала болезни, гиперкалиемии более 6 ммоль/л. Повышение показателей мочевины и креатинина в сыворотке крови имеет второстепенное значение. Следует помнить, что гемодиализ сопряжен с транспортировкой больного, выполнением различного рода манипуляций и введением гепарина, что на фоне геморрагического синдрома не всегда целесообразно.
Выписка пациентов из стационара осуществляется после исчезновения острых клинических проявлений, нормализации показателей мочевины и креатинина, но не ранее 3-4-х нед. от начала болезни. Умеренная полиурия и изогипостенурия не являются противопоказаниями для выписки.
Прогноз при неосложненном течении благоприятный. Врачам, работающим в очагах ГЛПС, необходимо помнить, что у большинства пациентов заболевание протекает циклично и к 9-11 дню болезни, как правило, наступает полиурический период, за которым следует реконвалесценция. Чрезмерно активные и необоснованные мероприятия в острый период — нередкая причина неблагоприятных исходов при ГЛПС.
У переболевших ГЛПС формируется длительный (вероятно, пожизненный) стойкий иммунитет. Случаев повторного заболевания ГЛПС не отмечалось.
Реабилитация больных ГЛПС начинается уже в стационаре в периоде реконвалесценции (с 21-25 дня болезни). Постепенно расширяется режим двигательной активности, больные переводятся на палатный режим, а в дальнейшем — на общий режим с возможными прогулками на воздухе.
Лечебная физкультура осуществляется ежедневно, преимущественно в виде дыхательной гимнастики, простых упражнений для рук и ног. Занятия проводятся под контролем методиста ЛФК. Противопоказаны упражнения, связанные с прыжками и резкими изменениями положения туловища.
В периоде реконвалесценции назначается общий стол без употребления острых продуктов и алкоголя. Обильное питье — минеральные воды типа «Ессентуки № 4».
При постинфекционной астении возможно назначение в/в 40% раствора глюкозы, в/м инъекций кокарбоксилазы 0,05 г, АТФ по 1 мл 1% раствора. Назначаются адаптогены (настойка лимонника, аралии, заманихи, женьшеня; экстракт элеутерококка, родиолы розовой). Курс лечения составляет 2-3 нед. Показаны антиоксиданты — витамин Е по 50-100 мг/сут, витамин А по 1 драже/сут; аскорбиновая кислота по 0,1 г 3 р/сут на протяжении 3-4 нед.
При неврологических нарушениях назначают витамины В1 и В 6 по 1 мл п/к через день 10-12 дней, никотиновую кислоту в виде 1%-ного раствора по 1 мл в течение 10-15 дней. Рекомендуются поливитамины внутрь: ундевит, супрадин, центрум и др.
При выраженных признаках гипофизарной недостаточности по согласованию с врачом-эндокринологом могут быть назначены адиуректин, питуитрин.
При поясничном болевом синдроме применяют физиотерапию (индуктотермию, ультразвук, электрофорез с йодом и новокаином, парафиновые и грязевые аппликации).
При миокардиодистрофии лечение должно проводиться с участием терапевта-кардиолога. Назначают рибоксин по 0,2 3 р/сут внутрь или в инъекциях, АТФ по 1 мл 1% раствор в/м, аскорбиновую кислоту по 0,1-0,2 г 3 р/сут, панангин по 100 мг 3 р/сут.
При почечных проявлениях резидуального синдрома или развитии хронической тубулоинтерстициальной нефропатии (ХТИН) дополнительно назначают трентал, который улучшает микроциркуляцию и активирует обменные процессы в почках, способствует развитию коллатерального кровообращения в почечной ткани. Препарат назначают по 0,1 г 3 р/сут курсами по 2-3 нед.
В.Г. Морозов, А. А. Ишмухаметов, Т.К. Дзагурова, Е А. Ткаченко
источник
Геморрагическая лихорадка с почечным синдромом (ГЛПС, мышиная лихорадка) – заболевание, которое вызывает контакт с выделениями грызунов. Инфицирование происходит группой вирусов, принадлежащих к роду Hantavirus семейства Bunyaviridae.
Патогенез неизвестен, но по данным исследований установлено, что иммунные механизмы играют важную роль.
Тяжелые формы ГЛПС регистрируют в странах Востока. Количество заболевших в Китае составляет примерно 100-250 тысяч в год. Мягкая форма чаще встречается в скандинавских странах Скандинавии. Заболеть ГЛПС можно в течение года, но заболеваемость зависит от динамики популяции грызунов-носителей.
Сезонные вспышки ГЛПС весной и осенью происходят из-за активного размножения мышей и связаны с увеличением контактов с грызунами на фоне садово-полевых работ. Наиболее тяжелая форма геморрагической лихорадки с синдромом почечной недостаточности вызвана вирусом Хантаан (HTNV) в Азии. Пуумала – наиболее распространенный хантавирус, но заболевание протекает легче. Встречается в Европе, России, и Балканах. Вирус Dobrava инициирует более тяжелую форму ГЛПС. Причины различий в клинической тяжести неизвестны. Смертность и заболеваемость варьируются от 5-15% в зависимости от патогенности штамма возбудителя.
Повышенная заболеваемость у мужчин обусловлена их более высокой активностью на открытом воздухе, что приводит к контакту с инфицированными грызунами.
Геморрагическая лихорадка с синдромом почечной недостаточности обычно развивается у лиц старше 15 лет (20-60). У детей и подростков младше 15 лет болезнь является легкой и часто протекает в субклинической форме.
Вирусы рода Hantavirus (семейство Bunyaviridae) вызывают различные формы геморрагической лихорадки с синдромом почечной недостаточности. Тяжесть заболевания зависит от штамма вируса и географического распределения. Хантавирусы, связанные с ГЛПС, включают вирус Хантаан (HTNV), Добрава / Белград (DOBV), Сеул (SEOV), Пуумала (PUUV) и Сааремаа (SAAV).
• Корейская геморрагическая лихорадка – тяжелый тип болезни, наблюдаемый в Азии, вызван хантавирусом и передается зараженной полосатой полевой мышью A agrarius mouse.
• Балканская геморрагическая лихорадка, тяжелый тип, встречается в балканских странах, вызван вирусом Добрава, грызун — A flavicollis.
• Легкая и умеренная форма геморрагической лихорадки с синдромом почечной недостаточности вызвана вирусом Сеула и передается зараженными грызунами рода Раттусратута и Rattusnovergicus.
• Умеренная форма геморрагической лихорадки с синдромом почечной недостаточности, наблюдаемая в Европе, вызвана вирусом Puumala и передается грызунами Clethrionomysglariolus.
Вирус обычно попадает к человеку через вдыхание экскрементов зараженных животных (например, мочи, фекалий, слюны). Укус грызуна может также привести к инфицированию человека. На сегодняшний день не существует подтверждения для передачи болезни между людьми.
В группу риска входят лица, связанные с сельскохозяйственной деятельностью, военные (полевые учения), любители походов, дачники и пр.
Проживание в зонах обитания грызунов, вероятность контакта с продуктами их жизнедеятельности (например, уборка дачи после зимы), клиническая картина и лабораторные данные, включая положительный анализ крови на ГЛПС, позволяют поставить окончательный диагноз.
Выполнение биопсии почек не является необходимой мерой.
• ПЦР-тест;
• ИФА в динамике;
• ОАМ и ОАК;
• проба Зимницкого;
• суточная протеинурия;
• мочевина, креатинин;
• коагулогоамма;
• показатели кислотно-основного состояния;
• электролиты крови и пр.
Инструментальная диагностика проводится по показаниям и включает:
• УЗИ почек;
• ЭКГ;
• ФГДС;
• рентгенографию органов грудной клетки или КТ;
• МРТ и пр.
Клинические особенности при геморрагической лихорадке с синдромом почечной недостаточности состоят из триады:
• повышение температурной реакции;
• кровоизлияния;
• почечная недостаточность.
К распространенным симптомам на начальном этапе заболевания относят:
• низкое артериальное давление;
• головную боль;
• миалгию и костно-суставные боли;
• озноб;
• жажду;
• абдоминальную и поясничную боль;
• диспепсию.
Инкубационный период – 12-16 дней.
У детей ГЛПС чаще протекает в субклинической форме и при тяжелом течении может осложниться гиповолемическим шоком. Период с момента инфицирования до клинических проявлений – 4-42 дня.
Болезнь имеет 5 прогрессирующих стадий:
• инкубационная;
• фебрильная,
• олигоурия;
• полиурия;
• выздоравление.
Только 1/3 пациентов проходит через все стадии.
Фебрильная стадия типична для всех пациентов и продолжается 3-7 дней. Болезнь характеризуется резким повышением температуры до 40° C. Пациенты предъявляют жалобы на головную боль, озноб, боль в животе и пояснице, недомогание, снижение остроты зрения.
На фоне лихорадки появляется геморрагическая сыпь на грудной клетке, в подмышечных впадинах, шее. На слизистой мягкого неба визуализируются петехии.
Субконъюнктивальное кровоизлияние отмечено у 30% пациентов. Брадикардия и пастозность лица встречаются достаточно часто. Тахикардия может указывать на предстоящий шок.
С почечной недостаточностью и низким давлением сталкиваются 11% пациентов.
При тяжелом течении осложнением присоединяется острый живот на фоне пареза кишечника. Повышенный уровень амилазы и липазы в сыворотке крови, в сочетании с острой болью в животе, указывает на острый панкреатит. Диагноз можно подтвердить при компьютерной томографии поджелудочной железы, которая показывает отек самого органа и окружающих тканей. У пациентов могут быть судороги или бесцельные движения.
• повышенный уровень гематокрита, вызванный гемоконцентрацией;
• тромбоцитопения (определяет прогноз и тяжесть почечной недостаточности);
• нормальное количество лейкоцитов или лейкоцитоз с атипичными лимфоцитами;
• нарушения в работе свертывающей системы крови (удлинение времени свертывания и пр.).
В моче временная протеинурия (как правило, разрешается в течение 2 недель) и микрогематурия.
Олигурическая стадия происходит у 65% пациентов и длится около 3-6 дней.
Для нее характерно острое поражение почек, характеризующееся резким снижением выработки мочи, гипертонией, склонностью к кровотечениям, вызванной уремией, отеками. На этом этапе мочевина и сывороточный креатинин крови достигают наивысшего уровня.
Гипонатриемия, гиперфосфатемия и гиперкалиемия также могут возникать во время олигурической фазы. Серьезное осложнение при неадекватной терапии – отек легких. На данной стадии уровень тромбоцитов возвращается к норме.
Выделение большого количества мочи обычно происходит в течение 2-3 недель. Суточный диурез составляет 3-6 литров, симптомы предыдущих стадий исчезают.
На данном этапе может возникнуть обезвоживание, если инфузионная терапия недостаточна.
Реконвалесценция продолжается до 3-6 месяцев.
Клиническое выздоровление обычно начинается в середине второй недели с постепенным разрешением симптомов и азотемии.
Важно! Концентрационная способность почечных канальцев восстанавливается в течение многих месяцев, поэтому необходимо соблюдать все рекомендации врача и сдавать анализы.
Жалобы пациентов на стадии выздоровления:
• слабость;
• утомляемость;
• мышечные боли;
• снижение аппетита.
Во время выздоровления постепенно восстанавливается привычная масса тела.
Терапия зависит от стадии заболевания, уровня дегидратации и состояния гемодинамики. Самый важный шаг в лечении геморрагической лихорадки с почечным синдромом – поддержание гемодинамики пациента и регидратация. Во время активной стадии болезни жизненно необходимо восполнение баланса жидкости и электролитов.
Показания к различным лекарствам основаны на клинике в разные стадии заболевания.
При шоковом состоянии используют препараты, повышающие давление и внутривенно вводят альбумин. Чрезмерная инфузионная терапия может привести к экстравазации, состоянию, когда стенки капилляров начинают пропускать кровь.
Во время олигоурической стадии показаны диуретики (Фуросемид), в случае неэффективности – проведение заместительной почечной терапии, особенно, если есть перегрузка жидкостью, гиперкалиемия и ацидоз.
Если повышено артериальное давление, используют гипотензивные препараты.
Антибиотики показаны только при подозрении на вторичное инфицирование.
При кровотечении переливают кровь и ее компоненты и назначают антагонисты Н 2 –рецепторов.
В случае диссеминированной внутрисосудистой коагуляции вводят свежую плазму или плазмозаменители.
Рекомендуется питание с низким содержанием натрия и с ограничением жидкости во время олигурической фазы. В период полиурии потребление жидкости свободное.
Из рациона исключают все острые, кислые, копченые, соленые продукты. Пищу готовят с щадящей термической обработкой. Питание – частое, дробное, малыми порциями.
Восстановление обычно начинается с 10-11 дня. Период ранней реконвалесценции может продолжаться от нескольких суток до нескольких недель, поэтому необходим тщательный контроль электролитных нарушений и признаков обезвоживания.
Фаза выздоровления длится 3-6 месяцев. Гломерулярные повреждения, как правило, проходят, и концентрационная способность почечных канальцев постепенно улучшается. Последующее наблюдение проводят еженедельно, пока состояние не нормализуется. В последующем анализы контролируют 1 раз в месяц, так как у некоторых пациентов сохраняется протеинурия и повышенное артериальное давление.
У 10-12 % пациентов может развиться пиелонефрит (при присоединении бактериальной флоры), нефросклероз, поэтому наблюдение нефролога обязательно.
Поведение человека может увеличить заболеваемость, поэтому основные превентивные меры включают следующее:
• Правильное хранение пищи и борьба с грызунами.
• Соблюдение мер предосторожности во время проведения садово-полевых работ, в походах, сборах и пр.
• Избегание кемпинга в полях, засаженных зерновыми культурами.
• Хранение соломы вдали от жилища.
Разработка недорогой, безопасной, эффективной и многовалентной вакцины против этой группы вирусов могла бы стать лучшей формой профилактики в эндемичных регионах. Однако высокое генетическое и антигенное разнообразие патогенных хантавирусов в сочетании со спорадическим характером вспышек заболеваний создают серьезные проблемы для разработки эффективных профилактических вакцин.
ГЛПС в редких случаях может привести к развитию следующих состояний:
• забрюшинное кровотечение:
• кровоизлияние в ткани внутренних органов;
• желудочно-кишечное кровотечение;
• отек легких;
• гипопитуитаризм;
• дисфункция гипофиза на фоне атрофии передней доли.
ГЛПС является самоограничивающейся болезнью, и большинство пациентов восстанавливается без осложнений; однако у некоторых людей могут сохраняться симптомы неблагополучия со стороны нервной системы и почек.
Нарушение реабсорбции натрия наблюдается через 12 месяцев после болезни, вызывая его повышенную экскрецию с мочой.
В ряде случаев диагностируют гиперкальциурию и гиперфосфатурию. Приблизительно у 1 из 10 взрослых с терминальной стадией почечной недостаточности в крови присутствуют специфичные к хантавирусу антитела.
В литературе есть данные, что панкреатит и орхит могут быть осложнениями при ГЛПС.
источник
Анисимова Татьяна Анатольевна
ассистент кафедры детских болезней с курсом инфекционных болезней медицинского факультета Чувашского государственного университета имени И. Н. Ульянова, г. Чебоксары
Ефимова Эльвира Васильевна
канд. мед. наук, доцент кафедры детских болезней с курсом инфекционных болезней медицинского факультета Чувашского государственного университета имени И. Н. Ульянова, г. Чебоксары
Клиническая диагностика ГЛПС в ранние сроки затруднена в связи с тем, что на начальных стадиях симптомы болезни могут напоминать многие острые лихорадочные состояния, прежде всего ОРЗ, пиелонефрит, острую пневмонию. Наряду с этим существуют атипичные, легкие, стертые формы геморрагической лихорадки, плохо диагностируемые даже в разгар болезни. По данным Т. К. Дзагуровой и соавт. (1983) в некоторых стационарах около половины больных ГЛПС выписывалось с другим диагнозом. В то же время может наблюдаться гипердиагностика (по нашим наблюдениям, до 30 % больных, госпитализированных с диагнозом ГЛПС в инфекционное отделение в 2009 году, выписывались с другим диагнозом). В связи с этим приобретает особое значение ранняя специфическая лабораторная диагностика геморрагической лихорадки.
Лабораторная диагностика хантавирусной инфекции начала развиваться с 80-х годов XX века. Диагноз ГЛПС ставится на основании характерных клинических симптомов, изменений гемограммы и общего анализа мочи, а также эпидемиологических и лабораторных данных.
После перенесенного заболевания остается стойкий длительный иммунитет. Специфическая диагностика ГЛПС основывается в основном на обнаружении специфических иммуноглобулинов [6, с. 66; 9, с. 14; 11, с. 73].
IgG антитела к вирусам Хантаан и Пуумала в сыворотках крови реконвалесцентов после перенесенного заболевания, по-видимому, остаются пожизненно [8, с. 100]. Доказательством заболевания ГЛПС служит серологическое подтверждение наличия вируса в организме человека — появление специфических иммуноглобулинов классов М и G (сероконверсия) или нарастание количества специфических иммуноглобулинов класса G в сыворотке крови в ходе заболевания.
В настоящее время наибольшее распространение получил метод диагностики ГЛПС на основе использования флуоресцирующих антител. В 1978 году корейским ученым впервые удалось с помощью метода флуоресцирующих антител (МФА) обнаружить антиген вируса геморрагической лихорадки в легочной ткани диких грызунов, а также специфические антитела к этому вирусу в сыворотках крови людей, переболевших данной инфекцией [13, с. 865]. В прямом МФА флуоресцентным красителем (обычно флуоресцеин изотиоцианатом) метятся антитела, узнающие вирусный антиген. В непрямом МФА, который используется для детекции антивирусных антител в физиологических жидкостях больных ГЛПС [2, с. 19], антивирусные антитела находятся в исследуемом образце и немечены, после связывания с антигеном добавляются антитела против иммуноглобулинов человека, несущие флуоресцентную метку. По окончании реакции образцы микроскопируются в ультрафиолетовом свете с соответствующей длиной волны. В случае присутствия антител к вирусу в клетках с помощью флуоресцентного микроскопа наблюдают специфическое свечение. В качестве антигена обычно используют криостатные срезы легких инфицированных грызунов [1, c. 184; 4, c. 678; 10, c. 619] или культуру клеток, зараженных вирусом. Внедрение МФА в широкую практику с начала 80-х годов позволило выявлять атипичные, стертые формы ГЛПС, а также подтверждать диагноз в сомнительных случаях. Этот метод позволяет обнаружить к вирусу ГЛПС уже на первой неделе с начала заболевания [4, c. 676]. Выявляемые МФА антитела представляют собой суммарно иммуноглобулины классов IgM и IgG, но в силу особенностей иммунохимических взаимодействий, антитела класса М этим методом отдельно плохо выявляются, поэтому МФА не используется как метод массового скрининга специфических IgM [5, c. 43]. Поскольку в эндемичных районах у 10—30 % здорового населения определяются специфические антитела класса IgG, для подтверждения серологического диагноза требуется исследование МФА парных сывороток крови для выявления 4-х кратного и более нарастания титра антител [7, c. 26]. В тоже время большинство серопозитивных обследованных не отмечают в анамнезе заболеваний, схожих с ГЛПС, что говорит о большом распространении стертых и легких форм болезни, обуславливающие естественную иммунизацию населения [4, c. 679]. Использование парных сывороток затрудняет постановку диагноза, кроме того, некоторыми авторами показано, что нарастание титра антител во второй сыворотке при ГЛПС удается зарегистрировать далеко не во всех случаях. Так, диагностическое нарастание титров антител было установлено только у 27—45,8 % больных, обследованных в оптимальные сроки [1, c. 185].
Следует отметить, что МФА, несмотря на свою широкую распространенность, имеет ряд серьезных недостатков. Метод малопроизводительный и достаточно трудоемкий. Оценка результатов реакции носит субъективный характер, а в ряде случаев регистрируется неспецифическое свечение.
Учитывая эти особенности, требовалось найти новые методы диагностики ГЛПС на ранних стадиях, хотя МФА остаются основным методом диагностики на территории РФ.
Метод иммуно-пероксидазного окрашивания отличается от МФА только тем, что вместо флуоресцентной метки используется пероксидаза хрена. После инкубирования антител с пероксидазой с исследуемым образцом добавляется субстрат для пероксидазы, который изменяет цвет при воздействии на него фермента. Достоинство метода состоит в том, что просматривать образцы можно в обычный микроскоп [12, c. 279]. Недостаток данного метода в том, что он еще более громоздкий, чем МФА, а также в том, что эндогенные пероксидазы могут вызывать довольно сильное фоновое окрашивание.
Были также предложены методы диагностики на основе реакции торможения гемагглютинации (РТГА) специфическими к вирусу антителами, поскольку многие штаммы хантавирусов обладают способностью агглютинировать эритроциты [16, c. 896]. С помощью модифицированной РТГА антитела удавалось определять на 2—8 день от начала заболевания в титрах 1:20—1:160. Однако и в этом случае перед исследователями стояла все та же проблема — необходимость определения антител в парных сыворотках.
Другой подход для ранней диагностики ГЛПС основан на определении IgM к вирусу. Специфические IgM появляются на самых ранних стадиях развития заболевания и циркулируют в крови всего несколько месяцев. Новый метод диагностики был предложен Engvall и Perlmann и Van Weemen и Schuurs — твердофазный иммуноферментный анализ (ИФА), основанный на принципе меченых антител или антигенов с использованием в качестве метки определенного фермента (Enzyme Linked Immunosorbent Assay — ELISA, ИФА). Иммуноферментный анализ высокочувствителен, специфичен, прост и быстр в постановке. Используется, главным образом, метод непрямого ИФА. В качестве антигена применяется очищенный вирус, рекомбинантные белки или синтетические полипептиды, представляющие собой отдельные детерминанты структурных вирусных белков — нуклеокапсидный белок (который экспрессировался в бактериях Е. сoli), G1 и G2. Показано, что нуклеокапсидный белок (НКБ) является основным антигеном, на который отмечается наиболее интенсивный гуморальный иммунный ответ. Причем он регистрируется уже в начале развития ГЛПС [15, c. 779].
Иммуноферментные наборы реагентов для выявления специфических иммуноглобулинов класса М (IgM) к хантавирусам позволяют проводить раннюю лабораторную диагностику этого заболевания, начиная с 5—7 суток после начала заболевания. Максимальная концентрация IgM отмечается на 8—25 день после проявления болезни. Выявление IgM является строгим доказательством наличия острой инфекции. К концу третьего месяца после начала заболевания IgM практически не обнаруживаются. В отдельных случаях возможно выявление специфических IgM в течение 1—3 лет после заболевания.
Научные разработки привели к созданию коммерческой тест-системы на основе ИФА (Progen), а в нашей стране разработка хантавирусных диагностикумов производится ФГУП «Предприятие по производству бактерийных и вирусных препаратов института полиомиелита и вирусных энцефалито в им. М. П. Чумакова РАМН». Это «Культуральный поливалентный диагностикум ГЛПС для выявления антител непрямым МФА» — для cеродиагностики ГЛПС у больных и “Иммуноферментная тест-система (Хантагност) — для выявления хантавирусного антигена — для оценки напряжённости эпизоотического процесса у грызунов — основного фактора, используемого для прогнозирования эпидемической ситуации. На базе ФГУП НПО «Микроген», филиал «Иммунопрепарат» разработана иммуноферментная тест-система для выявления антител класса М к вирусу ГЛПС, которая прошла государственные испытания, но еще не внедрена в широкую практику [3, c. 88].
Для упрощения процедуры диагностики разработаны методы ранней диагностики ГЛПС путем однократного определения в одном и том же образце свежесобранной мочи больного антигена вируса с помощью твердофазного иммуноферментного анализа (ИФА) и антител к нему с помощью непрямого метода флюоресцирующих антител (НМФА) в ранний период болезни (с 5-й по 13-й день). Одновременное определение в одном и том же образце мочи антигена вируса и антител к нему двумя различными методами (ИФА и НМФА) повышает точность, надежность способа, позволяет избежать ошибок при постановке диагноза. Преимуществом предлагаемого способа является также использование в качестве материала для исследования мочи, а не крови, что исключает дополнительный риск заражения другими заболеваниями (гепатит, СПИД). Необходимое для диагностики количество мочи (0,5—1,0 мл) столь невелико, что его, возможно, получить у больного даже при анурии (катетером).
Для диагностики ГЛПС также используются различные варианты иммуноблотинга с использованием в качестве твердой фазы нитроцеллюлозных мембран (НИМ) [6, c. 67]. Фирма Microgen (Германия) предлагает нитроцеллюлозные полоски с сорбированным на поверхности рекомбинантным НКБ вирусов Пуумала и Хантаан.
Как развитие подходов, использующих нитроцеллюлозные мембраны, можно рассматривать иммунохроматографические методы. Они позволяют определять специфические антитела всего за несколько минут. В их основе лежит так называемая латеральная иммунодиффузия. Иммунохроматографический анализ (ИХА) — это метод определения наличия определенных концентраций веществ в биологических материалах (моча, цельная кровь, сыворотка или плазма крови, слюна, кал и т. д.). Данный вид анализа осуществляется при помощи индикаторных полосок, палочек, панелей или тест-кассет, которые обеспечивают быстроту проведения тестирования [3, c. 89]. Фирма «Reagena» (Финляндия) предлагает иммунохроматографические тесты для ранней и быстрой диагностики хантавирусных инфекций, вызванных вирусами Puumula, Hantaan («Бесприборный экспресс тест PUUMALA», экспресс-тест для выявления IgM-антител к очищенному белку нуклеокапсида вируса Puumala и «Бесприборная диагностика HANTAAN», экспресс-тест для выявления IgM-антител к очищенному белку нуклеокапсида вируса Hantaan), позволяющие определить специфические иммуноглобулины класса М к очищенному белку нуклеокапсида соответствующего вируса всего за несколько минут. При нанесении капли образца начинается совместная диффузия исследуемых антител с антителами против иммуноглобулинов М человека, меченных коллоидным золотом. Когда комплекс, содержащий специфические IgM, достигает молекул антигена, сорбированных на НЦМ, образуется розовая полоса. Выявление IgM к рекомбинантному нуклеокапсидному белку осуществляется всего за 5 минут. При этом чувствительность и специфичность достигают 97-100 % [14, c. 416]. Так как в реакцию вступают только антитела IgM класса, тест определяет только острую инфекцию. IgG не влияет на результат теста. Обычно положительный результат теста может быть получен в первый же день проявления симптомов ГЛПС. В качестве исследуемого материала могут быть использованы сыворотка, плазма или кровь из пальца [3, c. 87].
Молекулярно — биологические методы — определение специфического участка ДНК/РНК в геноме возбудителя (полимеразная цепная реакция — ПЦР и лигазная цепная реакция — ЛЦР) очень перспективны в плане ранней диагностики ГЛПС. Метод обладает высочайшей чувствительностью, приравниваясь к «золотому стандарту». Преимущества ПЦР имеют особое значение именно в отношении хантавирусов, поскольку эти вирусы плохо размножаются в клеточных культурах, не оказывают цитопатического действия и до сих пор не имеют удачной лабораторной модели.
Диагностика ГЛПС с использованием обратной транскрипции-полимеразной цепной реакции (ОТ-ПЦР) является высокочувствительным методом ранней диагностики, Метод ОТ-ПЦР уже более 10 лет используется для детекции и генетической характеристики хантавирусов. Анализ данных ОТ-ПЦР при обнаружении вирусной РНК в крови и сыворотках больных в зависимости от сроков начала болезни свидетельствует о наличии вирусемии в крови больных довольно длительное время — до 15 дня от появления первых признаков заболевания [7, c. 28]. К сожалению, этот метод не применяется в широкой практике в связи с отсутствием коммерческих амплификационных диагностических систем, а тест-системы, разработанные в нашей стране ГНЦ вирусологии и биотехнологии «Вектор» совместно с ЗАО «Вектор-Бест» и ЦНИИ эпидемиологии, г. Москва, не освоены в промышленном масштабе.
Метод обратной транскрипции — полимеразной цепной реакции (ОТ-ПЦР) трудоемок и требует наличия высококвалифицированного лабораторного персонала. Альтернативой традиционным методам может стать разработанная модификация метода ОТ-ПЦР в реальном времени. Основные преимущества этого метода в том, что он является одостадийным, проводится при обычных условиях с доступными реагентами, и использует технологию, подходящую для многих лабораторий. В результате исследований [14, c. 416] появился метод прямой детекции продуктов амплификации в присутствии бромистого этидия — ПЦР в режиме реального времени, названной тогда кинетической и повлекшей за собой создание нового типа ДНК амплификаторов, оснащенных оптическим модулем и способными детектировать изменение флуоресценции реакционной смеси.
Помимо полимеразной цепной реакции, существует еще и лигазная цепная реакция (ЛЦР), которая известна гораздо меньше, но имеющая при этом в плане диагностики ряд преимуществ перед ПЦР. Впервые настоящая ЛЦР была применена в 1991 г. для детекции мутаций в гене глобина, где им была задействована уже термостабильная ПАД-зависимая ДНК лигаза, и олигонуклеотидов было уже четыре вместо двух. Таким образом, целевые продукты каждого цикла становились матрицами для последующих. Это уже была настоящая цепная реакция с геометрическим накоплением целевого продукта.
Разработанные методики могут быть использованы в дальнейшем для диагностических целей и позволят проводить высокочувстви–тельную детекцию хантавирусной РНК за максимально короткое время на ранних стадиях ГЛПС.
1. Астахова Т. И., Слонова Р. А., Павленко О. В. и др. Результаты изучения гуморального иммунитета при геморрагической лихорадке с почечным синдромом в Приморском крае. // Вопр. вирусологии. — 1986. — № 2. — С. 183—186.
2. Верета Л. А., Елисова Т. Д., Воронкова Г. М. Обнаружение антител к вирусу Хантаан в моче больных ГЛПС // Вопр. вирусологии. — 1993. — № 1. — С. 18—21.
3. Воробьев В. С., Ладыженская И. П. и др. Результаты государственных испытаний препарата: «ИФА-ГЛПС-ПУУМАЛА-IGM», тест–система иммуноферментная для выявления антител класса М к хантавирусу, серотипа Пууумала-возбудителю ГЛПС. // Геморрагическая лихорадка с почечным синдромом: историяизучения ми современное состояние эпидемиологи, патогенезе, диагностики и лечения и профилактики. / Материалы Всероссийской научно-практической конференции. — Уфа РИО филиала «Иммунопрепарат» ФГУП «НПО «Микроген» МЗ и СР РФ. — 2008. — С. 88.
4. Дзагурова Т. К. Серологическое обследование больных геморрагической лихорадкой с почечным синдромом в Европейской части СССР // Вопросы вирусологии.1983. — № 6. — С. 676—680.
5. Иванис В. А., Маркелова Е. В., Перевертень Л. Ю. Иммунологические аспекты нарушения гомеостаза у больных геморрагической лихорадкой с почечным синдромом // Гомеостаз и инфекционный процесс. — 2003. — № 8 — С. 41—45.
6. Иванов Л. И., Здановская Н. И., Волков В. И., Деконенко А. Е. Особенности циркуляции хантавирусов и эпидемиологии ГЛПС в Российском Приморье // Актуальные проблемы мед. вирусологии: Материалы научн. конф., посвящ. 90-летию со дня рожд. М. П. Чумакова — М., 1999. — С. 66.
7. Морозов В. Г. Клинико-эпидемиологическая характеристика, специфическая диагностика и лечение различных вариантов геморрагической лихорадки с почечным синдромом: автореф. дис. … д-ра мед. наук / В. Г. Морозов. — СПб.: ВМедА, 2002. — 42 с.
8. Слонова Р. А., Астахова Т. И., Компанец Г. Г. Результаты изучения геморрагической лихорадки с почечным синдромом на юге Дальнего Востока России. // Журнал микробиологии, эпидемиологии и иммунобиологии. 1997. — № 5. —С. 97—101.
9. Сокотун С. А. Иммунологическая и серотипическая характеристика природных очагов хантавирусной инфекции в Приморском крае: автореф. дис. канд. мед. наук / С. А. Сокотун. Владивосток, 2002. — 20 с.
10. Ткаченко Е. А., Донец М. А., Дзагурова Т. К. и др. Усовершенствование лабораторной диагностики геморрагической лихорадки с почечным синдромом. // Вопр. вирусологии. — 1981. — № 5. — С. 618—620.
11. Ткаченко Е. А., Дзагурова Т. К., Петров В. А. Эффективность применения культуральных антигенов для серодиагностики ГЛПС с помощью метода иммунофлюоресценции. // Вопросы вирусологии. 1988. — № 1. — С. 71—75.
12. Fields B. N: / Fields B. N., Kaufinann R. S. Pathogenesis of viral infection // Fundamental virology. NY. — 1986 — V. 1 — p. 277—289.
13. Lee H. W. Hemorrhagic fever with renal syndrome in Korea // Rev. infect, dis.- 1989. — Vol. 11, №. 4. — P. 864—876.
14. Higuchi R., Dollinger G., Walsh P. S., Griffith R. Simultaneous amplification and detection of specific DNA sequences // Biotechnology. —1992. —V. 10. —P. 413—417.
15. Schmaljohn C, Sugiyama K,. et al Baculovirus expression of the small genome segment of Hantaan virus and potential use of the expressed nucleocapsid protein as a diagnostic antigen // J. Gen. Virol. — 1988. — Vol. 69. — P. 777—786.
16. Tsai T., Tang Y., Hu S., et al. Hemagglutination inhibition antibody in hemorrhagic fever with renal syndrome // J. Infect. Dis. — 1984. — Vol. 150. — P. 895—898.
источник
Специфическая лабораторная диагностика ГЛПС
В настоящее время для лабораторной диагностики ГЛПС разработано несколько методов исследования, которые нашли применение для определения антител к хантавирусу, индикации специфического антигена и РНК хантавируса: непрямой метод иммунофлюоресценции (НРИФ), или непрямой метод флюоресцирующих антител (НМФА) с использованием культуральных хантавирусных антигенов; иммуноферментный анализ
(ИФА); радиоиммунологический анализ (РИА); реакция непрямой гемагглютинации (РНГА); реакция торможения гемагглютинации (РТГА);
полимеразная цепная реакция (ПЦР).
1. Серологическая диагностика с помощью НРИФ (НМФА) позволяет выявить у больных антитела к хантавирусу в первые дни от начала заболевания, проследить динамику их накопления и получить информацию о сроках сохранения антител у переболевших ГЛПС. Именно этот метод чаще всего используется в повседневной диагностической работе.
На сегодняшний день наиболее известным в России сертифицированным диагностическим препаратом для специфической диагностики ГЛПС является «Диагностикум геморрагической лихорадки с почечным синдромом культуральный, поливалентный для непрямого метода иммунофлюоресценции» производства ФГУП «ПИПВЭ им. М.П.Чумакова РАМН». Диагностикум выявляет специфические антитела в сыворотках крови больных людей ко всем известным к настоящему времени вирусам-
возбудителям ГЛПС. Определяемые НРИФ антитела представляют собой суммарно иммуноглобулины классов IgМ и IgG. Наиболее качественным показателем заболевания ГЛПС является установление четырёхили более кратного нарастания титров специфических антител в парных сыворотках крови больных, взятых в динамике болезни. Необходимость обследования парных сывороток крови для нахождения диагностического нарастания
титров специфических антител к вирусам-возбудителям ГЛПС связана с тем,
что у здорового населения, проживающего в различных географических районах нашей страны, установлено наличие естественного иммунитета по отношению к хантавирусам, в связи с чем не исключена возможность выявления у больных анамнестических антител.
Оптимальной для практического применения является следующая схема серологического обследования больных с подозрением на ГЛПС (в
соответствии с Инструкцией по применению диагностикума ГЛПС культурального, поливалентного для непрямого метода иммунофлуоресценции, утвержденной главным государственным санитарным врачом РФ Г.Г. Онищенко от 13.07.2005 г.):
— забор первой пробы крови от больного как можно раньше с начала заболевания (желательно сразу при поступлении в стационар или в поликлинике при первичном обращении лихорадящего больного),
— забор второй пробы крови – спустя 3-4 дня после взятия первой.
В случае, если не удалось обнаружить специфические антитела в двух сыворотках, следует провести третий забор крови через 7-8 дней после взятия второй сыворотки. Серологическая диагностика с помощью НРИФ позволяет выявить у больных антитела к хантавирусу в конце первой недели заболевания в титре 1:64 – 1:128 и выше. К концу 2-3 недели антитела достигают максимального уровня (1:512 и выше), который, как правило,
держится до 4-5 месяцев после исчезновения клинических симптомов заболевания, а затем наблюдается снижение титра антител. После перенесенного заболевания специфические антитела к хантавирусу в невысоком титре 1:64 — 1:128 персистируют длительно, практически пожизненно.
2. Иммуноферментный анализ (ИФА) является другим эффективным методом в лабораторной диагностике ГЛПС с помощью которого в сыворотках крови больных можно обнаружить специфические антитела
классов IgM и IgG (ЗАО «Вектор-Бест» ВектоХанта-IgG и ВектоХанта-IgM
«Наборы реагентов для иммуноферментного выявления иммуноглобулинов класса G и класса M к хантавирусам в сыворотке (плазме) крови человека»).
Как и при многих других инфекциях, при ГЛПС появление в сыворотках крови больных специфических IgM антител свидетельствует об острой фазе заболевания. Иммуноглобулины класса М к возбудителю ГЛПС в сыворотках больных обнаруживают с 6-го по 56-й дни от начала заболевания.
Максимальные значения титров IgM отмечают в начальный период заболевания (6-11 дни) — 1:3200 – 1:6400. В более поздние сроки уровень антител снижается до 1:400 – 1:200. В сыворотках крови поздних реконвалесцентов (2 мес. – 1 год) IgM не выявляются. Иммуноглобулины класса G к возбудителю ГЛПС в сыворотках крови больных можно обнаружить в ранние сроки заболевания (6 день). Антитела достигают высокого уровня к 11 дню и сохраняются на этих значениях до 5 месяцев
При обследовании больных с явными клиническими проявлениями ГЛПС и соответствующим эпиданамнезом, в 1-2% случаев антитела к хантавирусам могут не определяться. Это свидетельствует о возможном существовании серонегативных форм при этом заболевании, которые, возможно, являются следствием тех или иных «поломок» в иммунном механизме.
3. В отдельных случаях для выявления специфических антител к возбудителям ГЛПС могут быть использованы другие серологические методы: РТГА, РН в клеточных культурах, а также ПЦР для выявления РНК хантавирусов.
Применение специфической лабораторной диагностики ГЛПС позволяет подтвердить существование легких, стертых и атипичных форм заболевания.
Больные ГЛПС подлежат обязательной ранней госпитализации, независимо от тяжести и периода заболевания. Лечение может проводиться как в инфекционных, так и в терапевтических стационарах, имеющих палаты интенсивной терапии, специализированные врачебные кадры (инфекционисты, терапевты, нефрологи, реаниматологи) и оснащенную диагностическую (клинико-биохимическую) лабораторию. Амбулаторное наблюдение и лечение больных с подозрением на ГЛПС недопустимо. Следует помнить об опасности возникновения кровотечений (носовых, желудочно-кишечных, маточных, геморроидальных), спонтанных разрывов капсулы почек, поэтому транспортировка больных должна быть максимально щадящей, с исключением толчков и тряски, желательно в авиатранспорте с подвесными носилками.
Необходимо соблюдение строгого постельного режима вплоть до прекращения полиурии, ежедневный туалет полости рта, строгий контроль суточного диуреза. Важно следить за регулярным опорожнением кишечника. Рекомендуют полноценное питание с исключением маринадов, копченостей, консервов, но без ограничения поваренной соли, дробное, в тёплом виде. Диета коррегируется с учетом периода заболевания. В олигурический период исключают продукты, богатые калием (овощи, фрукты) и белком (бобовые, рыба, мясо). Питьевой режим должен быть дозированным, с учётом количества выделенной жидкости, предпочтение отдается щелочным минеральным водам, без газа. В период полиурии целесообразны продукты, содержащие магний, калий (картофель, чернослив, цитрусовые). При развитии осложнений со стороны желудочно-кишечного тракта диета должна быть химически и механически щадящей. Показано достаточное количество жидкости: минеральные воды типа «Ессентуки» №4, «Боржоми», фруктовые соки, кипяченая вода.
Эффективна только в начальном периоде (первые 5 дней заболевания).
В качестве специфической терапии используются:
1. противовирусные препараты: рибавирин (виразол, рибамидил)
внутривенно (16 мг/кг 4 раза в сутки) и внутрь (1000 мг в сутки). Применение внутривенной формы рибавирина, безусловно, является методикой выбора у больных тяжелыми формами ГЛПС, позволяющей быстро достичь максимальных терапевтических концентраций препарата в крови и органах-
мишенях хантавируса и прекратить репликацию последнего. Применяется ступенчатая методика терапии ГЛПС на ранней стадии (5-6 дни болезни),
двумя препаратами рибавирина — виразолом внутривенно 16 мг/кг 4 раза в сутки 3 дня (внутривенное введение) с последующим приемом внутрь рибавирина 1000 мг в сутки — 5 дней. При этом отмечается достоверная позитивная динамика болезни. Уменьшается продолжительность некоторых ведущих симптомов: головной боли, рвоты, болей в животе и области поясницы, отсутствие прогрессирования геморрагического синдрома и угрожающих массивных кровотечений.
2. Интерфероны: в свечах (виферон) и парентерально (реаферон, реальдирон по 4 млн. ед. в течение 5 дней).
3. Индукторы эндогенного интерферона: амиксин 0,25 мг 2 раза в сутки в 1-й
день, далее по 0,125 мг 2 дня.
4. Донорский специфический иммуноглобулин против ГЛПС по 6 мл 2 раза в сутки внутримышечно 1-2 дня (курсовая доза 12-24 мл).
Наличие при ГЛПС комплекса разнообразных клинико-патогенетических синдромов, определяющих трудности в диагностике, влечет за собой позднюю госпитализацию больных, когда исход болезни определяет не вирусемия, требующая этиотропной терапии, а полиорганная недостаточность и развитие неотложных состояний.
Патогенетическая терапия остается основным методом лечения при ГЛПС,
объем которой зависит от степени тяжести заболевания, периода болезни и развития осложнений. В процессе лечения важно учитывать динамику основных клинических симптомов и лабораторных показателей. При легких,
среднетяжелых и не осложненных формах полезна минимизация
«медицинской активности» относительно применения различных лекарственных препаратов и особенно парентеральных вливаний,
диуретиков, глюкокортикоидов и других препаратов.
I. Дезинтоксикация, восстановление ОЦК (под контролем показателей гемодинамики и диуреза)
1. Лёгкие формы болезни (суточный диурез более 1000,0 мл,
геморрагический синдром отсутствует, мочевина не превышает 10 ммоль/л)
склонны к самоэлиминации, поэтому больным показан постельный режим,
щадящяя диета, обычный питьевой режим с добавлением регидрона или глюкосалана до 1,0 л/сут., аскорбиновой кислоты 1,0 г/сут., глюконата кальция, аскорутина внутрь и симптоматическая терапия.
2. При среднетяжелом и тяжелом течении болезни:
а) в начальном периоде без нарушения диуреза показано внутривенное введение 5% глюкозы и солевых растворов (0,9% раствор натрия хлорида,
раствор Рингера, «Дисоль») в соотношении 1:1, 1:2;
б) в конце лихорадочного и первой половине олигурического периода —
внутривенное введение кристаллоидов (5% глюкоза, 0,9% раствор натрия хлорида, раствор Рингера, «Дисоль») и коллоидов (реоглюман) в
соотношении 2:1, 3:1. Общее количество жидкости, вводимой парентерально,
до 5-6 дня болезни не должно превышать объем выведенной на 750 мл;
в) во второй половине олигурического периода — кристаллоиды (5%
глюкоза, 0,9% раствор натрия хлорида, раствор Рингера). Общее количество жидкости в это время не должно превышать диурез на 500 мл.
Коллоидные растворы декстрана (реополиглюкин, полиглюкин, реоглюман),
гемодез, глюкокортикостероиды не вводятся (кроме случаев коллапса, отека мозга и легких). Объем вводимого в вену изотонического раствора натрия хлорида сокращают вплоть до полной отмены.
II. Коррекция нарушений гемостаза (под контролем коагулограммы,
Борьба с ДВС-синдромом, являющимся причиной смерти у больных тяжёлыми формами заболевания, очень сложна и требует участия квалифицированного гематолога. Прогрессирование ДВС-синдрома ухудшает микроциркуляцию и, как правило, усиливает ацидоз, гипоксию,
инициирует деструктивные процессы в органах и формирует полиорганную недостаточность.
1. В лихорадочном периоде к инфузионной терапии добавляют 5% раствор аскорбиновой кислоты 5-10 мл, дезагреганты (трентал, курантил, актовегил,
димефофон и др.) и ангиопротекторы (глюконат кальция, мексидол, рутин,
этамзилат натрия, продектин) в среднетерапевтических дозах. С целью улучшения микроциркуляции в этот период показаны также гепарин до 5000
ед/сут, который вводится внутривенно капельно или под кожу живота по
1500 ед. 2-3 раза в сутки, и низкомолекулярные гепарины: надропарин кальция (фраксипарин) 0,3 мл/сут, эноксапарин натрия (клексан) 0,2 мл/сут,
дальтепарин натрия (фрагмин) 0,2 мл/сут, п/к;
2. В олигугическом периоде в гиперкоагуляционную фазу ДВС-синдрома необходимо введение гепарина (внутривенно в 100 мл 0,9% раствора хлорида натрия со скоростью 40 капель в минуту, либо подкожно каждые 4 часа по
1000-5000 ЕД). После гепарина показано введение естественных ингибиторов протеаз (контрикал, гордокс 30000-1000000 ЕД) с последующей инфузией свежезамороженной плазмы. В гипокоагуляционную фазу гепарин вводить нельзя. Хороший эффект оказывают антиагреганты — дицинон (раствор этамзилата внутривенно 2000 мг/сут.) в сочетании с плазмозамещающими
растворами, а также альпростадил — действующее начало простагландина Е,
блокатора активации тромбоцитов;
3. При числе тромбоцитов 30х10 9 /л и менее и синдроме ДВС III-IV степени показано переливание тромбоцитарной массы;
4. При развитии кровотечений к кристаллоидам добавляют коллоиды, не оказывающие отрицательного воздействия на гемостаз: производные желатины – гелофузин, желатиноль, модежель; производное ПЭГ –
полиоксидин. Соотношение коллоидов и кристаллоидов 1:2.
III. Коррекция нарушений, связанных с ОПН в олигурическом периоде
(борьба с азотемией, гипергидратацией, ацидозом и электролитными нарушениями – под контролем соответствующих лабораторных показателей) 1. В раннюю стадию ОПН при отсутствии анурии проводится консервативная терапия с использованием салуретиков – стимуляция диуреза лазиксом в режиме ударных доз (200-300 мг одномоментно, в/в струйно)
после ощелачивания (4% гидрокарбонат натрия 100-200 мл) и введения белковых препаратов (альбумин, плазма). Если при введении первой дозы получено не менее 100-200 мл мочи, через 6-12 часов возможно повторное введение лазикса в той же дозе. Общая доза препарата не должна превышать
2. В разгар олигурии с угрозой перехода в анурию (менее 50 мл мочи в сутки):
а) использование лазикса противопоказано;
б) для снижения гиперазотемии, гиперкалиемии, гипермагниемии в состав внутривенных инфузий включают гипертонические растворы глюкозы (20% —
при олигурии, 40% — при анурии): 40% глюкозы до 200,0 мл или 20% — 500,0
мл с инсулином из расчета 1 ед на 4-5 г сухой глюкозы, 2,4% эуфиллина 10,0
мл, 10% глюконата кальция — 10-20 мл. Это способствует снижению гипергидратации тканей и улучшению почечного кровотока; хороший эффект достигается медленной внутривенной трансфузией допамина (3-5
мкг/кг/мин) в течение 6-12 часов, что улучшает как центральную гемодинамику, так и микроциркуляцию, в том числе и в почечной ткани;
в) коррекция ацидоза проводится назначением 4% гидрокарбоната натрия,
объем введения (в мл) которого рассчитывается по формуле: 0,6 х масса тела больного (кг) х BE (ммоль/л);
г) консервативное лечение уремической интоксикации включает:
промывания желудка (лучше через зонд) и кишечника 2% раствором бикарбоната натрия до 1000,0 мл (если нет угрозы кровотечения),
энтеросорбция (энтеродез, полифепан, гидрокарбонат натрия, цитрат натрия).
Для снижения белкового катаболизма применяют: ингибиторы протеаз
(контрикал, гордокс), продектин, метандростенолон, парентеральное питание
д) больным тяжёлыми и среднетяжёлыми формами ГЛПС, особенно при формировании ОПН, показано проведение экстракорпоральной детоксикации
(плазмаферез, цитоферез), основанной на удалении некоторого объёма крови
и замене её полиионными растворами или (при ДВС-синдроме)
IV . Проведение экстракорпорального гемодиализа целесообразно при неэффективности консервативных мероприятий на 8-12 день болезни.
Показания для гемодиализа определяются только совместно с врачом-
нефрологом Центра гемодиализа индивидуально у каждого больного.
Выделяют следующие показания:
А) клинические: анурия более 3-4 дней; начинающийся на фоне олигоанурии отёк лёгких; токсическая энцефалопатия с явлениями начинающегося отёка головного мозга и судорожным синдромом.
Б) лабораторные: гиперкалиемия (6,0 ммоль/л и более), мочевина 26-30
ммоль/л и выше, креатинин более 700-800 мкмоль/л, pH 7,25 и ниже, ВЕ 6
Противопоказания к гемодиализу: ИТШ, массивные кровотечения,
спонтанный разрыв почки, геморрагический инсульт, геморрагический
V. Применение кортикостероидных гормонов
До сих пор дискуссионным является вопрос о целесообразности применения глюкокортикостероидов, учитывая их негативные стороны (усиление репликативной активности вируса, прогипертонический и иммунодепрессивный эффекты в отношении гуморального и клеточного иммунитета). ГКС показаны больным тяжёлыми формами ГЛПС с ургентными состояниями как средство неотложной терапии, причём на очень короткий срок. Курсовое применение ГКС не рекомендуется.
Иммунологический контроль свидетельствует о неэффективности более длительных курсов ГКС у этой категории больных.
VI . Лечение больных в полиурический период
Основными принципами лечения больных в данном периоде являются:
коррекция водно-электролитного баланса и реологических свойств крови.
1. Учитывая развитие в этот период дегидратации (как внеклеточной, так и, в
особо тяжелых случаях, клеточной), гипокалиемии, гипонатриемии,
гипохлоремии, больным показано:
а) восполнение воды и солей приемом внутрь минеральных вод, отваров изюма и кураги, растворов «Регидрон» и «Цитроглюкосолан» и т.п., в
количестве не менее объема выделяемой за сутки мочи;
б) при суточном диурезе превышающем 5% массы тела, около половины теряемой жидкости замещается введением солевых растворов – «Ацесоль»,
«Хлосоль», «Лактасоль», «Квартасоль», «Квинтасоль»;
в) при выраженной гипокалиемии необходимо дополнительное введение препаратов калия – КСl 4% 20-60 мл/сут, панангин, аспаркам.
2. Коррекцию реологических свойств крови проводят, продолжая назначения дезагрегантов.
источник