В основе метода определения токсигенности коринебактерий дифтерии (тест Элека) лежит процесс встречной иммунодиффузии токсина и антитоксических антител в плотной питательной среде. В местах оптимального количественного соотношения между токсином, продуцируемым коринебактериями, и антитоксином, нанесенным на фильтровальную бумагу, происходит их взаимодействие с образованием преципитата в виде белой линии или «усов».
Токсигенность коринебактерий дифтерии определяют, как правило, в чистой культуре (отдельные колонии или культура со скошенного агара, или с пробы Пизу). Смесь колоний или культуры, загрязненные посторонней микрофлорой, также могут быть испытаны на токсигенность. При отсутствии, в этом случае, преципитатов в агаровом геле, опыт следует повторить с выделенными чистыми культурами.
Культуру засевают в виде «бляшек» диаметром 0,6-0,7 см на расстоянии 0,7-0,8 см друг от друга и 0,5 см от края полоски фильтровальной бумаги. На одну чашку следует засевать не более 10 «бляшек». Из них 6 «бляшек» испытуемой культуры, 4-контрольного штамма. При небольшом количестве испытуемого материала засевают 6 контрольных «бляшек» и 4 — испытуемых. Чашки с посевом помещают в термостат при 37 град. C.
Результат учитывают через 18-24 часа и 48 часов роста. Следует иметь в виду, что препарат антитоксической противодифтерийной сыворотки, помимо антител к дифтерийному антитоксину, содержит антитела к антигенам микробной клетки. Поэтому при постановке пробы на токсигенность с использованием данного препарата преципитаты могут образовываться не только в результате связывания токсина с антитоксином (специфические преципитаты), но и при взаимодействии антибактериальных антител с компонентами клетки коринебактерий дифтерии (неспецифические преципитаты). Последние могут формироваться как у токсигенных, в том числе и у контрольного штамма, так и у нетоксигенных коринебактерий дифтерии. Иногда отмечается появление множественных линий преципитации. Неспецифические преципитаты, как правило, слабо выражены, имеют нечеткие контуры, появляются чаще через 48-72 часа, в редких случаях могут появляться и на первые сутки. Критерием оценки специфичности преципитатов является слияние линий преципитации испытуемого штамма со специфическими линиями контрольного токсигенного штамма. В тех случаях, когда у контрольного штамма формируется несколько линий преципитации, специфическими следует считать более четкие и рано появляющиеся преципитаты. Поэтому просмотр чашек с пробой на токсигенность осуществляют через 18-24 часа от момента ее постановки. Если в течение данного времени у контрольного штамма линии преципитации не обнаруживаются, это свидетельствует о нарушении условий постановки реакции.
Варианты оценки результатов реакции:
- 1. Испытуемые культуры коринебактерий дифтерии являются токсигенными, если образуемые ими линии преципитации сливаются или имеют тенденцию к слиянию с соответствующими специфическими линиями контрольного токсигенного штамма.
- 2. Испытуемые культуры коринебактерий дифтерии являются нетоксигенными, если:
- а) линии преципитации, образуемые испытуемой культурой, отсутствуют, при наличии специфических линий преципитации у контрольного штамма;
- б) линии преципитации не могут слиться со специфическими линиями преципитации контрольного штамма, а скрещиваются или имеют тенденцию к скрещиванию с ними (неидентичные, неспецифические линии);
- в) линии преципитации испытуемой культуры сливаются с неспецифическими линиями контрольного штамма;
- г) линии преципитации испытуемой культуры перекрещиваются со специфическими линиями и сливаются с неспецифическими линиями контрольного штамма.
Очищенный ферментолизом и специфической сорбцией антитоксин не содержит антител к компонентам микробной клетки. При использовании этого препарата неспецифические линии преципитации не образуются.
источник
Возбудитель дифтерии относится к роду Corynebacterium (от лат. coryna — булава, diphthera — пленка). Бактерии имеют булавовидные утолщения на концах. К этому роду относятся патогенные для человека дифтерийные палочки и непатогенные виды — ложнодифтерийные палочки и дифтероиды, обнаруживаемые на слизистых оболочках и кожных покровах.
Возбудители дифтерии — Corynebacterium diphtheriae — были обнаружены Т. Клебсом (1883) и выделены в чистом виде Ф. Леффлером (1884).
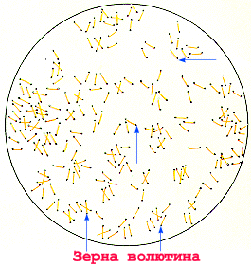
Морфология. Возбудители дифтерии слегка изогнутые, тонкие палочки, размером 3-6 × 0,3-0,5 мкм, на концах которых имеются утолщения. В этих утолщениях имеются зерна волютина (зерна Бабеша — Эрнста). Бактерии дифтерии неподвижны, не имеют спор и капсул. Грамположительны. Они хорошо окрашиваются основными анилиновыми красителями, при этом волютиновые зерна окрашиваются интенсивнее. Для окраски обычно применяют щелочной метиленовый синий или кристаллический фиолетовый. Особенностью коринебактерий дифтерии является их полиморфность; в одной кулатуре встречаются различные по форме и размерам палочки: изогнутые, прямые, длинные, короткие, толстые, иногда коккобактерии. Характерно расположение бактерий в мазках — они обычно располагаются попарно под острым или тупым углом, в виде растопыренных пальцев и т. д. Расположение в мазках и наличие зерен волютина является дифференциально-диагностическим признаком при микроскопическом исследовании. Непатогенные представители рода коринебактерий — ложнодифтерийные палочки и дифтериоды чаще располагаются в виде частокола, зерна волютина у них могут отсутствовать либо быть на одном конце (см. рис. 4).
Культивирование. Коринебактерий дифтерии — факультативные анаэробы. Растут при температуре 35-37° С, рН среды 7,4-7,8. Они не размножаются на обычных питательных средах. Культивируют их на средах, содержащих кровь или сыворотку.
В конце XIX века французский ученый Э. Ру для культивирования бактерий дифтерии предложил использовать свернутую бычью или лошадиную сыворотку, а Ф. Леффлер рекомендовал добавлять к ней бульон (25%) и 1% глюкозу. На этих средах коринебактерий растут быстро, в течение 14-18 ч образуют несливающиеся выпуклые колонии кремового цвета (рост на скошенной среде напоминает шагреневую кожу). Однако отдифференцировать на этих средах дифтерийные палочки от ложнодифтерийных невозможно.
В настоящее время основными средами для выращивания являются среда Клауберга (содержащая сыворотку крови и теллурит калия), хинозольная среда Бунина, среда Тинсдаля и др. На основании культуральных и ферментативных свойств коринебактерий дифтерии делят на три биовара: гравис (gravis), ми тис (mitis), интермедиус (intermedins). Биовар гравис обычно находится в R-форме. На среде Клауберга бактерии этого биовара растут в виде крупных колоний 2-3 мм, серовато-черного цвета (так как восстанавливают теллурит в теллур), имеют изрезанные края, что придает им вид розетки. При прикосновении к колонии петлей она как бы рассыпается. На бульоне бактерии этого биовара образуют крошащуюся пленку и зернистый осадок.
Коринебактерии биовара митис (mitis) на среде Клауберга растут в виде небольших, гладких колоний (S-форма) черного цвета. На бульоне они дают равномерное помутнение.
Коринебактерии биовара интермедиус (intermedins) являются промежуточными. На среде Клауберга бактерии этого биовара чаще растут в виде блестящих, мелких, черных колоний (этот биовар встречается редко).
Ферментативные свойства. Все три биовара дифтерийных бактерий обладают ферментом цистиназой, расщепляющим цистин с образованием сероводорода. Эти свойства используются для дифференциации возбудителей дифтерии от непатогенных представителей этого рода (табл. 49).
Таблица 49. Свойства возбудителей дифтерии и близких к ним коринебактерий
Примечание. + положительная реакция (расщепляет); — отрицательная реакция (не расщепляет).
Возбудители всех трех биоваров расщепляют глюкозу и мальтозу до образования кислоты. С. gravis расщепляют крахмал. Это свойство отличает его от двух других биоваров. Коринебактерий дифтерии восстанавливают нитраты в нитриты, не образуют индол, не разлагают мочевину.
Коринебактерии дифтерии образуют нейраминидазу, гиалуронидазу и другие ферменты патогенности.
Токсинообразование. Вирулентные штаммы возбудителей дифтерии продуцируют экзотоксин. Химически он представляет собой термолабильный белок, состоящий из Двух фракций. Фракция В фиксирует токсин на чувствительных к нему тканях организма. Фракция А ответственна за токсическое действие. Силу токсина дифтерийных культур можно устанавливать «in vivo» на чувствительных к этому токсину морских свинках. Dim дифтерийного экзотоксина — минимальная смертельная доза, это минимальное количество яда, убивающее морскую свинку массой 250 г на 4-й день.
Наличие экзотоксина можно обнаружить также «in vitro» — на плотной питательной среде. Этот метод широко используется в практической работе. Дифтерийный экзотоксин малоустойчив. Он быстро разрушается под влиянием температуры, света и кислорода воздуха. После добавления к токсину формалина (0,3-0,4%) и выдерживания его при температуре 37-38° С в течение нескольких недель он переходит в анатоксин, который теряет ядовитость, но сохраняет антигенные свойства токсина. Токсины, образуемые различными штаммами, не различаются между собой и могут быть нейтрализованы дифтерийным антитоксином * .
* ( В настоящее время установлено, что все биовары коринебактерий могут быть токсигенными и нетоксигенными.)
Антигенная структура. У бактерий дифтерии имеется поверхностный термолабильный белковый антиген и типоспецифический полисахаридный О-антиген. Кроме этого, среди коринебактерий различают 19 фаговаров, которые учитываются при идентификации культур. С помощью фаговаров выявляют источник заболевания.
Устойчивость к факторам окружающей среды. Возбудители дифтериии сравнительно устойчивы. Температура 60° С убивает их через 10-15 мин, 100° С — через минуту. В пленке они выдерживают нагревание до 90° С. На свернутой сыворотке при комнатной температуре сохраняются до 2 мес, на детских игрушках — несколько суток. Низкие температуры коринебактерий переносят хорошо. К высушиванию возбудители дифтерии довольно устойчивы. Дезинфицирующие вещества (3% раствор фенола, 1% раствор сулемы, 10% раствор перекиси водорода) убивают эти бактерии в течение нескольких минут.
Восприимчивость животных. В естественных условиях животные дифтерией не болеют. Из экспериментальных животных наиболее восприимчивы морские свинки и кролики. При внутрикожном или подкожном заражении у них развивается картина токсикоинфекции с образованием на месте введения воспаления, отека, некроза. В надпочечниках наблюдаются кровоизлияния.
Источники заболевания. Больные люди и бактерионосители.
Пути передачи. Воздушно-капельный путь, контактно-бытовой (через посуду, игрушки, книги, полотенца и т. д.).
Заболевание у человека: 1) дифтерия зева; 2) дифтерия носа.
Реже возникает дифтерия трахеи, бронхов, глаз, уха, влагалища и дифтерия поврежденной кожи.
Патогенез. Входными воротами являются слизистые оболочки дыхательных путей и поврежденная кожа. Попав на слизистую оболочку, возбудители дифтерии размножаются в месте внедрения и вызывают некроз ткани. Образуется пленка, тесно связанная с подлежащими тканями. На поверхности слизистой появляются грязно-серые или желтоватые налеты, состоящие из разрушенного эпителия, фибрина, лейкоцитов и коринебактерий дифтерии. При снятии пленки ватным тампоном или шпателем поверхность слизистой может кровоточить.
В процессе размножения коринебактерий дифтерии в некротических участках накапливается экзотоксин, который может привести к отеку слизистой оболочки и клетчатки. Со слизистой оболочки отек может распространяться на гортань, бронхи и вызвать явления асфиксии. Токсин, циркулирующий в крови, избирательно поражает сердечную мышцу, надпочечники и клетки нервной ткани.
Дифтерия — это токсикоинфекция. Тяжесть процесса зависит от степени токсигенности штамма и от защитных сил организма.
Иммунитет. Невосприимчивость обусловливается антитоксическим и антибактериальным иммунитетом. Грудные дети не болеют, так как у них имеется пассивный иммунитет, переданный от матери.
О наличии антитоксического иммунитета судят по реакции Шика. Для постановки реакции 1 /40 Dlm (летальной дозы токсина для морской свинки), содержащегося в 0,2 мл изотонического раствора натрия хлорида, вводят внутрикожно в области предплечья. При отсутствии в крови антитоксина в месте введения через 24-48 ч появляется краснота и припухлость (до 2 см в диаметре). При наличии антитоксина припухлости и красноты нет (имеющийся в крови антитоксин нейтрализовал введенный токсин).
Перенесенное заболевание оставляет иммунитет. Однако в 6-7% случаев наблюдаются повторные заболевания.
Профилактика. Ранняя диагностика. Изоляция. Дезинфекция. Выявление носителей токсигенной дифтерийной палочки.
Специфическая профилактика осуществляется введением анатоксина. В СССР проводят обязательную вакцинацию детей вакциной АКДС — это комплексная вакцина, в которую входят дифтерийный и столбнячный анатоксин и взвесь убитых коклюшных палочек. Вакцинируют детей с 5-6 месяцев с последующей ревакцинацией. Для ревакцинации вводят вакцину без коклюшных палочек.
Специфическое лечение. Применяют противодифтерийную антитоксическую сыворотку. Доза и кратность определяется лечащим врачом, вводят также антимикробные препараты.
1. Какова морфология коринебактерий дифтерии и какие имеются биовары?
2. На каких средах выращивают бактерии дифтерии и каков характер роста?
3. Отношение к какому углеводу позволяет отличить биовар gravis от других биоваров дифтерии?
4. Каков путь передачи и где чаще локализуется возбудитель дифтерии у больного?
5. Каковы специфическая профилактика и специфическое лечение дифтерии?
Цель исследования: выделение возбудителя для постановки диагноза. Выявление бактерионосителей дифтерии по эпидемиологическим показаниям. Выявление экзотоксина у выделенной культуры.
1. Отделяемое слизистой оболочки зева.
2. Отделяемое слизистой оболочки носа.
3. Отделяемое слизистой оболочки глаза.
5. Отделяемое слизистой оболочки влагалища.
Материал для исследования зависит от локализации процесса.
Способы сбора материала
При любой локализации процесса обязательно исследует слизистую зева и носа. Материал собирают ватным тампоном, для чего используют металлическую проволоку, желательно алюминиевую, на один конец которой плотно накручивают вату, затем тампон монтируют в корковую пробку, помещают в пробирку и стерилизуют в печи Пастера при температуре 160° С 1 тампон течение часа или в автоклаве при температуре 112° С.
Примечания. 1. Материал собирают натощак либо не раньше чем через 2 ч после еды и не ранее чем через 4 дня после лечения антибиотиками или другими антибактериальными средствами. 2. Если материал берут из зева и носа, то пробирки с обоими тампонами надписывают и связывают вместе. Посевы делают раздельно и исследование материала из каждого тампона ведут как самостоятельную работу. 3 Материал, собранный сухим тампоном, должен быть посеян не позднее чем через 2-3 ч после забора. При необходимости транспортировки собранного материала тампон предварительно смачивают 5% раствором глицерина в изотоническом растворе натрия хлорида.
Первый день исследования
Чашки вынимают из термостата и просматривают. Рост бактерий на среде Клауберга может быть замедлен из-за наличия ингибиторов в среде. В этом случае чашки ставят в термостат еще на 24 ч.
Чашки вынимают из термостата, просматривают их с помощью лупы или стереоскопического микроскопа. При наличии подозрительных колоний часть их под контролем стереоскопического микроскопа выделяют на агар с 25% сывороткой и на столбик со средой Пизу для определения фермента цистиназы. Из другой части колоний ставят пробу на токсигенность.
При микроскопическом исследовании колоний, снятых со среды Клауберга, коринебактерии дифтерии теряют свою специфичность: отсутствует зернистость, изменяется величина, расположение сохраняется. При посеве их на среды с сывороткой морфологическая специфичность возбудителей дифтерии восстанавливается.
Проба на наличие фермента цистиназы и определение токсигенности являются обязательными при идентификации возбудителей дифтерии. Если результат этих опытов, проведенных с частью колоний со среды Клауберга, недостаточно четкий или отрицательный, то опыт повторяют, используя выделенную чистую культуру.
Проба на цистиназу. Проводят посев исследуемой культуры уколом в центр столбика среды Пизу. При положительной реакции через 18-24 ч по ходу укола наблюдается почернение, а вокруг черного стержня образуется темное облачко; почернение происходит в результате того, что фермент цистиназа расщепляет цистин, входящий в состав среды Пизу, и освободившаяся сера вступает в реакцию с ацетатом свинца — образуется сульфит свинца черного цвета. Дифтероиды и ложнодифтерийные палочки не содержат фермент цистиназу, поэтому при росте их на среде Пизу цвет среды не изменяется.
Определение экзотоксина. Проводят методом диффузной преципитации в геле. Метод основан на взаимодействии токсина с антитоксином. В тех участках агара, где эти компоненты взаимодействуют, образуется преципитат в виде закругленных линий.
Методика определения: в чашки Петри разливают растопленный и охлажденный до 50° С агар Мартена рН 7,8 (на агаре Мартена лучше продуцируется экзотоксин). Количество агара в чашке должно быть не более 12-15 мл, чтобы сохранить прозрачность, — в толстом слое линии преципитации плохо видны. После застывания агара накладывают полоску стерильной фильтровальной бумаги, смоченной противодифтерийной антитоксической сывороткой.
Испытуемую культуру засевают «бляшками». Посев производят петлей. Диаметр бляшек 0,8-1,0 см. Расстояние бляшек от края полосок бумаги 0,5-0,7 см, между двумя бляшками испытуемой культуры засевают бляшки заведомо токсигенного штамма. Испытуемую культуру считают токсигенной, если линии преципитации четки и сливаются с линиями преципитации контрольного (токсигенного) штамма. Если линии преципитации перекрещиваются с линиями контрольного штамма или отсутствуют, выделенную культуру считают нетоксигенной (рис. 50).
Рис. 50. Выявление экзотоксина C.Diphtheriae методом диффузной преципитации в агаре. 1 — бляшки нетоксигенного штамма (линии преципитации перекрещиваются); 2 — бляшки токсигенного штамма (линии преципитации соединяются)
Приготовление полосок бумаги. Из фильтровальной бумаги нарезают полоски размером 1,5×8 см, заворачивают по несколько штук в бумагу и стерилизуют в автоклаве при температуре 120° С в течение 30 мин. Перед постановкой опыта стерильным пинцетом вынимают одну полоску, укладывают ее в стерильную чашку Петри и смачивают противодифтерийной антитоксической сывороткой. Предварительно сыворотку разводят так, чтобы в 1 мл содержалось 500 АЕ (антитоксических единиц). Бумажку смачивают 0,25 мл сыворотки (125 АЕ) и помещают на поверхность среды. Затем делают посевы указанным выше способом. Все посевы ставят в термостат. Учет результатов производят через 18-24 и 48 ч.
Вынимают посевы из термостата, учитывают результат. Делают мазки из культуры, выросшей на среде с сывороткой, и окрашивают их синим Леффлера.
Наличие в мазках характерных по морфологии палочек, черного с облачком стержня в среде Пизу и линий преципитации в агаре позволяет дать предварительный ответ: «Обнаружены коринебактерии дифтерии». Исследование продолжают. При отсутствии линий преципитации в агаре или их недостаточной четкости исследование на токсигенность обязательно повторяют с выделенной чистой культурой.
Для окончательной идентификации выделенной культуры и определения биовара возбудителя производят посев на глюкозу, сахарозу, крахмал и бульон с мочевиной (для выявления фермента уреазы). Посев на среды делают обычным способом.
Проба на уреазу. Выделенную культуру засевают на бульон с мочевиной и индикатором (крезоловый красный) и ставят в термостат. Уже через 30-40 мин можно учитывать результат: при посеве истинных возбудителей дифтерии цвет среды не изменяется, так как они не содержат уреазу. Псевдодифтерийные палочки расщепляют мочевину и изменяют индикатор — среда приобретает малиново-красный цвет.
Производят учет результатов (табл. 50).
Таблица 50. Ферментативные свойства выделенных возбудителей
1. Какой материал исследуют для выявления возбудителя дифтерии?
2. Как собирают материал для исследования на дифтерию из зева и носа?
3. Что нужно сделать с тампоном, если собранный материал необходимо транспортировать?
4. При помощи какого прибора изучают колонии на среде Клауберга?
5. Какие исследования проводят для окончательной идентификации выделенной культуры?
6. Какими методами определяют токсигенность коринебактерий дифтерии?
1. Возьмите у преподавателя проволоку и вату и приготовьте 10 тампонов, вмонтируйте их в корковую пробку, вставьте в пробирку и простерилизуйте.
Внимание! Перед стерилизацией проверьте, достаточно ли плотно накручен тампон.
2. Возьмите у преподавателя стерильные тампоны и произведите забор материала друг у друга из зева и носа (разными тампонами).
3. Изучите по табл. 49 свойства возбудителей дифтерии и близких к ним коринебактерий.
4. Поставьте пробу на токсигенность. Бляшки сделайте петлей без культуры.
5. Зарисуйте ход исследования и положительный и отрицательный результат пробы на токсигенность.
Теллуровая среда Клауберга: первая смесь — предварительно за 1,5 мес готовят смесь из 20 мл бараньей или лошадиной крови и 10 мл глицерина. В день приготовления среды готовят две другие смеси; вторая смесь — 50 мл МПА рН 7,5 растапливают и охлаждают до температуры 50° С, после чего прибавляют 2,5 мл первой смеси; третья смесь — смешивают 17 мл бараньей крови и 33 мл дистиллированной воды (смесь приготавливают стерильно), подогревают на водяной бане до температуры 50° С. Соединяют вторую и третью смеси, прибавляют 4 мл 1% раствора теллурита калия К2ТеО3, быстро все перемешивают и разливают в чашки. Среда прозрачная, имеет цвет красного вина.
Среда Пизу. К 90 мл расплавленного 2% МПА (рН 7,6) добавляют 2 мл раствора цистина (1% раствор цистина в 0,1 н. растворе гидроксида натрия), тщательно перемешивают и добавляют такой же объем 0,1 н. раствора серной кислоты. Среду стерилизуют 30 мин при температуре 112° С. К расплавленной и охлажденной до 50° С среде добавляют 1 мл 10% раствора ацетата свинца, стерилизованного двукратно текучим паром, перемешивают и добавляют 9 мл нормальной лошадиной сыворотки. Среду стерильно разливают в маленькие пробирки по 2 мл. Посев производят уколом.
Среда Бунина. Сухую хинозольную среду добавляют к 100 мл холодной воды (рН 7,6-7,8), размешивают и нагревают на слабом огне до расплавления агара (по прописи на этикетке). Затем среду кипятят 2-3 мин до образования пены, после чего среду остужают до 50° С и добавляют 5-10 мл стерильной дефибринированной крови. Среду перемешивают и разливают в чашки Петри. Готовую среду можно сохранять 3-4 дня при температуре 4-10°.
Среда Тинсдаля. К 100 мл 2% питательного агара, расплавленного и охлажденного до 50° С, добавляют: 1) 12 мл 1% раствора цистина на 0,1 н. растворе серной кислоты; 2) 12 мл 1% раствора гидроксида натрия; 3) 1,8 мл 2% раствора теллурита калия; 4) 1,8 мл 2,5% раствора гипосульфита натрия, 20 мл нормальной лошадиной или бычьей сыворотки. После добавления каждого ингредиента среду тщательно перемешивают. Чашки со средой хранят 3-4 дня при 10° С.
источник
Дифтерия — острая инфекционная болезнь, вызываемая токсигенными коринебактериями дифтерии. Передается воздушно-капельным путем, характеризуется местным фиброзным воспалением преимущественно слизистых оболочек рта и носоглотки, явлениями общей интоксикации и поражением сердечно-сосудистой, нервной и выделительной систем. Повреждающее действие на органы и ткани обусловлено токсином, выделяемым возбудителем в месте его локализации.
Возбудитель дифтерии относится к виду Согуnebacterium diphtheriae рода Согуnebacterium, семейству Actinomyceae.
Морфология. Отличительной особенностью С. diphtheriae является полиморфизм, проявляющийся в многообразии форм клеток. В культуре одного и того же штамма наряду с типичными длинными изогнутыми палочками можно обнаружить короткие, толстые, со вздутиями на концах, придающими им сходство с булавой. Размеры варьируют от 1 до 6 мкм по длине и от 0,3 до 0,8 мкм в диаметре. Для дифтерийных бактерий характерно неравномерное окрашивание клеток благодаря наличию в них зерен волютина, которые воспринимают любой анилиновый краситель интенсивнее, чем протоплазма, вследствие чего при окраске по Леффлеру или Нейссеру выявляются в виде гранул соответственно темно-синего или сине-черного цвета. Эти гранулы располагаются чаще всего в булавовидных утолщениях на обеих концах коринебактерий.
Возбудители дифтерии в мазках часто располагаются попарно, под острым углом один к другому, что объясняется своеобразным типом деления клеток путем излома («щелкающий тип» деления), в отличие от непатогенных коринебактерий, для которых характерно параллельное расположение в мазке.
Не образуют спор, капсул, жгутиков.
Культуральные свойства. Возбудитель дифтерии — аэроб или факультативный анаэроб, оптимальная температура роста — 37 0 С;
гетеротроф, то есть относится к группе бактерий, требующих для своего роста органические вещества. Используемые для выращивания среды должны содержать в качестве источника углерода и азота аминокислоты — аланин, цистин, метионин и др. В связи с этим селективными средами для культивирования являются те, которые содержат животный белок: кровь, сыворотку, асцитическую жидкость. На основании этого и была создана классическая среда Леффлера, а затем среды Клауберга и Тиндаля.
По культуральным и биологическим свойствам коринебактерий дифтерии подразделяются на три биовара: gravis, mitis, intermedius, которые отличаются рядом признаков. Наиболее четко дифференциацию типов можно провести по форме колоний при выращивании культуры на кровяном агаре с добавлением теллурита.
Колонии типа gravis через 48—72 часа достигают в диаметре 1—2 мм, имеют волнистые края, радиальную исчерченность и плоский центр (R-форма) черного или серого цвета. При росте на бульоне культуры типа gravis образуют на поверхности крошащуюся пленку. На средах Гисса с добавлением сыворотки они расщепляют полисахариды — крахмал, декстрин, гликоген с образованием кислоты. Токсигенные штаммы коринебактерий дифтерии относятся к этому биовару.
Культуры типа mitis на кровяном агаре с теллуритом вырастают в крупные, слегка выпуклые, с ровным краем, черные матовые колонии (S-форма). При росте на бульоне дают равномерную муть и осадок. Крахмал, декстрин и гликоген не расщепляют. Культуры этого типа, как правило, менее токсигенны и инвазионны, чем коринебактерий биовара gravis.
Коринебактерий биовара intermedius занимают промежуточное положение. Колонии, выращенные на теллуритовом агаре, мелкие (RS-форма), черного цвета, не ферментируют крахмал и гликоген, в бульоне растут с появлением мути и зернистого осадка.
Антигенная структура. Коринебактерий дифтерии характеризуются сложной антигенной структурой и многообразием серологических свойств. В реакции агглютинации выявляются белковые термолабильные R-антигены токсиноспецифической природы, локализованные в поверхностном слое клеточной стенки, O-антиген — типоспецифический.
Среди коринебактерий дифтерии имеется 19 фаготипов, с помощью которых выявляют источники инфекции; учитываются они и при идентификации выделенных культур.
Серологические свойства лучше всего изучены у штаммов варианта gravis. Его токсигенные штаммы подразделены на пять — девять сероваров. Распределение последних на различных территориях не является одинаковым, на одной и той же территории может циркулировать несколько сероваров, но среди них преобладает какой-нибудь один.
Факторы патогенности. Дифтерийные коринебактерий продуцируют в бульонных культурах сильные экзотоксины (гистотоксин, дермонекротоксин, гемолизин). Токсиногенез коринебактерий дифтерии детерминируется геном, содержащимся в профаге, следовательно, основное средство агрессии — токсинообразование, не связано с хромосомой бактерий. Особенность токсинообразования дифтерийной палочки определяется наличием ее в ДНК специфического профага, содержащего структурный ген токсичности, который обозначается как ТОХ*. Таким образом, не инфицированная специфическим фагом дифтерийная палочка не способна к токсинообразованию. При ее инфицировании профагом происходит присоединение ТОX + к ДНК микробной клетки. В связи с тем, что дифтерийная палочка способна контролировать профаг, эффект лизогении реализуется лишь при физиологическом старении или ингибиции основных процессов жизнедеятельности микробной клетки, когда профаг выходит из-под контроля и обеспечивает выраженную фаговую репродукцию.
В основе токсического действия дифтерийного токсина лежит способность подавлять биосинтез клеточного белка, что рассматривается как основная причина гибели клеток и смерти организма от дифтерийной инфекции. Дифтерийный токсин относится к сильнодействующим бактериальным токсинам и уступает только ботулиническому и столбнячному. Молекула токсина состоит из двух фрагментов, один из которых термостабилен и обладает ферментативной активностью, второй — термолабилен и выполняет протективную функцию. После добавления к токсину 0,3—0,4 %-ного раствора формалина и последующего выдерживания при 38°С в течение трех-четырех недель происходит превращение его в анатоксин, используемый для приготовления профилактического препарата.
В процессе жизнедеятельности дифтерийные бактерии продуцируют, кроме токсина, нейраминидазу, гиалуронидазу, некро-тизирующий и диффузионный факторы.
Резистентность. Дифтерийные бактерии обладают значительной устойчивостью к воздействию факторов окружающей среды В дифтерийной пленке, капельках среды, прилипших к стенке стакана, на ручках дверей, детских игрушках они могут сохрa-
няться до 15 дней, в воде и молоке — до 20. Выживаемость на предметах окружающей среды в осенне-весенний период достигает 5,5 месяца и не сопровождается утратой или ослаблением их патогенных свойств. К числу неблагоприятных факторов относятся прямые солнечные лучи, высокая температура, химические агенты. При кипячении и в алкоголе дифтерийные бактерии погибают в течение 1 минуты, в 10 %-ном растворе перекиси водорода — через три.
Эпидемиология. Источником дифтерии является человек, у которого она проявляется в разных клинических формах — от тяжелых токсических до стертых форм и здорового бактерионосительства.
Эпидемиологическое значение и роль источника инфекции в реализации механизма заражения определяется главным образом интенсивностью передачи инфекционного начала (возбудителя). Естественно, чем больше обсемененность слизистых оболочек верхних дыхательных путей, тем вероятнее возможность выброса возбудителя в массовых дозах в окружающую среду при разговоре, кашле, чихании. Наиболее опасны в этом отношении больные дифтерией и бактерионосители. Плотность заселения слизистых оболочек коринебактериями дифтерии резко возрастает у людей с воспалительными заболеваниями верхних дыхательных путей, ангинами, туберкулезом. Распространенность бактерионосительства коринебактерий дифтерии варьирует от 0 до 60 %, что свидетельствует о влиянии состояния организма на процесс носительства.
Патогенез. Наибольшую заболеваемость дифтерией отмечают осенью, что объясняется увеличением скученности населения в это время года и снижением сопротивляемости организма под влиянием охлаждения.
Восприимчивость к дифтерийной инфекции, развитие болезни обусловлены рядом факторов, основными из которых надо считать иммунологическое состояние организма, возраст, резистентность тканей в месте внедрения возбудителя, состояние нервной системы и общей реактивности.
Реакция организма на внедрение бактерий бывает местной и общей, степень и характер ее зависят в основном от защитных сил организма. Местная реакция проявляется в точке внедрения микроба. Прежде чем начинает действовать токсин, возбудитель должен пройти стадию приживления и размножения на слизистой оболочке рото- и носоглотки или коже. Попав на благоприятную почву, возбудитель размножается, вырабатывает экзотоксин, который фиксируется на клеточных мембранах, а затем проникает в глубь тканей и оказывает воздействие на нервные окончания, заложенные в стенках сосудов, что приводит к застойной гиперемии и формированию экссудата.
На месте внедрения возбудителя дифтерии (зев, нос, трахея, конъюнктива глаза, кожа, вульва влагалища, раневая поверхность) образуются пленки с большим количеством дифтерийных коринебактерий и других микробов. Продуцируемый экзотоксин вызывает некроз и воспаление слизистых оболочек и кожи. Всасываясь, он поражает нервные клетки, сердечную мышцу, паренхиматозные органы, обусловливает явления общей тяжелой интоксикации. Глубокие изменения происходят в сердечной мышце, сосудах, надпочечниках, а также в центральной и периферической нервной системе.
Клиника. Инкубационный период при дифтерии продолжается два—десять дней, заболевание развивается остро. По локализации процесса наиболее часто наблюдается дифтерия зева, дыхательных путей (дифтерийный круп), носа. Сравнительно редко встречается дифтерия глаз, ушей, половых органов, кожи. На дифтерию зева приходится более 90 % всех заболеваний, второе место занимает дифтерия носа.
Заболевание начинается повышением температуры с симптомами общего недомогания. Сразу же появляется кашель — вначале сухой, грубый «лающий», он затем теряет звучность, становится хриплым. На гортани появляются дифтерийные пленки, она отекает, сужается.
Затем развивается стенотическая стадия: шум при дыхании свистящего характера, напоминает звук пилы в сыром дереве; он настолько сильный, что слышен в соседней комнате. Дыхание сопровождается втягиванием уступчивых мест грудной клетки, напряжением вспомогательной дыхательной мускулатуры.
Третья стадия — асфиксическая — длится от нескольких минут до десятков часов и характеризуется такими симптомами как выраженное беспокойство, изменение цвета кожи. Она покрывается потом, губы, лицо, конечности синеют. Появляется парадоксальный пульс, возникают судороги, наступает смерть.
Иммунитет при дифтерии носит антитоксический и антибактериальный характер, при этом антитоксический иммунитет играет определяющую роль в противоинфекционной защите.
Лабораторная диагностика. Бактериологический метод основан на выделении чистой культуры и идентификации возбудителей по культурально-морфологическим, биохимическим и токсическим свойствам. Объектом для исследования служит отделяемое зева, носа, глаз, кожи и прочее, которое берут ватным тампоном и высевают на среду Клауберга или кровяной теллуритовый агар. Перечисленные среды содержат 0,04 % теллурита калия, который подавляет рост сопутствующей микрофлоры (стафилококки, стрептококки). Через 24—48 часов культивирования производят микроскопию мазков и дают предварительный ответ.
Дифтерийные коринебактерии не всегда бывают морфологически типичными, в ряде случаев возбудитель принимает форму коротких палочек, расположенных не под углом, а беспорядочно, со слабовыраженной зернистостью. Кроме того, образование гранул волютина происходит не всегда и, следовательно, этот признак не является абсолютным. Наиболее достоверный метод — токсинообразование. Дифференциацию токсигенных и нетоксигенных штаммов производят по методу Оухтерлони (метод двойной иммунодиффузии в чашках Петри или метод преципитации в агаре). Он основан на способности дифтерийного экзотоксина вступать в соединение с антитоксином и образовывать преципитаты в виде стрел — усиков.
Серологические реакции применяют для изучения коллективного иммунитета. Они включают: РПГА, отличающуюся высокой чувствительностью, проводимую с антительным диагностикумом;
реакцию Шика, проводимую для определения индивидуальной невосприимчивости к дифтерийному токсину; реакцию нейтрализации цитотоксического действия дифтерийного токсина в культуре ткани; РИА; иммуноферментный анализ (ИФА).
Лечение. Главным в лечении всех форм дифтерии является нейтрализация дифтерийного токсина антитоксической противодифтерийной сывороткой «Диаферм». При средней тяжести заболевания вводится 5000—15 000 МЕ, при тяжелых формах — 30 000—50 000 МЕ. Для лечения носителей назначают антибиотики.
Профилактика включает раннюю диагностику, немедленную госпитализацию, полноценную дезинфекцию помещения и предметов, выявление носителей.
Специфическая профилактика против дифтерии заключается в активной иммунизации детей с пятимесячного возраста методом первичной двукратной вакцинации и отдаленной однократной ревакцинации коклюшно-дифтерийно-столбнячной вакциной (АКДС).
Взрослому населению рекомендуется проводить однократные прививки адсорбированным дифтерийным анатоксином (АД-анатоксин).
Дата добавления: 2015-05-07 ; просмотров: 2504 | Нарушение авторских прав
источник
C. diphtheriae — палочковидные бактерии; вызывают дифтерию (греч. diphtheria — кожа, пленка) — острую инфекцию, характеризующуюся фибринозным воспалением в зеве, гортани, реже в других органах, и явлениями интоксикации.
Морфологические и культуральные свойства.
Corinebacterium diphteriae – тонкие, слегка изогнутые или прямые грамположительные палочки, расположенные под углом друг к другу в виде римских пятерок. Они утолщены на концах за счет наличия зерен валютина на одном или обоих полюсах клетки. Зерна валютина состоят из полифосфатов, они воспринимают анилиновые красители более интенсивно, чем цитоплазма клетки и легко выявляются при окраске по Нейссеру в виде гранул сине-черного цвета, тогда как тела бактерий – окрашивается в желто-зеленый. При окраске по Граму зерна валютина не выявляются.
Рисунок мазка из чистой культуры. Окраска по Нейссеру Мазок из чистой культуры.
Окраска щелочной синькой Леффлера
Дифтерийная палочка не обладает кислотоустойчивостью, неподвижна, спор не образует, имеет микрокапсулу с входящим в ее состав корд-фактором. В состав клеточной стенки входят галактоза, манноза, арабиноза, а также большое количество липидов, в том числе некислотоустойчивые миколовые кислоты.
Возбудитель дифтерии – факультативный анаэроб, гетеротроф, растет при 37 о С на сложных питательных средах: свернутая кровяная сыворотка, кровяной теллуритовый агар.
На элективных средах через 8-14 часов образует точечные, выпуклые желтовато-кремовые колонии с гладкой или слегка зернистой поверхностью. Колонии не сливаются и имеют вид шагреневой кожи.
На теллуритовых средах возбудитель дифтерии через 24-48 час образует черные или черно-серые колонии в результате восстановления теллурита до металлического теллура.
Возбудитель дифтерии обладает высокой ферментативной активностью. Дифференциально-диагностическими признаками C. diphteriae являются:
отсутствие способности ферментировать сахарозу и разлагать мочевину,
способность продуцировать фермент цистиназу.
Возбудитель дифтерии не однороден по культуральным и биохимическим свойствам. В соответствии с рекомендациями Европейского регионального бюро ВОЗ вид C. diphteriae подразделяют на 4 биовара: gravis, mitis, intermedius, belfanti.
На теллуритовой среде биовар gravis образует сухие, матовые, крупные, плоские, серовато-черные колонии, приподнятые в центре. Периферия колонии светлая с радиальной исчерченностью и неровным краем. Такие колонии напоминают цветок маргаритку. Биовар mitis образует мелкие, гладкие, блестящие, черные, выпуклые колонии с ровным краем, окруженные зоной гемолиза. Биовары intermedius и belfanti фактически относятся к биовару mitis, так как не разлагают крахмал, а этот признак у C. diphteriae является наиболее стабильным.
Антигенная структура. C. diphteriae имеют О-антиген (липидные и полисахаридные фракции, расположенные в глубине клеточной стенки) и К-антиген (поверхностный термолабильный белок). О-антиген является межвидовым. На основании К-антигена различают около 58 сероваров.
Факторы патогенности. Основными факторами патогенности C. diphteriae являются поверхностные структуры, ферменты и токсины.
Поверхностные структуры (пили, компоненты микрокапсулы: корд-фактор, К-антиген, миколовые кислоты) имеют белковую и липидную природу, способствуют адгезии микробов в месте входных ворот, препятствуют фагоцитозу бактерий, оказывают токсическое воздействие на клетки макроорганизма, разрушают митохондрии.
Ферменты патогенности: нейраминидаза, гиалуронидаза, гемолизин, дермонекротоксин. Нейраминидаза отщепляет N-ацетилнейраминовую кислоту от гликопротеидов слизи и поверхности клеток, лиаза расщепляет ее на пируват и N-ацетилманнозамин, а пируват стимулирует рост бактерий. В результате действия гиалуронидазы повышается проницаемость кровеносных сосудов и выход плазмы за их пределы, что ведет к отеку окружающих тканей. Дермонекротоксин вызывает некроз клеток в месте локализации возбудителя. Вышедший за пределы сосудов фибриноген плазмы контактирует с тромбокиназой некротизированных клеток организма и превращается в фибрин, что и является сущностью дифтерийного воспаления. Внутри дифтерийной пленки C. diphteriae находят защиту от эффекторов иммунной системы и антибиотиков, размножаясь, они образуют в большом количестве основной фактор патогенности — дифтерийный гистотоксин.
Дифтерийный гистотоксин оказывает блокирующее действие на синтез белка в органах, наиболее интенсивно снабженных кровью: сердечно-сосудистая система, миокард, нервная система, почки и надпочечники.
Эпидемиология. В естественных условиях дифтерией болеет только человек, не обладающий устойчивостью к возбудителю и антитоксическим иммунитетом. Заболевание распространено повсеместно. Наибольшее количество больных наблюдается во второй половине сентября, октябре и ноябре. Наиболее восприимчивы дети дошкольного и младшего школьного возраста. Среди взрослых к группе повышенного риска относятся работники общественного питания и торговли, школ, детских дошкольных и медицинских учреждений.
C. diphteriae обладает устойчивостью к факторам окружающей среды: в капельках слюны, прилипших к посуде или игрушкам, на ручках дверей они могут сохраняться до 15 дней, на предметах окружающей среды – 5,5 мес., могут размножаться в молоке. При кипячении C. diphteriae погибают в течение 1 мин, в 10% растворе перекиси водорода – через 3 мин, в 5% растворе карболовой кислоты и 50-60% спирте – через 1 мин.
Дифтерийный гистотоксин очень неустойчив и быстро разрушается при действии света, нагревании, окислении.
Источником инфекции являются:
1.носители токсигенных штаммов — особенно опасны те носители, у которых нет клинических проявлений заболевания, так как они обладают антитоксическим иммунитетом.
2.больные: Среди больных наибольшее значение имеют лица с локализацией процесса в верхних дыхательных путях. Больной эпидемиологически опасен в течение всего периода болезни, даже в период выздоровления он выделяет токсигенные штаммы в окружающую среду.
Основным механизмом заражения является аэрозольный. Пути передачи:
ведущая роль принадлежит воздушно-капельному,
иногда могут осуществляться воздушно-пылевой, контактно-бытовой, а также алиментарный (через молоко) пути передачи.
Входными воротами инфекции служат слизистые оболочки ротоглотки (небные миндалины и окружающие их ткани), носа, гортани, трахеи, а также слизистые оболочки глаз и половых органов, поврежденные кожные покровы, раневая или ожоговая поверхность, незажившая пупочная ранка.
Наиболее часто встречается дифтерия зева (90-95%). Инкубационный период длится от 2 до 10 дней. По патогенезу дифтерия относится к токсинемическим инфекциям, когда микроб остается в месте входных ворот инфекции, а все клинические проявления связаны с действием экзотоксина.
Начальным этапом инфекционного процесса является адгезия микроба в месте входных ворот. Размножаясь там, микроб выделяет гистотоксин, который оказывает местное действие на клетки тканей, а также поступает в кровь, что ведет к возникновению токсинемии.
В области входных ворот развивается воспалительная реакция, которая сопровождается некрозом эпителиальных клеток и отеком, образуется налет белого цвета с сероватым или желтоватым оттенком, содержащим большое количество микробов, продуцирующих токсин.
Характерным признаком дифтерии является фибринозная пленка:
Если слизистая оболочка образована однослойным эпителием (гортань, трахея, бронхи), возникает крупозное воспаление, здесь пленка располагается поверхностно и легко отделяется от подлежащих тканей.
Если слизистая оболочка образована многослойным эпителием (ротоглотка, надгортанник, голосовые связки), возникает дифтерическое воспаление, когда все клетки прочно связаны между собой и с подлежащей соединительнотканной основой. Фибринозная пленка в этом случае плотно спаяна с подлежащими тканями и не снимается тампоном. При попытке сделать это слизистая оболочка кровоточит.
Иммунитет. После перенесенного заболевания формируется стойкий и напряженный гуморальный антитоксический иммунитет. Продолжительность поствакцинального иммунитета – 3-5 лет.
Материалом для исследования является фибринозная пленка, слизь из зева или носа.
Сбор материала необходимо проводить в течение 3-4 ч (не позднее 12 ч) с момента обращения больного. Для взятия материала используют сухие ватные тампоны, если посев будет произведен в течение 2-3 ч, при транспортировке материала тампоны смачивают 5% раствором глицерина.
Основным методом диагностики является бактериологический. Бактериологическая лаборатория через 48 ч должна дать ответ о наличии или отсутствии C. diphteriae в анализах.
Материал засевают на питательную среду. Отбирают подозрительные колонии и выделенную культуру идентифицируют:
По наличию цистиназы (проба Пизу): в столбик питательного агара с цистином уколом засевают исследуемую культуру. Посевы инкубируют при 37 о С 24 ч. C. diphteriae вызывает почернение среды по ходу укола в результате образования сульфида свинца.
По наличию уреазы (проба Закса): готовят спиртовый раствор мочевины и раствор индикатора – фенолового красного, которые перед употреблением смешивают в соотношении 1:9 и разливают в агглютинационные пробирки. Исследуемые бактерии вносят петлей и растирают по стенке прибирки. В положительном случае через 20-30 мин инкубации при 37 о С среда приобретает красный цвет в результате расщепления мочевины уреазой.
Способности C. diphteriae продуцировать токсин (устанавливается в реакции преципитации в агаре). Для этого в чашку Петри с питательным агаром, содержащим 15-20% лошадиной сыворотки, 0,3% мальтозы и 0,03% цистина помещают полоску фильтровальной бумаги, пропитанную антитоксической противодифтерийной сывороткой, содержащей 5000 АЕ/мл. Чашку подсушивают при 37 0 С 30 мин и бляшками засевают испытуемые штаммы на расстоянии 0,6-0,8 см от края бумаги. Посевы инкубируют при 37 0 С 24 ч. В положительном случае в месте соединения токсина с антитоксином в среде образуется преципитат в виде белых линий – «усиков».
Для определения токсигенности возбудителя дифтерии может быть использована биопроба. Морской свинке внутрикожно или подкожно вводят испытуемую культуру. Токсигенные культуры убивают животных в течение 3-5 суток, при вскрытии обнаруживаются гиперемированные надпочечники, а при внутрикожном заражении – некроз кожи.
Для бактериоскопического исследования (как самостоятельный диагностический метод применяется редко ввиду полиморфизма возбудителя, но может быть проведен по просьбе врача) из материала готовят мазки на нескольких стеклах, один мазок окрашивают по Граму, другой по Нейссеру, третий – обрабатывают флюорохромом – корифосфином для люминесцентной микроскопии.
О наличии антитоксического иммунитета судят по реакции Шика – реакции нейтрализации токсина антитоксином. В кожу предплечья вводят 1/40 DLM дифтерийного токсина. Покраснение и припухлость в месте введения свидетельствует об отсутствии антитоксинов в крови. Отрицательная реакция Шика говорит о наличии антитоксинов.
Для ускоренного обнаружения дифтерийного токсина, как в бактериальных культурах, так и в сыворотке крови, применяют: РНГА с антительным эритроцитарным диагностикумом, РИА и ИФА. Из молекулярно-генетических методов исследования применяют ПЦР.
Препараты для специфического лечения дифтерии.
В целях нейтрализации дифтерийного гистотоксина применяют специфическую противодифтерийную лошадиную очищенную концентрированную сыворотку, которую получают путем гипериммунизации лошадей дифтерийным антитоксином.
Специфическое лечение противодифтерийной сывороткой начинают немедленно при клиническом подозрении на дифтерию. Необходимо выбрать оптимальный режим введения сыворотки, так как антитоксин может нейтрализовать только не связанный с тканями токсин. Для профилактики развития анафилактического шока сыворотку вводят дробно по А.М. Безредке. Введение сыворотки позднее 3-го дня болезни нецелесообразно.
Разработан противодифтерийный иммуноглобулин человека для внутривенного введения. Его применение дает меньше побочных реакций.
Для подавления размножения C. diphteriae в месте входных ворот обязательно назначают антибиотики. Препаратами выбора являются пенициллин или эритромицин, либо другие β-лактамы и макролиды.
Препараты для специфической профилактики дифтерии.
Для создания искусственного активного антитоксического иммунитета применяют дифтерийный анатоксин. Очищенный и концентрированный препарат входит в состав ассоциированных вакцин:
1. адсорбированной коклюшно-дифтерийно-столбнячной вакцины (АКДС-вакцина),
2. адсорбированного дифтерийно-столбнячного анатоксина (АДС-анатоксин),
3. адсорбированного дифтерийно-столбнячного анатоксина с уменьшенным содержанием антигенов (АДС-М),
4. адсорбированного дифтерийного анатоксина с уменьшенным содержанием антигена (АД-М).
Базисный иммунитет создается у детей согласно календарю прививок. Только 95% охват населения прививками гарантирует эффективность вакцинации.
источник
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Лабораторная диагностика дифтерийной инфекции
1. РАЗРАБОТАНЫ Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека (Е.Б.Ежлова, А.А.Мельникова, Н.А.Кошкина); ФБУЗ «Федеральный центр гигиены и эпидемиологии» Роспотребнадзора (М.В.Зароченцев, И.В.Новокшонова); ФБУН «Московский научно-исследовательский институт эпидемиологии и микробиологии им.Г.Н.Габричевского» Роспотребнадзора (И.К.Мазурова, О.Ю.Борисова, С.Ю.Комбарова, В.Г.Мельников, Н.М.Максимова, Т.Н.Якимова); ФБУЗ «Центр гигиены и эпидемиологии в г.Москве» Роспотребнадзора (Н.Я.Салова, И.П.Требунских).
2. РЕКОМЕНДОВАНЫ К УТВЕРЖДЕНИЮ Комиссией по государственному санитарно-эпидемиологическому нормированию Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (протокол от 30 мая 2013 года N 1).
3. УТВЕРЖДЕНЫ Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации Г.Г.Онищенко 14 июля 2013 г.
Методические указания (далее — МУ) предназначены для специалистов бактериологических лабораторий санитарно-эпидемиологической службы, лечебно-профилактических организаций независимо от их организационно-правовой формы и формы собственности и научно-исследовательских институтов, осуществляющих лабораторную диагностику дифтерийной инфекции.
Бактериологическое исследование проводят с целью лабораторной диагностики дифтерийной инфекции, выявления источников инфекции, подтверждения эпидемиологических связей и наблюдения за распространением токсигенных коринебактерий дифтерии. Цель бактериологического исследования — выявление возбудителя дифтерии с помощью минимального количества диагностических тестов, необходимых, достаточных и специфичных для получения достоверного ответа в максимально сжатые сроки: не менее трёх суток — отрицательный ответ, трёх-четырёх суток — ответ о выделении токсигенных коринебактерий дифтерии (возбудителя дифтерии), четырёх-пяти суток — ответ о выделении нетоксигенных коринебактерий дифтерии или других представителей этого рода.
Возбудитель дифтерии — коринебактерии дифтерии (Corynebacterium diphtheriae), продуцирующие дифтерийный токсин (экзотоксин). Источником инфекции является больной или бактерионоситель токсигенных С.diphtheriae.
Нетоксигенные С.diphtheriae не вызывают дифтерийную инфекцию. «Этиологическая» значимость этих микроорганизмов при фарингите, артрите, эндокардите и др. гнойно-септических заболеваниях требует специальных доказательств. При выделении нетоксигенных штаммов C.diphtheriae от больных с подозрением на дифтерийную инфекцию следует обратить внимание на правильность проведения бактериологического исследования и оценку токсигенных свойств.
Способность С.diphtheriae вырабатывать экзотоксин опосредован феноменом фаговой (или лизогенной) конверсии. Конверсию нетоксигенных штаммов С.diphtheriae в токсигенные и наоборот можно воспроизвести в особых экспериментальных (лабораторных) условиях. В тех случаях, когда при первичном посеве исследуемого материала от больных дифтерией или бактерионосителей выделяют токсигенные, а при повторных обследованиях после лечения антибиотиками — нетоксигенные коринебактерии дифтерии, можно предположить, что токсигенные и нетоксигенные С.diphtheriae колонизировали слизистые ротоглотки и носа одновременно. При лечении антибиотиками в первую очередь исчезают токсигенные штаммы, как более чувствительные к их действию, а нетоксигенные штаммы продолжают выделяться. Обнаружение только нетоксигенных штаммов у бактерионосителей при повторных обследованиях после лечения нельзя трактовать как утрату способности токсигенных штаммов продуцировать экзотоксин.
Таксономически близкими к виду C.diphtheriae являются Corynebacterium ulcerans и Corynebacterium pseudotuberculosis — природные патогены крупного и мелкого рогатого скота, лошадей, домашних животных, способные вырабатывать дифтериеподобный экзотоксин, в редких случаях могут вызывать заболевания у человека.
Известны случаи выделения токсигенных C.ulcerans при клинической картине заболевания, сходной с дифтерией, а также токсигенных C.pseudotuberculosis, вызывающих лимфадениты. Инфекции, вызванные этими микроорганизмами, у человека встречаются крайне редко, не имеют эпидемического распространения, а, следовательно, значение этих случаев в медицине невелико.
На слизистых оболочках ротоглотки и носа в норме часто встречается Corynebacterium pseudodiphtheriticum (ложнодифтерийная палочка Гофмана). Умение выделять и идентифицировать данные микроорганизмы, а также нетоксигенные C.diphtheriae служит критерием оценки качества работы бактериологов, особенно в период снижения и спорадической заболеваемости дифтерией.
C.diphthereiae растут на питательных средах, сбалансированных по своему составу, и не растут на простых питательных средах. Требуется кровь любого животного или человека (донора), как источник аминокислот, ростовых факторов, железа и пр. Не всегда коммерческие среды удовлетворяют этим требованиям, поэтому контроль качества питательных сред и всех ингредиентов в лабораториях обязателен.
Кровяные теллуритовые среды (КТА, Клауберг II) остаются лучшими селективными дифференциально-диагностическими средами, обеспечивающими рост колоний через 24 ч, что на одни сутки сокращает сроки выдачи окончательного бактериологического ответа. КТА прост в приготовлении: основой этой среды является коммерческий сухой питательный агар (СПА), в качестве кровяных добавок используют кровь, однако не исключены любые гемолизированные кровяные добавки.
Трудоемкость бактериологического метода и стоимость анализа сокращается при использовании двух половин одной чашки с селективной дифференциально-диагностической питательной средой (далее плотная питательная среда) для посева материала из зева и носа от одного обследуемого. Использование чашки для посева таких образцов на плотной питательной среде недопустимо, так как не позволяет, в большинстве случаев, получить рост изолированных колоний и провести исследование в установленные сроки.
Посев материала из зева и носа на кровяной агар производить нецелесообразно, так как очень сложно получить рост изолированных колоний C.diphtheriae на данной среде из-за обильного роста другой сопутствующей микрофлоры.
Колонии, морфология которых характерна для микроорганизмов рода Corynebacterium, в подавляющем большинстве не подлежат микроскопии и должны быть изучены по всем необходимым идентификационным тестам. «Сомнительные» колонии с нехарактерными морфологическими свойствами подвергают микроскопии. Если в мазках обнаруживают коринеформные микроорганизмы, исследование следует продолжить по всем необходимым идентификационным тестам.
Окрашивание мазков осуществляют по Лёффлеру (щелочной метиленовый синий) или с использованием других синих красителей. Окраску по Граму не применяют, т.к. в процессе окраски клетки грамположительных C.diphtheriae легко обесцвечиваются спиртом и могут выглядеть грамотрицательными (розовый оттенок). Чаще всего это явление наблюдают при окрашивании токсигенных C.diphtheriae (клеточная стенка токсигенных C.diphtheriae ближе по организации и структуре к грамотрицательным микроорганизмам).
В бактериологической практике опираться только на морфологические свойства микробной клетки или колоний при идентификации C.diphtheriae недостаточно. Описаны случаи бактериологической гипо- и гипердиагностики (в 55,0 и 14,5% случаев соответственно), когда использовали учет только морфологических признаков.
При идентификации C.diphtheriae необходим комплекс идентификационных тестов. Основной специфический тест для выявления возбудителя дифтерии, правильная постановка которого является залогом успешной диагностики дифтерийной инфекции, — определение у выделенной культуры способности к продукции дифтерийного токсина. Определять продукцию токсина следует начинать уже в первый день появления роста изолированных колоний на чашках с плотной питательной средой, исключая этап накопления чистой культуры. Несоблюдение этого правила увеличивает сроки исследования на одни сутки.
Во избежание ошибок при определении токсигенных свойств коринебактерий необходимо изучать данный признак у максимального числа выросших колоний (двадцать и более) с чашек первичного посева. При множественном росте подозрительных колоний нельзя ограничиться формированием только одной-двух бляшек. Кроме того, необходимо изучать токсигенные свойства отдельных изолированных колоний, чтобы не потерять нетоксигенные штаммы C.diphtheriae, присутствие которых также возможно при наличии токсигенных C.diphtheriae в патологическом материале.
Используют два способа постановки пробы на токсигенность:
1) модифицированная проба Элека с бумажными полосками, утверждённая для бактериологической практики в нашей стране в 1961 г.;
2) проба Фельдмана Ю.Г. и соавторов с бумажными дисками, разработанная в нашей стране и утвержденная в 1988 г., получившая одобрение Международной рабочей группы ВОЗ по лабораторной диагностике дифтерийной инфекции к применению в зарубежных лабораториях.
В пробе на токсигенность следует использовать только антитоксин — противодифтерийные антитоксические антитела, очищенные методом специфической сорбции, что позволяет избежать появления неспецифических линий преципитации микробного происхождения. В исключительных случаях при отсутствии антитоксина допускается использование лечебной противодифтерийной антитоксической лошадиной сыворотки. В таком случае возможно появление неспецифических линий преципитации микробного происхождения, которые необходимо отличить от специфических линий токсического происхождения.
Обязательными являются биохимические тесты — на цистиназу, уреазу, расщепление глюкозы, сахарозы и крахмала. Тест на нитраты проводят только при положительной уреазной реакции. Использование других тестов, применяемых в некоторых зарубежных странах, необоснованно увеличивает продолжительность, трудоемкость, стоимость исследования и не всегда приводит к точной идентификации «недифтерийных» микроорганизмов (других представителей рода Corynebacterium). При лабораторной диагностике дифтерии не является обязательным определение видовой принадлежности «недифтерийных» коринебактерий рода Corynebacterium, тем более что их идентификация требует отдельных хемотаксономических и молекулярно-генетических методов исследования.
C.diphtheriae подразделяют на культурально-биохимические варианты (биовары) gravis, mitis, intermedius, belfanti. В бактериологической практике определению подлежат биовар gravis и объединенная группа «митисных форм» — mitis, intermedius, belfanti, т.е. группа микроорганизмов C.diphtheriae, которая не обладает амилазной активностью (не разлагает крахмал). Биовар belfanti не подлежит отдельному определению, так как этот микроорганизм не способен продуцировать экзотоксин. В бактериологической диагностике отдельного выделения биовара intermedius так же не требуется, так как относительно условными дифференцирующими признаками от биовара mitis являются только размер колоний и наличие липофильности. Таким образом, в бактериологической диагностике определяются токсигенные и биохимические свойства C.diphtheriae биовара gravis и группы микроорганизмов, у которых отсутствует амилазная активность, объединённые в группу C.diphtheriae биовар mitis.
Молекулярно-генетические методы для лабораторного выявления C.diphtheriae находятся в стадии разработки. Имеющиеся тест-системы для метода ПЦР не могут различить ген дифтерийного токсина токсигенных штаммов от «молчащего» гена дифтерийного токсина нетоксигенных токснесущих штаммов C.diphtheriae, не способных продуцировать токсин из-за мутаций в этом гене. Это может привести к гипердиагностике. Поэтому их использование в лабораторной диагностике дифтерии может иметь только вспомогательное значение — поиск нетоксигенных токснесущих штаммов C.diphtheriae среди нетоксигенных штаммов.
Род Corynebacterium гетерогенный, как и группа, условно объединившая его и другие роды грамположительных палочек, не образующих споры размером 0,3-0,8 1,5-8,0 мкм, неподвижных, обладающих различной степенью полиморфизма и плеоморфизма. C.diphtheriae имеют размер 0,2-0,6 1,0-7,0 мкм. Арабиногалактановый полимер клеточной стенки C.diphtheriae отличает этот вид от всех других видов рода Corynebacterium. Клеточная стенка С. diphtheriae имеет от 3-5 до 7-9 слоёв. Известно, что клеточная стенка токсигенных C.diphtheriae лучше дифференцирована и более тонкая по сравнению с клеточной стенкой нетоксигенных C.diphtheriae и других коринеформных микроорганизмов этого рода, что определяет их отношение к антибиотикам — токсигенные более чувствительны, чем нетоксигенные к пенициллину, эритромицину, тетрациклину и макролидам. Однако появляются штаммы C.diphtheriae устойчивые к некоторым антибиотикам, преимущественно выделенные от бактерионосителей.
Патогенные для животных Corynebacterium ulcerans и Corynebacterium pseudotuberculosis, некоторые комменсалы кожи со слизистых оболочек человека, например, Corynebacterium pseudodiphtheriticum (ложнодифтерийная палочка Гофмана), Corynebacterium xerosis, Corynebacterium striatum таксономически близки к виду C.diphtheriae.
Большинство видов лучше растет в аэробных условиях, в том числе и микроорганизмы вида C.diphtheriae. Вместе с тем, C.diphtheriae являются факультативными анаэробами (генерируют энергию, используя как молекулярный О , так и органические соединения), что крайне важно учитывать при изучении их ферментативной активности.
Все коринебактерии, в т.ч. и C.diphtheriae, являются мезофилами и растут при 36-37 °С.
Устойчивость к факторам внешней среды
C.diphtheriae устойчивы к низкой и чувствительны к высокой температуре (низкие температуры не убивают дифтерийные палочки длительное время, под действием прямого солнечного света палочки дифтерии гибнут в течение нескольких дней); значительно устойчивы во внешней среде и длительно сохраняют жизнеспособность в дифтерийной плёнке, в капельках слюны, на ручках дверей, детских игрушках до 15 дней; в пыли, на полу, на предметах в окружении больного до 18-40 дней; в сухой дифтерийной плёнке до 7 недель; в воде выживают в течение 6-20 дней. Коринебактерии дифтерии не устойчивы к действию физических и химических обеззараживающих средств и разрушаются под действием обычных дезинфектантов в обычных концентрациях (3-5%) при экспозиции 30 мин; погибают при нагревании до 60 °С в течение 10 мин, кипячение убивает их моментально.
Культурально-морфологические свойства
Обычно колонии микроорганизмов из рода Corynebacterium на плотных питательных средах (например, на кровяном агаре) имеют серовато-белую или желтую окраску, непрозрачные или полупрозрачные, приподнятые, округлой формы, диаметром 1-3 мм. Чаще всего они бывают мягкой, маслянистой консистенции, хотя некоторые виды рода Corynebacterium могут образовывать шероховатые R-колонии и крошиться при прикосновении. На питательных средах, сбалансированных по своему составу и удовлетворяющих требованиям культивирования C.diphtheriae, через 24-48 ч роста вариант mitis образует колонии S-типа — приподнятые, гладкие, диаметром 1-2 мм; S-R-колонии варианта gravis обычно выпуклые, с приподнятым центром, диаметром 2-3 мм; колонии варианта intermedius — S-типа, мелкие, плоские, гладкие, с ровным краем, диаметром 0,5-1 мм.
На селективных дифференциально-диагностических средах — кровяной теллуритовый агар (КТА) и Клауберг II через 24-48 ч роста колонии C.diphtheriae варианта gravis имеют серо-черную или черную окраску с металлическим оттенком («цвет мокрого асфальта»), непрозрачные, матовые, приподнятые с выпуклым центром, округлой формы, диаметром 1-3 мм, имеют радиальную исчерченность (форма «маргаритки») или выраженную краевую изрезанность, часто крошатся при прикосновении; колонии C.diphtheriae варианта mitis имеют серо-черную или черную окраску («цвет мокрого асфальта»), непрозрачные, матовые, приподнятые с выпуклым центром, иногда плоские, округлой формы, диаметром 1-2 мм, чаще всего бывают мягкой, маслянистой консистенции или могут крошиться при прикосновении; колонии C.diphtheriae варианта intermedius имеют серо-черную окраску, мелкие, плоские, гладкие, с ровным краем, диаметром 0,5-1,0 мм, мягкой, маслянистой консистенции.
Морфология колоний C.ulcerans и C.pseudotuberculosis на КТА через 24-48 ч роста идентична морфологии колоний С.diphtheriae варианта gravis, серо-черной или черной окраски («цвет мокрого асфальта»), иногда с коричневым оттенком, колонии непрозрачные, матовые, приподнятые с выпуклым центром, округлой формы с радиальной исчерченностью (или без неё), диаметром 1-2 мм. Колонии C.pseudodiphtheriticum — серого цвета с характерным светлым ободком, непрозрачные, приподнятые, матовые, округлой формы, диаметром 1-2 мм.
На теллуритовой среде без крови (коринебакагар) колонии C.diphtheriae через 24 ч роста мелкие (иногда 0,2-0,6 мм), через 48 ч роста размер колоний увеличивается до 1,0-1,2 мм, иногда наблюдаются «гигантские» колонии. Однако морфология колоний изменяется — исчезает исчерченность края, к 48 ч колонии меняют характерную для C.diphtheriae архитектонику — плоские, «расползающиеся» по поверхности агара, иногда меняется цвет колоний.
Помимо относительно условной оценки морфологии колоний на питательной среде первичного посева существует несколько других признаков, позволяющих различать биовары gravis, mitis, intermedius. Например, характерный рост на бульоне в пробирке: для биовара gravis — поверхностная пленка, бульон прозрачен, на дне пробирки через 24 ч организуется осадок; для биовара mitis — диффузное помутнение среды с образованием осадка, для биовара intermedius — тонкое гранулярное помутнение с последующим оседанием гранул на дно пробирки.
На кровяном агаре можно наблюдать гемолиз эритроцитов (кроличьих и крупного рогатого скота) при росте биовара mitis, гемолиз только кроличьих эритроцитов при росте биовара gravis и отсутствие гемолиза при росте биовара intermedius. Однако только биовар intermedius обладает липофильностыо — способностью усиливать рост на среде с 0,3% твина — 80.
Морфология клетки
Для C.diphtheriae характерен значительный полиморфизм — разнообразие размеров и формы клеток. Клетки имеют форму булавы, ракетки, палочки, овоида и т.п. Клетки C.ulcerans и C.pseudotuberculosis чаще всего имеют овоидную форму. На средах КТА овоидную форму часто приобретают токсигенные C.diphtheriae. Взаиморасположение клеток напоминает римские цифры X, V, иногда — «китайские иероглифы». Подобную форму клетки приобретают при делении. Возможно параллельное расположение клеток, что особенно характерно для C.pseudodiphtheriticum и C.pseudotuberculosis.
При окраске часто обнаруживается выраженная внутриклеточная исчерченность, что объясняется наличием зерен волютина (метахроматические гранулы, тельца Бабеша-Эрнста). Описано сродство волютина к метиленовому синему (окраска по Лёффлеру), поэтому при обработке этим красителем гранулы или полоски (скопления гранул) прокрашиваются в синий цвет, а протоплазма в отдельных случаях может приобрести розовый оттенок. В бактериологической практике окраску по Граму не используют, поскольку клетки C.diphtheriae легко обесцвечиваются спиртом и могут выглядеть в мазке как грамотрицательные микроорганизмы. При окраске по Нейссеру, которую также редко используют, клетки C.diphtheriae окрашиваются в желтый цвет с зернами волютина (на концах клетки) темно-коричневого цвета, иногда с синим оттенком.
Ферментативная активность
Ферментативная активность коринебактерий изучается путем определения ферментов цистиназы, уреазы, способности расщеплять до кислоты глюкозу, сахарозу и крахмал (табл.1). C.diphtheriae продуцируют фермент цистиназу, отсутствует продукция фермента уреазы, разлагают глюкозу, крахмал (биовар gravis), не разлагают сахарозу. Биовар mitis не разлагает крахмал. C.diphtheriae способны восстанавливать соли азотной кислоты (нитраты) в соли азотистой кислоты (нитриты).
Токсигенные свойства
C.diphtheriae, вызывающие заболевание дифтерией, обладают токсигенными свойствами. Основными генами патогенности C.diphtheriae, отвечающими за токсинообразование, являются ген дифтерийного токсина — tox и регуляторный ген — dtxR. 55-65% токсигенных C.diphtheriae, циркулирующих в период спорадической заболеваемости дифтерией, имеют изменения (мутации) в этих генах, некоторые из них приводят к повышению уровня токсинообразования. Подобные изменения характеризовали большинство штаммов C.diphtheriae, распространенных в 90-е годы во время эпидемии дифтерии в России и вызвавшие тяжелые формы клинического течения заболевания.
Уровень токсинообразования штаммов C.diphtheriae биовара gravis в два-четыре раза превышал уровень токсинообразования биовара mitis, вызывая более тяжелое клиническое течение дифтерии в период последней эпидемии. Также, начиная с 90-х годов прошлого столетия, биовар gravis имеет доминирующее распространение среди токсигенных C.diphtheriae, в то время как среди нетоксигенных C.diphtheriae доминирующее распространение имеет биовар mitis. От 2,0 до 20,0% этой группы в различные периоды эпидпроцесса составляли штаммы, несущие «молчащий» ген дифтерийного токсина (tох-ген), не способный к экспрессии дифтерийного токсина, так называемые нетоксигенные токснесущие штаммы C.diphtheriae биовара mitis, эпидемиологическое значение которых до конца не изучено. Для циркуляции C.diphtheriae характерна периодическая смена доминирующего биовара, которая, как правило, совпадает с началом интенсификации эпидпроцесса.
В период спорадической заболеваемости сокращена циркуляция токсигенных C.diphtheriae, вместе с тем циркуляция нетоксигенных остаётся на высоком уровне.
Несвоевременное выявление носителей токсигенных C.diphtheriae бактериологическим методом приводит к «скрытому» распространению возбудителя дифтерии и возникновению новых очагов дифтерийной инфекции.
Эффективность проведения бактериологического исследования в значительной степени зависит от своевременного правильного взятия материала и соблюдения сроков доставки его в бактериологическую лабораторию.
Для взятия материала используют коммерческие стерильные сухие ватные (или дакроновые) тампоны, также возможно их приготовление в лабораторных условиях с учетом требований нормативно-методической документации. Тампоны должны иметь форму «капли», а не «веретена».
Материал из ротоглотки и носа берут отдельными тампонами, натощак или не ранее чем через 2 ч после еды, а также до применения полоскания или других видов лечения. Взятие материала осуществляют при хорошем освещении, с использованием шпателя, не касаясь тампоном языка и внутренних поверхностей щек и зубов. Одним тампоном собирают материал с участков ротоглотки — миндалин, дужек мягкого неба, небного язычка, при необходимости — с задней стенки глотки. При наличии налетов патологический материал следует брать с границы пораженных и здоровых тканей, слегка нажимая на них тампоном. Для взятия материала из носа используют другой тампон, который вводят глубоко сначала в один, а потом в другой носовой ход, собирая материал со стенок и перегородки носа, при этом не касаясь крыльев носа снаружи.
При дифтерии других локализаций (глаза, уши, кожа, раны, гениталии и пр.) помимо материала из пораженных участков забирают материал из ротоглотки и носа. При показаниях к обследованию на дифтерию и одновременном наличии пораженных слизистых и кожи в углу рта («заеды») обследование этих участков проводят отдельным тампоном и параллельно берут материал из ротоглотки и носа.
При прямой ларингоскопии материал (слизь, пленка) собирают непосредственно из гортани. В случаях оперативного вмешательства для бактериологического исследования следует брать слизь из интубационной трахеотомической трубки.
При взятии материала с пораженного участка кожи необходимо протереть его поверхность промокательными движениями стерильной марлевой салфеткой или тампоном, смоченными стерильным физиологическим раствором, осторожно приподнять или отодвинуть струпы и корочки. После этого тампоном, предназначенным для взятия материала на дифтерию, взять секрет с пораженного участка. Одновременно забирают материал из ротоглотки и носа.
При постмортальном исследовании для выявления возбудителя дифтерии материал следует брать с миндалин, гортани и полости носа (слизь, пленки), при редких локализациях — со слизистой пищевода и желудка. Учитывая, что дифтерия является токсикоинфекцией, другие органы (сердце, печень и пр.) обследуют только для выявления токсических поражений.
Тампоны должны быть доставлены в лабораторию не позднее чем через 3 ч после взятия материала. В холодное время года для предотвращения замерзания исследуемый материал доставляют в бактериологическую лабораторию в сумках-термосах.
При невозможности доставки исследуемого материала в баклабораторию в установленные сроки (не позднее 3 ч) или проведения обследования в ЛПО во второй половине дня материал из ротоглотки (зева) и носа засевают «площадкой» с последующим рассевом на одну чашку Петри с питательной средой, разделенной пополам («чашечный метод»). После этого посевы помещают в термостат при 37 °С до утра следующего дня, после чего доставляют в сумках-термосах в баклабораторию (с указанием времени посева материала). При редких локализациях посев материала из каждого пораженного участка осуществляют на отдельную чашку Петри с питательной средой.
Медицинский персонал ЛПО должен проходить инструктаж в баклаборатории о правилах взятия и посева материала на питательные среды.
При невозможности организовать посев материала «чашечным методом» допускается засевать материал в пробирки с транспортной средой для сохранения и подращивания возбудителя дифтерии, которая готовится в лабораторных условиях согласно нормативно-методической документации. Не допускается использование коммерческих транспортных сред, предназначенных для исследования на микрофлору ротоглотки и носа, в связи с тем, что состав этих сред не удовлетворяет условиям культивирования возбудителя дифтерийной инфекции, что приводит к потере патологического материала.
В случае использования транспортной среды, приготовленной в лабораторных условиях, согласно нормативной документации, материал собирают сухим тампоном, опускают в пробирку со средой и следят за тем, чтобы пробка тампона не намокала. Следует учитывать, что применение транспортной среды увеличивает срок выдачи окончательного ответа на одни сутки, так как после подращивания в термостате при 37 °С на утро следующего дня материал доставляется в баклабораторию для последующего посева на чашки Петри с селективной питательной средой.
Незасеянные (чистые) чашки Петри с питательной средой и пробирки с транспортной средой доставляются в ЛПО из баклабораторий. Хранение питательных сред в ЛПО осуществляется в холодильнике при 4-6 °С; чашки со средой — не более трех дней; пробирки с транспортной средой — не более 10 дней. Перед взятием и посевом материала их необходимо достать из холодильника и согреть до комнатной температуры. При невозможности доставки материала в баклабораторию круглосуточно ЛПО оснащаются термостатами. В стационаре взятие патологического материала проводят круглосуточно, используя «чашечный метод».
Исследуемый материал из ротоглотки и носа, собранный сухими ватными тампонами и помещенный в пробирки (не менее двух пробирок от одного лица, при редких локализациях добавляются дополнительные пробирки), или материал, засеянный в пробирки с транспортной средой (также не менее двух пробирок от одного лица), или материал из ротоглотки и носа, а также из редких мест локализации, засеянный «чашечным методом», должен быть четко пронумерован и иметь сопроводительную документацию. Пробирки с материалом от одного лица скреплены вместе.
В сопроводительном документе указывают: фамилию, имя, отчество, возраст, адрес обследуемого лица, название учреждения, направляющего материал, локализацию взятия материала (нос, зев, кожа и др.), дату и время взятия материала, цель обследования (диагностическая с указанием диагноза, по эпидпоказаниям, с профилактической целью).
1. Медицинским работникам лечебно-профилактических организаций (ЛПО), ответственным за взятие и транспортирование материала при обследовании на дифтерию, необходимо согласовывать методику взятия материала, условия транспортирования и возможности применения транспортной среды с врачами-бактериологами, проводящими эти исследования.
2. Медицинским работникам ЛПО, допущенным к взятию и посеву материала, следует проходить инструктаж не реже 1 раза в год в баклаборатории, проводящей исследования на дифтерию.
3. Врачам-бактериологам ЛПО и ФБУЗ «Центр гигиены и эпидемиологии» Роспотребнадзора в субъектах Российской Федерации следует повышать квалификацию на курсах тематического усовершенствования по лабораторной диагностике дифтерии не реже 1 раза в три года.
4. Методическую помощь по вопросам взятия, транспортирования и лабораторной диагностики дифтерии осуществляют региональные центры по мониторингу за возбудителями инфекционных и паразитарных болезней II-IV групп патогенности (на базе ФБУЗ «Центр гигиены и эпидемиологии» Роспотребнадзора в субъектах Российской Федерации — далее Региональные центры по мониторингу) и Референс-центр по мониторингу за дифтерией (на базе ФБУН МНИИЭМ им.Г.Н.Габричевского Роспотребнадзора — далее Референс-центр).
5. Бактериологические лаборатории ФБУЗ «Центр гигиены и эпидемиологии» Роспотребнадзора в субъектах Российской Федерации направляют все выделенные токсигенные и выборочно нетоксигенные штаммы C.diphtheriae, C.ulcerans, C.pseudotuberculosis, а также штаммы с атипичными свойствами в Референс-центр для реидентификации (верификации) по адресу: 125212, г.Москва, ул.Адмирала Макарова, 10.
6. Бактериологические лаборатории Региональных центров по мониторингу и Референс-центр осуществляют внешний контроль качества лабораторных исследований на дифтерию, проводимых в бактериологических лабораториях субъектов Российской Федерации.
Первый день. Посев материала
Материал для исследования из ротоглотки (зева), носа или других пораженных мест засевают раздельно на поверхность одной из рекомендуемых плотных питательных сред — КТА или Клауберг II, разлитых в чашки Петри («чашечный метод посева») (рис.1).
Посев от одного лица производят на одну чашку, используя при этом половину поверхности ( ) чашки среды для посева материала из ротоглотки (зева), а вторую — для посева материала из носа. При посеве материала с кожи или других пораженных мест добавляют еще одну чашку (все чашки маркируются). Не допускается посев материала от нескольких лиц на одну чашку.
При посеве материал тщательно втирают в среду со всех сторон тампона на участке площадью 2 1 см у края чашки, стараясь оставить весь патологический материал на поверхности формируемой «площадки». Формирование такой «площадки» является обязательным, что позволяет сохранить исследуемый материал, находящийся на тампоне. Дальнейший рассев исследуемого патологического материала осуществляют этим же тампоном, не отрывая тампон от поверхности питательной среды, засевая оставшуюся поверхность чашки, что позволяет получить изолированные колонии (чистую культуру) для дальнейшей идентификации непосредственно с чашки первичного посева. Такой метод сохраняет весь патологический материал на поверхности питательной среды и позволяет работать с отдельными изолированными колониями, исключая этап накопления на агаровом косяке чистой культуры, что сокращает длительность проведения исследования на одни сутки.
Засеянные чашки с плотной питательной средой или пробирки с транспортной средой помещают в термостат для инкубации при 37 °С.
Высев из транспортной среды производят описанным выше способом на следующие сутки, используя дифференциально-диагностическую плотную питательную среду, тампоном, отжатым о стенки пробирки, или петлей, забирая материал из осадка.
Чашки со средой предварительно согревают при комнатной температуре или в термостате при 37 °С (15-20 мин). Если на поверхности чашки со средой есть конденсат, то ее подсушивают на крышке, повернув чашку вверх дном. Нельзя использовать для посева материала «охлажденные» чашки с питательной средой.
Второй день
1. Колонии, выросшие на чашках, просматривают через 24 ч после посева материала (если материал засевали во второй половине дня, то просмотр осуществляется ровно через 24 ч, т.е. во второй половине дня) визуально или с помощью микроскопа бинокулярного стереоскопического (МБС).
2. Чашки с колониями, «подозрительными» на дифтерийные, отбирают для дальнейшей идентификации культуры по всем тестам. «Подозрительные» колонии на кровяно-теллуритовых средах (КТА) через 24 ч роста — темно-серого или серо-черного цвета, выпуклые, округлой формы, непрозрачные, с ровными краями или с легкой изрезанностью края или радиальной исчерченностью, мягкой, маслянистой консистенции; через 48 ч окончательно формируется типичная морфология (архитектоника) колоний — серо-черного или черного цвета с металлическим оттенком («цвет мокрого асфальта»), непрозрачные, матовые, приподнятые с выпуклым центром или выпуклые, округлой формы, гладкие с ровными краями и мягкой консистенции (S-форма) или шероховатые, с радиальной исчерченностью (напоминающие форму «маргаритки»), с приподнятым центром (R-форма). Иногда крошащиеся при прикосновении петлей.
3. Микроскопию препаратов — мазков из «подозрительных» колоний можно не проводить, так как все эти колонии подлежат обязательному изучению в пробе на токсигенность и в пробе Пизу.
4. Из «сомнительных» колоний готовят препараты — мазки. В препаратах-мазках, как «подозрительных», так и «сомнительных» колоний клетки C.diphtheriae из культуры, выросшей на средах первичного посева с ингибиторами роста (теллурит калия), могут быть укорочены, утолщены, однако присущее им расположение и полиморфизм сохраняются. Оценка морфологических признаков не позволяет установить видовую принадлежность микроорганизмов, но дает возможность при обнаружении коринеформных микроорганизмов предположительно отнести их к роду Corynebacterium и подвергнуть дальнейшей идентификации по всем тестам. В случае обнаружения других форм микроорганизмов (кокков, дрожжей, споровых палочек) дальнейшее изучение этих колоний прекращается.
5. В случае роста «подозрительных» по морфологии колоний, похожих на колонии коринебактерий, необходимо сразу через 24 ч роста приступить к изучению их токсигенных свойств. Токсигенные свойства изучают не менее чем у 2 изолированных колоний путем посева одной половины каждой колонии на среду для определения токсигенности и «необожженной» петлей — на среду Пизу, а другой половины колонии — в пробирку со скошенным сывороточным агаром для сохранения и накопления чистой культуры.
6. При невозможности снять колонии в первые 24 ч роста для посева на токсигенность и на среду Пизу используется материал целой колонии. Посев на скошенный агар исключается и в дальнейшем используется культура, выросшая через 24 ч в пробирке с пробой Пизу. Учитывая, что через 24 ч роста колонии имеют небольшие размеры и материала или 1 колонии может быть недостаточно для накопления дифтерийного токсина в пробе на токсигенность, а также то, что в исследуемом материале могут находиться одновременно токсигенные и нетоксигенные разновидности C.diphtheriae, крайне важно изучить токсигенные свойства, по возможности, у максимального числа выросших колоний (20 и более), смешивая по 5-7 однотипных колоний в одну бляшку. При невозможности постановки пробы на токсигенность классическим способом из-за недостаточного количества и малого размера колоний, выросших через 24 ч, изучают, смешивая однотипные по морфологии и размеру колонии в нескольких бляшках и, не прожигая петли, производят посев в среду Пизу. Чашки с пробами на токсигенность и Пизу помещают в термостат.
7. Чашки с первичным посевом исследуемого материала вновь помещают в термостат на 24 ч и просматривают их повторно через 48 ч роста первичного материала (на третьи сутки).
8. Предварительный ответ о выявлении C.diphtheriae может быть выдан при наличии множественного роста однотипных «подозрительных» колоний на чашках первичного посева после 24 ч инкубации. Выявляют наличие фермента цистиназы (через 3 ч) и определяют наличие фермента уреазы (через 30 мин) путем внесения в пробирки большого количества колоний (до 5-6).
Третий день
1. Через 24 ч, при появлении специфических линий преципитации на среде для определения токсигенности, положительной пробе на цистиназу, изучаемую культуру идентифицируют как коринебактерии дифтерии токсигенные и выдают документированный ответ о выделении C.diphtheriae токсигенных. При отсутствии специфических линий преципитации на среде для определения токсигенности чашки инкубируют еще 24 ч.
2. Культуру, выросшую на скошенном сывороточном агаре или с пробы Пизу (после оценки ее чистоты), засевают на среды для определения биохимического варианта (глюкоза, сахароза, крахмал) и фермента уреазы (гидролиз мочевины).
3. Чашки с первичным посевом исследуемого материала просматривают визуально или с помощью микроскопа бинокулярного стереоскопического (МБС) повторно через 36-48 ч инкубации в термостате. При наличии «подозрительных» колоний изучают их токсигенные свойства, цистиназную активность и выделяют чистую культуру на скошенном сывороточном агаре, если эти процедуры не были выполнены через 24 ч роста первичного материала.
4. Если вырастает только одна колония через 48 ч роста на чашках первичного посева, ее засевают на среду для определения токсигенности и, не обжигая петли, в столбик среды Пизу для определения цистиназы. Для дальнейшей идентификации можно использовать культуру из пробирки с пробой Пизу или с бляшки через 48 ч роста в пробе на токсигенность, или через 24 ч роста в случае выявления токсигенных свойств идентифицируемой культуры.
5. При отсутствии колоний, подозрительных на коринебактерии дифтерии, выдают окончательный ответ, что коринебактерии дифтерии не выявлены.
6. При отсутствии роста микроорганизмов на «площадках» в чашках первичного посева через 48 ч инкубации в ряде случаев требуется повторное взятие и исследование материала. Отсутствие роста чаще всего свидетельствует о нарушении правил проведения бактериологического исследования (взятия, транспортирования, посева и культивирования исследуемого материала и качества питательных сред для первичного посева).
Четвертый день (или пятый)
1. При появлении специфических линий преципитации на среде для определения токсигенности (через 24 ч инкубации пробы на токсигенность 48-часового роста первичного посева), положительной пробе на цистиназу выдают документированный ответ о выделении токсигенных коринебактерий дифтерии.
2. Культуру, выросшую на скошенном сывороточном агаре или с пробы Пизу, после определения ее чистоты засевают на среды для изучения биохимических свойств (среды Гисса с сахарозой, глюкозой, крахмалом, проба Заксе или бульон с мочевиной), если эта процедура не была сделана ранее.
3. Повторно (через 48 ч) учитывают результаты пробы на токсигенность, поставленной во 2 день исследования. Одновременно производят учет сахаролитических свойств и уреазной активности в пробах, поставленных в 3 день исследования.
При отсутствии специфических линий преципитации через 48 ч после постановки пробы на токсигенность, но при положительных результатах проб на цистиназу, глюкозу, отрицательных результатах проб на уреазу и сахарозу, только на 4-5 сутки культуру идентифицируют как C.diphtheriae нетоксигенные, с указанием биохимического варианта.
4. При выделении токсигенных C.diphtheriae на 3-4 сутки от начала исследования дополнительно ответ о биохимических свойствах может быть выдан на 4-5 сутки (через 72 или 96 ч с момента первичного посева исследуемого материала).
1. Наличие специфических линий преципитации при определении токсигенных свойств, положительная проба на цистиназу, отрицательная проба на уреазу, характерные морфологические, культуральные и биохимические свойства (отсутствие ферментации сахарозы, ферментация глюкозы и крахмала или неферментация крахмала) позволяют заключить, что выделенная культура является C.diphtheriae, токсигенная, биохимического варианта гравис или митис.
2. Отсутствие специфических линий преципитации при определении токсигенных свойств, положительная проба на цистиназу, отрицательная проба на уреазу, характерные морфологические, культуральные и биохимические свойства (отсутствие ферментации сахарозы, ферментация глюкозы и крахмала или неферментация крахмала) позволяют заключить, что выделенная культура является C.diphtheriae, нетоксигенная, биохимического варианта гравис или митис.
3. При выделении C.pseudodiphtheriticum (ложнодифтерийной палочки Гофмана) или других дифтероидов, бактериологический ответ считают отрицательным.
4. При наличии линий преципитации (чаще «размытых» в виде «облачка»), идентичных специфическим линиям контрольного штамма коринебактерий дифтерии, положительных проб на уреазу, цистиназу, ферментации глюкозы и крахмала, отсутствии ферментации сахарозы, отсутствии редукции нитратов в нитриты, культуру относят к виду C.ulcerans, токсигенный вариант.
При отсутствии линий преципитации при определении токсигенных свойств и наличии всех других признаков, характерных для C.ulcerans, нетоксигенный вариант, бактериологический ответ считают отрицательным.
5. C.pseudotuberculosis идентифицируется по положительной реакции в пробе на уреазу. Тест восстановления нитратов в нитриты у этих микроорганизмов является вариабельным признаком, поэтому дифференциацию от C.ulcerans проводят по крахмалу (C.pseudotuberculosis не способны разлагать крахмал — отрицательный результат). Необязательный тест для практических бактериологов — для дифференциальной диагностики C.ulcerans и C.pseudotuberculosis вводят дополнительную пробу ферментации трегалозы и гидролиз желатина. Возможно выделение токсигенных С.pseudotuberculosis.
6. При выделении C.ulcerans и C.pseudotuberculosis необходимо подтверждение подобной идентификации в Референс-центре ФБУН МНИИЭМ им.Г.Н.Габричевского Роспотребнадзора, чтобы исключить ошибки при возможном выделении C.diphtheriae.
7. Предварительный ответ при обследовании с диагностической целью и по эпидпоказаниям может быть выдан при наличии множественного роста однотипных «подозрительных» колоний на чашках первичного посева после 24 или 48 ч инкубации (на 2-3 сутки). Выявляют наличие фермента цистиназы и отсутствие фермента уреазы путем внесения в пробирки большого количества колоний. Предварительный ответ может быть изменен после окончания бактериологического исследования.
При нативной микроскопии (по просьбе инфекционистов) требуется дополнительный материал на тампонах из ротоглотки и носа. Однако чаше всего микроорганизмы в виде «палочек» не обнаруживают, что делает этот способ практически не пригодным.
1 день
Посев исследуемого материала на селективную дифференциально-диагностическую или, при необходимости, в транспортную среду. Инкубирование в термостате при 37 °С.
1. Изучение выросших колоний, при возможности — постановка пробы на токсигенность, цистиназу и посев культуры на скошенный сывороточный агар.
2. При использовании транспортной среды необходимо произвести пересев на селективную дифференциально-диагностическую среду.
3. При множественном росте, в случае необходимости, можно провести исследования для выдачи предварительного ответа — дополнительные пробы Пизу и Заксе.
1. Учет результатов проб на токсигенность и на цистиназу, поставленных во второй день исследования. В случае наличия специфических линий преципитации и при положительной пробе Пизу выдают документированный ответ о выделении токсигенных коринебактерий дифтерии.
2. Посев чистой культуры, выделенной во второй день исследования, на среды Гисса для изучения биохимических свойств (сахароза, глюкоза, крахмал, мочевина).
3. Повторный просмотр (через 48 ч) чашек первичного посева визуально или с помощью МБС. Постановка проб на токсигенность, цистиназу и отсев колоний на скошенный сывороточный агар.
4. В случае использования транспортной среды, ход исследования см. начиная с п.1 второго дня и далее по схеме.
5. Выдача бактериологического ответа об отсутствии коринебактерий дифтерии.
6. При обнаружении у исследуемой культуры фермента цистиназы, отсутствии фермента уреазы, можно выдать предварительный ответ о выделении дифтерийного микроба.
1. Учет токсигенных свойств культуры, выделенной в 3 день исследования (через 48 ч роста первичного посева), при обнаружении специфических линий преципитации выдают документированный ответ о выделении токсигенных коринебактерий дифтерии. Определяют биохимические свойства (сахароза, глюкоза, крахмал, мочевина).
2. Учет биохимических свойств культуры (токсигенной или нетоксигенной), выделенной во второй день исследования (через 24 ч инкубации первичного посева).
3. Выдача бактериологического ответа о выделении нетоксигенных коринебактерий дифтерии с указанием биохимического варианта и дополнительного ответа о биохимических свойствах токсигенных коринебактерий дифтерии, выделенных ранее.
1. Выдача бактериологического ответа о выделении токсигенных или нетоксигенных коринебактерий дифтерии с указанием биохимического варианта (в случае 48 ч инкубации первичного посева и 48 ч проявления или не проявления специфических линий преципитации в пробе на токсигенность).
В основе метода определения токсигенности коринебактерий дифтерии (модифицированный тест Элека с бумажными полосками и тест Фельдмана с соавт. с бумажными дисками) лежит процесс встречной иммунодиффузии токсина и антитоксических антител в плотной питательной среде. В местах оптимального количественного соотношения между токсином, продуцируемым коринебактериями, и антитоксином, нанесенным на фильтровальную бумагу, происходит их взаимодействие с образованием преципитата в виде белой линии.
Токсигенность коринебактерий дифтерии определяют, как правило, в чистой культуре (отдельные колонии со среды первичного посева или культура со скошенного агара, или с пробы Пизу). Смесь колоний или культуры, загрязненные посторонней микрофлорой, также могут быть испытаны на токсигенность. При отсутствии, в этом случае, преципитатов в агаровом геле, опыт следует повторить с выделенными на скошенной сывороточно-агаровой среде или после рассева на КТА чистыми культурами.
Для постановки пробы на токсигенность необходимо иметь: стерильные чашки Петри с ровным дном (стеклянные или одноразовые пластиковые), питательную среду — сухую коммерческую питательную среду для определения токсигенности или агар Мартена, нормальную сыворотку крови крупного рогатого скота (СКРС), стерильные полоски из фильтровальной бумаги размером 0,7 см 8,0 см, или бумажные диски диаметром 0,6 см, очищенный ферментолизом и специфической сорбцией дифтерийный антитоксин (в дальнейшем именуется антитоксин), при отсутствии которого в исключительных случаях можно использовать противодифтерийную антитоксическую сыворотку лошадиную, лечебную (в дальнейшем именуется антитоксическая сыворотка). Лучше использовать коммерческие или приготовленные в лаборатории бумажные диски, пропитанные антитоксином. Обязательным является использование контрольного токсигенного штамма коринебактерий дифтерии биовара gravis 24-48-часового роста.
7.1.1. Методика определения токсигенных свойств коринебактерий дифтерии с использованием бумажных дисков с антитоксином (по Фельдману с соавт.)
Приготовление чашек для постановки пробы на токсигенность
Питательный агар для определения токсигенности целесообразно разливать в пробирки по 10 мл (количество, необходимое для приготовления одной чашки). При большом объеме работы питательный агар разливают во флаконы по 70-80 мл (на 7-8 чашек пробы на токсигенность). Питательный агар следует расплавлять только 1 раз; многократное плавление ухудшает свойства среды. Питательный агар расплавляют в водяной бане при 90 °С, тотчас же вынимают из бани, охлаждают до 50 °С и добавляют 20% сыворотки крупного рогатого скота. Так, к 10 мл питательного агара добавляют 2 мл сыворотки крупного рогатого скота (СКРС), перемешивают и выливают, соблюдая правила асептики, в стерильную чашку Петри, распределяют среду по дну осторожным вращением чашки, не допуская «вспенивания» — появления неровностей на поверхности среды.
Чашку подсушивают в термостате при 37 °С в течение 15-20 мин, при открытой крышке, повернув ее вверх дном, до нанесения бумажных дисков с антитоксином на поверхность среды. Чашки с питательной средой недопустимо пересушивать.
В редких случаях, когда на чашках первичного посева вырастают единичные колонии (не более 8), токсигенные свойства которых надлежит изучить, возможно использование полистироловых чашек Петри диаметром 4,5 см. Количество питательного агара и СКРС уменьшается (3,2 мл питательного агара 1,8%+0,8 мл СКРС).
Чашки со средой для определения токсигенности хранить не рекомендуется.
Приготовление бумажных дисков с дифтерийным антитоксином
Диски из плотной фильтровальной бумаги нарезают диаметром 6 мм, стерилизуют автоклавированием при 2 атм. в течение 20-30 мин, высушивают и пропитывают антитоксином, разведенным в 1 мл дистиллированной воды (500 МЕ в 1 мл). Достаточно 1 мл антитоксина для приготовления 80-100 дисков, 1 диск содержит (5±1) МЕ дифтерийного антитоксина. Далее диски подсушивают в термостате (соблюдая асептические условия) в течение 18-24 ч. Готовые диски помещают в стерильный флакон иди пробирку с силикагелем или другим гигроскопическим веществом и сохраняют в холодильнике при 4-6 °С.
Постановка пробы на токсигенность
На поверхность чашки Петри со средой для определения токсигенности дифтерийных микробов помещают четыре бумажных диска с дифтерийным антитоксином. Вокруг каждого диска с антитоксином формируют 5 «бляшек»: две «бляшки» — контрольного штамма и три — испытуемые (из одного анализа с подозрительными колониями формируют минимум две «бляшки» из изолированных колоний и одну — из смеси 3-6 однотипных колоний; материалом из этого же анализа можно занять места вокруг других дисков с антитоксином). Все пять «бляшек» располагают симметрично вокруг диска на расстоянии 0,7 см от его края. Диаметр каждой «бляшки» 0,6-0,7 см. На одной чашке Петри можно разместить до четырех дисков с антитоксином и, соответственно, до 20 «бляшек» с культурами (8 «бляшек» контрольных и 12 «бляшек» испытуемых). Бумажные диски расставляют на поверхности сывороточно-агаровой среды на максимально удаленном расстоянии между дисками, чтобы не произошло перекрестных реакций (рис.3).
Чашки с посевами помещают в термостат при 37 °С.
Результат реакции учитывают через 18-24 часа, а также — через 48 ч. Наличие линий преципитации между диском с антитоксином и испытуемой культурой свидетельствует о ее токсигенности. Исследуемая культура считается токсигенной, если линия преципитации данной культуры сливается под углом с линией преципитации контрольного штамма. Отсутствие линий преципитации у испытуемых культур через 48 ч, при наличии их у контрольных штаммов, указывает на отсутствие токсигенности у изучаемых культур. Линии преципитации у контрольных штаммов должны появляться через 18-24 ч. Более позднее появление линий преципитации требует проверки качества питательной среды, проверки чистоты контрольного штамма, или улучшения его фенотипических свойств при выращивании на кровяном агаре, или замены контрольного штамма.
7.1.2. Методика определения токсигенных свойств коринебактерий дифтерии с использованием бумажных полосок (по модифицированному тесту Элека)
Чашки для постановки пробы на токсигенность этим методом готовят так же, как при работе с бумажными дисками (чашки диаметром 4,5 см не используют). В центр чашки на поверхность застывающего агара обожженным пинцетом помещают полоску фильтровальной бумаги, пропитанную антитоксином (или в редких случаях при отсутствии антитоксина используют антитоксическую лечебную лошадиную сыворотку). Чашку с бумажной полоской с антитоксином подсушивают в термостате при 37 °С в течение 15-20 мин при открытой крышке, повернув ее вверх дном. Приготовленные таким способом чашки не подлежат хранению.
Приготовление бумажных полосок с антитоксином
Полоски фильтровальной бумаги нарезают размером (0,7х8,0) см, заворачивают по 2-4 штуки в пакетик и стерилизуют в автоклаве при 0,5 атм. в течение 30 мин. Пакетики с бумажными полосками хранят в стерильной чашке Петри до 3 недель. Важным является сохранение ровных краев полоски и отсутствие грифельной черты при рисовании их на фильтровальной бумаге.
Перед постановкой пробы на токсигенность содержимое ампулы с антитоксином растворяют в 1 мл стерильного физиологического раствора, переносят в стерильную пробирку и указывают на ней данные этикетки (растворенный антитоксин хранят при температуре 4-6 °С не более 10 дней). Фильтровальные бумажки обожженным пинцетом помещают в стерильную чашку Петри, где на каждую полоску наносят 0,125 мл антитоксина, содержащего 500 МЕ в 1 мл.
Постановка пробы на токсигенность с бумажными полосками с антитоксином
Культуру засевают в виде «бляшек» диаметром 0,6-0,7 см на расстоянии 0,7-0,8 см друг от друга и 0,5 см от края полоски фильтровальной бумаги. На одну чашку следует засевать не более 10 «бляшек» (по 5 «бляшек» с каждой стороны полоски). Из них 6 «бляшек» испытуемой культуры, 4 — контрольного штамма. При небольшом количестве испытуемого материала засевают 6 контрольных «бляшек» и 4 — испытуемых. Материал от одного анализа засевают параллельными «бляшками» по обе стороны полоски с антитоксином (рис.4А).
Чашки с посевом помещают в термостат при 37 °С.
Учет результатов
Результат учитывают через 18-24 ч и 48 ч от начала постановки пробы на токсигенность. Критерием оценки специфичности преципитатов является слияние линий преципитации испытуемого штамма со специфическими линиями контрольного токсигенного штамма, чаще всего это может произойти через 48 ч, через 24 ч намечается только тенденция к слиянию. В тех случаях, когда у контрольного штамма формируется несколько линий преципитации (рис.4Б), что практически не наблюдается при использовании антитоксина, специфическими следует считать более четкие и рано появляющиеся преципитаты. Если через 18-24 ч от момента постановки пробы на токсигенность у контрольного штамма линии преципитации не обнаруживаются, это свидетельствует о нарушении условий постановки реакции. Необходимо проверить качество питательной среды или улучшить фенотипические свойства контрольного штамма, пассируя его на кровяной агаровой среде, или заменить контрольный штамм.
Оценка результатов реакции пробы на токсигенность при использовании бумажных дисков или полосок с антитоксином
Ознакомиться с документом вы можете, заказав бесплатную демонстрацию систем «Кодекс» и «Техэксперт».
источник