При изучении литературы, касающейся данной патологии, выявлены следующие факты: при сочетанном поражении больных туберкулезом и вирусными гепатитами (HBV, HCV) врачам фтизиаторам слишком часто приходится сталкиваться с разнообразными формами этого вирусного заболевания и слишком тяжелыми могут быть последствия данного сочетания. Также остаются малоизвестными данные о различном характере течения туберкулеза в зависимости от формы вирусного поражения, о соответствии различных сывороточных маркеров вируса этим формам.
Специфические маркеры гепатитов в сыворотке крови больных туберкулезом определяются в 10 — 25 раз чаще, чем у населения в целом. Отмечается повсеместный рост сочетанного течения туберкулезной и вирусной инфекции как в туберкулезных стационарах, так и вне их. Также сохраняется высокий риск заражения вирусными гепатитами медицинских работников, что подчеркивает их большую потенциальную роль в качестве источника инфекции. Длительный срок лечения больных туберкулезом в стационаре с множественными парентеральными вмешательствами, все более частая передача вирусных гепатитов при реализации естественных механизмов заражения (гемоперкутанные контакты) приводит к тому, что до 18% ранее не пораженных вирусом больных заражаются в лечебном стационаре. Это происходит, как правило, на 3 — 6 месяцах стационарного лечения без типичных клинических признаков заболевания гепатитом.
Общей особенностью противотуберкулезной терапии при данных заболеваниях являются в 4 раза более частое развитие и значительно более тяжелое течение медикаментозных гепато — токсических реакций с закономерно более существенным повреждением органов гепато — биллиарной системы, чем у неинфицированных вирусными гепатитами больных. Это обусловлено суммационным эффектом неблагоприятного влияния вирусной инфекции или постинфекции и противотуберкулезных препаратов. Кроме этого, для больных туберкулезом с признаками активной репликации вируса характерен более тяжелый специфический процесс (выраженный экссудативно — некротический характер воспаления) и замедленный регресс специфических изменений в легких, что определяет неблагоприятный прогноз и требует внесения существенных корректив в противотуберкулезную терапию.
Появилось предположение инициирующей роли вируса в возникновении и развитии туберкулезного процесса. Это, вероятно, обусловлено тем, что инфицирование вирусом оказывает выраженную иммуносупресию.
- Больные туберкулезом являются группой повышенного риска распространения вирусных гепатитов. Маркеры гепатитов у них определяются в 10 — 25 раз чаще, чем у взрослого здорового населения. Частота носительства и степень риска инфицирования вирусными гепатитами определяются продолжительностью лечения по поводу основного заболевания, характером терапии, клинической формой туберкулеза.
- Внутригоспитальное распространение вирусных гепатитов во фтизиатрических стационарах происходит интенсивно и преимущественно скрытно, затрудняя его профилактику и контроль.
- Необходимо проведение вакцинации против HBV больным туберкулезом, а также всем лицам медицинского и вспомогательного персонала туберкулезных стационаров неинфицированных вирусом.
- Своевременное проведение качественной гепатопротективной терапии больным с сочетанным поражением возбудителями туберкулеза и вирусных гепатитов.
- Не изучена проблема сочетанных инфекций туберкулеза и вирусных гепатитов в детских стационарах.
Работа представлена на IV научную конференцию с международным участием «Гомеостаз и эндоэкология», 21-28 февраля 2006г. Хургада (Египет). Поступила в редакцию 11.01.2006г.
источник
Опубликовано в журнале:
Большой Целевой Журнал о туберкулезе »» №4 1999 Nota Bene! Проф. Л.A. Галицкий, Б.В. Зарецкий, А.И. Лебединец Военно-медицинская академия, Санкт-Петербург
В настоящее время очень важно в полном объеме информировать врачей-фтизиатров о сочетанном поражении больных туберкулезом вирусным гепатитом В (ГВ). Слишком часто им приходится сталкиваться с разнообразными формами этого вирусного заболевания и слишком тяжелыми могут быть последствия данного сочетания. Следует подчеркнуть, что эти последствия имеют отношение не только к пациентам, но и к медицинским работникам. Малоизвестными остаются данные о различном характере течения туберкулеза в зависимости от формы вирусного поражения, о соответствии различных сывороточных маркеров вируса этим формам. Вследствие этого нет четкой клинико-эпидемиологической тактики фтизиатра при обнаружении у больных тех или иных маркеров вируса ГВ (HBV).
Актуальность проблемы в целом связана с неуклонным повышением во всем мире изолированной и сочетанной заболеваемости туберкулезом и вирусным ГВ. Эти инфекционные заболевания приобрели в последнее время всепланетарное значение. Еще в 1993 г., в связи с развивающейся пандемией туберкулеза, Всемирной Организацией Здравоохранения туберкулез объявлен проблемой «всемирной опасности». ГВ признан аналогом туберкулеза по глобальности распространения, а также обилию трудно решаемых проблем. По решению ВОЗ прошедший 1997 год был объявлен годом борьбы с инфекционными заболеваниями, среди которых особо выделялись туберкулез и ГВ.
Уникальной эпидемиологической особенностью ГВ является, с одной стороны, наличие разнообразных источников заражения, с другой — множественных естественных и искусственных путей передачи возбудителя, которые определяют распространенность вирусной инфекции. По мнению специалистов, наиболее частым вариантом заболевания является острая бессимптомная ГВ-инфекция, или «вирусоносительство». Число носителей вируса (поверхностного антигена HBV — HBsAg) в 100-200 раз превосходит число больных с диагностированной манифестной формой инфекции, а всего в мире насчитывается более 350 млн. носителей HBV. Термин «носители» в отношении HBV понимается весьма условно. Доказано, что носительство вируса ГВ есть в подавляющем большинстве случаев персистенция возбудителя, соответствующая бессимптомной или манифестной форме того или иного варианта хронического гепатита В (ХГВ).
Специфические маркеры HBV в сыворотке крови больных туберкулезом определяются в среднем в 10-25 раз чаще, чем у населения в целом. Отмечается повсеместный рост сочетанного течения туберкулезной и ГВ-инфекции как в туберкулезных стационарах, так и вне их. Не является секретом и то, что именно в стационарах существует наибольшая эффективность реализации множественных путей передачи вируса: парентерального (гемоконтактного) и контактно-бытового (гемоперкутанного) при наличии многочисленных источников инфекции (зараженные пациенты и медицинские работники).
Кстати, значительный уровень зараженности медицинских работников ГВ-инфекцией подтверждают, например, следующие данные. В Москве среди этой категории лиц маркеры HBV определяются методом иммуноферментного анализа (ИФА) в сыворотке крови у 62,7% обследованных. Распределяются они так: врачи — 63,0%, средний медицинский состав — 75%, младший медицинский состав — 32% и вспомогательный состав — 26%. Высокий риск заражения HBV медицинских работников подчеркивает их большую потенциальную роль в качестве источника инфекции.
Реализации путей передачи ГВ-инфекции в медицинских учреждениях способствуют продолжительная и интенсивная вирусемия у источников инфекции, чаще не имеющих внешних признаков заболевания, а также длительность нахождения больных в стационаре. С другой стороны, применение в стационарах лекарственных иммуносупрессоров может индуцировать латентный ГВ, а пациенты с иммунодефицитным состоянием склонны к длительному носительству HBV.
Сотрудниками кафедры фтизиатрии Военно-медицинской академии в течение нескольких лет проводятся исследования по проблемам сочетанного поражения туберкулезом и гепатитами с гемоконтактным механизмом передачи возбудителя. Исследования показали, что при первичной серодиагностике методом ИФА пораженность вирусами больных по всем маркерам с учетом микстовых случаев составляет: гепатит В — 49,7%, гепатит С — 7,4% и гепатит D — 1,3%. Маркеры только HBV определяются у 43,0% больных. При этом пораженность вирусом ГВ по изолированному определению HBsAg составляет 12,1%, что в 5,0-6,7 раза выше, чем среди населения в целом. Длительный срок лечения больных туберкулезом в стационаре с множественными парентеральными вмешательствами, все более частая передача HBV при реализации естественных механизмов заражения (гемоперкутанные контакты) приводит к тому, что до 18% ранее не пораженных вирусом больных заражаются в лечебном учреждении. Это происходит, как правило, на 3-6 месяцах стационарного лечения без типичных клинических признаков заболевания ГВ.
Среди больных туберкулезом с серологическими маркерами вирусов гемоконтактных гепатитов доминируют лица с признаками вируса ГВ (96,1 %). Среди этих больных состояние после перенесенного ГВ определяется в 82,8%, а текущая ГВ-инфекция — 17,2% случаев. Установлено, что в эпидемиологическом и клиническом плане важно выделение именно этих двух групп среди всех пораженных HBV. В первой группе выявляются только маркеры инфицирования вирусом (антитела к антигенам поверхностному — anti-HBs, пресердцевинному — anti-HBe и сердцевинному класса иммуноглобулинов G — anti-HBc-JgG), что свидетельствует о наличии HBV-постинфекции, то есть состояния после перенесенного ГВ. Эти лица не являются источниками ГВ-инфекции и не требуют специальной изоляции, а при сочетании туберкулеза с HBV-постинфекцией эффективность клинического излечения специфического заболевания не ухудшается. Во второй группе дополнительно определяются маркеры активной репликации вируса (антигены поверхностный — HBsAg, пресердцевинный — HBeAg и антитела к сердцевинному антигену класса иммуноглобулинов М — anti-HBc-JgM). Эти лица страдают острым ГВ (ОГВ) или ХГВ, то есть являются источниками ГВ-инфекции и нуждаются в срочной изоляции. Сочетание туберкулеза с любой формой текущей ГВ-инфекции ведет к ухудшению эффективности лечения больных туберкулезом.
Общей особенностью противотуберкулезной терапии лиц данных групп является в 4 раза более частое развитие и значительно более тяжелое течение медикаментозных гепатотоксических реакций (ГТР) с закономерно более существенным повреждением органов гепатобилиарной системы, чем у не инфицированных HBV. Это обусловлено суммационным эффектом неблагоприятного влияния ГВ-инфекции или HBV-постинфекции и противотуберкулезных препаратов. Кроме этого, для больных туберкулезом с признаками активной репликации вируса ГВ характерен более тяжелый специфический процесс (выраженный экссудативно-некротический характер воспаления) и замедленный регресс специфических изменений в легких, что определяет неблагоприятный прогноз и требует внесения существенных корректив в противотуберкулезную терапию.
Взаимное влияние туберкулеза и ГВ чрезвычайно разнообразно и, видимо, зависит от особенностей иммунного ответа, состояния неспецифической защиты при более или менее одновременном течении заболеваний в своих разнообразных формах и фазах. В определенной степени судить о форме (острой, хронической) и фазе вирусного процесса позволяет анализ различных сочетаний специфических маркеров HBV (табл.).
Таблица. Интерпретация клинических ситуаций при наличии в сыворотке крови специфических маркеров вируса ГВ
| Клинические формы, периоды инфекции | Серологические маркеры | |||||
| HBsAg | anti-HBs | anti-HBc-IgG | anti-HBc-IgM | HBeAg | anti-HBe | |
| ОГВ, ранняя фаза | + | — | — | + | + | — |
| ОГВ, поздняя фаза | +/- | -/+ | -/+ | + | — | + |
| ОГВ, реконвалесценция | — | + | + | +/- | — | + |
| ХПГ-В | +/- | -/+ | + | +/- | +/- | -/+ |
| ХАГ-В | +/- | — | + | + | + | — |
| HBV-постинфекция | — | + | + | — | — | +/- |
| «Здоровые носители» | +/- | -/+ | + | — | — | — |
ХПГ-В — хронический персистирующий ГВ
ХАГ-В — хронический активный ГВ
Однако перед фтизиатром в связи с проблемами ГВ при госпитализации больного в туберкулезный стационар первоначально стоит, прежде всего, только один, но очень важный вопрос: болен ли пациент ГВ — и тогда необходим его срочный перевод в отделение микст-инфекции — или текущей ГВ-инфекции нет, и он может находиться в обычной туберкулезной больнице?
Для решения этого и других вопросов предлагается следующая последовательность действий (алгоритм) фтизиатра. При госпитализации всех больных обязательно проведение серологической диагностики маркеров вируса ГВ методом ИФА в максимально возможном объеме. Минимальным объемом серодиагностики является поиск HBsAg (желательно с диагностикой anti-HBc-JgM) и anti-HBc-JgG.
По результатам определения маркеров HBV (см. табл.) обследованные разделяются на три группы:
1. С маркерами (одним или несколькими) активной репликации вируса (HBsAg, HBeAg, anti-HBc-JgM) — источники инфекции (ОГВ или ХГВ). Необходимо обследование инфекционистом, перевод в отделение микстинфекции инфекционного стационара, где должны решаться вопросы этиотропной терапии гепатита. До перевода — изоляция в палатах для больных с текущей ГВ-инфекцией.
2. С маркерами (одним или несколькими) инфицирования вирусом (anti-HBs, anti-HBc-JgG, anti-НВе) — перенесшие ГВ (HBV-постинфекция). Госпитализация возможна в палаты для больных без текущей ГВ-инфекции, допускается совместное размещение с вакцинированными против ГВ. Эту категорию лиц в первую очередь следует считать группой повышенного риска возникновения и тяжелого течения медикаментозных ГТР. Показано проведение превентивной гепатопротективной терапии (в том числе — фитотерапии по оригинальной методике кафедры фтизиатрии Военно-медицинской академии и группы фитотерапии Института мозга человека РАН) в течение всего курса стационарного лечения, а также усиленного антиоксидантного лечения. При планировании этиотропной терапии следует, по возможности, воздерживаться от применения наиболее гепатотоксичных препаратов и их комбинаций.
3. Отсутствие маркеров — не инфицированные вирусом. Госпитализация в палаты для больных туберкулезом без текущей ГВ-инфекции. Показана немедленная вакцинопрофилактика гепатита по оригинальной методике кафедры фтизиатрии Военно-медицинской академии для предупреждения внутрибольничного заражения вирусом гепатита В. Терапия туберкулеза по обычным схемам. При развитии медикаментозных ГТР через 3-6 месяцев после госпитализации необходима повторная серодиагностика ГВ для исключения внутрибольничного заражения вирусом.
Отдельно следует подчеркнуть назревшую необходимость и возможность проведения вакцинации против ГВ больным туберкулезом, а также всем лицам медицинского и вспомогательного персонала туберкулезных стационаров неинфицированным вирусом. Вакцинацию целесообразно проводить современными рекомбинантными дрожжевыми вакцинами. Однако современное состояние этой проблемы, а также вопросы гепатопротективной терапии (фитотерапии) больных с сочетанным поражением возбудителями туберкулеза и ГВ требуют специального освещения.
источник
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Нарушения функции и структуры печени у больных туберкулёзом могут быть следствием влияния туберкулёзной интоксикации, гипоксемии, приёма противотуберкулёзных препаратов, сопутствующих заболеваний, туберкулёзного поражения гепатобилиарной системы.
Влияние туберкулёзной интоксикации сказывается на ферментативной, белок-синтетической, коагуляционной, выделительной функциях печени, вызывает снижение объёмного кровотока в органе и замедление скорости элиминации лекарственных веществ. Распространённые формы туберкулёза могут сопровождаться гепато- и спленомегалией. При общем амилоидозе, развивающемся на фоне туберкулёза, поражение печени отмечают в 70-85% случаев.
На клеточном уровне гипоксия ведёт к переключению работы дыхательной цепи на более короткий и энергетически выгодный путь окисления янтарной кислоты, ингибирования монооксидазной системы, что приводит к повреждению структуры эндоплазматического ретикулума и нарушению клеточного транспорта.
Установлена последовательность выпадения функций печени при гипоксии: синтез белков; образование пигментов; образование протромбина; синтез углеводов; экскреция; образование мочевины; образование фибриногена; эстерификация холестерина; ферментативная функция. В первую очередь страдает экскреторная функция; поглотительная нарушается лишь при дыхательной недостаточности III степени. Имеется и обратная зависимость: присоединение патологии печени к лёгочному заболеванию усугубляет нарушение вентиляции и газообмена, что обусловлено повреждением клеток ретикуло-эндотелиальной, сердечно-сосудистой систем, нарушением функции гепатоцитов.
Поражение печени — одна из основных причин развития лекарственной непереносимости при туберкулёзе из-за ведущей роли этого органа в системе детоксикации. Частота токсических лекарственных гепатитов составляет 4-16% осложнений медикаментозной терапии, она увеличивается с длительностью приёма препаратов. Лекарственный гепатит характеризуется диспептическим, болевым абдоминальным синдромом, гепатомегалией, иногда появляются иктеричность слизистых оболочек и склер, кожный зуд; продрома нехарактерна. Преобладают воспалительный и цитолитический синдромы при умеренно выраженном холестатическом. Лабораторно выявляют повышение уровня трансаминаз, щелочной фосфатазы, холинэстераз, реже — билирубина. При применении противотуберкулёзных средств возможно развитие молниеносного гепатита, механизм развития — иммуноаллергический и токсический. Развившиеся нарушения функции печени сохраняются в течение 2-4 мес после исчезновения клинических проявлений. Отмечена связь переносимости лечения с возрастом пациента. У пожилых больных необходимо изменение режима лечения в связи с побочными явлениями, а в старческом возрасте — снижение доз препаратов. Данные о гепатотоксичности противотуберкулёзных препаратов достаточно противоречивы, поскольку это свойство связано не только с химическим строением препарата, но и с особенностями метаболических возможностей печени каждого больного, величиной печёночного кровотока, уровнем развития портокавальных анастомозов, степенью связывания препаратов белками плазмы и др.
Учащение случаев сочетанной патологии (туберкулёза и хронических неспецифических заболеваний лёгких, заболеваний ЖКТ, гепатобилиарной системы, сахарного диабета) приводит к учащению поражения печени. За последние десятилетия число случаев сочетания туберкулёза лёгких и заболеваний печени увеличилось в 23 раза и среди впервые выявленных больных туберкулёзом составило 16-22%, среда хроников — 38-42%. У фтизиопульмонологических пациентов самостоятельные заболевания печени диагностируют в 1% случаев, вторичные гепатиты составляют 10-15% всех осложнений медикаментозной терапии. Структура вторичных гепатитов: 36-54% — неспецифический реактивный гепатит. 16-28% — лекарственный. 3-8% — специфический туберкулёзный. 2% — алкогольный. Сочетание туберкулёза лёгких с заболеванием печени невирусной этиологии протекает неблагоприятно, с тенденцией к прогрессированию.
При сочетании вирусного гепатита В и туберкулёза тяжелее протекает желтушный период, чаще отмечают увеличение размеров печени и отклонения биохимических показателей, гемограммы, происходит замедление обезвреживания и инактивации гидразида изоникотиновой кислоты (ГИНК), учащается гепатотоксичность рифампицина и пиразинамида, в 3 раза чаще развивается затяжное течение гепатита. Среди больных туберкулёзом лёгких — носителей маркёров гепатита В в 85% случаев отпечены гепатотоксические реакции на туберкулостатики, заболевание характеризуется более острым началом, выраженной клинической картиной и низкой эффективностью лечения. Экскреторная функция печени у таких больных нарушена ещё до начала лечения и не нормализуется в процессе противотуберкулёзной терапии. Поражение гепатитом С наиболее характерно для больных хроническим лёгочным туберкулёзом. Положительную реакцию на антитела к гепатиту С относят к факторам риска развития гепатотоксических реакций при назначении противотуберкулёзных препаратов.
Среди лиц с циррозом печени повышен риск заболевания туберкулёзом, а больные острым туберкулёзом с циррозом печени имеют плохой прогноз.
При сочетании туберкулёза лёгких и алкоголизма вероятны плохая переносимость противотуберкулёзных препаратов (до 60%) и поражение печени (до 80%). Алкоголь нарушает липидный обмен, вызывая жировую инфильтрацию печени, снижает интенсивность метаболизма биологически активных веществ, угнетает белковый синтез в гепатоцитах и их способность к регенерации. Возможно прямое некробиотическое действие этанола на печень. Для таких больных характерны токсические, токсикоаллергические и не характерны аллергические реакции. При высоком распространении токсикомании и наркомании можно прогнозировать нарастание проблемы гепатотоксических реакций.
Заболеваемость туберкулёзом больных сахарным диабетом в 5 раз превышает заболеваемость населения. У больных с гипергликемией, гиперлипидемией и кето-ацидозом в сочетании с туберкулёзной интоксикацией в 100% случаев при пункционной биопсии обнаруживают патологию в виде белковой и жировой дистрофии, воспалительных и цирротических изменений. Это препятствует эффективной химиотерапии туберкулёза лёгких, являясь одной из причин частой непереносимости лечения. Сочетание туберкулёза лёгких и сахарного диабета диагностируют в 3 раза чаше у больных с распространёнными деструктивными изменениями в лёгких, чем при локальных формах туберкулёза без явлений диссеминации и деструкции.
Туберкулёз печени может быть единственным проявлением болезни или частью диссеминированного процесса. Морфологически выделяют три основные формы поражения печени: милиарный диссеминированный, крупноузелковый и опухолевидный туберкулёз печени. Основным путём поражения печени является гематогенный. При милиарном туберкулёзе печень почти всегда вовлекается в острое гранулёматозное воспаление, туберкулёз печени требует стандартной системной противотуберкулезной терапии.

источник
Туберкулез и гепатиты, как вирусные, так и токсические, сочетаются довольно часто. Второй тип патологии часто развивается на фоне тубинфекции, так как бактерии в процессе своей жизнедеятельности выделяют продукты распада и провоцируют сильную интоксикацию печени. Негативно влияют на орган также сильнодействующие противотуберкулезные средства.
Учитывая эти негативные воздействия на печень, а также общую ослабленность организма, иммунитет не в состоянии бороться с инфекциями. В результате чего организм становится более восприимчив к любого рода патогенам, в том числе и гепатитам В, С и D.
Гепатиты В, С, Д имеют вирусную природу, поэтому туберкулез не может спровоцировать ни один из них. Если говорить о гепатитах, спровоцированных туберкулезом, то это может быть или токсический, или лекарственный гепатит. В условиях стационара заболеть вирусом гепатита больной может в результате сильнейшей интоксикации при лечении заболевания. Тяжелые медикаменты, которые используются в лечении, поражают клетки печени и могут спровоцировать развитие гепатита.
Но это не значит, что вирусные заболевание печени при туберкулезе невозможны, наоборот, такая ситуация встречается довольно часто.
Вирусы В, С и D возникают вследствие заражения ослабленного больного. Причинами могут быть:
- переливание крови;
- неоднократное использование шприцов;
- половые контакты с инфицированным;
- использование средств гигиены больного (бритвы, зубные щетки);
- косметические и медицинские манипуляции.
Применение противотуберкулезной химиотерапии может спровоцировать развитие молниеносного гепатита, который является иммуноаллергической реакцией организма на препараты.
Вирусным гепатитам присущи свои особенности в зависимости от типа:
- При гепатите С снижается липидный обмен и метаболизм. Его еще называют «ласковым убийцей», так как заболевание у туберкулезников протекает бессимптомно и выявляется только методом диагностирования. За несколько лет гепатит С способен полностью разрушить печень.
У больных с гепатитами туберкулез протекает особенно остро. Патология поддается лечению очень тяжело. Причиной является поражение печени и развитие ее дисфункции. Врачи стараются уменьшать дозы препаратов, чтобы печень могла справляться с интоксикацией, и тем самым удлиняется период выздоровления.
Если гепатит прогрессирует в стадию цирроза печени, шансы излечиться от двух заболеваний значительно уменьшаются. Повышается риск летального исхода.
Вирусы В, С и D относят к гемоконтактным формам. Гепатиты и туберкулез чаще всего выявляются среди представителей социально уязвимых слоев населения. В группу риска входят:
- больные, требующие переливания крови;
- пациенты после гемодиализа;
- пациенты, нуждающиеся в пересадке органов;
- наркоманы;
- заключенные в тюрьмах;
- люди, любящие татуировки;
- гомосексуалисты.
Также факторами риска являются:
- некачественная дезинфекция медицинских инструментов;
- игнорирование мер безопасности: работа в медучреждениях без перчаток, халатов, масок;
- люди, которые ухаживают за больными с сочетанной инфекцией. В ходе исследований в мокроте пациентов был обнаружен вирус гепатита С.
Симптоматика коинфекции имеет свою специфику – возникают одновременно проявления обеих патологий, что существенно осложняет диагностику. У больного возникают такие симптомы, характерные для вирусной инфекции:
- тошнота и рвота;
- потеря аппетита;
- привкус горечи во рту;
- желтуха.
Одновременно проявляются симптомы, характерные для туберкулеза:
- боли в грудной клетке;
- нарушение дыхания;
- повышение температуры.
Общие симптомы для обоих заболеваний следующие:
- слабость;
- повышенная утомляемость;
- сильные головные боли;
- сонливость;
- дрожание рук и ног.
В основном у больных туберкулезом патологии печени выявляют при обследовании биохимическими тестами (показатели билирубина, активность АСТ/АЛТ, ЩФ и ГТП). Также, чтобы выявить вирусное заболевание, необходимо провести такие исследования:
- УЗИ печени, которое позволяет выявить пораженные участки;
- ультразвуковое обследование других органов, которое позволяет оценить общее состояние организма пациента.
Для выявления туберкулеза следует провести следующие исследования:
- рентген легких – позволяет определить очаги поражения и состояние легких;
- пробу Манту – введение минимальной дозы туберкулина (вещество, которое состоит из фрагментов микобактерий) подкожно для определения наличия палочки Коха в организме;
- Диаскинтест – самый современный, быстрый и надежный способ. Подкожно вводят «белки», схожие на туберкулин, но отличительной особенностью от пробы Манту является то, что эти «белки» не реагируют на ранее проведенную вакцину БЦЖ и не дают ложноположительный результат;
- бактериологический анализ мокроты – при проведении анализа можно выделить палочки Коха, что 100% гарантирует наличие инфекции в организме.
Лечение туберкулеза при гепатите требует особенного внимания. Следует лечить одновременно оба заболевания. При этом необходимо учитывать наличие других патологий, которые имеются у пациента.
При вирусе В у больных долгое время держится желтуха. Опасность заболевания – быстрый его переход в хроническую форму, а также вирус устойчив к низким температурам и дезинфицирующим средствам. Вирусы тормозят выздоровление от туберкулеза. Поэтому особенность терапии заключается в том, чтобы разгрузить печень и уменьшить ее интоксикацию.
Обычно специалисты применяют следующие препараты:
- введение внутривенно солевых растворов и глюкозы;
- капельницы с физраствором;
- введение внутримышечно витаминов В1, В6;
- прием комбинированных препаратов (Фосфонциале, Гепатрин, Сирепар);
- ПТП – Этамбутол, Пиразинамид, Стрептомицин и др.
После перенесенного заболевания у пациентов вырабатывается стойкий иммунитет.
При сочетании данного вируса и туберкулеза в начале лечения все силы направлены на подавление вирусной инфекции. Гепатит С тяжело поддается лечению, велика опасность перехода заболевания в хроническую стадию.
- Для снижения интоксикации печени и восстановления гепатоцитов применяют гепатопротекторы (Гепатосан, Эссенциале Форте).
- Для подавления вирусной активности назначают комбинацию Софосбувира+Даклатасвира. Препараты достаточно эффективны, позволяют излечиться в течение 6-12 месяцев. Однако следует отметить, что они имеют высокую стоимость и существуют сложности по приобретению (покупают препараты под заказ в интернете или лично при поездке за границу).
Обязательным моментом в терапии является диета, которая помогает разгрузить печень:
- Запрещена жирная пища. Следует употреблять в пищу постные продукты (рекомендовано для обоих заболеваний).
- При туберкулезе необходимо повышенное употребление белковых продуктов. При гепатите его потребление должно быть ограниченным. Поэтому налегать необходимо на рыбные блюда и молочные продукты.
- Питание должно быть дробным, небольшими порциями. Интервал между приемами пищи должен составлять не менее четырех часов.
- Жареное также запрещено. Разрешено употреблять вареные, тушеные, запеченные и приготовленные на пару продукты питания.
- Курение и алкогольные напитки исключаются.
Данный тип считается одним из самых тяжелых. Инфекция – быстропрогрессирующая, нередко приводящая к смерти пациента. Сама по себе вирусная инфекция не встречается, она возникает только на фоне гепатита В. Лечение туберкулеза в данном случае схоже с терапией вируса В.
Но кроме этого, пациентам вводят противовирусные препараты – раньше назначались препараты, содержащие пегилированные интерфероны (Пегасис, Альгерон), на протяжении полугода для подавления вируса, сейчас они заменяются менее агрессивными препаратами прямого действия: Софосбувиром, Даклатасвиром и их дженериками. В некоторых тяжелых случаях к данным препаратам добавляют еще Рибавирин.
Особенностью является то, что лечение вирусной инфекции затягивается из-за токсического влияния на печень противотуберкулезных препаратов (Изониазида, Рифампицина и др.).
Поскольку при данном заболевании поражаются желчные протоки, в дополнение к другим методам терапии назначаются желчегонные и фосфолипидные препараты. Залогом излечения от туберкулеза является правильная диета, содержащая необходимое количество белка.
Нередко фтизиатры при составлении схемы лечения туберкулезным больным с вирусными гепатитами не проводят сразуполноценную терапию, предпочитая лечить патологии по очереди. Из-за высокой токсичности ПТП повышается риск развития серьезных осложнений. Происходит транзиторное повышение трансаминаз в печени. Это вызывает еще большую ее интоксикацию. Поэтому предпочтительно осуществлять противотуберкулезную терапию, как описано выше.
Дать положительный прогноз при коинфекции не сможет ни один специалист. Все зависит от ряда внешних и внутренних факторов. Препараты при туберкулезной терапии полностью не будут метаболизироваться больной печенью. При развитии лекарственного гепатита излечение маловероятно. Вирус В несложно выявить, благодаря продолжительному желтушному периоду, но вылечить его сложно, так как заболевание быстро приобретает хроническую форму.
Вирус D латентен, он поражает желчные протоки и незаметно прогрессирует. Выздоровление зависит от стадии заболевания, терапии и общего состояния больного.
Вирус С победить возможно, однако лечение не всем доступно из-за высокой стоимости препаратов.
Так как зачастую гепатиты обнаруживаются не своевременно, то возможен риск развития цирроза печени при туберкулезе. Прогноз при таком сочетании крайне неблагоприятен, в большинстве случаев наступает летальный исход.
Для предупреждения вирусных гепатитов и туберкулеза разработаны вакцины. Первые прививки делают новорожденным детям в течение 48 часов после рождения. Своевременная вакцинация защищает организм человека и уменьшает риск заражения. Вирусная инфекция и палочки Коха отличаются особой стойкостью, поэтому необходимо придерживаться строгих профилактических мер:
- Вирусы передаются не только через кровь, но и через биологические жидкости. Поэтому при сексуальных контактах с новым партнером необходимо использовать надежные барьерные методы контрацепции.
- Туберкулез передается воздушно-капельным путем. Попадая в ослабленный организм, микобактерии провоцируют развитие патологии. Поэтому, необходимо укреплять организм и повышать защитные силы.
- Использование личных предметов гигиены.
- Ведение здорового образа жизни, отказ от вредных привычек.
Группу риска составляют медработники тубдиспансерных учреждений. Поэтому необходимо обращаться с кровью больных пациентов, согласно установленным инструкциям по безопасности. Следует пользоваться элементарными методами защиты – надевать перчатки, маски, халаты.
Нельзя использовать нестерилизованные медицинские инструменты дважды. В обязательном порядке нужно пользоваться одноразовыми шприцами и инструментами. А при их отсутствии – кипятить инструменты многоразового использования их в автоклаве.
Сочетание туберкулеза и вирусных гепатитов – сложная комбинация для лечения. Поскольку прогноз обычно негативный, следует больше времени уделять методам защиты от таких серьезных заболеваний.
источник
Среди имеющихся на сегодняшний день заболеваний есть такие, которые представляют большую опасность для здоровья человека. Даже после излечения остается высокий риск рецидива или накладывается отпечаток на работу всего организма. Если две таких патологии развиваются одновременно, то нагрузка и вред увеличиваются вдвое. Опасно сочетание туберкулез и гепатит. Довольно часто эти два заболевания развиваются друг за другом, что осложняет терапию, усиливает выраженность симптоматики.
Пациенты с туберкулезом довольно часто обращаются к врачу по поводу появившихся новых симптомов, сигнализирующих о наличии проблем в работе печени. Туберкулезная интоксикация, продолжающаяся длительное время угнетает работу печени. К тому же сложная терапия не может пройти бесследно для этого органа, который несет на себе детоксикационную функцию.
Чаще всего у больных туберкулезом диагностируются гепатиты B, D, и C. Во времена использования не одноразовых шприцов в медицине в туберкулезных диспансерах часто наблюдались вспышки гепатитов, что сразу заносит туберкулезных больных в группу риска.
Среди причин развития туберкулеза при гепатитах можно назвать следующие:
- Многие пациенты являются носителями вирусов гепатита, но при этом не имеют симптомов заболевания.
- Продолжительная терапия в стационарах.
- Подавление иммунной системы на фоне самой патологии и сложного лечения.
Развитие вирусного гепатита существенно снижает успешность противотуберкулезной терапии, так как печень не в состоянии выполнять свои функции.
Печень в организме человека выполняет главную роль по очищению крови от токсических веществ. При развитии гепатита орган просто не в состоянии справиться со своей задачей. Поступающие отравляющие вещества, токсины и возбудители заболеваний могут свободно наносить вред организму.
К тому же происходит ослабление иммунной системы, что и позволяет микобактериям, возбудителям туберкулеза, прекрасно процветать в организме.
Гепатиты B, C и D – это гемоконтактные формы, которые чаще всего и встречаются среди больных туберкулезом. К группе риска можно отнести следующие категории населения:
- Пациенты, которым требуется переливание крови.
- Больные после гемодиализа или нуждающиеся в пересадке органов.
- Медицинские работники, контактирующие с больными пациентами.
- Наркоманы.
- Лица, находящиеся в местах лишения свободы.
- Любители разукрасить свое тело татуировками.
- Лица нетрадиционной сексуальной ориентации.
Гепатиты и туберкулез чаще всего диагностируются среди социально незащищенных слоев населения, не соблюдающих гигиенические нормы.
К факторам риска можно отнести:
- Использование в медицинских учреждениях не одноразовых инструментов.
- Пренебрежение мерами безопасности: работа с пациентами без халатов, медицинских перчаток, защитных очков во время операций.
- Несвоевременная утилизация окровавленных салфеток, ветоши в процедурных и операционных.
Надо учитывать, что, если гепатит передается через кровь, то палочка Коха может перемещаться и воздушно-капельным путем.
Туберкулез и гепатит C или любой другой – это всегда тесная взаимосвязь терапии одной патологии и второй, которые накладывают отпечаток друг на друга. При одновременном развитии данных заболеваний симптоматика усиливается. У пациентов могут наблюдаться следующие проявления:
- Тошнота и рвота.
- Потеря аппетита.
- Привкус горечи в ротовой полости.
- Кожные покровы приобретают желтоватый оттенок.
- Туберкулез сильнее проявляет свои симптомы:
- Поднимается температура тела.
- Наблюдаются нарушения в дыхании.
- Появляются боли в грудной клетке.
На фоне развития двух патологий наблюдается общая интоксикация организма:
- Сильные головные боли.
- Общая слабость.
- Повышенная утомляемость.
- Сонливость.
- Дрожание конечностей.
Особенности каждого заболевания необходимо учитывать при назначении соответствующей терапии.
Без правильно поставленного диагноза невозможно подобрать эффективное лечение. Для подтверждения гепатита необходимо:
- Сделать УЗИ печени, которое позволит обнаружить в органе опухоли, травмированные участки и абсцессы.
- С помощью ультразвукового обследования оценить состояние желчного пузыря и других внутренних органов.
Выявить туберкулез можно при помощи рентгенографии легких. Также может использоваться проба Манту или Диаскинтест, которая позволяет распознать палочку Коха в организме практически сразу после ее проникновения.
Для подтверждения диагноза проводится бактериологический анализ мокроты, выделяющийся у пациента при кашле.
При выявлении патологии в зависимости от разновидности гепатита подбирается соответствующая терапия. Врач обязательно должен также учитывать наличие у больного сопутствующих заболеваний в других системах органов.
Еще не до конца изучено сочетание терапии гепатита C и туберкулеза. По многочисленным данным исследований многих врачей можно отметить, что чаще всего практикуется такая схема терапии:
- Терапия проводится с назначением следующих препаратов: «Изониазид», «Рифампин», «Этамбутол». Для снижения токсичности препаратов рекомендуемая дозировка вводится один раз в сутки.
- Периодически проводятся функциональные тесты для диагностики работы печени.
- Для подавления вирусной активности может быть назначен «Интерферон» в течение полугода в дозировке 3000000 МЕ три раза в неделю.
Было отмечено, если терапия туберкулеза при гепатите C обычными препаратами проводится краткосрочными режимами, то можно существенно снизить токсическое воздействие на печень.
Обязательно пациенту рекомендуется соблюдать диету.
При развитии гепатита B у пациентов, как правило, увеличивается продолжительность желтушного периода, а также повышается риск перехода патологии в хроническую форму.
Подмечено, что гепатит вирусной природы не влияет на эффективность лечения туберкулеза, но препараты для терапии оказывают токсическое воздействие на печень, чтобы это предотвратить назначают:
- Внутривенное введение «Глюкозы».
- Солевые растворы также вводят внутривенно.
- Капельница с «Физраствором».
- В виде инъекций витамины B1, B6, особенно, если проводится химиотерапия.
- Препараты с большим количеством витамина С.
Чтобы снизить токсическое влияние препаратов от туберкулеза на печень обязательно прописывают детоксикационную терапию, для этого используют «Атоксил», «Альбумин».
Иммунная система пациента сильно ослаблена, как во время гепатита, так и при туберкулезе. Для повышения эффективности лечения назначают иммуностимуляторы: «Вилозен», «Тималин».
Во время лечения питание должно быть основано на употреблении блюд на пару, каш, супов и большого количества жидкости.
Врач напомнит пациенту, что категорически запрещено употребление алкоголя и придется исключить острые, копченые, жареные блюда, пищу быстрого приготовления.
Терапия туберкулеза при данной форме гепатита практически не отличается от предыдущих. Можно только отметить, что полностью избавиться от гепатита во время противотуберкулезной терапии практически невозможно, учитывая токсическое влияние лекарственных средств на печень.
Так как затрагиваются при гепатите D и желчные протоки, то пациентам назначают препараты для выведения желчи. Важная составляющая лечения – правильное питание. Во время туберкулезной терапии организм теряет большое количество белка, а при гепатите его потребление должно быть ограничено, поэтому восполнение рекомендуется через молочные продукты, рыбу.
При сочетании этих двух патологий довольно сложно прогнозировать исход терапии. Препараты для излечения туберкулеза не будут подвергаться метаболизму из-за нарушений в функционировании печени.
Если сочетается туберкулез с невирусными заболеваниями печени, то велика тенденция к прогрессированию. При диагностике гепатита B осложняется желтушный период, который при других формах практически отсутствует. Клиническая картина ярко выражена, а эффективность терапии довольно низкая.
При развитии цирроза печени на фоне туберкулеза прогноз для пациента неблагоприятный.
Каждая из патологий представляет серьезную опасность для организма. Гепатит приводит к поражению важного органа, а туберкулез нарушает работу всех внутренних систем. Гарантировать успешность терапии при сочетании патологий не может ни один врач. Все зависит от многих внешних и внутренних факторов.
источник
Среди пациентов с туберкулезом регистрируется повышенная заболеваемость вирусными гепатитами по отношению к остальному населению. Заболевания могут возникать в любой последовательности друг относительно друга – понижение иммунитета отмечается и при гепатитах, и при туберкулезе, что при неблагоприятном стечении обстоятельств может вести к присоединению другого инфекционного заболевания.
Не редкость, к сожалению, и заражение гепатитом в туберкулезных диспансерах. Сейчас это может произойти только при вопиющей халатности медперсонала, но ранее, до массового распространения одноразовых медицинских шприцов, заражения в тубдиспансерах происходили из-за многократного использования игл или же обратного заброса при инъекциях.
Чаще всего у больных туберкулезом регистрируется инфицирование гепатитом C. При сочетании этих болезней повышается риск возникновения гепатотоксических реакций – т.е. побочных эффектов от препаратов туберкулеза, связанных с поражением печени.
Кроме этого, отмечается заболевание гепатитом B. При этом заболевании печени туберкулез провоцирует тяжелое затяжное развитие желтушного периода, препараты против туберкулеза в несколько раз чаще начинают давать гепатотоксичную реакцию, что, в конце концов, заканчивается циррозом и затяжным течением гепатита.
Цирроз печени, развившийся в результате вирусного гепатита (или по иным причинам) уменьшает шансы пациента с туберкулезом на успешное излечение.
К сожалению, это сочетание встречается довольно часто из-за социальной природы обеих болезней – их жертвами нередко становятся заключенные, бездомные, маргиналы. К сожалению, для успешного излечения сочетания этих двух болезней прогноз крайне неутешительный – противотуберкулезные лекарства просто не будут метаболизироваться в печени из-за того, что та не выполняет своих функций.
При сочетании вирусного гепатита с туберкулезом взаимно усиливаются симптомы обоих заболеваний, при этом к ним могут присоединяться и побочные эффекты лекарственных средств, риск которых возрастает многократно в связи с нарушенной функцией печени. Прежде всего, больной сильно теряет в весе. У него отсутствует аппетит, нередко он испытывает тошноту или же рвоту. Отмечается:
- боль в правом боку;
- горький привкус во рту;
- пожелтение лица, белков глаз.
Усиление симптомов туберкулеза может проявляться в виде:
- повышения температуры;
-
нарушения дыхания;
- болей в грудной клетке.
Возможны общие симптомы интоксикации:
- головная боль;
- слабость;
- утомляемость;
- рвота;
- сонливость;
- тремор конечностей.
К особенностям лечения туберкулеза при вирусных гепатитах относят поддерживающие меры для работы печени. Для того, чтобы снять симптомы интоксикации и снизить побочные эффекты, пациенту в вену вводят растворы:
Возможно назначение капельницы с физраствором. Для профилактики развития гепатита вследствие химиотерапии больному делают инъекции B1, B6, назначают препараты с высоким содержанием витамина C.
Полноценное лечение гепатита невозможно одновременно с противотуберкулезной терапией, т.к. включает в себя мощные противовирусные препараты, действие которых может плохо сказаться на ослабленном пациенте. Также больному показаны препараты для выведения желчи.
Важной мерой является соблюдение диеты на время лечения и в качестве меры профилактики. При гепатите из рациона пациента должны быть исключены жирные, жареные продукты, острые, соленые, копченые блюда, десерты в больших количествах.
Следует иметь в виду, что алкоголь не должен присутствовать ни в каких количествах на протяжении всей жизни после постановки диагноза гепатита, даже после перехода болезни в хроническую стадию.
И гепатит, и туберкулез часто возникают среди социально незащищенных слоев населения. Как правило, в жизни людей из группы риска присутствует алкоголь и употребление наркотиков. Внутривенное введение наркотических средств является главным путем передачи гепатита В и С. Кроме того, из-за несоблюдения гигиены растет риск распространения туберкулезных микобактерий.
Во время манипуляций с кровью и полостных операций на медицинском работнике должна быть маска, халат, перчатки, шапочка и очки для защиты слизистой. Окровавленную одежду и ветошь должны чистить и утилизировать в соответствии с инструкцией.
Для защиты от туберкулеза необходимо регулярно проводить гигиену помещений (в особенности это касается казенных помещений и мест проживания больных туберкулезом).
Для уменьшения рисков пациент должен:
- регулярно проходить флюорографию;
- своевременно лечить все заболевания верхних дыхательных путей;
- избегать переохлаждения и работы в сырых холодных помещениях.
Медицинские работники в тюрьмах и тубдиспансерах должны также соблюдать все меры гигиены и предосторожности, т.к. туберкулез передается не только воздушно-капельным путем, но и через кровь, а также долгое время остается в помещениях и почве.

Лечащий врач, наблюдающий пациента с сочетанием туберкулеза и вирусного гепатита, должен предпринять все меры для снижения токсичного воздействия антибиотиков на печень. При этом важно индивидуально рассчитывать дозировку, предпринимать дезинтокационные меры, регулярно делать УЗИ печени, брать пробы и вводить пациенту витамины.
Немаловажно помнить о вакцинации против этих заболеваний. Вакцинация снижает риск заражения при попадании инфекции в организм в несколько раз, и даже при развитии заболевания риск осложнений намного ниже, чем у пациентов без вакцинации.
источник
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 |
ТУБЕРКУЛЁЗ ЛЁГКИХ В СОЧЕТАНИИ С
ХРОНИЧЕСКИМИ ВИРУСНЫМИ ГЕПАТИТАМИ:
ДИАГНОСТИКА, ЛЕЧЕНИЕ, ПРОГНОЗ
14.00.10 – инфекционные болезни
диссертации на соискание ученой степени
Работа выполнена в Новосибирском научно-исследовательском институте туберкулёза Федерального агентства по здравоохранению и социальному развитию
доктор медицинских наук, профессор
доктор медицинских наук, профессор
доктор медицинских наук, профессор
доктор медицинских наук, профессор
доктор медицинских наук, профессор
Ведущая организация: Санкт-Петербургский научно-исследовательский институт фтизиопульмонологии Федерального агентства по здравоохранению и социальному развитию
Защита состоится «___»______2008 года в ___часов на заседании Диссертационного совета Д 208.062.01 при Новосибирском государственном медицинском университете Федерального агентства по здравоохранению и социальному развитию г. Новосибирск, Красный проспект, 52.
С диссертацией можно ознакомиться в библиотеке Новосибирского государственного медицинского университета
Автореферат разослан «___»__________2008 года
Ученый секретарь Диссертационного совета,
кандидат медицинских наук, доцент
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Туберкулёз лёгких (ТЛ) – одна из важнейших современных медико-социальных проблем вследствие широкой распространенности, сохраняющейся тенденции роста числа больных, их высокой инвалидизации и смертности, ограниченных возможностей и токсичности противотуберкулёзной терапии ( и соавт., 2003; , 2003; , 2005; , 2007). В последние годы регистрируют возрастание заболеваемости сочетанными инфекциями с участием различных вирусов. Развитие инфекционного заболевания определяется многообразием факторов: воздействие ксенобиотиков при несостоятельности механизмов детоксикации, нарушение внутренней среды организма и системы иммунитета, истощения резервов компенсации у лиц с сочетанной патологией ( и соавт., 2007). Изменения гомеостаза, характера метаболических и иммунных реакций в условиях персистирующих вирусных инфекций обуславливают новые качественные характеристики туберкулёза.
В наступившем столетии туберкулёз, вирусные гепатиты В и С признаны ведущей патологией (ВОЗ, 2002). Вопрос о взаимном влиянии двух инфекций – ТЛ и хронического вирусного гепатита (ХГ) представляет большой интерес из-за высокой частоты их сочетания ( и соавт., 2005) и в связи с ведущей ролью печени в иммунном ответе, в детоксикации и метаболизме противотуберкулёзных препаратов (, 2007).
Угнетение монооксигеназной системы печени (МОС) приводит к увеличению частоты токсических реакций на лекарственные препараты, инактивация которых осуществляется печенью (, , 1997; , , 2004). Один из наиболее информативных показателей активности МОС – антипириновый тест, который рассматривают как отражающий «окислительный метаболизм лекарств печени» (Gurley B. J. et al., 1997), и как «общую метаболическую пробу» (Matzke G. R. et al., 2000). Несмотря на значительное число работ, посвящённых метаболизму антипирина при различных заболеваниях, лишь в единичных оценивается активность МОС у больных ТЛ (Hamide A. et al., 1990), не определена зависимость состояния МОС от способов и кратности приема противотуберкулёзных препаратов.
Традиционная многомесячная ежедневная бактериостатическая терапия туберкулеза часто вызывает у больных побочные (особенно гепатотоксические) реакции, лекарственную болезнь, и может явиться причиной смерти пациента (, 2002; Decocq G. et al., 1996; Ungo J. R. et al., 1998). В связи с ростом лекарственно-устойчивых форм ТЛ эксперты ВОЗ рекомендуют назначать 6–8 противотуберкулёзных препаратов (ПТП) ежедневно без учета сопутствующей патологии и активности МОС. Такое лечение вызывает появление побочных реакций на основные ПТП в 17 % случаев ( и соавт., 2003), а на препараты 2-го ряда – в 73 % ( и соавт., 2004). Развитие побочных реакций ограничивает возможности химиотерапии и снижает эффективность лечения больных ТЛ по таким критериям, как сроки прекращения бактериовыделения и закрытия каверн (, 2007).
В Новосибирском НИИ туберкулеза с 70-х годов разрабатывается и внедряется в практику бактерицидная внутривенная химиотерапия больных ТЛ в интермиттирующем режиме с первых дней лечения ( и соавт., 1979). В эксперименте показано, что внутривенное лечение 2 и 3 раза в неделю по сравнению с ежедневным пероральным или внутривенным введением ПТП существенно уменьшает выраженность структурных и обменных нарушений в печени ( и соавт., 1982). В условиях клиники режим внутривенного лечения 2 или 3 раза в неделю высокоэффективен, значительно сокращает количество побочных реакций (, 1983, , 1998). Однако внедрение данной методики химиотерапии в широкую практику противотуберкулёзных учреждений затруднено в связи с приказом № 000 Министерства Здравоохранения РФ от 01.01.2001, регламентирующим назначение 4-х и более ПТП внутрь ежедневно в течение 2-х и более месяцев. Обоснованием служит общепринятое мнение о том, что прерывистость противотуберкулёзной терапии приводит к развитию вторичной лекарственной устойчивости (ВЛУ) возбудителя. Но это не было доказано в случае назначения ПТП внутривенно 2 или 3 раза в неделю, когда концентрации лекарственных веществ в крови в несколько раз выше их минимальной ингибирующей концентрации, а лечение является контролируемым.
Одна только этиотропная химиотерапия, без воздействия на механизмы патологического процесса, часто не позволяет достичь хороших результатов лечения. Накоплены убедительные факты, свидетельствующие об угнетении иммунитета у больных с деструктивными формами ТЛ (, 2004), хроническими гепатитами В и С (, 2002). Негативные изменения иммунитета и при туберкулёзе, и при гепатите проявляются в снижении количества Т-клеток, изменении их субпопуляционной структуры, в пролиферативном характере ответа Т-лимфоцитов на митогены, в нарушении функциональной активности моноцитов, дисбалансом в цитокиновой системе (Ройт А. и соавт., 2000; и соавт., 2007; Lai C. K. et al., 1997). Наличие иммунодепрессии и сопряженность степени её выраженности с тяжестью сочетанной инфекционной патологии (туберкулёза легких и вирусного гепатита) диктует необходимость поиска эффективных средств иммунокоррекции как важного компонента терапии. В настоящее время одним из перспективных направлений биологической терапии в клинической медицине является применение цитокинов, таких как интерферон-a. Действие его, как инициатора сбалансированной продукции провоспалительных и противовоспалительных цитокинов, показано ранее при различных видах инфекционной патологии ( и соавт., 1998; , 1999; и соавт., 2003; Zein N. N., 1998). Требуется разработка универсальной терапии, направленной на саморегуляцию организма, имеющую сигнальный характер, что достигается выбором доз препаратов, по возможности максимально сниженных, и способов введения (, 2001; и соавт., 2007). Указанные аргументы послужили планированию цели и задач настоящего исследования, посвященного важным вопросам диагностики, лечения и прогноза при сочетанной инфекционной патологии.
Цель работы. На основании изучения особенностей диагностики, закономерностей течения, сравнения режимов противотуберкулёзного лечения и определения факторов, влияющих на прогноз, разработать терапевтическую тактику ведения пациентов с сочетанной инфекционной патологией – туберкулёзом лёгких и хроническим гепатитом В и/или С.
1. Определить частоту выявления и спектр диагностических маркеров HBV — и HCV-инфекции у пациентов противотуберкулезных стационаров с разными сроками течения туберкулёза лёгких.
2. Выявить медико-социальные факторы, ассоциированные с неблагоприятным течением туберкулеза легких (у пациентов с хроническими вирусными гепатитами в сравнении с больными без гепатитов).
3. Определить связь морфологической активности патологических процессов в печени с иммунологическими характеристиками и ответом на противотуберкулёзную терапию у пациентов с сочетанной инфекционной патологией.
4. Дать оценку состояния монооксигеназной системы печени больных с впервые выявленным туберкулёзом лёгких в процессе внутривенной интермиттирующей в сравнении с ежедневной традиционной противотуберкулёзной терапией.
5. Изучить частоту, сроки развития и спектр вторичной лекарственной устойчивости микобактерий туберкулёза у впервые выявленных больных туберкулёзом лёгких, получавших внутривенную интермиттирующую химиотерапию.
6. Проанализировать результаты лечения туберкулёза лёгких у больных моно — и микст-инфекцией с учетом разных режимов терапии (внутривенной интермиттирующей и ежедневной традиционной).
7. Разработать эффективную терапевтическую тактику стационарного ведения больных туберкулёзом лёгких в сочетании с хроническими вирусными гепатитами с включением реаферона в противотуберкулёзную терапию.
8. Оценить влияние интерферонотерапии на особенности тканевых реакций у больных туберкулезом легких с сопутствующими хроническими гепатитами В и С.
Научная новизна. Впервые были исследованы закономерности ответа пациента на одновременное поражение нескольких систем макроорганизма различными инфекционными агентами, изучено влияние патологических процессов разной этиологии друг на друга и на успешность лечения каждого из них.
Впервые определен маркерный профиль хронических гемоконтактных гепатитов у пациентов туберкулёзных стационаров с разными сроками течения ТЛ. Показано, что впервые выявленный туберкулёз лёгких ассоциирован с повышенным относительным риском HBV-инфицирования, а длительно текущий, в том числе хронический ТЛ – HCV — и HCV + HBV-инфицирования.
Установлены факторы, ассоциированные с выявлением хронического вирусного гепатита у больных ТЛ. Выявлены клинические особенности течения микст-инфекции, а также иммунологические, морфологические, биохимические параметры, неблагоприятно влияющие на прогноз туберкулёза лёгких. Показано, что наличие сочетанной инфекционной патологии негативно сказывается на результатах лечения пациентов с впервые выявленным туберкулёзом лёгких.
Установлено, что для прогнозирования и мониторинга токсических осложнений химиотерапии, для определения скорости метаболических процессов в печени больного туберкулёзом лёгких оптимальным методом исследования является легкая в интерпретации, простая в исполнении, атравматичная для пациента антипириновая проба (Патент на изобретение «Способ определения антипирина в слюне» № /15 от 01.01.2001).
Впервые показано, что активность монооксигеназной системы печени у пациентов с туберкулёзом легких на протяжении ежедневного лечения противотуберкулёзными препаратами снижается в сравнении с больными, получавшими внутривенную интермиттирующую химиотерапию, что свидетельствует о более агрессивном характере ежедневной химиотерапии ТЛ в отношении метаболической функции печени.
Установлено, что для пациентов туберкулёзом лёгких с сопутствующими хроническими гепатитами В и С предпочтителен высокоэффективный метод лечения, предупреждающий возникновение токсических реакций, — внутривенная интермиттирующая химиотерапия 2 раза в неделю.
Впервые была изучена частота возникновения вторичной лекарственной устойчивости у пациентов, получавших внутривенную интермиттирующую химиотерапию, в сравнении с группой ежедневного перорального лечения. Выявлено, что частота развития вторичной ЛУ в группах больных была одинакова, а множественная ЛУ при интермиттирующем лечении развивалась реже. В процессе внутривенной интермиттирующей химиотерапии вторичная ЛУ появлялась медленнее, чем при ежедневном приеме химиопрепаратов, в среднем через 3 месяца от начала химиотерапии.
Разработан и применен показатель «плотности доз» противотуберкулезных препаратов с целью объективного разделения пациентов на группы ежедневного и интермиттирующего лечения и беспристрастной оценки результатов лечения ТЛ у них. Этот показатель позволил выявить промежуточную группу «проблемных» больных, регулярность режима приема препаратов у которых по различным причинам нарушена, и проанализировать у них неблагоприятные прогностические факторы течения туберкулёза лёгких.
Впервые для лечения больных туберкулезом легких с сопутствующими хроническими гепатитами В и С применен реаферон (интерферон-a), назначаемый в дозе 3 млн. МЕ ректально капельно в дни проведения внутривенной интермиттирующей противотуберкулёзной терапии (Патент на изобретение № /14 от 01.01.2001). Показано, что в группе пациентов, получавших реаферон, было больше больных, достигших прекращения бактериовыделения и закрытия полости(тей) распада на терапевтическом этапе, причем в более ранние сроки, чем в группе сравнения. Установлено, что комбинированное лечение реафероном в сочетании с внутривенной интермиттирующей химиотерапией 2 раза в неделю приводило к уменьшению сроков восстановления показателей гемограммы, к увеличению количества лимфоцитов крови и их субклассов, к снижению проявлений цитолиза и холестаза.
Впервые получены морфологические признаки противовоспалительного действия реаферона (при включении его в терапию больных с ТЛ) как непосредственно в зоне специфического воспаления, так и в окружающих тканях легкого.
Теоретическая и практическая значимость. Результаты исследования позволяют расширить существующие представления о взаимодействии микст-инфекции (ТЛ + ХГ) в организме больного, о влиянии гепатотропных вирусов на течение, лечение и прогноз туберкулёза лёгких.
Разработана система обследования больных туберкулёзом лёгких, позволяющая выявлять у них хронические вирусные гепатиты в зависимости от их этиологии, биохимической и морфологической активности, и, с учетом этого, планировать лечебные мероприятия.
Выявленные особенности клинического течения сочетанной инфекции, характеризующиеся слабой выраженностью симптомов каждого из заболеваний в отдельности, свидетельствующие о недостаточной активности метаболических и иммунных реакций макроорганизма, определяют поиск дополнительных диагностических и лечебных мероприятий, направленных на полное клиническое излечение пациента от туберкулёза лёгких в условиях персистенции вирусов.
Для прогнозирования течения и исходов туберкулёза лёгких и хронических гепатитов В и С, а также побочных реакций у больных ТЛ предложен весьма простой, неинвазивный, легкий для интерпретации антипириновый тест, проводимый в динамике на протяжении противотуберкулёзной терапии.
С целью объективного разделения пациентов на группы по режиму лечения и оценки эффективности химиотерапии предложен показатель «плотности доз» противотуберкулезных препаратов.
Применение антипиринового теста и показателя «плотности доз» наряду с традиционными клинико-лабораторными методами исследования позволило продемонстрировать, что внутривенная интермиттирующая химиотерапия предпочтительна у пациентов ТЛ с сопутствующими ХГ, как эффективный и предотвращающий токсические реакции способ лечения в условиях скомпрометированной вирусом печени.
Полученные клинико-биохимические, иммунологические и морфологические данные свидетельствуют о высокой терапевтической эффективности реаферона у больных ТЛ с сопутствующими ХГ и позволяют рекомендовать его к практическому применению.
Разработанная тактика ведения больных микст-инфекцией позволяет улучшить верификацию диагноза хронического вирусного гепатита во фтизиатрической практике на 89 %, повысить эффективность лечения туберкулёза лёгких: уменьшить сроки прекращения бактериовыделения на 1,8 месяца, закрытия каверн – на 1,4 месяца.
Положения, выносимые на защиту:
1. Комплексное иммуно-биохимическое обследование пациентов фтизиатрических стационаров Новосибирска позволяет выявлять диагностические маркеры HBV — и HCV-инфекции в 32 – 48 % случаев. У пациентов с длительно протекающим туберкулёзом легких повышены относительные риски HCV — и HCV + HBV-инфицирования, а с впервые выявленным туберкулёзом – HBV-инфицирования.
2. У социально дезадаптированных пациентов туберкулёзом лёгких повышен относительный риск выявления хронических вирусных гепатитов. Сочетание туберкулёза легких и хронических гепатитов В и С характеризуется: преимущественно слабовыраженными симптомами туберкулёзной интоксикации с отсутствием температурной реакции; малосимптомным течением гепатитов с повышенными уровнями АЛТ, АСТ и ГГТП; снижением вероятности раннего (до 3-х месяцев) прекращения бактериовыделения в 2 раза с относительным риском развития лекарственной устойчивости к этамбутолу и канамицину; снижением в 2,3 раза вероятности благоприятной рентгенологической картины при выписке из стационара. В условиях отсутствия явных клинических признаков сочетанной патологии (ТЛ + ХГ) возрастает роль дополнительных методов обследования (лабораторных, морфологических), которые важно учитывать в совокупности для разработки оптимальных подходов к лечению и прогнозу.
3. Факторами неблагоприятного течения туберкулёза лёгких у пациентов с сочетанной патологией являются: а) наличие ХГС или ХГВС в сравнении с ХГВ; б) слабовыраженный фиброз печени в сравнении с умеренным или выраженным; в) низкая степень морфологической активности гепатита в сравнении с умеренной или высокой; г) нормальные уровни АЛТ и АСТ в сравнении с повышенными; д) выраженный нейтрофилез в синусоидах и липофусциноз гепатоцитов в сравнении с отсутствием или слабой выраженностью этих параметров; е) уровень всех лимфоцитов менее 1000 в мкл и уровень CD4+ менее 400 клеток в мкл в сравнении с бóльшим их уровнем.
4. Внутривенная интермиттирующая химиотерапия имеет ряд преимуществ перед ежедневной: а) более частое закрытие полостей распада, б) отсутствие подавления монооксигеназной системы печени и редкое развитие токсических осложнений, в) отсутствие нарастания частоты вторичной ЛУ, а в случаях её появления – развитие в более поздние сроки.
5. Результатами иммуномодулирующего действия реаферона в комплексе с внутривенной интермиттирующей (2 раза в неделю) химиотерапией у больных туберкулезом с сопутствующими хроническими вирусными гепатитами являются: а) укорочение сроков прекращения бактериовыделения и закрытия полостей распада, б) снижение признаков цитолиза и холестаза, в) уменьшение морфологических проявлений специфического и неспецифического воспаления в лёгочной ткани.
Апробация работы. Материалы диссертации доложены и обсуждены на: 7 Российском съезде фтизиатров «Туберкулёз сегодня» (Москва, 2003), на международном конгрессе Европейского Респираторного Общества (Глазго, 2004), на международной конференции «Развитие международного сотрудничества в области изучения инфекционных заболеваний» (Новосибирск, 2004), на внутренней научно-практической конференции ННИИТ (Новосибирск, 2005), на заседании Ученого Совета ННИИТ (24 июня 2005), на международном конгрессе Европейского Респираторного Общества (Копенгаген, 2005), на областном обществе фтизиатров (г. Новосибирск, 31 мая 2006 г.), на международном конгрессе Европейского Респираторного Общества (Мюнхен, 2006), на II Российско-Германской конференции «Туберкулёз, СПИД, вирусные гепатиты» (Томск, 2007), на юбилейной межрегиональной научно-практической конференции «Современное здравоохранение: проблемы и перспективы» (Новосибирск, 2007).
Внедрение результатов исследования. Материалы диссертации, её выводы и рекомендации используются в учебном процессе кафедры туберкулёза факультета повышения квалификации и кафедры патологической анатомии Новосибирского государственного медицинского университета. Разработанная тактика ведения больных микст-инфекцией внедрена в клиническую практику работы клиник Новосибирского НИИ туберкулёза, Санкт-Петербургского НИИ фтизиопульмонологии, Екатеринбургского НИИ фтизиопульмонологии, специализированой туберкулезной больницы № 3 (г. Новосибирск).
Публикации. По теме диссертации опубликовано 45 печатных работ, в том числе 1 монография, 3 патента на изобретение, 11 статей в ведущих рецензируемых журналах.
Объем и структура диссертации. Работа состоит из введения, 4-х глав, включающих аналитический обзор литературы, описание методов исследования и характеристику больных, результаты собственных исследований и обсуждение полученных результатов, выводов, практических рекомендаций. Диссертация изложена на 232 страницах машинописного текста, включает в себя 58 таблиц и 32 рисунка. Указатель использованной литературы содержит 120 отечественных и 157 иностранных источников.
Личное участие автора. Работа выполнена на базе клиники Новосибирского НИИ туберкулёза (директор – профессор ), на кафедре патологической анатомии НГМУ (зав. кафедрой — акад. РАМН, профессор ), в Институте клинической иммунологии СО РАМН (директор – акад. РАМН, профессор ), ДИКБ № 3 г. Новосибирска (гл. врач – к. м.н. ), туберкулёзной больнице № 3 г. Новосибирска (гл. врач – ).
Автор самостоятельно собрал, статистически обработал и проанализировал все полученные данные. Проведенное клиническое исследование одобрено локальным этическим комитетом Новосибирского научно-исследовательского института туберкулёза Росмедтехнологий.
Автор выражает искреннюю благодарность коллегам по совместным исследованиям: доценту кафедры патологической анатомии НГМУ, д. м.н. , зав. лабораторией клинической иммунологии ИКИ СО РАМН, д. м.н., проф. , научному сотруднику лаборатории иммунологии ННИИТ, к. м.н. , врачам клинико-биохимической лаборатории ННИИТ, к. м.н. и , зав. отд. ДИКБ № 3 к. м.н. , сотрудникам ННИИТ и туберкулёзной больницы № 3 г. Новосибирска. Особую благодарность автор выражает своим учителям – проф. , проф. и научным консультантам – д. м.н., проф. , д. м.н., профессору .
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Характеристика пациентов, включенных в исследование, понятие показателя «плотности доз». Всего обследовано 566 больных, находившихся с различными формами туберкулёза лёгких в клинике ННИИТ и в туберкулёзной больнице № 3 г. Новосибирска в 2000 – 2007 гг.
На рисунке 1 схематично представлены этапы исследования.

Структура исследования. На 1-м этапе исследования – решение проблемы коинфекции, вызванной возбудителями туберкулёза и вирусного гепатитаВ и/или С. Определяли частоту выявления и спектр диагностических маркеров HBV- и HCV-инфекции у 188-ми пациентов, последовательно поступавших в ННИИТ в 2002 – 2003 гг. и у 154-х больных, госпитализированных в туберкулёзную больницу № 3 г. Новосибирска в 2003 – 2004 гг. с разными сроками течения туберкулёза легких. К длительно болеющим ТЛ относили пациентов, срок диспансерного наблюдения которых во фтизиатрической службе составлял от 1 года и более.
Изучали медико-социальные факторы, обуславливающие неблагоприятное течение туберкулёза лёгких (у пациентов с хроническими вирусными гепатитами в сравнении с больными без гепатитов). Обследовали и проспективно наблюдали в клинике ННИИТ 224 больных, из них у 95-ти пациентов гепатитов не было (группа 1), у 129-ти выявлены хронические гепатиты В и С (группа 2): В (ХГВ) – у 58-ми больных, С (ХГС) – у 29-ти, В + С (ХГВС) – у 42-х. Больные с ХГВ были старше (36,3 ± 12,2 лет), чем с ХГС (26,6 ± 5,6 лет, р = 0,0003) и ХГВС (29,7 ± 8,7 лет, р = 0,005). Средний возраст пациентов, не имевших гепатита, составил 30,9 ± 11,2 лет. Пациентов в 1 группу отбирали методом случайных чисел. Критерии исключения: очаговый и фиброзно-кавернозный туберкулёз, казеозная пневмония, первичные формы туберкулёза, генерализованный туберкулёз, возраст пациентов менее 17 и более 70 лет.
На 2-м этапе исследования – оценка у больных с сочетанной инфекционной патологией связи морфологической активности патологических процессов в печени с иммунологическими характеристиками и ответом на противотуберкулёзную терапию. В течение первых 2-х недель нахождения в стационаре 84-м пациентам туберкулёзом легких с сопутствующими хроническими гепатитами В и С была выполнена пункционная биопсия печени. У этих пациентов определяли связи между клинико-биохимическими, морфологическими и иммунологическими показателями. Кроме того, сравнили результаты иммунологического обследования и стационарного лечения этих пациентов и 49-ти больных ТЛ, не имевших гепатитов. Группы не различались по полу, возрасту, формам туберкулёзного процесса.
На 3-м этапе исследования – изучение реакции макро — и микроорганизма на различные режимы противотуберкулёзной терапии. Проводили оценку состояния монооксигеназной системы печени больных с впервые выявленным ТЛ в процессе внутривенной интермиттирующей терапии в сравнении с ежедневным традиционным приемом противотуберкулёзных препаратов. Исследовали антипириновый тест в течение первых 2-х недель пребывания в клинике НИИ туберкулёза и спустя 6 месяцев у 47-ми пациентов группы интермиттирующего лечения (на фоне внутривенной терапии 2 раза в неделю) и у 52-х впервые выявленных больных группы ежедневного лечения.
Определяли частоту и сроки развития, спектр вторичной лекарственной устойчивости (ВЛУ) микобактерий туберкулёза (МБТ) у впервые выявленных больных ТЛ (в том числе с сопутствующими ХГ), получающих внутривенную интермиттирующую химиотерапию. Проанализировали данные теста лекарственной чувствительности микобактерий у 76-ти пациентов – бактериовыделителей с впервые выявленным ТЛ, поступавших на лечение в клинику Новосибирского НИИ туберкулёза в 2004 – 2005 гг. Противотуберкулёзную терапию до поступления в стационар все эти больные не получали. Отбор больных в группы ежедневного и интермиттирующего лечения проводили рандомизированно. Сроки наблюдения больных составили 5–14 месяцев. Внутривенную интермиттирующую химиотерапию с первых дней лечения назначали 38-ми пациентам (основная группа); ежедневный прием ПТП – 38-ми больным, которые составили группу сравнения. Больных с сопутствующими туберкулёзу ХГВ и/или ХГС в основной группе было 11, в группе сравнения – 8. ВЛУ микобактерий туберкулёза определяли исходно и через каждые 2 месяца от начала лечения. Сроки наблюдения больных составили от 5 до 14 месяцев (в течение всего времени пребывания в стационаре).
На 4-м этапе исследования – анализ результатов лечения туберкулёза лёгких у больных моно — и микст-инфекцией с учетом разных режимов химиотерапии (внутривенной интермиттирующей и ежедневной традиционной) и разработка оптимальной терапевтической тактики. Сведения о клиническом, биохимическом, рентгенологическом, бактериологическом, серологическом, биохимическом, иммунологическом, морфологическом динамическом обследовании 224-х пациентов в динамике на протяжении курса стационарного лечения заносили в статистическую таблицу SPSS. При последующем анализе применённых схем лечения оказалось, что не всем пациентам удалось закончить режим противотуберкулёзной терапии в том виде, в котором он был назначен. Так, у некоторых пациентов наблюдали развитие необратимых или тяжелых побочных реакций на лечение, заставлявших на какое-то время отменять ПТП с последующим постепенным подбором лекарств и доз. У ряда других больных в процессе лечения была выявлена лекарственная устойчивость МБТ, сопровождавшаяся клинико-рентгенологическими признаками прогрессирования болезни, заставлявшая пересматривать схемы и режимы лечения. Мы разделили количество дней лечения ПТП (количество доз) каждого пациента на количество койко-дней, проведенных им в клинике, и получили показатель, который назвали «плотность доз». Это позволило выделить из 224-х пациентов группу больных (Х), которых нельзя отнести ни к группе интермиттирующего (2 раза в неделю), ни к группе ежедневного лечения.
Пациенты с «плотностью доз» от 0,22 до 0,3 были отнесены к группе А: 128 человек (за весь период нахождения в стационаре они соблюдали схему лечения 2 раза в неделю); менее 0,22 и от 0,31 до 0,6 – к группе Х: 45 больных (схему лечения изменяли по причинам, перечисленным выше); от 0,61 и более – к группе Б: 51 пациент (прием препаратов 5 – 7 раз в неделю). Пациенты, не закончившие курс стационарного лечения (выписанные досрочно за нарушение режима; их койко-день был от 8 дней до 3 месяцев), исключены из анализа результатов противотуберкулёзной терапии.
Для разработки эффективной терапевтической тактики стационарного ведения больных туберкулёзом лёгких с сопутствующими хроническими гепатитами В и С оценили результаты лечения реафероном-ЕС в составе комплексной внутривенной интермиттирующей химиотерапии у 134-х больных ТЛ, у 92-х (68,7 %) из них – в сочетании с ХГ В и/или С. Отбор больных в группы сравнения проводили согласно критериям проспективного когортного исследования: 67 человек получали реаферон и составили I группу, а 67 пациентов II группы реаферон не получали. Курс лечения реафероном был 6 месяцев и более.
Для выявления признаков влияния интерферонотерапии на особенности тканевых реакций при туберкулезе легких были отобраны 34 пациента с инфильтративным ТЛ в фазе распада, у которых ранее был проведен предварительный 5–6-месячный курс терапии ПТП в сочетании с реафероном, после чего выполнено хирургическое резекционное лечение. На момент проведения операции у 25-ти пациентов данной группы легочный процесс был представлен туберкуломами, у 9-ти – фиброзно-кавернозным туберкулезом. Группу сравнения составили 35 прооперированных пациентов с подобными изменениями в лёгких (туберкуломы – у 25-ти человек, фиброзные каверны – у 10-ти человек), которые лечились в тех же условиях, но без реаферона. При подборе пациентов в группу сравнения стремились к соответствию всех параметров: пола, возраста, характера туберкулёзного процесса на момент оперативного вмешательства, этиологии хронического вирусного гепатита.
Объектом исследования служил операционный материал легких. Микроскопическому исследованию подвергали кусочки ткани из стенок каверн, капсул очагов и туберкулом, макроскопически неизмененных участков, исследовали бронх у места его пересечения по краю резекции. Использовали окраску гематоксилином и эозином, пикрофуксином по ван Гизону в комбинации с фукселином, окраску по Цилю–Нельсену на МБТ.
Для объективизации морфологической характеристики легочной ткани у пациентов сравниваемых групп гистологические препараты изучали, не имея на этот момент никакой информации о пациенте. Основные структурные компартменты легких оценивали с помощью разработанной нами совместно с д. м.н. схемы полуколичественной морфометрии:
1. Инкапсулированные зоны казеозного некроза (очаги и туберкуломы)
a. Зрелость капсулы: зрелая – 0 (преобладают фиброциты, плотное расположение пучков коллагена без лимфоцитарной инфильтрации, лимфоциты только вокруг капсулы в виде редких небольших скоплений), незрелая – 1 (преобладают фибробласты, пучки коллагена рыхлые, отечные, капсула диффузно инфильтрирована мононуклеарами)
b. Признаки специфического поражения капсулы: нет – 0, есть – 1 (участки казеоза структур капсулы)
c. Воспалительная инфильтрация ткани вокруг капсулы: минимальная продуктивная – 0, выраженная продуктивная – 1, экссудативная – 2
2. Ткань легкого на отдалении от очагов специфического воспаления
a. Признаки хронического бронхита: нет – 0, ремиссия – 1 (очаговая мононуклеарная инфильтрация перибронхиальной ткани без признаков эпителиотропизма), обострение – 2 (диффузный, часто муфтообразный характер перибронхиальной инфильтрации, значительная примесь плазмоцитов и нейтрофильных гранулоцитов среди клеток инфильтрата, признаки повреждения бронхиального эпителия, отек стромы)
b. Обструктивный характер бронхита: нет – 0, есть – 1 (наличие в просвете бронхов слизистого и/или гнойного экссудата, десквамированных эпителиоцитов)
c. Очаговая пневмония: нет – 0, есть – 1 (безвоздушные участки, экссудат в просвете альвеол, нейтрофильная инфильтрация межальвеолярных перегородок)
d. Интерстициально-десквамативная пневмония (очаговое или диффузное утолщение межальвеолярных перегородок за счет инфильтрации мононуклеарами, гиперплазия и десквамация в просвет альвеол альвеолярных макрофагов и альвеолоцитов 2 типа): нет – 0, минимальная – 1, умеренная/выраженная – 2
3. Туберкулез бронха: нет – 0, есть – 1 (любые признаки казеификации стенки бронха с повреждением его эпителия)
4. Пневмофиброз (избыточное отложение масс коллагена, пролиферация фибробластов разной степени зрелости)
a. Периваскулярный и перибронхиальный: нет или минимальный – 0, умеренный – 1, выраженный – 2
b. Интерстициальный (вне видимой связи с сосудами и бронхами): нет – 0, минимальный – 1, умеренный/выраженный – 2.
Объем обследования больных туберкулёзом лёгких. Сведения о всех пациентах, включенных в исследование, заносили в специальную таблицу. Они охватывали паспортные данные, анамнез, жалобы и объективные признаки заболевания, сопутствующие болезни, осложнения туберкулёзного процесса, результаты лабораторного и других методов исследования, характер лечения и его результаты. Динамику клинических симптомов болезни оценивали на основании данных анамнеза и результатов ежедневных клинических осмотров обследуемых пациентов.
Рентгенологическое исследование включало обзорную рентгенографию органов грудной клетки в двух проекциях, прицельную томографию зоны воспалительной реакции лёгочной ткани, по показаниям выполняли цифровую томографию и компьютерную томографию органов грудной клетки. Рентгенологический контроль динамики туберкулёзного процесса осуществляли ежемесячно. «Распространённым» считали туберкулёзный процесс, охватывающий 3 и более сегментов лёгких.
Бактериологическое исследование включало посевы мокроты на МБТ и люминесцентную микроскопию, которые выполняли трёхкратно при поступлении и двукратно ежемесячно в процессе проведения противотуберкулёзной терапии. Пациентам с бактериовыделением определяли тест лекарственной чувствительности МБТ ко всем противотуберкулёзным препаратам (1-го и 2-го ряда) и это исследование повторяли каждые 2 месяца в случае сохранения бактериовыделения на фоне проводимой химиотерапии.
Такой тщательный контроль позволил выявить первичную лекарственную устойчивость и констатировать появление вторичной лекарственной устойчивости МБТ, установить момент прекращения бактериовыделения, стойкость негативации мокроты, судить о времени закрытия полостей распада и рентгенологической динамике в сравниваемых группах.
Объем обследования для диагностики вирусного гепатита. Гепатиты у больных выявляли в процессе специального обследования, включавшего анамнез, жалобы, объективный осмотр, исследование биохимического анализа крови, ультразвуковое исследование органов брюшной полости, метод иммуноферментного анализа, позволявший выявлять маркёры гепатита В (HBsAg, aHBs, aHBcIgG, aHBcIgM, HBeAg, aHBeIgG), гепатита С (aHCV сумм., aHCVIgM, aHCVcoreIgG, aHCVNS3IgG, aHCVNS4, aHCVNS5), гепатита D (aHDV сумм), полимеразную цепную реакцию крови и ткани печени, забираемой при пункционной биопсии, морфологическое исследование биоптатов печени.
источник
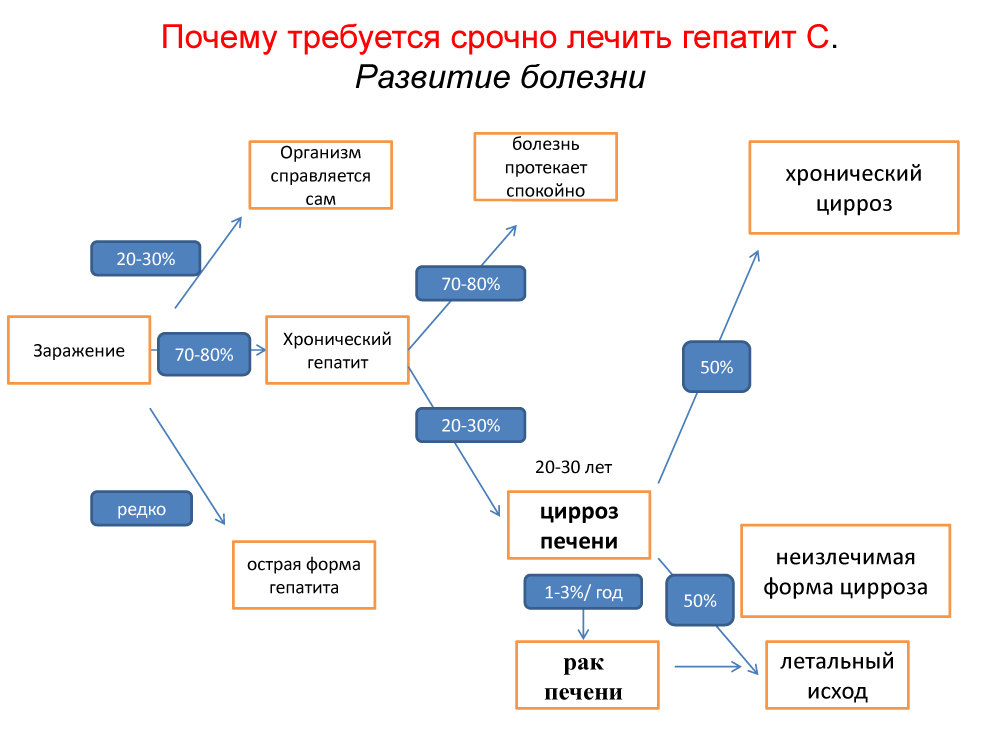

 нарушения дыхания;
нарушения дыхания;