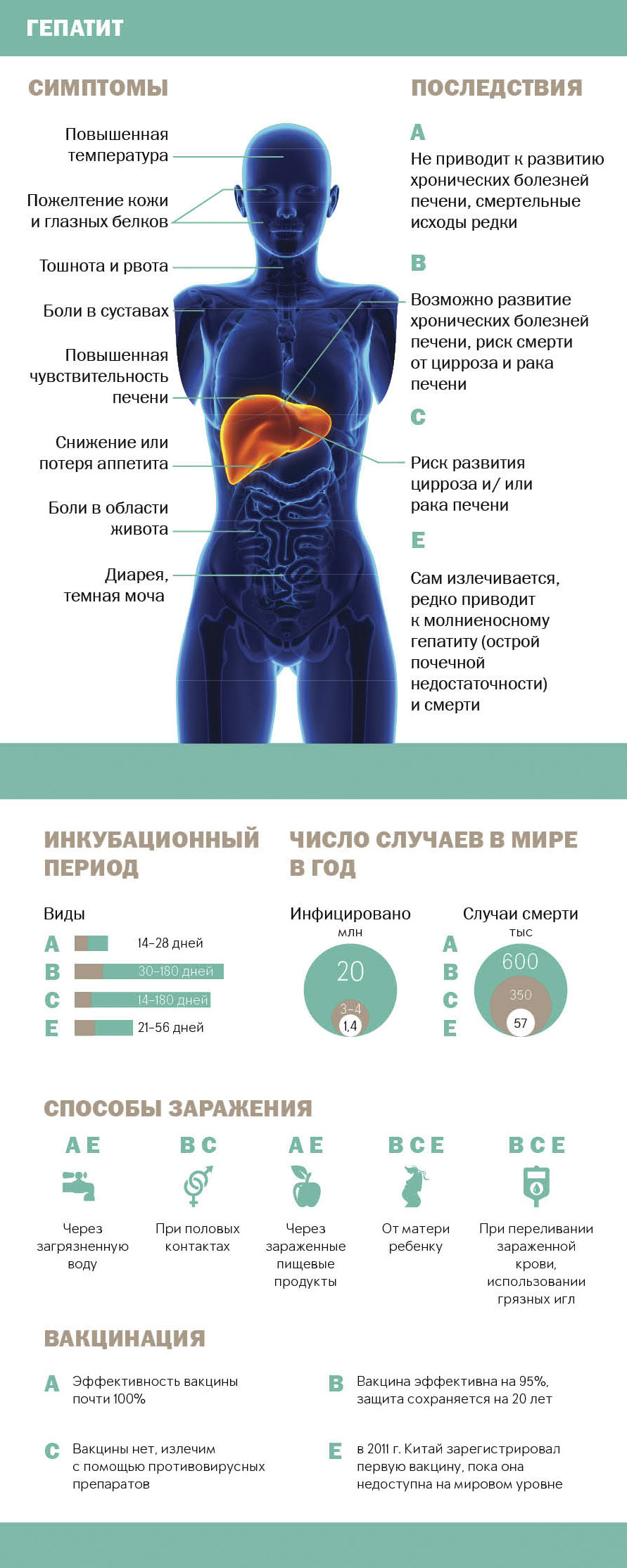
Вирусное поражение печени приводит к нарушению работы всего организма. Нередко отмечаются боли в суставах при гепатите В и С, что связано со стремительным снижением защитных функций. Из-за ослабленного иммунитета организм не способен сопротивляться вирусам, которые активно прогрессируют и втягивают в патологический процесс не только органы, но и суставы.
ЭТО действительно ВАЖНО! Прямо сейчас можно узнать дешевый способ избавится от болей в суставах. УЗНАТЬ >>
Болезни печени любого характера на начальных стадиях развития практически не имеют клинического проявления. Как правило, больной узнает о своем диагнозе, когда патология активно прогрессирует и клетки органа масштабно отмирают. Обычно при вирусном гепатите жалуются на симптоматику, которую не связывают со столь тяжелым недугом, а именно:
- снижение работоспособности;
- быстрая утомляемость;
- вялость;
- апатия;
- бессонница;
- отсутствие аппетита;
- стремительное снижение массы тела;
- стабильная субфебрильная температура;
На более поздних стадиях болезни отмечается пожелтение кожных покровов и глазных белков, что свидетельствует о стремительном разрушении печени. Опасность вирусного гепатита заключается в том, что он является первопричиной развития цирроза и новообразований. Этот недуг поражает не только печень, но и является системным, влияет на состояние всего организма.

Нередко страдают и суставы при гепатите. Как правило, суставные боли проявляются таким синдромом, как артралгия, при котором отсутствуют симптоматические проявления поражения костно-хрящевой ткани. При диагностике, на рентген-снимках, не отмечаются структурные изменения или деформации суставов. Более чем у 5% больных диагностируется гепатитный артрит, который проявляется отечностью мягких тканей в пораженном участке.
Боль в суставах на фоне эмоциональной нестабильности и слабости, считается основным признаком гепатита В и С.
ВАЖНО ЗНАТЬ! Даже «запущенные» суставы можно вылечить дома, без операций и больниц. Просто прочитайте что говорит Валентин Дикуль читать рекомендацию.
Под действием вирусного гепатита С в организме больного отмечается стремительное понижение иммунитета, что является первопричиной развития дегенеративных нарушений в опорно-двигательном аппарате. Из-за прогрессирования вируса отмечаются артритные поражения суставов, что вызваны воспалительной реакцией на раздражитель. На фоне вирусного гепатита, более чем у 20% больных развивается артралгия с хроническим характером протекания. Основной причиной такого явления считается токсический синдром, который связан с отмиранием клеток печени. Усугубить ситуацию могут ранее перенесенные болезни и травмы ОДА.
Артриты, что развиваются на фоне гепатита С и В имеют слабовыраженную симптоматику. В основном страдают крупные суставные сочленения. По мере развития дегенеративных процессов патология поражает суставы пальцев, кистей и стоп. Вначале, гепатитный артрит проявляется отечностью околосуставной области, далее отмечается болевой синдром. На фоне гепатита В и С развивается двустороннее поражение суставов, при этом разрушительный процесс распространяется снизу вверх. Дегенеративные изменения отмечаются в сухожилиях и связках. При гепатите В возрастает риск рецидива полиартритов.
При артралгии поражается тазобедренная и коленная область. Довольно редко болят суставы пальцев рук и голеностопа. По мере развития синдрома болевые ощущения увеличивают свою интенсивность и из периодических перерастают в постоянные. При гепатите С отмечается первичное поражение мелких суставов с проявлением выраженной боли.
Чтобы установить точную причину суставных болей на фоне вирусного гепатита, проводится ряд исследований:
- биохимический и общий анализ крови;
- рентгенография;
- УЗД суставов;
- КТ и МРТ;
- диагностика синовиальной жидкости.

А также лечащим врачом проводится внешний осмотр больного, определяется способность суставов к сгибанию и разгибанию, отмечается наличие скованности. Обязательно собирается полный анамнез болезни для выявления взаимосвязи с гепатитом. Благодаря своевременной диагностике недуга можно остановить дистрофически-дегенеративные изменения в ОДА, что поспособствует дальнейшему излечению.
В первую очередь лечебные мероприятия направляются на устранение основного недуга. Артриты, что возникают на фоне гепатита, тяжело поддаются лечению. В основном используются препараты для устранения симптоматики и приостановления дегенеративных процессов. С такой целью применяются нестероидные противовоспалительные средства и глюкокортикоиды. Назначаются лекарства, направленные на восстановление хрящевой ткани и обогащение костей полезными минералами.
Помимо медикаментов, используют средства физической реабилитации в виде ЛФК, массажа и физиотерапии. Физические упражнения способствуют нормализации кровообращения и оттоку желчи, которая собирается при поражениях печени. Движения выполняются в медленном темпе с минимальной нагрузкой на органы брюшной полости. Массаж способствует укреплению мышечного каркаса и улучшению местной трофики, что снижает болевые ощущения. А также способствует нормализации эмоционального состояния больного. Физиотерапевтические процедуры направлены на устранение отечности и ощущения скованности в суставах. С такой целью применяют ультразвук и различные аппликации.
Судя по тому, что вы сейчас читаете эти строки — победа в борьбе с воспалением хрящевой ткани пока не на вашей стороне.
И вы уже думали о стационарном лечении? Оно и понятно, ведь боли в суставах — очень опасный симтом, который при несвоевременном лечении может закончиться ограниченной подвижностью. Подозрительный хруст, скованность после ночного отдыха, кожа вокруг проблемного места натянута, отеки на больном месте. Все эти симптомы знакомы вам не понаслышке.
Но возможно правильнее лечить не следствие, а причину? Рекомендуем прочитать статью о современных методах лечения суставов. Читать статью >>
источник
Количество заболевших вирусными болезнями постоянно растет. Людей, страдающих этими заболеваниями, интересует вопрос, почему при гепатите С болят суставы. Как известно, эти вирусы в первую очередь поражают печень, однако часто в дальнейшем они приводят к патологиям остальных органов организма человека. Почти 80% больных вирусными формами этого заболевания испытывают сопутствующие симптомы нарушений работы организма.
Чаще всего среди этих симптомов встречаются боли в суставах, это так называемая артралгия. Особенностью этого заболевания является то, что болям не сопутствуют симптомы воспалительных процессов в суставах, и при проведении рентгенологического исследования никаких изменений в них обнаружить не удается. Больных интересует вопрос, какие суставы чаще всего поражаются вирусом и какое лечение необходимо в этом случае.
Главной проблемой вирусных болезней печени является бессимптомное протекание болезни. Зачастую то, что человек заразился таким вирусом, выявляется случайно, во время обследования по какому-либо другому поводу. Люди могут годами жаловаться на усталость, повышенную утомляемость, боли в спине и пояснице, и не догадываться, что причиной этому всему служит вирусное заболевание печени, так как подобные симптомы сопутствуют и другим болезням. Со временем происходит:
-
ухудшение самочувствия;
- степень разрушения печени растет;
- возможно развитие цирроза и онкологии.
Чем раньше было диагностировано это заболевание, пока в организме и печени больного не произошли необратимые изменения, тем больше шансов на успешный итог его лечения. А боль в суставах при гепатите С, наряду с повышенной утомляемостью и депрессией, как раз является одним из ранних симптомов поражения организма этим вирусом. Необходимо обращать внимание на появление подобных симптомов и своевременно обращаться к специалистам.
Вирусные болезни довольно часто провоцируют ревматические заболевания и артрит. Гепатит в этом плане не исключение. У людей со сниженным иммунитетом могут болеть суставы при гепатите С. При попадании в организм человека вирус вызывает инфекционную болезнь и является основополагающим фактором в появлении суставных болей, а в дальнейшем и ревматических патологий. Осложнения гепатита примерно в 25% случаев составляют такие заболевания, как хроническая артралгия и вирусный артрит.
Вероятность возникновения суставных болей зависит от общего состояния организма заболевшего человека, а также от вида возбудителя, который вызвал болезнь.
Факторы, которые увеличивают риск возникновения болей, а в дальнейшем переход их в хроническую форму артрита:
- сниженный иммунный статус больного;
- перенесенные ранее болезни;
- повреждения суставов.
Для гепатитов В и С характерен симметричный двусторонний артрит, внезапное возникновение болей, возможно появление утренней скованности. Наблюдается также болезненность кожных покровов в области пораженных суставов. При проведении рентгенологического исследования больного, несмотря на наличие болей, никаких патологий выявить не удается. При хронической форме гепатита В высока вероятность возникновения повторных полиартритов и полиартралгий.
При вирусном гепатите С артриты наблюдаются реже. Чаще для этой формы заболевания характерно появление внезапных острых болей в мелких суставах кисти, коленных, плечевых и тазобедренных суставах. В таких случаях кроме основной противовирусной терапии врачом может быть назначено лечение, направленное на устранение симптомов ревматических заболеваний и артрита.
Учитывая постоянно возрастающее количество больных вирусными формами гепатита, а еще тот факт, что лечение будет успешнее при ранней диагностике этого заболевания, необходимо более внимательно относиться к своему организму.
Если болят ноги, ноют суставы, беспокоит позвоночник, появилась быстрая утомляемость, необходимо обратиться к специалистам, сдать необходимые анализы, чтобы исключить вероятность вирусного поражения печени.
А в случае, если наличие вируса в организме подтвердится, то необходимо как можно скорее начать лечение.
источник
Вирусы являются агентами, которые могут вызвать как само инфекционное заболевание, так и быть кофактором в развитии различных ревматических болезней. Развитие любого вирусного инфекционного заболевания зависит и от свойств самого вируса, и от состояния макроорганизма. Свойства вируса реализуются в зависимости от способа поступления в макроорганизм, тропности тканей, способности к делению, возможности длительного персистирования или латентного существования и т. д..
Общая клиническая характеристика вирусных артритов .
Вирусные артриты, как правило, возникают в продромальный период, совпадая по времени с появлением кожной сыпи и соответственно вирусемии. Характерным проявлением вирусных артритов является симметричное поражение преимущественно мелких суставов, хотя в процесс могут вовлекаться крупные суставы, а также окружающие мягкие ткани. Во всех случаях артриты являются недеструктивными. Хронизация процесса не наблюдается.
Парвовирус В19 относится к вирусам, которые состоят из одноцепочечной ДНК, проникают в делящиеся клетки, поэтому обладают высокой тропностью к клеткам-предшественникам эритропоэза. У 10 % заболевших возникает суставной синдром, особенностью которого является полиартрикулярное поражение. Полиартрит развивается преимущественно у взрослых, имеющих тесный контакт с детьми (учителя, врачи-педиатры, медицинские сестры детских учреждений и т. д.). Вспышки инфекции обычно происходят в поздний зимний и весенний периоды, однако спорадические случаи могут наблюдаться круглогодично. Основной путь передачи инфекции — воздушно-капельный. Возможна передача инфекции от матери плоду, особенно в первом и втором триместре беременности.
У детей инфекция в 70 % случаев может протекать бессимптомно. Редко имеет место гриппоподобный синдром с артралгией, лихорадкой, головной болью, кашлем, жидким стулом, тошнотой. Сыпь располагается в области щек по типу «пощечины». Суставы поражаются достаточно редко, примерно в 5-10 % случаев. У взрослых сыпь развивается редко, а суставной синдром возникает у 60 % больных. Чаще возникают артралгии, чем явный артрит. Артралгии носят симметричный характер, боль локализуется в мелких суставах кистей, лучезапястных, коленных, голеностопных суставах. Возможно появление утренней скованности и незначительного припухания в суставах.
Поражение суставов при краснухе.
Вирус краснухи поражает взрослых и детей, среди взрослых чаще болеют женщины. Путь передачи инфекции воздушно-капельный, пик заболеваемости приходится на зимние и весенние месяцы. Приблизительно в 50-75 % случаев заболевание протекает субклинически. Обычно поражаются мелкие суставы кистей, лучезапястные и коленные суставы. Процесс носит симметричный и полиартрикулярный характер. Острый артрит совпадает с появлением сыпи.
Поражение суставов при гепатитах.
Суставной синдром при гепатите А встречается в 10-14 % случаев, преимущественно в виде артралгий, возникающих в остром периоде инфекции.
Вирусные артриты при гепатите В наблюдаются значительно чаще, примерно в 20-25 % случаев. В основном поражаются суставы кисти и коленные суставы. Артрит носит симметричный и мигрирующий характер. Иногда развивается утренняя скованность. Артрит и уртикарная сыпь могут предшествовать желтухе на несколько дней или недель и длиться несколько недель после исчезновения желтухи. При хронической форме вирусного гепатита В возможно развитие повторных полиартритов и полиартралгий.
При гепатите С может развиться острая боль в мелких суставах кисти, лучезапястных, плечевых, коленных, тазобедренных. Артриты наблюдаются редко. Также для вирусного гепатита С характерны миалгический синдром, криоглобулинемия с признаками васкулита.
Поражение суставов при ретровирусной инфекции.
ВИЧ-инфекция ассоциируется с несколькими ревматологическими синдромами. Наиболее часто, примерно в 25-40 % случаев имеют место артралгии. Артралгии могут возникать на любой стадии заболевания. Характер суставного синдрома не отличается от всех других вирусных заболеваний: острое начало, малая продолжительность, повторные атаки, отсутствие эрозивно-деструктивного процесса. В некоторых случаях развиваются псориатический артрит, недифференцированная спондило-артропатия, миозит, системный васкулит, синдром фибромиалгии, подагра. Также описаны случаи возникновения септического артрита, остеомиелита и пиомиозита. В 5 % случаев встречается диффузный инфильтративный лимфоцитарный синдром, который по своей клинической картине напоминает синдром Шегрена. Наряду с развитием сухого синдрома, увеличением слюнных желез наблюдается лимфоцитарная инфильтрация легких, желудочно-кишечного тракта и почек. В отличие от синдрома Шегрена в составе клеточной инфильтрации преобладают CD8+ над CD4+. Синдром Рейтера, ассоциированный с ВИЧ-инфекцией, встречается достаточно редко (у 0,5-3 % больных). Олигоартрит суставов нижних конечностей и уретрит являются частыми клиническими симптомами. Следует отметить, что артрит у больных СПИДом протекает тяжело, с развитием эрозивного процесса. Такой же характер имеет артрит при псориазе.
Поражение суставов при других вирусных инфекциях.
Вирус Эпстайна — Барр. Заболевание ассоциируется с полиартралгиями, хотя описаны случаи развития моноартрита коленного сустава и разрыва кисты Бейкера.
Вирус инфекционного паротита. У инфицированных взрослых возможно развитие артритов мелких и крупных суставов, которые длятся несколько недель, причем артриты могут как предшествовать развитию паротита, так и возникать в течение 4 нед. после начала заболевания.
Инфекции, вызванные аденовирусами и вирусами Коксаки А9, В2, ВЗ, В4, В6, могут сопровождаться развитием полиартрита, плеврита, миалгии, сыпи, фарингита, миокардита.
Диагностика вирусных артритов основывается на выявлении вирусов с помощью ПЦР или обнаружении специфических антител.
Лечение вирусных артритов.
Артриты при вирусных инфекциях протекают благоприятно, и пациентам требуется лишь проведение симптоматической терапии анальгетиками или НПВП. В особых случаях возможно применение глюкокортикоидов в малых дозах. В острый период целесообразна легкая иммобилизация и постельный режим на несколько дней. В подавляющем большинстве случаев применение хирургических методов лечения нецелесообразно.
источник
*Импакт фактор за 2017 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Хронические вирусные гепатиты (ХВГ) в настоящее время представляют собой серьезную медико–биологическую и социальную проблему для всего человечества. Основными причинами, определяющими их актуальность, являются: а) высокая заболеваемость, б) нередкое развитие цирроза и первичного рака печени и, как следствие, нарастание летальности, в) значительные экономические потери, обусловленные необходимостью выделения огромных средств на лечение и профилактику этих инфекций.
В современной ревматологии проблема ХВГ, как и инфекционной патологии в целом, представляется весьма значимой. Хорошо известно о наличии так называемых «внепеченочных» (клинических и лабораторных) проявлений ХВГ, которые развиваются в 20–70% случаев и часто встречаются в ревматологической практике (артриты/артралгии, васкулит, феномен Рейно, синдром Шегрена, криоглобулинемия, наличие ревматоидного фактора и антиядерных антител в сыворотке крови и др.).
С другой стороны, несомненного внимания заслуживает проблема ХВГ как коморбидной инфекции, особенно при системных заболеваниях соединительной ткани. Указанное обстоятельство обусловливает необходимость модификации тактики лечения пациентов, получающих антиревматическую терапию, особенно цитостатики и современные генно–инженерные биологические препараты (ГИБП). При этом возникает необходимость внесения определенных корректив в схемы применения противовирусных препаратов, назначаемых с терапевтической и/или профилактической целью.
Цель настоящей статьи – представить данные о значении хронических коморбидных инфекций, вызванных вирусами гепатита В (HBV) и С (HCV) у больных ревматоидным артритом (РА).
Хронический вирусный гепатит В (ХГВ)
Приблизительно треть населения Земли имеют маркеры перенесенной HBV–инфекции и около 350 млн человек из них – маркеры текущей хронической HBV–инфекции, отличающейся широким спектром клинических вариантов и исходов заболевания.
Вирус HBV относится к ДНК–содержащим вирусам из семейства Hepadnaviridae. Оболочка его состоит из фосфолипидного двойного слоя, в который погружены частицы поверхностного антигена, состоящие из нескольких сотен молекул белка, гликопротеидов и липопротеидов. Внутри HBV находится нуклеокапсид или ядро (core), имеющее форму икосаэдра, содержащее геном HBV, концевой белок и фермент ДНК–полимеразу. ДНК HBV включает 4 гена, представленные ниже [1].
S–ген кодирует поверхностный («австралийский») антиген оболочки – HBsAg. С–ген (core–ген) кодирует белок нуклеокапсида – так называемый сердцевинный Ag (HBсAg). В core–гене выделяют pre core – зону, кодирующую pre core – полипептид, который модифицируется в растворимую форму и секретируемый в кровь белок – HBeAg (маркер репликации вируса). Инфицирование pre core мутантным HBV приводит к снижению или полному прекращению продукции HBeAg. Селекция HBeAg–негативных штаммов влечет за собой трансформацию HBeAg–позитивной формы хронического гепатита В в HBeAg–негативную. Больные хроническим HBeAg–отрицательным гепатитом В хуже реагируют на терапию противовирусными препаратами.
Ген Р кодирует ДНК–полимеразу HBV. Ген Х кодирует белок, играющий важную роль в развитии первичного рака печени у HBV–носителей.
Против каждого HBV–антигена в макроорганизме вырабатываются антитела. В клинической практике выявление антигенов и антител используют для диагностики ХГВ, определения стадии процесса, прогноза, оценки эффективности терапии, определения показаний к вакцинации и ревакцинации.
В ходе естественного течения хронической HBV–инфекции выделяют несколько фаз, характеризующихся присутствием или отсутствием в крови больного HBeAg, степенью активности аланиновой аминотрансферазы (АлАТ) и уровнем виремии, а также гистологической картиной заболевания [2]. Соответственно фазам течения хронической HBV–инфекции диагноз у пациента формулируется в конкретный момент времени. При этом необходимо учитывать возможность перехода одной фазы в другую.
В течении ХГВ возможны прекращение продукции HBeAg (как спонтанное, так и под влиянием лечения) и стойко регистрируемое наличие антител к данному антигену (HBeAb) – так называемая «сероконверсия» по HBeAg. Она характеризуется очень низкими или даже неопределяемыми концентрациями ДНК HBV, нормализацией активности АлАТ и аспарагиновой (АсАТ) трансаминаз и положительной динамикой морфологических изменений в ткани печени. Исчезновение HBsAg и сероконверсия с формированием HBsAb могут развиваться спонтанно у 1–3% больных в год, обычно после нескольких лет стойко отрицательного теста на ДНК HBV в сыворотке крови [3]. В таблице 1 отражены основные лабораторные и морфологические характеристики, позволяющие диагностировать фазу течения хронической HBV–инфекции и вариант ХГВ.
Неактивное носительство HBsAg – самая частая форма хронической HBV–инфекции, которая выявляется у 60–70% больных, имеющих HBsAg в крови. Характеризуется стойко нормальным уровнем трансаминаз, отсутствием HBeAg и наличием HBeAb в сыворотке крови, низким уровнем виремии (ДНК HBV в сыворотке крови менее 2000 МЕ/мл или менее 10 000 копий/мл), минимальными признаками активности процесса по данным биопсии печени (индекс гистологической активности менее 6 баллов по шкале Knodell или Ishak). Данная категория больных имеет благоприятный прогноз, т.е. очень низкий риск прогрессирования заболевания и развития цирроза печени, гепатоцеллюлярной карциномы, печеночной летальности.
Латентная HBV–инфекция – это состояние, при котором в отсутствие HBsAg в сыворотке единственными маркерами вирусной инфекции являются антитела к антигенам вируса, прежде всего «изолированные» HBcAb класса IgG (суммарные) при наличии вируса гепатита В в ткани печени и очень низкой сывороточной концентрации HBV–ДНК.
Под воздействием иммуносупрессивной терапии больной из статуса неактивного носительства HBsAg или латентной HBV–инфекции может перейти в фазу реактивации, которая характеризуется повышением уровня ДНК HBV в сыворотке с последующим нарастанием АлАТ, отражающим острое печеночно–клеточное повреждение. Реактивация HBV–инфекции в большинстве случаев развивается вслед за прекращением иммуносупрессивной терапии, однако может появиться и во время лечения. Как правило, обострение развивается в срок от 4 до 36 нед. от начала терапии (в среднем через 16 нед.).
Большинство авторов оценивают реактивацию HBV–инфекции на основании вирусологического мониторинга, так как клинические признаки острого гепатита, как правило, появляются спустя 1–11 нед. после роста виремии, у ряда больных отмечается бессимптомное течение реактивации. Кроме того, у части больных ДНК HBV может снижаться и даже не обнаруживаться в период нарастания АлАТ сыворотки. Поэтому мониторинг ДНК HBV проводится в динамике высокочувствительными ПЦР–методами. Ряд исследователей предлагают рассматривать в качестве признака реактивации 5–кратное повышение АлАТ, другие учитывают нарастание АлАТ в 3 раза от первоначального уровня.
Большинство авторов оценивают следующие признаки:
• развитие гепатита с повышением уровня ДНК HBV сыворотки более чем на один log 10 копий/мл от исходного уровня;
• абсолютное увеличение вирусной нагрузки свыше 6 log 10 копий/мл;
• появление ДНК HBV в сыворотке при ее отрицательном значении до начала химиотерапии.
Таким образом, оценка вирусной нагрузки и уровня АлАТ сыворотки в динамике являются ключевыми в диагностике и мониторинге реактивации. Безусловно, биопсия печени позволяет получить дополнительную важную информацию, провести дифференциальный диагноз с другими причинами ее поражения и выявить гистологические признаки HBV–инфекции.
Курация больных ревматическими заболеваниями (РЗ) в целом и РА в частности в рамках хронической HBV–инфекции представляется весьма актуальной клинической проблемой. Так, по данным литературы последних 3 лет, частота HBV–носительства среди больных РА и спондилоартропатиями колеблется от 10 до 51% [4–7]. При анализе переносимости некоторых базисных препаратов больными РА, инфицированными HBV, показано, что метотрексат отменялся в 100% случаев в связи с повышением уровня печеночных ферментов [8].
Другой не менее важной причиной неудач в лечении является возможность реактивации HBV–инфекции. Случаи ее развития описаны для всех ГИБП, зарегистрированных в РФ. Японскими исследователями установлено, что назначение ГИБП больным РА, являющимся HBV–носителями, повышало вероятность активации инфекции в 10,9 раза (р=0,008) [6]. Указанное обстоятельство связано с тем, что «мишенями» ГИБП являются ключевые компоненты иммунной защиты человека от инфекций, а именно фактор некроза опухоли–α (ФНО–α), интерлейкин–1, интерлейкин–6 (ИЛ–6), В– и Т–лимфоциты и др. В частности, показано, что ФНО–α является важным медиатором активации врожденного ответа макроорганизма против HBV–инфекции, заключающегося в дестабилизации нуклеокапсидов вируса в гепатоцитах и торможении репликации ДНК HBV [9].
В 2003 г. в литературе появились первые описания случаев реактивации HBV–инфекции c развитием фульминантного гепатита у больных РА и болезнью Стилла на фоне терапии инфликсимабом [10,11]. В обзоре испанских авторов проведен анализ результатов применения ингибиторов ФНО–α (иФНО–α) у 257 пациентов, страдавших ревматическими, гастроэнтерологическими и дерматологическими аутоиммунными заболеваниями с наличием HBV–маркеров в сыворотке крови. Частота реактивации среди 89 HBsAg–носителей составила 39%. При этом HBV–реактивация наблюдалась значительно чаще среди больных, предварительно получавших иммуносупрессивную терапию (96 и 70% соответственно, р=0,033). Имели место 5 случаев острой печеночной недостаточности, в том числе у 4 больных с летальным исходом. Из 168 носителей HBcAb в сыворотке реактивация инфекции наблюдалась у 9 (5%), включая 1 случай летального исхода [12]. Хотя к интерпретации этих данных следует подходить с определенной осторожностью, в целом они подчеркивают нарастание риска HBV–реактивации у HBsAg–позитивных больных при лечении иФНО–α и с меньшей частотой – при латентной HBV–инфекции, характеризующейся наличием HBcAb (в сочетании с HBeAb и/или HBsAb), и свидетельствуют о необходимости назначения противовирусных препаратов с профилактической целью [13]. Данное положение отражено и в консенсусе экспертов EULAR 2011 г. [14].
Другие авторы также разделяют это мнение и полагают, что у неактивных HBV–носителей ГИБП–терапия может быть проведена при обязательном профилактическом применении современных противовирусных препаратов. Так, D. Vassilopoulos и соавт. в рамках проспективного исследования наблюдали 14 больных (РА–9, спондилоартропатии – 5) с хронической HBV–инфекцией (HBeAg–/ HBeAb+), которые получали терапию иФНО–α в сочетании с противовирусными препаратами (ламивудин, энтекавир, телбивудин). Авторами продемонстрирован высокий (93%) уровень безопасности комбинированной терапии на протяжении 2–летнего периода наблюдения. У 1 больного отмечалась реактивация инфекции как следствие развития резистентности HBV к ламивудину [15].
В исследовании J. Lan и соавт. показано, что применение иФНО–α при РА может привести к HBV–реактивации как у HBsАg(+) –, так и у HBsАg(–)/HBcАb (+) – больных с определяемым уровнем ДНК HBV (т.е. при латентной HBV–инфекции). Отсутствие превентивной противовирусной терапии является значимым (р 10–кратному нарастанию титров ДНК HBV по сравнению с исходными данными в среднем через 10,5 мес. от начала лечения. Авторы делают вывод, что применение абатацепта у больных РА и ХГВ, по–видимому, безопасно и эффективно при одновременно проводимой противовирусной терапии HBV–инфекции энтекавиром или тенофовиром. Указанные результаты должны привести к инициации контролируемых исследований абатацепта при ХГВ [25].
Выбор противовирусного препарата и длительность его применения зависят от планируемой продолжительности терапии ГИБП и HBV–статуса, поэтому окончательное решение принимается только после консультации гепатолога. Как правило, лечение противовирусными препаратами начинают за 1–2 нед. до начала ГИБП–терапии и продолжают по меньшей мере 6–12 мес. после ее окончания. В процессе терапии обязательно мониторирование титров HBsAb, уровней виремии и трансаминаз каждые 4–8 нед. Известно, что снижение титра HBsAb в сыворотке при латентной HBV–инфекции является первым предвестником обратной сероконверсии в HBsAg и развития реактивации процесса. В таблице 2 представлен алгоритм применения ГИБП у HBV–инфицированных больных РЗ.
Хронический вирусный гепатит С (ХГС)
Вирус гепатита С (HCV) – одна из главных причин хронических заболеваний печени. Диапазон исходов HCV–инфекции широк и колеблется от минимального до тяжелого поражения печени, включая развитие цирроза и гепатоцеллюлярной карциномы. В настоящее время в мире насчитывается более 180 млн хронических носителей HCV.
HCV относится к классу Flaviridae, имеет липидную оболочку, сферическую форму, нуклеокапсид содержит однонитевую линейную РНК. Геном HCV отличается высокой склонностью к мутациям и изменениям своей антигенной структуры, что позволяет вирусу ускользать из–под иммунного контроля макроорганизма и длительно в нем персистировать. В различных регионах мира выделяют разные генотипы вируса. Генотипы не влияют на исход инфекции, но позволяют прогнозировать эффективность и длительность терапии.
У 70–80% больных, перенесших острую форму, болезнь приобретает хроническое течение и отличается латентным течением или малосимптомностью клинических проявлений в течение многих лет. Основные признаки хронической HCV–инфекции – это повышение активности трансаминаз, выявление анти–HCV и РНК HCV в сыворотке крови в течение ≥6 мес. Пункционная биопсия, являющаяся «золотым стандартом» диагностики хронических гепатитов, позволяет получить информацию о стадии фиброза и прогнозе заболевания. В последние годы в клиническую практику внедрены неинвазивные методы оценки фиброза, прежде всего эластография. Этот метод позволяет достаточно точно диагностировать отсутствие фиброза или его минимальные значения, а также конечную стадию (цирроз), но в то же время он может дать искаженные результаты у больных со стеатозом печени и чрезмерным развитием подкожно–жировой клетчатки [1].
Проблема применения ГИБП у носителей HCV по–прежнему привлекает внимание исследователей. В частности, известно, что ФНО–α наряду с другими провоспалительными цитокинами вырабатывается при HCV–инфекции и, следовательно, играет важную роль в естественном течении болезни. Показано, что ФНО–α может индуцировать продукцию трансформирующего фактора роста–β, экспрессия которого тесно связана с гистологической выраженностью активности процесса у больных хронической HCV–инфекцией. Более того, высокие уровни ФНО–α оказывают негативное влияние на ответ макроорганизма больного ХГС при терапии интерфероном [32]. Следовательно, блокирование ФНО–α могло бы иметь благоприятные последствия для больных с HCV–инфекцией. Показано, что комбинация этанерцепта со стандартной противовирусной терапией (интерферон + рибавирин) при хронической HCV–инфекции приводила к более благоприятному результату (p=0,04) [33]. Однако длительность терапии в этом исследовании не превышала 3–9 мес.
Исследователями из Австрии опубликован систематический обзор, включающий данные 153 больных с хронической HCV–инфекцией и различными воспалительными заболеваниями (РА, псориаз, псориатический артрит, АС, болезнь Крона, криоглобулинемия, васкулит), по поводу которых проводилась иФНО–α–терапия [34]. На фоне лечения у 8,8% больных РА и 4,2% – псориазом и псориатическим артритом зарегистрирована отрицательная динамика, заключавшаяся в нарастании вирусной нагрузки и/или повышении уровня трансаминаз сыворотки и/или подтвержденная при гистологическом исследовании биоптатов печени. Превалирование в указанной подгруппе больных РА, наряду с прочими причинами, может быть объяснено и с позиций более частого назначения сопутствующих препаратов, обладающих определенным гепатотоксическим эффектом (метотрексат, циклоспорин, нестероидные противовоспалительные препараты, азатиоприн).
В соответствии с консенсусом 2011 г. у всех больных перед началом иФНО–α–терапии необходимо проводить HCV–обследование, поскольку безопасность длительного применения этих препаратов у пациентов с данной инфекцией не установлена. Однако, как подчеркивают авторы, подобное заключение не обеспечивает ни четкими показаниями к применению иФНО–α–терапии в рамках хронической HCV–инфекции, ни четкими противопоказаниями, и в ежедневной клинической практике врачи продолжают применять эти препараты, не располагая стандартизованными схемами наблюдения.
В соответствии с национальными рекомендациями США и Великобритании по лечению псориаза и псориатического артрита, всем пациентам перед назначением иФНО–α проводится скрининг для исключения HCV–инфицирования, [35,36], при этом в ряде случаев может потребоваться консультация гепатолога [36]. Мониторинг должен включать ежемесячные исследования значений трансаминаз и периодическую оценку уровня виремии (РНК HCV).
Необходимо отметить, что в настоящее время завершен набор больных в многоцентровое рандомизированное исследование PARTNER, целью которого является изучение эффективности и переносимости инфликсимаба в сочетании с пегилированным интерфероном–α 2b и рибавирином у больных с хронической HCV–инфекцией. С учетом предусмотренного 2–кратного исследования биоптатов это будет первая крупная работа, оценивающая влияние иФНО–α на патоморфологические процессы в печени в рамках HCV–инфекции [37].
В 2 рандомизированных контролируемых исследованиях III фазы отчетливо продемонстрирована эффективность РТМ при HCV–ассоциированной криоглобулинемии [38,39]. В то же время данные других авторов не представляются столь однозначными. Из 32 больных с HCV–ассоциированным васкулитом, которые получали лечение РТМ, рецидивы заболевания, обусловленные появлением РНК HCV, отмечены в 11 случаях (34%) [40]. Недавно опубликовано наблюдение РТМ–ассоциированной HCV–реактивации у больного РА [41].
Сообщается об успешном применении абатацепта у 2 больных РА, имеющих хроническую HCV–инфекцию. Каких–либо значимых отклонений в уровнях активности трансаминаз и вирусной нагрузки не наблюдали. Авторы делают вывод о перспективности изучения применения абатацепта у данной категории больных в условиях длительного проспективного исследования с обязательным строгим контролем как серологических маркеров, так и гистологических данных [42].
Как следует из упоминавшегося выше консенсуса 2011 г., безопасность тоцилизумаба (ТЦЗ) у больных РА с активной HCV–инфекцией не известна, поскольку подобные пациенты в рандомизированные клинические исследования не включались. В литературе имеются отдельные наблюдения безопасного применения ТЦЗ при РА с коморбидной HCV–инфекцией [43,44]. Однако более широкое применение ТЦЗ и адекватная оценка его переносимости у этих больных могут быть затруднены, так как лечение данным препаратом ассоциируется с нарастанием активности трансаминаз (> 30% случаев), особенно на фоне комбинированной терапии с метотрексатом.
В соответствии с современными рекомендациями Европейского научного общества по изучению болезней печени (EASL), основу терапии хронической HCV–инфекции составляет сочетание пегилированных интерферонов–α (ИФН–α) и рибавирина [45]. В то же время хорошо известно, что пегилированные интерфероны могут индуцировать развитие или ухудшать течение уже существующих аутоиммунных заболеваний. Японские авторы приводят описание случая развития РА у 48–летнего мужчины через 2 мес. после окончания 24–недельного курса противовирусной терапии по вышеуказанной схеме, назначенной по поводу HCV–инфекции [46]. В связи с этим представляют несомненный интерес сообщения об успешном применении этанерцепта в сочетании с противовирусной терапией препаратами ИФН–α и рибавирином у больных РА с сопутствующей HCV–инфекцией [47,48]. В обоих указанных случаях этанерцепт назначали в превентивном режиме, т.е. за 3 мес. до начала противовирусной терапии. Полагают, что такой подход позволяет избежать ИФН–α–ассоциированного обострения РА [49]. В рекомендациях Американской коллегии ревматологов 2012 г. по лечению РА этанерцепт упоминается в качестве единственного ГИБП, применение которого возможно для лечения больных РА с коморбидной HCV–инфекцией [50].
Таким образом, проблема «РА – хронические гепатиты» по–прежнему таит в себе множество вопросов, ответы на которые еще предстоит найти. Несомненно, что для более полной оценки эффективности и безопасности различных ГИБП у этих больных необходимы крупномасштабные проспективные исследования с длительными сроками лечения и наблюдения. Ведь именно «свободное и всесторонне исследование истины есть единственное средство против безумия и заблуждения, какого бы рода они ни были» (Й. Гердер).
источник
ГУ Институт ревматологии РАМН
У читывая высокую распространенность острого вируснуго гепатита В (ВГВ) и частое развитие в его дебюте суставного синдрома, необходимо исключать ВГВ как причину поражения суставов при дифференциальной диагностике ранних артритов.
Приводимый ниже пример очень показателен и подтверждает важность своевременного обследования на гепатиты в практике ревматолога поликлиники.
Пациентка С., 66 лет, пенсионерка, впервые обратилась в консультативно-поликлиническое отделение ГУ Института ревматологии РАМН 5 марта 2003 г. (на 4-й неделе болезни) с жалобами на выраженную утреннюю скованность более часа, сильные боли в суставах, субфебрильную температуру, слабость, утомляемость, резкое снижение аппетита, депрессию, похудание.
Из анамнеза: в течение 10 лет (до 30-летнего возраста) страдала тиреотоксикозом, по поводу которого неоднократно лечилась стационарно с применением различных инвазивных процедур. В 32 года перенесла острый бурсит левого плечевого сустава и эпикондилит слева. В 2000 г. – аппендэктомия без осложнений, переливаний крови не было. В 1999 и 2001 гг. – протезирование зубов.
Заболела остро – 10 февраля 2003 г., когда появились сильные боли в суставах рук и их припухлость, повышение температуры до субфебрильных цифр, анорексия, слабость. В поликлинике по месту жительства был сделан общий анализ крови, не выявивший отклонений (СОЭ=9 мм/час). Направлена на консультацию с диагнозом “Ревматоидный артрит”.
При осмотре. Состояние средней тяжести из-за выраженного болевого синдрома. Эмоционально лабильна, плаксива, угнетена (“не хочу жить”), двигается с трудом из-за сильных болей во всех суставах. Оценивает боль как очень сильную, по визуальной аналоговой шкале – 90 мм. Самостоятельно раздеться не может, кисть в кулак не сжимает. Отмечается умеренно выраженная симметричная припухлость проксимальных межфаланговых (ПМФ) и пястно-фаланговых суставов кистей, лучезапястных, коленных и голеностопных суставов. Пальпация всех суставов резко болезненна. Сгибательные болевые контрактуры ПМФ суставов и коленных суставов. Кожа и слизистые розовые. В легких хрипов нет. Тоны сердца несколько приглушены, ритмичны, не учащены, систолический шум на аорте. Живот мягкий, безболезненный. Печень и селезенка не пальпируются. Отеков нет. В течение 10 дней принимает 100–150 мг диклофенака в сутки без эффекта. Для уточнения диагноза была направлена на обследование, рекомендован прием 200 мг диклофенака в сутки. Во время второго визита через 2 нед (19.03.03, 6-я неделя болезни) сообщила об улучшении состояния: утренняя скованность в течение 15–20 мин, но боли в суставах кистей оценивает по ВАШ на 75 мм. Сохраняется выраженный астенический синдром, анорексия, с начала болезни похудела на 5 кг. Принимает диклофенак в дозе 100–150 мг/сут. При осмотре: воспалительные изменения сохраняются только в ПМФ суставах, в них же небольшие болевые сгибательные контрактуры. По органам – без динамики. Рентгенологических изменений в костях и суставах кистей нет. Лабораторное обследование выявило значительное повышение трансфераз, щелочной фосфатазы и лактатдегидрогеназы (табл. 1). В связи с явными признаками поражения печени пациентка была направлена на дополнительное обследование для исключения вирусного гепатита. В результате в начале апреля 2003 г. были выявлены лабораторные признаки гепатита В: положительный тест на ДНК ВГВ, выявлен HBsAg и суммарные антитела к сердцевинному антигену (HB total anti-core+), маркеры гепатита С были отрицательными.
Через три месяца, 25.06.03, во время третьего визита отмечала значительное улучшение состояния, воспалительных изменений в суставах не выявлено, хотя появились слабые боли в плечевых суставах и мышцах плечевого пояса, сохранялась утренняя скованность 10–15 мин в мелких суставах кистей. Астенический синдром купировался, появился аппетит. Продолжает принимать диклофенак 50–100 мг/сут, появились гастралгии. При осмотре признаков поражения суставов и внутренних органов не выявляется. В анализах крови – без отклонений от нормы. Катамнез через год (осмотр 25.03.04): чувствует себя хорошо. Суставы не беспокоят. Жалобы на гастралгии при погрешностях в диете. При осмотре воспалительных изменений в суставах нет. В анализах крови тест на ВГВ-ДНК отрицательный, HBsAg не выявлен, определены антитела HBcIgG+. Повторно консультирована гепатологом по месту жительства, заключение: реконвалесценция после острого гепатита В.
Таким образом, динамическое наблюдение позволило заключить, что пациентка перенесла острый гепатит В с повышением уровня АЛТ в 36 раз. Гепатит протекал в безжелтушной форме и был подтвержден по виремии и обнаружению антител к вирусу гепатита В. Все клинические проявления купировались за 5–6 мес полностью. Внепеченочные проявления включали ревматоидоподобный полиартрит, серопозитивный по ревматоидному фактору в дебюте. В этот период пациентка обратилась за помощью к ревматологу, поскольку поражение суставов было ведущим в клинической картине. Обычного биохимического анализа крови оказалось достаточно, чтобы обнаружить повышение трансфераз и целенаправленно провести дополнительное обследование на гепатиты. Исходом болезни было выздоровление.
На основании клинических данных и результатов лабораторных исследований функции печени течение болезни было определено как острое затяжное (прогредиентное), поскольку проявления инфекции сохранялись до 6 мес болезни. При затяжных формах острого ВГВ клинико-биохимические проявления разгара заболевания и особенно периода обратного его развития могут быть достаточно длительными – от 3 до 6 мес. Установлено, что гематогенная циркуляция в стабильно высокой концентрации ВГВ-ДНК более 3 нед, HBeAg более 1 мес, HBsAg более 3 мес, характеризуют прогредиентное течение ГВ, а соответственно более 5 нед, 2 и 6 мес прогнозирует вероятность хронизации. В связи с возможной хронизацией инфекционного процесса решение вопроса о выздоровлении после ВГВ зависит от полноты и тщательности клинико-биохимического и серологического (вирусологического) обследования. Известно, что к моменту выписки из стационара клиническое выздоровление, нормализация биохимических показателей и исчезновение маркеров активной вирусной репликации наступает лишь у 75–90% реконвалесцентов. Однако в нашем случае исчезновение клинических симптомов сопровождалось купированием виремии и исчезновением HBsAg, что позволило констатировать выздоровление. Приводимое наблюдение демонстрирует необходимость проведения скрининговых исследований на гепатиты не только пациентов с выявленными факторами риска, с симптомами заболевания печени или с повышенной активностью АЛТ, но и больных с ранним артритом. В заключение приводим алгоритм обследования пациента с подозрением на вирусные гепатиты, включая и гепатит С (ВГС), поскольку нередко встречаются случаи коинфекции.
В практике ревматолога могут встретиться носители HBsAg, у которых после перенесенного ВГВ какое-то время может сохраняться положительный тест на HBsAg (“постгепатитное носительство”). Длительное (более 3 мес) обнаружение в крови HBsAg в стабильно высокой концентрации даже при отсутствии клинических признаков, цитолиза, маркеров активной вирусной репликации является косвенным критерием затяжного (прогредиентного) течения болезни, что может быть подтверждено гистологическими исследованиями печеночных биоптатов. Выявление HBsAg в стабильном титре на протяжении 6 мес и более от начала острого ВГВ даже при нормальных клинико-лабораторных показателях свидетельствует о хронизации процесса. В отдельных случаях процесс элиминации HВsAg из организма после перенесенной острой инфекции может затягиваться и занимать промежуток времени от 6 мес до 2 лет. Однако HВsAg не должен определяться в сыворотке крови уже через 1 год после перенесенной острой HBV-инфекции. Данное обстоятельство является показанием для проведения пункционной биопсии печени с целью исключения хронического ГВ.
Комментарии
Ряд острых вирусных инфекций может сопровождаться артралгиями и артритами. Возбудители этих инфекций хорошо известны – это вирусы краснухи, эпидемического паротита, парвовирус В19, энтеровирусы Коксаки и ЕСНО, вирусы гепатита и др. Острое поражение суставов может быть обусловлено тропностью вирусов к тканям сустава и происходить в результате прямой инвазии клеток синовии вирусом и гибелью синовиоцитов в результате цитопатического действия вируса. Полагают, что отложение в тканях сустава циркулирующих иммунных комплексов, состоящих из вирусного антигена, антител к нему и комплемента, также может вызывать острый синовит.
Заболеваемость острыми гепатитами у нас в стране очень высока. Например, в 2000 г. число свежих случаев превысило 180 тыс. Частота и особенности развития артритов при гепатитах зависят от возбудителя. Так, при остром вирусном гепатите А, который иногда протекает в виде эпидемических вспышек, артралгии встречаются в 6–10% случаев у детей и у 30% взрослых. Как правило, суставные боли возникают в острой фазе заболевания – в преджелтушном периоде, носят умеренный характер и продолжаются 5–7 дней. Истинные артриты при гепатите А представляют большую редкость. В отличие от острого гепатита А, при котором переход в хроническую форму и носительство вируса не развиваются, гепатиты В и С, склонные к хроническому течению, чаще сопровождаются воспалительными изменениями в суставах. Показано, что ВГВ может инфицировать не только гепатоциты, но и внепеченочные клетки, например, лимфоидные. Внепеченочные проявления инфицирования вирусом гепатита В чаще наблюдаются при его хронических формах. К проявлениям хронического инфицирования ВГВ в настоящее время относят некоторые формы узелкового панартериита, мембранозный гломерулонефрит, смешанную криоглобулинемию, изолированный кожный лейкоцитокластический васкулит, пурпуру Шенлейна – Геноха. В настоящее время хронические гепатиты В и С рассматриваются как генерализованные вирусные инфекции, т.е. как системные заболевания. Поражение суставов и других внепеченочных проявлений при хронических гепатитах обусловлены преимущественно иммунопатологическими механизмами.
Таблица 1. Результаты лабораторных тестов пациентки С.
Сокращения: АЛТ – аланиновая трансфераза; АСТ – аспарагиновая трансфераза; ЩФ – щелочная фосфатаза; РФ – ревматоидный фактор; ЛДГ – лактатдегидрогеназа.
Алгоритм обследования пациента
Клинические проявления артритов при острых вирусных гепатитах
- частое развитие в продромальном периоде (до желтухи)
- ассоциация с системными симптомами (макуло-папулезная сыпь, уртикарные высыпания, лимфаденопатия)
- острое начало
- очень сильные мышечно-суставные боли
- продолжительная утренняя скованность
- симметричное полиартикулярное поражение
- преимущественное воволечение мелких суставов кистей
- болезненность непропорциональна скромным признакам воспаления
- вовлечение периартикулярных тканей
- нередко изменение цвета кожи над суставами
- самопроизвольное купирование через 2-4 нед
- редко — эволюция в хроническую артропатию
Электронная фотография вируса гепатита В
Течение инфекции, вызванной HBV, у взросл ых
Таблица 2. Интерпретация результатов серологических тестов на гепатит В
источник
Вирус гепатита С (НСV) является главной причиной посттрансфузионного и приобретенного бытовым путем хронического гепатита, не относящегося ни к А, ни к В типу. НСV-инфекция протекает субклинически и у 70-80% больных переходит в хроническую форму. Заболеваемость в США составляет 150000 новых случаев каждый год, в 93000 случаев развивается хронический гепатит С. Гепатит С, которым в США в настоящее время заражено 3,5 млн человек, передается в основном парентеральным путем. У большинства пациентов никогда не развивается прогрессирующее поражение печени, но приблизительно у 20% в течение двух или трех десятилетий формируется цирроз печени или гепатоцеллюлярная карцинома. Гепатит С сопровождается разнообразными внепеченочными проявлениями, многие из которых являются ревматическими и связаны иммунологическими механизмами.
Для гепатита С характерно поражение суставов, которое проявляется в виде артрита. Суставные проявления изучены недостаточно (их клинические особенности, патогенез, естественное течение и оптимальное лечение). Данные по распространенности суставных признаков НСV -инфекции заметно варьируют в различных исследованиях. В то время как при проведении клинического осмотра артрит как осложнение гепатита С выявляется менее чем у 5% пациентов, при использовании опросников суставные жалобы регистрируются у 30% инфицированных лиц. Пока точно не установлено, связан ли гепатит С с отдельной формой воспалительного заболевания суставов, однако растущее количество наблюдений предполагает именно это.
Один недавно описанный синдром характеризуется неэрозивным, непрогрессирующим артритом, связанным с теносиновитом и суставной симптоматикой, которая не соответствует результатам объективного исследования. Кроме того, описаны ревматоидоподобные проявления, а также мнтермиттирующий моноартрит и олигоартрит без эрозивных изменений. При клиническом осмотр обычно выявляются болезненность суставов, но явный синовит встречается реже. Экссудативные изменения суставов встречаются очень редко.
Одна из самых частых проблем у НСV-инфицированных лиц — это проведение дифференциальной диагностики между истинным ревматоидным артритом и полиартритом при НСV-инфекции. Дифференциальная диагностика осложнена тем фактом, что у НСV- зараженных людей часто встречается ревматоидный фактор (50-60%), а также другие лабораторные проявления аутоиммунного процесса. Частое выявление РФ отчасти объясняется высокой распространенностью криоглобулинов у этой категории больных.
Хотя присутствие РФ не коррелирует с суставными признаками, оно затрудняет дифференциальную диагностику между HCV-инфекцией и истинным ревматоидным артритом. Наличие АЦЦП является более надежным диагностическим признаком, чем РФ. У больных с ревматоидным артритом отмечаются также более значительные объективные изменения суставов (т.е. явный синовит), чем у пациентов с гепатитом С, для которых более характерны артралгии. Наконец, поражение суставов при гепатите С не сопровождается эрозивными изменениями. Деструкция сустава указывает на другое заболевание.
Ведение артрита при гепатите С остается проблематичным. В недавнем неконтролируемом исследовании эффективности лечения интерфероном было показано, что суставные проявления гепатита С могут отвечать на агрессивную антивирусную терапию, но необходимы контролируемые исследования и лучшие клинические определения болезни и ответа на лечение. Учитывая возможность обострения гепатита, любое лечение должно проводиться с осторожностью.
- Что такое ювенильный идиопатический артрит ?Ювенильный идиопатический артрит (ЮИА) — самая распространенная форма детского артрита неустановленной этиологии и одно из.
- Диагноз ювенильный идиопатический артритДля постановки диагноза ювенильный идиопатический артрит (ЮИА) у ребенка должны быть затронуты пять или больше.
- Постстрептококковый артрит — симптомы и лечениеОсобое место в диагностике ревматической лихорадки занимает постстрептококковый артрит.
- Что такое ювенильный идиопатический артрит ?Ювенильный идиопатический артрит — самая распространенная форма детского артрита и одно из частых хронических детских.
- Хронический артритХронический артрит это воспалительный процесс в суставах, продолжающийся более 3 месяцев. Особенно важно выявить пациента.
- Ювенильный артрит с энтезитомВ основе ювенильного артрита с энтезитом лежит тот факт, что у детей со спондилоартропатией признаки.
Прежде всего необходима этиотропная противовирусная терапия и гепатопротекторы для поддержки печени. Если изменения в суставах значительны — возможно прибегнуть к хондропротективной терапии для поддержания нормального функционирования суставного хряща и тканей — хорошо себч показап европейский препараат Алфлутоп, он уменьшает воспалительные изменения, купирует болевой синдром, что улучшает качество жизни пациента.
источник
Внепеченочные проявления при вирусных гепатитах В и С.
2. Внепеченочные проявления гепатита В………………………………….4
2.2. Хронический гломерулонефрит…………………………………. 5
2.6. Апластическая анемия……………………………………………. 7
3. Внепеченочные проявления гепатита С………………………………….7
3.1. Смешанная криоглобулинемия……………………………………10
3.2. Сухой кератоконъюнктивит……………………………………….11
3.3. Лимфопролиферативные заболевания……………………………11
3.6. Неврологические нарушения……………………………………..13
3.9. Поражение щитовидной железы………………………………. 15
3.10. Иммунная тромоцитопения………………………………………16
3.12. Поздняя кожная порфирия………………………………………. 18
3.13. Красный плоский лишай…………………………………………..18
3.14. Сахарный диабет 2 типа…………………………………………. 18
3.15. Нейромышечные проявления……………………………………..19
6. Список использованной литературы……………………………………23
Актуальность.
Болезни печени в настоящее время невозможно рассматривать изолированно, в отрыве от патологии других органов и систем. Сегодня в гепатологии понятие “трудный” больной во многом связано с внепеченочными проявлениями (изолированными или сочетанными) – суставным синдромом, многообразными кожными изменениями, цитопениями, нефритом. Очень часто системные внепеченочные проявления не только маскируют поражение печени, но и во многом определяют прогноз заболевания.
Системные проявления наблюдаются при острых и хронических заболеваниях печени различной этиологии (вирусной, аутоиммунной, токсической, наследственной), но наиболее часто – при инфекции вирусами гепатита В (HBV) и С (HCV). На основании клинико-морфологического обследования выделяют две группы механизмов развития внепеченочных поражений при инфицировании HBV и HCV:
Первая группа включает в себя патологию, вызванную преимущественно реакциями гиперчувствительности замедленного типа: поражение суставов, скелетных мышц, сердца (миокардит, перикардит), легких (фиброзирующий альвеолит, гранулематоз), синдром Шегрена.
Вторая группа – патология преимущественно иммунокомплексного генеза, главным образом, обусловленная васкулитами, которые развиваются из-за повреждающего действия иммунных комплексов, содержащих антигены вируса и антитела к ним.
В последние годы большое значение в развитии системных проявлений хронической HBV и HCV-инфекции придают также внепеченочной репликации вирусов гепатита и их прямому или опосредованному цитопатическому действию.
Внепеченочные проявления гепатита В.
Установление факта внепеченочной репликации HBV способствовало пониманию патогенеза многосистемности поражения при HBV-инфекции и рассмотрению вирусного гепатита не только как инфекционного заболевания печени, но и как системной генерализованной вирусной инфекции. Имеются сообщения о репликации HBV в мононуклеарных клетках крови, лимфатических узлах, селезенке, костном мозге, в тканях нелимфоидного происхождения – половых железах, щитовидной железе, почках, надпочечниках, поджелудочной железе и др. По данным литературы, внепеченочные поражения при хронической HBV-инфекции наблюдаются в 25 – 35% случаев.
Узелковый полиартериит.
Одно из наиболее тяжелых по течению и прогнозу внепеченочных проявлений HBV-инфекции представляет собой узелковый полиартериит (УП) – системный некротизирующий васкулит с преимущественным вовлечением артерий среднего и мелкого калибра, с образованием аневризм и вторичным поражением органов и систем.
Показано, что более чем 30-50% случаев УП обусловлены HBV инфекцией, при этом обнаруживают фибриноидный некроз стенок артерий (мелкого и среднего калибра), отложения HВsAg, комплексов HвeAg/anti-Hвe в стенках пораженных сосудов.
HBV-индуцированный УП может развиваться на фоне желтушной и безжелтушной форм острого и хронического гепатита. Однако описаны больные без явных признаков вовлечения печени в патологический процесс. В большинстве случаев, когда установлено время инфицирования HBV, симптомы УП появляются уже менее чем через 6 месяцев после заражения.
Для УП, сочетающегося с HBV инфекцией, по сравнению с HвsAg-отрицательным УП характерен более тяжелый прогноз, в клинической картине чаще наблюдаются злокачественная гипертония, инфаркты почек и орхиэпидидимит. У трети больных вирус-ассоциированным УП в момент установления диагноза выявляется морфологическая картина хронического гепатита умеренной или высокой степени активности. После спонтанной или медикаментозно-индуцированной сероконверсии е-антигена часто наблюдается ремиссия заболевания.
Поражение суставов.
Поражение суставов представляет собой одно из наиболее частых внепеченочных проявлений HBV-инфекции и наблюдается как при остром (в 20-35% случаев), так и хроническом (в 30% случаев) гепатите В. Артралгии или артриты, возникающие в продромальном периоде ОВГ, обычно исчезают при появлении желтухи.
Суставной синдром характеризуется внезапным началом, протекает либо по типу симметричного поражения, захватывающего все новые суставы, либо носит мигрирующий характер с преимущественным вовлечением мелких суставов кистей и коленных суставов. Отмечаются утренняя скованность и боли; обычно, эти симптомы наблюдаются в течение 1-3 недель. При остром гепатите клинические проявления со стороны суставов исчезают самостоятельно, без их деформации.
У больных хроническим гепатитом В артралгии и/или артриты могут наблюдаться постоянно или возникать через длительные промежутки времени, но при этом поражение суставов носит, как правило, доброкачественный и не прогрессирующий характер, с отсутствием эрозивно-деструктивных изменений. Тем не менее, известны случаи сочетания хронического гепатита В с типичными признаками ревматоидного артрита.
Поражение кожи.
Поражения кожи, наблюдаемые при остром и хроническом гепатите B, весьма вариабельны и включают макулярные, папуловезикулярные высыпания, крапивницу, петехии, пурпуру, узловатую эритему и др. При биопсии, в участках кожи обнаруживают периваскулярные скопления лимфоцитарных и плазматических клеток с фокальным некрозом (лейкоцитокластический васкулит). При иммунофлюоресцентном исследовании в сосудистой стенке выявляют иммунные комплексы, содержащие IgM, C3, фибрин и антигены вируса (HвsAg, HвeAg).
Болезнь Джанотти.
Клинически проявляется симметричной макулопапулезной эритематозной сыпью на ногах, ягодицах, предплечьях, сохраняющейся от 15 до 20 дней, иногда сопровождающейся лимфоаденопатией. В патогенезе патологического процесса играют роль циркулирующие иммунные комплексы, содержащие HBsAg и антитела к нему. У детей эта форма заболевания всегда строго ассоциируется с выявлением HBsAg в сыворотке крови.
Апластическая анемия.
В литературе описаны тяжелые случаи апластической анемии в ранней фазе ОГВ. Однако, результаты недавних исследований показали, что ассоциированная с гепатитом апластическая анемия развивается по иммунопатологическому механизму и патогенетически напрямую не связана с вирусом.
Смешанная криоглобулинемия.
К настоящему времени получены клинико-эпидемиологические и молекулярно-биологические доказательства роли HCV в качестве основного этиологического фактора (более 80% случаев) смешанной криоглобулинемии (СКГ), при этом у больных хроническим гепатитом С она выявляется почти в 40-50% случаев. У 5-10% больных хроническим гепатитом С с криоглобулинемией развиваются клинические проявления криоглобулинемического васкулита (поражения кожи, суставов, нервной системы, почек и др.).
HCV-индуцированная СКГ характеризуется широким спектром клинико-лабораторных проявлений, которые выявляются с различной частотой. Наиболее часто у больных наблюдается сочетание прогрессирующей общей слабости, кожной пурпуры и артрита или артралгий (триада Мельцера), очень часто в процесс вовлекаются почки, поражение которых и определяет, в целом, прогноз заболевания.
Сухой кератоконъюнктивит.
В настоящее время этиологическая роль HCV в развитии синдрома Шегрена (сухой кератоконъюктивит), который представляет собой аутоиммунное поражение экзокринных (в первую очередь слюнных и слезных) желез, убедительно продемонстрирована в целом ряде эпидемиологических (более высокая, чем в популяции частота обнаружения синдрома среди инфицированных HCV) и клинико-морфологических (тропизм HCV к слюнным железам) исследований.
Поражение почек.
Почки при HCV-ассоциированной СКГ вовлекаются в 35-60% случаев. Наиболее часто встречающийся тип гломерулонефрита – мезангиокапиллярный гломерулонефрит (МКГН). HCV РНК выявляется в сыворотке у 81% больных МКГН с СКГ против 25% случаев некриоглобулинемического МКГН. В почечной паренхиме экспрессируются рецепторы CD81 и SR-B1, позволяющие связаться вирусу гепатита С с поверхностью клетки и проникать внутрь посредством эндоцитоза. Поражение почек встречается в дебюте заболевания у 20% больных ХГС с криоглобулинемией. Среди больных ХГС с поражением почек в 25% случаев развивается протеинурия нефротического уровня (>3 г/сут), отеки, гипертензия и гипокомплементемия. В 30% случаев вовлечение почек начинается с остронефритического синдрома и ОПН (олигурическая в 5% случаев). В 55% случаев отмечается только легкая гематурия, протеинурия и начальные стадии почечной недостаточности. При биопсии почки выявляются иммунокомплексные депозиты IgG, IgM с активностью ревматоидного фактора (РФ) и С3 в капиллярной сети. Наиболее характерной гистологической картиной при световой микроскопии являются капиллярные тромбы, состоящие из преципитированных криоглобулинов.
Реже HCV вызывает фокальный сегментарный гломерулярный склероз, мембранозный или пролиферативный гломерулонефрит. Картина HCV-ассоциированного некриоглобулинемического МКГН не имеет существенных отличий по клиническим и морфологическим признакам от таковой при идиопатическом МКГН.
Клиническое течение болезни в 30% случаев медленное и функция почек остается сохранной многие годы. В 20% случаев болезнь характеризуется рецидивирующими эпизодами остронефритического синдрома. Менее чем в 15% случаев больным требуется диализ в связи с терминальной уремией.
Поражение легких.
Описано вовлечение сосудов легких (легочный васкулит) в рамках СКГ, проявляющееся легочными инфильтратами, альвеолярными кровотечениями. Имеется ряд наблюдений фиброзирующего альвеолита у больных ХГС, в том числе с морфологическим подтверждением и обнаружением HCV РНК в ткани легкого.
В некоторых регионах мира (Италия, Япония) частота выявления HCV инфекции среди больных фиброзирующим альвеолитом составила 13-14%, что значительно превысило частоту в соответствующих популяциях. Эти данные, а также результаты исследований бронхоальвеолярной жидкости у больных ХГС, выявляющих повышенное содержание лимфоцитов и эозинофилов, позволили обсуждать триггерную роль HCV в развитии альвеолита. В то же время в Англии частота HCV-инфекции у больных фиброзирующим альвеолитом оказалась невысокой (1,6%) и роль HCV в его патогенезе ставится под сомнение.
По данным клиники им. Е.М.Тареева частота поражения легких была выше у больных без СКГ (11,3%), чем с КГ (6,3%). В группе пациентов без КГ поражение легких характеризовалось развитием фиброзирующего альвеолита, у больных с КГ наблюдалась картина легочного васкулита.
Неврологические нарушения.
Нейропатия, связанная с СКГ отмечается у 7-90% больных ХГС, является в основном сенсорной и характеризуется онемением, жжением, покалыванием, ползаньем “мурашек”, зудом, чаще всего на руках и ногах, но могут проявляться на других участках тела. Неврологические поражения также были описаны у больных ХГС без СКГ. В основном, это мононейропатия, а также поражение периферической нервной системы, ассоциированное с узелковым полиартериитом, которое обычно представлено асимметричной полинейропатией с ведущими моторными нарушениями.
Поражение сердца.
Поражение миокарда, ассоциированное с HCV-инфекцией, может быть обусловлено:
· прямым (вирусным) воздействием на миокард;
· непрямым (иммунологическим) механизмом поражения и апоптозом клеток, обусловленным внутренними и внешними сигналами.
Имеются данные о прямом повреждающем действии на миокард core-белка вируса. Иммуноопосредованный путь повреждения миокарда осуществляется при участии В-клеток, Т-клеток и макрофагов.
Обнаружение (+) и (-)-цепей HCV РНК в ткани миокарда у больных миокардитом, дилатационной миокардиопатией и (+)-цепи HCV РНК в миокарде больных гипертрофической кардиомиопатией, сочетающихся с HCV-инфекцией, позволяют обсуждать возможность репликации HCV в ткани миокарда. Обсуждается также роль реакций клеточного иммунитета на тканевые антигены вируса и индуцированные им аутоантигены, роль иммунных комплексов в патогенезе поражения миокарда. Кроме того, не исключается роль цитокинов (продуцируемых активированными вирусом иммуноцитами), которые через механизм повышения продукции оксида азота вызывают отрицательный инотропизм и повреждение сердечной мышцы.
Васкулит – воспаление кровеносных и лимфатических сосудов, вызванное криоглобулинами – антиглобулинами, которые при понижении температуры осаждаются, а при повышении растворяются. Васкулит связан с криоглобулинемией, вызванной гепатитом С.
Симптомы включают розовую сыпь (изменение цвета кожи, вызванное кровотечением сосудов), мелкую красную сыпь, вызванную небольшими кровотечениями. Обычно эти симптомы проявляются в нижних конечностях. Другие симптомы включают лихорадку, зудящие рубцы, мышечную боль, увеличение лимфатических узлов, а также периферическую невропатию.
Лечение заключается в лечении основного заболевания (ВГС) интерфероном и рибавирином. Иногда васкулит может поражать и другие органы: почки, печень, сердце, центральную нервную систему, однако это встречается редко. Биопсия кожи показывает воспаление малых кровеносных сосудов.
Иммунная тромбоцитопения
Тромбоцитопения — наиболее частое поражение системы крови, наблюдающееся при HCV-инфекции и имеющее различные (иммунные и неиммунные) механизмы развития. В отсутствие гиперспленизма и сниженной продукции тромбопоэтина основными ее механизмами являются аутоиммунный (связанный с продукцией антитромбоцитарных аутоантител) и непосредственный ингибирующий эффект вируса, реплицирующегося в клетках-предшественниках гемопоэза, на продукцию тромбоцитов в костном мозге. В пользу наличия аутоиммунного механизма тромбоцитопении свидетельствуют: обнаружение антитромбоцитарных антител, наблюдения развития тяжелой тромбоцитопении вследствие терапии ИФН-α, эффективность терапии кортикостероида. Представляют интерес данные об эффективности микофенолата мофетила в лечении тяжелой аутоиммунной тромбоцитопении, развившейся на фоне терапии ИФН-α и резистентной к лечению кортикостероидами.
Показано, что у больных с HCV-ассоциированной иммунной тромбоцитопенией наблюдается менее тяжелое, чем при идиопатической тромбоцитопенической пурпуре, течение и более частая (свыше чем у 50% больных) резистентность к терапии кортикостероидами, что может свидетельствовать о значительной роли механизма ингибирования продукции тромбоцитов в костном мозге.
Описывались наблюдения ХГ С с эффективностью ПВТ в отношении тромбоцитопении, резистентной к предшествующей кортикостероидной терапии. Наблюдающаяся при HCV-инфекции иммунная тромбоцитопения требует тщательной оценки (в первую очередь, исключения аутоиммунного механизма) и избирательного подхода к лечению. Данные литературы свидетельствуют о возможности положительного эффекта ПВТ в отношении тромбоцитопении при применении ее в качестве терапии выбора, а не только в случаях резистентности к кортикостероидам.
Синдром Шегрена
Этиологическая роль HCV в поражении экзокринных (в первую очередь слюнных) желез и развитии синдрома Шегрена в настоящее время не вызывает сомнений на основании высокой частоты их поражения при HCV-инфекции, доказанного тропизма HCV к слюнным железам. Влияние ПВТ на течение HCV-ассоциированного синдрома Шегрена не изучено. Имеются единичные наблюдения развития или обострения синдрома Шегрена в связи с терапией ИФН-α. а также уменьшения проявлений синдрома Шегрена в результате успешной комбинированной ПВТ.
Поздняя кожная порфирия
В основе спорадической формы поздней кожной порфирии (ПКП) лежит снижение активности печеночного фермента уропорфириногендекарбоксилазы.
Частота HCV-инфекции составляет среди больных ПКП от 8% до 91% (в среднем около 50%). HCV, наряду с инфекцией HBV, синдромом перегрузки железом, этаноловым фактором, приемом эстрогенов, рассматривается в качестве одного из основных этиологических факторов этого заболевания, патогенез которого изучен недостаточно.
Красный плоский лишай.
Красный плоский лишай — заболевание кожи и слизистых оболочек (преимущественно полости рта) с иммуноопосредованным механизмом повреждения кератиноцитов. Более частое развитие этого заболевания (в среднем в 2 раза чаще, чем в популяции) среди больных ХГ С, обнаружение HCV RNA методом in situ гибридизации в эпителии слизистой оболочки больных красным плоским лишаем позволяет рассматривать HCV в качестве одного из этиологических факторов этого заболевания. Несмотря на единичные описания положительного эффекта ИФН-α в отношении проявлений красного плоского лишая, в большом числе исследований показано, что ИФН-α вызывает обострение или провоцирует развитие этого заболевания.
Сахарный диабет 2 типа
Сахарный диабет 2 типа встречается у больных ХГ С в 2-3 раза чаще, чем при хронических заболеваниях печени другой этиологии и в общей популяции. ПВТ сопровождается улучшением толерантности к глюкозе, что связывают с увеличением клиренса инсулина печенью, снижением уровня свободных жирных кислот. Применение ПВТ безопасно при сахарном диабете 2 типа (в отсутствие его тяжелых осложнений), однако известно, что у генетически предрасположенных лиц ИФН-α вызывает обострение или провоцирует развитие сахарного диабета 1 типа.
Течение вирусного гепатита у значительной части больных осложняется развитием внепеченочных поражений. Подтверждение роли вирусов гепатита в развитии внепеченочных синдромов и заболеваний обусловило принципиально новые подходы в их лечении с применением противовирусных препаратов. С внедрением новых эффективных противовирусных препаратов эта терапия, по-видимому, будет играть решающую роль в лечении больных ХГ с внепеченочными поражениями. В терапии тяжелых форм васкулита, аутоиммунных синдромов сохранит свое значение комбинация противовирусных препаратов с совершенствующейся патогенетической терапией.
Список использованной литературы.
1. Апросина З.Г. Хронический активный гепатит как системное заболевание. М.: Медицина, 2009г.- 190 с.
2. Игнатова Т.М., Апросина З.Г., Серов В.В. и др. Внепеченочные проявления хронической HCV-инфекции // Росс. мед. журнал.- 2001.- 2.- С. 13-18.
3. Серов, В.В., Апросина, З.Г. Хронический вирусный гепатит. — М.: Медицина, 2002. — 384 с.
4. Елисеев Ю.Ю. Инфекционные болезни. — М., 2008. — С. 440-446.
5. Логинов А.С., Блок Ю.Е. Хронические гепатиты и циррозы печени. — М.: Медицина, 1987., с.76-82.
Внепеченочные проявления при вирусных гепатитах В и С.
2. Внепеченочные проявления гепатита В………………………………….4
2.2. Хронический гломерулонефрит…………………………………. 5
2.6. Апластическая анемия……………………………………………. 7
3. Внепеченочные проявления гепатита С………………………………….7
3.1. Смешанная криоглобулинемия……………………………………10
3.2. Сухой кератоконъюнктивит……………………………………….11
3.3. Лимфопролиферативные заболевания……………………………11
3.6. Неврологические нарушения……………………………………..13
3.9. Поражение щитовидной железы………………………………. 15
3.10. Иммунная тромоцитопения………………………………………16
3.12. Поздняя кожная порфирия………………………………………. 18
3.13. Красный плоский лишай…………………………………………..18
3.14. Сахарный диабет 2 типа…………………………………………. 18
3.15. Нейромышечные проявления……………………………………..19
6. Список использованной литературы……………………………………23
Актуальность.
Болезни печени в настоящее время невозможно рассматривать изолированно, в отрыве от патологии других органов и систем. Сегодня в гепатологии понятие “трудный” больной во многом связано с внепеченочными проявлениями (изолированными или сочетанными) – суставным синдромом, многообразными кожными изменениями, цитопениями, нефритом. Очень часто системные внепеченочные проявления не только маскируют поражение печени, но и во многом определяют прогноз заболевания.
Системные проявления наблюдаются при острых и хронических заболеваниях печени различной этиологии (вирусной, аутоиммунной, токсической, наследственной), но наиболее часто – при инфекции вирусами гепатита В (HBV) и С (HCV). На основании клинико-морфологического обследования выделяют две группы механизмов развития внепеченочных поражений при инфицировании HBV и HCV:
Первая группа включает в себя патологию, вызванную преимущественно реакциями гиперчувствительности замедленного типа: поражение суставов, скелетных мышц, сердца (миокардит, перикардит), легких (фиброзирующий альвеолит, гранулематоз), синдром Шегрена.
Вторая группа – патология преимущественно иммунокомплексного генеза, главным образом, обусловленная васкулитами, которые развиваются из-за повреждающего действия иммунных комплексов, содержащих антигены вируса и антитела к ним.
В последние годы большое значение в развитии системных проявлений хронической HBV и HCV-инфекции придают также внепеченочной репликации вирусов гепатита и их прямому или опосредованному цитопатическому действию.
Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
источник

 ухудшение самочувствия;
ухудшение самочувствия;