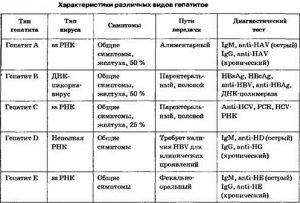
Гепатит, диагностика которого носит комплексный характер, представляет собой воспалительно-дистрофическое поражение печени. Чтобы поставить диагноз, врач изучает анамнез и осматривает пациента. Если жалобы указывают на возможное наличие болезни, доктор назначает лабораторные и дифференциальные методы обследования. Результаты анализов указывают на форму и вид патологии. Воспаление печени может быть острым или хроническим. Чаще всего диагностируются вирусные гепатиты A, B, C и D.
Воспалительно-дистрофическое поражение печени на начальной стадии проявляется слабо. Патология подтверждается анализами. Лабораторная диагностика вирусных гепатитов — наиболее достоверный метод обнаружения заболевания. Она позволяет выявить в организме специфические антигены и антитела, появившиеся вследствие активного размножения патогенных клеток. Благодаря лабораторным исследованиям становится известной генетическая информация вирусов.
Полимеразная цепная реакция (ПЦР) — основной вид лабораторной диагностики. Обследование направлено на изучение ДНК возбудителя заболевания. Благодаря ПЦР-диагностике выявляются маркеры (антигены и антитела) вирусов. Это дает возможность определить вид патологии.
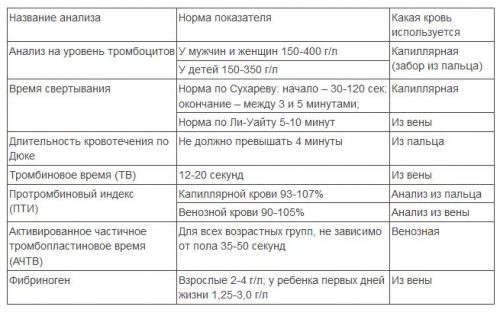
Обязательным является биохимический анализ крови. Он назначается всем пациентам, у которых есть подозрения на гепатит. При воспалении печени в крови меняется концентрация глобулинов, фибриногена, билирубина, альбумина, протромбина. В некоторых случаях врач отправляет пациента на коагулограмму. Анализ помогает определить гепатит С. Если свертываемость крови понижена или замедлена, существует вероятность воспалительного процесса в печени.
Современные методы лабораторного исследования включают в себя печеночные пробы, а именно:

Важно вовремя отличить вирусный гепатит от лучевого, аутоиммунного и токсического. Для этого проводится дифференциальная диагностика. На начальной стадии вирусное поражение печени часто путают с алкогольным. Заболевания развиваются по одинаковой схеме. При вирусном гепатите желтушность кожи и слизистых оболочек присутствует длительное время. Болевой и диспепсический синдромы практически отсутствуют. Температура тела повышается редко.
Общий анализ крови играет важную роль в дифференциальной диагностике. При алкогольном гепатите отмечается ярко выраженный лейкоцитоз. Нейтрофильная формула сдвигается влево. Вирусный гепатит А (B, C или D) характеризуется вялотекущим воспалительным процессом, поэтому количество лейкоцитов увеличивается незначительно.
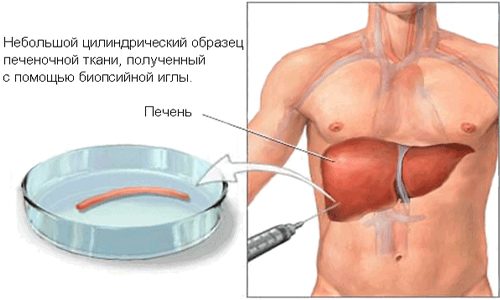
Дифференциальная диагностика включает в себя также биопсию печени. Цель процедуры — исследовать живую ткань органа. Во время биопсии определенное количество клеток печени забирается через иглу в шприц.
Если поражены преимущественно центральные зоны долек, это свидетельствует о наличии алкогольного поражения. Когда патологический процесс затрагивает в основном края, диагностируется вирусное воспаление печени.
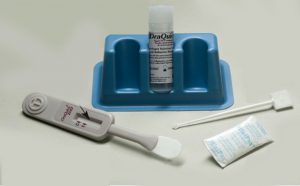
- герметично упакованной полоски;
- скарификатора для прокалывания пальца;
- химического вещества для разбавления крови;
- антисептической салфетки;
- пипетки для забора биологического материала.
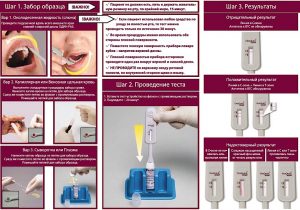
Тест на гепатит В, D, A и C можно сделать самостоятельно без посторонней помощи. Исследование включает в себя следующие этапы:
-
Обеззараживание кожи. Для этого используется антисептическая салфетка из набора.
- Прокол пальца. С помощью скарификатора целостность эпидермиса нарушается.
- Забор крови. Биологический материал помещается в специальную пипетку. Для исследования достаточно забрать 2–3 капли крови.
- Помещение биологического материала на тест-полоску. Туда же выливается химическое вещество.
- Ожидание результата. Если через 15 минут на тесте появляются 2 полоски, маркеры гепатита присутствуют. 1 черта свидетельствует о том, что человек здоров. Отсутствие обеих полосок — повод повторить тест.
Домашняя проверка на наличие гепатитов разных видов не отменяет консультации специалиста. Если результат теста положительный, человек должен срочно обратиться к доктору. Вирусное поражение печени быстро прогрессирует. При отсутствии лечения болезнь перерастает в цирроз или онкологию. Даже если с помощью экспресс-теста обнаружился гепатит B, диагностика в медицинском учреждении проводится повторно.
Эффективным диагностическим методом является УЗИ печени и других органов брюшной полости. Ультразвуковое исследование показывает состояние сосудов и ткани органа. На мониторе врач видит полную картину воспалительного процесса. Во время УЗИ определяются размер и плотность печени. При необходимости дополнительно исследуются желудок, поджелудочная железа. Недостатком УЗИ является то, что просматриваются исключительно поверхностные изменения органа.
Инструментальные методы диагностики гепатита включают в себя эластометрию. Это современный и наиболее эффективный способ в короткие сроки поставить верный диагноз. Эластометрия проводится с помощью фиброскана. Данный прибор вычисляет патологические изменения в тканях печени на клеточном уровне. Иногда данные эластометрии более информативны, чем результаты биопсии.
Часто у пациентов присутствуют сразу несколько типов вирусного гепатита. В связи с этим логично проводить комплексную поэтапную диагностику. Сначала врач опрашивает пациента и пальпирует органы брюшной полости. Затем назначаются анализы и инструментальные исследования. В сложных случаях доктор направляет пациента на биопсию. Терапия назначается с учетом результатов диагностики.
источник
Многие годы безуспешно боретесь с БОЛЯМИ в ПЕЧЕНИ?
Глава Института заболеваний печени: «Вы будете поражены, насколько просто можно вылечить печень просто принимая каждый день.
Современная, постоянно совершенствующаяся диагностика гепатитов и ВИЧ является одним из наиболее важных условий успешной борьбы с инфекционными болезнями.
- Чем отличается ВИЧ от гепатита?
- Признаки гепатита
- Признаки ВИЧ
- Диагностика
- Методы диагностики гепатита
- Диагностика ВИЧ
- Профилактика
В настоящее время традиционные подходы постепенно сменяются двумя более современными способами тестирования:
- Сложные автоматизированные анализаторы, позволяющие проводить исследования одного образца сразу по нескольким параметрам.
- Экспресс-методы, благодаря которым можно очень быстро получить информацию о состоянии здоровья пациента.
Гепатиты представляют большую опасность в связи с тем, что могут приводить к развитию рака, цирроза и прочих тяжелых патологий. Очень опасен гепатит в случаях осложнения другими заболеваниями, особенно — ВИЧ-инфекцией.
Именно поэтому больных гепатитом обязательно проверяют на наличие СПИДа.

Иммунодефицит относится к неизлечимым болезням, в то время как некоторые виды гепатита можно излечить полностью.
Гепатит протекает без каких-либо видимых симптомов, и особенно сложно выявить его у человека при коинфекции, то есть, в сочетании с ВИЧ.
Поэтому очень важно знать, какими симптомами проявляются эти заболевания и какие отличительные черты они имеют.

- Больной человек быстро утомляется.
- Возникает чувство тяжести в правом боку.
- Желтеют кожные покровы.
- Пропадает аппетит, больного периодически тошнит.
- Моча приобретает темный цвет.
- Беспокоит кожный зуд.

- Без видимых причин повышается температура.
- Беспокоят боли в суставах и горле, а также головные боли.
- Появляются кожные высыпания.
- Больной страдает от расстройства желудка, поноса.
- Припухают лимфоузлы.
- В полости рта образуются язвы, развивается молочница.
Считается, что ВГС может приводить к ускорению прогрессирования ВИЧ-инфекции и развитию СПИДа.
А ВИЧ-инфекция способствует усугублению течения печеночных заболеваний, вызванных гепатитами В и С, и может привести к развитию хронического гепатита или цирроза.

Первые симптомы заражения как гепатитом, так и ВИЧ-инфекцией, появляются не ранее, чем через полгода после проникновения вируса в организм.
Если имеет место коинфекция, то симптомы могут появиться раньше.
Для выявления гепатита применяются следующие методы:
- Лабораторные анализы мочи и крови.
- Биохимия.
- УЗИ внутренних органов.
- ПРЦ (метод, при котором исследуется генетический материал человека с целью выявления инфекции).
- HCV — проводится с целью выявления гепатита С.
- HBS — позволяет определить гепатит группы В.
В некоторых случаях может потребоваться и такой метод исследования, как биопсия печени. При выявлении гепатита необходимо вести постоянный мониторинг состояния пациента.
Метод исследования, позволяющий определить класс антитела, позволяет установить, как давно человек заразился инфекцией и как его иммунная система на неё реагирует.
Основным методом, который позволяет выявить ВИЧ, является анализ крови. При помощи ИФА (иммуноферментного анализа) определяется наличие или отсутствие в организме антител к ВИЧ, а также их количество.
Если пациенту устанавливается диагноз ВИЧ, то проводятся исследования, направленные на определение вирусной нагрузки. Кроме того, инфицированного человека врач направляет на комплексное обследование, которое включает следующие анализы:
- Кровь на наличие иммунодефицита.
- Моча (общая).
- Кровь на ТОРЧ-инфекционные заболевания наследственного характера.
- ЭКГ.
Кроме того, больному может потребоваться консультация у узких специалистов и УЗИ внутренних органов.
Очень важным условием предупреждения развития как ВИЧ, так и гепатита, является грамотная профилактика этих заболеваний, которая включает:
- Использование только личных предметов гигиены в быту.
- Применение механических мер контрацепции во время полового акта.
- Вакцинация против гепатита В.
- Профилактика наркомании.
- Ведение здорового образа жизни.
- Использование одноразовых медицинских инструментов.
- Тщательная обработка многоразовых медицинских инструментов.
- Регулярные обследования на наличие данных заболеваний.
Диагностика и тактика лечения острых и хронических вирусных заболеваний печени ведется согласно специального протокола, разработанного врачами-инфекционистами и утвержденного Министерством Здравоохранения.
В настоящее время все чаще происходит поражение печени различными заболеваниями. Причинами их появления становятся малоактивный образ жизни, неправильное питание, злоупотребление жирной пищей, длительный прием медикаментов и многое другое. Для того чтобы избежать обострения патологий, требуется своевременная диагностика печени.
Определение заболевания всегда начинается с самодиагностики, т.е. определения симптомов. Не стоит забывать, что некоторые недуги имеют схожую симптоматику.
Но все же при появлении следующих признаков следует обязательно обратиться к врачу:
- тяжесть и дискомфорт в правом подреберье;
- зуд кожи;
- изменение цвета кала;
- запор или диарея;
- желтушность кожных покровов и слизистых поверхностей.

Печеночные заболевания могут вызвать нарушения работы других внутренних органов, в результате чего появляется масса неспецифичных симптомов. Подобное влияние может быть произведено, например, на нервную систему, проявившись в виде бессонницы, ухудшения работоспособности и памяти.
С прогрессированием поражения гепатоцитов будут усиливаться и интоксикационные явления: повышенная температура, ухудшение аппетита, тошнота, рвотные позывы, боль в мышцах и т.д.
Важно! Особое внимание здоровью следует уделять при появлении этих признаков во время беременности.
Для постановки точного диагноза требуется соблюдение определенной последовательности исследований печени.
Стандартный порядок состоит из следующих процедур:
-
биохимический анализ крови;
- общие анализ мочи и крови;
- определение маркеров гепатитов вирусного характера;
- ультразвуковое исследование брюшной полости и печени;
- фибротест;
- МРТ и КТ;
- биопсия печени.
Помимо этих методик также иногда назначается рентген, сцинтиграфия (получение данных с помощью введенного радиоактивного вещества) и фибросканирование (назначается при фиброзе и является альтернативой биопсии).
В этих анализах насчитывается около 40 показателей, по которым можно определить внутреннее состояние организма.
На поражение печени могут указывать такие показатели, как билирубин, АЛТ, АСТ, ГГТП и щелочная фосфатаза:
-
АЛТ и АСТ являются ферментами клеток, наибольшее количество которых расположено в печени, скелетных мышцах и сердечной мускулатуре. Если клеточная мембрана повреждена, то они попадают в кровь. АЛТ может возрасти при развитии токсического или вирусного гепатита, инфаркта миокарда и рака печени, а АСТ – при хроническом и токсическом гепатите, сердечно-сосудистых болезнях. При проведении анализа обращается внимание не только на отдельные показатели этих ферментов, но и на их соотношение. Если уровень АЛТ выше уровня АСТ, то можно говорить о разрушении печеночных клеток.
- ГГТП – это фермент, который принимает участие в метаболизме аминокислот. Больше всего его содержится в печени и почках. Он наиболее чувствителен к желчному застою, поэтому рост его количества может являться следствием закупорки канала.
- Щелочная фосфатаза имеется во многих внутренних органах, но больше всего в печени, почках и желчных каналах. При увеличении показателя этого фермента можно говорить о закупорке протока или беременности.
-
Билирубин повышается при вирусных и токсических повреждениях печени, желчнокаменном заболевании, циррозе и гемолитической анемии. Не стоит забывать, что билирубин есть прямой и непрямой, поэтому для каждой патологии свойственно изменение одного из типов этого фермента. Для всех методов исследования анализов и тест-систем характерны свои нормы показателей.
Кроме того, с помощью биохимического анализа крови можно определить уровень альбумина, снижение которого характерно для нарушения функциональности печени, а также контролировать процессы углеводно-жирового обмена и свертываемость крови, которая изменяется при развитии хронических патологий.
Лабораторные анализы необходимы для определения изменений в организме, но все же неспецифичны при заболеваниях печени. Степень выраженности воспаления можно определить по изменению уровня лейкоцитов, а нарушение функциональности гепатоцитов – по снижению количества тромбоцитов.
Неспецифичным показателем изменений в человеческом организме является скорость оседания эритроцитов (СОЭ). Его норма составляет 2-15 мм/ч. Значительное повышение этого уровня может означать воспаление печени, инфекцию или беременность.
Норма показателей общего анализа крови для каждого пациента индивидуальна. На нее влияет пол и возраст человека, а также возможное наличие беременности. Во всех лабораториях должны быть таблицы с указанием нормальных значений.
Анализ мочи обязательно сдается при подозрении на развитие печеночных заболеваний. На их появление может указывать потемнение мочи. Лабораторный анализ позволит выявить в ней сахар, билирубин и повышенное количество уробилиногена, которые также являются признаками проблем с печенью.
Рост билирубина также сказывается на цвете каловых масс, поэтому при его изменении назначается еще и общий анализ кала.
Существует два типа антител – IgG и IgM. По первому типу можно определить были ли ранее перенесены инфекции, так как они сохраняются в организме на всю жизнь, а по второму диагностировать наличие острой формы заболевания.
Для лечения печени наши читатели успешно используют Leviron Duo. Видя, такую популярность этого средства мы решили предложить его и вашему вниманию.
Подробнее здесь…
Для выявления гепатита А необходимо определение антител IgM. Основным же показателем развития гепатита В является выявление ядерного антигена HBeAg, который означает серьезное заражение крови и размножение вируса в клетках печени.
Врач-гастроэнтеролог 1 категории Попов В.Р.: “Лекарства последнего поколения совмещают в себе плюсы фармакологических и натуральных средств: они действуют также быстро, как таблетки, но также безопасны, как средства народной медицины. Из самых популярных я выделил бы “Гепаклин” – это …”
Данный тип диагностики требует подготовки, поэтому пациентам необходимо знать с чего начать. За несколько дней до процедуры (3-4 дня) следует отказаться от всех продуктов, которые могут вызвать метеоризм. Также может потребоваться очистительная клизма.
С помощью УЗИ можно определить параметры желчного пузыря и печени, выявить поражения этих органов очагового или диффузного типа. Цирроз, гепатоз и гепатит в острой или хронической форме относятся к диффузным поражениям.
-
Гепатоз развивается из-за накопления жира в гепатоцитах. При прогрессировании болезни активная ткань печени заменяется соединительной, что становится причиной развития фиброза, который легко выявляется на УЗИ. Кроме того, при гепатозе происходит увеличение объемов обеих долей и округление их краев.
- УЗ-картина при гепатите получается неспецифичной, вне зависимости от его типа (токсический или вирусный). Основными признаками гепатита при данном типе обследования является рост объема печени и изменение её краев. В дальнейшем возможно появление гипоэхогенных участков.
- Для цирроза характерны косвенные и прямые признаки. Чтобы точно диагностировать заболевание необходимо выявить 3 прямых признака, или 2 прямых/2 косвенных. К прямым признакам относится изменение параметров печени (увеличение на ранней стадии и уменьшение при тяжелом поражении с атрофированием), неровный контур и округление краев долей, изменение плотности и ухудшение эластичности органа. К косвенным же симптомам цирроза относят рост размеров селезенки, увеличение селезеночной и воротной вен, а также асцит.
Очаговые поражения органов лучше и отчетливее видны, нежели диффузные. По ним можно легко выявить участки с увеличенной плотностью, которые свидетельствуют о появлении метастаз рака, гемангиомы, кальцификатов и аденом. А очаговые изменения, выявленные на УЗИ как зоны с низкой эхогенностью, могут означать развитие гематомы, саркомы, абсцесса или лимфомы.
УЗИ очень часто входит в состав комплексного обследования организма, так как эта процедура весьма информативна. Но если у больного не наблюдаются специфичные для того или иного заболевания симптомы, то установить диагноз только по этой методике невозможно.
В современной медицине применяется новая неинвазивная процедура обследования, называемая фибротестами. Эта методика является альтернативой биопсии. С ее помощью можно выявить некровоспалительный процесс и фиброз, а также их степень тяжести. Кроме того, фибротесты назначаются при гепатитах хронических форм.
В 2008 г. данная диагностика была признана во Франции достоверным исследованием для выявления прогрессирующего гепатита С. Так как она является безопасной, то ее могут назначить и беременным женщинам.
Полное обследование органа обязательно включает в себя МРТ и КТ. Эти неинвазивные методы диагностики позволяют получить полную картину печени, которая изображается в виде срезов через каждые 5-10 мм. С помощью контрастного вещества можно выявить очаговое поражение.
Данные методики позволяют диагностировать изменения нормальных показателей размеров органа и его строения. Но эти процедуры дорогостоящие и имеют противопоказания к проведению (установленный кардиостимулятор и период беременности).
Этот тип обследования печени применяется при малой информативности других методик. Но он является травматичным, поэтому назначается только при острой необходимости.
Биопсия подразделяется на несколько видов:
-
стандартная, при которой иглой берется маленький кусочек ткани органа;
- трансвенозная, заключающаяся в продвижении по сосудам венозного катетера к печени и взятии ее участка;
- лапароскопическая, основная идея которой заключается во введении в брюшную полость иглы для забора пробы и камеры для контроля за процессом.
Биопсия относится к последним дифференциальным диагностическим мерам, позволяющим полностью исследовать печень и ее пораженные участки.
В печени нет нервных рецепторов, поэтому даже тяжелые патологии не вызывают в ней болезненные ощущения. Именно поэтому диагностика имеет огромное значение. Только врач может определить, как обследовать печень и какие методики при этом применять. Множество типов обследования позволяет искать наиболее подходящую альтернативу при невозможности проведения той или иной диагностики.
- Печеночные показатели биохимического анализа крови
- Что такое эластометрия (фибросканирование) печени? Расшифровка результатов
- Как подготовиться к УЗИ желчного пузыря, желчегонный завтрак
- Анализы при холецистите — показатели крови, лабораторные и аппаратные методы диагностики
источник
За последнее время с проблемой вирусных гепатитов столкнулись миллионы людей. Эти опасные инфекционные заболевания получили колоссальную распространенность по всему миру.
Специалисты считают, что темпы распространения гепатита С уже превысили масштабы разрастания вируса иммунодефицита. На сегодняшний день в мире насчитывается 200 миллионов зараженных. Гепатит С признан более опасной болезнью, чем СПИД.
Гепатит С – это медленно-прогрессирующая инфекция. А наша печень – это уникальный орган, созданный с большим резервом. Поэтому, несмотря на постоянное воспаление, формирование фиброза (замещение здоровой ткани печени на рубцовую ткань), вызываемые вирусом, наша печень долгое время функционирует. Однако, определить хватит ли ее резерва на всю человеческую жизнь довольно сложно. Мы точно знаем, что у трети больных – не хватит! Даже если мы в течение нескольких лет наблюдаем мягкое, медленное течение инфекции, никаким образом не влияющее на самочувствие пациента, то это отнюдь не означает, что гепатит и дальше не будет прогрессировать, и что этот пациент защищен от развития цирроза и рака печени в ближайшем будущем.
Гепатит С – это инфекционно-воспалительное заболевание печени, обусловленное вирусом гепатита С (HCV), способное прогрессировать до цирроза печени или сочетающееся с циррозом печени.
Вирус гепатита С медики называют «ласковым убийцей» поскольку заболевание может годами никак не проявляться.
Выделено 7 различных видов (генотипов) вируса гепатита C. В России выявляются следующие генотипы HCV: 1 (1а, 1в), 2 (2а, 2в), 3а. По данным Европейской ассоциации по изучению печени, в промышленно развитых странах хроническая ВГС-инфекция является причиной 40% случаев терминальной стадии цирроза, 60% случаев гепатоцеллюлярной карциномы (ГЦК — одна из наиболее грозных злокачественных опухолей) и 30% случаев трансплантации печени.
Хроническая инфекция вирусом гепатита С характеризуется малосимптомным течением. Жалобы пациентов носят, как правило, неспецифический характер. Первой и нередко длительно единственной жалобой является общая слабость, повышенная утомляемость.
Клинические проявления поражения печени у больных с хроническим гепатитом С не выражены. Умеренное увеличение печени выявляется лишь у части больных. Клинические и лабораторные признаки могут полностью отсутствовать. Желтуха наблюдается редко, как правило, уже на стадии цирроза печени или гепатоцеллюлярной карциномы.
Пациент замечает, что он болен и обращается к врачу зачастую, когда цирроз печени сформирован или, по крайней мере, начал свое формирование. Радикальное лечение на этих стадиях гораздо менее эффективно и более сложно для врача и пациента, а подчас уже не представляется возможным.
В клинической практике лабораторная диагностика HCV-инфекции (гепатита С) включает определение в сыворотке крови вирусного генома (РНК HCV), ядерного антигена (cor Ag) и вирус-специфических антител (анти-HCV IgM, анти-HCV IgG, анти-cor IgG, анти-NS3 IgG, анти-NS4 IgG, анти-NS5 IgG).
Для диагностики HCV инфекции используются твердофазный иммуноферментный анализ (ИФА), а также полимеразная цепная реакция (PCR). Использование PCR позволяет подтвердить HCV инфекцию в спорных случаях и при отсутствии антител к HCV, встречающемся в 10% случаев.
Первые антитела удается обнаружить через 20-150 дней (в среднем через 50 дней) от момента заражения. По мере развития инфекционного процесса титры выявляемых антител увеличиваются. На фоне хронической инфекции антитела выявляются постоянно.
После того, как у пациента определяют наличие в сыворотке крови антител к вирусу гепатита С, проводят тест на вирусную нагрузку. Вирусную нагрузку определяют измеряя количество рибонуклеиновых кислот (РНК) вируса гепатита С в крови. Ранее вирусная нагрузка измерялась в количестве копий вируса. В настоящее время ее обычно измеряют в Международных Единицах на мл (МЕ/мл).*
Вирусная нагрузка бывает высокой и низкой.
- низкая: менее 2 миллионов копий или менее 800,000 МЕ/мл
- высокая: более 2 миллионов копий или более 800,000 МЕ/мл.
Использование инструментальных методов исследования печени (УЗИ брюшной полости, ФГС и радиоизотопное исследование) выявляют увеличение размеров печени с различной степенью уплотнения паренхимы, иногда – увеличение селезенки, наличие портальной гипертензии, варикозного расширения вен пищевода.
Основным методом диагностики хронического гепатита С является фибросканирование. Фибросканирование печени – это новейший метод исследования применяемый в гепатологии, который по простоте проведения идентичен обычному ультразвуковому исследованию (УЗИ), а по информативности в некоторых аспектах приближается к биопсии. Фибросканирование печени проводится для определения стадии фиброза и назначения противовирусного лечения.
Определение маркёров вирусных гепатитов осуществляется в клинической лаборатории ГБУ РО «КБ им. Н.А. Семашко». Фибросканирование печени проводится с помощью аппарата «Фиброскан» в ФГУ «Центральный НИИ эпидемиологии МЗРФ», г. Москва.
В течение длительного времени пациенты, страдающие хроническим гепатитом С, считались неизлечимыми. До начала 90х годов это действительно было так. Роль врача практически сводилась к наблюдению и констатации факта прогрессирования болезни, раннему выявлению жизнеопасных осложнений и назначению поддерживающей, симптоматической, терапии, направленной на уменьшение симптомов болезни. Эти лекарственные препараты не влияли на неуклонное прогрессирование болезни и формирование цирроза и рака печени.
Однако, в настоящее время ситуация изменилась кардинально!
Современная цель лечения гепатита С – это не коррекция осложнений, а полное излечение от вируса на ранних стадиях болезни. В последние годы появились новые поколения лекарственных препаратов и их комбинации, значительно повышающие эффективность противовирусной терапии.
Стандартной терапией для пациентов с любым генотипом ВГС-инфекции до 2011 года было использование пегилированного (длительно-действующего) интерферона Альфа 2а или интерферона альфа 2 в (Роферон А, Альтевир, Пегасис, ПЭГ Интрон) в комбинации с рибавирином.
Комбинированная противовирусная терапия, применяемая для лечения хронических вирусных гепатитов, преследует следующие цели:
- Исчезновение клинических симптомов;
- Уменьшение признаков воспаления в ткани печени;
- Нормализация уровня сывороточных трансаминаз;
- Замедление прогрессирования поражения печени и развитие гепатоцеллюлярной карциномы;
- Прекращение активной репликации вируса, отражением чего служит исчезновение серологических маркеров активной репликации.
Стандартные показания к началу противовирусной терапии.
- повышенная и нормальная активность трансаминаз в сыворотке крови,
- положительные результаты определения ВГС-РНК в сыворотке,
- гистологические признаки септального фиброза и (или) хронического гепатита (умеренной или выраженной активности)
Оптимальные условия для назначения интерферонов:
- небольшая продолжительность заболевания,
- отсутствие гистологических признаков цирроза печени или наличие фиброза только в портальных трактах при биопсии печени,
- молодой возраст больного (до 45 лет),
- женский пол
- низкий титр ВГС-РНК в сыворотке крови (менее 2 х 106 копий/мл)
- генотип, отличный от 1b,
- низкое содержание железа в ткани печени.
Выделяют три типа ответов на комбинированную противовирусную терапию:
1. полный или постоянный ответ — нормализация уровня АлАТ и отсутствие РНК ВГС в крови регистрируются на протяжении не менее 6 месяцев после завершения терапии;
2. непостоянный (транзиторный) ответ — нормальный уровень АлАТ и отсутствие РНК ВГС в крови регистрируется в конце лечения, однако после прекращения терапии может наступить обострение, что подтверждается биохимическими и вирусологическими показателями;
3. отсутствие ответа — нет изменений в уровне АлАТ и сохранение маркеров активной репликации вируса.
- Для больных с генотипом 2 и 3 без морфологических признаков цирроза печени курс лечения составляет 6 месяцев.
- для больных с генотипом 2 и 3 с морфологическими признаками цирроза печени или фиброза 3-й степени курс лечения составляет 12 месяцев.
- для больных с генотипом 1 курс лечения составляет 12 месяцев
У большинства пациентов с постоянным ответом на лечение интерфероном регистрируется подавление некрозо-воспалительного поражения печени. Кроме того, у части пациентов со стойким исчезновением РНК ВГС , но с повышенными показателями АлАТ, происходит уменьшение ткани печени.
Пациент должен понимать, что ответ на комбинированную противовирусную терапию в вашем конкретном случае будет совпадать с одним из 3 вышеперечисленных типов ответа на ПВТ и зависит от факторов, связанных как с вирусом-возбудителем (генотип, вирусная нагрузка), так и с особенностями Вашего организма. Поэтому мы заранее информируем Вас о возможных исходах комбинированной противовирусной терапии.
Побочные эффекты терапии:
В процессе терапии могут возникать побочные эффекты, которые подразделяются на ранние и поздние.
К ранним побочным эффектам интерферонотерапии относят гриппоподобный синдром (лихорадка, головная боль, познабливание, ощущение усталости и др.). Этот синдром обычно регистрируется через 4-5 часов после инъекции интерферона. Для уменьшения этих неблагоприятных проявлений рекомендуется введение препарата непосредственно перед ночным сном, а также прием парацетамола (0,5 — 1.0 г за 30-60 мин до инъекции интерферона). Обычно через 2-3 недели от начала терапии проявление гриппоподобного синдрома уменьшается или исчезает полностью.
Поздние побочные эффекты: снижение массы тела, выпадение волос, тромбоцитопения. лейкопения, анемия, изменение показателей функции печени, нарушение функции ЦНС: депрессия, возбуждение, агрессивность. Редко могут быть зарегистрированы такие осложнения, как судороги, острый психоз, бактериальные инфекции, аутоиммунные реакции, нарушения функции щитовидной железы и др.
В последнее время в России были одобрены два новых антивирусных препарата прямого действия из класса ингибиторов протеазы вируса гепатита С — Телапревир (TVR) и Боцепревир (BOC), которые предназначены для использования в комбинации с пегилированными интерферонами Альфа и рибавирином для лечения пациентов с хроническим гепатитом С, инфицированных 1 генотипом вируса – самым трудноизлечимым.
Индивидуализированная противовирусная терапия, подход к пациенту, с учетом особенностей вируса, позволяет добиться результата у абсолютного большинства пациентов, в том числе у пациентов с 1 генотипом вируса гепатита С. Путь может быть долгим, но ГЕПАТИТ С –ИЗЛЕЧИМОЕ ЗАБОЛЕВАНИЕ!
Стандартная противовирусная терапия может назначаться врачами-инфекционистами КИЗ территориальных поликлиник и врачами инфекционных стационаров, где впервые был установлен диагноз.
Учитывая разнообразие возможных побочных эффектов комбинированной противовирусной терапии, пациенту будет необходимо в течение всего курса терапии и 48 недель после окончания терапии наблюдаться у врача – инфекциониста в поликлинике по месту жительства.
Коррекция противовирусного лечения, мониторинг эффективности необходимо осуществлять под контролем врачей гепатологического центра ГБУ РО «КБ имени Н.А. Семашко».
источник
МЕТОДЫ ДИАГНОСТИКИ ВИРУСНЫХ ГЕПАТИТОВ
Первичное обследование на заболевание гепатитом в независимости от его разновидности начинается со сдачи анализов крови и мочи и общего осмотра. При анализе мочи определяют изменение ее цвета, при анализе крови – количество лейкоцитов, лимфоцитов и СОЭ, а при осмотре врач выявляет наличие желтухи, увеличена ли и уплотнена ли печень и повышена ли болевая чувствительность ее нижнего края.
При подозрении на гепатит следуют дальнейшие обследования. Для оценки степени поражения печени и определения, связана ли желтуха с воспалением печени, необходимы биохимические анализы крови и мочи. Анализы определяют уровень желчного пигмента билирубина, образующегося в печени в результате распада эритроцитов. При гепатитах концентрация свободного и связанного билирубина в крови резко повышается, а когда уровень билирубина превышает 200–400 мг/л и при этом есть признаки желтухи, то это верный признак гепатита.
Другим показателем, говорящим о тяжести течения вирусного гепатита, является изменение протромбинового индекса. Его определяют с помощью тимоловой пробы. Еще можно с помощью белков, синтезируемых печенью, провести специальные тесты на свертываемость крови. Здесь диагнозом служит положительная реакция мочи на уробилин.
Отдельным видом диагностики вирусных гепатитов являются серологические методы. С их помощью обнаруживают антитела и антигены в крови и других жидкостях организма. Одним из таких методов является иммуноферментный анализ (ИФА).
Иммуноферментный анализ является универсальным, широко используемым на практике методом диагностики гепатита. Он предназначен для выявления вирусных белков, или антигенов, вырабатываемых иммунной системой после попадания вирусов в организм человека. Наличие этих белков позволяет поставить точный диагноз, оценить характер заболевания и помочь врачу выбрать правильный способ лечения.
Для выявления антигенов существуют так называемые тест-системы, выпускаемые в виде полистироловых планшетов с 96 лунками. На дно лунок заранее сорбируются антитела к тому или иному антигену возбудителя гепатита. На первом этапе в каждую лунку добавляют, например, сыворотку крови больного в разных концентрациях, содержащую пока не определенный вирусный антиген. Если этот антиген совпал с антителом, то происходит их связывание. Для выявления результата в лунки затем добавляют специальный фермент, который окрашивает раствор в желто-коричневый цвет. После этого планшет промывают, и из тех лунок, где антиген был полностью связан с антителом и уже не сможет взаимодействовать с добавляемым соединением, он легко смывается. Так выясняют, антиген какого вируса содержится в крови больного.
К достоинствам этого метода можно отнести простоту методики, высокую чувствительность и возможность обследования одновременно большого количества пациентов. В качестве недостатков можно отметить необходимость наличия специального дорогостоящего оборудования и квалифицированного персонала.
Вторым серологическим методом диагностики вирусных гепатитов является метод полимеразной цепной реакции (ПЦР). С его помощью можно найти в организме нуклеиновые кислоты ДНК и РНК, а затем провести прямую идентификацию инфекционного агента или генетической мутации в любой биологической среде. С точки зрения клинической медицины выявление в исследуемом объекте нуклеиновой кислоты равнозначно обнаружению там возбудителя болезни. Теоретически ПЦР позволяет обнаружить даже одну искомую молекулу нуклеиновой кислоты среди миллионов других. Метод ПЦР анализа также дает возможность оценить качество лечения путем контроля за наличием или отсутствием возбудителя.
В основе метода полимеразной цепной реакции лежит способность ДНК и РНК к воспроизводству. В случае подозрения на вирусный гепатит у больного берут образец ткани и сначала выделяют нуклеиновую кислоту, которая имеет свою уникальную последовательность нуклеотидов, из которых она состоит. Для каждого возбудителя болезни составлена своеобразная тестовая карта. Кроме этого, для проведения ПЦР нужны праймеры – короткие участки ДНК, соответствующие участкам выделенной из образца нуклеиновой кислоты. Праймеры обеспечивают возможность и специфичность реакции. Еще нужны специальные ферменты, или полимеразы, без помощи которых реакция невозможна.
ПЦР-анализы проводят в несколько этапов, по окончании которых получаются точные копии распознаваемого участка матричной нуклеиновой кислоты. Количество этапов составляет от 30 до 50 в соответствии с заданной программой. Конечный продукт реакции распознается с помощью электрофореза, проводимого в геле.
Для каждого вида возбудителя вирусных гепатитов разработаны системы тестов, но лучше всего метод ПЦР диагностирует вирусы гепатитов В, С и D, и это вообще единственная возможность обнаружить вирус гепатита G. Для диагностики гепатита В метод ПЦР тоже важен, так как среди множества разновидностей этого вируса встречаются такие, которые не определяются другими серологическими тестами. Что же касается гепатита С, то для его обнаружения применение ПЦР стало поистине находкой. Метод позволяет выявлять вирус гепатита С на самом раннем этапе заболевания. Уже через неделю после инфицирования вирус гепатита С можно обнаружить в сыворотке крови. Также можно распознать и генетические разновидности этого вируса, что позволит врачу назначить правильное лечение.
Кроме перечисленных методов диагностики вирусных гепатитов для выявления заболевания используют все методы исследования печени, описанные выше. В частности, ультразвуковое обследование органов брюшной полости и биопсию.
источник
Повсеместное внедрение диагностики вирусов гепатитов В (HBV) и С (HCV) открыло грандиозную картину: HBV инфицировано 300–350 млн человек в мире, носителями HCV являются, по разным данным, от 170 до 500 млн.
Повсеместное внедрение диагностики вирусов гепатитов В (HBV) и С (HCV) открыло грандиозную картину: HBV инфицировано 300–350 млн человек в мире, носителями HCV являются, по разным данным, от 170 до 500 млн. Следовательно, по меньшей мере каждый десятый житель Земли инфицирован одним из этих вирусов.
Только в США зарегистрировано 4 млн инфицированных вирусом гепатита С; из них ежегодно умирает 8–10 тыс. больных. В Европе число инфицированных HCV составляет 2% от всей популяции (5 млн в Западной Европе), в России — от 3 до 4 млн человек. С 1961 г. в США и Западной Европе хронические вирусные гепатиты (ХВГ) и циррозы печени (ЦП) как причина смерти переместились с 10-го на 5-е место [1, 2]. ВОЗ прогнозирует, что к 2010 г. показатель заболеваемости может утроиться.
В настоящее время известны гепатиты, вызываемые вирусами A, B, C, D, E, F, G, TTV, SENV. Они имеют разные пути проникновения в организм, свое «клиническое лицо» и исходы [3].
В мире и в нашей стране ведущее место среди всех ХВГ занимают гепатиты В и С. Именно они характеризуются непрерывным ростом заболеваемости и наиболее частым развитием ЦП и рака печени.
Лечение вирусных гепатитов — проблема трудная и неоднозначная. Имеющийся арсенал лекарственных средств базируется на гепатопротекторах, действие которых не является этиотропным. Ряд из них имеют побочные эффекты и достаточно высокую стоимость. Этиотропная противовирусная терапия остается дорогой и малодоступной для большинства пациентов. Это делает актуальным поиск новых эффективных и недорогих средств для лечения ХВГ.
Начиная с 1970–80-х гг. происходил поиск средств этиотропной терапии вирусных гепатитов [1, 7, 30, 31].
Интерфероны. Интерфероны (ИФН) — группа гликопротеинов, действие которых связано с противовирусным эффектом — активацией (депрессией) клеточных генов, в результате чего синтезируются белки, ингибирующие синтез вирусной ДНК (РНК), а также иммуномодулирующим эффектом — усилением экспрессии антигенов HLA на клеточных мембранах и увеличением активности цитотоксических Т-клеток и естественных киллеров.
К 1 типу ИФН, действующему как ингибиторы репликации вируса, относятся 22 различных подтипа ИФН-α и 1 подтип ИФН-β. К 2 типу, проявляющему иммуномодуляторную активность, относятся ИФН-γ.
Существует 3 класса ИФН: ИФН-α, ИФН-β, ИФН-γ. К ИФН естественного происхождения относятся лимфобластоидный и лейкоцитарный ИФН (ИФН-α), синтезируемые соответственно стимулированными моноцитами и В-лимфоцитами человека, фибробластный ИФН (ИФН-β) и Т-лимфоцитарный ИФН (ИФН-γ). К искусственно синтезируемым ИФН относится рекомбинантный ИФН-a, получаемый по молекулярной технологии [27].
Среди рекомбинантных ИФН: ИФН-α-2а (Роферон-А), ИФН-α-2b (Интрон А, Реаферон), ИФН-α-2с, а также лимфобластоидный ИФН-α (Вэллферон). В последние годы в клинике стали использоваться препараты рекомбинантных ИФН-α пролонгированного действия — PEG (конъюгированные ИФН-α), производимые в виде препаратов Пегасис и ПегИнтрон. Пегасис — это препарат ИФН-α-2а, соединенный с молекулой полиэтиленгликоля (ПЕГ) с молекулярной массой 40 кДа, а ПегИнтрон — препарат ИФН-α-2-b, объединенный с молекулой ПЕГ с массой 12 кДа. Эти препараты обладают наибольшей противовирусной активностью [7].
Рекомбинантные ИФН-α являются в настоящее время основой лечения ХВГ В и С. Основным показанием для их назначения стало наличие репликации вируса, маркерами которой в крови являются: при HBV-инфекции — HBeAg, DNA HBV, при HCV-инфекции — RNA HCV.
Благоприятными прогностическими факторами у больных ХВГ B и C при проведении ИФН-терапии являются: длительность заболевания менее 5 лет, возраст менее 45 лет, отсутствие гистологических признаков ЦП, низкий уровень аланинаминотрасферазы (АЛТ), аспартаминотрансферазы (АСТ) (не более 3-х норм), низкое содержание железа в ткани печени (менее 650 мкг/г нативной массы) и нормальные цифры сывороточного железа (17–22 мкмоль/л) [1, 7, 8, 9, 10].
Схемы применения короткодействующих препаратов ИФН-α можно разделить на три основных режима.
Режим высоких доз — по 10 млн МЕ в/м ежедневно до получения нормальных трансаминаз, затем по 3 млн МЕ 3 раза в нед в течение еще 6 мес.
Режим средних доз — по 5 млн МЕ в/м 3 раза в нед в течение 2–3 мес, затем по 3 млн МЕ 3 раза в неделю в течение 4–12 мес.
Режим малых доз — по 3 млн МЕ в/м 3 раза в нед в течение 3–6 мес.
Режим высоких доз чаще применяется при острых вирусных гепатитах. При ХВГ лечение начинают с режима средних доз; при плохой переносимости ИФН переходят на режим малых доз [8, 9].
Оценка эффективности ИФН-терапии проводится по нормализации уровня трансаминаз (АЛТ, АСТ), устранению маркеров репликации вирусов гепатитов В и С из крови и выраженности положительной динамики морфологических изменений ткани печени после курса лечения [6, 7, 11, 12].
На фоне терапии ИФН-α могут наблюдаться побочные эффекты, такие как гриппоподобный синдром, развивающийся на 1–2 нед лечения. Он может быть уменьшен переносом инъекций ИФН-α на вечерние часы. Кроме того, могут отмечаться диспепсические явления, инсомния, похудание, слабость, лейко-, тромбоцитопения и гипертиреоз [13]. Большинство побочных эффектов являются дозозависимыми и могут быть устранены при подборе дозы [1, 8, 9].
Эффективность монотерапии короткодействующими ИФН-α невысока. Только у трети больных с ХВГ В и С достигается устойчивый вирусологический ответ на лечение ИФН-α (отсутствие репликации вируса, нормальный уровень АЛТ и АСТ через 6 мес после окончания терапии). В связи с этим большинство специалистов считает, что лечение ХВГ В и С не должно осуществляться одними только ИФН [7, 9, 12, 14, 15, 29, 33]. Очевидна необходимость одновременного использования разнонаправленных препаратов, хотя интерфероны продолжают оставаться базисным компонентом лечения.
С началом применения в клинической практике ПЕГ-ИФН-α открылись возможности для повышения эффективности лечения. Принципиальное преимущество ПЕГ-ИФН-α перед короткодействующими интерферонами — возможность их использования при ЦП, поскольку данные препараты не требуют для выведения высокосохранной печеночной перфузии [16]. Пролонгированные ИФН-α обладают меньшей антигенностью и могут применяться у больных с заболеваниями сердца, почек и гемоглобинопатиями [17]. Использование ПЕГ-ИФН-α удобно и тем, что инъекции вводятся гораздо реже. Введение осуществляется подкожно в дозе 1,5 мкг/кг массы тела всего 1 раз в нед в течение 6–12 мес.
Публикации, отражающие эффективность ПегИнтрона в сочетании с Ребетолом, говорят о высокой противовирусной активности этой комбинации в лечении ХВГ С. Еще более обнадеживают результаты, полученные при использовании препарата «Пегасис» [7].
В последние годы в лечении ХВГ привлекает внимание также отечественный препарат интерферона Виферон. Это комплексный препарат противовирусного и иммуномодулирующего действия. В его состав входят генно-инженерный интерферон-альфа-2, витамины Е и С, усиливающие противовирусный эффект и активизирующие систему ИФН.
Виферон стимулирует Т-клеточный иммунитет, восстанавливает иммунорегуляторный индекс, повышает активность естественных киллерных клеток, приводит к возрастанию фракции цитотоксических Т-лимфоцитов, активирует фагоцитоз.
В комплексной терапии ХВГ В и С у взрослых назначают Виферон по 1 млн МЕ или по 3 млн МЕ (по 1 суппозиторию утром и 1 суппозиторию вечером) через 12 ч трижды в неделю через день в течение 6–12 мес.
Если после достижения первичной ремиссии возникает обострение заболевания, назначают повторный курс лечения Вифероном продолжительностью 6 мес. При отсутствии ремиссии по окончании курса лечения дальнейшее применение препарата нецелесообразно.
Перспективным следует считать применение комбинированных схем терапии — одновременное назначение ИФН + индуктора ИФН (например, Виферон + Амиксин) с целью предупреждения ускользания ремиссии.
Аналоги нуклеозидов. Аналоги нуклеозидов — это группа средств, проявляющих активность в отношении генома вирусов гепатита.
Ламивудин (Зеффикс, Эпивир ТриТиСи) является препаратом, ингибирующим РНК-зависимую обратную транскриптазу, необходимую для транскрипции прегенома HBV-РНК в HBV-ДНК. Ламивудин обладает выраженной противовирусной активностью в отношении HBV [1, 18]. Лечение ламивудином показано больным с репликацией вируса гепатита В (наличие в крови НВеАg и ДНК HBV), при повышении активности АЛТ в 3 и более раз и изменении гистологической картины печени, а также у пациентов в стадии декомпенсации хронического гепатита и ЦП с сохраняющейся репликацией HBV [9, 18]. Взрослым ламивудин назначается в дозе 100–300 мг в день в течение как минимум 12 нед.
Критериями эффективности терапии ламивудином служат снижение концентрации HBV ДНК, исчезновение HBe-Ag и появление anti-HВe, нормализация АЛТ, уменьшение прогрессирования фиброза в печени и замедление перехода в цирроз по данным биопсии [18, 28].
Монотерапия ламивудином переносится хорошо. Побочные эффекты (недомогание, головная боль, тошнота, повышение температуры, лейкопения, депрессивный синдром) наблюдаются у 1–5% больных [18].
Терапия ламивудином позволяет через 1–3 мес лечения добиться подавления репликации и снижения уровня HBV ДНК до минимальных значений [19]. Длительное (в течение года и более) применение ламивудина приводит к исчезновению из крови ДНК HBV с нормализацией АЛТ и улучшению гистологической картины печени у 65% больных [20]. У остальных 35% больных после завершения годичного и даже трехгодичного курса терапии уровень HBV ДНК в крови вновь повышается.
При длительной терапии ламивудином развивается резистентный к препарату штамм вируса с мутациями в YMDD-зоне [19], вероятность появления которого после 1 года терапии составляет 24%, а после 3-х лет лечения — 49% [18]. Больным ХВГ В с мутацией в YMDD-зоне, резистентным к терапии ламивудином, дополнительно назначают Гепсеру (адефовира дипивоксил), который способен ингибировать обратную транскриптазу мутировавшего вируса (только в комбинации с ламивудином). У больных ХВГ B с «мутировавшим» штаммом вируса испытываются комбинации с клевудином, энтекавиром, эмрицитабином. Все эти препараты также относятся к группе аналогов нуклеозидов [21].
Монотерапия ламивудином наиболее эффективна у больных с HBeAg-негативным вариантом ХВГ В. Тактика же лечения HBeAg-позитивного варианта HBV-инфекции требует комбинации ламивудина с ИФН [22].
Рибавирин (Копегус, Рeбетол, Веро-рибавирин) — аналог гуанозина, который вызывает торможение РНК-полимеразы вируса и непрямое торможение синтеза протеина. Доза препарата составляет 800–1200 мг/сут. Препарат принимается дважды в сутки внутрь в течение 12–48 нед. Среди его побочных эффектов отмечаются головокружение, тошнота, депрессия, гемолиз эритроцитов. Даже длительная монотерапия рибавирином не приводит к элиминации вируса. Поэтому рибавирин применяется только в комбинациии с ИФН-α, что значительно усиливает противовирусный эффект, особенно у больных, не ответивших на монотерапию ИФН, а также у больных, у которых не удалось добиться стойкого эффекта при лечении ИФН [14, 15, 23]. Схема комбинированного применения Интрона А в сочетании с Ребетолом в течение ряда лет являлась официально лицензированной схемой лечения ХВГ С [7]. Интрон А назначается в дозе 3 млн МЕ 3 раза в нед п/к или в/м в течение 24 нед, Ребетол — в дозе 800–1200 мг/сут per os в два приема также в течение 24 нед. После курса лечения у 40% больных стойко исчезала HCV РNA, снижалась активность АЛТ и уменьшался воспалительно-некротический процесс по данным биопсии печени [1].
Комбинированная терапия ПегИнтроном в дозе 1,5 мкг/кг п/к 1 раз в нед в сочетании с Ребетолом 800–1200 мг/сут per os ежедневно в течение 6–12 мес является «золотым стандартом» в лечении ХВГ С [17]. У пролеченных по такой схеме пациентов устойчивый вирусологический ответ наблюдался в 72% случаев, причем в группе HCV 2-го и 3-го генотипов он достигал 94%, а в группе с 1b-генотипом, распространенным в России, значительно возрастал и достигал 63% [16].
Адефовира дипивоксил относится к группе аналогов нуклеозидов, является аналогом аденозина монофосфата (АМФ). Лечение препаратом в дозе 10 мг/сут приводит к достоверному улучшению гистологической картины печени у HBeAg-позитивных больных в сравнении с плацебо. Снижение уровня HBV DNA, скорость HВeAg-сероконверсии, нормализация АЛТ оказываются значительно выше в основной группе, чем в группе плацебо. Препарат эффективен и в лечении HВeAg-негативных больных. Важным качеством адефовира является его способность подавлять репликацию HBV DNA у ламивудин-резистентных мутантов.
Препарат в последние годы проходит клиническую апробацию как в виде монотерапии, так и в сочетании с ламивудином. Наибольший интерес вызывает последняя комбинация, хотя безопасность длительного курса адефовира дипивоксила еще предстоит уточнить.
Для пациентов с сочетанной HBV + HCV-инфекцией разработаны схемы лечения, включающие применение ПЕГ-ИФН-a в течение года и комбинацию с ламивудином в течение 6 мес, а затем рибавирина на тот же срок. При отсутствии стойкого эффекта возможно продление данной комбинированной терапии еще на 24–48 нед.
Индукторы ИФН (интерфероногены). Индукторы ИФН являются препаратами с комбинированным эффектом: этиотропным противовирусным и иммуномодулирующим, т. е. корригирующим нарушения иммунной системы. Они представляют собой семейство высоко- и низкомолекулярных природных и синтетических соединений, объединенных способностью вызывать в организме образование эндогенного ИФН. Большинство препаратов индуцируют синтез смеси α- и β-интерферонов в разных пропорциях; некоторые (Амиксин) индуцируют синтез интерферонов α, β и γ. Комбинированное применение с другими препаратами приводит к потенцированию их эффектов [24].
Индукторы интерферонов имеют определенные преимущества перед рекомбинантными интерферонами:
- индукторы ИФН не обладают антигенностью;
- рекомбинантные ИФН стимулируют цитотоксичность иммуноцитов и вызывают экспрессию молекул HLA в тех популяциях клеток, которые не экспрессируют эти антигены. Это может быть причиной усугубления аутоиммунного ответа организма;
- некоторые индукторы ИФН (Амиксин) обладают способностью запускать синтез интерферона в определенных популяциях клеток, что имеет преимущество перед поликлональной стимуляцией иммуноцитов рекомбинантными ИФН;
- рекомбинантные ИФН являются препаратами a-ИФН, что ограничивает их противовирусные свойства, т. к. для эффективной противовирусной защиты необходимо наличие всех трех классов ИФН, синтез которых вызывается индукторами интерфероногенеза;
- индукторы ИФН обладают собственными иммуномодулирующими свойствами.
Индукторы ИФН, применяющиеся для лечения ХВГ:
А — синтетические соединения:
- низкомолекулярные (ароматические) углеводы: флуореноны, акриданоны;
- полимеры (двуспиральные РНК) — поли(А) поли(У), поли(Г) поли(Ц);
- низкомолекулярные полифенолы (производные госсипола).
Амиксин — наиболее известный препарат, является первым пероральным индуктором эндогенных ИФН α, β, γ. Он наиболее полно сочетает в себе преимущества индукторов ИФН. Являясь поликлональным стимулятором, Амиксин вызывает синтез ИФН 1 и 2 типов в Т-лимфоцитах, энтероцитах кишечника, гепатоцитах, клетках мозга. Важной особенностью Амиксина является вызываемая им длительная циркуляция в организме терапевтической концентрации ИФН (50–100 ЕД/мл в сыворотке крови) [25]. Препарат выпускается в таблетках по 125 мг, по 6 или 10 таблеток в упаковке.
Для лечения ХВГ В, С, В + С Амиксин назначается по схеме: в 1-й день — 2 таблетки по 125 мг, потом через каждые 48 ч по 125 мг — начальная фаза лечения (20 таблеток), затем следует фаза продолжения — по 125 мг 1 раз в нед на 10–20 нед (при HBV общее количество составляет 30 таблеток, при HСV и при HBV + HСV — 40 таблеток) [25].
Иммуномодуляторы. Интерлейкин-2 (ИЛ-2) представляет собой гликопротеин, индуцирующий пролиферацию и дифференцировку Т-лимфоцитов и NK-клеток. ИЛ-2 активизирует функциональную активность Т-хелперов, продуцирующих ИФН-γ. Усиление с помощью ИЛ-2 продукции ИФН-α ведет к активации макрофагов.
Интерлейкин-12 (ИЛ-12) активирует ТНJ-лимфоциты и NK-клетки, а также индуцирует выработку ИФН-α и ИЛ-2.
Для лечения ХВГ B ИЛ-2 и ИЛ-12 назначаются в дозе 500 мкг п/к 2–5 раз в нед на 4–6 мес, что ингибирует репликацию ДНК НВV без уничтожения инфицированных гепатоцитов. Биохимическая ремиссия достигается в 20% случаев. Однако после окончания лечения уровень АЛТ вновь повышается и нормальные показатели сохраняются лишь у 8% больных [1].
Рекомбинантный дрожжевой ИЛ-2 человека — Ронколейкин, является полным аналогом ИЛ-2 и обладает тем же спектром активности. Для лечения ХВГ С Ронколейкин вводят по 500000 МЕ в/в капельно 2–3 раза в нед в течение 8 нед. После курса монотерапии Ронколейкином нормальные биохимические показатели и негативная ПЦР наблюдаются у 40% пациентов [26].
Глицирризин — оказывает выраженный иммуномодулирующий эффект, характеризующийся усилением Т-клеточной активности, стимуляцией и продукцией эндогенного γ-интерферона, повышением фагоцитоза и антителообразования. Применяется в лечении хронического репликативного гепатита В. В первый месяц лечения препарат назначают по 40 мл 3 раза в нед, затем 2 раза в нед. Терапию глицирризином продолжают не менее 1 года, после чего назначается ИФН. Такая адъювантная терапия потенцирует последующий эффект интерферонотерапии у 60% больных с сероконверсией HBeAg, а у части больных наблюдается исчезновение ДНК HBV [1].
При ХВГ С представляется обоснованным назначение отечественного комплексного препарата Фосфоглив, содержащего фосфатидилхолин и тринатриевую соль глицирризиновой кислоты, обладающего не только гепатопротекторными свойствами, но и противовирусной активностью.
Амантадин — препарат, ранее применявшийся для лечения гриппа. Препарат использовался в качестве монотерапии при ХВГ С в дозе 1000 мг 2 раза в день в течение 6 мес. У 30% больных к концу лечения была достигнута биохимическая ремиссия, более чем у 50% снизилась виремия [10]. В ряде европейских стран (Австрия, Германия) официально зарегистрированы схемы «тройной» терапии ХВГ С, в которой наряду с ИФН-α и рибавирином используются препараты амантадиновой группы (Амантадин, Ремантадин, Симметрель, Мидантан) 200 мг/сут. Частота вирусологического ответа при таком режиме лечения у пациентов с не 1b-генотипом вируса составляет 60–70% и 50% — у больных с 1b-генотипом вируса, не ответивших до этого на монотерапию ИФН-a или с рецидивом после ее отмены [7].
Тимозин-α — ацетилированный полипептид, состоящий из 28 аминокислот, способный модифицировать иммунный ответ организма. Основной механизм действия, определяющий его эффективность в лечении гепатита В, — это влияние на рост и дифференциацию Т-лимфоцитов. Используется для лечения «дикого типа» (HBeAg+) HBV-инфекции. Назначается 1 мг тимозина-α 2 раза в день на 6–12 мес. Целесообразнее комбинированное лечение тимозином-a в дозе 1 мг 2 раза в день и лимфобластоидным ИФН-a в дозе 3 млн ЕД в/м 3 раза в нед. После курсового лечения, длящегося 1 год, эффективность терапии составляет 40–73% [1].
Применение лечебных вакцин. Принципиально новым подходом в лечении ХВГ В явилась разработка лечебных вакцин. Среди них выделяют три типа: рекомбинантные, Т-клеточные и ДНК-вакцины.
Эффективность первых двух типов вакцин оценена в пилотных исследованиях, результаты которых пока не позволяют рекомендовать их внедрение в клиническую практику. Усиление иммунного ответа в этих случаях связывают со снижением исходной вирусной нагрузки (комбинация с противовирусными препаратами) и с дополнительной иммуностимуляцией (комбинация с гамма-интерфероном, интерлейкином-2).
Особый интерес представляют плазмидные ДНК-вакцины, которые вводятся внутримышечно и индуцируют иммунный ответ против антигенов, синтезированных in vivo. В экспериментальных исследованиях на мышах показана не только длительная персистенция антител к HВsAg, но и мощный Т-клеточный ответ со стороны как цитотоксических Т-лимфоцитов, так и Т-хелперов 1-го типа. После получения доказательств безопасности ДНК-вакцин планируется исследование их эффективности у больных HBV-инфекцией.
Мы располагаем личным опытом патогенетической терапии у 44 пациентов с ХВГ В и ХВГ С. Применявшиеся нами препараты ламивудин, Циклоферон и Неовир оказывали неплохой ближайший эффект (снижение маркеров цитолиза и холестаза после курса лечения в 72–73% случаев, элиминация вирусных маркеров из крови в 28–30% случаев). Вместе с тем спустя 6 мес после окончания лечения вирусологические маркеры не определялись лишь у 12–15% больных, отмечалось рецидивирование активности патологического процесса.
По мнению профессора гепатологии Graham Foster (Лондонский университет), имеется группа «трудных пациентов», тяжело поддающихся терапии. К факторам, ухудшающим прогноз лечения, относят 1-й и 4-й генотипы ХВГ С, высокую исходную вирусную нагрузку.
У пациентов, инфицированных HCV с 1-м генотипом, комбинация Пегасиса и Копегуса (рибавирина) обеспечивает самый высокий показатель сероконверсии — 52%. В случае инфицирования ХВГ С с 4-м генотипом терапия, проводимая в течение 48 нед Пегасисом (180 мкг/нед) и Копегусом (1000 или 1200 мг/сут), дает возможность получить уровень сероконверсии, сопоставимый с таковым при 2-м и 3-м генотипах — около 80%. Статистически достоверно большее количество больных с высокой исходной вирусологической нагрузкой (> 2 в 106 копий/мл), принимающих Пегасис + Копегус, продемонстрировало достижение сероконверсии по сравнению с пациентами, получающими простой ИФН альфа-2b + рибавирин (53% против 41%, р = 0,003).
APRICOT (AIDS PEGASYS Ribavirin International Coinfection Trial) — международное многоцентровое рандомизированное исследование, изучающее комбинированное применение Пегасиса и Копегуса у больных с ВИЧ + ВГС, — продемонстрировало уровень эффективности, равный 40%, при длительности терапии 48 нед. Это самый высокий показатель по данной коинфекции, полученный в международном исследовании. Пегасис и Копегус — единственные препараты в мире, одобренные Управлением по контролю за пищевыми продуктами и лекарственными средствами (FDA) для лечения пациентов с ВИЧ + ВГС.
Существует еще несколько перспективных направлений создания противовирусных препаратов. Интересным представляется появление соединений, блокирующих ферменты HCV — геликазу, протеазу, РНК-зависимую РНК-полимеразу. В процессе клинических испытаний находится генная терапия ХВГ В противосмысловыми олигонуклеотидами и рибозимами. Разработан также новый подход к лечению ХВГ С, когда в качестве объекта внешнего воздействия («рибосомальные ножницы») выступает наиболее стабильная часть генома — Core-протеин.
Клинические испытания проходит новый препарат ISIS-14803, нарушающий связывание РНК HCV с рибосомами.
Имеются сообщения ряда фирм об успешном исследовании соединений, в основе механизма действия которых лежит их способность ингибировать протеазную активность вирусного белка NS3 (VRT-21493, Ro-32-6167, Ro-32-6168 и др.). Получены данные о возможном применении бета-лейкина в терапии больных ХВГ C.
В целом терапия вирусных гепатитов остается сложной и актуальной задачей на сегодняшний день. Можно утверждать, что будущее химиотерапии вирусных гепатитов принадлежит использованию комбинации лекарственных средств с разными механизмами действия.
В. В. Скворцов, доктор медицинских наук
А. В. Тумаренко, кандидат медицинских наук
ВГМУ, Волгоград
источник

 Обеззараживание кожи. Для этого используется антисептическая салфетка из набора.
Обеззараживание кожи. Для этого используется антисептическая салфетка из набора.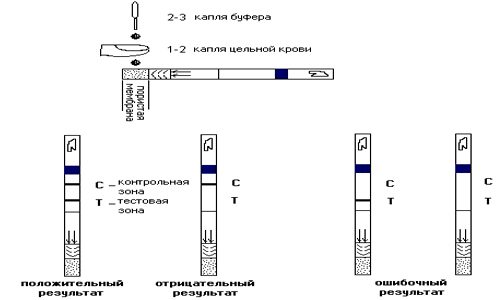
 биохимический анализ крови;
биохимический анализ крови; АЛТ и АСТ являются ферментами клеток, наибольшее количество которых расположено в печени, скелетных мышцах и сердечной мускулатуре. Если клеточная мембрана повреждена, то они попадают в кровь. АЛТ может возрасти при развитии токсического или вирусного гепатита, инфаркта миокарда и рака печени, а АСТ – при хроническом и токсическом гепатите, сердечно-сосудистых болезнях. При проведении анализа обращается внимание не только на отдельные показатели этих ферментов, но и на их соотношение. Если уровень АЛТ выше уровня АСТ, то можно говорить о разрушении печеночных клеток.
АЛТ и АСТ являются ферментами клеток, наибольшее количество которых расположено в печени, скелетных мышцах и сердечной мускулатуре. Если клеточная мембрана повреждена, то они попадают в кровь. АЛТ может возрасти при развитии токсического или вирусного гепатита, инфаркта миокарда и рака печени, а АСТ – при хроническом и токсическом гепатите, сердечно-сосудистых болезнях. При проведении анализа обращается внимание не только на отдельные показатели этих ферментов, но и на их соотношение. Если уровень АЛТ выше уровня АСТ, то можно говорить о разрушении печеночных клеток. Билирубин повышается при вирусных и токсических повреждениях печени, желчнокаменном заболевании, циррозе и гемолитической анемии. Не стоит забывать, что билирубин есть прямой и непрямой, поэтому для каждой патологии свойственно изменение одного из типов этого фермента. Для всех методов исследования анализов и тест-систем характерны свои нормы показателей.
Билирубин повышается при вирусных и токсических повреждениях печени, желчнокаменном заболевании, циррозе и гемолитической анемии. Не стоит забывать, что билирубин есть прямой и непрямой, поэтому для каждой патологии свойственно изменение одного из типов этого фермента. Для всех методов исследования анализов и тест-систем характерны свои нормы показателей. Гепатоз развивается из-за накопления жира в гепатоцитах. При прогрессировании болезни активная ткань печени заменяется соединительной, что становится причиной развития фиброза, который легко выявляется на УЗИ. Кроме того, при гепатозе происходит увеличение объемов обеих долей и округление их краев.
Гепатоз развивается из-за накопления жира в гепатоцитах. При прогрессировании болезни активная ткань печени заменяется соединительной, что становится причиной развития фиброза, который легко выявляется на УЗИ. Кроме того, при гепатозе происходит увеличение объемов обеих долей и округление их краев. стандартная, при которой иглой берется маленький кусочек ткани органа;
стандартная, при которой иглой берется маленький кусочек ткани органа;