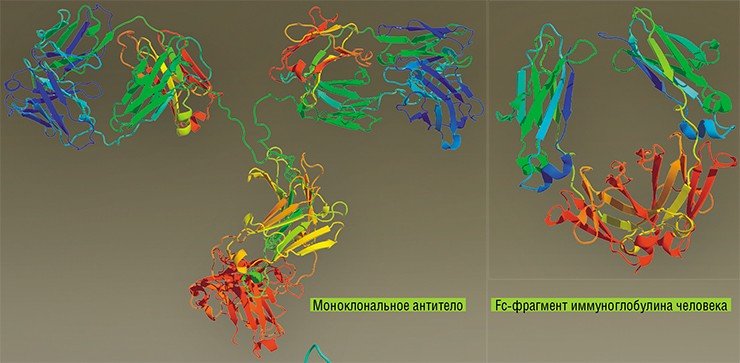
Семейство Poxviridae включает несколько родов, имеющих разнообразных хозяев. Патогенным для человека является вирус натуральной оспы.
Заболевание оспой известно с незапамятных времен (около 3000 лет до н. э.) и распространено оно было во всех странах мира.
Один из древних историков писал: «Никакой народ, никакая раса, ни звание, ни возраст, ни пол не щадились оспой. Все трепетало перед ней». Оспа страшна своей контагиозностью. В Германии в XVIII веке от оспы погибло 80 тыс. человек. От оспы умерли русский царь Петр II, австрийский император Иосиф, французский король Людовик XIV, английская королева Анна, знаменитая русская актриса Комиссаржевская и др.
Нам сейчас трудно представить себе ту сокрушительную силу, с которой орудовал вирус оспы. Но этот бич человечества был сломлен наукой. Прекратились эпидемии оспы.
И за последние несколько лет не было зарегистрировано ни одного случая оспы во всем мире.
Этиология оспы была установлена к концу XIX века. В 1892 г. Гварниери в гистологических срезах, сделанных и роговицы глаз кролика, зараженного оспенным материалом, обнаружил шаровидные и серповидные включения величиной от 3-4 до 10 мкм, окрашивающиеся по Романовскому — Гимзе в красный цвет. Эти включения были названы тельцами Гварниери. А в 1906 г. в содержимом оспенных пустул Пашен обнаружил оспенные корпускулы, в препаратах, обработанных методом серебрения по Морозову. Эти корпускулы были названы тельцами Пашена — Морозова.
Морфологическая структура. Вирус оспы крупный, размером 300-350 нм, кубоидальной формы. На ультрасрезах оспенных вирионов обнаружена липопротеидная оболочка, под ней вироплазма, в которой содержится нуклеокапсид. ДНК у вируса оспы — двунитчатая. Из нуклеокапсида вириона выделены некоторые ферменты.
Культивирование. Вирус натуральной оспы хорошо развивается в куриных эмбрионах на хорион-аллантоисной оболочке. Репродукция его характеризуется образованием на оболочке белых, плотных точечных бляшек с блестящей поверхностью, величиной около 1 мм.
Вирус можно также культивировать на первичных и перевиваемых клеточных культурах человека и животных. Здесь рост характеризуется цитопатическим действием (дегенерацией клеток через 48-72 ч).
Антигенная структура. У вируса оспы обнаружено несколько антигенов: растворимые (L-термолабильный и S-термостабильный), нуклеопротеидный NP-антиген. Вирусы оспы имеют общие антигены с вирусом оспенной вакцины и эритроцитами человека группы А и АВ.
Устойчивость к факторам окружающей среды. При температуре 100° С вирусы погибают моментально. Температура 60° С губит их через час. Низкие температуры и высушивание вирусы натуральной оспы переносят хорошо — в оспенных корочках сохраняются длительно. Дезинфицирующие растворы (30% хлорамин, лизол) инактивируют вирусы оспы через 30 мин. К фенолу и эфиру они более устойчивы, а в 50% глицерине вирусы оспы сохраняются месяцами.
Восприимчивость животных. К вирусу оспы чувствителен мелкий и крупный рогатый скот. В экспериментальных условиях легко заражаются обезьяны, морские свинки, кролики и др. Однако воспроизвести заболевание, сходное по клинике с болезнью человека, можно только у обезьян.
У новорожденных белых мышей вирус вызывает оспенный энцефалит.
Источники инфекции. Больные люди.
Пути передачи. Воздушно-капельный и воздушно-пылевой (вирус передается при кашле, разговоре, через посуду, а также через пылевые частицы, находящиеся на одежде).
Патогенез. Вирус оспы проникает через слизистую оболочку дыхательных путей и через кожные покровы. Проникнув в организм, вирусы локализуются в регионарных лимфатических узлах. Размножившись там, они попадают в кровь, обусловливая вирусемию. Вторичная репродукция (размножение) происходит в лимфоидной ткани и сопровождается клиническими проявлениями заболевания: высокой температурой, головной болью, потерей сознания и т. д. Обладая дермотропными свойствами, вирусы попадают в эпидермис. На коже и слизистых оболочках образуются папулы, везикулы и пустулы. Оспенные папулы характеризуются прозрачным содержимым и имеют вид жемчужин с перламутровым блеском. На месте появления пустул образуется некроз, после заживления которого остаются рубцы. Образование рубцов на слизистой глаз приводит к слепоте (в 25% случаев). Процент смертности при оспе велик, при геморрагической форме — 100%. При этой форме пустулы наполняются кровью — черная оспа.
Встречаются легкие формы оспы, когда заболевание протекает без температуры и сыпи.
Иммунитет. У переболевших людей иммунитет пожизненный. Обусловливается он вируснейтрализующими, гемагглютинирующимися и комплементсвязывающими антителами. Искусственная иммунизация с последующей ревакцинацией дает стойкий иммунитет. Считают, что интерферон также является фактором защиты.
Профилактика. Ранняя диагностика, изоляция, дезинфекция, предупреждение завоза оспы из других стран, карантин и т. д.
Специфическая профилактика. В борьбе с натуральной оспой большое значение имеет специфическая профилактика. За много лет до нашей эры на востоке существовали разные методы борьбы с оспой. В Индии, Иране — растертые корочки из пустул больных легкой формой втирали в кожу здоровых, а в Китае наносили на слизистые оболочки носа.
В 1796 г. английский врач Э. Дженнер после длительных наблюдений использовал содержимое пустул коровьей оспы для вакцинации людей. Отсюда название — вакцина (от лат. vacca — корова).
Вакциной, приготовленной таким методом, пользовались длительное время. Затем был разработан метод получения ововакцины (вирус накапливали в курином эмбрионе). Этот метод удобнее для изготовления и экономнее.
В настоящее время вакцину готовят из вируса, выращенного в культуре клеток.
В марте 1919 г. В. И. Лениным был подписан декрет об обязательном оспопрививании. После проведения массовой иммунизации оспа в СССР была ликвидирована.
В 1958 г. по инициативе СССР на XI Ассамблее ВОЗ было принято решение о ликвидации оспы во всем мире путем массовой вакцинации. В результате за последние годы не было зарегистрировано ни одного случая заболевания оспой в мире и в 1981 г. по рекомендации ВОЗ обязательная прививка против оспы была отменена.
Цель исследования: выявление возбудителя оспы. Работа с вирусом оспы проводится в строго режимных условиях (см. «Особо опасные инфекции»).
1. Содержимое папул, везикул, пустул.
2. Отделяемое слизистой оболочки носоглотки.
3. Кровь (с 5-го дня болезни) берут для выявления специфических антител.
Способы сбора материала
1. Метод иммунофлюоресценции (экспресс-диагностика) (см. главу 12).
2. Реакция РСК, РТГА и РНГА (см. главу 12).
3. Выделение вируса в куриных эмбрионах и культуре клеток Hela, Нер-2.
4. Обнаружение телец Гварниери в зараженных клетках.
5. Обнаружение телец Пашена в содержимом везикул (окраска по Морозову).
1. Какова величина и структура вириона оспы?
2. Каковы основные методы культивирования вируса оспы?
3. Патогенез натуральной оспы.
4. Иммунитет и специфическая профилактика? Кем и когда был подписан первый декрет об обязательной прививке против оспы?
5. Каковы основные методы диагностики оспы?
источник
История открытия вируса оспы, изучение его этимологии, строения. Подвиды вируса натуральной оспы по вирулентности для людей. Изучение патогенеза вируса и его жизненного цикла. Физиология развития болезни. Практическое применение вируса в настоящее время.
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Министерство здравоохранения Российской Федерации
Государственное бюджетное образовательное учреждение высшего профессионального образования
«Санкт-Петербургская государственная химико-фармацевтическая академия»
Выполнил (а): студентка 3 курса 222 группы
Андреева Екатерина Алексеевна
Научный руководитель: Ольга Михайловна
- Введение
- 1. История открытия вируса
- 2. Этимология и особенности строения
- 3. Жизненный цикл
- 4. Механизм зарождения и развития болезни
- 4.1 Преодоление барьеров
- 4.2 Физиология развития болезни
- 4.3 Иммунные реакции организма на ВНО
- 5. Практическое применение
- Список используемой литературы
Несмотря на победу над болезнью, которая стала возможна благодаря сотрудничеству всех стран мира, вирус натуральной оспы все еще жив и активно используется во многих научных исследованиях.
— узнать историю открытия вируса, его этимологию и особенности строения;
— исследовать практическое применение вируса в настоящее время.
Эпидемия чёрной оспы впервые прокатилась по Китаю в IV веке, а в середине VI века — поразила Корею. В 737 году от оспы вымерло более 30 % населения Японии. В VI веке оспа уже хозяйничала в Византии, будучи занесённой в последнюю из Африки. Арабы-мусульмане, приступив к завоеваниям, в VII — VIII веках разнесли оспу от Испании до Индии: история засвидетельствовала появление оспы в Сирии, Палестине и Персии в VII веке, в Сицилии, Италии, Испании и Франции в следующем, VIII столетии.
С VI века оспа фигурирует под сохранившимся до сих пор её латинским названием variola, впервые употреблённым епископом Марием из Аванша в 570 году. С этого времени оспа, под своим несменяемым именем, уносила ежегодно множество жизней в Европе.
Из Европы оспа перешла в Америку, где она похитила много миллионов жизней, вымерли без остатка многие племена.
Начиная с XVII столетия, имеется уже много фактических данных об оспе, зарегистрированных современниками. В общей сумме было вычислено, что в Европе ежегодно умирало от оспы более 1,5 миллионов человек.
Возбудитель оспы относится к вирусам семейства Poxviridae, подсемейства Chordopoxviridae, рода Orthopoxvirus.
По вирулентности для людей ВНО делится на два подвида: Variola major (летальность среди заболевших людей колеблется в пределах от 5 до 40 %); и Variola minor или алястрим (летальность 0,1-2 %).
Вирусы оспы — наиболее крупные из всех вирусов животных. Под электронным микроскопом они выглядят как большие овальные частицы размером около 250-350×200-270 нм.
В структуре вирусов оспы различают три основных компонента: двояковогнутую сердцевину, овальные боковые тела и оболочку вириона. Сердцевину вириона составляют ДНК и связанные с нею белки. Сердцевина окружена гладкой мембраной (толщиной около 5 нм), снаружи покрытой слоем вертикально уложенных и плотно прилегающих друг к другу цилиндрических субъединиц (5×10 нм). Вогнутость сердцевины с обеих сторон занята овальными образованиями (неизвестной природы), называемыми боковыми телами. Они как бы сдавливают сердцевину, придавая ей форму двояковогнутого диска, имеющего на разрезе вид гантели.
Вирионы заключены в липопротеиновую супероболочку, которая имеет толщину 20 — 30 нм и содержит липиды клетки и вирусспецифические белки.
Вирионы большинства вирусов оспы окружены слоем беспорядочно расположенных трубчатых структур, придающих им характерный вид. Эти структуры состоят из сферических субъединиц диаметром около 5 нм. Субъединицы построены из молекул протеина или гликопротеина. В состав ворсинок длиной 20 нм покрывающих поверхность вируса осповакцины (ВОВ), входит белок с молекулярной массой 58 кД, относящийся к главным полипептидам вириона.
Вирус осповакцины содержит белки, липиды и ДНК, которые соответственно составляют 90, 5 и 3,2% массы вириона (5х10
15 г). В вирусе оспы птиц около 1/3 массы составляют липиды.
Вирионы, содержащие двухцепочечную геномную ДНК, ферменты, факторы транскрипции, адсорбируются на клетке (1) и сливаются с плазматической мембраной клетки, высвобождая сердцевины в цитоплазму (2). Сердцевины синтезируют ранние мРНК, с которых транслируются различные белки, включая факторы роста, молекулы защиты от иммунной системы, ферменты и факторы для репликации ДНК и транскрипции промежуточных генов (3). Происходит раздевание сердцевины (4) и вирусная ДНК реплицируется, формируя конкатемерные молекулы (5). Промежуточные гены транскрибируются на дочерних молекулах ДНК и с этих мРНК транслируются факторы поздней транскрипции (6). Затем транскрибируются поздние гены. С их мРНК транслируются вирионные структурные белки, ферменты и факторы ранней транскрипции (7). Сборка вирионов начинается с образования дискретных мембранных структур (8). Конкатемерные промежуточные формы вирусной ДНК разделяются на единичные геномы и упаковываются в незрелые вирионы (9). Созревание приводит к образованию внутриклеточных зрелых вирионов (10). Эти вирионы покрываются модифицированными мембранами аппарата Гольджи и перемещаются к периферии клетки (11). Слияние таких вирионов с плазматической мембраной завершается высвобождением внеклеточных вирионов. Хотя размножение вируса происходит полностью в цитоплазме, ядерные факторы могут быть вовлечены в процессы транскрипции генов и сборки вирионов.
РНК-вирусы имеют определенный лимит генетической сложности, обусловленный небольшими размерами их геномов — от 3 до 30 кб. Однако они более эффективно, чем ДНК-вирусы используют мутационный процесс для изменения своей антигенной структуры и тропизма в организме хозяина, а также для уклонения от антител и цитотоксических лимфоцитов. Высокую частоту мутаций у РНК-вирусов обычно объясняют отсутствием механизмов корректировок в синтезе РНК. Все молекулы вирусной РНК обычно реплицируют через ассиметричную транскрипцию от одной цепи, исключающую большинство корректирующих механизмов, характерных для репликации молекул ДНК. S. Holland и соавт. (1982) экспериментально доказали, что вероятность ошибки во время копирования РНК-молекулы будет в 105 — 107 раз больше, чем при копировании ДНК-молекулы. Ими также была установлена средняя частота мутаций для РНК-вирусов, составляющая приблизительно 10-4,5. Это означает, что до 10% всех молекул РНК в популяции вируса, могут содержать мутации.
Инфекционные частицы поксвирусов содержат в своем составе полную ферментативную систему транскрипции, способную синтезировать функциональную мРНК в полиаденилированной, кэпированной и метилированной форме. Это позволяет ВНО:
1) самостоятельно осуществлять эффективную защиту от ранних специфических реакций на инфекцию и противодействовать развивающимся позже специфическим реакциям;
ВНО variola maior обуславливает генерализованную инфекцию, которая в высоком проценте случаев завершается летальным исходом. Для этого вирус располагает беспрецедентным, по сравнению с вирусами других семейств, набором генов, белковые продукты которых эффективно изменяют многочисленные защитные реакции организма.
Рис.4. Общая схема синтеза ВНО молекулярных факторов, обеспечивающих вирусу преодоление защитных барьеров человека
Первым неспецифическим и, возможно, самым древним барьером, который вынужден преодолевать ВНО, является программированная гибель клеток (апоптоз). Инфицирование клетки запускает механизм ее самоубийства, благодаря чему предотвращается размножение вируса и его распространение среди соседних клеток. ВНО располагает, по крайней мере, четырьмя генами, белковые продукты которых ингибируют апоптоз по альтернативным и дублирующим механизмам.
Вторым неспецифическим барьером являются местные воспалительные процессы. Они быстро индуцируются для ограничения распространения вируса в первые часы и дни после инфицирования, пока формируется полноценный иммунный ответ. ВНО несет гены не менее чем пяти белков, блокирующих различные этапы развития воспаления в участках размножения вируса (SPI-2, G3R, растворимых аналогов рецепторов фактора некроза опухолей — TNF и гамма-интерферона — гаммаlFN) и предотвращающих развитие системных реакций (растворимый рецептор интерлейкина-1бета — IL-1 бета). Как правило, все эти белки обладают одновременно несколькими активностями. Например, TNF-связывающий белок необходим еще и для развития генерализованной инфекции, столь характерной для ВНО. Поэтому эти белки считаются факторами вирулентности.
Система блокирования интерферона у ВНО также мультигенна (не менее 5 белков), поэтому он очень устойчив к его действию. Синтезируемые вирусом аналоги растворимых рецепторов IFN обоих типов, интерферируют с IFN, связывая его клеточные рецепторы. Это приводит к блокированию антивирусного состояния клетки и предотвращает лейкоцитарную инфильтрацию в участки вирусной репликации.
Для облегчения распространения ВНО по тканям организма хозяина, в его геноме содержится ген C11R VAC-COP, кодирующий белок VGF, отнесенный к семейству эпидермального фактора роста. Он стимулирует рост и / или метаболическую активность неинфицированных клеток, обеспечивая тем самым распространение ВНО по организму. На эффективность диссеминации ВНО в организме человека также влияют белки оболочки внеклеточных вирионов (прежде всего, гемагглютинин) и анкиринподобные белки (определяют круг хозяев вируса). Пока не идентифицированы вирусные белки, подавляющие созревание гликопротеидов главного комплекса гастосовместимости класса I и тем самым снижающих эффективность представления на поверхности инфицированной клетки вирусных антигенов специфическим цитотоксическим Т-лимфоцитам.
Однако большое количество синтезируемых ВНО белковых структур неизбежно обнаруживаются иммунной системой хозяина. Поэтому, патогенез ВНО построен на компромиссе между скоростью развития иммунного ответа хозяина (индуцируется полный спектр клеточно-опосредованных и гуморальных иммунных ответных реакций) и скоростью размножения вируса до количеств, достаточных для его передачи другому реципиенту.
У переболевших оспа оставляет длительный, стойкий и стерильный иммунитет, что исключает возможность повторного использования вирусом для своего размножения того же хозяина. Эта та цена, которую вирус платит за сложность своего генома иммунной системе человека. Однако заболевший успевает инфицировать от 5 (в среднем) до 38 человек, из них не менее трети погибнет — это уже цена, которую платим мы за то же самое.
ВНО среди людей распространяется воздушно-капельным путем. В организме человека он предварительно накапливается в альвеолярных макрофагах, затем по лимфатическим путям проникает в лимфатические узлы, где происходит его репликация. Ортопоксвирусы в отношении фагоцитирующих клеток ведут себя как паразитические организмы и используют их для своего размножения. Разрушившиеся фагоцитирующие клетки становятся источником вируса, а через 2 — 3 суток его обнаруживают уже в крови (первичная виремия), костном мозге, печени и селезенке.
В пробах крови больного натуральной оспой в этот период инфекционного процесса можно обнаружить как инфицированные, так и не инфицированные лейкоциты, но в основном репликация ВНО происходит в моноцитах / макрофагах. Лимфоциты остаются неинфицированными, они сохраняют свою функцию, хотя при этом и наблюдается выраженная лимфопения. Вирус распространяется из лимфатических узлов фагоцитирующими клетками крови по внутренним органам через выносящие (эфферентные) лимфатические сосуды. Затем вирус проникает в эпителий кожи и слизистых, где начинается его репликация. Появляются энантемы и экзантемы, инфицирование которых вторичной микрофлорой определяет эволюцию кожных элементов из везикул в пустулы. Количество вируса через 4 — 5 суток уже превышает емкость ретикуло-эндотелиальной системы, и он вновь проникает в кровяное русло.
Вторичная виремия обычно соответствует началу клинической манифестации болезни. Специфические антитела выявляются в крови на седьмые сутки после инфицирования, и их максимальный уровень достигается на 14 сутки. Уже на 10-е сутки болезни заразность больного для окружающих резко снижается. Через 4 недели от начала болезни вирус невозможно выделить из отделяемого носоглотки и из мочи реконвалесцента. У выживших людей развивается стерильный иммунитет.
Интенсивная репликация ВНО в макрофагах сопровождается явлением, которое из-за его неблагоприятного исхода, назвали «цитокиновым штормом» («cytokine storm»). Оно проявляется каскадной активацией и выбросом инфицированными макрофагами значительных количеств различных лимфокинов (monocyte chemoattractant protein 1, macrophage inflammatory protein 1бета, IFN-гамма, IL-6 и др.) и развитием клиники токсемии и шока, приводящих больного к смерти.
Для освобождения организма от ортопоксвирусов, необходимо участие в иммунных ответах CD4 + T-клеток — субпопуляция Т-клеток, оказывающая помощь В-клеткам в продукции специфических антител; и MHC класса II — эти молекулы локализованы на поверхности макрофагов и обеспечивают включение в иммунный ответ CD4 T-клеток. В ответах на острую инфекцию, вирусоспецифические антитела наиболее эффективно освобождают организм от вируса. Вирус разрушается по различным механизмам, предполагающим участие таких антител. Во-первых, антитела могут непосредственно связывать вирус, вызывая его агрегацию и препятствуя адсорбции и интернализации в клетках. Во-вторых, они могут связывать вирус, вызывая его разрушение с помощью комплемента или опсонизации, а затем посредством фагоцитоза. Антитела могут связывать инфицированные клетки хозяина, вызывая цитотоксические реакции со стороны клеток-киллеров и др.
Геморрагическая форма натуральной оспы с летальным исходом развивалась у людей с врожденными дефектами иммунной системы, проявившимися отсутствием антител в ответ на вакцинацию против натуральной оспы. При инфицировании таких больных ВНО, у них развивалась выраженная виремия, вирус в высоких титрах обнаруживали в фарингеальном тракте.
ВНО и другие ортопоксвирусы представляют собой очень благодарный для иммунолога объект исследования, так как реакции иммунной системы человека на них всегда укладываются в представления об иммунитете и инфекции, сложившиеся еще в начале ХХ столетия. В таких исследованиях открывается обширное поле деятельности по детализации прописных истин из старых учебников, поэтому они всегда «глубоко научны».
Основной антигеной детерминантой поксвирусов и мишенью для протективных антител является консервативный белок L1 (другое название L1R). У вируса вакцины (так называют ортопоксвирус, используемый в настоящее время для вакцинации людей против ВНО), вируса оспы обезьян и ВНО этот белок различается отдельными аминокислотами. Антитела к L1 способны блокировать инвазию ортопоквирусов в клетки. Поэтому он рассматривается учеными в качестве кандидата на включение в перспективные противооспенные вакцины.
Вакцинация обычно предупреждает заражение ВНО в течение, по меньшей мере, 5-10 лет. При развитии болезни ее симптомы у вакцинированных лиц менее выражены, чем у невакцинированных. Так как специфические антитела считаются «первой линией обороны» против вторжения возбудителей инфекционных болезней, их обычно выявляют для оценки иммунной защиты индивидуума. По данным Gallwitz S. et al. (2003), использовавших ферментативный иммуноанализ для поиска антител к вирусу вакцины у лиц, вакцинированных 30-60 лет назад, их можно обнаружить у 65% обследуемых, вакцинированных однократно; и у 80 % обследуемых, вакцинированных два раза и более. Crotty S. et al. (2003) продемонстрировали присутствие у лиц, вакцинированных более 50 лет назад, В-клеток памяти, специфических к вирусу вакцины. Количество таких клеток после вакцинации снижается в течение нескольких лет до уровня, представляющего примерно десятую часть от достигнутого максимума. Далее количество противооспенных антител (0,1% от общего количества IgG + B-клеток) не меняется практически на протяжении всей оставшейся жизни вакцинированного. Этим объясняется выраженная антительная реакция на противооспенную ревакцинацию. В опытах Frey S.E. et al. (2003) вакцинация ранее вакцинированных лиц давала очень хороший результат даже при десятикратном разведении вакцины.
1. Научный обзор исследований вируса натуральной оспы, 1999-2010 гг. Antonio Alcami, Inger Damon, David Evans, John W. Huggins, Christine Hughes, Peter B. Jahrling, Grant McFadden, Hermann Meyer, Bernard Moss, Sergei Shchelkunov, Evgeni Stavskiy, Nina Tikunova. Всемирная организация здравоохранения, 2011 г.
2. Консультативный комитет ВОЗ по исследованию вируса натуральной оспы. Всемирная организация здравоохранения. Доклад пятнадцатого совещания, Женева, Швейцария, 24-25 сентября 2013 г.
3. Супотницкий М.В. Эволюционная патология. К вопросу о месте ВИЧ-инфекции и ВИЧ/СПИД-пандемии среди других инфекционных, эпидемических и пандемических процессов — М., 2009. — 400 с.: ил.
4. Супотницкий М.В. Натуральная оспа, оспа обезьян. В кн.: Супотницкий МВ. Биологическая война. Введение в эпидемиологию искусственных эпидемических процессов и биологических поражений. М.: «Кафедра», «Русская панорама»; 2013.
5. Супотницкий М.В. Микроорганизмы, токсины и эпидемии. Глава 1.6. Патогенность вирусов.
6. http://www.who.int/ru/ Всемирная организация здравоохранения, 2015 г.
Исследование понятия и основных особенностей ДНК-геномных вирусов. Изучение жизненного цикла вируса. Характеристика вируса папилломы человека. Описание болезней, вызываемых вирусом папилломы человека. Лабораторная диагностика папилломавирусной инфекции.
реферат [94,2 K], добавлен 17.03.2014
Вирус иммунодефицита человека — ретровирус из рода лентивирусов, вызывающий медленно прогрессирующее заболевание — ВИЧ-инфекцию. Схематическое строение вируса. Проникновение ВИЧ в клетку человека. Транспорт вирусной ДНК в ядро и интеграция в геном.
презентация [20,6 M], добавлен 03.05.2017
Латенция и вирогения как типы взаимодействия вируса с клеткой. Процесс адсорбции вируса и его проникновения в клетку, синтез вирусных белков. Этапы созревания дочерних вирусных частиц, способы их выхода из клетки, общие принципы сборки вирионов.
реферат [18,6 K], добавлен 29.09.2009
Отрицательная роль вирусов в жизни человека как возбудителей ряда опасных заболеваний: оспы, гепатита, энцефалита, краснухи, кори, бешенства, гриппа. «Индикаторы жизни»: происхождение и природа вирусов, их строение. Взаимодействие вируса с клеткой.
реферат [164,7 K], добавлен 01.04.2009
Вирусы как первая форма жизни на Земле и возбудители болезней. Предыстория их открытия. Схема проведения биологического эксперимента. Строение вируса и бактериофага. Виды вирусных заболеваний человека. Жизненный цикл вируса иммунодефицита человека.
презентация [690,1 K], добавлен 27.02.2011
Свойства вирусов, особенности их строения и классификация. Взаимодействие вируса с клеткой. Процессы, связанные с размножением вируса. Описание основных вирусных заболеваний. Эволюция вирусов на современном этапе. Влияние загрязнения внешней среды.
реферат [466,4 K], добавлен 24.03.2011
Организация генома и кодируемые белки вируса иммунодефицита человека. Транскрипция провирусной дезоксирибонуклеиновой кислоты и синтез вирусных веществ. Анализ получения сыворотки и плазмы крови. Характеристика референсных сиквенсов и электрофореграмм.
дипломная работа [1,3 M], добавлен 04.06.2017
Схема строения булавовидного бактериофага. Жизненный цикл вируса на примере ортомиксовирусов, к которым относятся вирусы гриппа А, В и С типов. Описание вирусов иммунодефицита человека (ВИЧ), вызывающего СПИД, табачной мозаики, герпеса 8 типа, гриппа.
презентация [864,8 K], добавлен 07.09.2010
Таксономия вируса и морфология вириона. Антигенная структура и вариабельность. Гемагглютинирующие и гемадсорбирующие свойства вирусов, их культивирование в различных живых системах. Диагностика чумы плотоядных. Способы введения вакцин и схема вакцинации.
реферат [33,6 K], добавлен 25.04.2015
Эволюционное происхождение. Свойства вирусов. Природа вирусов. Строение и классификация вирусов. Взаимодействие вируса с клеткой. Значение вирусов. Вирусные заболевания. Особенности эволюции вирусо на соременном этапе.
реферат [299,2 K], добавлен 22.11.2005
Работы в архивах красиво оформлены согласно требованиям ВУЗов и содержат рисунки, диаграммы, формулы и т.д.
PPT, PPTX и PDF-файлы представлены только в архивах.
Рекомендуем скачать работу.
источник
Эпидемии ч пандемии натуральной оспы были известны с древнейших времен. В 1892 г. Г. Гварниери обнаружил внутриклеточные включения вируса в гистологических срезах роговицы глаза зараженного кролика. В 1906 г. впервые были обнаружены вирионы оспы в световом микроскопе Е. Пашеном.
Структура и биологические свойства.Вирус оспы — самый крупный из вирусов. Вирионы размером до 400 им, имеют форму кирпича с закругленными углами. Вирус имеет сложное строение, состоит из сердцевины (нуклеоида), имеющей форму восьмерки, по обе стороны от которой находятся овальные боковые тела. Сердцевина содержит дву-нитчатую ДНК, заключенную в белковый фугляр и окружена внутренней и наружной мембранами. Сердцевина и боковые тела окружены внешней оболочкой с шарообразными выступами.
Антигены.Нуклеопротеидный антиген, общий с вирусом оспо-вакцины, содержится в сердцевине вириона. Протективными являются антигены внешней оболочки: растворимые антигены и гемагглютинин.
Культивирование.Вирус культивируется в курином эмбрионе, образуя на хорион-аллантоисной оболочке плотные белые бляшки. В культуре клеток вызывает ЦПД и образование внутриклеточных включений Гварниери.
Устойчивостьво внешней среде высокая, вирус может сохраняться в высохших экссудатах в течение многих месяцев при комнатной температуре. При 100°С погибает сразу, при 60°С в течение 15 минут, под действием дезинфицирующих растворов — в течение нескольких часов.
Заболевание у человека.Натуральная оспа относится к особо опасным инфекциям. Источник инфекции — больной человек. Пути передачи — воздушно-капельный, воздушно-пылевой, контактно-бытовой. К оспе восприимчивы все люди, не имеющие приобретенного иммунитета.
Инкубационный период равен в среднем 9-14 дням. Заболевание протекает с тяжелой интоксикацией и развитием высыпаний на коже в виде везикул и пустул, в тяжелых случаях — геморрагических.
Лабораторная диагностика.Выделение вируса проводится в специальных лабораториях. Обнаруживают: вирионы при микроскопии в электронном микроскопе; включения Гварниери в пораженных клетках; вирусный антиген с помощью специфических антисывороток в РИФ, РСК, РПГА, ИФА.
Выделение вируса проводят на куриных эмбрионах и в культуре клеток. Серологическую диагностику осуществляют с помощью РТГА, РСК.
Лечебные и профилактические препараты.Оспа ликвидирована на земном шаре, последний случай заболевания описан в Сомали в 1977 г.
В 1967 г. ВОЗ разработала план мероприятий по ликвидации оспы в мире. В проведении этих мероприятий активно участвовала наша страна. Основным средством, с помощью которого была достигнута победа над оспой, была живая осповакцина, впервые предложенная еще в 1796 г. английским врачом Э. Дженнером и в дальнейшем значительно усовершенствованная. Ликвидация оспы была достигнута также благодаря организации противоэпидемических мер: выявления и подавления очагов заболевания. Для лечения больных применялся ме-тисазон. В настоящее время, с 1980 г., по рекомендации ВОЗ обязательная вакцинация против оспы прекращена.
Герпесвирусы
К семейству герпесвирусов относятся три подсемейства:
1) а-герпесвирусы. К этому подсемейству относятся:
Herpes simplex — вирус простого герпеса (ВПГ);
Herpes zoster — вирус ветряной оспы и опоясывающего лишая
2) р-герпесвирусы — цитомегаловирус (ЦМВ).
3) у-герпесвирусы — вирус Эпштейн-Барра — возбудитель инфекционного мононуклеоза.
Вирус простого герпеса (Herpes simplex)
Структура, биологические свойства.Вирионы сферической формы, размером 120-150 нм, сложноорганизованные. Сердцевина вируса содержит двунитевую ДНК и белковый капсид, окруженный лшюпроте-идной оболочкой с шипами гликопротеидной природы.
Антигены.Внутренние белки нуклеокапсида являются группос-пецифическими, общими с другими герпесвирусами. Гликопротеиды внещней оболочки являются типоспецифическими. Существуют два се-ротипа вируса простого герпеса: ВПГ-1 и ВПГ-2.
Культивирование.Вирус простого герпеса культивируется в куриных эмбрионах, культуре клеток. На хорион-аллантоисной оболочке куриных эмбрионов образует белые тонкие бляшки. В культуре клеток вызывает цитопатическое действие — образование многоядерных клеток с внутриядерными включениями. Особенность репродукции вируса в том, что этот процесс происходит в ядре клетки.
Устойчивость.Вирус термолабилен, инактивируется при 56°С через 30 минут, при кипячении погибает, чувствителен к дезинфицирующим веществам. На предметах выживает при комнатной температуре в течение нескольких часов. Длительно сохраняется при низких температурах.
Заболевание у человека.Источником инфекции являются больные люди и вирусоносители. Носительство вируса — очень распространенное явление. Пути передачи вируса: контактно-бытовой, воздушно-капельный и половой. Вирус может передаваться при поцелуях, через посуду, игрушки и другие предметы, через необеззараженные медицинские инструменты. Герпес является одной из распространенных болезней, передающихся половым путем.
Заражение ВПГ-1 чаще всего происходит в возрасте от 6 месяцев до 3 лет, но могут первично заражаться и взрослые. В подростковом возрасте чаще заражаются ВПГ-2. Возможна передача инфекции от матери плоду.
Входными воротами при герпетической инфекции служат кожа и слизистые оболочки. Вирус персистирует в организме пожизненно, сохраняясь в нервных клетках в виде провйруса, периодически вызывая рецидивы. Появлению рецидивов способствует иммунодефицитное состояние.
Клинические проявления герпетической инфекции: бессимптомное носительство; поражение кожи и слизистых оболочек с появлением высыпаний в виде пузырьков; ОРЗ, пневмония; рецидивирующий герпес половых органов; кератит, кератоконъюнктивит.
ВПГ-2 чаще вызывает генерализованные формы инфекции с поражением печени, центральной нервной системы, а также внутриутробную герпетическую инфекцию.
Лабораторная диагностика. Вмазках-отпечатках пз содержимого герпетических пузырьков, окрашенных по Романовскому-Гимза, обнаруживаются многоядерные клетки с внутриклеточными включениями. Применяются РИФ, ИФА. Выделение вируса проводят на куриных эмбрионах, культуре клеток. Для определения серотипа применяют мо-ноклональные антитела. Для молекулярной диагностики применяют ДНК-зонды в реакции гибридизации и полимеразной цепной реакции.
Для серологической диагностики используют РСК с парными сыворотками. Диагностическим считается нарастание титра антител в 4 раза.
Лечебные препаратыдля этиотропной терапии: бонафтон, теоб-рофен, флореналь, госсипол, ацикловир, виразол. Иммуномодулирую-щие препараты — тималин, тактивин, нуклеинат натрия.
Для противорецидивного лечения применяют инактивированную вакцину во время стойкой ремиссии.
источник
Вирус вызывает особо опасное высококонтагиозное инфекционное заболевание, характеризующееся общим поражением организма и обильной сыпью на коже и слизистых оболочках. В прошлом отмечались эпидемии и пандемии заболевания, сопровождающиеся высокой летальностью. В 1892 г. Г.Гварниери, исследуя под микроскопом срезы роговицы зараженного кролика, обнаружил специфические включения, впоследствии названные тельцами Гварниери, представляющие собой скопления вирусов натуральной оспы. Возбудитель оспы впервые обнаружен в световом микроскопе Е. Пашеном (1906).
Таксономия. Вирус натуральной оспы – ДНК-содержащий; относится к семейству Poxviridae (от англ, рох – язва), роду Orthopoxvirus.
Морфология, химический состав, антигенная структура. Вирус натуральной оспы является самым крупным вирусом, при электронной микроскопии имеет кирпичеобразную форму с закругленными углами размером 250-400 нм. Вирион состоит из сердцевины, имеющей форму гантели, двух боковых тел, расположенных по обе стороны от сердцевины, трехслойной наружной оболочки. Вирус содержит линейную двунитчатую ДНК, более 30 структурных белков, включая ферменты, а также липиды и углеводы.В составе вируса обнаружено несколько антигенов: нуклео-протеидный, растворимые и гемагглютинин. Вирус натуральной оспы имеет общие антигены с вирусом осповакцины (коровьейоспы).
Культивирование. Вирусы хорошо размножаются в куриных эмбрионах, образуя белые плотные бляшки на хорионаллантоисной оболочке. Репродукция вируса в культуре клеток сопровождается цитопатическим эффектом и образованием характерных цитоплазматических включений (телец Гварниери), имеющих диагностическое значение.
Резистентность. Вирусы оспы обладают довольно высокой устойчивостью к окружающей среде. На различных предметах при комнатной температуре сохраняют инфекционную активность в течение нескольких недель и месяцев; не чувствительны к эфиру и другим жирорастворителям. При температуре 100ºС вирусы погибают моментально, при 60ºС – в течение 15 мин, при обработке дезинфицирующими средствами (фенол, хлорамин) – в течение нескольких часов. Длительно сохраняются в 50 % растворе глицерина, в лиофилизированном состоянии и при низких температурах.
Восприимчивость животных. Заболевание, сходное по клиническим проявлениям с болезнью человека, можно воспроизвести только у обезьян. Для большинства лабораторных животных вирус оспы малопатогенен.
Эпидемиология. Натуральная оспа известна с глубокой древности. В XVII-XVIII вв. в Европе оспой ежегодно болело около 10 млн человек, из них умирало около 1,5 млн. Оспа являлась также главной причиной слепоты. На основании высокой контагиозности, тяжести течения и значительной летальности натуральная оспа относится к особо опасным карантинным инфекциям.
Источником инфекции является больной человек, который заразен в течение всего периода болезни. Вирус передается воздушно-капельным и воздушно-пылевым путями. Возможен контактно-бытовой механизм передачи – через поврежденные кожные покровы.В начале 20-х годов текущего столетия в результате применения оспенной вакцины удалось ликвидировать натуральную оспу в Европе, Северной Америке, а также в СССР (1936). Отечественные ученые В. М. Жданов, М. А. Морозов и др. обосновали возможность осуществления глобальной ликвидации оспы. В 1958 г. по предложению СССР Всемирная организация здравоохранения приняла резолюцию и разработала программу по ликвидации оспы во всем мире, которая была успешно выполнена благодаря глобальной противооспенной вакцинации людей. В 1977 г. в Сомали был зарегистрирован последний случай оспы в мире. Таким образом, оспа исчезла как нозологическая форма.
Патогенез и клиническая картина. Вирус оспы проникает в организм через слизистую оболочку дыхательных путей и реже через поврежденную кожу. Размножившись в регионарных лимфатических узлах, вирусы попадают в кровь, обусловливая кратковременную первичную вирусемию. Дальнейшее размножение вирусов происходит в лимфоидной ткани (селезенка, лимфатические узлы), сопровождается повторным массивным выходом вирусов в кровь и поражением различных систем организма, а также эпидермиса кожи, так как вирус обладает выраженными дерматотропными свойствами. Инкубационный период составляет 8-18 дней. Заболевание начинается остро, характеризуется высокой температурой тела, головной и поясничной болью, появлением сыпи. Для высыпаний характерна последовательность превращения из макулы (пятна) в папулу (узелок), затем в везикулу (пузырек) и пустулу (гнойничок), которые подсыхают с образованием корок. После отпадения корок на коже остаются рубцы (рябины). По тяжести течения различают тяжелую форму («черная» и сливная оспа) со 100% летальностью, среднюю с летальностью 20-40% и легкую с летальностью 1-2%. К числу легких форм натуральной оспы относится вариолоид – оспы у привитых. Вариолоид характеризуется отсутствием лихорадки, малым количеством оспенных элементов, отсутствием пустул или сыпи вообще.
Иммунитет. У переболевших людей формируется стойкий пожизненный иммунитет, обусловленный выработкой антител, интерферона, а также клеточными факторами иммунитета. Прочный иммунитет возникает также в результате вакцинации.
Лабораторная диагностика. Работа с вирусом натуральной оспы проводится в строго режимных условиях по правилам, предусмотренным для особо опасных инфекций. Материалом для исследования служит содержимое элементов сыпи на коже и слизистых оболочках, отделяемое носоглотки, кровь, в летальных случаях – кусочки пораженной кожи, легкого, селезенки, кровь. Экспресс-диагностика натуральной оспы заключается в обнаружении: а) вирусных частиц под электронным микроскопом; б) телец Гварниери в пораженных клетках; в) вирусного антигена с помощью РИФ, РСК, РПГА, ИФА и других специфических реакций. Выделение вируса осуществляют в куриных эмбрионах или клеточных культурах. Идентификацию вируса, выделенного из куриного эмбриона, проводят с помощью РН (на куриных эмбрионах), РСК или РТГА. Вирус, выделенный на культуре клеток, обладает гемадсорбирующей активностью по отношению к эритроцитам кур, поэтому для его идентификации используют реакцию торможения гемадсорбции и РИФ. Серологическую диагностику осуществляют с помощью РТГА, РСК, РН в куриных эмбрионах и на культурах клеток.
Специфическая профилактика и лечение. Живые оспенные вакцины готовят накожным заражением телят или куриных эмбрионов вирусом вакцины (осповакцины). Повсеместная вакцинация населения привела к ликвидации натуральной оспы на земном шаре и отмене с 1980 г. обязательного оспопрививания. Поэтому оспенные вакцины необходимо использовать только по эпидемическим показаниям с целью экстренной массовой профилактики. Методы введения вакцин – накожно или через рот (таб-летированная форма). После вакцинации формируется прочный иммунитет.
Для лечения натуральной оспы, помимо симптоматической терапии, применяли химиотерапевтический препарат – метисазон.
Не нашли то, что искали? Воспользуйтесь поиском:
источник
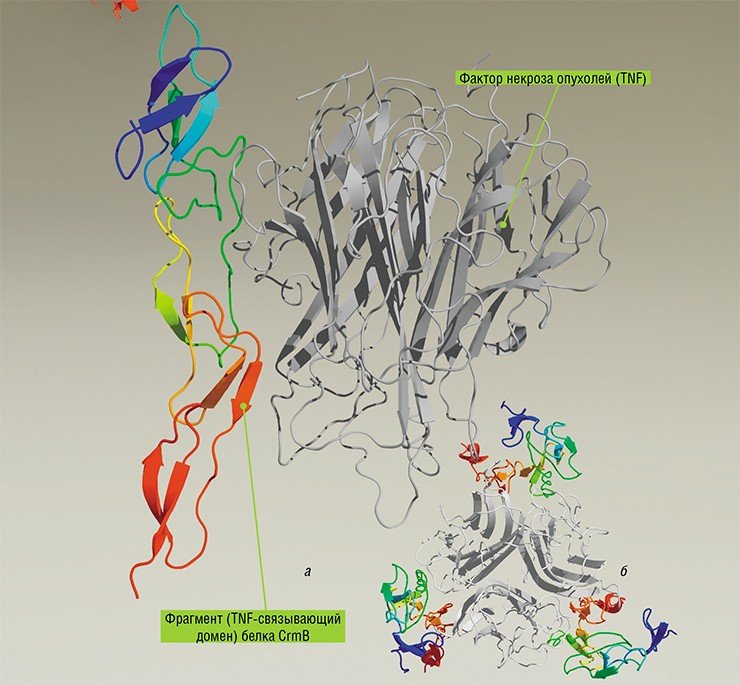
| Семейство поксвирусов (Poxviridae): Вирус натуральной оспы |
| Автор: http://www.eurolab.ua/ |
| 03 Марта 2011 |
| В многочисленное семейство поксвирусов (лат. рох — пустула) включены вирусы, патогенные для млекопитающих, птиц, рыб, амфибий и насекомых. Главное значение в патологии имеют вирус натуральной оспы, а также вирус контагиозного моллюска, вирус оспы обезьян, вирус оспы коров (осповакцина). Вирус натуральной оспы (ВНО) является возбудителем грозных эпидемий, известных человечеству в течение нескольких тысячелетий. В 1892 г. Г. Гварниери описал околоядерные включения (тельца Гварниери) в клетках роговицы глаза инфицированного кролика, а в 1906 г. Э. Пашен обнаружил вирусные корпускулы (элементарные тельца Пашена) в жидкости оспенных везикул, использовав для этого особый метод окраски. Структура и химический состав. ВНО является самым крупным — 200-300 нм, имеет кирпичеобразную форму с закругленными углами. При окраске по методу Пашена или Морозова вирусы становятся различимыми в световом микроскопе в виде мелких зерен. Вирионы имеют сложное строение. В центре располагается сердцевина в форме гантели, которая окружена белковым капсидом. В ней содержатся ДНК, внутренние белки. К центру сердцевины примыкают два латеральных тела, функция которых неизвестна. Наружная оболочка вириона содержит липиды и трубчатые белковые структуры, образующие характерные выступы. ДНК представлена двунитевой нефрагментированной молекулой, содержащей десятки генов. В составе вириона содержится 30 белков, и около 50 белков находятся в инфицированных клетках. Свыше 10 вирусных белков являются ферментами, катализирующими преимущественно нуклеиновый синтез: ДНК-зависимая РНК-полимераза, нуклеозид-трифосфатфос-фогидролаза, ДНК-аза и др. Антигены. Нуклеопротеиновый антиген NP, общий для всего семейства, располагается в сердцевине вириона. Во внешней оболочке содержатся гликолизированные белки, являющиеся протективными антигенами. Это вирусный гемагглютинин, имеющий липопротеидную природу, термолабильный и термостабильный растворимые антигены. Культивирование и репродукция. Вирус культивируется в куриных эмбрионах, на хорионаллантоисной оболочке которых образуются белые вирусные бляшки-оспины, а также в первичных и перевиваемых культурах клеток человека и животных (обезьян, свиней, овец и др.), с характерным ЦПД в виде очаговой дегенерации клеточного пласта. Идентификация вируса проводится в реакции гемадсорбции. Цикл репродукции завершается за 6-7 ч. В цитоплазме клеток формируются круглые или серповидные включения — тельца Гварниери, которые располагаются в околоядерной зоне цитоплазмы. Аналогичные включения обнаружены в оспенных пустулах человека. Это имеет диагностическое значение. Репродукция вируса начинается с транскрипции сверхранних мРНК, кодирующих синтез «раздевающего» белка (он завершает депротеинизацию вирионов), после чего синтезируются ранние мРНК, транслирующие информацию о синтезе вирусспецифической репликазы. С дочерних молекул ДНК транслируется информация о синтезе многочисленных структурных и функциональных вирусных белков. Формирование вирионов происходит в цитоплазме клетки хозяина. Зрелые вирионы доставляются через аппарат Гольджи к клеточной оболочке и при выходе из клетки приобретают двухслойную внешнюю оболочку из компонентов клетки хозяина. Патогенез и иммунитет. Вирус проникает в организм через слизистую оболочку верхних дыхательных путей и локализуется в регионарных лимфатических узлах. После первичной репродукции поступает в кровь, разносится по всему организму и локализуется в клетках лимфоидной ткани, в которых происходит вторичная репродукция вируса. Вирус выделяется из крови только в первые дни болезни. Кожные поражения появляются после его проникновения из крови в клетки эпидермиса. Образующиеся на коже пустулы могут быть контаминированы стафилококком, что приводит к бактериемии и даже сепсису. Интенсивное выделение вируса из организма происходит с 6-го по 9-й день болезни из очагов поражения слизистых оболочек рта. На месте пустул развивается некроз кожи, в результате у перенесших заболевание остаются рубцы. В клетках кожи появляются цитоплазматические, ацидофильные включения — тельца Гварниери. Новорожденный получает материнские антитела, которые исчезают через несколько месяцев после рождения. После заболевания развивается пожизненный постинфекционный иммунитет. При вакцинации антитела появляются через 8-9 дней и достигают максимальных титров через 3 недели. Механизм иммунитета связан как с вируснейтрализующими антителами, так и с клеточными факторами. В клеточном иммунитете большую роль играет реакция ГЗТ, которая подавляет репродукцию вируса и его распространение в организме, и интерферон. Эпидемиология. Вирус устойчив к высушиванию. Он длительное время остается жизнеспособным в корочке пустул, в жидкости везикул, инфицируя соприкасающиеся с ними предметы. Вирус оспы устойчив к действию обычных концентраций дезинфектантов. При нагревании до 50°С инактивируется в течение 30 мин., при 100°С — через несколько секунд. Источником инфекции являются больные люди в течение всего периода болезни. Инфекция передается воздушно-капельным и контактным путем через предметы обихода и одежду больного. В прошлом эпидемии оспы возникали во многих странах мира. В нашей стране она ликвидирована к 1937 г. Однако отдельные заносные случаи заболеваний регистрировались до 1960 г. В 1967 г. ВОЗ разработала план мероприятий по ликвидации оспы в мире, который успешно был воплощен в жизнь при активном участии нашей страны. Последний случай заболевания был зарегистрирован в Сомали в 1977 г. Однако в конце 70-х годов в странах Экваториальной Африки наблюдались заболевания вызванные вирусом оспы обезьян, который до этого считали непатогенным для человека. В настоящее время по рекомендации ВОЗ обязательная вакцинация против оспы отменена. Лабораторная диагностика. Для экспресс-диагностики в острый период заболевания используют вирусоскопию, иммунофлюоресцентный метод и выявление антигенов в инфекционном материале. Выделяют вирус путем заражения куриных эмбрионов и перевиваемых культур клеток человека. Серодиагностику проводят в РТГА, РСК и реакции нейтрализации. источник 111. Возбудитель натуральной оспы. Таксономия. Характеристика. Лабораторная диагностика. Специфическая профилактика оспы на современном этапеТаксономия. Вирус натуральной оспы — ДНК-содержащий, семейство Poxviridae, род Orthopoxvirus. Морфология и антигенная структура. Вирионы поксвирусов имеют кирпичеобразную или овоидную форму. Вирус натуральной оспы — один из самых крупных вирусов, обнаружен в световом микроскопе. Вирионы видны при специальных методах окраски в виде так называемых элементарных телец Пашена (окраска серебрением по Морозову). Поверхность вириона состоит из нитевидных, овоидных элементов. Оболочка и наружная мембрана вириона заключают сердцевину (ДНК и белки) и мембрану сердцевины. Геном вириона — двунитевая линейная ДНК с ковалентно замкнутыми концами. Вирусы имеют более 30 структурных белков. Антигены — нуклеопротеиновый, растворимые и гемагглютинин; имеются общие антигены с вирусом вакцины. Культивирование. Вирус размножается: в куриных эмбрионах с образованием белых бляшек на хорион-аллантоисной оболочке; в культуре клеток, в цитоплазме которых формируются характерные околоядерные включения. Резистентность. Вирусы устойчивы к высушиванию и низким температурам, нечувствительны к эфиру. Моментально погибают при 100С, а при 60С — через 15 мин. Эпидемиология. Особо опасная конвенционная (карантинная) инфекция. Источником инфекции является больной человек, который заразен с последних дней инкубационного периода и до отпадения корок высыпаний. Инфицирование происходит воздушно-капельным, воздушно-пылевым, а также контактно-бытовым путями при соприкосновении с вещами больного, загрязненными слизью, гноем, калом и мочой, содержащими вирус. Патогенез. Вирус проникает через слизистые оболочки верхних дыхательных путей, реже — через кожу и после размножения в регионарных лимфатических узлах попадает в кровь. Из крови возбудитель заносится в кожу и лимфоидные ткани, в которых происходит размножение вирусов, формируются очаги поражения в коже, слизистых оболочках и паренхиматозных органах. Характерно образование папулезных высыпаний. Клиника. Инкубационный период 7—17 дней. Заболевание проявляется высокой температурой тела, рвотой, головной и поясничной болями, появлением сыпи. Первоначально сыпь имеет вид розовых пятен, которые затем переходят сначала в узелки — папулы, а затем — в пузырьки (везикулы) и пустулы , подсыхающие и превращающиеся в корки. Различают несколько форм оспы: тяжелую (пустулезно-геморрагическая); среднетяжелую; легкую (оспа без сыпи, оспа без повышения температуры тела). Иммунитет. После перенесенной болезни формируется стойкий пожизненный иммунитет, обусловленный появлением вируснейтрализующих антител, интерферонов и активацией факторов клеточного иммунитета. Микробиологическая диагностика. Исследуют содержимое элементов сыпи, отделяемое носоглотки, кровь, пораженные органы и ткани. Вирус выявляют при электронной микроскопии, в РИФ, РП, по образованию телец Гварниери. Выделяют вирус путем заражения куриных эмбрионов и культур клеток с последующей идентификацией в реакции нейтрализации (на куриных эмбрионах), РСК, РТГА. Серологическую диагностику проводят в РТГА, РСК, РИГА, реакции нейтрализации. Лечение. Симптоматическое; индукторами интерферона и противовирусными препаратами. Профилактика. Прочный иммунитет создает живая оспенная вакцина. Ее готовят из соскобов сыпи телят или при культивировании вируса вакцины (осповакцины) на куриных эмбрионах. Вакцину вводят накожно. Разработана оральная таблетированная вакцина, менее реактогенная. источник Человеку, как и другим животным, постоянно приходилось бороться с окружающими его патогенными микроорганизмами, что обусловило появление и развитие у нас систем врожденного и приобретенного иммунитета. Однако нарушения в регуляции работы этих механизмов, защищающих от внешних «агрессоров», приводят к развитию хронических воспалительных и аутоиммунных болезней, с трудом поддающихся лечению. Для терапии таких заболеваний, как астма, атеросклероз, системная красная волчанка, псориаз, ревматоидный артрит, рассеянный склероз и другие, такие как вирус натуральной оспы, используются человеческие антитела, блокирующие белковые факторы воспаления. Оказалось, что для этих целей можно использовать и белки инфекционных микроорганизмов, которые эволюционно адаптированы к преодолению защитных систем организма. Особый интерес для медицинской биотехнологии представляют высоко патогенные вирусы, для которых человек является единственным хозяином. И сегодня на основе белков вируса натуральной оспы, столетиями являвшегося настоящим бичом цивилизаций, создаются препараты для коррекции тяжелейших патологических состояний неинфекционной, в том числе аутоиммунной, природы Вплоть до открытий Антони ван Левенгука в XVII в. человечество и не подозревало, что живет в среде, наполненной множеством разнообразных мельчайших существ. Эти микроорганизмы настолько малы, что их можно увидеть, лишь вооружившись хорошим микроскопом: оптическим – для изучения бактерий и других одноклеточных, сложным и дорогим электронным – для получения «портретов» вирусов. Большинство микроорганизмов сосуществует с человеком и животными вполне миролюбиво, а многие – и на взаимовыгодных началах, однако некоторые из них нарушают «мирный договор», переходя в разряд болезнетворных. Удивительно, но способность таких патогенных микроорганизмов преодолевать защитные системы организма хозяина можно использовать нам во благо. Особый интерес для современной медицинской биотехнологии представляют высокопатогенные вирусы, такие как вирус натуральной оспы, для которых человек является единственным хозяином. На основе белков этих вирусов сегодня создаются препараты для лечения тяжелых хронических воспалительных заболеваний неинфекционной, в том числе аутоиммунной, природы Микроорганизмы обитают везде: в воздухе и в воде, в почве и в наших собственных телах… По сравнению с человеком и животными размножаются они чрезвычайно быстро, и их сообщества неизмеримо многочисленнее. Так, если человечество перевести в масштаб микромира, то все 7 млрд человек легко уместились бы в стандартной микробиологической колбе. Чтобы выжить, человеку, как и другим животным, постоянно приходилось бороться с окружающими его патогенными микроорганизмами. Такие события в эволюционной истории происходили многократно, чем и обусловлено появление и развитие у млекопитающих большого числа защитных механизмов, обеспечивающих их выживание в «микробном бульоне» тонкой биосферной прослойки нашей планеты. Среди защитных реакций организма самая «быстрая» – неспецифическая, т. е. направленная против любых вирусов, микробов и биологических макромолекул. Речь идет о системе врожденного иммунитета, настроенной на распознавание и последующее реагирование на молекулярные компоненты микроорганизмов, представляющих угрозу. Важную роль в ранней неспецифической защите организма от инфекции играют хорошо всем знакомые воспалительные процессы, которые препятствуют распространению патогена в первые часы и дни после инфицирования. Специфическая защита организма против конкретного инфекционного агента – адаптивный или приобретенный иммунитет, развивается медленнее и представляет собой сложное взаимодействие иммунных клеток разного типа, регулируемое специальными белками. Все эти системы защищают нас от внешних «агрессоров», однако нарушения в их работе могут приводить к развитию патологических состояний, сопровождающихся хроническими воспалительными и (или) аутоиммунными реакциями, такими как астма, атеросклероз, системная красная волчанка, псориаз, ревматоидный артрит, рассеянный склероз и другие тяжелые болезни, с трудом поддающиеся лечению. В настоящее время разрабатываются методы так называемой «биологической» терапии подобных заболеваний, основанные на блокировании избыточной активации защитных систем с помощью различных биологических макромолекул. В том числе для этого используют человеческие антитела, способные специфично взаимодействовать и дезактивировать белки врожденной и адаптивной систем иммунитета, сверхсинтез которых и приводит к развитию патологий. Но что если использовать для этих целей белки патогенных микроорганизмов, таких как вирусы, эволюционно-адаптированных к преодолению защитных систем организма, обернув, образно говоря, зло во благо? Царство вирусов было открыто более ста лет назад выдающимся русским ученым Д. И. Ивановским, однако изучить эти мельчайшие организмы удалось лишь в последние десятилетия благодаря бурному развитию инструментальных методов исследований. Хотя вирусы очень разнообразны по своей организации и функционированию, все они способны размножаться лишь в клетках других организмов, одноклеточных и многоклеточных. В процессе длительной совместной эволюции с организмом хозяина вирусы постоянно «пробуют» новые варианты подавления защитных реакций хозяина или их «обмана» за счет молекулярной мимикрии. В частности, вирусы могут включать в состав своего генома кодирующие последовательности клеточных генов, участвующих в регулировании иммунных реакций, и модифицировать их, приспосабливая для обеспечения собственной жизнедеятельности. Разные вирусы млекопитающих отличаются не только по размеру генома и самих вирусных частиц, но и по стратегии своего развития в организме хозяина. Вирусы различных семейств демонстрируют удивительное разнообразие в механизмах преодоления систем врожденного и адаптивного иммунитета млекопитающих. Поэтому изучение этих особенностей вирусов позволяет выявить новые закономерности организации и функционирования защитных систем животных и человека, обеспечивающих выздоровление после инфицирования болезнетворным агентом. Большинство вирусов способно заражать широкий спектр видов животных (круг хозяев). Однако для медицинской биотехнологии особый интерес представляют высокопатогенные и при этом антропонозные вирусы, для которых человек является единственным хозяином. В этом случае вирус может очень эффективно подавлять (или «уходить» от атаки) иммунные реакции именно человеческого организма. Генотипические исследования таких вирусов и выявление вирусных белков, эффективно подавляющих развитие воспалительных процессов в ответ на инфекцию, создает предпосылки для создания новых препаратов, предназначенных для лечения хронических воспалительных заболеваний неинфекционной природы. Удивительный пример высокой патогенности для человека и строгой антропонозности представляет собой вирус натуральной оспы. Этот вирус, предположительно, исходно имел широкий круг хозяев, однако в процессе эволюции утратил способность размножаться в организме других млекопитающих, сохраняясь в эндемичном (т. е. свойственном только данной местности) состоянии в течение многих столетий в густонаселенных районах, прежде всего, Индийского субконтинента (Щелкунов, 2012). При этом вирус натуральной оспы не способен находиться в организме человека в латентном состоянии или вызывать хроническую инфекцию – болезнь всегда заканчивается либо выздоровлением, либо гибелью инфицированного. Это снижает вероятность выживания вируса в природе и свидетельствует о том, что он попал в своеобразный эволюционный «тупик»; с другой стороны, размножаясь из поколения в поколение только в организме человека, вирус натуральной оспы максимально приспособился на молекулярном уровне к преодолению многоярусных механизмов врожденного и адаптивного иммунитета человека (Щелкунов, 2011). Такие свойства особо опасного вируса натуральной оспы позволили предположить, что его белки можно использовать для терапии различных иммунопатологий человека (Щелкунов, 1995). И сегодня в ГНЦ вирусологии и биотехнологии «Вектор» (Кольцово, Новосибирская обл.) идет работа над созданием лекарственных препаратов нового поколения на основе белков, секретируемых поксвирусами, к которым принадлежит и вирус натуральной оспы. Как уже упоминалось, главной причиной аутоиммунных заболеваний является разбалансировка иммунитета, в том числе сверхсинтез веществ, провоцирующих воспалительные реакции. Одним из ключевых цитокинов иммунного воспалительного ответа является фактор некроза опухолей (TNF) – именно его повышенная продукция приводит к таким болезням аутоиммунной природы, как псориаз, болезнь Крона, ревматоидный артрит и т. п. Высокий уровень продукции TNF обусловливает и тяжелую патологию, часто завершающуюся летальным исходом – септический или эндотоксический шок. Воспрепятствовать связыванию TNF с его белковыми рецепторами, зафиксированными на клеточных мембранах, можно с помощью соответствующих моноклональных антител либо так называемых растворимых форм его рецепторов, которые представляют собой внеклеточные домены (участки) рецепторных белков и обычно обнаруживаются в сыворотке и других биологических жидкостях. Присоединение подобных молекул к TNF должно инактивировать этот цитокин и уменьшить вызванный им воспалительный процесс. Действительно, в модельных лабораторных экспериментах было доказано терапевтическое действие анти-TNF антител при лечении ряда патологий, обусловленных повышенной продукцией TNF. Однако попытки использовать для этих целей напрямую растворимые клеточные TNF-рецепторы не дали положительных результатов. Успеха удалось добиться лишь с помощью методов генетической инженерии, когда были созданы так называемые химерные белки, состоящие из TNF-связывающей части клеточных рецепторов и фрагмента иммуноглобулина человека. Уже несколько таких биологических терапевтических средств, созданных на основе белков человеческого организма, в течение ряда лет успешно применяются в клинической практике для терапии воспалительных заболеваний неинфекционной природы. Это, в первую очередь, «Etanercept» (на основе химерного белка), а также «Infliximab» и «Adalimumab» (на основе моноклональных человеческих антител); недавно этот список пополнился еще двумя аналогичными препаратами. Однако клинические исследования показали, что пациенты, страдающие ревматоидным артритом или другим воспалительным или аутоиммунным заболеванием, оказываются избирательно чувствительны лишь к одному из этих анти-TNF препаратов. Кроме того, поскольку все эти препараты имеют белковую природу, они сами по себе являются мишенью для иммунной системы больных, поэтому при длительной терапии их эффективность может снижаться. Это означает, что при потере чувствительности к одному препарату его требуется заменить на другой. И вот здесь на помощь терапевтам могут придти новые лекарственные средства на основе вирусных белков. Например, в ГНЦ ВБ «Вектор» уже разрабатываются анти-TNF препараты на основе TNF-связывающих белков поксивирусов. РЕВМАТОИДНЫЙ АРТРИТ — системное аутоиммунное заболевание соединительной ткани, проявляющееся главным образом хроническим воспалением суставов: голеностопных, лодыжек, коленей и кистей рук. СЕПСИС (от греч. «гниение») – тяжелое инфекционное заболевание человека, которое развивается как системная воспалительная реакция при попадании в кровь инфекционных агентов (бактерий или одноклеточных грибов) или их токсинов. Тяжесть заболевания нередко связана с развитием так называемого септического шока (инфекционно-токсический шок, эндотоксический шок), который чаще развивается при инфекции грамотрицательными бактериями и стафилококками и сопровождается нарушением функции легких, печени и почек, изменением свертывающей системы крови. Методами генетической инженерии здесь были созданы рекомбинантные бакуловирусы, способные продуцировать в клеточной культуре TNF-связывающий белок (CrmB), характерный для вирусов оспы коров, оспы обезьян и натуральной оспы. Однако на экспериментальной модели эндотоксического шока было показано, что существенным терапевтическим эффектом обладает лишь белок CrmB вируса натуральной оспы (Gileva et al., 2006). Именно этот белок или его реконструированные варианты могут стать действующим началом новых средств анти-TNF терапии (Гилева и др., 2009). Возможности медицинского «приложения» вирусных белков далеко не исчерпываются одной лишь анти-TNF терапией. Так, еще одним воспалительным цитокином является широко известный гамма-интерферон (γ- IFN). И в настоящее время вторую стадию клинических испытаний уже проходит препарат «Fontolizumab», созданный на основе человеческих моноклональных анти-IFNγ антител и предназначенный для лечения некоторых аутоиммунных заболеваний. Однако эффективным ингибитором IFNγ человека может оказаться и IFNγ-связывающий белок, секретируемый вирусом натуральной оспы. Такой белок, полученный в ГНЦ ВБ «Вектор», эффективно ингибировал защитное действие человеческого гамма-интерферона при заражении культуры клеток легкого эмбриона человека вирусом энцефаломиокардита мышей. По этой характеристике вирусный белок значительно превосходил препарат на основе человеческих клеточных IFNγ-рецепторов. (Непомнящих и др., 2005). На сегодня имеется много данных о том, что воспалительный процесс и гистопатологические изменения при ряде воспалительных и аутоиммунных заболеваний нервной системы, артрите, гломерулонефрите, системной красной волчанке и других болезнях во многих случаях обусловлены активацией системы комплемента крови, представляющей собой еще одну из систем неспецифического иммунитета. Комплемент играет важную роль и в реакции отторжения трансплантата. Поксвирусы кодируют особый белок (КСБ), способный ингибировать активацию комплемента, причем наиболее эффективно с белками комплемента человека взаимодействует белок того же вируса натуральной оспы. Сегодня считается, что именно этот вирусный белок может стать перспективным препаратом для лечения болезни Альцгеймера, синдрома мультиорганной дисфункции и отторжения ксенотрансплантатов (Jha, Kotwal, 2003). Так, на лабораторных животных было показано, что рекомбинантный КСБ способствует восстановлению функций мозга после средней и тяжелой черепно-мозговой травмы. Этот белок оказался эффективен и при травмах спинного мозга: при его применении значительно уменьшались гистопатологические изменения, вызванные воспалительными реакциями. В патогенезе воспалительных и аутоиммунных заболеваний важную роль играют и хемокины – обширное семейство небольших белков, имеющих очень сходную третичную структуру. Поксвирусы кодируют хемокинсвязывающие белки, по аминокислотной последовательности не имеющие гомологов среди известных белков позвоночных. Их высокий терапевтический потенциал был показан на ряде лабораторных моделей воспалительных и аутоиммунных заболеваний (Непомнящих, Щелкунов, 2008). Таким образом, предположение ученых, что вирусные белки, являющиеся антагонистами иммунных белков-регуляторов, можно использовать в терапевтических целях, полностью подтвердилось. Сегодня на их основе с помощью методов генетической инженерии уже разрабатываются препараты нового поколения для коррекции патологических состояний человека, связанных с избыточной активацией белков-медиаторов защитных систем организма. И с этой точки зрения, мы можем по-новому взглянуть на смертельно опасный для человека вирус натуральной оспы: результаты лабораторных исследований и доклинических испытаний свидетельствуют о большой перспективности препаратов для лечения тяжелейших воспалительных и аутоиммунных заболеваний человека, созданных на основе белков этого вируса, на протяжении столетий бывшего настоящим бичом цивилизаций. Непомнящих Т. С., Щелкунов С. Н. Иммуномодулирующие белки поксвирусов как новые средства иммунокорректирующей терапии // Молекуляр. биология. 2008. Т. 42, №. 5. С. 904–912. Щелкунов С. Н. Вирус натуральной оспы – источник новых медицинских препаратов // Соросовский образовательный журнал. 1995. № 1. С. 28—31. Щелкунов С. Н. Генетическая инженерия: Учеб.-справ. пособие. 3-е изд., испр. и доп. Новосибирск: Сиб. универ. изд-во, 2008. 514 с. Щелкунов С. Н. Преодоление ортопоксвирусами защитных систем организма млекопитающих // Молекуляр. биология. 2011. Т. 45, № 1. С. 30—43. Щелкунов С. Н. Оспа – дамоклов меч цивилизаций // Наука из первых рук. 2012. № 6 (48). С. 96—109. Shchelkunov S. N. Orthopoxvirus genes that mediate disease virulence and host tropism // Advances in Virology. 2012. Vol. 2012, Article ID 524743, 17 p. doi:10.1155/2012/524743. Автор и редация благодарят к. б. н. Д. В. Антонец (ФБУН ГНЦ ВБ «Вектор») за помощь в подготовке иллюстративного материала Работа выполнена при финансовой поддержке РФФИ (грант 12-04-00110а) источник |