1. Истощение энергетических ресурсов.
3. Дисфункция сердечно-сосудистой системы.
4. Угнетение центральной нервной системы.
VI. Лихорадка и перегревание: сходства и различия.
Пирогенно необусловные гипертермии принято называть лихорадоподобными состояниями (ЛПС, перегревание).
При перегреванииреакция аппарата терморегуляции не имеет системного характера, повьппение температуры тела обычно связано с влиянием на отдельные звенья терморегуляции или непосредственно на обмен веществ в тканях.
Неврогенные ЛПС подразделяют на центрогенные, психогенные и рефлексогенные.
Центрогенные ЛПС могут возникать при повреждении различных отделов головного мозга (кровоизлияниях, опухолях, травме, отеке мозга и т.п.). Причиной развития психогенных ЛПС могут быть,функциональные нарушения высшей нервной деятельности (невроз, психические расстройства), значительное эмоционально-умственное напряжение; описаны случаи возникновения гипертермии под влиянием гипнотического внушения.
Рефлексогенные ЛПС могут наблюдаться при почечнокаменной болезни, желчнокаменной болезни, раздражении брюшины, катетеризации уретры и т.д. При этом, как правило, возникает болевой синдром; нельзя исключить в некоторых случаях и микроповреждения тканей, приводящего к образованию первичных неинфекционных пирогенов. В таких случаях, очевидно, наряду с рефлекторным механизмом будет участвовать и обычный механизм действия пирогенных веществ.
Эндокринные ЛПС наблюдаются при некоторых эндокринопатиях, в частности, при гипертиреозах.
Лекарственные ЛПСвозникают при энтеральном или парентеральном введении некоторых фармакологических препаратов (кофеина, эфедрина, метиленовой сини, гипе-росмолярных растворов и др.
Дифферениальные признаки лихорадки и перегревания представлены в таблице 2.10.1.
| Таблица 2.10.1. Отличительные признаки перегревания организма и лихорадки | ||
| Признак | Перегревание организма | Лихорадка |
| Этиология | Уменьшение теплоотдачи. Травмы, кровоизлияния, опухоли, инфекции головного мозга. Химические соединения, нарушающие сопряженность между свободным дыханием и фосфорилированием. | Воздействие пирогенных веществ на центр терморегуляции. |
| Патогенез | Формирование функциональной системы, поддерживающей гипертермию при действии высокой температуры окружающей среды или факторов, затрудняющих термолиз. | Функциональная перестройка ценра терморегуляции, наблюдающаяся в результате действия пирогенных веществ. |
| Состояние терморегуляции | Температура тела начинает повышаться после того, как теплоотдача оказывается меньше теплопродукции. | Температура тела активно регулируется на новом уровне. |
| Направленность изменений терморегуляции | На термолиз. | На термогенез. |
| Чем определяется степень повышения температуры | Физическими условиями теплообмена организма с окружающей средой. | Уровнем смещения «установочной точки» в центре терморегуляции, 1 |
| Признак | Перегревание организма | Лихорадка |
| Озноб | Отсутствует. | Отмечается в I стадии. |
| Усиленное потоотделение | Как правило, есть. | Отмечается в III стадии. |
| Эффективность жаропонижающей терапии | Не эффективна. | Эффективна. |
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Для студентов недели бывают четные, нечетные и зачетные. 9174 — 

источник
Лихорадка как часть ответа острой фазы. Отличия лихорадки от перегревания. Значение лихорадочной реакции. Механизм защитного действия лихорадки.
· ОТЛИЧИЕ ЛИХОРАДКИ ОТ ПЕРЕГРЕВАНИЯ
Для возникновения лихорадки главным этиологическим фактором является первичный пироген, а для развития перегревания — высокая температура окружающей среды (в условиях жаркого климата, производства).
Механизм повышения температуры тела при лихорадке абсолютно не идентичен таковому при перегревании. При лихорадке происходит смещение «установочной точки» на более высокий уровень функционирования под влиянием пирогенов. Перестройка функции центра теплорегуляции при лихорадке направлена на активную задержку тепла в организме независимо от внешней температуры, при этом механизмы терморегуляции сохранены. При перегревании не происходит смещения «установочной точки» теплорегулирующего центра. При перегревании организм стремится освободиться от лишнего тепла путем максимального напряжения процессов теплоотдачи, чему препятствует повышенная температура окружающей среды. Таким образом, при перегревании механизмы терморегуляции нарушены: при высокой температуре воздуха, высокой влажности воздуха, отсутствии ветра теплоотдача существенно снижена.
Как было сказано, повышение температуры тела при лихорадке связано со сдвигом «установочной точки» теплорегуляции на новый, более высокий уровень функционирования для активной задержки тепла в организме. В отличие от лихорадки повышение температуры тела при перегревании является не активным, а пассивным процессом, и деятельность теплорегулирующих центров направлена не на накопление в организме тепла, а на воспрепятствование изменению температурного гомеостаза.
При лихорадке процесс активного повышения температуры тела обычно останавливается, когда она достигает 41 °С (за счет системы эндогенного антипиреза). При перегревании такого ограничения нет: температура тела может повышаться вплоть до гибели организма.
Человека лихорадит одинаково в широком диапазоне температур внешней среды (т.е. развитие лихорадки не зависит от внешней температуры). При перегревании же степень повышения температуры тела напрямую зависит от условий теплоотдачи во внешнюю среду (т.е. от температуры среды).
Кроме этого, лихорадка и перегревание отличаются по последствиям их развития для организма. Лихорадка как типовой патологический процесс имеет двоякое значение для организма — положительное и отрицательное (см. выше раздел 11.7). Перегревание имеет отрицательное воздействие на организм (см. раздел 2.5), если только не используется с лечебной целью (см. раздел 11.10).
· Защитно-приспособительное значение лихорадки подтверждается следующими наблюдениями:
• при лихорадке усиливается иммунный ответ организма вследствие активации Т- и В-лимфоцитов, ускорения превращения последних в плазматические клетки, что стимулирует образование антител; повышается образование интерферона;
• умеренная степень подъема температуры тела может активировать функцию фагоцитирующих клеток и NK-клеток (натуральные киллеры);
• активируются ферменты, угнетающие репродукцию вирусов;
• замедляется размножение многих бактерий и снижается устойчивость микроорганизмов к лекарственным препаратам;
• возрастают барьерная и антитоксическая функции печени;
• гепатоциты усиленно продуцируют так называемые белки острой фазы; некоторые из этих протеинов связывают бивалентные катионы, необходимые для размножения микроорганизмов;
• кроме того, повышение температуры тела при лихорадке достаточно часто является первым и единственным признаком какого-либо заболевания, это сигнал тревоги.
Отрицательное воздействие лихорадки на организм выявляется главным образом при резко выраженном и длительном повы-
шении температуры тела. Оно связано со стимуляцией функции сердца, которая может привести к развитию перегрузочной формы сердечной недостаточности, особенно у людей пожилого и старческого возраста, а также у пациентов, ранее уже имевших то или иное заболевание сердца. Представляет опасность возможность развития коллапса при критическом снижении температуры тела в заключительную стадию лихорадки. При лихорадке высокой степени может произойти подавление иммунных реакций. Установлено, что умеренная лихорадка повышает выживаемость инфицированных животных, а чрезмерно высокая лихорадка увеличивает летальность. У детей при высокой лихорадке могут развиться судороги, которые не всегда устраняются приемом жаропонижающих препаратов. При температуре выше 41 °С у детей может развиться отек мозга или острая недостаточность кровообращения из-за лабильности водно-солевого обмена. Длительно лихорадящие больные (при туберкулезе, бруцеллезе, сепсисе) обычно находятся в состоянии резкого истощения и ослабления жизненных функций. Конечно, при инфекционных заболеваниях нарушения вызываются не только действием высокой температуры, но и микробными токсинами.
Понятие «неоплазия». Особенности опухолевого роста (злокачественная пролиферация, клональный характер, метаплазия, инвазивность). Характеристика анаплазии опухолей. Понятие о прогрессии опухолей.
Опухолевый рост или неоплазия, типовой патологический процесс характеризующийся безудержным размножением клеток с нарушением их роста и дифференцировки, обусловленных нарушениями их генетического аппарата – соматические мутации.
Основные свойства опухоли : аутохтонность, бесконтрольный рост, атипизм.
Анаплазия (от др.-греч. ἀνα- ‘назад, обратно’ и πλάσις ‘образование’) — переход живых клеток и тканей в недифференцированное состояние, вплоть до полной невозможности определения происхождения клетки. При этом клеточная ткань теряет способность выполнять свои характерные функции, однако приобретает способность к неограниченному росту. Анаплазия часто встречается у быстро растущих злокачественных опухолей.
Опухоль растет за счет размножения своих клеток и снабжается питательными веществами и стимуляторами роста от организма — хозяина через кровь.
Доказано, что опухоль вырабатывает фактор, стимулирующий пролиферацию эндотелиальных клеток кровеносных сосудов нормальной ткани и врастание сосудов внутрь опухоли.
Особенностями роста опухоли является относительно независимый от регулирующих влияний организма — «автономный» — рост. Ее клетки слабее реагируют на контролирующие рост факторы, чем клетки соответствующих нормальных тканей. Степень автономности опухоли может нарастать в ходе ее развития.
Рост опухоли не обусловлен потребностями организма и приводит к нарушению постоянства, состава внутренней среды организма (гомеостаза). Даже после устранения фактора, явившегося причиной возникновения неопластических клеток, начавшийся рост опухоли продолжается, ибо стимул к пролиферации заложен в самих опухолевых клетках (Н. Н. Петров).
Свойства малигнизированных клеток. Нарушения обмена веществ в организме с опухолевым ростом. Механизмы инфильтративного роста опухолей. Механизмы метастазирования и исходы метастазов.
· Метастазирование (греч. metastasis — перемещение) — перенос опухолевых клеток с одного места на другое с последующим развитием опухолевого процесса.
Основные этапы метастазирования:
отделение опухолевых клеток от основного узла и попадание их в кровеносные или лимфатические пути;
циркуляция их в крови или лимфе;
прилипание к сосудистой стенке и образование опухолевого эмбола;
выход из сосуда в прилегающую ткань и пролиферация — с образованием метастатического узла.
Важную роль в метастазировании играет уменьшение прочности контактов опухолевых клеток друг с другом, что облегчает отрыв отдельных клеточных элементов от основной массы опухоли и занос их током крови или лифмы в отдаленные участки тела.
Не все опухолевые клетки, циркулирующие в крови и лимфе, дают начало метастазам, большая часть их погибает. Для образования метастазов имеет значение состояние того органа, в который попадают опухолевые клетки с током крови или лимфы. В эксперименте показано, что частота развития метастазов в определенном органе, например в печени, увеличивается после повреждения органа химическими и механическими воздействиями.
Хронический воспалительный процесс, травма или интоксикация могут создать благоприятные условия для развития метастазов.
Метастазы сохраняют основные свойства первичной опухоли, особенности ее строения, способность к образованию тех же продуктов жизнедеятельности или имеют более примитивное строение и состоят из клеток функционально менее зрелых.
Рецидив — возврат болезни (опухоли), характеризует злокачественный рост. Рецидивы бывают прямые ранние и отдаленные поздние. Прямые ранние рецидивы возникают вскоре после оперативного или лучевого лечения и представляют собой дальнейшее прогрессирование исходной опухоли.
Отдаленные поздние рецидивы возникают через несколько лет и не на прежнем месте, где была опухоль, а в регионарных лимфатических узлах или других местах.
· 4. Нарушения обмена веществ в организме — носителе опухоли. Кахексия
Злокачественные опухоли оказывают системное действие на организм-носитель опухоли. Это влияние выражается прежде всего в изменении обмена веществ в различных органах и тканях, не пораженных непосредственно опухолевым ростом.
Изменения белкового и азотистого обмена. Опухолевая ткань поглощает азот тканевых белков, пептидов, аминокислот и азотистых оснований нуклеотидов организма-носителя опухоли. Потребление азота раковыми клетками сопровождается уменьшением его содержания в здоровой ткани. В то же время рост злокачественной опухоли приводит к разрушению здоровых тканей и поэтому часть азотистых соединений (аммонийные соли, аминокислоты и др.), образованных вследствие увеличенного распада тканей, не улавливается опухолью и выводится с мочой. Кроме того, скорость образования мочевины в печени у больных злокачественными опухолями оказывается недостаточной для устранения аммиака, возникающего при распаде тканевых белков, что также способствует выделению с мочой азотистых соединений. Увеличение распада тканевых белков организма является одним из важных выражений его истощения — опухолевой кахексии. Увеличивается также выделение недоокисленных органических соединений, не содержащих азот (жирные кислоты и др.). Эти процессы изменяют соотношение в моче C/N в пользу углерода, что называется «дизоксидативная карбонурия». Однако это соотношение в некоторых случаях может даже уменьшиться, например в состоянии глубокого истощения — кахексии у больных со злокачественными новообразованиями.
Нарушения углеводного обмена. Усиление поглощения глюкозы тканью опухоли может вызвать у больных гипогликемию. Гипогликемическому действию опухоли противостоит стимуляция глюконеогенеза — эндогенного образования глюкозы из аминокислот и глицерина.
Другие нарушения. Стимуляция глюконеогенеза во время роста опухоли сопровождается распадом тканевых белков, например мышц, а также белков лимфатической ткани, вилочковой железы, селезенки, что нарушает функцию иммунологической системы и ослабляет иммунную защиту против опухоли.
В результате обеднения антиоксидантами в печени накапливаются перекиси ненасыщенных жирных кислот, что приводит к частичному разобщению дыхания и фосфорилирования в митохондриях печени организма — носителя опухоли. Увеличение содержания перекисей ненасыщенных жирных кислот наряду с обеднением мышц гликогеном приводит на последних стадиях опухолевого процесса к мышечной дистрофии в результате повреждения ими лизосом и выхода в цитоплазму протеоли-тических ферментов, усиливающих распад белков мышечных клеток.
Дата добавления: 2018-08-06 ; просмотров: 115 ; ЗАКАЗАТЬ РАБОТУ
источник
Положительная роль лихорадочной реакции послужила основанием для использования пирогенной терапии для лечения ряда заболеваний, таких как сифилис, малярии.
Лихорадка положительно влияет на целый ряд функций организма: возрастает интенсивность фагоцитоза, стимулируется выработка антител, увеличивается выработка интерферона.
В ряде случаев длительный лихорадочный процесс, сопровождающийся высокой температурой, оказывает отрицательное влияние на состояние организма. Развивается тепловая альтерация тканей. Может наблюдаться нарушение ряда физиологических функций: развивается периодическое дыхание, сердечные аритмии. Высокая лихорадка способствует накоплению в организме метаболитов, что вызывает явления интоксикации с потерей сознания и судорогами. Особенно опасна такая лихорадка у детей, так как дети еще не обладают устойчивой терморегуляцией. Тяжело переносят лихорадку люди пожилого возраста и с заболеваниями сердечно-сосудистой системы. Критическое падение температуры в III стадию лихорадки сопровождается резким снижением сосудистого тонуса и может вызвать у больного развитие коллапса.
VIII.Реактивность
1.Реактивность— свойство (способность) целостного организма отвечать дифференцированно изменением жизнедеятельности на действие раздражителей.
Резистентность—устойчивость организма к действию чрезвычайных раздражителей, способность сопротивляться без существенных изменений постоянства внутренней среды; это важнейший качественный показатель реактивности;
2.Индивидуальная реактивность определяется наследственными и приобретенными свойствами организма. Она определяется полом, возрастом, функциональным состоянием всех органов и систем(главным образом− нервной и эндокринной), типом высшей нервной деятельности, конституцией и зависит от факторов внешней среды(питания, температуры, содержания кисло- рода и т.д.).
· Индивидуальная р. обусловливается наследственными и приобретенными свойствами организма. Она определяется полом, возрастом, функциональным состоянием всех органов и систем (главным образом — нерп-нон и эндокринной), типом высшей нервной деятельности, конституцией и зависит от факторов внешней среды (питания, температуры, содержания кислорода и т.д.).
· Групповая р. — реактивность определенных групп людей, сходных по тем или иным наследственно-конституционным особенностям (по типам конституции, высшей нервной деятельности, группам крови и др.).
Индивидуальная и групповая формы реактивности м.б физиологическими и патологическими.
· Физиологическая р. — реактивность нормального, здорового организма в благоприятных условиях существования, адекватно реагирующего на действие раздражителя.
· Патологическая р. возникает под воздействием чрезвычайного, болезнетворного фактора и проявляется снижением приспособительных возможностей болеющего или выздоравливающего организма, необычной формой реагирования на раздражитель. Она может возникать вследствие нарушения либо самой генетической программы (наследственные формы патологии), либо механизмов ее реализации (приобретенные формы патологии).
И физиологическая, и патологическая реактивность бывает специфической и неспецифической.
· Специфическая (иммунологическая) р.— это способность организма отвечать на антигенное раздражение выработкой гуморальных антител и комплексом клеточных реакций, специфичных по отношению к антигену.
Специфическая физиологическая р. обеспечивает невосприимчивость к инфекциям; реакции биологической несовместимости тканей, трансплантационный иммунитет, противоопухолевый иммунитет, специфическую рсзистентность (устойчивость к какому-либо определенному агенту), адаптацию к определенному фактору среды (например, к недостатку кислорода).
· Неспецифическая р. – это способность организма отвечать однотипной реакцией на разнообразные раздражители.
Неспецифическая физиологическая реактивность проявляется в форме адаптации к нескольким факторам среды, например, к недостатку кислорода и одновременно — к физической нагрузке, в форме стресс-реакции, неспецифической резистентности.
4.К видовому иммунитету относится невосприимчивость определенных видов животных или человека к возбудителям некоторых инфекционных болезней. Так, люди невосприимчивы к возбудителю чумы собак, многие животные — к вирусу кори, гонококку и ряду других возбудителей антропонозных инфекций. Устойчивость к соответствующей инфекции наследуется, как видовой признак, и проявляется у всех представителей данного вида. Молекулярно-клеточные механизмы видового иммунитета изучены недостаточно. Предполагают, что они препятствуют как прикреплению возбудителей болезней к клеткам барьерных тканей и внедрению их в организм, так и размножению инфекционных агентов в организме хозяина. Видовой иммунитет может также обеспечивать неспецифические его факторы: комплемент, интерферон, фагоцитарно активные клетки, естественные киллеры и др.
5.Приобретенный иммунитет формируется в течение всей жизни индивидуума. В зависимости от условий и особенностей формирования различают активно и пассивно приобретенный иммунитет. Активно приобретенный иммунитет возникает в результате перенесенного инфекционного заболевания или введения в организм вакцины. Пассивно приобретенный иммунитет формируется при передаче антител от матери к плоду и может быть искусственно создан путем парентерального введения в организм антител или лимфоцитов от гипериммунных особей. Он развивается быстро (сразу же после введения соответствующих препаратов или клеток), но сохраняется менее продолжительно, чем активно приобретенный иммунитет.
6.Искусственный иммунитет — это иммунитет, который создан в результате активации иммунной системы или искусственной иммунизации.
· Пассивный иммунитет возникает вследствие введения в организм специфических сывороток, интерферонов и их смесей, интерлейкинов, иммуноглобулинов, клеток костного мозга, моноцитов, лимфоцитов, которые искусственно активированы in vitro. Сыворотки содержат готовые антитела, которые облегчают течение уже развившегося заболевания. Пассивный иммунитет создают при первичном или тяжёлом вторичном иммунодефиците.
· Активный иммунитет создают за счет активации механизмов иммунного ответа. Для этого применяют вакцины, индукторы интерлейкинов, интерферонов, активаторы систем фагоцитоза и комплемента, механизмов натуральных киллеров. При активной иммунизации происходит выработка самим организмом интерферонов, антител, интерлейкинов и других факторов иммунитета. Вакцина содержит ослабленные или убитые вирусы или бактерии. Развивается первичный иммунный ответ, а после попадания неослабленного возбудителя обеспечивается и вторичный ответ, который способствует легкому течению болезни и быстрому выздоровлению.
7.Антитоксический иммунитет. Данный вид иммунитета формируется в случае, если циркулирующие в организме свободные белковые токсины обладают выраженными иммуногенными свойствами, способными вызвать иммунный ответ. Это относится главным образом к токсинам возбудителей столбняка, анаэробной инфекции, ботулизма, дифтерии, в меньшей степени к токсинам пирогенного стрептококка, холерного вибриона и некоторых других бактерий. Образующиеся антитоксины обладают выраженными защитными свойствами, вызывая специфическую нейтрализацию соответствующего токсина.
Антибактериальный иммунитет. Специфический антибактериальный иммунитет формируется при контакте макроорганизма с соответствующими бактериями (антигенами). При этом в сыворотке крови появляются антибактериальные иммунные тела (иммуноглобулины). Их защитное действие проявляется в иммобилизации бактерий, т. е. способности ограничивать распространение последних в организме. Это приводит к повышению интенсивности фагоцитоза, что в свою очередь способствует очищению организма от патогенных агентов.
Противовирусный иммунитет .Основой противовирусного иммунитета является клеточный иммунитет. Клетки-мишени, инфицированные вирусом, уничтожаются цитотоксическими лимфоцитами, а также NK-клетками и фагоцитами, взаимодействующими с Fc-фрагментами антител, прикрепленных к вирусспецифическим белкам инфицированной клетки. Противовирусные антитела способны нейтрализовать только внеклеточно расположенные вирусы, как и факторы неспецифического иммунитета — сывороточные противовирусные ингибиторы. Такие вирусы, окруженные и блокированные белками организма, поглощаются фагоцитами или выводятся с мочой, потом и др. (так называемый «выделительный иммунитет»). Интерфероны усиливают противовирусную резистентность, индуцируя в клетках синтез ферментов, подавляющих образование нуклеиновых кислот и белков вирусов. Кроме этого, интерфероны оказывают иммуномодулирующее действие, усиливают в клетках экспрессию антигенов главного комплекса гистосовместимости (МНС). Противовирусная защита слизистых оболочек обусловлена секреторными IgA, которые, взаимодействуя с вирусами, препятствуют их адгезии на эпителиоцитах.
8.Патофизиологическое действие антител и продуктов их реакции с антигенами. Появление или введение в организм антител сопровождается рядом явлений, не ограничивающихся изменением свойств и состоянием того антигена, с которым соединяется антитело. Так, например, действие антитоксина в организме не ограничивается нейтрализацией соответствующего ему токсина, но вызывает ряд изменений деятельности нервной, сосудистой и других систем пораженного организма.
Антитоксические белки (гамма-глобулины) и продукты их реакции с токсинами являются раздражителями чувствительных нервных окончаний кровеносных сосудов (интерорецепторов), а по мнению некоторых исследователей, и других рецепторных аппаратов. Это вызывает ряд рефлекторных реакций защитно-физиологического и патологического характера в организме. Защитно-физиологическая реакция выражается, например, в том, что иммунные глобулины или продукты их реакции с токсинами вызывают защитно-охранительное торможение в коре головного мозга, увеличивают сопротивляемость (резистентность) нервной ткани к интоксикации путем инактивации ее ферментных систем (хо-линэстераза и др.). Она выражается также в том, что продукты реакции токсин — антитоксины вызывают стимуляцию выработки антител, т. е. действуют как специфический антигенный раздражитель. Она заключается, наконец, в том, что эти продукты стимулируют разрушение их макрофагами и выделение почками. Это способствует освобождению организма от токсинов в виде соединений их с антителами.
8.Иммунологическая толерантность(от лат. tolerantia – терпение) – это состояние ареактивности иммунной системы, специфической «неотвечаемости» организма только на определенные антигены (предварительно введенные). При этом сохранена способность к иммунному ответу на любые другие антигены. Следовательно, толерантность специфична по отношению к тому антигену, который ее вызвал. Толерантность может быть полной (нет иммунного ответа) или частичной (существенное снижение ответа).Иммунологическая толерантность представляет особую форму иммунного ответа, характеризующуюся запретом, налагаемым Т- и В-супрессорами на образование клеток-эффекторов против данного, в т.ч. собственного, антигена
9.Ослабление высшей нервной деятельности вследствие ее перенапряжения резко снижает реактивность организма к химическим ядам, бактериальным токсинам, антигенам и к инфицирующему действию микробов.
— Удаление коры головного мозга резко меняет реактивность животного. У такого «таламического животного» легко возникают реакции «ложного гнева», немотивированного возбуждения.
— Удаление или повреждение свода гиппокампа и передних ядер миндалевидного комплекса или прехиазмальной области мозга у кошек, обезьян или крыс вызывает усиление голосовых реакций (животные пищат, кричат, мяукают), повышение половых реакций, реакций «ложного гнева» и различных общих реакций «эффективной экспрессии».
— Повреждение заднего отдела гипоталамуса и мамиллярных тел вызывало заторможенность поведенческих реакций животных.
— Повреждение серого бугра путем наложения стеклянного шарика на турецкое седло обусловливает дистрофические изменения в легких и желудочно-кишечном тракте.
— Введение кротонового масла в ствол седалищного, тройничного, блуждающего нервов вызывает образование язв в желудке и кишечнике, на роговице глаз, кровоизлияния в легкие и другие нарушения.
— Возбуждение парасимпатического отдела вегетативной нервной системы сопровождается увеличением титра антител и усилением антитоксической и барьерной функций печени и лимфатических узлов. Увеличивается комплементарная активность крови и развивается лейкоцитоз, сменяющийся лейкопенией.
— Возбуждение симпатического отдела вегетативной нервной системы сопровождается выделением в кровь норадреналина и адреналина, стимулирующих фагоцитоз, усилением обмена веществ и повышением реактивности организма.
10.Реактивность и функции эндокринных желез
Гормоны передней доли гипофиза (тройные гормоны), стимулирующие секрецию гормонов коры надпочечников, щитовидной, половых и других желез внутренней секреции. В частности, АДГ гормон передней доли гипофиза влияет на реактивность через посредство глюкокортикоидных гормонов надпочечников.
Значение надпочечников в механизме реактивности определяется главным образом гормонами коркового вещества (кортикостероидами). Удаление надпочечников и лишение животного гормонов коркового вещества приводят к резкому снижению сопротивляемости организма механической травме, электрическому току, бактериальным токсинам и другим вредным влияниям среды и к смерти в сравнительно короткий срок. (1-2 дня). Наряду с этим введение гормонов коркового вещества надпочечников больным увеличивает защитные силы организма по отношению к вредности.
Альдостерон (минералокортикоид) оказывает действие, до некоторой степени противоположное кортизолу, и способствует переходу воды и ионов калия из тканей в кровь, а также усиливает воспалительный процесс.
Действие на реактивность щитовидной железы в значительной степени обусловлено ее функциональной взаимосвязью с гипофизом и надпочечниками. Тиреоидэктомия вызывает усиление секреции гипофизарного АДГ. Это в свою очередь увеличивает устойчивость животных к инфекциям, ядам и анафилаксии.
11. Реактивность и инфекционный процесс.
Основной причиной инфекционного процесса является патогенный микроорганизм, а состояние реактивности макроорганизма и различные влияния внешней среды (питание, простуда и пр.) являются условиями, способствующими возникновению инфекционного процесса.
Патогенез инфекционного процесса:
1. Представление о микробе-возбудителе как о раздражителе нервной системы, который вызывает разнообразные изменения рефлекторной регуляции (как безусловной, так и условной) функций. Соотношения этих реакций разнообразны. Они определяются многими факторами внешней среды (свойства, вирулентность возбудителя, состояние макроорганизма, питание, температура и пр.).
2. Зараженный организм, являясь питательной средой для патогенного микроба, представляет собой сложную, активно реагирующую систему, которая изменяет свою деятельность прежде всего в направлении уничтожения попавшего патогенного микроба, а затем в направлении противодействия его вредоносным влияниям.
3. Изменения микроба как чрезвычайного раздражителя и реактивности зараженного макроорганизма различны в зависимости от стадии развития инфекционной болезни.
В настоящее время установлено, что в каждой стадии развития инфекционной болезни как свойства макроорганизма и микроорганизма, так и условия их воздействия др на др существенно изменяются. Так, вирулентность микроба в процессе инфекционного заболевания может увеличиваться: микроб приспосабливается к существованию в организме одного заболевшего человека (например, при фурункулезе) или группы людей, живущих в одинаковых условиях (очаг инфекции при гриппе).Наряду с этим заболевший организм в процессе болезни приобретает ряд новых свойств: изменяется деятельность нервной системы, обмен веществ, появляются специальное защитные приспособления (вырабатываются антитела, активируется фагоцитоз и пр.).
12. Норма-, гипо-, гиперергические реакции.
Известно, что в зависимости от состояния реактивности организма различают следующие типы воспалительного ответа:
1) нормоэргический, когда сила повреждающего агента и ответ на это повреждение адекватны;
2) гиперергический, когда ответная реакция организма превышает необходимую степень реакции на
данное повреждение. Это воспаление возникает, как правило, на иммунной основе, и примером являетсяреакция гиперчувствительности немедленного и замедленного типов;
3) гипоэргический, когда отмечается пониженная реакция на повреждающее воздействие, обусловленная различными обстоятельствами (ослабление организма; пониженная чувствительность организма в связи с наличием защитных механизмов к определенному возбудителю). Крайней степенью такой реакции является анергический ответ, т. е. отсутствие реакции на повреждение.
Последнее изменение этой страницы: 2016-12-12; Нарушение авторского права страницы
источник
Общая характеристика нарушений терморегуляции
организма. Лихорадка и ее этиология.
Значение лихорадки для организма.
Общая характеристика нарушений терморегуляции организма. Лихорадка и ее этиология.
Терморегуляция – это процесс поддержания t тела животного или человека на одном уровне, независимо от условий внешней среды.
К нарушениям терморегуляции организма относятся:
Лихорадка (febris) – это патологическое состояние характеризуется нарушением терморегуляции и повышением температуры тела под влиянием пирогенных веществ.
В основе лихорадки лежит процесс перестройки терморегуляции в сторону увеличения теплопродукции. Это и отличает лихорадку от гипертермии.
Лихорадка – это не болезнь. Это симптом целого ряда болезней инфекционного и неинфекционного происхождения.
У молодых животных лихорадка протекает очень тяжело в связи с тем, что физическая терморегуляция развита слабо в связи с этим, эти организмы перегреваются или переохлаждаются в течение 1 месяца жизни.
Непосредственной причиной лихорадки (патогенетические факторы) являются пирогенные вещества (pyr, pyretos – жар, огонь). Они вызывают повышение температуры тела.
Различают экзогенные и эндогенные пирогенные вещества.
К экзогенным пирогенам относятся пирогенные вещества, которые выделяют бактерии, вирусы, простейшие, гельминты, грибы в процессе жизнедеятельности или их распаде.
По химическому составу относятся к липополисахаридам (гаптены).
Пирогенные свойства бактерий и других возбудителей не зависят от их вирулентности, токсичности.
Лихорадка под действием этих веществ развивается через 3-6 часов.
К эндогенным пирогеннам относятся пирогенные вещества, выделяемые лейкоцитами (микрофагами) и макрофагами органов и тканей.
Наиболее активные пирогены у нейтрофилов. Образуются только в патологических условиях (инфекционные болезни, ожоги, переохлаждения, некрозы).
По химическому составу белки повышают температуру через 10-15 минут.
в зависимости от причины, те по происхождению:
а) солевая – введение гипертонических растворов NaCl.
б) медикаментозное – пенициллин, адреналин
в) белковая – введение сывороток, вакцин, крови.
от степени повышения температуры:
субфебрильная – t повышается до 1 0 С.
Высокая, пиретическая 2,1-2,5 о
в зависимости от суточных колебаний:
постоянная лихорадка (febris continua) – характеризуется повышением t на 1,5-3,0 о С, продолжительностью до 2-3 недель, суточные колебания не превышают 1 о (отмечается при крупозной пневмонии, бронхопневмонии, при незначительных травмах).
Послабляющая, ремитирующая (febris remittens) – 
Перемежающаяся (febtis intermittens) – характеризуется наличием пароксизмов (приступы, подъема t) и апирексий (спадение t). T повышается на 1,5-3,0 о , продолжительность до 2-х недель. Но пароксизмы длятся несколько часов, а апирексии несколько суток (1-2 сут.) Встречается при заболевании печени, вирусных болезнях.
Возвратная (febris reсcurens) – похожа на перемежающую 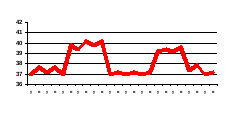
Истощающая, изнуряющая (febris hectica)- характеризуется 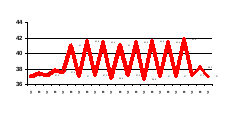
Кратковременная (febris ephemera) – температура повышается на 1-2 , в течение 1-2 суток. Отмечается при вакцинациях, туберкулинизации, транспортировке, гибели потомства.
Атипическая (febris atypica) — характеризуется разнообразием суточных колебаний температуры без всякой закономерности в периодах подъема и длительности течения. При атипических формах заболеваний.
Вид лихорадки зависит не только от вида инфекции, но и от состояния организма (реактивности).
Патогенез лихорадки протекает в три стадии.
Для нее характерно преобладание теплопродукции над теплоотдачей.
Пирогенвы возбуждают рефлекторно и гуморальный центр теплорегуляции, и способствует снижению или увеличению теплопродукции.
Отдача тепла уменьшается вследствие сужения сосудов, в результате этого тормозится потоотделение. Нарушается тепло потери.
Теплопродукция увеличивается за счет повышения потребления кислорода и усиления окислительных процессов. Особенно увеличивается обмен вв. в мышцах и печени.
В мышцах теплопродукция увеличивается за счет повышения сократительной способности и возникновения мышечной дрожи (озноб- это не координированное сокращение мышечных волокон).
Дрожь появляется вначале в жевательных мышцах, спины, конечностей, всей скелетной мускулатуре. Дрожь переходит в тепловую энергию. Механизм мышечной дрожи рефлекторный.
В паринхиматозных органах увеличивается теплопродукция.
стадия стояния высокой температуры(stadium fastigium)
Процессы теплоотдачи и теплорегуляции выравниваются. Периферические сосуды расширяются , увеличивается потоотделение. Во время этой стадии высокий уровень температурного гомеостаза не зависит от колебаний температуры внешней среды.
стадия спада температуры (stadium decrementum).
В этой стадии теплопродукция ограничивается. Теплоотдача осуществляется расширенными периферическими сосудами кожи и потоотделение, а также сопровождается отдышкой.
В зависимости от скорости снижения температуры различают литическое и критическое снижение.
Критическое снижение (резкое) называется кризис (crisis).Из-а резкого расширения периферических сосудов может развиться острая сосудистая недостаточность – коллапс.
Литическое падение температуры (постепенное) – лизис (lysis) более желательно для больного организма.
Таким образом, в механизме развития лихорадки и повышения температуры тела ведущим является временное задержание тепла в организме за счет преобладания теплопродукции над теплоотдачей.
Значение лихорадки для организма.
Лихоарадка оказывает на организм патологическое влияние, но может оказывать и защитное.
Патологическое влияние проявляется в том, что повышение температуры тела ведет к нарушению функции дыхания (учащенное поверхностное дыхание, одышка)), ссс (тахикардия, спазм периферических сосудов, повышение давления), в крови появляется лейкопения (снижение нетрофилов и эозинофилов) вачале лихорадки, зхатем сменяющаяся лейкоцитозом, снижается аппетит из-за снижения секреции слюны и желудочного сока, желчи, что приводит к нарушению обмена веществ, увеличивается распад белков в организме.
Положительная роль лихорадки.
Высокая температура действует губительно на некоторые микроорганизмы, особенно чувствительны вирусы, задерживается размножение некоторых микроорганизмов.
В начале активизируется обмен веществ за счет повышения окислительного фосфолирования и активизации гипофизарной и надпочечной системы. Затем активизируется ретикуломакрофагальные системы, лейкоциты.
источник
Лихорадка рассматривается в основном как сформировавшаяся в процессе эволюции защитно-приспособительная реакция организма на действие различных патогенных факторов. Вместе с тем, подобно воспалению и другим типовым патологическим процессам, она может оказать наряду с положительным и отрицательное воздействие на организм.
Защитно-приспособительное значениелихорадки подтверждается следующими наблюдениями:
• при лихорадке усиливается иммунный ответ организма вследствие активации Т- и В-лимфоцитов, ускорения превращения последних в плазматические клетки, что стимулирует образование антител; повышается образование интерферона;
• умеренная степень подъема температуры тела может активировать функцию фагоцитирующих клеток и NK-клеток (натуральные киллеры);
• активируются ферменты, угнетающие репродукцию вирусов;
• замедляется размножение многих бактерий и снижается устойчивость микроорганизмов к лекарственным препаратам;
• возрастают барьерная и антитоксическая функции печени;
• гепатоциты усиленно продуцируют так называемые белки острой фазы; некоторые из этих протеинов связывают бивалентные катионы, необходимые для размножения микроорганизмов;
• кроме того, повышение температуры тела при лихорадке достаточно часто является первым и единственным признаком какого-либо заболевания, это сигнал тревоги.
Отрицательное воздействиелихорадки на организм выявляется главным образом при резко выраженном и длительном повы-
шении температуры тела. Оно связано со стимуляцией функции сердца, которая может привести к развитию перегрузочной формы сердечной недостаточности, особенно у людей пожилого и старческого возраста, а также у пациентов, ранее уже имевших то или иное заболевание сердца. Представляет опасность возможность развития коллапса при критическом снижении температуры тела в заключительную стадию лихорадки. При лихорадке высокой степени может произойти подавление иммунных реакций. Установлено, что умеренная лихорадка повышает выживаемость инфицированных животных, а чрезмерно высокая лихорадка увеличивает летальность. У детей при высокой лихорадке могут развиться судороги, которые не всегда устраняются приемом жаропонижающих препаратов. При температуре выше 41 °С у детей может развиться отек мозга или острая недостаточность кровообращения из-за лабильности водно-солевого обмена. Длительно лихорадящие больные (при туберкулезе, бруцеллезе, сепсисе) обычно находятся в состоянии резкого истощения и ослабления жизненных функций. Конечно, при инфекционных заболеваниях нарушения вызываются не только действием высокой температуры, но и микробными токсинами.
Возникающие при лихорадке изменения лишь отчасти зависят от действия высокой температуры тела и возбуждения симпатической нервной системы. Значительная часть наблюдаемых при лихорадке метаболических и функциональных сдвигов представляет собой проявления ответа острой фазы, одним из компонентов которой является и сама лихорадка. Кроме нее, проявлениями этой реакции служат развитие стресса, лейкоцитоз, синтез в печени белков острой фазы, повышение активности иммунной системы и ряд других изменений. Ответ острой фазы развивается при любом существенном повреждении тканей (травма, инфекция и др.). Основную патогенетическую роль в развитии ответа острой фазы играют вторичные пирогены — IL-1, IL-6, TNF-α, интерферон и др. Особенно следует выделить IL-1 и IL-6. Кроме воздействия на центр теплорегуляции и возникновение лихорадки, они ответственны за развитие стресса и других гормональных сдвигов, за стимуляцию синтеза белков ответа острой фазы, развитие отрицательного азотистого баланса, лейкоцитоза и активацию функции фагоцитов, иммунологические сдвиги. С их действием связаны анорексия, мышечная слабость и миалгия. Под действием IL-1 повышается основной обмен, стимулируется продукция дру-
гих цитокинов (IL-2, IL-6, TNF-α, интерферонов). Исследования, проведенные на грызунах, показали, что интерферон-γ, наряду с развитием лихорадки вызывает снижение массы тела и дистрофические изменения в мышцах; подобные же нарушения вызывают IL-1 и TNF-α.
ЛИХОРАДОПОДОБНЫЕ СОСТОЯНИЯ
Различают три вида гипертермий: лихорадка, перегревание и лихорадоподобное состояние (В.Д. Линденбратен и соавт., 2001). Повышение температуры тела, связанное с активным накоплением в организме тепла без участия классических пирогенных веществ, обозначается как лихорадоподобное состояние(ЛПС). ЛПС проявляется временным повышением температуры тела за счет преходящего преобладания теплопродукции над теплоотдачей.
Физиологические лихорадоподобные состояния наблюдаются в ряде случаев при эмоциональном напряжении у ораторов, артистов, экзаменующихся, у футболистов, баскетболистов, хоккеистов, тяжелоатлетов и т.д. во время соревнований (психогенные ЛПС). ЛПС в этих случаях повышают умственную и физическую работоспособность, т.е. играют адаптивную роль. Лихорадоподобные состояния, связанные с изменением функции центральной нервной системы, наблюдаются также в ряде случаев у больных истерией, при психических расстройствах, при приступах эпилепсии и т.д.
Лекарственные (фармакологические, медикаментозные) ЛПС могут развиться при лечении амфотерицином В, дифенином, новокаинамидом, хинидином, циметидином, при передозировке кофеина, фенамина, аминазина, эфедрина, адреналина, норадреналина и других лекарственных препаратов. Отмена лекарственного препарата сопровождается быстрой нормализацией температуры тела.
Некоторые формы эндокринной патологии, например тиреотоксикоз, феохромоцитома (гиперпродукция катехоламинов), могут сопровождаться развитием ЛПС. Лихорадоподобное состояние развивается у женщин в стадию овуляции.
Механизм повышения температуры тела при ЛПС не вполне ясен. В некоторых случаях он может быть связан или с возбуждением симпатической нервной системы (уменьшение теплоотдачи
за счет спазма поверхностных сосудов), или с прямым действием (например, гормонов щитовидной железы, катехоламинов) на периферические внутриклеточные механизмы теплообразования. В результате отмечается преобладание теплопродукции над теплоотдачей и повышение температуры тела.
Папиллярные узоры пальцев рук — маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ — конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.
источник
Существует несколько точек зрения на значение лихорадки и ее роль в патогенезе болезни. Высказывается мнение, что лихорадка является преимущественно защитно-приспособительной реакцией организма (П. Н. Веселкин и др.). Действительно, при лихорадке обнаруживаются процессы, значение которых можно оценить как защитно-приспособительные. Например, состояние лихорадочной гипертермии оказывает стимулирующее действие на выработку некоторых антител, интерферона и процессы фагоцитоза. Лихорадочное состояние тормозит развитие некоторых аллергических реакций. При повышении температуры тела до 38-39°С нарушается репликация некоторых вирусов, размножение бактерий и опухолевых клеток, усиливается влияние интер-лейкина-1 на клеточный и гуморальный иммунитет. Лихорадка может понизить выживаемость микробов. Например, гонококки и трепонемы погибают при температуре 40-41,1° С. Заражение кроликов пневмококками на фоне снижения лихорадочного состояния жаропонижающими препаратами (салицилаты, фенацетин, индометацин и др.) протекает более тяжело, чем при наличии выраженной лихорадки. Подобные наблюдения послужили основанием для разработки специальных препаратов, вызывающих лихорадку (пирогенал и др.), с помощью которых проводили терапию вяло текущих инфекций. В истории медицины было время, когда такую хроническую инфекцию, как сифилис, лечили искусственно вызванной лихорадкой от прививок малярии. В настоящее время эти приемы терапии не применяются, но некоторый положительный эффект от подобного лечения в свое время считался доказанным. Препарат пирогенал сейчас применяется в основном как неспецифический стимулятор тонуса вегетативных нервных реакций и многих других функций. Полезность лихорадки можно усматривать и в том, что она является одним из ранних симптомов болезни. Лечение лихорадки жаропонижающими средствами может затруднить диагностику и прогнозирование тяжести течения заболевания. Аргументом в пользу признания положительного влияния лихорадки на организм является закрепление этого типического процесса в эволюционном развитии живых организмов.
Следует, однако же, считать, что положительное влияние лихорадки на организм проявляется лишь при ее умеренном и недлительном течении. Высокая лихорадка доставляет страдания больному, неблагоприятно действует на сердечно-сосудистую и центральную нервную системы, на процессы пищеварения и в целом на метаболизм. Длительно лихорадящие больные (при туберкулезе, бруцеллезе и др.) обычно находятся в состоянии резкого истощения и ослабления всех физиологических функций. Резкое истощение организма можно моделировать у кроликов путем многократных введений чужеродного белка, вызывающих развитие лихорадки.
Показаниями для лечения лихорадки жаропонижающими средствами являются заболевания сердца и легких, сепсис, шок, острые неврологические заболевания, водно-электролитные нарушения, почечные или метаболические расстройства, возраст моложе 5 лет, подъем температуры тела до 39-40°С и др.
Резюмируя сказанное, следует, очевидно, согласиться с утверждением крупного отечественного патофизиолога П. Н. Веселкина: «Лихорадочная реакция, как и всякая другая приспособительная реакция (воспаление, адаптационный синдром и др.), развиваясь при наличии пирогенной стимуляции стереотипно по генетически обусловленным закономерностям, не может быть всегда и безусловно полезной».
ИЗМЕНЕНИЯ КОЛИЧЕСТВЕННОГО И КАЧЕСТВЕННОГО СОСТАВА ЭРИТРОЦИТОВ
В норме содержание эритроцитов в периферической крови у мужчин составляет в среднем (4-5)х10 12 /л, у женщин — (3,7-4,7)х10 12 /л; уровень гемоглобина соответственно 130-160 и 120-140 г/л. У здоровых людей количество образующихся в костном мозге эритроцитов равно числу выходящих из циркуляции (гемолизирующихся) клеток, в связи с чем уровень их в крови практически постоянен. При различных заболеваниях эритроцитарный баланс может нарушаться, что приводит к увеличению числа эритроцитов в крови (эритроцитозу) или к его уменьшению (анемии).
Анемия, или малокровие, — патологическое состояние, характеризующееся уменьшением концентрации гемоглобина и в подавляющем большинстве случаев числа эритроцитов в единице объема крови.При тяжелых формах анемий в крови могут появляться патологические формы эритроцитов.
Этиология анемий включает острые и хронические кровотечения, инфекции, воспаления, интоксикации (солями тяжелых металлов), глистные инвазии, злокачественные новообразования, авитаминозы, заболевания эндокринной системы, почек, печени, желудка, поджелудочной железы. Анемии часто развиваются при лейкозах, особенно при острых их формах, при лучевой болезни. Кроме того, играют роль патологическая наследственность и нарушения иммунологической реактивности организма.
Общими симптомами для всех форм анемий, возникновение которых связано с основным звеном патогенеза малокровия — гипоксией, являются бледность кожных покровов и слизистых оболочек, одышка, сердцебиение, а также жалобы на головокружение, головные боли, шум в ушах, неприятные ощущения в области сердца, резкую общую слабость и быструю утомляемость. В легких случаях малокровия общие симптомы могут отсутствовать, так как компенсаторные механизмы (усиление эритропоэза, активация функций сердечно-сосудистой и дыхательной систем) обеспечивают физиологическую потребность тканей в кислороде.
Классификация анемий. В основу существующих классификаций анемий положены данные о морфологии эритроцита, способности костного мозга к регенерации, патогенетические признаки заболевания с учетом важнейших этиологических факторов. По механизму развития выделяют три основных вида анемий: вследствие кровопотери (постгеморрагические), вследствие повышенного гемолиза эритроцитов (гемолитические) и вследствие нарушения кровообразования.
Морфологическими критериями, заложенными в основу классификаций анемий, являются величины цветового показателя (ЦП), среднего диаметра эритроцитов (СДЭ) и тип кроветворения. По цветовому показателю анемии делят на:
1) гипохромные (ЦП = 0,8 и ниже);
3) гиперхромные (ЦП выше 1,0).
По величине СДЭ различают:
1) микроцитарные (СДЭ ниже 7,2 мкм);
2) нормоцитарные (СДЭ в пределах 7,2- 8,0 мкм);
3) макроцитарные (СДЭ выше 8,1 мкм) анемии. В группу макроцитарных анемий входят и мегалоцитарные (мегалобластические) анемии, при которых СДЭ превышает 9,0 мкм.
По типу кроветворения анемии можно подразделить на две группы:
1) с нормобластическим типом кроветворения (нормальный эритропоэз: эритробласт -> пронормобласт -> нормобласт базофильный -> нормобласт полихроматофильный -> нормобласт оксифильный ->эритроцит);
2) с мегалобластическим (промегалобласт -> мегалобласт базофильный -> мегалобласт полихроматофильный -> мегалобласт оксифильный -> мегалоцит) типом кроветворения (рис. 66).
По способности костного мозга к регенерации различают анемии:
1) регенераторные (с достаточной функцией костного мозга);
2) гипорегенераторные (понижение регенераторной функции костного мозга);
3) арегенераторные (гипо- и апластические) — с резким угнетением процессов эритропоэза.
Оценить функциональное состояние костного мозга при анемиях помогает лейко-эритробластическое соотношение, которое можно определить на мазках костного мозга при подсчете миелограмм. В норме оно составляет 4:1, при анемиях с достаточной функцией костного мозга снижается до 1:1 или даже 1:2-1:3, при тяжелых формах малокровия (пернициозная анемия) может доходить до 1:8. Показателем достаточной регенераторной способности костного мозга служит развивающийся ретикулоцитоз. В норме на суправитально окрашенных мазках периферической крови выявляется 5-10%о ретикулоцитов (расчет ведется на 1000 эритроцитов), при анемиях с достаточной функцией костного мозга их число может увеличиваться до 50-100%о и выше, при арегенераторных анемиях ретикулоциты выявляются в виде единичных экземпляров или же отсутствуют вообще. Анемия всегда представляет собой частный симптом какого-то общего заболевания и в связи с этим для практических целей анемии делятся на гипо- и гиперхромные, так как цветовой показатель автоматически позволяет направить диагностический поиск в нужное русло.
Патологические формы эритроцитов. При анемиях в периферической крови на фиксированных или суправитально окрашенных мазках могут встречаться эритроциты и эритроидные формы костного мозга, не выявляемые у здоровых людей (рис. 67). Появление их свидетельствует либо о компенсаторных усилиях эритропоэза или о нарушении созревания клеток эритроидного ряда в костном мозге (регенеративные формыэритроцитов), либо о дегенеративных изменениях эритроцитов, возникающих при действии на организм повреждающих факторов в результате извращения эритропоэза (дегенеративные формы эритроцитов). К группе регенеративных форм эритроцитов относят незрелые формы эритропоэза — ядросодержащие эритроциты (нормобласты, мегалобласты), эритроциты с остатками ядерной субстанции (тельца Жолли, кольца Кабо, азурофильная зернистость, азурофильная штрихованность). Цитоплазматическую природу (остатки базофильной субстанции) имеют полихроматофильные эритроциты, ретикулоциты (выявляются на суправитально окрашенных препаратах), базофильная зернистость эритроцитов. К группе дегенеративных форм эритроцитов относят клетки с измененной величиной (анизоцитоз — наличие в крови эритроцитов различной величины: нормоцитов (7,0-8,0 мкм), микроцитов (6,9-5,7 мкм), макроцитов (8,1-9,35 мкм), мегалоцитов (10-15 мкм)), формой (пойкилоцитоз — наличие на мазках крови эритроцитов различной формы: вытянутой, грушевидной, овальной, веретеновидной и др.), различным содержанием гемоглобина в эритроцитах (анизохромия — появление гипохромных и гиперхромных эритроцитов), гемоглобиновую дегенерацию Эрлиха (Гемоглобиновая дегенерация Эрлиха — неравномерное распределение гемоглобина в эритроцитах в результате его коагуляции), вакуолизацию эритроцитов. На суправитально окрашенных мазках в эритроцитах обнаруживаются тельца Гейнца (Тельца Гейнца субстанционально тождественны с гемоглобиновой дегенерацией Эрлиха, но выявляются в виде 2-3 голубых телец при суправитальной окраске мазков крови), а также иссиня-темные эритроциты — дегенеративная полихромазия.
Анемии вследствие кровопотерь (постгеморрагические). Различают острую и хроническую постгеморрагическую анемию. Первая является следствием быстрой потери значительного количества крови, вторая развивается в результате длительных постоянных кровопотерь даже в незначительном объеме.
1) Острая постгеморрагическая анемия. Развивается в результате массивных кровопотерь от травм, кровотечений желудочных, кишечных, маточных, при разрыве фаллопиевой трубы при внематочной беременности и др. Сразу же после кровопотери уменьшается масса циркулирующей крови, равномерно снижается содержание эритроцитов и гемоглобина. Цветовой показатель близок к единице, показатель гематокрита не снижается. Через 1-2 дня в кровь поступает тканевая жидкость, масса ее восстанавливается, а количество эритроцитов, гемоглобина, процент белка и железа оказываются сниженными. Анемия чаще протекает по типу нормохромной, на препаратах периферической крови могут наблюдаться явления умеренного анизо- и пойкилоцитоза эритроцитов. Возникающая при этом гипоксия вызывает повышение уровня эритропоэтина, стимулирующего активность коммитированной (унипотентной) клетки — предшественницы эритропоэза — КОЕ-Э. Уже к 4-5-му дню после кровопотери усиливается функция костного мозга и в крови увеличивается содержание молодых форм эритроцитов (полихроматофилов, а на суправитально окрашенных мазках — ретикулоцитов, могут встречаться отдельные нормобласты), что свидетельствует о достаточной регенераторной способности костного мозга (регенераторная анемия). Процесс образования эритроцитов опережает их созревание из-за дефицита железа. Анемия может приобретать гипохромный характер. Развивается нейтрофильный лейкоцитоз со сдвигом влево.
2) Хроническая постгеморрагическая анемия. Развивается в результате небольших повторных кровотечений (язвы, опухоли желудка и кишечника, геморрой, дисменоррея, геморрагические диатезы, легочные, почечные, носовые кровотечения и др.). Протекает по типу гипохромной, железодефицитной анемии. На мазках крови обнаруживаются анизоцитоз, пойкилоцитоз, анизохромия эритроцитов, микроциты. Выявляется лейкопения за счет нейтропении, иногда со сдвигом влево.
Анемии вследствие повышенного кроворазрушения (гемолитические анемии). В обширную группу гемолитических анемий входят разнообразные заболевания, объединенные лишь одним общим признаком — укорочением продолжительности жизни эритроцитов. Механизм развития этого вида анемии связан с повышенным разрушением (гемолизом) эритроцитов периферической крови или (значительно реже) с гибелью созревающих клеток эритроидного ряда в костном мозге. В результате повышенного гемолиза эритроцитов в крови накапливается большое количество непрямого билирубина, что приводит к развитию желтухи. Гемолиз эритроцитов при гемолитических анемиях может происходить внутриклеточно, как и обычный физиологический, или непосредственно в сосудах. Главным признаком повышенного внутриклеточного гемолиза является увеличение селезенки (спленомегалия), в случаях внутрисосудистого разрушения эритроцитов ведущим симптомом становится появление гемоглобина в моче (гемоглобинурия), что сопровождается изменением ее окраски до почти черного цвета. Все формы малокровия, связанные с повышенной гибелью эритроцитов периферической крови, относятся к группе регенераторных анемий с нормобластическим типом эритропоэза. Появление патологического гемолиза обусловлено главным образом двумя причинами: наследственным нарушением строения эритроцитов, либо воздействием на эритроциты каких-либо внешних факторов, которые вызывают гемолиз непосредственно или существенно изменяют свойства эритроцитов, способствуя тем самым их повышенному разрушению. В зависимости от причин возникновения различают наследственные и приобретенные гемолитические анемии.
Наследственные гемолитические анемии. Данные анемии делят на три большие группы (Ю. Н. Токарев):
1. Мембранопатии эритроцитов с характерной морфологией клеток (сфероцитоз, эллиптоцитоз, стоматоцитоз и др.).
2. Энзимопенические (ферментопенические) анемии, или эритроцитарные энзимопатии (связанные с дефицитом ферментов пентозо-фосфатного цикла — глюкозо-6-фосфатдегидрогеназы и др.; связанные с дефицитом ферментов гликолиза — пируваткиназы и др.; связанные с нарушением метаболизма нуклеотидов — дефицит пиримидин-5-нуклеотидазы и др.).
3. Гемоглобинопатии («качественные» гемоглобинопатии — HbS, С, Д, Е и др. и «количественные» гемоглобинопатии — талассемии).
Мембранопатии. Основным патогенетическим звеном гемолитических анемий этой группы является генетический дефект белково-липидной структуры мембраны эритроцитов, что приводит к изменению формы и эластичности клеток. В результате нарушается способность эритроцитов деформироваться в узких участках кровотока, в частности при перехода из межсинусных пространств селезенки в синусы. В процессе циркуляции эритроциты постепенно теряют оболочку и в конечном счете разрушаются макрофагами селезенки. Из группы мембранопатий наиболее часто встречаемым заболеванием является наследственный микросфероцитоз (болезнь Минковского-Шоффара), в основе которого лежит наследственный дефект мембраны, способствующий повышенной проницаемости ее для ионов натрия. Проникновение в клетку избытка натрия, а вместе с ним и воды увеличивает объем эритроцитов и придает им характерную шаровидную форму. Удаляя избыток воды, сферические эритроциты постоянно тратят энергию, расходуя больше глюкозы и АТФ. Эти процессы наряду с механическим повреждением сфероцитов в синусоидах селезенки приводят к изнашиванию эритроцитов и сокращению срока их жизни до 14-12 дней. Аномалия передается с аутосомной хромосомой и наследуется по доминантному типу, т. е. болезнь проявляется и у гетерозигот.
Энзимопатии. Они обусловлены наследственным дефицитом ряда ферментов эритроцитов. В мире насчитывается несколько сотен миллионов человек (примерно 1/20 человечества) — носителей наследственного дефицита глюкозо-6-фосфатдегидрогеназы (Г-6-ФДГ). При недостатке Г-6-ФДГ блокируется реакция окисления глюкозо-6-фосфата в пентозо-фосфатном цикле, вследствие чего уменьшается образование восстановленной формы глютатиона, предохраняющего SH-группы глобина и мембраны эритроцитов от различного рода окислителей. Описано около 90 различных мутантных форм Г-6-ФДГ, 2 из которых являются основными: африканская форма дефицита — А и средиземноморская — В. Последняя характеризуется не только снижением активности Г-6-ФДГ, как это имеет место при африканской форме, но и уменьшением количества ее в эритроцитах. Дефицит Г-6-ФДГ наследуется как сцепленный с Х-хромосомой признак, поэтому среди заболевших лиц преобладают мужчины. Клинические проявления носительства Г-6-ФДГ, развивающиеся по типу острого гемолитического криза, наблюдаются при приеме некоторых лекарств, обладающих окислительными свойствами: хинин, ПАСК, сульфаниламиды, производные салициловой кислоты и др., употреблении в пищу конских бобов и стручковых растений (фавизм), а также на фоне заболевания вирусным гепатитом или гриппом.
Гемоглобинопатии (гемоглобинозы). Данные заболевания связаны с наследственным нарушением синтеза гемоглобина. «Качественные» гемоглобинопатии сопровождаются нарушением первичной структуры гемоглобина, «количественные» гемоглобинопатии характеризуются снижением скорости синтеза полипептидных цепей глобина. Как и носительство дефицита Г-6-ФДГ, наследственные гемоглобинопатии относятся к числу наиболее распространенных в человеческой популяции генетических аномалий. Среди известных форм гемоглобинопатии наибольшее значение в практическом отношении представляют гемоглобиноз S (серповидно-клеточная анемия) и талассемия.
Гемоглобиноз S. Заболевание возникает в связи с наследованием патологического гемоглобина S, в котором гидрофильная глутаминовая кислота в 6-м положении бета-цепи глобина замещена на гидрофобный валин. Такая замена изменяет суммарный заряд молекулы гемоглобина, уменьшает его растворимость. При падении парциального давления кислорода происходит агрегация (кристаллизация) гемоглобина, что и лежит в основе одного из важнейших признаков гемоглобиноза S — серповидности эритроцитов. Серповидные эритроциты (или дрепаноциты) повышают вязкость крови, замедляют кровоток, вызывают стаз. Стаз, в свою очередь, приводит к развитию гипоксемии, еще более увеличивая образование серповидно-клеточных эритроцитов. В результате уменьшается прочность мембран дрепаноцитов, увеличивается их гемолиз. Тяжелая анемия проявляется лишь у гомозиготных по HbS носителей.
Талассемия (средиземноморская анемия). Она связана с нарушением скорости синтеза альфа-, бета- или гамма-цепи нормального гемоглобина A1 и в зависимости от этого различают альфа-, бета- и гамма-талассемию. Чаще всего встречается нарушение скорости синтеза бета-цепей. В этом случае содержание Hb A1 (с цепями альфа2бета2) уменьшается, а уровень Hb F(альфа2гамма2) и Hb A2 (альфа2сигма2), напротив, возрастает (у здорового человека НЬ А1 составляет 95-98%, Hb A2 — 2-2,5%, Hb F — 1-2%). Недостаточный синтез бета-цепей приводит к избыточному образованию альфа-цепей. Лишние альфа-цепи способствуют появлению нестабильного гемоглобина, который преципитирует и выпадает в эритроците в виде «телец включения», придавая им форму мишеней. Кроме того, образующиеся в избытке альфа-цепи вступают в соединения с SH-группами мембраны и повышают ее проницаемость. Все это ведет к повышенному гемолизу. Развернутая картина тяжелой гемолитической анемии возникает при гомозиготном наследовании нарушения синтеза бета-цепей (болезнь Кули).
Приобретенные гемолитические анемии.Среди заболеваний этой группы выделяют иммунные гемолитические анемии и анемии, связанные с воздействием прямых гемолизинов и других повреждающих факторов.
1) Иммунные гемолитические анемии. Данные анемии характеризуются образованием антител, действие которых направлено против антигенов, находящихся на поверхности эритроцитов.
а) Аутоиммунные гемолитические анемии (АИГА). Они возникают в результате образования антител к собственным эритроцитам. Выработка антиэритроцитарных аутоантител может быть связана с изменением антигенной структуры мембраны эритроцитов в результате воздействия различных повреждающих факторов либо обусловлена нарушениями в самой иммунокомпетентной системе больного. В основе патологического процесса большинства форм АИГА лежит срыв иммунологической толерантности к собственному антигену. Считается, что это возникает лишь в тех случаях, когда она связана с воздействием малых доз толерогена и с нарушенной функцией Т-клеток при нормальном функционировании В-лимфоцитов. Антиэритроцитарные аутоантитела могут уничтожающе действовать на эритроциты крови, эритронормобласты костного мозга и даже на самые ранние клетки — предшественники эритроцитов периферической крови. По серологическому типу выделяют АИГА с неполными тепловыми агглютининами (IgG, реже IgM и IgA), с тепловыми гемолизинами, с холодовыми агглютининами (IgM, реже IgG) и двухфазными агглютининами (IgG). АИГА, вызываемые тепловыми аутоантителами, развиваются либо без видимых причин (идиопатическая форма), либо на фоне различных заболеваний — лимфогранулематоза, хронического лимфолейкоза, системной волчанки (симптоматическая форма), а также при приеме некоторых лекарств (пенициллин). Действие холодовых аутоантител проявляется при температуре ниже 32° С. Агглютинация и последующее разрушение эритроцитов происходят главным образом в мелких сосудах отдаленных от сердца участков тела (пальцы, уши) при охлаждении. Двухфазные гемолизины при охлаждении организма оседают на поверхности эритроцитов, а гемолиз вызывают при 37° С.
б) Изоиммунные гемолитические анемии. Заболевания возникают при воздействии изоиммунных антител. К этой группе анемий относят гемолитические анемии, связанные с резус-несовместимостью или несовместимостью по группе АВО между матерью и плодом. Сюда же относятся и посттрансфузионные анемии, обусловленные несовместимостью по групповой или резус-принадлежности.
Гемолитическая болезнь (эритробластоз) новорожденных. Она может возникнуть при беременности резус-отрицательной матери резус-положительным плодом, когда в организме матери начинают вырабатываться антитела, вызывающие агглютинацию эритроцитов плода. Особую опасность в этом отношении представляют повторные беременности, когда в крови матери уже есть антитела после предшествовавших беременностей.
2) Анемии при действии прямых гемолизинов и других повреждающих факторов.Эта группа анемий объединяет гемолитические состояния, при которых полноценные в морфофункциональном отношении эритроциты разрушаются под действием гемолитических (фенилгидразий, свинец, бензол, мышьяковистый водород, анилиновые красители, змеиный и грибной яды и др.), бактериальных (токсины гемолитического стрептококка, стафилококка и др.), паразитарных (малярия) и других факторов. Патогенез этих анемий различен: разрушение мембраны эритроцитов, истощение их ферментных систем и т. д.
Анемии вследствие нарушенного кровообразования.Группа анемий, объединенных одним общим механизмом развития, который связан с нарушением или полным прекращением эритропоэза в результате дефицита веществ, необходимых для осуществления нормального кроветворения, носит название дефицитных анемий. Сюда относят дефицит микроэлементов (железо, медь, кобальт), витаминов (B12, В6, В2, фолиевая кислота) и белков. При замещении костномозговой полости жировой, костной или опухолевой, тканью (метастазы опухолей в костный мозг, лейкоз), а также при действии физических (ионизирующая радиация) и химических факторов, некоторых микробных токсинов и лекарственных препаратов развиваются анемии в результате сокращения плацдарма кроветворения.
Железодефицитные анемии. Анемии, обусловленные дефицитом железа в организме, относятся к числу наиболее распространенных заболеваний в мире и составляют 80-95 % всех форм малокровия. Наиболее часто они встречаются у детей младшего возраста, девушек-подростков и женщин детородного возраста. Этиология. Железодефицитная анемия может быть обусловлена самыми разнообразными причинами: недостаточным поступлением железа с пищей, нарушением всасывания его в тонком кишечнике, повышенной потребностью в период роста, беременностью, лактацией, кровотечениями из различных органов и др. Однако наиболее частой причиной железодефицитной анемии являются кровопотери и в первую очередь длительные постоянные кровотечения даже с небольшими потерями крови. В этих случаях количество теряемого железа превышает его поступление с пищей. Дефицит железа в организме развивается при суточной потере железа в количестве, превышающем 2 мг (рацион мужчины содержит 18 мг железа, женщины — 12-15 мг железа, из которых всасывается не более 1,5 мг, при повышенной потребности организма — не более 2 мг).
По патогенетическому принципу с учетом основных этиологических причин железодефицитные анемии делят на пять основных подгрупп (Л. И. Идельсон):
1) хронические постгеморрагические анемии, связанные главным образом с маточными кровотечениями и кровотечениями из желудочно-кишечного тракта;
2) связанные с недостаточным исходным уровнем железа (у новорожденных и детей первых лет жизни);
3) связанные с повышением потребности в железе (без кровопотери);
4) связанные с нарушением всасывания железа, и поступлением его с пищей;
5) связанные с нарушением транспорта железа.
Патогенез. Основным патогенетическим звеном заболевания является снижение содержания железа в сыворотке крови, костном мозге и депо. В результате нарушается синтез гемоглобина, возникают гипохромная анемия и трофические расстройства в тканях, признаками которых являются: сухость, вялость кожи, ломкость ногтей, выпадение волос, атрофия слизистой оболочки языка, повышенное разрушение зубов, дисфагия, извращение вкуса, мышечная слабость и др. В патогенезе клинических проявлений болезни в еще большей степени, чем недостаточное снабжение тканей кислородом, имеет значение нарушение активности ряда ферментов тканей организма (цитохром С, цитохромоксидаза, сукцинатдегидрогеназа, пероксидаза, митохондриальная моноаминооксидаза, альфа-глицерофосфатоксидаза). Признаки гипоксии тканей появляются лишь при значительной выраженности малокровия, когда наступает истощение компенсаторных механизмов, обеспечивающих на ранних этапах развития дефицита железа нормализацию отдачи кислорода из гемоглобина тканям.
Картина крови. Основным признаком железодефицитной анемии является гипохромия со снижением цветового показателя ниже 0,85 и соответственно уменьшением содержания гемоглобина ниже 110 г/л. Количество эритроцитов, как правило, остается на исходном уровне, но в ряде случаев может оказаться сниженным до 2-1,5 o 10 12 /л вследствие нарушения процессов пролиферации клеток эритроидного ряда в костном мозге и усиления неэффективного эритропоэза (в норме разрушение эритронормобластов в костном мозге не превышает 10-15 %). Содержание ретикулоцитов колеблется в пределах нормы, но при значительной кровопотере бывает несколько повышенным. Важным морфологическим признаком железодефицитных анемий является анизоцитоз эритроцитов с преобладанием микроцитов. В костном мозге отмечается нарушение процессов гемоглобинезации эритрокариоцитов, сопровождающееся увеличением количества базофильных и полихроматофильных нормобластов при параллельном снижении числа их оксифильных форм, а также резкое уменьшение количества сидеробластов — нормобластов, содержащих единичные гранулы железа в цитоплазме (в норме до 20-40 %). В диагностике железодефицитной анемии решающее значение имеют показатели обмена железа (сывороточное железо, железо-связывающая способность сыворотки, общий запас железа в организме и др.). Количество железа в сыворотке крови при выраженной железодефицитной анемии падает до 5,4-1,8 мкмоль/л (40-30 мкг %) при норме 12,5-30,4 мкмоль/л (70-170 мкг %). Резко уменьшается и железо-связывающая способность сыворотки (количество железа, которое может связаться с трансферрином, в норме составляет 30,6-84,6 мкмоль/л (или 70-470 мкг %). Содержание ферритина в сыворотке крови, по результатам радиоиммунологических методов исследования, при железодефицитных анемиях снижается до 9-1,5 мкг/л (в норме — 12-300 мкг/л). Об уровне депонированного железа можно судить по содержанию железа в суточной моче после однократного введения больному 500 мг десферала (продукт метаболизма актиномицетов, избирательно выводящий ион железа из организма). В норме этот показатель соответствует 0,6-1,3 мг железа, а при железодефицитной анемии снижается до 0,2 мг в сутки и менее.
В12-дефицитные и фолиеводефицитные анемии. При дефиците витамина В12 и фолиевой кислоты имеют место нарушения образования пиримидиновых или пуриновых оснований, синтеза ДНК и РНК, развиваются анемии, характеризующиеся наличием в костном мозге мегалобластов. Сочетанный дефицит витамина В12 и фолиевой кислоты встречается редко, чаще наблюдается изолированный дефицит витамина В12.
Этиология.Дефицит витамина В12 развивается в результате нарушения его всасывания при снижении секреции внутреннего фактора, чаще в результате атрофии слизистой желудка либо в результате отсутствия желудка (агастрические анемии — Агастрические пернициозные анемии развиваются через 5-7 лет после операции тотальной гастрэктомии). У большинства больных с дефицитом витамина В12 обнаруживаются антитела, направленные против париетальных клеток слизистой желудка и внутреннего фактора Касла (В 1929 г. Касл высказал предположение, что в мясе содержится внешний, а в желудочном соке внутренний фактор, необходимые для нормального гемопоэза). В12— и фолиеводефицитные состояния могут развиваться при инвазии широким лентецом, поглощающим большое количество витамина В12, при беременности, нарушении всасывания витамина В12 в кишечнике, реже при недостатке поступления с пищей.
Пернициозная анемия (болезнь Аддисона-Бирмера —Тяжелое заболевание, ранее заканчивающееся летальным исходом, старое название — злокачественное малокровие, предложенное Бирмером в 1872 г.). Представляет собой одну из форм заболевания, связанного с дефицитом витамина В12. Чаще развивается у лиц пожилого возраста. Различают обычную форму взрослых и врожденную, характеризующиеся поражением трех систем: пищеварительной (воспаление, и атрофия сосочков языка, гистаминрезистентная ахилия, связанная с глубокой атрофией слизистой желудка, в результате чего железы дна и тела желудка прекращают выработку внутреннего фактора Касла — гастромукопротеина), нервной (фуникулярный миелоз — дегенерация задних и боковых столбов спинного мозга, нарушение кожной и вибрационной чувствительности, мышечно-суставного чувства, изменение ахилловых, коленных и других рефлексов), системы крови (гиперхромная анемия, переход на мегалобластический тип кроветворения).
Патогенез.Переход на мегалобластический тип кроветворения обусловлен резким снижением активности В12-зависимых энзимов, участвующих в метаболизме фолатов (соли фолиевой кислоты), необходимых для синтеза ДНК. При этом наблюдается уменьшение активности метилтрансферазы, сопровождающееся кумуляцией в клетках неактивного метилтетрагидрофолата и снижением синтеза ДНК, что приводит к нарушению клеточного деления и развитию мегалобластоза [Алексеев Г. А., 1982]. Нарушение кроветворения связано с замедлением темпа мегалобластического эритропоэза в результате удлинения времени митотического цикла и сокращения числа митозов: вместо 3 митозов, свойственных нормобластическому эритропоэзу, наблюдается один. Срок жизни эритроцитов сокращается до 30-40 дней (в норме 120 дней). Распад мегалобластов, не успевших превратиться в эритроциты, наряду с их замедленной дифференциацией приводит к тому, что процессы кроветворения не компенсируют процессы кроворазрушения. Развивается анемия.
Картина крови. В периферической крови наблюдаются гиперхромная анемия (цветовой показатель 1,2-1,5), явления пойкилоцитоза с тенденцией к овалоцитозу, анизоцитоза с выраженным макроцитозом и мегалоцитозом. Характерны явления анизохромии и гиперхромии эритроцитов; могут обнаруживаться полихроматофильные и оксифильные мегалобласты (Мегалобласты- клетки мегалобластического кроветворения: базофильные формы имеют размер 15-25 мкм, базофильную цитоплазму без включений, круглое, слегка овальное ядро, расположенное эксцентрично, хроматин в нем распределен равномерно; полихроматофильные формы имеют крупное ядро с нежной сетчатой структурой без ядрышек; в цитоплазме появляется гемоглобин; ортохромные формы — более зрелые клетки, содержащие гемоглобин. Ядро может сохранять нежно-петлистое строение или более грубое вследствие скучивания хроматина (см. рис. 66, 67)), эритроциты с тельцами Жолли, кольцами Кабо, азурофильной зернистостью. Средний диаметр эритроцитов увеличен до 8,2-9,5 мкм, их средний объем превышает 100 фл (110-160 фл). Наблюдается умеренная лейкопения с нейтропенией, встречаются гиперсегментированные нейтрофилы (сдвиг вправо), редко — гигантские формы нейтрофилов. Количество тромбоцитов уменьшено, часть их представлена крупными формами кровяных пластинок. На препаратах костного мозга обнаруживаются мегалоциты и мегалобласты, гигантские формы метамиелоцитов. Гипо- и апластические анемии. Гипопластические анемии — гетерогенная группа заболеваний, характеризующаяся уменьшением продукции всех клеток костного мозга. Патогенез анемии неизвестен: считается, что имеет место поражение частично детерминированной (плюрипотентной) стволовой клетки (КОЕ-ГЭММ) или ее микроокружения (В последние годы появились данные, позволяющие считать, что некоторые случаи апластической анемии и лейкоз могут представлять собой крайние проявления в клиническом диапазоне одного заболевания [Гейл Р., Бутурлани А., 1991]). Апластическая анемия развивается при действии на организм некоторых химических и лекарственных веществ (бензол, бензин, пары ртути и различных кислот, красители, сульфаниламиды, антибиотики, цитостатические препараты, препараты золота, висмута, мышьяка и др.), ионизирующей радиации, при ряде инфекций и аутоиммунных процессах. Описаны случаи апластической анемии среди жителей Хиросимы и Нагасаки, перенесших острое лучевое поражение после взрыва атомной бомбы. Для апластической анемии характерны панцитопения, сочетающаяся со снижением кроветворения в костном мозге, уменьшение количества стволовых клеток или потеря ими способности к пролиферации. Заболевание чаще начинается постепенно, в крови наблюдается снижение содержания гемоглобина (до 30-20 г/л), эритроцитов, ретикулоцитов. Анемия, как правило, нормохромная, макроцитарная. Лейкопения сопровождается абсолютной нейтропенией, относительным лимфоцитозом. Содержание тромбоцитов уменьшается до (60-30)х10 9 /л и ниже, удлиняется время кровотечения, развивается геморрагический синдром. Характерно ускорение СОЭ до 30-50 мм/ч. В костном мозге выявляются резкое снижение количества ядросодержащих элементов, особенно эритроидного ряда, торможение дифференциации клеток, почти полное исчезновение мегакариоцитов.
источник