Государственное бюджетное учреждение здравоохранения по Новосибирской области
Центр по профилактике и борьбе со СПИД и инфекционными заболеваниями
Территориальная программа государственных гарантий бесплатного оказания гражданам медицинской помощи в Новосибирской области
Поликлиническое отделение Центра СПИД
г. Новосибирск, ул. Семьи Шамшиных, 40
Режим работы: с 8.00 до 20.00
Телефоны регистратуры
(многоканальные):
8 (383) 218-20-42
8 (383) 349-59-65
Человек ВИЧ-инфицированно в Новосибирской области
По оценкам, ежегодно происходит 1,3 миллиона новых случаев заболевания лейшманиозом.
Лейшманиозы – группа трансмиссивных болезней человека и животных, вызываемых простейшими рода Leishmania, характеризующихся ограниченными поражениями кожи и слизистых оболочек с изъязвлением и рубцеванием — кожный лейшманиоз, или поражением внутренних органов, лихорадкой, спленомегалией (увеличение селезенки), анемией, лейкопенией — висцеральный лейшманиоз. Обе формы болезни разделяют на лейшманиозы Старого Света и лейшманиозы Нового Света.
Лейшманиозы вызываются внутриклеточными паразитами рода Leishmania, семейства Trypanosomatidae. Возбудителем висцерального лейшманиоза является L.donovani, подвиды которого L donovani, L infantum, L chagasi, вызывают различные клиникоэпидемиологические варианты болезни.
Жизненный цикл паразита состоит из двух стадий со сменой хозяев: амастиготной (безжгутиковой) в организме животных и человека и промастиготной (жгутиковой) в организме членистоногого переносчика. В организме теплокровных амастиготы лейшманий в виде овальных или округлых телец обнаруживаются в протоплазме клеток СМФ. При окраске по Романовскому-Гимза их протоплазма окрашивается в серовато-голубой цвет, овальное ядро (расположенное в центре или сбоку) – в красный или красно-филетовый цвет. Более темную окраску фиолетового оттенка приобретает кинетопласт, располагющийся рядом с ядром и имеющий форму короткой палочки. Промастиготы лейшманий в теле переносчика имеют удлиненную веретенообразную форму со жгутиками.
Лейшманиозы распространены в странах с тропическим и субтропическим климатом. Точно определить ареал распространения различных форм лейшманиоза довольно трудно. Изменения условий окружающей среды и другие экологические и социальные факторы могут привести к исчезновению болезни в некоторых высокоэндемичных очагах, или, напротив, повысить распространенность лейшманиозов в других. Основные очаги висцерального лейшманиоза расположены в Средиземноморском регионе (Северная Африка, Юг Европы), в странах Ближнего Востока, Центральной и Юго-Западной Азии, Китая, Южной и Центральной Америки, некоторых странах Западной и Восточной Африки, а также в Индии. Очаги висцерального лейшманиоза, вызываемого L. infantum, известны в Грузии, Армении, Азербайджане, Узбекистане, Туркменистане и на юге Казахстана.
Источником инфекции индийского висцерального лейшманиоза является больной человек, восточно-африканского – человек и дикие животные (грызуны, хищники); средиземноморско-среднеазиатский висцеральный лейшманиоз – зооноз, источником и резервуаром которого служат как домашние (собаки), так и дикие животные.
Переносчиками возбудителей лейшманиозов являются различные виды москитов из рода Phlebotomus. Сезонность заболевания людей, наличие эпидемических вспышек и другие эпидемиологические особенности различных форм и клинико-эпидемиологических вариантов лейшманиозов в очагах определяются экологией природных резервуаров.
В последние годы прогрессивно возрастает число случаев микст-инфекции висцерального лейшманиоза и ВИЧ-инфекции. Особенно много таких случаев в странах Средиземноморья: в Южной Европе и в Северной Африке. При ассоциации висцерального лейшманиоза с ВИЧ-инфекцией резко возрастает интенсивность инвазии, и лейшмании в большом количестве появляются в крови. В связи с этим у ВИЧ-инфицированных, значительная часть которых является наркоманами, передача может происходить при инъекциях, когда от больного лейшманиозом другому человеку попадают лейкоциты с амастиготами паразита.
Инкубационный период колеблется от 10 дней до года. На месте инфицирующего укуса переносчика можно наблюдать первичный аффект – бледно-розовую папулу или небольшой узелок. Заболевание начинается постепенно. Наиболее частые клинические проявления: лихорадка с ознобами, похудание, слабость, снижение аппетита, бледность и землистый оттенок кожных покровов, реже наблюдаются кашель, диарея. Характерны также спленомегалия и гепатомегалия, лимфаденопатия, в последующем развиваются истощение, отеки. В периферической крови выявляются лейкопения, гранулоцитопения, тромбоцитопения, признаки анемии, гипоальбуминемия, гипергаммаглобулинемия, снижение показателей свертываемости крови. Нередко болезнь отягощается вторичной бактериальной инфекцией: развиваются фурункулез, стоматит, энтероколит и поражения.
У детей младшего возраста иногда наблюдается острая форма висцерального лейшманиоза, характеризующаяся бурным, тяжелым течением, при отсутствии своевременной специфичечкой терапии приводящая к летальному исходу. У детей старшего возраста и у взрослых чаще регистрируется хроническая форма болезни, которая имеет более благоприятный прогноз, и при адекватной специфической терапии заканчивается выздоровлением.
В сочетания с ВИЧ-инфекцией висцеральный лейшманиоз рассматривается как оппортунистическая инфекция. У инфицированных ВИЧ висцеральный лейшманиоз приобретает, как правило, злокачественное течение и наблюдается резистентность к используемым противопаразитарным препаратам. У ВИЧ-инфицированных висцеральный лейшманиоз часто протекает с кожными высыпаниями, наблюдаются и изъязвления элементов. Средняя продолжительность жизни больных с микст-инфекцией существенно сокращается. Это обусловлено как реактивацией латентной инфекции у лиц с иммунодефицитом, так и резким увеличением интенсивности инвазии; в этих случаях лейшмании в большом количестве появляются в крови у больных.
Диагноз висцерального лейшманиоза устанавливается на основании эпидемиологического анамнеза (указание на пребывание в эндемичной территории), клинической симптоматике. Для обнаружения амастиготных форм лейшманий исследуют мазки пунктатов костного мозга, увеличенных лимфатических узлов, селезенки, печени. В периферической крови амастиготные формы паразита практически не обнаруживаются даже при тяжелом течении болезни, за исключением больных СПИДом, у которых они выявляются в 80% и более. Промастиготные формы паразита можно обнаружить при посеве пунктатов на специальные среды (среда NNN и др.). В специальных лабораториях проводят биологические пробы — заражение лабораторных животных (хомячков). Используются сероиммунологические методы диагностики – ИФА, НРИФ, РПА, которые в случаях сочетания с ВИЧ-инфекцией практически у 50% больных оказываются негативными. В тканях можно выделить антигены лейшманий методом ПЦР.
Профилактика лейшманиозов. Борьба с переносчиками — москитами: мероприятия по снижению численности популяций москитов. Мероприятия по уменьшению контакта между человеком и москитами. Борьба с резевуарными хозяевами инфекции: борьба с грызунами,
уничтожение бродячих собак, активное выявление и лечение инфицированных лиц.
Весьма эффективной мерой профилактики лейшманиозов является защита от нападения москитов. Для этого в вечернее время непосредственно перед заходом солнца и в течение всей ночи целесообразно использовать специальные отпугивающие москитов вещества — репелленты, а также полог из мелкоячеистой сетки.
Граждане России, выезжающие за пределы страны, могут заразиться лейшманиозами при посещении в активный сезон передачи инфекции (май — сентябрь) стран ближнего зарубежья: Азербайджана (ВЛ), Армении (ВЛ), Грузии (ВЛ), Южного Казахстана (ВЛ, ЗКЛ), Кыргызстана (ВЛ), Таджикистана (ВЛ, ЗКЛ), Туркменистана (ЗКЛ, ВЛ), Узбекистана (ЗКЛ, ВЛ). Эндемичным по висцеральном лейшманиозе следует считать и Крым, где в прошлом регистрировались единичные случаи висцерального лейшманиоза.
Из стран дальнего зарубежья наибольшую опасность в отношении кала-азара представляет Индия, где ежегодно регистрируются десятки тысяч случаев этого заболевания. Висцеральный лейшманиоз чаще всего можно заразиться в странах Среднего, Ближнего Востока и Средиземноморья. Кожный лейшманиоз опасен для граждан, выезжающих в страны Среднего, Ближнего Востока и Северной Африки. В странах Центральной и Южной Америки наряду с висцеральным имеются очаги кожно-слизистого лейшманиоза.
Основной мерой профилактики для граждан, даже на короткое время выезжающих в названные регионы, служит защита от нападения москитов. Кроме того, для предупреждения ЗКЛ можно рекомендовать прививки живой культурой и химиопрофилактику пириметамином. При этом необходимо отметить, что прививки противопоказаны детям до 1 года, больным кожными или хроническими заболеваниями (туберкулез, сахарный диабет и др.) и людям, переболевшим ранее кожным лейшманиозом, а пириметамин — противопоказан при заболеваниях кроветворных органов, почек и беременности.
источник
ФЕДЕРАЛЬНАЯ СЛУЖБА ПО НАДЗОРУ В СФЕРЕ ЗАЩИТЫ ПРАВ ПОТРЕБИТЕЛЕЙ И БЛАГОПОЛУЧИЯ ЧЕЛОВЕКА
от 4 марта 2015 года N 01/2160-15-27
О ситуации по лейшманиозам в Российской Федерации
Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека информирует, что на территории Российской Федерации ежегодно регистрируются завозные случаи висцерального и кожного лейшманиоза, которые по данным Всемирной организации здравоохранения отнесены к «забытым тропическим болезням».
По оценкам ВОЗ ежегодно в мире регистрируются от 700 тысяч до 1,3 миллиона новых случаев кожного лейшманиоза и 200-400 тысяч случаев висцерального лейшманиоза. В среднем от висцерального лейшманиоза в мире погибает до 30 тысяч человек и по показателям смертности висцеральный лейшманиоз уступает только малярии.
Висцеральный лейшманиоз является высокоэндемичным заболеванием в Индостане и Восточной Африке. Свыше 90% случаев висцерального лейшманиоза регистрируется в шести странах: Бангладеш, Бразилии, Индии, Судане, Эфиопии и Южном Судане.
Кожный лейшманиоз является самой распространенной формой лейшманиоза. По данным ВОЗ более двух третей случаев заболевания приходится на шесть стран: Алжир, Афганистан, Бразилию, Иран, Колумбию и Сирию.
При слизисто-кожном лейшманиозе (разновидность кожного лейшманиоза), сопровождающимся разрушением носовой перегородки, мягкого неба, хрящей глотки и гортани, в 90% случаев заражение происходит в Боливии, Бразилии и Перу.
В Российской Федерации регистрируются только завозные случаи лейшманиоза. Это связано с выездом в страны с теплым климатом — тропики, субтропики. Риск заражения лейшманиозом остается при посещении стран ближнего зарубежья: Азербайджана, Армении, Грузии, Кыргызстана, Таджикистана, Узбекистана в пик активности переносчиков возбудителя (май — сентябрь).
Всего за последние 4 года (с 2011 по 2014 годы) было зарегистрировано 23 случая лейшманиоза, в том числе 15 случаев кожного и 8 случаев висцерального лейшманиоза.
Висцеральный лейшманиоз зарегистрирован в 6 субъектах Российской Федерации: Республике Дагестан, Пермском и Красноярском краях, Самарской области, городах Москва и Санкт-Петербург.
Кожный лейшманиоз зарегистрирован в 8 субъектах Российской Федерации: Хабаровском крае, республиках: Крым и Татарстан, Волгоградской, Томской и Калужской областях, городах: Москва и Санкт-Петербург).
В структуре заболевших доля детей до 14 лет составила 44% (10 сл.). Максимальная заболеваемость лейшманиозом пришлась на детей в возрасте от 3 до 6 лет (6 случаев). Зарегистрирован завозной случай кожного лейшманиоза у ребенка 8 месяцев — жителя Ленинабадского района Таджикистана.
На долю городских жителей пришлось 91% (23 сл.) от числа заболевших. Удельный вес женщин составил 61% (15 случаев).
Анализ случаев лейшманиоза по месяцам года показывает, что лейшманиоз регистрируется в течение всего года, что связано с посещением россиянами эндемичных по лейшманиозу стран в течение всего года.
За четырехлетний период зарегистрирован завоз лейшманиоза из 11 стран: Азербайджана, Израиля, Индонезии, Ирана, Испании, Мексики, Сирии, Таджикистана, Туркменистана, Турции, Узбекистана.
Висцеральный лейшманиоз был завезен из трех стран: Мексики, Азербайджана, Ирана. Наибольшее число случаев висцерального лейшманиоза завезено из Азербайджана.
Максимальное число завозных случаев лейшманиоза зарегистрировано в г.Москве (5 сл.) и г.Санкт- Петербурге (6 сл.).
Все случаи лейшманиоза связаны с миграцией и передвижением людей, не имеющих иммунитета, в эндемичные территории, где сохраняется возможность передачи возбудителя лейшманиоза.
Завоз лейшманиоза происходит в большинстве случаев коренными жителями эндемичных стран, в том числе азербайджанцами (5 сл.), таджиками (5 сл.), узбеками (3 сл.), туркменами (1 сл.), а также российскими гражданами после туристических поездок (9 сл.).
Анализ случаев лейшманиоза показывает, что после возвращения из эндемичной территории клинические проявления наблюдались при кожном лейшманиозе спустя 1-4 месяца, при висцеральном лейшманиозе — спустя 2-6 месяцев.
При обращении за медицинской помощью имела место поздняя диагностика как висцерального, так и кожного лейшманиоза. Так, диагноз «Висцеральный лейшманиоз?» в первые три дня от момента обращения за медицинской помощью установлен только в одном случае (Республика Дагестан), в остальных случаях постановка диагноза варьировала от 12 дней до 4 месяцев от момента обращения за медицинской помощью. Больным были поставлены первично диагнозы «Анемия тяжелой степени?» «ОРВИ?», «Инфекционный мононуклеоз».
По данным ВОЗ проблема ассоциации висцерального лейшманиоза с ВИЧ-инфекцией в мире является актуальной. Наибольшее число случаев микст-инфекции висцерального лейшманиоза и ВИЧ-инфекции отмечается в странах Средиземноморья, в Южной Европе и в Северной Африке.
При ассоциации висцерального лейшманиоза с ВИЧ-инфекцией резко возрастает интенсивность инвазии и лейшмании в большом количестве появляются в крови.
В Российской Федерации одной из ведущих причин заражения ВИЧ-инфекцией является внутривенное введение наркотиков, в связи с этим остается угроза парентерального пути заражения лейшманиозом наркоманов (лейкоциты с амстиготами паразита попадают в кровь).
У ВИЧ-инфицированных даже слабовирулентные штаммы лейшмании могут вызвать поражение внутренних органов. Лейшманиоз у них развивается в результате как недавнего заражения, так и реактивации латентной инфекции.
В 2013 году в Санкт-Петербурге зарегистрирован случай висцерального лейшманиоза у больного с ВИЧ-инфекцией.
По социальному статусу 91% (21 сл.) заболеваний приходится на долю безработных, студентов и детей. Установлено, что недостаточное потребление продуктов с высоким содержанием протеинов, железа, витамина А и цинка повышает риск развития тяжелой формой висцерального лейшманиоза (кала-азар) после инфицирования.
Анализ карт эпидемиологического расследования случаев лейшманиоза свидетельствует о низком качестве проводимых эпидемиологических расследований, противоэпидемических и профилактических мероприятий в городе Москве. Составление карт эпидемиологического расследования проводится крайне небрежно с многочисленными ошибками, неточностями, противоречиями. В большинстве представленных карт произвольно исключена строка, свидетельствующая о проведении эпидемиологическом расследовании. В результате эпидемиологическое расследование сводится к заполнению паспортных данных. Кроме того, экстренная сигнализация о случаях лейшманиоза не отработана. Так, больному К., диагноз выставлен в январе и только через 10 месяцев поступило экстренное извещение, в другом случае экстренная сигнализация на больного с лейшманиозом поступила через 11 дней. Во всех представленных картах отсутствуют сведения и наблюдения за лицами, которые могли находиться в тех же условиях и также подвергнуться риску заражения. В картах указано, что диагноз «лейшманиоз» без вопроса поставлен пациенту в первый день обращения за медицинской помощью. Так, в одном из случаев больной был обследован на лейшманиоз только через 18 дней. Описание клинической картины ограничиваются одним термином «язва на коже». Кроме того, не указаны условия, которые способствовали заражению лейшманиозом, отсутствует эпидемиологическая диагностика, а также должности специалистов, которые проводили расследования.
В целях улучшения профилактических, противоэпидемических мероприятий по лейшманиозу предлагаю:
1. Руководителям управлений Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека по субъектам Российской Федерации совместно с руководителями органов управления здравоохранением субъектов Российской Федерации, главным врачам ФБУЗ центров гигиены и эпидемиологии в субъектах Российской Федерации:
1.1. Обеспечить применение эффективных методов диагностики, регламентированных МУК 4.2.3145-13 «Паразитологические методы диагностики гельминтозов» для выявления возбудителей лейшманиозов.
1.2. Организовать обучение и регулярную подготовку специалистов медицинских организаций по клинике, диагностике, лечению и профилактике лейшманиозов.
1.3. Усилить разъяснительную работу с населением о профилактике лейшманиозов среди лиц, выезжающие в эндемичные страны с использованием всех каналов СМИ, интернет-ресурсов, печатных и других изданий.
2. Руководителям управлений Роспотребнадзора по субъектам Российской Федерации:
2.1. Обеспечить контроль за полнотой проведения эпидемиологического расследования случаев лейшманиоза.
2.2. Обеспечить качественное заполнение карт эпидемиологического расследования случаев паразитарного заболевания в соответствии с методическими указаниями 3.2.2601-10 «Профилактика описторхоза» (приложение 1).
2.3. Направлять в Роспотребнадзор карты эпидемиологического расследования на каждый случай лейшманиоза.
3. Руководителю Управления Роспотребнадзора по городу Москве принять меры по улучшению заполнения карт эпидемиологического расследования и доложить в Роспотребнадзор о принятых мерах к 01.04.2015.
источник
Конфликт интересов: не объявлено
Конечный диагноз: мембраннопролиферативный гломерулонефрит
Симптомы: нефротический синдром
Клиническая процедура: биопсия почек
Висцеральный лейшманиоз является важной оппортунистической болезнью у ВИЧ-положительных пациентов. Информация о влиянии такой коинфекции в почках ограничена. Мы описываем пациента с коинфекцией ВИЧ / лейшмании, у которых развился нефротический синдром и мембранопролиферативный гломерулонефрит. Насколько нам известно, сообщалось только о 2 случаях этой нефропатии при коинфекции ВИЧ / лейшмании.
У 47-летнего мужчины развился нефротический синдром. У него был диагностирован ВИЧ-инфекция и висцеральный лейшманиоз, и он лечился антиретровирусной терапией, антимониальными соединениями, липосомальным амфотерицином В и милтефозином, но лейшмания следовала рецидивирующему курсу.
Почечную биопсию раскрывали мембранно-пролиферативный гломерулонефрит и лейстиама-амастиготы, наблюдавшиеся в клубочковых капиллярных просветах. Ему давали miltefosine и липосомальный амфотерицин B, но лейшманиоз сохранялся. Хроническая почечная болезнь стадии 3B и протеинурия нефротического диапазона, как правило, стабильны на 15-месячный период наблюдения.
Наш случай иллюстрировал некоторые аспекты лейшманиоза у пациентов с ВИЧ: его рецидивирующий курс, трудности в терапии и участие в почечной недостаточности.
Многие виды гломерулонефритов могут проявляться у ВИЧ-инфицированных, таких как коллапсирующий фокальный сегментный гломерулосклероз, иммунокомплексные гломерулонефриты и тромботическая микроангиопатия. Иммунокомплексные гломерулонефриты включают те, которые связаны с ВИЧ (РНК ВИЧ обычно более 400 копий / мл) и другие типы инфекционного гломерулонефрита [1].
Лейшманиоз является важной оппортунистической инфекцией ВИЧ, а висцеральный лейшманиоз (ВЛ) является наиболее распространенной клинической формой.
Почечная активность лейшмании хорошо документирована у иммунокомпетентных субъектов, но у ВИЧ-инфицированных информация ограничена [2-9]. Мы описываем пациента с ВИЧ с нефротическим синдромом и мембранно-пролиферативным гломерулонефритом (MPGN), связанным с VL.
47-летний мужчина был госпитализирован для отек нижних конечностей около 3-4 недель эволюции и протеинурии. Он представил гипертонию за предыдущие 18 месяцев, которые были обработаны тиазидом и блокатором рецепторов ангиотензина.
Он был диагностирован с ВИЧ-статусом С3 в другой больнице в октябре 1999 года и получил антиретровирусное лечение. В ноябре 2002 года ему был поставлен диагноз ВЛ и лечили антиоксидантами. Он был направлен в нашу больницу в октябре 2004 года; пациент прекратил получать антиретровирусную терапию и был бессимптомным, за исключением очаговых поражений кожи на туловище и конечностях. Биопсия кожи и аспирация костного мозга выявили лейшманию, которую лечили антиретровирусными препаратами и антиоксидантами. В последующие годы наблюдалось несколько рецидивов лейшманиоза (кожные повреждения и цитопения), и пациент получал липосомальный амфотерицин В и милтефозин в качестве лечения и профилактики.
Физическое обследование на текущий прием в больницу (июнь 2012 г.) показало, что артериальное давление 130/80 мм рт. Ст., Отсутствие лихорадки, отеки в ногах до колен; другие результаты были нормальными. Лабораторные исследования показали фибриноген 7,88 г / л, гемоглобин 85 г / л, лейкоциты 1,78 × 109 / л, количество CD4 93 / мкл, тромбоциты 110 × 109 / л, мочевина 12,5 ммоль / л, креатинин 123,76 мкмоль / л, альбумин 19 г / л, GGT 83 U / L и C-реактивный белок 16,7 мг / л; электролиты, другие параметры коагуляции и обычные результаты биохимии были нормальными. Следующие результаты были нормальными / отрицательными: иммуноглобулины, RF, C3, C4, ANA, анти-ДНК, анти-GBM, ANCA, криоглобулины и анти-TPO. Исследование крови / мочи для моноклональных белков было отрицательным. 24-часовая протеинурия составляла 8 г (электрофорез с высоким разрешением: неселективный гломерулярный рисунок), а анализ осадка мочи показал 40-60 RBC / HPF. Результат культуры мочи был отрицательным. Серология для гепатита В и С, а также РНК ВИЧ-РНК и результаты РПР были отрицательными.
Результаты рентгенографии грудной клетки и ЭКГ были нормальными. Ультразвук брюшной полости выявил умеренную спленомегалию и нормальный размер почек с повышенной эхогенностью коры. Устремление костного мозга показало обильную внутри- и внеклеточную лейшманию.
ЭБК трансфузировали, вводили десмопрессин, а чрескожную почечную биопсию выполняли без технических трудностей (3 прохода иглы с 3 тканевыми сердечниками). Гламулы (9) имели лобулярный вид с диффузной мезангиальной пролиферацией и утолщенными капиллярными стенками с двойными контурами. Лейкемические амастиготы были идентифицированы в клубочках (рис. 1), в интерстиции были осадки кальция, и сосуды были нормальными. Иммунофлуоресценция показала мезангиальные отложения C3 (+++) и C1q (++); IgG, IgA, IgM, C4, каппа и лямбда были отрицательными. Эти результаты согласуются с МПГН.
После биопсии пациент испытывал сильную боль в левой поясничной ямке. КТ показала большую левую периренальную гематому; ангиография не выявила кровотечения. RBC переливали, вводили транексамовую кислоту, и последующая эволюция была положительной. Пациент был выписан с симптоматическим лечением, антиретровирусной терапией, интерфероном-гамма и глюкантимом. Через неделю он был снова переведен с многоорганической дисфункцией с участием почек (креатинин 654,16 мкмоль / л), печени и поджелудочной железы; культуры крови и культура мочи были отрицательными. Интерферон-гамма и / или токсичность Глюкантима считались вероятными и лечились с помощью поддерживающих мер и гемодиализа; эволюция была удовлетворительной, а функция почек улучшилась до уровня креатинина 143,20 мкмоль / л.
источник
Лейшманиоз у человека — это группа инфекционных протозойных заболеваний, передающихся трансмиссивным путем (через укусы некоторых видов инфицированных москитов), вызываемое простейшими микроорганизмами (Leishmania), характеризующихся поражением кожи/слизистых оболочек (кожный лейшманиоз) или внутренних органов (висцеральный лейшманиоз).
Лейшманиозы – это природно-очаговые заболевания, которые периодически встречаются в 75 странах мира, преимущественно с тропическим/субтропическим климатом, расположенных в Средиземноморье, Ближнем Востоке, во всех регионах Африки, Центральной/Южной Америке. Наибольшее число заболеваний приходится на Индию, Бразилию, Кению, Эфиопию, Южный Судан и Сомали. Ниже приведены фото лейшманиоза у человека (ВОЗ).
Ареал распространения лейшманиоза различных форм чётко определить достаточно сложно, поскольку на распространенность заболевания значительное влияние оказывают экологические и социальные факторы (вырубка лесов, строительство ирригационных систем, отсутствие ресурсов для анти-москитных и дератизационных мероприятий, низкий уровень жизни — плохие жилищные условия, недостаточное питание, миграционные процессы, слабая иммунная система), которые могут как способствовать снижению заболеваемости в некоторых высоко эндемичных очагах, так и повышать распространенность лейшманиозов в слабо эндемичных очагах.
Согласно данным ВОЗ лейшманиозом поражено около 50 млн. млн. человек и ежегодно регистрируется около 1 миллиона новых случаев инфицирования, а смертность варьирует в пределах 20-30 тыс./год. Около 1/3 населения Земли постоянно проживает на территориях эндемичных по лейшманиозам и находятся под высокой угрозой заражения. Эти показатели не полностью отражают реальную эпидемиологическую ситуацию, так как подавляющее число заболевших приходится на развивающиеся страны, где учет больных систематически не проводится. В РФ регистрируются преимущественно завозные случаи в единичных количествах.
Однако, в ряде стран СНГ (Азербайджане, Грузии, Южном Казахстане, Узбекистане, Туркменистане) выявляются спорадические случаи заболеваний лейшманиозом. Отягощающим фактором является тенденция к росту общего числа заболевших лейшманиозом и расширение ареала, в том числе и увеличение количества случаев микст-инфекций (ВИЧ + висцеральный лейшманиоз), а у местного населения эндемических районов — лейшманиоза с туберкулезом.
Возбудитель лейшманиоза в жгутиковой форме (промастиготы) проникает в кожу человека в момент укуса и кровососания некоторых видов москитов. Возбудитель быстро проникает в макрофаги, где промастиготы переходят безжгутиковую форму (амастиготы) и активно размножаются бинарным делением, разрывая в конечном итоге клетку и проникая в рядом находящиеся макрофаги. При этом, в области входных ворот (на месте укуса) формируется лейшманиозная гранулема (первичный эффект), состоящая из макрофагов и различных клеток (ретикулярных, гигантских, эпителиоидных). Вначале визуально она схожа с бугорком (гранулемой), окруженного ободком воспаленной кожи, размер которого быстро прогрессирует до 8-12 мм в диаметре. Одновременно увеличивается воспалительный отек кожи вокруг него, иногда достигающий значительных размеров. Дальнейший процесс определяется видовой формой возбудителя и состоянием клеточного иммунитета человека: при кожной форме заболевания гранулема переходит в язву, а при висцеральной — рассасывается.
При кожном лейшманиозе через 7-15 дней начинается некроз центральной части гранулемы с образованием язвенного дефекта диаметром 2-4 мм с обрывистыми краями. Дно язвы покрыто налетом желтовато-серого цвета с обильным серозно-гнойным отделяемым. Язва окружена инфильтратом, который постепенно распадается, увеличивая язвенный дефект до 5-6 см. Число язв не ограничено и соответствует числу укусов.
При кожной форме инфекционный очаг ограничивается толщей кожи с формированием лейшманиновой реакции замедленного типа, протекающей на фоне выраженной инфильтрации лимфоцитами и снижения числа паразитов. Болезнь часто заканчивается спонтанным излечением. Однако, при кожно-слизистом лейшманиозе после полного/частичного заживления язвенного дефекта могут возникать метастатические поражения кожи и слизистых оболочек, что связывают с развитием гиперчувствительности организма к антигенам лейшманий.
Нетипичный характер развития кожной формы заболевания характерен для кожного диффузного лейшманиоза, при котором поражение кожи приобретает прогрессирующее хроническое распространение, протекающее на фоне отрицательной лейшманиновой реакции, отсутствия инфильтрации лимфоцитами и снижения количества возбудителей.
При висцеральной форме возбудитель из первичного очага с током лимфы разносятся по всему организму, поражая регионарные лимфатические узлы, вдоль которых могут формироваться несколько последовательно расположенных специфических язв (лейшманиом). Происходит генерализация процесса: лейшмании, продолжая активно размножаться в клетках мононуклеарных фагоцитов, диссимилируют в печень, селезенку, костный мозг, лимфатические узлы кишечника и другие органы.
В результате развивающихся процессов дистрофии и некроза увеличиваются размеры паренхиматозных органов и нарушаются их функции. Особенно страдает функция селезенки, в которой образуются геморрагические инфаркты и анемические очаги, подавляется гемопоэз, быстро развивается анемия, осложняющаяся поражением костного мозга, в котором развиваются некротические/дегенеративные процессы. В печени нарастают процессы гиперплазии купферовых клеток и развивается интерглобулярный фиброз, что приводит к с атрофии гепатоцитов. Развивается гранулоцитопения, снижается выработка протромбина, что в сочетании с тромбоцитопенией вызывает кровотечения в слизистых оболочках.
В основе квалификации лейшманиоза лежат различные этиологические, эпидемиологические, патогенетические и клинические признаки, в соответствии с которыми выделяют несколько клинических форм заболевания:
- Висцеральный с преимущественным поражением и вовлечением в процесс органов ретикуло-эндотелиальной системы (лимфатические узлы, костный мозг, селезенка, печень).
- Кожный с развитием процесса в структурах кожи (синонимы — пендинская язва, болезнь Боровского, пендинка).
- Кожно-слизистый (носоглоточный лейшманиоз) с поражение кожных покровов и слизистых оболочек, верхних дыхательных путей.
Висцеральный лейшманиоз в свою очередь подразделяется на несколько вариантов:
- Антропоноз — кала-азар (индийский лейшманиоз), вызываемый L. Donovani.
- Зооноз — средиземноморско-среднеазиатский лейшманиоз, вызываемый L. donovani infantum.
- Зооантропоноз — восточноафриканский лейшманиоз, вызываемый L. donovani archibaldi.
Кожный/кожно-слизистый лейшманиозы также подразделяется на несколько типов:
- Антропонозный кожный лейшманиоз (ашхабадская форма, городской тип болезни Боровского).
- Зоонозный (сельский тип болезни Боровского, пендинская язва).
- Кожный эфиопский лейшманиоз.
В зависимости от источника инфекции выделяют:
- Антропонозные лейшманиозы, при которых источником заражения может быть только человек. При этом, от него могут заражаться москиты, которые в ряде случаев могут инфицировать различных животных, но животные источниками инфекции для москитов не являются. К таким возбудителям относятся Leishmania donovani и Leishmania tropica.
- Зоонозные лейшманиозы — источником инфекции служат животные — грызуны, псовые (лисы, собаки, шакалы), дикобразы, ленивцы.
Еще одним признаком разделения лейшманиозов является их географическое распространение, в соответствии с которым выделяют лейшманиозы:
- Старого Света — Европы, Азии и Африки (лейшманиозы, перечисленные выше).
- Лейшманиозы Нового Света (стран американского континента) — висцеральный американский лейшманиоз. Кожно-слизистые лейшманиозы различных биотопов: язва Чиклеро (мексиканский лейшманиоз), Ута (перуанский лейшманиоз), лесная фрамбезия (гвианский лейшманиоз), панамский лейшманиоз, венесуэльский лейшманиоз, кожно-слизистый лейшманиоз (эспундия), диффузный кожный лейшманиоз и другие.
Разделение по географическому признаку обусловлено видовой самостоятельностью лейшманий, при этом каждый из видов включает большое количество рас, отличающихся степенью патогенности, характером вызываемых заболеваний, географическим распространением, клинико-эпидемиологическим разнообразием болезни.
Лейшманиозы относятся к группе природно-очаговых заболеваний, существующих в различных биогеоценозах. Развитие заболеваний такого типа связанно с комплексом природных условий, а их поддержание обусловлено наличием трофических связей.
Циркуляция возбудителя в таких очагах не зависит от человека, осуществляется неопределенного длительный период времени без заноса его извне. Основными компонентами природного очага являются возбудитель заболевания, переносчики, восприимчивые к конкретному возбудителю организмы и условия среды. Ареал природных очагов лейшманиоза определяется ареалом обитания естественных хозяев возбудителя и ареалом распространения переносчика.
Выявлено почти 70 видов животных, в том числе человек, являющихся естественными резервуарами лейшманий. Наибольшую значимость имеют мелкие дикие/синантропные грызуны (песчанки, мыши, крысы, суслики, даманы), дикие и домашние хищные животные (собаки, лисы, шакалы), реже — обезьяны, сумчатые. У животных, больных лейшманиозом на теле присутствуют язвы, отмечается резкое истощение, сухость кожи.
Возбудители различных видов лейшманиоза относятся к роду Leishmania.
Жизненный цикл возбудителя развивается со сменой хозяев и включает 2 последовательные стадии: безжгутиковую (амастиготную стадию), протекающую в организме теплокровного животного/грызуна или человека и жгутиковую (промастиготную), протекающую в организме переносчика.
Путь передачи — трансмиссивный через укус москита (инокуляция). Специфическим переносчиком лейшманий в Старом Свете является москиты рода Phlebotomus и в Новом Свете — рода Lutzomyia. Москиты обитают в лесных массивах, заболоченной местности, сырых жилых и подвальных помещениях, на мусорных свалках. Распространение возбудителя происходит во время кровососания инфицированных млекопитающих при заглатывании самкой москита амастогиты. Далее в пищеварительном тракте москита происходит размножение паразитов, которые преобразуются в жгутиковую стадию (промастиготу) и их накопление в хоботке.
Заражение человека осуществляется во время укуса москитом, при котором самка, освобождая свой пищеварительный тракт, срыгивает в ранку укуса промастиготы. При попадании в организм позвоночных (человека, млекопитающих) промастиготы теряют жгутик, преобразуясь в асмастиготы и начинается процесс интенсивного размножения и активного паразитирования. Процесс выплода москитов происходит в норах грызунов, скоплениях гниющей растительности, термитниках, скальных расщелинах, гнёздах птиц, норах во влажном теплом микроклимате. Человек, при попадании в такой природный очаг имеет высокий риск заражения лейшманиозом.
В населенных пунктах москиты обитают в сырых жилых и подвальных помещениях, на мусорных свалках, а зараженность лейшманиозом домашних собак, являющихся естественным резервуаром лейшманиоза в местах компактного проживания людей, также формирует высокий риск заражения. Наибольшая активность насекомых характерна в период солнечного заката. Передача заболеваний от человека к человеку (кроме случаев индийского кала-азара), встречается чрезвычайно редко. Крайне редко передается инфекция во время инъекций, при переливаниях крови.
Схематически жизненный цикл возбудителя лейшманиоза приведен на рисунке:
Низкий уровень жизни (нищета), сопровождаемый плохими условиями проживания, антисанитарным состоянием прилегающих территорий (отсутствие системы канализации и утилизации отходов, скученные жилищные условия, привычка спать вне помещений) способствуют увеличению численности мест для пребывания/размножения москитов и расширению их доступа к людям.
Недостаточное потребление продуктов, содержащих животные протеины, микроэлементы (цинк, железо), витамина А ослабляет иммунитет и увеличивают риск развития лейшманиоза после инфицирования.
Эпидемические вспышки висцерального и кожного лейшманиоза во многом обусловлены миграцией и передвижением большого количества людей, не имеющих иммунитета, в места, эндемичные по лейшманиозу.
На уровень заболеваемости существенно влияют процессы урбанизации, связанные с обезлесением территорий и их освоением для проживания и ведения сельскохозяйственных работ.
Заболеваемость лейшманиозом тесно коррелирует с климатическими условиями, что обусловлено выпадением большого количества осадков и повышением влажности/температуры, благоприятно воздействующим на выживаемость и расширение ареала популяций естественных хозяев лейшманий и интенсивность выплода москитов.
Переносчиками висцерального лейшманиоза (кала-азар), являются инвазированные Leishmania donovani москиты рода Phlebotomus, заражающие человека через укус. Заражение от доноров с латентной инвазией при гемотрансфузиях (переливании инфицированной крови) и вертикальная передача возбудителя висцерального лейшманиоза встречается значительно реже. B эндемичных регионах висцеральный лейшманиоз часто возникает как оппортунистическая инфекция на фоне ВИЧ-инфицирования, а также у лиц, получающих иммуносупрессивную терапию, поэтому такие лица относятся к особой группе риска. Заражение животных может происходить при поедании мяса зараженных (больных) животных. Болеют преимущественно дети 1-5 лет, а взрослые в основном представлены приезжими лицами из неэндемичных районов.
Заболеваемость может носить как спорадический характер, так и протекать в виде локальных эпидемических вспышек. Основной период заражения – лето, а пик заболеваемости приходится на осень того же года или весну следующего.
Общая характеристика кала-азара во всех районах мира аналогична, однако существуют местные особенности клинических проявлений и длительность периодов его эндемичности на различных территориях, что является основанием разделения висцерального лейшманиоза на несколько типов.
- Африканский кала-азар встречается преимущественно в восточной части Африки. В других частях континента встречаются спорадические случаи. Болеют дети и лица молодого возраста (10-25 лет), чаще мужского пола. Заболевание устойчиво к препаратам сурьмы относительно других форм кала-азара на других территориях мира.
- Индийский кала-азар. Отличительной особенностью является то, что при этой форме лейшманиоза единственным резервуаром возбудителя является человек, а переносчики — антропофильные виды москитов. По всем основным характеристикам (возрастному и половому распределению) сходен с африканским кала-азаром.
- Средиземноморский висцеральный лейшманиоз, вызываемый L. Infantum/L. Chagasi распространен преимущественно в районах Средиземноморья, Латинской Америке, Китае, и на территории стран СНГ (Азербайджан, Казахстан, Грузия). Болеют дети и взрослые. Резервуаром возбудителя служат шакалы, лисицы, собаки, крысы.
Перекрестный иммунитет отсутствует, но формируется иммунитет против гомологичного штамма. Реинфекция аналогичным штаммом возможна в случаях выраженного иммунодефицита.
Кожный и кожно-слизистый лейшманиозы в Старом и Новом Свете вызываются целым рядом возбудителей. Для этих видов лейшманиозов характерно развитие единичных/множественных изъязвляющих поражений, локализующихся в местах укусов переносчика кожного лейшманиоза (москитов рода Phlebotomus). Для кожного лейшманиоза Старого Света более характерно спонтанное заживление изъязвлений, что значительно реже встречается в Новом Свете. Заживление язвенного дефекта происходит на протяжении 1-2 лет с остаточным явлением в виде депигментированного рубца.
- Кожный лейшманиоз Старого Света (возбудитель L. Tropica) вызывает антропонозную (городскую, сухую) форму кожного лейшманиоза (восточная язва). Эндемическое заболевание встречается среди детей и лиц молодого возраста. Основным резервуаром возбудителя является человек, в качестве синантропного хозяина могут быть домашние собаки. Встречают преимущественно в городах и поселках на протяжении всего года. Заболеваемость носит спорадический характер, эпидемические вспышки чрезвычайно редкие. Распространен на территории Средиземноморья, в Индии, на Ближнем Востоке и юге СНГ.
- Кожный лейшманиоз (возбудитель L. Major) вызывает зоонозную (сельскую, влажную острую,) форму заболевания, которая эндемична в странах Ближнего Востока (районах пустынь), Африке на юге СНГ. Резервуаром возбудителя являются грызуны.
- Кожно-слизистый лейшманиоз является разновидностью кожного лейшманиоза Нового света. Ареал — леса Южной Америки, протекает с чрезвычайно обширным поражением кожных покровов и слизистых оболочек верхних дыхательных путей, часто с глубоким разрушением мягких тканей и хрящей.
У лиц, после перенесенного кожного лейшманиоза формируется нестерильный пожизненный иммунитет ко всем формам этого заболевания.
Инкубационный период варьирует в широких пределах (от 2-3 недель до 3–6 месяцев и более). В местах укуса инфицированных москитов (места внедрения паразита) формируется первичный аффект, проявляющийся в виде гранулемы (папулы), покрытой иногда чешуйкой. Первичный эффект появляется задолго до манифестации общих проявлений заболевания. В течении висцерального лейшманиоза выделяют три периода:
- Начальный, для которого характерны появление слабости, нарастающей адинамии, понижение аппетита, незначительная спленомегалия (увеличение селезенки).
- Разгар болезни — начинается с появлением основного симптома – волнообразной лихорадки с подъемами температуры тела до 39–40°C, которая сменяется периодами ремиссии.
- Продолжительность лихорадочных периодов варьирует от 4-6 дней до 3-4 месяцев, продолжительность ремиссий – от нескольких дней до 2 месяцев. К характерным признакам заболевания относятся увеличение и уплотнение печени и, особенно, селезенки, которая существенно увеличивается в размерах, может занимать значительную часть брюшной полости. Пальпаторно оба органа безболезненны и плотные. Для висцерального лейшманиоза средиземноморско-среднеазиатского типа характерно вовлечение в процесс лимфатических узлов различной локализации с развитием лимфаденита, бронхоаденита и мезаденита. Зачастую присоединяются пневмонии, вызванные вторичной бактериальной флорой. При неправильном лечении или его отсутствии состояние больных прогрессивно ухудшается — развивается анемия, течение которой усугубляемая поражением костного мозга. Возникает агранулоцитоз/гранулоцитопения, геморрагический синдром с периодическими кровоизлияниями в кожу, слизистые, сопровождаемый кровотечениями из органов ЖКТ и носа. Возможны инфаркты селезенки. Часто развивается диарея. На фоне гепатоспленомегалии и прогрессирующего фиброза печени развивается портальная гипертензия с появлением отеков и асцита. Артериальное давление понижено. Отмечается снижение половой активности у лиц мужского пола, а у женщин олиго/аменорея. В крови — снижение гемоглобина, уменьшение числа эритроцитов и цветового показателя. Имеет место лейкопения, анэозинофилия, тромбоцитопения. Характерно резкое (до 90 мм/час) повышение СОЭ.
- Терминальной период. Отмечается резкое снижение мышечного тонуса, истончение кожи и приобретение нею «фарфорового» вида с восковой окраской, развивается дефицит массы тела, вплоть до кахексии. Через брюшную стенку визуально проступают контуры увеличенной селезенки и печени.
Висцеральный лейшманиоз средиземноморско-среднеазиатского типа может протекать в острой, подострой и хронической формах. - Острая форма, встречается редко, чаще встречается у детей младшего возраста, течение бурное и при несвоевременном обращении за помощью заканчивается летально.
- Более часто встречается подострая форма: течение тяжело, продолжающееся 5–6 месяцев, с нарастанием симптомов и развитием осложнений. При отсутствии своевременного лечения отмечается высокая смертность.
- Чаще всего больные переносят хроническую форму, которая является самой благоприятной, протекающая с длительными ремиссиями и при своевременном лечении заканчивается выздоровлением.
На современном этапе значительное число случаев лейшманиоза протекает в латентной или субклинической формах. При кала-азаре в Индии у небольшой прослойки больных (5-10 %) развивается кожный лейшманоид, появляющийся в виде пятнистых и узелковых высыпаний, которые появляются после успешного лечения через 1-2 года. В этих высыпаниях содержатся лейшмании, сохраняющиеся в них на протяжение нескольких лет.
У пациентов, имеющих сочетанную инфекцию (ВИЧ-инфицированные с висцеральным лейшманиозом) заболевание имеет более злокачественное течение с высокой резистентностью к традиционным противопаразитарным препаратам. Висцеральный лейшманиоз у ВИЧ-инфицированных больных часто протекает с обильными кожными высыпаниями и последующим изъязвлением этих элементов и резким увеличением интенсивности инвазии.
Инкубационный период составляет 1-6 недель, чаще 10-20 дней. В местах укуса инфицированных москитов формируется лейшманиома, число которых может достигать несколько десятков с локализацией на открытых участках кожи (лице, верхних/нижних конечностях). Они небольшого размера, неправильной формы, чаще с подрытыми, реже ровными краями. Язвы практически безболезненны, однако при присоединении вторичной бактериальной микрофлоры появляется болезненность с гнойно-некротическим отделяемым.
Для кожного лейшманиоза характерен регионарный лимфаденит с выраженным лимфангоитом. Через 2-4 месяца уменьшается инфильтрат, язвенный дефект очищается от гнойно-некротического налета и появляется свежие грануляции, постепенно заполняющие дно язвы, и начинается формирование рубцов, которые в дальнейшем атрофируются, но пигментация на коже остается на всю жизнь. При лимфадените нижних конечностях могут возникать отеки стоп и голеней вследствие нарастающего лимфостаза. Весь процесс от появления папулы до формирования рубца длится 2-6 месяцев.
Инкубационный период варьирует от 2-3 месяцев до 2 лет, реже до 4-5 лет. По истечении инкубационного периода в месте укуса инфицированных москитов появляются единичные, реже множественные малозаметные бугорки с гладкой, блестящей поверхностью диаметром до 3 мм, которые постепенно увеличиваются, достигая размеров 8-10 мм через 3-4 месяца, приобретая бурую окраску с синюшным оттенком. Постепенно на протяжении 5-6 месяцев бугорки могут рассосаться и исчезнуть практически бесследно, однако такое абортивное течение встречается редко.
Наиболее частым вариантом является появление незначительного кратера, покрытого чешуйками, которые превращаются позже в плотную корочку, отпадающую впоследствии с формированием неглубокой эрозии или кратерообразной язвы с мелкозернистым дном, покрытым гнойно-некрозным налетом. Через 3-5 месяцев (реже на протяжении 1-2 лет) язва постепенно рубцуется. У 10-12% больных, преимущественно с наличием иммунодефицита, после перенесенного заболевания развивается хронический туберкулоидный вялотекущий рецидивный кожный лейшманиоз, клиника которого аналогична туберкулезной волчанке, длительность течения которой может составлять 10-20 лет.
Диагноз «лейшманиоз» ставится на основании данных эпидемиологического анамнеза (нахождение, а районах эндемичных по лейшманиозу), жалоб пациента, физикальных проявлений и лабораторных данных.
- Исследования крови: лейкопения, относительный лимфоцитоз анэозинофилия, нейтропения, гипергаммаглобулинемия, повышенное СОЭ, тромбоцитопения, агранулоцитоз, анизохромия, пойкилоцитоз.
- Паразитологические исследования: выделение возбудителя (бакпосев на питательной среде NNN) из биопсийного материала лимфатических узлов, селезенки, печени костного мозга, крови при висцеральном лейшманиозе или в мазках из содержимого, отделяемого язвенных дефектов при кожной форме.
- Серологические тесты (положительная ПЦР, прямая реакция агглютинации, ИФА). Инструментальные исследования назначаются по показаниям (ЭКГ, УЗИ брюшной полости, рентгенография).
Внутрикожная аллергологическая проба лейшманином (аллергеном из лейшманий), так называемый кожный тест Монтенегро используется преимущественно для ретроспективной диагностики, так как он всегда отрицателен в острой фазе. Позитивная проба появляется только в периоде реконвалесценции не ранее, чем через 6 месяцев после выздоровления. Он не является специфическим и большой диагностической ценности не представляет. Поэтому тест Монтенегро на лейшманиоз в Москве чаще практикуется при проведении эпидемиологических исследований.
Подтвержденным диагнозом может считаться случай при наличии:
- Положительной микроскопии материала биопсии лимфатических узлов, селезенки, печени костного мозга, содержимого язвенных дефектов.
- Положительного иммуноферментного анализа.
- Положительной реакции иммунофлуоресценции/полимеразной цепной реакции.
Обязательным является проведение дифференциального диагноза с тифо-паратифозными заболеваниями, малярией, бруцеллезом, лейкозом, лимфогранулематозом. При обследовании больного особое внимание необходимо обратить на основные отличительные признаки: длительную лихорадку и ее характер, увеличение селезенки и печени, лимфаденопатию, похудание, анемию и специфическую картину крови.
Выбор препаратов и тактика лечения лейшманиозов зависит от ряда факторов: вида лейшманиоза, стадии и тяжести заболевания, присоединения вторичной микрофлоры, общего состояния больного, сопутствующих осложнений. Основой лечения лейшманиозов являются препараты, основным действующим веществом которых является пятивалентная сурьма. Ее действие базируется на угнетении энергетических процессов у безжгутиковой формы лейшманий за счет блокировки процесса гликолиза и нарушения процесса окисления жирных кислот в глизосомах, что препятствует восстановление АТФ.
Другой механизм действия обусловлен неспецифическим связыванием белков амастигот с сульфгидрильными группами, что приводит к угнетению процессов их размножения и развития. В отличие от ранее применявшихся трехвалентных препаратов сурьмы пятивалентные соединения обладают меньшей токсичностью, что позволяет использовать их в более высоких концентрациях. Препараты сурьмы назначаются преимущественно при висцеральном лейшманиозе, поскольку при кожной форме заболевания их эффективность значительно меньше.
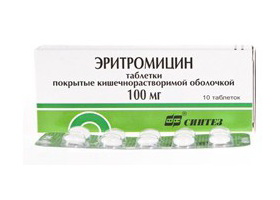
При недостаточной эффективности препаратов сурьмы, в частности, в регионах с высокой устойчивости к сурьме при кожной форме лейшманиоза широко используется как препарат первой линии препарат Амфотерицин. В ряде случаев эффективным средством является антибиотик-аминогликозид Паромомицин, который оказывает протозоацидное действие на простейшие, вызывая нарушение синтеза белка рибосомами. Может использоваться как для монотерапии, так в сочетании с препаратами сурьмы.
Модифицированным способом лечения висцерального лейшманиоза является вариант с включением иммунотропных лекарственных средств (Тактивин), воздействующих на Т-звено иммунной системы. Препараты этой группы повышают синтез интерферона, восстанавливают синтез факторов, нарушающих процессы миграции макрофагов, усиливают дифференцировку клеток Т-ряда. Также, эффективность противолейшманиозных препаратов усиливает одновременно назначаемый Интерферон гамма человеческий рекомбинантный.
источник
Висцеральный лейшманиоз – это хроническое инфекционное протозойное заболевание с поражением печени и селезенки, развитием анемии и кахексии. Другими симптомами являются лихорадка, увеличение лимфоузлов, кожные проявления. Диагностика включает выявление возбудителя из крови и биоптатов внутренних органов, реже путем биопроб на грызунах, поиск антител к возбудителю. Лечение состоит из курса этиотропных препаратов (преимущественно пятивалентной сурьмы) и коррекции органных дисфункций в качестве симптоматической терапии. В некоторых случаях показаны гемотрансфузии.
Висцеральный лейшманиоз (лихорадка дум-дум, кала-азар, черная лихорадка) принадлежит к трансмиссивным инфекциям, вызываемым простейшими. В 1903 году английский патолог Лейшман совместно с итальянским ученым Донованом описал морфологию органных поражений и выделил возбудителя. В честь исследователей инфекционный агент получил своё название Leishmania donovani. Болезнь наиболее распространена в тропических и субтропических странах, сезонный рост заболеваемости зависит от особенностей жизненного цикла переносчика и приходится на период с мая по ноябрь.
Возбудитель инфекции – простейший паразитический микроорганизм лейшмания. Источниками и резервуарами инфекции служат теплокровные дикие и домашние животные (грызуны, ленивцы, лисы, собаки), люди. Путь инфицирования преимущественно трансмиссивный, переносчики – самки москитов рода Phlebotomus. Имеются данные о единичных случаях заражения при переливаниях крови, передачи лейшманий от матери плоду, при использовании нестерильного медицинского инструментария и игл во время внутривенного введения наркотических средств.
В своем развитии лейшманиям необходимо пройти две стадии: безжгутиковую и жгутиковую в организме человека либо животного и переносчика соответственно. Амастиготы обитают внутри клеток, лишены способности к перемещению, промастиготы имеют жгутики для активных движений в пространстве. Находясь внутри самки москита, лейшмании активно размножаются в пищеварительном канале насекомого, после чего перемещаются к хоботку. Наиболее подвержены заражению дети до 5 лет, молодые мужчины, сельскохозяйственные работники, туристы, пациенты с ВИЧ-инфекцией, онкопатологиями.
В месте укуса переносчика формируется первичный аффект в виде гранулемы, которая состоит из макрофагов с размножающимися внутри лейшманиями, ретикулоцитов, эпителиоцитов и гигантских клеток. Через некоторое время гранулема подвергается обратному развитию, реже рубцеванию, а находящиеся в макрофагах возбудители с током лимфы и крови попадают во внутренние органы. При нормальном состоянии иммунной системы происходит разрушение пораженных клеток. В случае иммунодефицита лейшмании размножаются с увеличенной скоростью, поражают паренхиматозные органы.
Это приводит к возникновению воспалительных изменений, активному фиброзированию и увеличению размеров органов. В печеночной ткани при патогистологическом исследовании обнаруживаются участки интерлобулярного фиброза и дистрофия гепатоцитов, в лимфатических узлах – дистрофические изменения зародышевого центра и аплазия костного мозга, в селезенке – атрофия пульпы, зоны инфарктов, некроза и геморрагических инфильтратов. При длительном течении висцерального лейшманиоза возникает амилоидоз внутренних органов.
Разделение висцерального лейшманиоза на сельский и городской виды подразумевает разные источники инфекции (домашние и дикие животные), а также тяжесть течения патологии – считается, что при городском типе болезнь протекает доброкачественнее. Выделяют острый, подострый и хронический варианты органного лейшманиоза. Наиболее благоприятным течением отличается хроническая форма, острый тип данной протозойной инфекции чаще всего встречается у детей, характеризуется бурным развитием симптомов и нередкими летальными исходами. Для подострого варианта типично наличие осложнений.
Инкубационный период составляет от 20 дней до 1 года, чаще 3-5 месяцев. Для манифестации болезни характерно постепенное начало, появление кожной папулы бледно-розового цвета на месте внедрения возбудителя, сменяющейся участком депигментации (лейшманоид). Отмечается слабость, беспричинная усталость, снижение аппетита, похудание. В дальнейшем присоединяется лихорадка до 39-40° C, которая протекает с чередованием высокой и нормальной температуры тела на продолжении нескольких месяцев.
Наблюдается безболезненное увеличение всех групп лимфатических узлов, изменение их консистенции до плотно-эластической. Пациенты с висцеральным лейшманиозом почти всегда отмечают тяжесть и дискомфорт в подреберьях. При прогрессировании болезни наблюдается гепатоспленомегалия с появлением отеков и увеличением живота. Снижается количество выделяемой мочи. В связи с развитием гиперспленизма и поражения костного мозга возникают кровотечения. Обнаруживается одышка, язвенно-некротические поражения ротовой полости, бледность кожи, нарушения дефекации.
Наиболее частые осложнения (тромбогеморрагический синдром, гранулоцитопения, агранулоцитоз) связаны с поражением кроветворной системы, следствием чего является некроз миндалин, слизистой рта и десен (нома). Отечно-асцитический синдром при висцеральном лейшманиозе возникает из-за вовлечения печени, сопровождается хронической сердечной недостаточностью, нарушениями в работе ЖКТ (энтероколитом), нефритом, снижением либидо, олиго- и аменореей. Характерны случаи бактериальной пневмонии ввиду высокого стояния диафрагмы и снижения дыхательной емкости легких. К редким осложнениям относят разрывы селезенки, геморрагический шок, ДВС-синдром.
Определение висцеральной формы лейшманиоза требует осмотра инфекциониста, по показаниям назначаются консультации других специалистов. Важно уточнить у пациента факт пребывания в эндемичных зонах земного шара в течение предшествующих пяти лет, наличие вакцинации от лейшманиоза, род профессиональных занятий. Лабораторные и инструментальные методы верификации болезни включают в себя:
- Физикальное исследование. Во время объективного осмотра обращает на себя внимание бледность, сухость, истончение кожи, наличие язв в полости рта. Лимфоузлы плотные, увеличенные, безболезненные. При аускультации тоны сердца приглушены, выслушивается тахикардия, шумы, в легких могут определяться участки ослабленного дыхания. Пальпация живота безболезненна, размеры селезенки и печени резко увеличены. Часто обнаруживаются периферические отеки, асцит.
- Лабораторные исследования. Признаками лейшманиоза в общем анализе крови служат анемия, пойкилоцитоз, анизоцитоз, лейкопения, нейтропения, анэозинофилия, тромбоцитопения, резкое ускорение СОЭ. Биохимические параметры изменены в сторону повышения АЛТ, АСТ, СРБ, креатинина и мочевины, гипоальбуминемии. Наблюдается увеличение времени свертывания крови. В общеклиническом анализе мочи отмечается повышение плотности мочевого осадка, протеинурия, гематурия.
- Выявление инфекционных агентов. Для обнаружения лейшманий проводится микроскопия, посев биологических препаратов и крови, реже биопробы на хомячках. Серологическая диагностика (ИФА) направлена на выявление противолейшманиозных антител. Использование внутрикожной пробы Монтенегро является косвенным методом подтверждения диагноза в период реконвалесценции, применяется при эпидемиологических исследованиях в популяции.
- Инструментальные методики. Рентгенография ОГК выполняется для исключения пневмонии, туберкулезного поражения. Сонография брюшной полости визуализирует увеличение размеров печени, селезенки, признаки портальной гипертензии, наличие асцита. УЗИ и биопсию лимфатических узлов, стернальную пункцию, трепанобиопсию костного мозга, диагностическую торакоскопию и лапароскопию осуществляют по показаниям.
Дифференциальную диагностику лейшманиоза внутренних органов проводят с малярией, для которой характерна желтуха и триада «озноб-жар-пот»; бруцеллезом с его патогномоничными поражениями опорно-двигательного аппарата, нервной, репродуктивной, сердечно-сосудистой систем и кожи; брюшным тифом, клиническими особенностями которого являются тифозный статус, относительная брадикардия и парез кишечника. Для гриппа характерно острое начало и присоединение симптомов поражения верхних отделов респираторного тракта, а также сезонность в холодное время года.
Туберкулез проявляется длительным субфебрилитетом, редко сухим кашлем и симптомами дисфункции вовлеченных в патологический процесс органов; часто диагноз верифицируется только лабораторно-инструментальными методиками. Схожесть клинических симптомов заболевания наблюдается с такими патологиями, как лейкоз и лимфогранулематоз, при данных патологиях диагностическими критериями становятся данные анализов крови и биопсии костного мозга. Сепсис клинически протекает схоже, но обычно имеет первичный очаг поражения (рана, гнойное образование и др.).
Пациенты с данным заболеванием госпитализируются в стационар. В обязательном порядке необходимо ограничить возможность контакта с москитами, поэтому над кроватями и в оконных проемах устанавливают противомоскитные сетки. Постельный режим показан до устойчивых нормальных цифр температуры тела в течение 3-5 дней, из-за риска разрыва селезенки при её значительном увеличении не рекомендуются резкие наклоны, повороты, поднятие тяжестей более 10 кг. Режим питания предусматривает высококалорийную, богатую белками пищу, водная нагрузка подбирается индивидуально.
Этиотропная терапия висцерального лейшманиоза должна включать препараты сурьмы (натрия стибоглюконат) либо пентамидин, милтефозин, липосомальный амфотерицин В. Некоторые исследования показали эффективность терапевтического приема производных пятивалентной сурьмы в сочетании с сульфатом паромомицина, при этом сокращается длительность курса лечения. Пациентам с осложнениями, ВИЧ-инфекцией, тяжелыми сопутствующими болезнями рекомендовано курсовое введение амфотерицина В как первой линии лечения висцерального лейшманиоза.
Выраженная анемия является показанием для эритроцитарных гемотрансфузий, реже требуется введение тромбомассы и донорских лейкоцитов. Коррекция анемии заключается в длительном приеме препаратов железа, по показаниям – колониестимулирующих факторов. Симптоматическое лечение предполагает дезинтоксикацию, прием жаропонижающих средств (аспирин – с осторожностью), антибиотиков в случае присоединения вторичных инфекций. Важной составляющей лечения является борьба с отеками, в числе прочего в план терапии включаются мочегонные средства и растворы альбумина.
Прогноз при ранней диагностике благоприятный за исключением случаев болезни у ВИЧ-инфицированных пациентов – у данной категории больных даже слабопатогенные штаммы лейшманий вызывают органные поражения. Продолжительность лечения составляет 14-30 дней, наблюдение за реконвалесцентами занимает 4-6 месяцев из-за возможных рецидивов лейшманиоза. У 17% пролеченных пациентов в течение 5 лет после выздоровления могут обнаруживаться симптомы посткала-азарного дермального лейшманиоза, протоколы диагностики и лечения для которого окончательно не разработаны.
Специфическая профилактика заключается в плановом введении живой вакцины, рекомендована лицам, проживающим или планирующим длительное либо кратковременное пребывание на эндемичных территориях, туристам. Введение препарата необходимо осуществлять зимой или осенью минимум за три месяца до поездки. Неспецифические меры предотвращения висцерального лейшманиоза включают своевременное выявление, изоляцию и лечение больных, использование противомоскитных сеток, вакцинацию собак, устранение свалок, меры дезинсекции и дератизации. Борьба с москитами заключается, в том числе, в осушении болот, подвалов и овощехранилищ.
источник