| ВОЗБУДИТЕЛИ ДИФТЕРИИ И ТУБЕРКУЛЕЗА. |
| Дифтерия поражает детские коллективы и все вновь создаваемые коллективы (1, 9 классы школы и училищ, армейские коллективы). Сегодня дифтерия очень актуальна. |
| Семейство Corinobacteriaceae объединяет порядка 60 видов из них примерно 20 патогенны для человека и животных. |
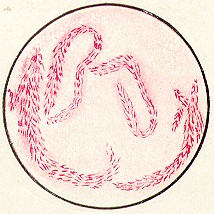
| Corinobacterium Difteriae — микроб патогенный только для человека. Слово Corine обозначает булава. На обоих концах бактерии есть булавовидные утолщения. Считается что эти булавидные утолщения связаны с накоплением на обоих концах питательных веществ в зернах волютина, что выявляется окраской по Нейсеру. Волютин — это полиметафосфаты, окрашиваются в синий цвет. Коринобактерии довольно мелкие, полиморфные, располагаются в мазке под углом друг к другу, изображая букву L. |
| Впервые выделил и описал коринобактерии дифтерии Лефлер. При делении они делятся вдоль. Дифтерийная палочка — аэробы, имеют набор сахоролитических ферментов, расщепляют глюкозу, иногда крахмал и сахарозу. |
| Они хорошо устойчивы во внешней среде и на предметах (они могут передаваться через посуду, предметы). Протеолитических ферментов у возбудителя дифтерии нет вообще, потому применяются сложные питательные Среды. Они содержат аминокислоты, витамины и как правило кровь. Основная плотная Среда — Среда Клауберга, жидкая Среда — Среда Костюковой. В среду Клауберга входит и эритрацитарная масса и гемолизированная кровь. Обе Среды содержат гелурит калия или натрия. Рост дифтерийной палочки на них — потемнение (черные полоски на среде Клауберга, а Среда Костюковой— темнеет) это очень удобно при массовых исследованиях. |
| Дифтерийные коринобактерии вирулентны в R-форме. Для R-формы характерны шероховатые колонии. По культуральным свойствам выделяют 2 типа: 1) gravis (тяжелый), 2)mitio (легкий). Gravis описывается как цветок маргаритки: круглый выпуклый центр и фестончатый край, радиальная исчерченность по периферии. Mitio — гладкая выпуклая ко. с ровными краями. Раньше считалось что gravis вызывает более тяжелое заболевание чем mitio, но это не так такой зависимости нет (зависит только от токсина). |
| Дифтерийные палочки имеют большое количество антигенов. В нашей стране наиболее распространены 7 антигенных типов. Их можно фаготипировать. Есть циногенные культуры (коринобактерии продуцируют цины 2 типов). Существуют циночувствительные культуры. |
| Ген токсигенности дифтерийной палочки не находится в хромосоме, а находится в ДНК умеренного фага. Если ДНК такого фага интегрируется в геном дифтерийная палочка начинает продуцировать токсин. Это явление было открыто в 1951 году (сейчас это доказано для возбудителя ботулизма, для некоторых энтеротоксигенных кишечных палочек, для холерного вибриона). Такое явление называется фаговая конверсия. Вообще лизогенная конверсия — это привнесение профагом информации в бактериальную клетку. Если же профаг приносит факторы вирулентности, то такая конверсия называется фаговой. Токсин дифтерийной палочки — истинный экзотоксин. Это белок состоящий из 2 субъединиц А и В. А имеет меньшую молекулярную массу, а В большую. Субъединица В отвечает за рецепцию. Когда субъединица В соединилась с клеткой, она остается снаружи, а А — проникает внутрь клетки где находит фермент амитрансферазу-2, участвующий в синтезе белка. Он характерен для эукариотов. Этого фермента в каждой клетке 1-2 молекулы. Таким образом 1-2 молекулы экзотоксина достаточно чтобы остановить синтез белка в клетке. Токсин дифтерийной палочки очень ядовит. Его минимальная летальная доза для морской свинки весом где-то 235 гр составляет 0.06 микрограмма. Высокая ядовитость противоположна малой |
инвазивности. Дифтерийная палочка имеет фактор похожий на гиалуронидазу, гемолизины, корд-фактор. Корд-фактор находят и у туберкулезных палочек. Это вещество которое не дает микробам расходиться друг от друга, склеивает их. Инвазивность дифтерийной палочки несмотря на наличие этих факторов считается нулевой, т.е. палочка попала в организм и не двигается с места.
Самая частая форма дифтерии — дифтерия зева. На втором месте — дифтерия зева и носа. На 3 м месте — дифтерия носа. Остальные формы дифтерии — редкие: дифтерия раны, пупочного кольца, половых органов, ануса, глаза. Лизоцим на дифтерийные палочки вообще не действует. Есть коринобактерия — нормальный обитатель глаза — Corinobacterium xerosis. Там где размножается дифтерийная палочка образуется пленка. Эта пленка состоит из чистой культуры дифтерийных микробов которые связаны корд-фактором и фибрином. Микробы в составе этой пленки никуда не распространяются, а распространяется только токсин. Если дифтерийная палочка попала на орган покрытый многослойным эпителием (зев, глотка) то развивается дифтерийное воспаление. При этом пленка плотно связана с подлежащими тканями (при удалении пленки — слизистая разрушается). Если дифтерийная палочка попала на орган покрытый однослойным плоским эпителием (более низкие отделы — гортань, трахея, бронхи) то воспаление будет крупозное. Пленка будет легко отделятся от подлежащей ткани (сама) и может перекрывать дыхательные пути и вызывать асфиксию. Дифтерия опасна также тем что происходит отек гортани и дыхательные пути перекрываются. Есть третья причина асфиксии — дифтерийный токсин действует на дыхательный центр угнетающе. Пленки надо отсасывать (раньше врачи это делали ртом, сами при этом заражались).
Токсин действует еще на надпочечники и сердечную мышцу, которые фактически не функционируют. Вылечить такого ребенка можно только с помощью противодифтерийных сывороток. Противодифтерийная сыворотка — антитоксическая. Применение ее является противопоказанием для серодиагностики. Применяют для лабораторной диагностики бактериоскопический метод (можно покрасить любой краской, отличия сразу видны) и бактериологический. Сыворотка лошадиная, применяется в огромных дозах до 30000 МЕ. Это примерно 30 мл. Поэтому возможно развитие сывороточной болезни. Поэтому она вводится по Безредко, дают антигистаминные препараты.
ПРЕПАРАТЫ ДЛЯ АКТИВНОЙ ПРОФИЛАКТИКИ ДИФТЕРИИ.
1. Основной препарат — дифтерийный анатоксин (АД-анатоксин). Он получен из дифтерийного токсина по Романову 0.4% формалином. Он обязательно сорбируется на гидроокиси Al. Так как анатоксин легко растворяется, рассасывается , то нужно создать депо. Вводится под лопатку, т.к медленнее всего рассасывается. 2. АДС-анатоксин — адсорбированный дифтерийно-столбнячный анатоксин. 3. АДСМ-анатоксин (М— минимальный,т.е в очень маленьких дозах антиген (в 4 раза меньше доза). Применяется при аллергии. Вместо одного введения делают два. 4. АКДС — вакцина. Сюда прибавляется убитые коклюшная вакцина, которая создает антимикробный иммунитет. Здесь “А” — ассоциированная. Очень реактогенный препарат. Если ребенок на 2 м году жизни не привит, то ему не нужно прививать коклюшную вакцину, т.к коклюш уже не опасен., прививают АДС. Промежуток между вакцинациями АКДС вакцины должен быть не более 6 месяцев. Прививку нельзя делать если ребенок простужен.
Относится к семейству Micobacterioceae к порядку Actinomycetoles. Актиномицеты имеют сходство с грибами : они медленно растут на питательных средах, малый диаметр гиф, способны давать ветвящийся рост. Однако есть общее и с бактериями — во-первых это прокариоты, во-вторых у актиномицетов клеточное стенка такая же как у бактерий, рибосомы, жгутики бактериального типа.
Семейство микобактерий включает около 200 видов. У человека заболевание вызывают Mycobacterium tuberculosis, M. Bovis, M. Afrecanus, M.lepra (возбудитель проказы).
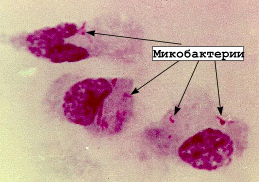
Все микобактерии характеризуются кислотоустойчивостью, которая обусловлена высоким содержанием жировосковых веществ в клеточной стенке микобактерий: это миколовая, туберкулостеариновая, туберкулопальмитиловая кислоты. Эти кислоты встречаются только у туберкулезных палочек. Эти вещества позволяют микобактериям быть устойчивыми в агрессивных средах, устойчивы к высушиванию. В пыли, высохшей мокроте возбудители туберкулеза могут сохранятся до 6 месяцев. Окрасить микобактерии вследствие их кислотоустойчивости также очень трудно. Открыл микобактерию туберкулеза Кох. Красят их по Цилю-Нильсону (окрашиваются в красный цвет).палочки Коха также чуть изогнутые.
Микобактерии облигатные анаэробы, растут в виде поверхностной пленки. У них есть сахаро- протео- и липолитические ферменты. Требовательны к питательным средам, которые должны содержать аспарагин и глицерин. Основная Среда — Левенштейна-Нейсена. Плотная желточная Среда, содержит малахитовую зелень. Растут микобактерии крайне медленно — первые признаки роста обнаруживаются к концу 3 ей недели.
Существует большая группа условнопатогенных микобактерий которые вызывают микобактериозы. Микобактероизы часто похожи на туберкулез и на проказу. Есть и группы условно-патогенных микобактерий по способности продуцировать пигмент:
1. фотохромогенные — образуют пигмент на свету
2. скотохромные — независимые
3. нехромогенные и быстрорастущие — вырастают в пределах одной недели. Пигмент оранжево-желтого цвета продуцируется на свету. К быстрорастущим относится М.smegmatis представитель нормальной микрофлоры.
ПАТОГЕНЕЗ. Основное действующее вещество микобактерий туберкулеза — эндотоксин-аллерген, названный Кохом туберкулином. Основная защита макроорганизма — клеточная на уровне фагоцитов, на уровне специфических Т-лимфоцитов.
Источник инфекции — больной человек или животное (для М.bovis). механизм передачи аэрозольный, может быть и алиментарным. Почти в 100% туберкулезная палочка вызывает туберкулез легких, иногда ЖКТ, мочеполовой системы, кости — это вторичные процессы.
Если фагоцитоз микобактерий завершенный — очаг обезвествляется и процесс заканчивается ( в корне правого легкого у каждого из нас есть так называемый очаг Гона). Если фагоцитоз незавершен, образуется специфическая гранулема, появляются гигантские многоядерные клетки Пирогова-Ланганса, в которых много туберкулезных палочек, развивается некроз. В центре гранулемы — творожистый некроз. Образуется полость —каверна, если она сообщается с наружной средой то туберкулезная палочка будет выходить наружу — это открытая форма туберкулеза (исследуют мокроту на содержание палочек при открытой форме туберкулеза).
Фтизиатры делят туберкулез на активный и неактивный. Активный туберкулез — это когда обнаруживается антитела в РСК или в РНГА (реакция связывания комплимента или нагрузочной гемагглютинации). Титр антител очень маленький: диагностический титр 1: 5. Антитела не играют защитной роли.
Также для аллергодиагностики применяют пробу с туберкулином (Манту). Официальное название туберкулина — протеин-туберкулин-дериват (т.е прозводное кожи) Линкинова.
Проба Манту проводится внутрикожно.
Специфическая профилактика — вакцина BCG.
Лечение — использавание ПАСК, изониазида, антибиотиков (стрептомицин, канамицин).
источник
ЛЕКЦИЯ 16 . Микробиологическая диагностика воздушнокапельных инфекций (дифтерия, коклюш, туберкулез, микобактериозы).
ВОЗБУДИТЕЛИ ДИФТЕРИИ И ТУБЕРКУЛЕЗА
План лекции I . Возбудитель дифтерии: 1) морфология;
5) этиотропная терапия, специфическая профилактика.
6) Сorynebacterium non diphtheriaе. II. Возбудитель туберкулеза: 1) морфология;
6) лабораторная диагностика; 7) этиотропная терапия, специфическая профилактика.
Возбудитель дифтерии
Дифтерия – это острое инфекционное заболевание, характеризующиеся воспалительным процессом слизистых оболочек, реже кожи, с образованием фибринозных пленок и общей интоксикацией.
Возбудитель: семейство Corynebacteriacae, род. Corynebacterium, вид Сorynebacterium diphtheriaе.
Вид Сorynebacterium diphtheria является патогенным и внутри вида делится на токсигенные и нетоксигенные штаммы.
Возбудителем дифтерии является C. diphtheriae tox +. Нетоксигенные штаммы не вызывают дифтерию.
Все остальные представители рода обозначаются общим термином дифтероиды, или коринеформные бактерии, они не отличаются от C. diphtheriae по морфологическим и культуральным, но отличаются по биохимическим свойствам. Все они условнопатогенные, входят в состав нормальной микрофлоры (кожа, носоглотка, гениталии). Дифтероиды могут вызывать ГВЗ самой различной локализации, в иммунокомпроментированном организме.
C. diphtheriae требовательны к питательным средам. Растут на средах с добавлением сыворотки крови. На свернутой сыворотке (среда Ру) рост появляется через 10-12 часов. Колонии выпуклые, не сливаются, желтовато-кремового цвета. Для выделения культуры возбудителя дифтерии из патологического материала используют элективные питательные среды. Такой средой является кровяно-теллуритовый агар. Теллурит подавляет рост сопутствующей флоры и не влияет на рост C. diphtheria. На нем хороший рост появляется через 48 часов. Колонии от серого до черного цвета (в зависимости от их биовара) за счет восстановления теллурита калия или натрия до металлического теллура (черного цвета), который накапливается в цитоплазме клетки. В жидкой питательной среде они либо растут в виде пленки, либо дают помутнение и осадок в зависимости от биовара.
По морфологии C. diphtheriae — палочки средней величины, прямые или слегка изогнуты, на концах имеют булавовидное утолщение. В мазках характерно расположены в виде римских букв X, V, L. Такое расположение обусловлено особенностями деления. В цитоплазме находятся метахроматические включения (полифосфаты). У возбудителя дифтерии они расположены по одному по концам палочки. У дифтероидов этих включений нет или они располагаются по всей цитоплазме. Они обнаруживаются при окраске мазков метиленовым синим или по Нейссеру. Расположение их является дифференциально-диагностическим признаком.

по характеру колонии на КТА;
по характеру роста на сывороточном бульоне;
по биохимическим свойствам.
C. diphtheria обладают сложным антигенным строением и делятся на серовары.
К факторам вирулентности относят: 1. Фимбрии.
У C. Diphtheria обнаружены фимбрии трех типов. Фимбрии обуславливают тропизм возбудителя к определенным клеткам и тканям организма и участвуют в процессах образования биопленки.
2. Ферменты агрессии и защиты (нейраминидаза, протеаза, гиалуронидаза), кордфактор. Основным ведущим фактором является продукция экзотоксина, синтез которого детерминирован профагом, т.е. является результатом лизогенной конверсии. По наличию профага C. diphtheriaе подразделяются на tox + и tox –.
Дифтерийный экзотоксин состоит из 2 субъединиц: А и В пептидов. Пептид В выполняет акцепторную функцию. Он распознает соответствующие рецепторы, связывается с ними и формируют внутримембранный канал, по которому в клетку поступает пептид А. Он модифицирует фактор элонгации Ef-2. Эта модификация приводит к нарушению синтеза белка на рибосомах. Дифтерийный экзотоксин оказывает специфическое и избирательное действие. Он поражает в основном сердце (миокард), симпатико-адреналовую систему, периферическую нервную систему (демиелинизация нервных волокон), сосуды (прямое действие и через поражение надпочечников). Сила токсина измеряется в Dlm.
Dlm – это наименьшее количество токсина, которое при подкожном введении морской свинке весом 250 г. вызывает ее гибель на 3-4 сутки при характерной патологоанатомической картине.
Определение дифтерийного токсина можно проводить с помощью:
— биопробы. Морским свинкам вводят внутрикожно бульонную культуру. На месте введения – некроз;
— реакция преципитации в агаре;
— иммуноиндикация: ИФА и латекс-агглютинация;
Дифтерия – антропоноз, источником является человек, больной или носитель.
Основной путь передачи — воздушно-капельный, возможен контактно-бытовой. Болеют в основном дети, в последнюю вспышку, и взрослые. Различают разные локализации процесса дифтерия: нос и зев, глаза, раны, кожа и половые органы.
Попав воздушно-капельным путем, возбудитель адсорбируется на эпителии и размножается с выделением экзотоксина. При дифтерии возбудитель остается на месте входных ворот, а патогенез заболевания обусловлен действием экзотоксина – местным и общим. По существу дифтерия – это токсинемия.
Местное действие: токсин поражает эпителиальные клетки носоглотки, а затем прилегающие кровеносные сосуды. Их поражение приводит к повышенной проницаемости сосудистой стенки. В экссудате содержится фибриноген, свертывание которого приводит к появлению на слизистых оболочках сероватобелых пленчатых налетов, которые пронизывают ткани миндалин, поэтому налёты очень плотно спаяны с подлежащей тканью. Такой тип фибринозного воспаления носит название — дифтерическое. Это местное действие токсина. Если пленок много и они проникают в воздухоносные пути, то наступает асфиксия (истинный круп). Общее действие: избирательное действие экзотоксина – поражение миокарда, нарушение сосудистой системы, всегда поражается кора надпочечников, периферическая нервная система.
Инкубационный период от 2-12 дней. Если это дифтерия зева, появляется температура, боли в горле, в зеве – характерная пленка. Развивается интоксикация разной степени. Осложнения-миокардиты, параличи, парезы. После перенесенного заболевания формируется стойкий антитоксический иммунитет.
1. Бактериологическое исследование. Материал зависит от клинической формы.
2. Иммуноиндикация. Обнаружение экзотоксина — ИФА, латекс-агглютинация.
3. ПЦР – обнаружение нуклеотидных последовательностей, которые кодируют синтез экзотоксина.
Лечение антитоксической сывороткой, которую вводят в дозе 10000-50000 АЕ, в зависимости от тяжести заболевания и возраста.
Она осуществляется дифтерийным анатоксином:


Ревакцинация проводится под контролем определения антитоксического иммунитета. Ставят РПГА с дифтерийным эритроцитарным анатоксическим диагностикумом.
Сorynebacterium non diphtheriaе вызывают ОРВИ в 11%; бронхиты, пиелонефриты, уретриты, эндокардиты, кольпиты, дерматиты, пневмонии, артриты и др. Чаще выделяли С. pseudobliphthericum и C. xerasis, C. ulcrans. Часто Сorynebacterium non diphtheriaе выделяли из клинического материала в ассоциации со стафилококками и стрептококками. В этих случаях факторы патогенности и резистентности к антибиотикам более выражены.
Возбудитель туберкулеза
Ежегодно в мире от туберкулеза погибают 3 млн. человек и регистрируется 8-9 млн.
новых случаев заболеваний. За последние 10 лет заболеваемость в России повысилась в 2 раза, летальность – в 1,5 раза. Широко распространены штаммы, обладающие множественной лекарственной устойчивостью. По данным ВОЗ лечение больных, у которых туберкулез вызван множественноустойчивыми штаммами, обходится в 100 раз дороже, а эффективность лечения не превышает 65%.У больных с ВИЧ, туберкулез встречается в 500 раз чаще.
Возбудитель: семейство Mycobacteriaceae, род Mycobacterium.
Микобактерии туберкулезного комплекса:

Основная роль M. Tuberculosis – 95%; M. Bovis – 5%. Остальные представители рода обозначаются как нетуберкулезные микобактерии (НТМБ). НТМБ — это условно патогенные бактерии, широко распространены в природе, могут заселять верхние и нижние отделы респираторного тракта и мочевыводящую систему. В настоящие время около 20 видов НТМБ могут вызывать различные заболевания (поражения кожи, подкожной клетчатки, костей, мягких тканей, воспалительные процессы в легких, менингиты и 6
дессиминированные процессы). По последним данным у ВИЧ — инфицированных 5056% вторичные инфекции вызывают НТМБ.
Март 1882 г. Р. Кох – выделил возбудителя туберкулеза.
Это палочки средней величины, тонкие, изящные, полиморфные. Встречаются ветвящиеся формы, внутри — включения — зерна Муха. Спор и капсул нет. Неподвижные. Снаружи от клеточной стенки – слой гликопептидов (в виде паутинки) – МИКОЗИДЫ – это микрокапсула, один из факторов вирулентности. Очень плохо воспринимают анилиновые красители. Для окраска по методу Грама нужно 24 часа → Грам +. Применяется метод Циля – Нильсена. Микобактерия характеризуется особенностями строения клеточной стенки: многослойная;

Липиды КС разнообразны, но есть характерные для МБ — миколовые кислоты; они либо находятся фиксированно в каркасе клеточной стенке, либо в свободном состоянии — сульфатиды. Все слои клеточной стенки пронизываются липоарабиномананном. Манозные концы отвечают за способность туберкулезной бактерии взаимодействовать с рецепторами макрофага. Перечисленные особенности играют ключевую роль в физиологии микобактерий. Эти особенности объясняют кислото-, щелоче- и спиртоустойчивость микобактерий, они объясняют неспособность окрашиваться анилиновыми красителями; возбудители, попавшие в микрофаги, устойчивы к биоцидным свойствам макрофагов. По типу получения энергии они аэробы.
1. Требовательны к питательным средам, фактором роста является глицерин; используют яично-глицериновые, картофельно-глицериновые синтетические среды.
2. Поскольку они растут медленно, для подавления сопутствующей флоры добавляют бриллиантовый зеленый или генциан-виолетт.
3. Бактерии туберкулеза растут очень медленно; время генерации 14-16 часов. Видимый рост появляется через 21-28 дней. Медленный рост — один из признаков для дифференциации M. tuberculosis от других быстро растущих микобактерий. Способность к медленному росту объясняется строением клеточной стенки. Благодаря гидрофобности, питательные вещества очень медленно проникают в цитоплазму, что приводит к снижению метаболизма. Этим же объясняется плохое проникновение анилиновых красителей.
На плотных средах дают колонии желтоватого цвета, не сливаются, поверхность не ровная. В жидких средах растут в виде пленки.
Изучение биохимических свойств используется для определения видовой принадлежности.
Антигенное строение: сложное. Антигены: белки и фосфолипиды клеточной стенки, корд-фактор и эндотоксин.
Основные факторы вирулентности M. tuberculosis начинают продуцировать, только когда они попадают в организм (макроорганизм). Когда они находятся во внешней среде, эти факторы репрессированы. К факторам вирулентности относят: сульфатиды, микозиды, липоарабиномананн. Туберкулезные бактерии являются факультативными внутриклеточными паразитами, которые размножаются внутри макрофагов.
Источником является человек. Путь заражения воздушно-капельный, контактнобытовой и алиментарный. При аэрогенном пути заражения туберкулезная палочка попадает в альвеолы, где происходит контакт с альвеолярными макрофагами; размножение в них сопровождается развитием неспецифической доиммунной гранулемы. Они легко проникают через барьеры в регионарные лимфатические узлы, затем кровь и другие органы. Развитие специфической гранулемы или туберкулемы происходит только через 2-3 недели и связано с подключением Т —
сенсибилизированных лимфоцитов. Эта специфическая гранулема еще называется первичным аффектом. В процессе вовлекаются регионарные лимфатические сосуды и узлы. Все вместе составляет первичный туберкулезный комплекс. У большинства людей он самоизлечивается, первичный аффект подвергается фибролизу и кальцификации. В других случаях (у детей) самоизлечение не наступает и развивается острый первичный туберкулез. Это всегда острый процесс у лиц, которые ранее не имели контакт с туберкулезными бактериями. Вторичный туберкулез – это хронический процесс, он возникает не ранее чем через 5 лет после первичного туберкулеза. Хронический туберкулез не излечивается без этиотропной терапии; хронический процесс — это всегда иммунопатология, относится к внутримакрофаговым инфекциям. Вторичный туберкулез в 80% случаев возникает в результате реактивации эндогенной инфекции и лишь 20% случаев является результатом экзогенного заражения. Чаще заболевание развивается при стрессе, плохих жилищных условиях. Причины, по которым происходит активация эндогенного туберкулеза, расплывчаты, вероятность его развития нельзя предсказать.
Туберкулезный процесс может развиваться в любых органах: легкие, кости, мочеполовая система и др. Наиболее частая локализация – легкие
Иммунитет при туберкулезе нестерильный, не стойкий. Антитела не играют защитной роли, решающую роль в механизме играет инфекционная аллергия.
1. Бактериологическое исследование: 2 мазка (по Цилю-Нильсену и флюорохромами). В процессе лечения они могут терять клеточную стенку ( превращаясь в L- форму). С потерей клеточной стенки они теряют кислотощелочоустойчивость, не обнаруживаются при окраске по Цилю-Нильсену.
2. Бактериологическое исследование: посев на специальные среды (28 дней). Определяется чувствительность к противотуберкулезным препаратам.
3. Серодиагностика. ИФА. Антитела не играют защитной роли, но они образуются.
5. А-ллергические диагностические пробы.
Возбудители природно-устойчивы к большинству антибиотиков. Выделяют особую группу противотуберкулезных препаратов. Основная комбинация в настоящее время – рифампицин + изониазид. Однако процент штаммов, обладающих лекарственной устойчивостью, быстро растет. Для лечения применяется комбинированная терапия, как минимум 2 препарата, лечение длительное (6 месяцев и более).
Существует вакцина БЦЖ – живая вакцина (бактерии Кальметта и Герена). Вводится в роддоме, на 3-5 день после рождения. Ревакцинация проводится в школе, под контролем пробы Манту. Ревакцинируют лиц с отрицательной пробой Манту.
и лабораторной диагностики, специфической профилактики и этиотропного лечения дифтерии и туберкулеза.
На протяжении всей истории человечества врачи и философы, жрецы и учёныепытались выяснить природу туберкулёза. Однако все догадывались, что этозаразная болезнь. В древней Персии, Риме-чахотка, в Индии- были запрещеныбраки с больными туберкулёзом, В Египте была обнаружена мумия человека споражениями внутренних органов, умершего примерно 2000 лет от туберкулеза.
Название болезни туберкулёз происходит от её характерного патанатоморфологического признака – специфических гранулам и туберкулом. (tuberkulum – от лат. бугорок; phthisis – совмещает два значения: харкать кровью и чахнуть – быстро терять вес. Ежегодно от tbc умирает 3 млн. чел. и 8-10 млн. новых случаев регистрируется ежегодно.
Туберкулез – бугорчатка, чахотка — хроническая инфекционное заболевание, характеризующееся образованием в различных органах, чаще в лёгких, специфических воспалительных изменениях. Инфекционная природа tbc была доказана в марте 1882г. на заседании Берлинского физиологического общества учёным Кохом, который сообщил о своих исследованиях по этиологии tbc – поэтому в настоящее время возбудители tbc называют палочкой Коха.
Возбудители относится к семейству M ус obacheriac е ae род. M ус obacherium, виды–
М. tuberculosis (95%) и m.bovis (5%), некоторые учёные относят сюда виды m.auium,
м.africanum. Но современный tbc связан преимущественно с видом М.tuberculosis.
По морфологии это тонкие, прямые или слегка изогнутые палочки средней величины, неподвижные, спор и капсул не образуют. Снаружи клеточная стенка окружена паутинным слоем гликолипидов, которые называются микозидами, а данную оболочку называют микозидной, и иногда сравнивают с микрокапсулой. Морфологические особенности: в цитоплазме есть включения, зёрна Муха. Морфологической особенностью М. tuberculosis является строение клеточной стенки: компонентами клеточной стенки этих бактерий является липоарабиноманат, и монозные радикалы или кэпы, которые определяют взаимоотношения микобактерий с макрофагами. В клеточной стенке, которая устроена сложнее, чем у других прокариот, преобладают липиды (более 60%),специфичные для микобактерий. Большинство липидов представлено миколовыми кислотами, которые не только фиксированы в каркасе клеточной стенки, но и присутствуют в виде свободных гликопептидов — и корд — факторов.
Наличие корд — фактора определяет рост М.tub. в виде жгутиков. Ранее считали, что с ним связано вирулентность, но в наше время это не доказано. Наличие уникальных миколовых кислот в клеточной стенке М.tub. делает их отличной мишенью для таких химиотерапевтических соединений как изониацид , этлонамид. С другой стороны, высокое содержание липидов в клеточной стенке придаёт этим бактериям ряд характерных свойств — устойчивость к кислотам, щелочам и спирту. Труднее восприятие анилиновых красителей (плохо окрашиваются по гр. (гр. +) в течение 24ч.) поэтому для окраски М.tub. используют метод Циля-Нильсона.
Необходимо отметить, что морфология микобактерий может изменяться в зависимости от состава питательной среды, условий культивирования, и особенностей клинического течения.
При неблагоприятных условиях могут образовываться колбовидные, ветвящиеся, напоминающие форму мицеллия гриба, коковидные, зернистые, фильтрующиеся и L – формы бактерий.
1. Культуральные свойства. Очень требовательны к питальным средам: для роста необходимы глицерин и аминокислоты. Наиболее часто используются яично – глицериновая среда Левинштейна- Иенсена; картофельная глицериновая среда и синтетические среды. Кроме того, для оптимального роста необходимо большое количество О2.
Даже в оптимальных условиях М.tub. растут очень медленно. Видимый рост на твёрдых питательных средах появляется на 21-28 день, в жидких на 7-10 день, для появления обильного роста необходимо 4-6 нед. Это связано с медленным размножением М. tub.- период генерации который составляет 14-15 часов (а типично бактерии делятся каждые 15 мин.).
Одной из причин медленного деления является их выраженная гидрофобность, связанная с высоким содержанием липидов в клеточной стенке. Это затрудняет поступление питательных веществ, снижая метаболическую активность клетки.
На плотных средах бактерии дают морщинистые, сухие, с неровными кр изолированные, не сливающиеся друг с другом колонии. При культивировании на жи средах — рост на поверхности в виде сухой пасты, которая со временем уплотня становится бугристо-морщинистой. Бульон остаётся прозрачным.
M . tub . относится к мезофиллам, растущим только при t = 37С.
В связи с необходимостью длительного культивирования для устранения возможности роста посторонней микрофлоры обязательным компонентом сред для культивирования являются анилиновые красители — типа бриллианта зелёного, метиленового синего.
Б/х. свойства — используется для дифферинциальной диагностики других представителей этого рода. Используются следующие тесты: редукций нитратов, определение активности никотинамидазы, никотиназы, пероксидазы, уреазы, каталазы.
Антигенные свойства. В АГ структуре микобактерий выделяют 4-е гр. АГ:
2) общие для медленно растущих
3) общие для быстрорастущих
4) общие для определенного вида;
Возбудители имеют сложное АГ строение. АГ М. bact. являются белки и фосфолипиды клеточной стенки, Корд-фактор и эндотоксин-туберкулим.
Факторы-вирулентности: токсический компонент клеточной стенки — жирные кислоты: миколовая, фтионовая и др.; эндотоксин и корт-фактор.
Патогенез —источник инфекций — больной человек (бациллярный больной), выделяющий с мокротой М.tub.
Для возбуждения конфликта с хозяином, бактерии должны попасть в альвеолы, где М.tub. поглощаются резидентными макрофагами отношения с которыми определяют дальнейшее развитие событий.
Неслучайно ТВС относится к классическим внутримакрофагальным инфекциям.
“ TBC ”- болезнь макрофагов. Главная роль в связывании с микроорганизмами принадлежит микозидам и микоарабитоманниту.
Оказавшись внутри клеток благодаря мощной липидной оболочки малочувствительны к факторам фагоцитов. Взаимодействие междупалочками макрофагами инициируют базисный для ТВС процесс воспаления — гранулематозного типа. Сама по себе гранулема не уникальна для ТВС, сходные реакции возникают и при других хронических инфекциях. Появляясь тотчас после инфекцированных туберкулёзных гранулем получают мощный импульс с появлением Т- лимфоцитов, синсибилированных возбудителю. Неспецифическая гранулема трансформируется в специфическую, обретая признаки, характерныедля ТВС. Именно с этогомомента гранулема называется туберкулом. Доиммунная гранулема неостанавливает инфекцию легких. ТВС палочки проникают в регионарные лимфатические узлы и далее в кровоток, получая возможность для диссеминации. Доимунная фаза соответствует инкубациинному периоду.
Клиника по локализации различают туберкулез легких, почек, туберкулезный менингит, костно – суставной.
По характеру поражения — миллиарный, инфильтративный, лобарная пневмония, диссеминированный кавернозный, фибринозно — ковернозный, туберкулема. По эпидемиологической опасности: -открытую и закрытую формы.
При открытой форме в мокроте обнаруживаются М.tub. и больной представляет опасность для окружающих. При закрытой- М.tub. в мокроте нет, больной опасности для окружающих не представляет. Но при прогрессировании болезни, закрытая форма может перейти в открытую.
Принято выделять 2 патогенетических варианта туберкулёза: первичный и вторичный. Первичный – возникает у лиц ранее не имевших контакт с возбудителем. Инфицирование обычно происходит в раннем детском возрасте.
Первичный ТВС развивается без аллергии к возбудителю. В зоне внедрения (обычно это в паренхиме лёгкого) возбудитель захватывается микрофагами, возбуждая неспецифическую гранулематозную реакцию. Бактерии легко проходят этот барьер, быстро проникают в регионарные лимфатические узлы и далее через кровеносное русло попадают в отдалённые органы.
Развитие истинного туберкулёза (т.е. специфической гранулемы) занимает 2-3 недели и связано с Т-синсибилизированием лимфоцитов – формируется первичный аффект, а втягивание в процесс регионарной лимфоидной ткани ведёт развитию лимфаденита и лимфангита, т.е. формируется первичный ТВС комплекс в лёгком + лимфаденит. Первичный очаг поражения в лёгких со временем может инкапсулироваться и кальцинироваться с образованием петpификата – очаг Гона. Однако, этот процесс не завершается полным освобождением организма от возбудителя и микобактерии могут сохраняться в организме на протяжении многих лет, создавая состояния инфицированности. Но эти люди, в отличии от носителей не являются эпидемиологически опасными, т.к. не выделяют МО во внешнюю среду.
Запомните! бактерионосительства при ТВС – нет.
Также при первичном ТВС возможны осложнения в виде развития системной инфекции .
Вторичный ТВС – может быть отнесён к категории иммунопатологии. Он развивается в более позднем возрасте при наличии эндогенной инфекции и повторном инфицировании.
Вторичный ТВС протекает хронически и не излечивается без этиотропной терапии. Почти всегда это патология лёгких – там формируется очаг. С мокротой возбудитель попадает в гортань, ротовую полость, кишечник, кровяное русло, угрожая экстрапульмонарными осложнениями.
Вторичный ТВС возникает при реактивации эндогенного инфекта через 5 лет и более после первичного заражения. Реинфицирование из вне тоже возможно, но наблюдается гораздо реже.
Интоксикация – одно из обязательных проявлений ТВС, она имеет не специфический характер (таким образом поиски специфических туберкулёзных токсинов оказались безуспешными).
Пути передачи :
1) Аэрогенный возбудитель — полевой возбудитель – капельный — самый опасный, капельки мокроты больного отлетают не более чем на 1.5 метра.
2) Алиментарный — чаще с молочными продуктами, от больной коровы, пастеризация не убивает М.tub, необходимо кипячение.
3) Контактный— при уходе за больными, мокрота с М.tub попадает на раневую поверхность
4) Внутриутробный — крайне редко, если женщина больна туберкулезом.
Туберкулез это: антропозоонозный, наследственнообусловленный, мультифакториальный, длительно действующий инфекционный процесс.
В процессе эволюции передаётся способность вырабатывать специфические защитные механизмы, это связано с системой несовместимости тканей НLA. Поэтому сейчас выделяют людей, устойчивых к ТВС. Наше население на ¾ и более являются потомками устойчивой линии, дают абортивные формы, бессимптомные, если не сыграли роль различные факторы — сон, еда, условия жизни, нет сопутствующих заболеваний — ТВС относится социальной болезни.
Особенности туберкулёза на современном этапе:
1) развивается на фоне хронических вирусных инфекций и вторичных имуннодифицитов
2) увеличение удельного веса, запущенных труднодиагностируемых форм
3) распространение ТВС с мультилекарственной устойчивостью
ТБ и ЛУ. -это связано с нерациональной химиотерапией данного заболевания.
Лечение. Хорошее питание, свежий воздух, снятие эмоций, химиотерапия.
1 ряд — широкоиспользуемые препараты, наиболее эффективны туберкулостатики — изониазид, тубазит.
2 ряд – стрептомицин, этионамит. 3 ряд – паси и его аналоги.
Профилактика ТВС.
Живой аттенуированной вакциной -бациллы Гернета и Кельмета, содержащий авирулентный штамм М.boris. проводят на 3-7нед. Ревакципеации в 57лет и более поздние сроки. Ревакцинацию проводят БЖЦ вакциной, содержащей в 2- раза меньше нагрузки. Особенности иммунитета.
1. не стерильный — инфекционный т.е. поддерживается бактериями, обеспечивающими состояние инфицированности.
2. неустойчивый – при определённых условиях микобактерии могут стать причиной развития эндогенной инфекции.
3. нестойкий. Продолжительность циркуляции вакцинных штамов в организме 5-7лет.
4. клеточный. Основной механизм защиты при ТВС- антимикробная резистентность осуществляется активностью систем комплемента и фагацитоза.
5. аллергический, т.е. развиваются реакции ГЗТ.
6. АТ к микобиктериям туберкулёза является свидетелями иммунитета и не оказывают ингибирующего действия на возбудитель.
Лабораторная диагностика ТВС.
Осуществляется в соответствии с документами МЗ РФ № 342 от 29.05.1980г. «Об улучшении борьбы с внелёгочным туберкулёзом» и с приказом № 324 от
22.11.1995г. «О совершенствовании противотуберкулёзной помощи РФ»
1. бактериоскопический— окраска мазков по методу Циля – Нильсона..
2. люминисцениттныя микроскопия – носит ориентировачный характер, т.к.
не позволяет отличить возбудителя ТВС от других микобактерий.
Дата добавления: 2018-10-15 ; просмотров: 301 | Нарушение авторских прав
источник
Вопросы для самоподготовки:
Возбудитель туберкулеза, его основные свойства, патогенез, лечение и профилактика туберкулеза. Методы микробиологической диагностики туберкулеза.
Возбудители дифтерии, их свойства, отличия от дифтероидов и ложнодифтерийных бактерий. Патогенез, лечение, профилактика и микробиологическая диагностика дифтерии.
Возбудители коклюша, их свойства. Патогенез, лечение, профилактика и микробиологическая диагностика коклюша.
Туберкулез – первично хроническое заболевание человека и животных, сопровождающееся поражением различных органов и систем (органов дыхания, лимфатических узлов, кишечника, костей, суставов, глаз, кожи, почек и мочевыводящих путей, половых органов, ЦНС).
Возбудители туберкулеза относятся к семейству Mycobacteriaceae, роду – Mycobacterium. Заболевание вызывается 3 видами:
M. tuberculosis – человеческий вид (в 92% случаев),
M. вovis – бычий вид (в 5% случаев),
M. аfricanum – промежуточный вид (в 3% случаев).
Морфологические и культуральные свойства.
— прямые или изогнутые палочки,
— грамположительны (но из-за большого содержания липидов в клеточной стенке плохо воспринимают красители),
— чаще применяют окраску по Цилю–Нильсену, при этом микобактерии обнаруживаются в препаратах в виде ярко-красных кислотоустойчивых палочек, расположенных поодиночке или небольшими скоплениями.
— в состав клеточной стенки входят миколовая, фтионовая, туберкулостеариновая и другие жирные кислоты.
Родовой признак микобактерий – кислото-, спирто- и щелочеустойчивость.
Рис.Туберкулезные палочки в чистой культуре (рисунок)
Рис. Мазок из чистой культуры M. вovis Рис. M.tuberculosis в мазке
(окраска по Цилю-Нильсену) из мокроты (окраска по Цилю-Нельсену)
Растут на сложных питательных средах, содержащих яйца, глицерин, картофель, аспарагин, витамины, соли. Для подавления токсического действия образуемых в процессе метаболизма жирных кислот к средам добавляют активированный уголь или сыворотки животных, для подавления роста сопутствующей микрофлоры – красители (малахитовый зеленый) и антибиотики, не действующие на микобактерии. Элективной средой является среда Левенштейна–Йенсена.
При внутриклеточном размножении, а также при росте на жидких питательных средах и микрокультивировании на стеклах в жидкой среде (метод микрокультур Прайса) через 48–72 ч у вирулентных штаммов выявляется корд-фактор, благодаря которому микобактерии склеиваются и растут в виде «жгутов» или «кос».
Рис. Корд-фактор M.tuberculosis: палочки, Рис. Незавершенный фагоцитоз микобактерий
расположены в виде «косы», жгутов (окраска по Цилю-Нильсену)
В отличие от условно-патогенных микобактерий, M. tuberculosis и M. bovis в большом количестве образуют никотиновую кислоту (ниацин), которая накапливается в жидкой питательной среде.
В отличие от M. bovis, M. tuberculosis обладают способностью редуцировать нитраты в нитриты.
К факторам патогенности микобактерий относятся компоненты клеточной стенки бактерий: туберкулопротеины, липиды и их комплексы.
— Туберкулопротеины являются основными носителями антигенных свойств микобактерий, они – высокотоксичны и вызывают развитие гиперчувствительности 4-го типа.
— Липиды (миколовая и фтионовая кислоты, корд-фактор) вызывают развитие гранулем, подавляют активность фагоцитарных клеток.
— Корд-фактор – это гликолипид, состоящий из трегалозы и димиколата. Он разрушает митохондрии клеток инфицированного организма, чем нарушает функцию дыхания.
Экзотоксины микобактерии не образуют.
Устойчивость в окружающей среде.
В естественных условиях при отсутствии солнечного света жизнеспособность микобактерий сохраняется в течение нескольких месяцев, при рассеянном свете – погибают через 1-1,5 мес.
В уличной грязи они сохраняются до 4 мес., в речной воде – до 7 мес., в сточной воде – до 15 мес., в навозе – до 2-х лет.
При кипячении они погибают через 5 мин, при пастеризации – в течение 30 мин, под воздействием ультрафиолетовых лучей – через 2-3 мин.
Возбудители туберкулеза устойчивы к действию дезинфицирующих веществ. Для дезинфекции используются активированные растворы хлорамина и хлорной извести, вызывающие гибель бактерий в течение 3-5 ч.
1.Основной — больной туберкулезом органов дыхания человек, выделяющий микробы в окружающую среду с мокротой.
2. Второстепенную роль играют больные сельскохозяйственные животные (крупный рогатый скот, верблюды, свиньи, козы, овцы) и люди, страдающие внелегочными формами туберкулеза (пищеварительного тракта или урогенитальной системы) и выделяющие микробактерии с мочой и калом.
Основной механизм заражения – аэрогенный с соответствующими ему воздушно-капельным и воздушно-пылевым путями передачи инфекции. Входными воротами при этом могут быть слизистая оболочка полости рта, миндалин, бронхи и легкие.
Реже заражение туберкулезом может происходить пищевым путем при употреблении термически не обработанных мясных или молочных продуктов, что особенно характерно для заболеваний, вызванных M. bovis, чаще поражающих детей.
Возможен контактный путь передачи инфекции от больных туберкулезом через поврежденные кожные покровы и слизистые оболочки при использовании инфицированной одежды больных, игрушек, книг, посуды. Известны случаи заражения людей при уходе за больными животными. Описаны редкие случаи заражения хирургов, паталогоанатомов, мясников.
Возможен и трансплацентарный путь передачи, но он, как правило, не реализуется вследствие тромбоза кровеносных сосудов плаценты в местах поражения. Внутриутробное заражение плода может происходить не только через пупочную вену и плаценту, но и при заглатывании амниотической жидкости, содержащей микобактерии.
Организм человека обладает высокой устойчивостью к действию патогенных микобактерий, поэтому большое значение для возникновения заболевания имеют длительность контакта с источником инфекции, массивность инфицирования, вирулентность микобактерий и снижение резистентности макроорганизма.
Инкубационный период длится от 3-8 недель до 1 года и более (40 лет). Возбудитель в течение длительного времени сохраняется в фагоцитирующих клетках региональных лимфатических узлов.
В развитии заболевания выделяют первичный туберкулез, диссеминированный и вторичный.
Первичный туберкулез возникает у ранее неинфицированных людей и характеризуется выраженными токсикоаллергическими осложнениями и некротическими изменениями в тканях, возникающими на фоне высокой чувствительности макроорганизма к возбудителям туберкулеза. Для него характерна гематогенная диссеминация.
В зоне проникновения и размножения бактерий возникает специфический воспалительный очаг – инфекционная гранулема. Затем развивается специфический воспалительный процесс в региональных лимфатических узлах и наблюдается сенсибилизация организма — формируется первичный туберкулезный комплекс. Обычно первичный очаг имеет доброкачественное течение, он рассасывается, пораженный участок кальцинируется и рубцуется. Но бактерии полностью не уничтожаются. В первичном очаге и лимфатических узлах они могут сохраняться долгие годы и при неблагоприятных условиях может произойти активация возбудителя и генерализация процесса.
Из первичного туберкулезного комплекса микобактерии разносятся:
в результате чего образуются очаги в других органах и тканях и возникает диссеминированный легочный или внелегочный туберкулез.
Вторичный туберкулез возникает у ранее инфицированных людей, процесс, чаще всего, локализуется в каком-либо органе. Возникновение вторичного туберкулеза – результат активации старых эндогенных очагов или нового экзогенного заражения возбудителями туберкулеза (суперинфекция) вследствие тесного контакта с бактериовыделителем.
Различают 3 клинические формы заболевания: первичная туберкулезная интоксикация у детей и подростков, туберкулез органов дыхания, туберкулез других органов и систем.
Чаще всего возникает туберкулез органов дыхания (легких и внутригрудных лимфатических узлов). Он проявляется субфебрильной температурой тела, кашлем с мокротой, кровохарканьем, одышкой. Симптомов, характерных только для туберкулеза, нет.
В отличие от M. tuberculosis, M. bovis чаще поражает детей и вызывает такие внелегочные формы заболевания, как туберкулез периферических лимфатических узлов и мочеполовых органов, туберкулез костей и суставов, сопровождающиеся лекарственной устойчивостью к изониазиду.
Иммунитет нестерильный, что обусловлено длительной персистенцией L-форм бактерий в макроорганизме. Он появляется через 4-8 недель после попадания микробов в макроорганизм.
Материалом для исследования служит мокрота.
Обязательными методами микробиологической диагностики туберкулеза являются бактериоскопическое и бактериологические исследования, биопроба и туберкулинодиагностика. Обнаружение в патологическом материале возбудителей является прямым доказательством активности инфекционного процесса.
Бактериоскопическое исследование. Из материала готовят мазки, окрашивают по Цилю–Нильсену и микроскопируют. В препаратах обнаруживают единичные или слипшиеся по 2-3 красные палочки, если в 1 мл мокроты их содержится не менее 10 4 -10 5 бактериальных клеток (предел метода). При получении отрицательных результатов прибегают к методам обогащения материала: гомогенизации и флотации.
Метод гомогенизации: к суточной порции мокроты добавляют равный объем 1% раствора едкого натра, флакон закрывают пробкой и встряхивают 10-15 мин, центрифугируют, нейтрализуют кислотой и из осадка готовят мазок.
Чаще применяют метод флотации: мокроту гомогенизируют и прогревают при 55 0 С 30 мин на водяной бане. Затем добавляют 1-2 мл ксилола, дистиллированную воду и повторно встряхивают в течение 10 мин. Оставляют стоять 25-30 мин при комнатной температуре. На поверхности образуется пена, состоящая из всплывших капелек ксилола с адсорбированными бактериями. Мазок готовят из пенообразного слоя, несколько раз наслаивая материал на стекло. Метод флотации на 10% повышает обнаружение микобактерий в патологическом материале.
Широкое распространение получил высокочувствительный метод люминесцентной микроскопии, основанный на способности липидов микобактерий воспринимать люминесцентные красители и светиться при облучении ультрафиолетовыми лучами.
Бактериологическое исследование является основным методом диагностики туберкулеза Исследуемый материал перед посевом в течение нескольких минут подвергают действию 10% серной кислоты или 4-6% едкого натра для освобождения от сопутствующей микрофлоры, затем тщательно встряхивают и центрифугируют. Осадок нейтрализуют и засевают в несколько пробирок со средой Левенштейна–Йенсена. Посевы инкубируют при 37 0 С 4-6 нед и более, просматривая посевы 1 раз в неделю. Выделенную культуру микобактерий туберкулеза дифференцируют от условно-патогенных микобактерий по морфологическим, тинкториальным, биохимическим свойствам и др.
Из биохимических свойств чаще всего определяют способность исследуемой культуры синтезировать никотиновую кислоту (ниациновая проба). Для определения ниацина к культуре микобактерий в жидкой питательной среде добавляют 1 мл КСN и 1 мл 5% раствора хлорамина. При наличии ниацина через несколько минут появляется ярко-желтая окраска. После учета результатов для нейтрализации КСN в пробирки добавляют 3-5 мл 10% гидрокарбоната натрия.
2.А. Для ускорения диагностики используют метод микрокультур Прайса. На нескольких предметных стеклах делают толстые мазки из исследуемого материала, высушивают, обрабатывают несколько минут 2-6% серной кислотой и нейтрализуют. Затем стекла опускают во флаконы с гемолизированной цитратной кровью в разведении 1/4-1/8 и ставят в термостат. Через 4-14 дней извлекают стекла, фиксируют препарат, окрашивают по Цилю–Нильсену и микроскопируют. Вирулентные штаммы образуют микрокультуры, имеющие вид кос или жгутов.
2.Б. Определение лекарственной устойчивости микобактерий проводят перед началом лечения, спустя 3 мес. и далее при продолжающемся выделении бактерий туберкулеза через каждые 6 мес. методом серийных разведений.
С этой целью по 0,1 мл взвеси микобактерий засевают в пробирки со средой Левенштейна–Йенсена, содержащей различные концентрации антибактериальных препаратов: 5, 10, 50 мкг/мл стрептомицина, 1, 5, 10, 25 мкг/мл тубазида и т.п. Результаты исследования учитывают по истечении определенного срока выращивания, достаточного для получения обильного роста в контрольных пробирках.
Устойчивость штамма выражается максимальной концентрацией антибактериального препарата (количество микрограммов в 1 мл питательной среды), при которой еще наблюдается рост, приближающийся к росту в контроле.
Биологический метод является наиболее надежным при выявлении микобактерий туберкулеза, он позволяет обнаружить от 1 до 5 микробных клеток в исследуемом материале. Исследуемый материал обрабатывают серной кислотой для освобождения от посторонней микрофлоры, нейтрализуют и вводят подкожно по 2-3 мл морской свинке и кролику с отрицательными туберкулиновыми реакциями. Через 4 мес., если животное не погибнет, его забивают и проводят микроскопическое исследование его органов. M. tuberculosis – высокопатогенны для морских свинок и малопатогенны для кроликов, M. bovis –высокопатогенны для кроликов.
4.Туберкулодиагностика – это ведущий метод диагностики туберкулеза у детей и подростков, основан на определении повышенной чувствительности макроорганизма к туберкулину, наступившей в результате заражения возбудителями туберкулеза или вакцинации ВСG, с помощью кожно-аллергических проб. Туберкулин – это белковые фракции – протеины, выделенные из бульонной культуры микобактерий путем добавления химических веществ, осаждающих белок, с последующей очисткой и лиофилизацией. Туберкулин вводят внутрикожно в строго определенной дозировке – проба Манту. Результаты оценивают через 48-72 ч. Реакция считается положительной при наличии выраженного инфильтрата (папулы) диаметром 5 мм и более.
5. Для экспресс-диагностики применяют реакцию иммунофлюоресценции (РИФ) с использованием видоспецифических моноклональных антител, иммуноферментный анализ (ИФА) и полимеразно-цепную реакцию (ПЦР). Эти методы направлены на обнаружение как антигенов возбудителей туберкулеза, так и антител к ним.
Международный союз борьбы с туберкулезом в связи с распространением в настоящее время множественно-резистентных штаммов предложил все противотуберкулезные препараты по степени их эффективности разделить на 3 группы:
группа А – наиболее эффективные – изониазид, рифампицин и их производные;
группа В – препараты средней эффективности – стрептомицин, канамицин, этионамид (пропионамид), этамбутол, пиразинамид, флоримицин, циклосерин, производные фторхинолонов; группа С – препараты малой эффективности – ПАСК, тибон (тиоацетозон).
В России препараты группы С в последнее время не применяются, а также получены препараты, превосходящие рифампицин по лечебным свойствам: рифапентин, рифабутин и комбинированные препараты: рифатер, рифанг.
Период лечения состоит из 2 этапов. Цель первого — подавить репликацию активно размножающейся бактериальной популяции, располагающейся в основном внеклеточно, добиться снижения ее численности. Цель второго этапа – долечивание в результате воздействия на оставшуюся бактериальную популяцию, в большинстве своем находящуюся внутриклеточно в виде персистирующих форм микобактерий.
Большинство больных перестают быть источником инфекции в течение 2 недель с начала соответстующей противотуберкулезной терапии.
Препараты для специфической профилактики.
Для специфической профилактики используют живую вакцину БЦЖ – BCG, полученную путем длительного культивирования M. bovis на картофельно-глицериновом агаре с добавлением бычьей желчи. Вакцинацию проводят новорожденным на 2-5 день в роддоме внутрикожно с последующей ревакцинацией согласно календарю прививок. Ревакцинацию проводят лицам с отрицательной туберкулиновой пробой с интервалом 5-7 лет до 30-летнего возраста.
источник
Дифтерия – острая инфекция, вызываемая Corynebacterium diphtheriae, симптоматика которой обусловлена выработкой токсина – внеклеточного белкового продукта токсигенного штамма возбудителя.
Этиология. Возбудитель дифтерии – Corynebacterium diphtheriae, или палочка Леффлера, – неравномерно окрашивающаяся грамположительная, неспороносная, неподвижная плеоморфная бактерия. Колбообразные вздутия на ее концах, не являющиеся истинным морфологическим признаком, отражают результаты выращивания на неадекватной питательной среде (Леффлера). Дифтерийные палочки лучше всего растут на специальных питательных средах, содержащих ингибиторы, способные угнетать и замедлять рост других микроорганизмов.
Токсигенные и нетоксигенные микроорганизмы встречаются среди гладких и среди шероховатых штаммов, выработка экзотоксина определяется в любом из трех типов колоний коринебактерий. Обработка дифтерийных штаммов бактериофагами, несущими гены токсигенности, способствует увеличению числа возбудителей, продуцирующих токсин. Однако размножение фагов не является необходимым условием выработки токсина, которая определяется генетическими факторами и условиями культивирования. Образуют токсин, по-видимому, те клетки, в которых происходит спонтанная индукция профагов в фаги.
Заболевания вызывают токсигенный и нетоксигенный штаммы дифтерийной палочки, но только первые, токсигенные, ответственны за развитие таких осложнений, как миокардиты и невриты.
Эпидемиология. Дифтерия – распространенное по всему миру заболевание, отличающееся сезонностью: пик заболеваемости приходится на осенние и зимние месяцы. Заражение происходит при контакте с больным или бактерионосителем. Бактерии передаются воздушно-капельным путем, роль бытового пути заражения невелика.
Патогенез и патоморфология. Первоначально инфекция локализуется на слизистых оболочках верхних дыхательных путей, реже – на конъюнктивальной оболочке, раневых поверхностях кожи или в области половых органов. Через 2–4 дня инкубационного периода штаммы возбудителя с бактериофагом начинают продуцировать токсин, который вначале адсорбируется на клеточной стенке, затем преодолевает ее и вмешивается в процессы белкового синтеза клетки, способствуя ферментативному расщеплению никотинамидадениндинуклеотида с последующим образованием неактивной трансферазы аденозиндифосфорибозы. При этом прекращается синтез клеточных белков вследствие нарушения переноса аминокислот от РНК к удлиняющимся полипептидам.
Некроз тканей наиболее выражен по периферии зон размножения дифтерийных возбудителей. В этих участках развивается воспалительная реакция, вместе с процессами некроза способствующая образованию характерных налетов, вначале легко удаляемых. По мере увеличения продукции токсина зона поражения становится шире и глубже, на ее поверхности появляются фибринозные наложения, быстро трансформирующиеся в плотные, прочно фиксированные пленки от серого до черного цвета в зависимости от содержания в них крови. Также в их состав входят фибрин и клетки поверхностного эпителия. Отделение пленки вызывает кровотечение, так как эпителиальный слой прочно входит в ее состав. В процессе выздоровления пленки отслаиваются самостоятельно.
Отек окружающих мягких тканей может принимать угрожающие размеры. Пленки и отечные мягкие ткани могут нависать над дыхательными путями, нарушая их проходимость и вызывая удушье, что может сопровождаться расширением гортани и трахеобронхиального дерева.
Токсин, образующийся на месте размножения дифтерийных палочек, попадает в ток крови и разносится по всему организму. Когда миндалины, зев и глотка уже покрыты дифтерийными пленками, начинается токсемия.
Токсин оказывает разрушающее воздействие больше всего на сердце, нервную систему и почки. После фиксации токсина в клетках до развития клинической симптоматики проходит латентный период. Миокардит обычно развивается через 10–14 дней, а заболевания нервной системы – не ранее 3—7-й недели после начала заболевания.
Для дифтерии наиболее характерны токсический некроз и гиалиновая дегенерация органов и тканей.
Клинические проявления. Симптоматика дифтерии определяется локализацией инфекции, иммунологическим статусом макроорганизма и степенью выраженности токсемии. Инкубационный период – 1–6 дней. Классификация на основании начальной локализации инфекции:
1) дифтерия носа встречается преимущественно у маленьких детей. Вначале характеризуется слабой ринореей при отсутствии общих нарушений. Постепенно отделяемое из носа становится серозно-кровянистого цвета, а затем и слизисто-гнойным. На верхней губе и у носовых ходов появляются экскориации, может появиться неприятный запах. На носовой перегородке видны белые пленки. Медленное всасывание токсина и слабая выраженность общих нарушений обусловливают запоздалую диагностику;
2) дифтерия миндалин и глотки – более тяжелая форма заболевания. Для начала заболевания свойственны незаметное, постепенное повышение температуры тела, анорексия, недомогание и фарингит. Через 1–2 дня в зеве появляются пленки, распространенность которых зависит от иммунного статуса больного. При частичном иммунитете пленки могут не образовываться. В начале заболевания пленка тонкая, серого цвета, распространяющаяся с миндалин на мягкое и твердое небо, напоминающая густую паутину. Этот признак отличает дифтерию от других форм мембранозного тонзиллита. В последующем пленки утолщаются, распространяются на стенки глотки или гортань и трахею.
Шейный лимфаденит в некоторых случаях сопровождается отеком мягких тканей шеи, в иных может быть сильно выражен, напоминая бычью шею. Отечные ткани мягкие и безболезненные, теплые на ощупь. Эти признаки наблюдаются у детей в возрасте старше 6 лет.
Течение дифтерии глотки зависит от распространенности пленок и количества продуцируемого токсина. В тяжелых случаях могут развиваться нарушения дыхания и циркуляторный коллапс. Частота пульса увеличивается непропорционально температуре тела, которая повышается незначительно или остается в пределах нормы. Нередко наблюдается паралич мягкого неба. Ступор, кома и летальный исход могут наступить в течение 7—10 дней. В менее тяжелых случаях ребенок выздоравливает постепенно, нередко у него развивается миокардит или неврит. В легких случаях заболевания выздоровление наступает через 7—10 дней, вскоре после отслаивания пленок;
3) дифтерия гортани развивается при распространении пленок с миндалин и из носоглотки. Изолированная дифтерия гортани встречается редко и чаще протекает со слабо выраженными явлениями интоксикации. Клиническая симптоматика напоминает картину обычного инфекционного крупа: шумное затрудненное дыхание, нарастающий стридор, хрипы и сухой кашель. Надгрудинные, подключичные и межреберные втяжения на вдохе указывают на сильную обструкцию гортани, которая при отсутствии мер может закончиться летально. Внезапная и часто фатальная обструкция гортани может наступать при легкой форме дифтерии в случае, если частично отслоившиеся пленки закупоривают дыхательные пути.
Тяжелые случаи дифтерии сопровождаются распространением пленок на все трахеобронхиальное дерево. Признаки токсемии слабо выражены у детей при изолированной дифтерии гортани. При более тяжелых формах сочетанного поражения гортани и носоглотки отмечаются выраженные токсемия и обструкция дыхательных путей;
4) для дифтерии кожи характерны язвы с четкими краями и дном, покрытым дифтерийной пленкой. Эта форма заболевания чаще встречается в странах жаркого климата и представляет собой значительную эпидемическую опасность;
5) дифтерия конъюнктивальной оболочки обычно ограничивается местным процессом, при этом отмечается покраснение век, их отечность и образование пленок;
6) дифтерия ушей характеризуется наружным отитом с длительно персистирующим и издающим неприятный запах гнойным отделяемым.
Описаны случаи и дифтерии вульвовагинальной формы. Кроме того, дифтерийная инфекция одновременно может локализоваться в нескольких местах.
Диагноз. Дифтерия диагностируется:
1) на основании клинических данных;
2) при подтверждении выделения возбудителя;
3) с помощью метода флюоресцирующих антител.
Микроскопическое исследование дифтерийных пленок считается нерациональным.
Дифференциальный диагноз. Легкие формы дифтерии носа необходимо дифференцировать с инородными телами в носу, синуситом, аденоидитом и врожденным сифилисом; дифтерию миндалин и глотки – со стрептококковым фарингитом, обычно сопровождающимся более сильными болями при глотании, высокой температурой тела и весьма легко отделяемыми пленками, покрывающими только миндалины. У некоторых больных дифтерия зева и стрептококковый фарингит сосуществуют; дифтерию миндалин и глотки – с инфекционным мононуклеозом, небактериальным мембранозным тонзиллитом, первичным герпетическим тонзиллитом, некоторыми болезнями крови (агранулоцитозей и лейкозом), посттонзиллэктомическими изменениями, токсоплазмозом, туляремией, сальмонеллезом и цитомегаловирусной инфекцией, ангиной Венсана; дифтерию гортани – с крупом иной этиологии, острым эпиглоттитом, ларинготрахеобронхитом, аспирацией инородных тел, окологлоточными и заглоточными абсцессами, папилломами гортани, гемангиомами и лимфангиомами.
Осложнения. Внезапная смерть из-за окклюзии просвета гортани или трахеи отслоившейся дифтерийной пленкой; сужение дыхательных путей вследствие значительного отека тканей шеи; миокардит после тяжелых и даже легких форм дифтерии, но чаще при распространенных поражениях и запоздалой постановке диагноза; неврологические осложнения (паралич мягкого неба, паралич глазодвигательного нерва, неврит диафрагмального нерва и паралич диафрагмы, паралич конечностей); поражение вазомоторных центров; гастрит, гепатит и нефрит.
Лечение. Основа лечения – нейтрализация свободного дифтерийного токсина и уничтожение возбудителя с помощью антибиотиков. Единственным специфическим лечебным средством служит дифтерийный антитоксин, получаемый из сыворотки гипериммунизированных лошадей.
Антитоксин следует вводить как можно раньше внутривенно и в количествах, достаточных для нейтрализации всего циркулирующего в организме токсина. Вводят его однократно для того, чтобы избежать сенсибилизации лошадиной сывороткой при повторном ее введении, предварительно проведя пробу на чувствительность к чужеродным белкам. Дозы антитоксина подбирают эмпирически: при легких формах дифтерии носа или глотки назначают 40 000 ЕД, а при более тяжелых – 80 000 ЕД. Дозу 120 000 ЕД назначают при наиболее тяжелых формах дифтерии глотки и гортани. Ту же дозу антитоксина вводят при множественной локализации инфекции, массивном отеке и давности заболевания более 48 ч.
Антибиотики (эритромицин и пенициллин, амоксициллин, рифампицин, клиндамицин) назначают с целью прекращения дальнейшей выработки токсина дифтерийной палочкой, а отменяют после троекратного получения отрицательных результатов посева на дифтерийные палочки.
Поддерживающая терапия. С целью предупреждения развития миокардита при дифтерии назначается строгий постельный режим на 2–3 недели; электрокардиография – 2–3 раза в неделю в течение 4–6 недель для своевременной диагностики начинающегося миокардита. Строгий постельный режим абсолютно необходим при развитии миокардита. При наличии симптомов сердечной недостаточности, кроме случаев дифтерийной аритмии, больным миокардитом назначают препараты наперстянки, в тяжелых случаях – преднизолон в течение 2 недель в суточной дозе 1–1,5 мг/кг.
Необходимо поддерживать гидратацию организма на оптимальном уровне, отсасывать отделяемое из носоглотки, внимательно следить за глотательным рефлексом и изменениями голоса, проводить трахеостомию для обеспечения проходимости дыхательных путей.
Пища должна быть жидкой и высококалорийной. В случае паралича мягкого неба или мышц глотки кормить ребенка следует через желудочный зонд с целью предупреждения аспирации.
Вакцинацию необходимо проводить лицам, перенесшим дифтерию, так как у половины из них не развивается прочный иммунитет и возможны рецидивы заболевания.
Профилактика дифтерии включает:
1) иммунизацию с применением дифтерийного анатоксина – дифтерийного токсина, лишенного токсический свойств, адсорбированного на гидроксиде алюминия (АД-анатоксин). В последнее время АД-анатоксин входит в качестве составляющего компонента в комплексные вакцины АКДС, АДС, АДС-М и др. Первичная вакцинация проводится начиная с 3-месячного возраста вакциной АКДС трехкратно с интервалом 45 дней. Первая ревакцинация – через 12–18 месяцев после третьей вакцинации, вторая – через 6–7 лет АДС-токсином, третья – в 16 лет и далее через 10 лет АДС-токсином;
2) изоляцию больных, пресечение путей распространения инфекции и наблюдение за контактами. Больные считаются заразными до тех пор, пока у них обнаруживаются возбудители в месте инфекции. Изоляцию прекращают после получения трех отрицательных результатов посева.
Прогноз и исходы зависят от тяжести первичной интоксикации и сроков начала лечения. Благоприятный исход более вероятен при локализованных формах дифтерии ротоглотки и носа. При токсических формах частота и тяжесть осложнений зависят от тяжести формы и сроков начатого лечения противодифтерийной сывороткой. Летальный исход может наступить в случае тяжелого миокардита или паралича дыхательной мускулатуры.
Дети с гипертоксической формой дифтерии ротоглотки умирают в первые 2–3 дня болезни при явлениях тяжелейшей интоксикации.
Перенесенная дифтерия оставляет иммунитет, сохраняющийся у 50 % больных в течение не менее 1 года. Повторные случаи заболевания редки, но вакцинировать против дифтерии необходимо и лиц, перенесших это заболевание.
источник