Диагностика дифтерии основана на клинических данных с последующим подтверждением диагноза бактериологическим исследованием. Лабораторная диагностика дифтерии включает в себя ряд исследований, основным из которых является микробиологическое.
- Зачастую для постановки диагноза бывает достаточно тщательно собранного анамнеза заболевания и осмотра ротоглотки. Всякая задержка при установлении диагноза и назначения адекватного лечения увеличивает вероятность неблагоприятного исхода заболевания.
- Выделение культуры возбудителей с последующим определением у выделенных возбудителей токсикогенности является основным и единственным методом микробиологической диагностики дифтерии. Предварительный результат получается через 24 часа, через 48 часов получается результат исследования дифтерийных палочек на токсикогенность, через 72 часа определяется биовар возбудителя.
- Микроскопическое исследование при дифтерии нерационально.
- Серологическая диагностика основана на определении роста титра антибактериальных антител. Результаты получаются на 2-й неделе заболевания.
- При диагностике дифтерии применяется генетический метод (ПЦР), позволяющий определить ДНК бактерий.
- Реакция латекс агглютинации относится к экспресс-методам. Результат получается уже через два часа.
- Иммунофлуоресцентный анализ результативен. Однако его проведение должно осуществляться только высококвалифицированным персоналом.
Рис. 1. Пленка грязно-белого цвета и выраженный отек подкожной жировой клетчатки шеи — «бычья шея» — классические признаки дифтерии.
Микробиологическое исследование является основным методом лабораторной диагностики дифтерии.
Бактериологическое исследование проводится в следующих случаях:
- с целью диагностики дифтерии зева, носа и глотки у взрослых и детей,
- с целью выявления возможного бактерионосительства у лиц, которые поступают в детские дошкольные учреждения и специализированные учреждения для взрослых,
- с целью выявления заболевания среди контактирующих лиц.
Материал для исследования (мазок на дифтерию) собирается натощак или спустя 2 часа после еды. Для исследования используются дифтерийные пленки или кусочки тканей, расположенных по соседству, отделяемое из мест поражения и носоглоточная слизь.
Забор материала (мазок на дифтерию) осуществляется ватным тампоном. Корень языка прижимается шпателем. Ватным тампоном необходимо коснуться слизистой оболочки миндалин на границе пленки, дужек и задней стенки глотки. Далее тампон опускается в стерильную пробирку, не касаясь ее стенок.
В течение первых 3-х часов должен быть отправлен в лабораторию. При невозможности произвести посев в ближайшие 3 — 4 часа, забор материала осуществляется стерильным ватным тампоном, который смачивают в 5% растворе глицерина в изотоническом растворе хлорида натрия или 2% растворе теллурита калия.
Забор материала (мазок на дифтерию) осуществляется двумя ватными тампонами, один из которых используется для посева, другой — для микроскопии.
При подозрении на дифтерию необходимо оповестить сотрудников лаборатории, чтобы собранный материал был посеян на соответствующие среды (кровяной агар, среда Леффлера или теллуритовая среда).
Посев осуществляется на питательные среды (кровяной агар, среда Леффлера или теллуритовая среда). Теллурит в большой концентрации подавляет рост сопутствующей микрофлоры.
Рис. 2. На фото рост колоний палочки дифтерии на разных средах — кровяном агаре и теллуритовой среде.
При росте бактерий на кровяном агаре колонии приобретают беловатую окраску, они непрозрачные, округлые, выпуклой формы, 1 — 2 мм в диаметре, чаще маслянистой консистенции.
При росте бактерий на теллуритовых средах колонии серого цвета, выпуклые, края ровные. Через двое суток колонии приобретают темно-серый или черный цвет, они имеют металлический блеск, ровные или фестончатые края, поверхность гладкая или радиально исчерчена.
Идентификации разновидностей штаммов возбудителей дифтерии основана на способности бактерий расщеплять гликоген и крахмал. Для этих целей используется методика «длинного» ряда углеводов.
Принимая во внимание ферментативные признаки возбудителей и структуру колоний при росте на теллуритовых средах, выделяют 4 биотипа коринебактерий дифтерии: Corynebacterium diphtheriae gravis, Corynebacterium diphtheriae mittis, Corynebacterium diphtheriae intermedius и Corynebacterium diphtheriae belfanti.
Рис. 3. На фото слева колонии коринебактерий дифтерии гравис (Corynebacterium diphtheriae gravis). Они имеют большой размер, выпуклые по центру, радиально исчерчены, с неровными краями. На фото справа Corynebacterium diphtheriae mittis. Они небольшого размера, темной окраски, гладкие и блестящие, с ровными краями.
Токсикогенность возбудителей дифтерии определяется после выделения культуры бактерий. Для этих целей используется методика диффузной преципитации в геле и методика определения токсикогенности бактерий в живом организме (на морских свинках).
Лабораторная диагностика с применением микроскопии является второстепенным по значимости. Ввиду того, что возбудители дифтерии плохо впитывают красители, окраска по Граму считается не специфичной, однако она позволяет косвенно определить непатогенные коринебактерии, которые в мазке располагаются параллельно друг другу.
При окраске по Нейссеру выявляются характерные для дифтерийных палочек зерна Бабеша-Эрнста, которые располагаются на полюсах клеток, придавая им вид булавы.
В мазках патогенные дифтерийные палочки располагаются под углом друг к другу.
Для выявления зерен Бабеша-Эрнста применяется методика люминесцентной микроскопии. При окрашивании мазков корифосфином в микроскопе можно увидеть желто-зеленые тела бактериальных клеток с оранжево красными зернами волютина.
Рис. 4. Дифтерийные палочки под микроскопом. Окраска по Граму.
Рис. 5. На фото слева ложнодифтерийные палочки Гоффмана. Они часто обнаруживаются в носоглотке. Они толстые, короткие, располагаются в мазках параллельно друг другу. На фото справа патогенные бактерии. В мазке располагаются под углом друг к другу.
Серологические исследования позволяют обнаружить антибактериальные и антитоксические антитела. Значимым является обнаружение антибактериальных антител, так как содержание антитоксина изменяется в связи с применением с первых дней антитоксической сыворотки. Наиболее распространенными в настоящее время является реакция пассивной гемагглютинации (РНГА и РПГА).
Иммуноглобулины G и M говорят об остроте инфекционного процесса.
Иммуноглобулины G говорят о недавно перенесенном заболевании.
Иммуноглобулины М говорят об остропротекающей дифтерии.
При дифтерии титр антител со временем повышается. Понижение концентрации антител свидетельствует о выздоровлении больного.
Противодифтерийные антитела образуются после вакцинации. В крови привитого человека они циркулируют многие годы.
Благодаря применению методики флуоресцирующих антител стало возможным проведение качественного и количественного анализа внутриклеточных и поверхностных антигенов в образцах клеточных суспензий. Антигены визуализируются с помощью специфических антител с флуоресцентными маркерами. Использование данной методики доверяется только высококвалифицированному персоналу.
Методика ПЦР применяется для раннего выявления дифтерийных палочек, подтверждения диагноза и в случаях атипичной ангины. Обнаружение гена токсикогенности методом ПЦР является наиболее быстрым и надежным методом лабораторной диагностики дифтерии.
Рис. 6. ПЦР является наиболее быстрым и надежным методом лабораторной диагностики дифтерии.
- При токсическом поражении сердечной мышцы отмечаются изменения на электрокардиограмме, фонокардиограмме и УЗИ сердца. Исследуется активность целого ряда ферментов (лактатдегодрогиназа, креатинфосфокиназа, аспартатаминотрансфераза).
- Поражение почек при дифтерии проявляется в виде токсического нефроза. При подозрении на это осложнение производится общий анализ крови и мочи, биохимические исследования (определение креатинина, мочевины, остаточного азота), производится УЗИ почек.
- Токсическое поражение печени протекает с явлениями гипогликемии (снижение уровня глюкозы в крови) и глюкозурии (наличие глюкозы в моче).
- Развитие анемии связано с гемолизом эритроцитов.
к содержанию ↑
Наличие или отсутствие противодифтерийного иммунитета устанавливается при помощи внутрикожной пробы Шика, которая проводится с дифтерийным токсином.
В случае отрицательной реакции говорят о невосприимчивости к дифтерии. Реакцию Шика сегодня используют только по эпидпоказаниям. На ее проведение уходит несколько дней. Однако несмотря на это она помогает определить степень восприимчивости к дифтерии лиц, находившихся в контакте с больным и уточнить их иммунный статус.
Рис. 7. Реакция Шика проводится с дифтерийным токсином. Стандартный дифтерийный токсин в дозе 0,2 мл вводится внутрикожно в среднюю треть предплечья туберкулиновым шприцом.
источник
Опубликовано в журнале:
Сестринское дело »» №5-6 1998 Внедрение новейших научных достижений в практику — одна из задач медицинской науки. В лаборатории клеточных гибридов НИИ вакцинаций и сывороток имени И.И. Мечникова РАМН разрабатываются новые диагностические препараты и тест-системы для быстрой и эффективной диагностики ряда инфекционных заболеваний, в том числе и дифтерии. Предлагаем вашему вниманию новые научные разработки.
Дифтерия — острое инфекционное заболевание, для которого характерно тяжелое течение. Некоторые случаи завершаются летальным исходом. Болеют дифтерией и взрослые, и дети. Вызывает заболевание микроб Corynebacterium diphtheriae, который продуцирует токсин, повреждающий клетки тканей человека. Токсин в значительной степени определяет характер заболевания. Болезнь передается от человека к человеку воздушно-капельным путем. Циркуляция микроба возрастает или, напротив, уменьшается в зависимости от восприимчивости людей к возбудителю. В свою очередь, восприимчивость или невосприимчивость зависит от того, были ли люди привиты специальной вакциной или нет, есть ли у них в крови специфические антитоксические антитела. Поэтому главным методом борьбы с дифтерией является иммунизация детей, а при необходимости и взрослых.
Для иммунизации используют комплексную адсорбированную вакцину, включающую в себя инактивированные (то есть лишенные токсического действия) корпускулярные антигены — возбудители коклюша, инактивированные дифтерийный и столбнячный токсин. Это АКДС или АДС (без коклюшного компонента) вакцины. Цикл иммунизации состоит из первичной вакцинации и ряда ревакцинаций с определенными интервалами времени. Входящий в состав вакцины инактивированный формалином дифтерийный токсин (анатоксин) в отличие от биологически активного токсина не вызывает в организме человека токсического действия, но вместе с тем способствует синтезу специфических антитоксических тел, которые нейтрализуют токсин, выделяемый попавшими в организм бактериями, и предупреждают развитие заболевания или облегчают его течение. В настоящее время ведутся исследования по усовершенствованию вакцин. В частности, показано, что в вакцину целесообразно включить не только анатоксин, но и некоторые компоненты самого микроба, чтобы в организме привитого синтезировались антитела, способные блокировать не только токсин, но и сам микроб.
Помимо иммунопрофилактики (вакцинации) для предупреждения распространения заболеваемости дифтерией важными мерами являются своевременная диагностика заболевания, изоляция больных и бактерионосителей. У привитых лиц дифтерия может протекать в легкой форме или вообще скрыто, в виде бактерионосительства, без явных признаков заболевания. Такие лица, не будучи своевременно изолированными, могут стать распространителями болезни. Вот почему после длительного отсутствия в коллективе или при приеме в детский коллектив, а также при выписке из больницы и детей, и взрослых проверяют на бактерионосительство. Берут пробы из носа и зева и исследуют их на наличие токсигенных бактерий. Такой анализ довольно продолжителен: ориентировочный ответ — через 24 часа, окончательный — через 48 часов и более. Это несколько снижает его ценность, особенно в тех случаях, когда речь идет о диагностике заболевания, когда нельзя медлить с началом специфического лечения с введением антитоксической сыворотки, чтобы предотвратить тяжелые последствия.
Вот почему в лаборатории клеточных гибридов НИИ вакцинаций и сывороток имени И.И. Мечникова РАМН (заведующий В.В. Свиридов) был разработан и апробирован на практике экспресс-метод выявления токсичных микробов. Суть его состоит в том, что взятые из зева и носа пробы помещают в жидкую питательную среду и культивируют в течение 6-8 часов. Затем жидкость исследуют на наличие дифтерийного токсина методом иммуноферментного анализа (ИФА). Такой способ высокочувствителен (выявляется 4 нанограмм токсина в 1 мл и более), специфичен, прост, демонстративен и быстр — ответ о наличии токсичного дифтерийного микроба дается через 17-20 часов. В лаборатории получены моноклональные антитела к той части токсина, которая ответственна за связь с клетками тканей и последующее его токсическое действие. Для постановки ИФА используют специальные планшеты с лунками, к поверхности которых прочно прикреплены данные антитела. В эти лунки вносят испытуемые пробы, и если в пробе есть токсин, он прочно связывается с антителами на поверхности планшета. Далее присутствие токсина выявляется с помощью специфических реагентов, дающих цветную реакцию. Интенсивность окраски меняется в зависимости от количества токсина, связавшегося с антителами. Это позволяет давать ответ не только о наличии токсигенных штаммов, но и о степени их токсичности.
Для клиники и эпидемиологической практики важно не только быстро поставить диагноз заболевания. Также важно иметь возможность количественно оценить напряженность иммунитета у отдельного человека или у больших коллективов. В первом случае это позволяет прогнозировать тяжесть течения и исход заболевания, во втором — оценить эффективность вакцинации и определить степень защищенности населения от заболевания. Наиболее распространенным методом является реакция пассивной агглютинации (РПГА). Этот метод основан на том, что в реакции используют эритроциты, на поверхности которых прикреплен анатоксин. При смешивании взвеси таких эритроцитов с испытуемой сывороткой и последующей инкубации на поверхности лунки образуется осадок эритроцитов в виде зонтика, если антитела есть, если же нет — эритроциты оседают в виде точечного плотного осадка. Для постановки такой реакции не требуется сложного оборудования и реактивов, она доступна любой лаборатории. Однако установлено, что эта реакция малочувствительна и часто дает ложно-отрицательные результаты.
Более точные данные о содержании антитоксических антител получают при постановке реакции нейтрализации токсина антителами. Она может быть поставлена на животных (этот метод используется в настоящее время для стандартизации диагностических и лечебных антитоксических сывороток, но он малопригоден для испытания сывороток, полученных от человека) или в культуре прививаемых клеток. К дифтерийному токсину чувствительны многие культуры клеток: Vero — культура клеток обезьян, СНО — культура клеток яичников хомяка и др. Клетки выращивают в специальных средах в планшетах, наблюдают за их состоянием и ростом под микроскопом. Оказалось, что под действием токсина они умирают, и степень поражения пласта клеток зависит от количества внесенного токсина. Оценить действие токсина можно под микроскопом визуально или используя специальные красители, окрашивающие только живые клетки, и судить по интенсивности окраски: интенсивность окраски убывает при увеличении дозы токсина, то есть при увеличении его повреждающего действия. Если в пробе содержится достаточно много защитных антитоксических антител, то клетки оказываются полностью защищенными и не умирают, так как антитела полностью блокируют, нейтрализуют токсин. При меньших дозах антител возможно частичное разрушение пласта клеток. При использовании серии разведений сыворотки можно найти то разведение, которое и обеспечивает полную защиту, то есть титр токсин-нейтрализующих антител.
И зарубежный, и наш опыт показал, что преимущества способа использования культур клеток для определения активности токсина и для постановки реакции нейтрализации в том, что он более прост, стандартен и позволяет давать более точную количественную оценку. Однако и этот метод имеет существенный недостаток, так как может быть использован только в специальных лабораториях, имеющих соответствующее оборудование для работы с живыми клетками. Вот почему возник вопрос о разработке такого метода оценки, который был бы доступен большинству практических лабораторий. Такой метод был разработан в нашей лаборатории. В лаборатории получены моноклональные антитела к той части дифтерийного токсина, который определяет его связь с клеткой. Полистироловый планшет, покрытый такими антителами (они прочно связаны с поверхностью лунок), будет так же связывать токсин из испытуемой пробы, как и клетка. Поэтому можно измерить количество связывающегося токсина, как при простом титровании токсина, так и при постановке реакции нейтрализации. В этих случаях количество связавшегося токсина определяется с помощью реактивов, дающих цветную реакцию, и может быть измерено.
Для оценки эффективности вакцинации и для прогнозирования течения болезни очень важно исследовать напряженность иммунитета. По данным ВОЗ, разное содержание антитоксических антител обеспечивает разный уровень защищенности человека: меньше 0,01 ME/ мл — человек восприимчив к дифтерии; 0,01 МЕ/мл — минимальная степень защищенности; 0,01-0,09 МЕ/мл — некоторая степень защиты; 0,1 МЕ/мл — защитный уровень антител; более 1,0 МЕ/мл — стойкая, длительная невосприимчивость к дифтерии.
В сравнительных исследованиях при постановке реакции нейтрализации в культуре клеток или при постановке ИФА с использованием моноклональных антител к токсину нами было показано, что имеется полная корреляция находимых уровней антител в обоих случаях. Этот метод прост, доступен любой лаборатории, точен и позволяет быстро (за 5-6 часов) получить результат.
Нина ТИТОВА, ведущий научный сотрудник лаборатории клеточных гибридов НИИ вакцин и сывороток им. И.И. Мечникова РАМН
источник
Изобретение относится к области медицины, точнее клинической иммунологии бактериальной инфекции, и предназначено для ранней диагностики дифтерии у детей и иммунологического мониторинга в процессе лечения. Способ состоит в том, что дифтерийный токсин определяют в составе циркулирующих иммунных комплексов, затем образцы, диссоциированные нагреванием, наносят на тест-систему с моноклональными антителами к СООН-концевому участку молекулы токсина и при уровне токсина 0,45 Lf/мл и выше диагносцируется дифтерия. Способ обладает высокой специфичностью и чувствительностью. 3 табл., 1 ил.
Данное изобретение относится к области медицины, точнее к клинической иммунологии бактериальных инфекций и предназначено для ранней диагностики дифтерии у детей и иммунологического мониторинга в процессе лечения и может быть использовано в клинической практике.
Значительное ухудшение в 90-е годы эпидемической обстановки заболеваемости дифтерией, увеличение частоты тяжелых токсических форм, приводящих нередко к неблагоприятным исходам, а также регистрация случаев атипичного течения локализованных форм дифтерии среди привитых детей, диктует необходимость совершенствования методов лабораторной диагностики этой инфекции, поиска более информативных методических подходов, создания чувствительных и специфических диагностических препаратов.
Важное значение в этом аспекте приобретает определение дифтерийного токсина /ДТ/, как основного поражающего фактора при дифтерии, в биосубстратах от больных. Известен способ выявления ДТ методом иммуноферментного анализа /ИФА/, для постановки которого применяется набор ингредиентов концерна «Иммуноген», НПО «Биомед», иммуноферментная тест-система для выявления антигенов ДТ /Майкоп/. /Цыганова И.В., Паранук З.Ш., Хшитова Н.С. и др., Клинич. лаб. диагностика N 1 1995, с. 31 — 33/. Учет результатов иммуноферментной реакции проводится визуально. Авторами предложенного метода ДТ определялся в бульонных культурах, получаемых после посева материала из зева и носа больных на среду /кровяно-теллуритовый агар/, а также на содержание ДТ исследовались сыворотки крови больных дифтерией. В результате, из 773 подозрительных на дифтерию бульонных культур только 70 дали положительные результаты ИФА, а из 25 сывороток крови — 5. Это позволяет судить о низкой чувствительности метода и ограниченности его использования для диагностических целей. К тому же, метод требует специального оборудования и больших затрат времени для проведения подготовительных мероприятий перед постановкой ИФА /посев на среду материалов из зева и носа — 24 — 28 часов, отсев на бульон Мартена и выращивание в течение 18 — 20 часов/. Результат лабораторного обследования больных этим методом можно получить только на 3 день после забора материала, что значительно замедляет процесс диагностики дифтерии и не позволяет использовать названный выше метод для экспресс-диагностики этой инфекции.
Для ускорения процедуры лабораторного подтверждения дифтерии определение ДТ проводят в сыворотках крови больных методом ИФА с использованием тест-системы производства НИИ вакцин и сывороток г. Пермь на основе F(ab)2-фрагментов чистых противодифтерийных антител /Шабалина С.В., Райхер И.И., Райхер Л.И. и др., ЖМЭИ N 8 1987, с. 82 — 85; Никитюк Н.М., Смурова Л. Ю., Шабухова Т.С. и др., ЖМЭИ N 9 1990, с. 67 — 69/. Положительным контролем в иммуноферментной реакции служит ряд разведений очищенного дифтерийного анатоксина. Учет результатов происходит визуально по появлению в лунках коричневого окрашивания различной интенсивности. Исследование сывороток крови 52 больных с различными клиническими формами дифтерии при помощью вышеназванного метода показало, что частота обнаружения ДТ составила 100% только при субтоксических и токсических формах. При локализованных формах ДТ обнаруживается только в 41,3% случаев. В контрольной группе здоровых детей ДТ не выявлялся ни в одном случае, что подчеркивает специфичность используемого метода с одной стороны, но и его недостаточную чувствительность — с другой. Своевременная дифференциальная диагностика локализованных форм дифтерии, как наиболее часто встречающихся среди привитых детей, заболевших дифтерией, основанная только на особенностях клинических проявлений дифтерийной интоксикации, весьма затруднена и требует быстрого лабораторного подтверждения. Это не позволяет достигнуть использование вышеуказанного диагностического теста. В настоящее время, также, остается дискутабельным вопрос циркуляции свободного ДТ в кровяном русле, что заставляет усомниться в информативности данных, получаемых при исследовании сывороток крови на содержание в них свободного ДТ. Поэтому отсутствие или наличие ДТ в сыворотке крови, отмечаемое данным методом, еще не позволяет сделать окончательный вывод о состоянии токсинемии организма больного. К тому же, авторы вышеназванного иммуноферментного набора не исключают возможность наличия ложноположительных реакций за счет присутствия противовидовых иммуноглобулинов в сыворотке крови. Кроме того, во фракции ИГG даже у гипериммунного организма антител определенной специфичности содержится не более 20% /Райхер И.И., 1973/. Таким образом этот способ не отвечает современным представлениям о патогенезе дифтерии и не позволяет провести дифференциальную диагностику локализованных форм дифтерии в 100% случаев, что может отразиться на своевременности проводимых терапевтических мероприятий по специфической детоксикации организма.
Устранить недостатки, характерные для указанных выше диагностических тестов, позволит предлагаемый авторами настоящего изобретения метод количественного определения ДТ в составе циркулирующих иммунных комплексов с помощью иммуноферментного анализа. Проблеме излучения циркулирующих иммунных комплексов /ЦИК/ в современной клинической иммунологии уделяется большое внимание. Определение составляющих компонентов ЦИК — антигена или антитела — является весьма перспективным направлением в дифференциальной диагностике инфекционных заболеваний. Синтез специфических антител против антигенов возбудителя или факторов его патогенности — токсинов, формирование иммунных комплексов является обязательным компонентом нормального иммунного ответа, что приводит к снижению циркулирующих антигенов и может существенно искажать данные традиционных методов исследования, в частности и вышеназванных методов.
Авторами впервые сконструирован диагносический тест, основанный на известных методических приемах, позволяющий определить количественный уровень ДТ в составе ЦИК из сыворотки крови детей, больных разными формами дифтерии ротоглотки, что значительно улучшит не только диагностику дифтерии, но и иммунологический мониторинг в процессе лечения.
В основу предлагаемого способа экспресс-диагностики дифтерии положен следующий принцип обнаружения составляющих компонентов специфических ЦИК: 1. Осаждение ЦИК из сывороток крови больных с помощью ПЭГ 6000; 2. Разрушение /диссоциация/ иммунных комплексов нагреванием на водной бане; 3. Определение антигенов возбудителя с использованием высокоспецифичных диагностикумов. Для работы авторами изобретения использовалась тест-система «Дифтерия-монозим», производства НИИ вакцин и сывороток им. И.И.Мечникова /Москва/, предназначенная для иммуноферментного определения ДТ при помощи моноклональных антител с COOH-концевому участку молекулы токсина.
Разработанный авторами способ диагностики разных форм дифтерии осуществляется следующим образом: из свежей сыворотки крови больного проводят осаждение ЦИК по Digeon с использованием 3,5% ПЭГ 6000 /»Serva»/. Для этого к 0,1 мл исследуемой сыворотки добавляют 4,9 мл охлажденного 3,5% раствора ПЭГ, приготовленного на боратном буфере pH 8,5 — 8,7. Смесь инкубируют при t 4 o C в течение 16 — 18 часов, затем центрифугируют при 5000 об/мин в течение 30 мин. Надосадочную жидкость сливают, а ПЭГ-преципитат растворяют в 0,3 мл Na-фосфатного буфера pH 7,4 
При постановке опыта проводят контроль специфичности сорбции конъюгата и контроль субстрата. В специальном опыте авторы проводили параллельное тестирование ДТ в необработанных нагреванием образцах. Результаты представлены в таблице 1. Как видно из таблицы, в шести опытах из восьми ДТ в составе ЦИК без диссоциации последних не выявлялся, в двух других опытах ДТ выявляется в меньших количествах, чем в образцах, обработанных нагреванием.
Таким образом, процесс определения ДТ в составе ЦИК предлагаемым методом с момента забора крови до последнего этапа ИФА занимает в целом 24 часа.
Предлагаемым методом авторами было обследовано 273 образца сыворотки крови детей, больных различными формами дифтерии ротоглотки: локализованной — 20, распространенной — 7, субтоксической и токсической — 19 человек, группу носителей токсигенных коринебактерий дифтерии /ТКД/ составляли 24 ребенка. В контрольную группу вошли здоровые дети /4 чел./, больные лакунарной ангиной /4 чел. / и вирусным энцефалитом /4 чел./. Уровень ДТ определяли в разных этапах инфекционного процесса: до лечения антитоксической противодифтерийной сывороткой /АПДС/ — 1 — 6 день болезни — и после лечения с недельными интервалами.
При исследовании сывороток крови детей контрольной группы ни в одном случае не был выявлен ДТ, что подтверждает специфичность используемого метода. Результаты исследований сывороток крови детей с разными формами дифтерии представлены в таблице 2. Как видно из таблицы 2, уровень ДТ при разных клинических формах дифтерии варьирует в довольно широком диапазоне концентраций: от 0,45 до 22,3 Lf/мл. В острую фазу инфекционного процесса /1 — 6 сутки болезни/ у 52% детей с локализованными формами дифтерии концентрация ДТ составляет в среднем 1,07 



Таким образом, применение предлагаемого метода количественного определения ДТ в составе ЦИК в клинической практике позволяет, с одной стороны, провести экспресс-диагностику дифтерии в течение 24 часов, а с другой стороны, прогнозировать тяжесть течения дифтерии и оценивать эффективность проводимых терапевтических мероприятий. Преимущество этого метода перед упомянутыми выше аналогами состоит в том, что за счет выявления ДТ в составе специфических ЦИК увеличивается чувствительность способа диагностики дифтерии как такового и, следовательно, значительно возрастает достоверность получаемых результатов при использовании сывороток крови больных на содержание ДТ.
Способ диагностики дифтерии у детей путем выявления дифтерийного токсина, отличающийся тем, что дифтерийный токсин определяют в составе циркулирующих иммунных комплексов, проводят их диссоциацию нагреванием и полученные образцы затем наносят на тест-систему с моноклональными антителами к СООН-концевому участку молекулы токсина и при уровне токсина 0,45 Lf /мл и выше диагностируется дифтерия.
источник
Род Corynebarteriurn (от лат. Сoryne — булава) – Гр+ палочковидные бактерии, длиной 1–8 мкм и шириной 0,3–0,8 мкм, не образующие спор, не имеющие жгутиков. Содержат зерна волютина, расположенные чаще всего на концах палочек, они часто превышают размеры поперечника бактерии и придают вид булавы. Также имеются включения липидов и крахмала, который откладывается при недостатке кислорода.
В состав клеточной стенки входят специфические только для бактерий рода Corynebacterium липиды: эфиры коринемиколовой и коринемиколиновой кислот, димикола, фосфатиды маннозы и инозита.
В организме человека обитают условно-патогенные: С.diphtheriae, С.pseudodiphtheriticiim (hofmanii), С.xerosis, С.ulcerans. С.diphtheriae вызывает у человека дифтерию, другие являются возбудителями вторичных инфекций.
КОРИНЕБАКТЕРИЙ ДИФТЕРИИ С.diphtheriae.
Морфология. Прямые или слегка изогнутые палочки. В препаратах располагаются под углом друг к другу в виде букв L, V или китайских иероглифов. Зерна волютина (на концах палочек) выявляются при окраске синькой Леффлера или по методу Нейссера. Факультативные анаэробы, хорошо размножаются при свободном доступе кислорода. К питательным средам требовательны: не способны утилизировать азот из аммонийных соединений, требуют наличия почти всех АК, солей Mg, Zn, Cu, Fe; необходимы углеводы Þ используются среды, полученные на основе ферментативного расщепления белка (казеина, дрожжей) с добавлением крови или сыворотки. На поверхностях плотных сред дифтерийные палочки образуют темно-серые или черные колонии (биовары гравис, способны расщеплять крахмал, или миттис). Рост на скошенном сывороточном агаре сравнивают с шагреневой кожей, колонии не сливаются.
Расщепляют глюкозу и другие моно- и дисахариды с образованием кислоты без газа, восстанавливают нитраты, расщепляют цистеин.
Лизируются специфичны для отдельных видов вирулентными фагами, что позволяет устанавливать фаговары исследуемых культур.
АГ. Имеют белковую капсулу, которая содержит К-АГ. Определение этого АГа позволяет установить серовар (их более 10). Группоспецифический полисахарид АГ клеточной стенки дает перекрестные реакции с микобактериями, нокардиями.
Экология и распространение. Передается аэрозольным (воздушно-капельным) путем. В настоящее время часто регистрируется у взрослых (тяжелая формы). Токсигенность связана лизогенизацией специфическим профагом. Выделяясь в окружающую среду со слюной, пленками, дифтерийные палочки сохраняют жизнеспособность в течение нескольких дней. Хорошо переносят высыхание. Чувствительны к дезинфицирующим растворам, антибиоткам.
Патогенность и патогенез. Заболевание развивается у лиц, не имеющих антитоксического иммунитета. На месте внедрения (зев, гортань, трахея, реже – нос, ухо) развивается местный воспалительный процесс. Все патогенные виды обладают фимбриями Þ АДГЕЗИЯ к клеткам хозяина, они выявляются в РА трипсинизированных бараньих эритроцитов.
Токсигенность – способность секретировать гистотоксин, что проявляется в виде локальной воспалительной реакции и в общей интоксикации организма, особенно чувствительны к нему надпочечники, миокард, НС. Токсин блокирует синтез белка, что приводит к гибели клеток, возникает некроз и летальный исход.
Ферменты (гиалуронидаза, нейраминидаза,фибринолизин) обеспечивают распространение в тканях, но бактериемия клинически не проявляется.
Корд-фактор нарушает фосфорилирование и дыхание клеток микроорганизмов.
Иммунитет. Наиболее восприимчивы дети 1–4 лет. Вырабатывается не очень прочный антитоксический иммунитет, возможны повторные заболевания дифтерией. Невосприимчивость зависит главным образом от содержания в крови антитоксина и АТ (опсонины, преципитины, комплементсвязывающие). Уровень антитоксического иммунитета устанавливают, определяя в крови антитела в РНГА с эритроцитарным диагностикумом (эритроциты нагружены дифтерийным анатоксином). Титр 1:20 и выше Þ иммунность обследуемого. Такжеже применяется реакция Шика (внутрикожно вводят дифтерийный токсин, у неимунных людей – местная воспалительная реакция, при наличии антитоксина реакции нет).
Лабораторная диагностика. В диагностике дифтерии важное значение имеет микроскопический метод. Мазки из налетов зева и носа окрашивают метиленовым синим, по Нейссеру и Граму. Одновременно материал засевают на элективную и дифференциально–диагностическую среды. Выделив культуру, ее идентифицируют по культурально–биохимическим признакам. Затем определяют токсигенность, испытывая культуру на морских свинках или в реакции преципитации на пластинчатом фосфатно–пептонном агаре, подсевая ее бляшками к расположенной вдоль чашки полоске фильтровальной бумаги, смоченной антидифтерийной сывороткой.
Токсигенные штаммы коринебактерии дифтерии при внутрикожном введении вызывают местный некроз, а при подкожном – гибель животных с экссудацией в серозные полости и резкое увеличение надпочечников. Положительная реакция преципитации в агаре проявляется образованием на границе взаимодействия антитоксина и продуцируемого экзотоксина равномерно сливающихся полос преципитации или «стрел–усиков».
Экспресс–диагностика. Если прямой микроскопией мазков, окрашенных обычными способами, выявить коринебактерии дифтерии в материале не удается, то его берут тампоном со свернутой сывороткой (метод Фольгера). Тампон помещают в термостат для подращивания культуры и через 3–5 ч им делают мазки.
Профилактика и лечение. Для профилактики дифтерии используют адсорбированную коклюшно–дифтерийно–столбнячную вакцину (АКДС), содержащую в 1 мл 20 млрд микробных тел палочек коклюша, 30 АЕ (антигенные единицы) дифтерийного анатоксина, 10 АЕ столбнячного анатоксина. Вакцинацию начинают с 5–6–месячного возраста. Курс иммунизации состоит из трех внутримышечных инъекций по 0,5 мл препарата с интервалом 30–40 дней. Ревакцинацию проводят в 3 года, 6 и 11 лет. По эпидемическим показаниям вакцинируют все население, даже людей старше 50 лет.
Специфическое лечение проводится лошадиной антитоксической иммунной сывороткой, которую вводят дробно по методу Безредки в зависимости от тяжести заболевания в количестве от 10 000 до 250 000 АЕ Антибиотики и сульфаниламиды сокращают сроки бактериовыделения у реконвалесцентов и санируют организм здоровых бактерионосителей. Для этих целей назначают пенициллины, тетрациклины, эритромицин.
источник
Дифтерию вызывают токсигенные штаммы Corynebacterium diphtheriae или палочки Леффлера, не токсигенные штаммы заболевания не вызывают. Дифтерийный токсин по своим свойствам относится к сильнодействующим ядам, уступая лишь ботулитическому и столбнячному. Под воздействием токсина нарушается синтез белков во внутренних органах больного, что приводит к структурным и функциональным нарушениям, демиелинизация нервных волокон – к параличам и парезам. Способность к токсинообразованию проявляют лишь лизогенные штаммы C.diphtheriae, инфицированные бактериофагом (р-фаг), несущим ген tox, кодирующий структуру токсина дифтерии. Передача бактериофагом гена tox нетоксигенным штаммам C.diphtheriae, обитающим в носоглотке и накопление их в популяции, может сопровождаться развитием вспышки дифтерии.
Наиболее таксономически близкими к виду C.diphtheriae являются C.ulcerans и C.рseudotuberculosis, природные патогены крупного и мелкого рогатого скота, лошадей. Кроме того, на слизистой ротоглотки и носа часто встречается палочка Гофмана (C.pseudodiphtheriticum), не обладающая патогенностью и токсигенностью для человека. Поэтому основной задачей лабораторной диагностики дифтерии является выявление токсигенных штаммов дифтерии и дифференцировка возбудителя дифтерии от других коринебактерий, нормальных обитателей носо- и ротоглотки. Все микроорганизмы рода Corynebacterium – грамположительные полиморфные палочки, не образующие спор, хорошо растущие в аэробных условиях при 37°С. При окраске метиленовым синим в клетках C.diphtheriae отмечается внутриклеточная исчерченность, что объясняется наличием зерен волютина. Окраска по Граму не используется из-за вариабельности окрашивания клеток. По форме колоний и некоторым биохимическим свойствам C.diphtheriae подразделяются на культурально-биохимические варианты – gravis, mitis, intermedius, однако все они обладают способностью вырабатывать дифтерийный токсин. Тяжесть течения заболевания не связана с биохимическим вариантом C.diphtheriae. Токсигенные штаммы дифтерии более чувствительны к антибиотикам, чем не токсигенные.
- Профилактическое обследование – выявление источников инфекции, группы населения с повышенным риском заболевания; наблюдение за циркуляцией токсигенных штаммов в популяции; лица, поступающие в детские дома, школы интернаты, специализированные учреждения для детей и взрослых;
- обследования по эпидемическим показаниям – лица с подтвержденным контактом с больным дифтерией или при эпидемии дифтерии в данной местности;
- диагностические исследования – при подозрении на заболевание дифтерией (тонзиллит, назофарингит или ларингит который протекает с налетами псевдомембранозного характера).
Дифференциальная диагностика. Заболевания, сопровождающиеся тонзиллитом (инфекционный мононуклеоз, ангины стрептококковой, стафилококковой этиологии и др.).
При культуральных исследованиях возбудитель C.diphtheriae дифференцируется от других коринебактерий, в первую очередь C.pseudodiphtheriticum, C.ulcerans, C.pseudotuberculosis.
Материал для исследований
- Мазок из ротоглотки и носа, при подозрении на дифтерию редких локализаций (глаз, рана, ухо и т.д.) – материал с пораженных участков, а также с миндалин и носа – культуральные исследования, обнаружение специфического фрагмента гена tox;
- сыворотка крови – выявление АТ.
Этиологическая лабораторная диагностика включает посев клинического материала с изучением токсигенных свойств на среде для определения токсигенности и биохимической идентификацией возбудителя, обнаружение АГ (дифтерийного токсина), выявление специфических АТ к дифтерийному токсину, обнаружение специфического фрагмента гена tox.
Сравнительная характеристика методов лабораторной диагностики и особенности интерпретации их результатов. Микроскопические исследования выполняют только для идентификации выделенной культуры. Микроскопия биологического материала не проводится.
Для посева используют материал соответствующих локализаций. Изучение токсигенных свойств на среде для определения токсигенности выполняют при использовании метода встречной иммунодиффузии токсина и антитоксических АТ в плотной питательной среде. При отсутствии линий преципитации на среде для определения токсигенности через 48 ч инкубации культура признается не токсигенной. Для биохимической идентификации используется тест с цистиназой (среда Пизу), определение уреазной и сахаролитической (сахароза, глюкоза, крахмал) активности.
- при обнаружении специфических линий преципитации на среде для определения токсигенности через 24–48 ч, положительной пробе на цистиназу, отрицательной пробе на уреазу, характерных культуральных и биохимических свойств дается заключение о выделении токсигенного штамма C.diphtheriae принадлежащего к культурально-биохимическому варианту gravis, mitis;
- при отсутствии специфических линий преципитации на среде для определения токсигенности через 48 ч, положительной пробе на цистиназу, отрицательной пробе на уреазу, характерных культуральных и биохимических свойств дается заключение о выделении не токсигенного штамма C.diphtheriae принадлежащего к соответствующему культурально-биохимическому варианту;
- при наличии линий преципитации на среде для определения токсигенности, идентичных линиям контрольного штамма дифтерии, положительных проб на цистиназу, уреазу, ферментации глюкозы и крахмала, отсутствие ферментации сахарозы, отсутствие редукции нитратов в нитриты, культуру относят к виду C.ulcerans, токсигенный вариант;
- при выделении дифтероидов ответ выдается отрицательный.
При посеве возбудитель C.diphtheriae дифференцируется от других коринебактерий, в первую очередь C.pseudodiphtheriticum, C.ulcerans, C.pseudotuberculosis. Для выявления дифтерийного токсина используют методы РНГА или ИФА. Это исследование не является обязательным в практических бактериологических лабораториях, однако может использоваться как дополнительное для выдачи предварительного ответа. Метод также позволяет определить относительное (условное) количественное содержание токсина в исследуемой пробе.
Для выявления специфических АТ используют методы РПГА и РНГА. Метод РПГА используется для изучения напряженности противодифтерийного иммунитета. Условно-защитным титром АТ принят титр 1:20.
У больных определение титра АТ к АГ дифтерийной палочки в сыворотке крови методом РНГА проводится в двух пробах крови, собранных в начале заболевания и через 7–10 дней. Нарастание титра АТ в 3–4 раза во второй сыворотке относительно первой свидетельствует о перенесенной инфекции. Исследование используется преимущественно для ретроспективной диагностики дифтерии.
Обнаружение гена токсигенности (tox) методом ПЦР – наиболее быстрый и надежный метод лабораторной диагностики, однако он не дает информацию о способности микроорганизма к экспрессии дифтерийного токсина. Описаны случаи нетоксигенных штаммов дифтерии, несущих в себе
Продолжая использовать наш сайт, вы даете согласие на обработку файлов cookie, пользовательских данных (сведения о местоположении; тип и версия ОС; тип и версия Браузера; тип устройства и разрешение его экрана; источник откуда пришел на сайт пользователь; с какого сайта или по какой рекламе; язык ОС и Браузера; какие страницы открывает и на какие кнопки нажимает пользователь; ip-адрес) в целях функционирования сайта, проведения ретаргетинга и проведения статистических исследований и обзоров. Если вы не хотите, чтобы ваши данные обрабатывались, покиньте сайт.
Copyright ФБУН Центральный НИИ Эпидемиологии Роспотребнадзора, 1998 — 2019
Центральный офис: 111123, Россия, Москва, ул. Новогиреевская, д.3а, метро «Шоссе Энтузиастов», «Перово»
+7 (495) 788-000-1, info@cmd-online.ru
! Продолжая использовать наш сайт, вы даете согласие на обработку файлов cookie, пользовательских данных (сведения о местоположении; тип и версия ОС; тип и версия Браузера; тип устройства и разрешение его экрана; источник откуда пришел на сайт пользователь; с какого сайта или по какой рекламе; язык ОС и Браузера; какие страницы открывает и на какие кнопки нажимает пользователь; ip-адрес) в целях функционирования сайта, проведения ретаргетинга и проведения статистических исследований и обзоров. Если вы не хотите, чтобы ваши данные обрабатывались, покиньте сайт.
источник
Дифтерия — это острая инфекционная патология бактериальной этиологии, представленная фибринозной воспалительной реакцией и значительной интоксикацией. Возбудителем дифтерии являются грамположительные палочки вида коринебактерий. Они продуцируют экзотоксин, обладающий токсигенными и нетоксигенными свойствами. Контагиозность составляет 10-15%.
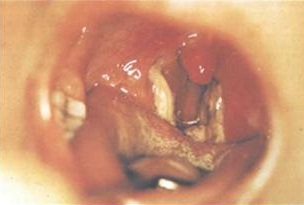
Дифтерийные бактерии внедряются в слизистые ротоглотки, носа, дыхательных путей, реже глаз и гениталий, где происходит их размножение. При репродукции бактерий происходит выделение экзотоксина и других факторов патогенности (некротоксина, гемолизина, гиалуронидазы, нейроминидазы), что приводит к коагуляционному некрозу клеток с формированием очага воспаления. В результате некроза освобождается тромбокиназа, которая превращает фибриноген воспалительного экссудата в фибрин. В области воспаления фибрин вместе со слущенным эпителием формируют фибринозную пленку — типичный признак дифтерии.
Параллельно коринебактерии внедряются и в лимфатическую систему, вызывая в лимфоузлах фибринозное воспаление и некроз, обуславливая токсикоз и изменения во всех внутренних органах, центральной и периферической нервной системе.
При локализованной форме процесс начинается с лихорадки и неинтенсивной боли в горле. Патогномонична изолированная патология миндалин, которые умеренно гиперемированы и покрыты фибринозной пленкой в виде с трудом снимающегося беловато-сероватого налета, похожего на островки (островчатая форма), либо пленок. Течение заболевания доброкачественное без осложнений. Местные проявления проходят при лечении через неделю после начала болезни.
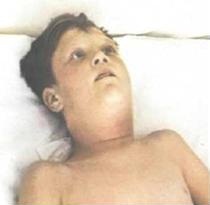
При распространенной форме температура выше и интоксикация выражена в большей степени. Фибринозные налеты занимают кроме миндалин небные дужки, язычок и заднюю стенку глотки. Одновременно наблюдается умеренная лимфаденопатия. Исход заболевания благоприятный без осложнений. Под влиянием терапии реконвалесценция происходит через месяц. У непривитых детей развивается токсическая форма, характеризующаяся тяжелым токсикозом, вплоть до инфекционно-токсического шока. Воспалительный процесс распространен в ротоглотке с отеком подкожной клетчатки шеи. Отмечается повышение температуры до 40 °С с сильной головной болью, рвотой, ознобом, бледностью, одышкой и тахикардией, появляется интенсивная боль в горле. Миндалины увеличены, на них формируется фибринозная пленка, которая в дальнейшем быстро переходит на небные дужки, язычок, твердое и мягкое небо, боковые и заднюю стенки глотки. Одновременно увеличиваются и уплотняются подчелюстные и шейные лимфоузлы, в месте локализации которых развивается воспалительный отек шеи. При гипертоксической форме развивается тяжелейшая интоксикация, гипертермия, потеря сознания, судороги. Токсическая и гипертоксическая формы дифтерии опасны своими осложнениями: миокадитом, параличом мягкого неба, птозом век, косоглазием, нефротическим синдромом.
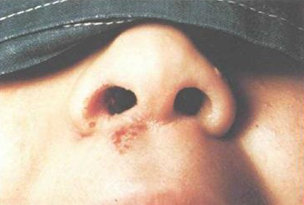
Диагноз устанавливается с учетом патогномоничной клиники дифтерии и данных лабораторного исследования, ведущим из которых является бактериологический высев возбудителя из носовой полости и миндалин. Специфические антитела определяют с серологическими методиками РА, РПГА, ИФА.
Обязательным является своевременное введение антитоксической противодифтерийной сыворотки, доза и продолжительность курса которой в каждом случае определяется индивидуально. При тяжелых формах заболевания дополнительно назначаются антибиотики (цефалоспорины 2-го и 3-го поколения). Для уменьшения признаков интоксикации применяется инфузионная терапия глюкозо-солевыми растворами. В случае токсической формы применяются «Преднизолон», «Гепарин», сосудистые, метаболические и бронхоспазмолитические препараты. Важным условием терапии является строгое соблюдение постельного режима.
Имеются противопоказания. Необходима консультация специалиста.
- Противодифтерийная сыворотка (ПДС). Режим дозирования: при легкой форме вводится однократно в/м в дозе 20–40 тыс. МЕ, при среднетяжелой форме — 50–80 тыс. МЕ однократно или повторно в той же дозе через 24 часа. При тяжелой форме заболевания суммарная доза увеличивается до 90–120–150 тыс. МЕ, при этом 2/3 дозы вводится сразу, а в течение первых суток госпитализации должно быть введено 3/4 суммарной дозы.
- Преднизолон (противовоспалительное средство). Режим дозирования: в/в или в/м в дозе 2-3 мг/кг/сут. в первые 2–3 дня. С 4-го дня переходят на прием внутрь. Курс лечения 5–6 дней. При гипертоксической и геморрагической формах доза увеличивается до 5–10 мг/кг/сут.
- Цефтриаксон (антибактериальное средство). Режим дозирования: в/м, в/в взрослые и для дети старше 12 лет в суточной дозе 1–2 г 1 раз/сут. или 0,5–1 г каждые 12 ч.
Рекомендуется консультация инфекциониста.
| • | Ведущие специалисты и учреждения по лечению данного заболевания в России: |
| з.о. д.м.н. Артюшкин С.А., Покровская больница, Санкт-Петербург; з.о. Астащенко С.В., Санкт-Петербургский НИИ уха, горла, носа и речи. | |
| • | Ведущие специалисты и учреждения по лечению данного заболевания в мире: |
| ICHILOV MEDICAL CENTER, Тель-Авив. |
| Мужчины | Женщины | |||||||||||||
| Возраст, лет | 0-1 | 1-3 | 3-14 | 14-25 | 25-40 | 40-60 | 60 + | 0-1 | 1-3 | 3-14 | 14-25 | 25-40 | 40-60 | 60 + |
| Кол-во заболевших | 0.1 | 0.6 | 0.003 | 0.003 | 0.001 | 0.001 | 0.1 | 0.6 | 0.003 | 0.003 | 0.001 | 0.001 | ||
При дифтерии отмечается относительный лимфоцитоз (Lymph) (более 35%).
источник
Для диагностики дифтерии разработаны различные методы: бактериологический, биологический, иммунохимический (РПГА, ИФА, РКоА, РЛА), также проводятся молекулярно-биологические исследования (ПЦР, риботипирование, энзимотипирование, секвенирование ДНК).
Крайне важны правильное взятие и своевременная доставка материала, а также четкий учет результатов.
Современная лабораторная диагностика дифтерийной инфекции имеет большое значение для установления диагноза, принятия решения о проведении специфической терапии, оценки и прогнозирования эпидемиологической ситуации.
Бактериологический или культуральный метод является основным и используется с диагностической, профилактической и эпидемиологической целями.
Проведение бактериологического исследования на обнаружение возбудителя дифтерии регламентировано и осуществляется в соответствии с методическими указаниями «Лабораторная диагностика дифтерийной инфекции».
Результаты бактериологического исследования в значительной степени зависят от своевременного и правильного забора материала, качества питательных сред, четкого и профессионального выполнения.
С диагностической целью в стационаре обследуют больных с острыми воспалительными заболеваниями в ротоглотке и дыхательных путях при подозрении на дифтерию ежедневно в течение 3 дней; при амбулаторном обследовании — больных ангинами, имеющих патологические выпоты на миндалинах, больных с подозрением на паратонзиллит, заглоточный абсцесс, стенозирующий ларинготрахеит, инфекционный мононуклеоз. Материал берут однократно.
По эпидемиологическим показаниям обследуются лица, бывшие в контакте с источником инфекции. Забор материала у них проводится однократно.
С профилактической целью обследуют лиц, поступающих в детские дома, специальные учреждения для детей с поражением ЦНС, санатории для детей с туберкулезной интоксикацией, в психоневрологические стационары — однократно.
Бактериологическое обследование бактерионосителей токсигенных штаммов С. diphtheriae проводят двукратно.
В период реконвалесценции после завершения антибактериальной терапии обследование проводят через 3 дня после окончания лечения, дважды с интервалом в одни сутки.
Материалом для исследования служат слизь, отделяемое и пленки из ротоглотки и носа. При наличии налета взятие материал производится с границы пораженной и здоровой ткани.
При подозрении на экстрабуккальные формы дифтерии проводят забор из очагов поражения (глаз, ухо, кожа, влагалище и др.), также следует брать материал из носа и зева. От больных материал должен быть взят в течение 3-4 ч (не позднее 12 ч) с момента поступления в стационар до назначения антибактериальной терапии.
При обследовании здоровых лиц на дифтерийное бактерионосительство исследуют слизь из зева (миндалины, дужки) и носа (нижние носовые ходы).
Для взятия проб используют стерильные ватные сухие тампоны. Исследуемый материал из каждого локуса забирают отдельным тампоном. Фибринозную пленку можно снять пинцетом.
Доставка материал в лабораторию осуществляется в течение 3 часов, в холодное время года, предохраняя от охлаждения.
При проведении обследования контингентов в отдаленных от бактериологических лабораторий районах, когда посев не может быть проведен в течение 3 ч, материал засевают у постели больного на транспортную полужидкую среду с теллуритом калия.
При использовании транспортной среды тампоны с материалом погружают в среду. Допускается инкубация посевов на транспортной среде до 18-20 ч, после чего делают высев на плотные питательные среды.
Культивирование материала на тампоне в транспортной среде, используемой в качестве среды обогащения, позволяет повысить показатель высеваеваемости коринебактерий дифтерии и применять иммунохимические методы для выявления токсина, использование которых сокращает сроки выдачи предварительного ответа.
С другой стороны, культивирование исследуемого материала на транспортной среде свыше 8 ч может способствовать размножению не только коринебактерий, но и сопутствующей микрофлоры, в частности S. aureus и S. epidermidis, соответственно более 90 и 10 % штаммов которых обладают теллуритредуктазой.
Для выделения возбудителя дифтерии проводят прямой посев материала, взятого сухим ватным тампоном или тампоном после культивирования в транспортной среде, на одну из элективноселективных сред для коринебактерий дифтерии.
В настоящее время предпочтение отдается кровяным теллуритовым средам. Все среды, используемые для первичного посева и последующей дифференциации выделенной культуры, подлежат предварительному контролю.
Через 24 часа инкубации на кровяных теллуритовых средах формируются колонии, окрашенные в черный или темно-серый цвет. Замедленное формирование подозрительных колоний (через 48 ч) в основном выявляется при исследовании материала, взятого у бактерионосителей.
Признаки, характерные для колоний биоваров gravis, mitis и intermedius, проявляются через 48 ч. Просмотр колоний осуществляют с помощью микроскопа бинокулярного стереоскопического (МБС).
В случае обнаружения подозрительных на коринебактерии дифтерии колоний их сразу же исследуют на токсигенные свойства. Необходимо изучать токсигенные свойства у нескольких колоний, т. к. из исследуемого материала могут быть выделены одновременно токсигенные и нетоксигенные клоны клеток коринебактерий дифтерии.
Для определения токсигенности используют тест Элека (традиционный или модификационный), основанный на методе встречной иммунодиффузии токсина и антитоксических антител (антитоксина) в специальных питательных средах (среда для определения токсина дифтерийного микроба или коринетоксагар) и являющийся одним из вариантов постановки реакции преципитации в геле.
При постановке теста Элека делают посев по 1\2 каждой из 2 изолированных колоний на среду для определения токсигенности и необожженной петлей — уколом в столбик среды Пизу; другую половину колонии отсевают в пробирку со скошенным 10% сывороточным агаром, из оставшихся нескольких 5-7 колоний формируют бляшки.
В случае множественного роста подозрительных колоний проводят определение уреазной активности в пробе Заксе. При обнаружении только одной колонии ее засевают на среду для определения токсигенности и, не обжигая петлю, в среду Пизу для определения цистиназы.
После учета результатов для дальнейшей идентификации используют культуру со среды Пизу или из бляшки.
У выросшей на сывороточном агаре культуры изучают морфологию, используя метод окраски по Леффлеру, биохимические свойства (глюкоза, сахароза, мальтоза, крахмал, декстрин), определяют уреазную активность.
При необходимости идентифицировать С. ulcerans используют тесты на уреазу и восстановление нитратов в нитриты.
Определение токсина является основным дифференциально-диагностическим тестом при бактериологическом исследовании на дифтерию.
Клиническое и эпидемиологическое значение токсигенных и нетоксигенных штаммов различно, поэтому чрезвычайно важно как можно быстрее получить точные данные о токсигенности штаммов, чтобы подтвердить диагноз дифтерии и воспрепятствовать распространению инфекции путем выявления бактерионосителей среди контактных лиц.
Критерием оценки специфичности преципитатов служит время появления и расположение линий преципитации испытуемого штамма по отношению к линиям преципитации контрольного токсигенного штамма. Специфические линии преципитации появляются через 24-48 ч, сливаются или направлены на слияние с линиями контрольного штамма.
Метод преципитации является высокоспецифичным, но его чувствительность составляет 0,5-1,0 мкг/мл по белку антигена. В связи с этим у штаммов коринебактерий дифтерии с низким уровнем продукции токсина специфические линии преципитации могут формироваться гораздо позже.
В практических лабораториях возможна гиподиагностика при определении токсигенности дифтерийных бактерий, что в основном обусловлено нестандартными питательными средами, повышенным содержанием железа в сыворотке, добавляемой в среду, недостаточными посевными дозами и малым содержанием антитоксина на бумажных носителях, а также другими отклонениями от методики постановки теста.
Одной из причин гиподиагностики при определении токсина методом иммунодиффузии является повышенное содержание железа в сыворотке лошади или крупного рогатого скота, которая является обязательным компонентом, добавляемым в среду для определения токсина дифтерийного микроба или коринетоксагар.
У токсигенных штаммов С. diphtheriae способность экспрессировать ДТ, а также интенсивность роста и размножения наблюдаются при малых концентрациях железа, что объясняется снижением потребности в источнике железа у токсиген-ных штаммов С. diphtheriae.
Экспрессия структурного tox-гена, носителем которого является профаг, находится под контролем хромосомного регуляторного гена dtxR. Ген dtxR является ответственным за синтез железо-зависимого белка-репрессо-ра dtxR.
В операторе гена tox имеется участок ДНК, с которым взаимодействует белок-репрессор, препятствуя транскрипции tox-мРНК и, следовательно, продукции дифтерийного токсина. При дефиците железа белок-репрессор инактивируется и начинается синтез токсина.
Неспецифические линии преципитации при определении токсина могут быть выявлены в основном при использовании лечебной антитоксической сыворотки или препаратов нестандартного антитоксина, содержащих антитела к клеточным антигенам С. diphtheriae.
Выявление цистиназной активности, способности окислять глюкозу и мальтозу, отношение к крахмалу, декстрину и отсутствие фермента уреазы наряду с характерными морфокультуральными признаками (полиморфизм, метахроматичное окрашивание, формирование колоний черного или серого цвета на кровяных теллуритовых средах) позволяют отнести выделенный микроорганизм к С. diphtheriae и одному из биоваров.
Выделенный в результате бактериологического исследования штамм C.diphtheriae является возбудителем дифтерии, если он обладает токсигенными свойствами.
Бактериологический метод диф-диагностики дифтерии позволяет в случае выделения токсигенного штамма, обладающего цистиназной активностью, дать окончательный документированный ответ через 48-72-96 часов, нетоксигенного штамма — через 72-96 часов.
Использование высококачественных питательных сред для первичного посева, определения токсигенности, биохимических свойств и микроскопа бинокулярного стереоскопического (МБС) для отбора колоний позволяет ускорить проведение бактериологического исследования и, соответственно, сократить сроки выдачи ответа до 48 часов.
Определение токсина у возбудителя дифтерии является основным дифференциальным тестом при диагностике дифтерии.
Для определения токсигенных свойств коринебактерий дифтерии разработаны и могут быть использованы разные методы, которые значительно различаются по специфичности, чувствительности и времени проведения исследования.
Основной метод определения токсина — иммунодиффузия в агаре — является высокоспецифичным, но позволяет выявлять ДТ только у 84,0 и 80,4 % штаммов, выделенных от больных и бактерионосителей соответственно.
Это связано с наличием у положительных в ПЦР и отрицательных в тесте Элека штаммов «молчащего» гена токсигенности. Роль таких штаммов в патологии пока неясна.
Биологические методы определения токсигенности, основанные на использовании 9-дневных куриных эмбрионов, перевиваемых культур клеток, пробах на вирулентность на морских свинках или кроликах, являются высокочувствительными, но трудоемкими и дорогостоящими.
Наиболее надежным тестом для определения токсина in vivo является подкожный тест на вирулентность на морских свинках.
При диагностике дифтерии комплексное микробиологическое исследование с использованием иммунохимических (РЛА, РКоА, РПГА, ИФА) методов позволяет значительно повысить эффективность лабораторной диагностики дифтерийной инфекции, ускорить обнаружение токсина.
Методы не являются обязательными при проведении диагностики дифтерии, но, по сравнению с традиционным (метод Элека), имеют преимущества по чувствительности и времени проведения анализа.
Современные варианты иммунохимического анализа, использование моноклональных антител к эпитопам дифтерийного токсина гарантируют и их высокую специфичность. Результаты, полученные этими методами, позволяют дать только предварительный ответ о наличии токсина.
Реакция пассивной гемагглютинации (РИГА) и иммуноферментный анализ (ИФА) могут быть использованы для выявления слаботоксигенных штаммов C.diphtheriae, определения уровня токсинопродукции, а также с целью сокращения сроков выявления ДТ.
Токсин обнаруживается в РИГА через 18 часов после посева культуры в жидкую питательную среду, содержащую сыворотку и теллурит калия, и через 3 ч при использовании бульона на основе сред 199 или «Игла» с 20 % сыворотки крупного рогатого скота.
Для проведения ИФА можно использовать культуру и непосредственно надосадок среды культивирования исходного клинического материала. Реакции являются высокочувствительными, и при их использовании токсин определяется в 98 % случаев.
Постановка РИГА основана на использовании эритроцитарного дифтерийного диагностикума, сенсибилизированного поликлональными антитоксическими антителами (антитоксином), способными взаимодействовать только с дифтерийным токсином.
При наличии в исследуемом образце токсина образуется специфический комплекс (ДТ—АТ), который выявляется в виде агглю-тината эритроцитов. Для постановки РПГА необходимо использовать стабильные стандартные диагностикумы, чувствительность которых не ниже 0,003 Lf/мл.
Метод позволяет определять относительное содержание токсина, умножая значение чувствительности диагностикума, выраженного в единицах Lf/мл, на обратное значение титра исследуемой пробы.
Для определения дифтерийного токсина методом ИФА разработан твердофазный вариант «сэндвич». В микробиологии тест-системы ИФА пдля диагностики дифтерии используют моноклональные антитоксические противодифтерийные антитела (МкАт) к концевому участку В-фрагмента дифтерийного токсина, адсорбированные на поверхности полистироловых планшет.
Адсорбированные на поверхности полистирола МкАт взаимодействуют с эпитопами В-фрагмента ДТ, если он присутствует в исследуемой пробе. К комплексу МкАт—ДТ добавляют конъюгат (К), представляющий собой поликлональные антитоксические антитела, конъюгированные с ферментом (пероксидаза хрена).
Свободные эпитопы ДТ взаимодействуют с поликлональными антитоксическими антителами, входящими в состав конъюгата, образуется комплекс МкАт—ДТ—К, который обнаруживают, добавляя смесь перекиси водорода с индикатором.
Результаты реакции учитывают визуально или с использованием спектрофотометра. Использование Fab-фрагментов МкАт гарантирует высокую чувствительность тест-системы. Метод позволяет определять токсин в концентрации 0,8-1,5 нг/мл или 0,0002 Lf/мл анатоксина и используется как в варианте «скрининг», так и для количественного определения ДТ.
Разработан метод определения ДТ на мембранах эпителиоцитов слизистой оболочки больных с помощью ИФА. С этой целью используют тест-систему «Дифтерия-монозим», в которую входят моноклональные антитела к СООН-концевой части В-фрагмента молекулы ДТ.
Данный метод позволяет выявить в течение 5-6 ч даже незначительное количество токсина, адсорбированного на мембранах клеток слизистой оболочки больных в 100 % случаев, провести раннюю дифференциальную диагностику дифтерии с клинически схожими заболеваниями.
РЛА и РКоА являются экспресс-методами обнаружения ДТ в культуральной жидкости.
Разработана аналитическая система для реализации экспресс-способа диагностики токсигенных штаммов, в которую входит дифтерийный латексный диагностикум и микроридер со сменными чипами.
Дифтерийный антительный диагностикум получен путем химической сорбции на поверхности полиакриламидных латексных частиц высокоавидных антитоксических антител с индексом авидности не менее 90 %.
Постановку РЛА осуществляют на чипах, результаты фиксируют в заданном или произвольном режиме в памяти компьютера в виде фотоизображений. Разработанный способ обладает высокой эффективностью, количественная оценка чувствительности метода составляет 0,001 Lf/мл.
В настоящее время большинство иммунохимических методов определения дифтерийного токсина могут применяться только в лабораториях научно-исследовательских учреждений, в которых они разработаны, т. к. соответствующих тест-систем производственного выпуска не существует.
Основным показателем напряженности противодифтерийного иммунитета является уровень дифтерийного антитоксина в сыворотке крови.
Для определения уровня антитоксина в сыворотке крови вакцинированных и больных используют иммунологические методы (РПГА, ИФА, методы Ремера и Йенсена, реакция нейтрализации токсина в клеточной культуре Vero).
Реакцию нейтрализации in vivo на морских свинках по Ремеру или на кроликах по Йенсену считают универсальными методами, или «золотым стандартом» определения антитоксических антител в сыворотке крови человека. Результаты реакции нейтрализации по Йенсену в 100 % случаев совпадают с результатами теста Элека.
Иммунологические методы могут быть полезными при необходимости дифференциации стертых и атипичных форм дифтерии и неспецифических ангин с сопутствующим носительством токсигенных штаммов.
Реакция пассивной гемагглютинации (РПГА) отличается высокой специфичностью и чувствительностью и является регламентированным методом для изучения напряженности противодифтерийного иммунитета.
Это двухкомпонентная сложная реакция, при которой противодифтерийные антитела, находящиеся в исследуемой сыворотке, взаимодействуют с дифтерийным анатоксином, который адсорбирован на эритроцитах.
В результате специфического взаимодействия антитоксических антител с анатоксином образуется комплекс, выявляемый в виде агглютината эритроцитов. За условно-защитный титр противодифтерийных антитоксических антител принимается титр 1:20. Существует и мнение, что нет четко определенного «защитного титра» антител, определяемого в этой реакции.
Результат РПГА подтверждается в реакции торможения пассивной гемагглютинации (РТПГА), реакция оценивается специфичной при снижении титра антител в РТПГА в 4-8 раз и более.
Реакцию нейтрализации (PH) на кроликах по Йенсену проводят с целью количественного определения антитоксина в крови больного. Метод основан на способности ДТ вызывать воспалительную реакцию и некроз при внутрикожном его введении кроликам.
In vitro исследуемую сыворотку смешивают с различными дозами стандартного токсина и затем вводят кроликам. Отсутствие или степень выраженности внутрикожной реакции зависит от количества антитоксина, содержащегося в крови больного.
С помощью метода Йенсена можно дифференцировать стертые и атипичные формы дифтерии от ангины другой этиологии с сопутствующим носительством токсигенных штаммов. Исследование крови проводят в первые 3-5 дней от начала заболевания.
Отсутствие антитоксина или его низкий уровень (менее 0,01 МЕ/мл) является доводом в пользу заболевания. Уровень антитоксина 0,5-1,0 МЕ/мл свидетельствует в пользу бактерионосительства.
Резкий подъем антитоксина у больных может быть обусловлен вторичным иммунным ответом в случае, если больной вакцинирован, что необходимо учитывать при оценке реакции. Определение титра антитоксина с диагностической целью проводят только до введения лечебной сыворотки. Метод Йенсена применяют редко, т. к. он остается трудоемким и дорогостоящим.
Соответственно рекомендациям ВОЗ для определения уровня антитоксина в сыворотке используют и реакцию нейтрализации токсина в культуре клеток Vero (перевиваемая культура клеток почек обезьян).
Дифтерийный токсин подавляет метаболическую активность и рост культуры клеток Vero. Тест основан на нейтрализации цитотоксического действия ДТ антитоксином, который содержится в сыворотке крови.
Реакцию нейтрализации проводят в микропланшете, в лунки которого с последовательно разведенной исследуемой сывороткой крови вносят ДТ в рабочей дозе и культуру клеток Vero, инкубируют в течение 5-6 дней при 37 °С.
Определение титра антител к дифтерийному токсину проводят по выявлению живых клеток культуры Vero или спектрофотометрически по снижению степени окрашиваемости субстрата митохондриальной дегидрогеназой.
При иммунном ответе на дифтерийный токсин или анатоксин в крови обнаруживаются лимфоциты (1,00-5,71 %), специфически связывающие эти антигены. Определение лимфоцитов, специфически связывающих дифтерийный токсин или анатоксин, проводят в реакции смешанного розеткообразования.
С этой целью в качестве контроля используют эритроциты, сенсибилизированные столбнячным анатоксином, что позволяет дифференцировать антигенсвязывающие лимфоциты (АСЛ) дифтерийной специфичности, обусловленной дифтерийной инфекцией или вакцинацией.
Обнаружение АСЛ дифтерийной специфичности и отсутствие АСЛ столбнячной специфичности является основным критерием для постановки диагноза дифтерийной инфекции.
Вакцинация дифтерийным анатоксином практически всегда осуществляется в комплексе со столбнячным, а иммуногенная активность последнего в АКДС и АДС больше, чем дифтерийного, поэтому в случаях, когда выявление АСЛ дифтерийной специфичности обусловлено вакцинацией, всегда будут обнаружены АСЛ и столбнячной специфичности.
В случае дифтерийной инфекции (заболевание или носительство), наоборот, выявляются АСЛ только дифтерийной специфичности.
Метод количественного определения токсина в составе циркулирующих иммунных комплексов (ЦИК) разработан для ранней диагностики дифтерии и иммунологического мониторинга в процессе лечения.
Для постановки метода используют сыворотку крови больного, из которой с помощью полиэтиленгликоля осаждают ЦИК и исследуют в иммуноферментной реакции согласно инструкции по применению «Дифтерия-монозим». ДТ в составе ЦИК обнаруживается в широком диапазоне концентраций: 0,45-22,3 Lf/мл.
Сроки обнаружения ДТ в ЦИК и его уровень имеют корреляцию с длительностью симптомов интоксикации и развитием осложнений дифтерийного процесса, что является важным для прогнозирования тяжести течения дифтерии и оценки эффективности терапевтических мероприятий.
источник