Брюшной тиф — острое инфекционное заболевание из группы кишечных, сопровождающееся явлениями общей интоксикации организма (слабость, недомогание, головная боль, повышение температуры, тошнота, иногда рвота) и преимущественным поражением лимфатического аппарата тонкой кишки. Возбудитель: Salmonella typhi. Путь заражения: парентерально от больного человека или бациллоносителя, в выделениях которого (кал, моча, пот) содерж-ся микробы. Поражается — тонкая кишка. Инкубационный период — 10-14 дней. В этот период в нижнем отделе тонкой кишки бактерии размножаются. Часть их погибает, выделяя при этом эндотоксин, оказывающий токсическое действие на организм, особенно на сердечно-сосудистую и нервную системы. Интрацеллюлярно через микроворсинки слизистой кишки сальмонеллы мигрируют по лимфатическим сосудам в солитарные фолликулы и групповые лимфатические фолликулы (бляшки Пейера), в регионарные лимфатические узлы, а затем в кровь. Изменения при брюшном тифе делят на местные и общие. Местные изменения. Основные морфологические изменения при брюшном тифе выявляются в групповых лимфатических и солитарных фолликулах тонкой кишки. Наиболее характерные изменения развиваются в пейеровых бляшках подвздошной кишки (илеотиф). Иногда морфологические изменения могут наблюдаться как в тонкой, так и в толстой кишках, тогда говорят об илео-колотифе. Если доминируют структурные изменения в толстой кишке — о колотифе. Эти изменения проходят 5 стадий: 1) мозговидного набухания — в слизистой тонкой кишки вначале заболевания развиваются катаральное воспаление и изменения лимфоидного аппарата; групповые фолликулы увеличиваются, выступают над поверхностью слизистой оболочки, на их поверхности образуются борозды и извилины, что напоминает поверхность мозга. На разрезе они серо-красные, сочные. При гистологическом исследовании в лимфоидном аппарате обнаруживаются характерные тифозные узелки, состоящие в основном из крупных мононуклеарных клеток: моноцитов, гистиоцитов и ретикулярных клеток, которые вытесняют лимфоциты. Это крупные клетки со светлой цитоплазмой, фагоцитирующие брюшнотифозные палочки, в сущности, являются макрофагами. Такие макрофаги называют брюшнотифозными клетками. Они образуют скопления, или брюшнотифозные гранулемы. Макро-: слизистая оболочка пораженных отделов умеренно полнокровна; в просвете кишки содержатся полужидкие или кашицеобразные массы с небольшой примесью слизи; групповые и солитарные фолликулы, брыжеечные лимфатические узлы заметно увеличены в размерах, сочные, красноватого цвета. Мозговидное набух-е групповых и солитарных фолликулов сочетается с катаральным энтеритом. В случае выздоровления на этой стадии болезни брюшнотифозные клетки рассасываются, а катаральное воспаление стихает. 2) стадия некроза – в основе лежит некроз брюшнотифозных гранулем; некроз начин-ся в поверхностных слоях групповых фолликулов и постепенно углубляется, достигая иногда мышечного слоя и даже брюшины. Вокруг некротических масс возникает демаркационное воспаление. Макро-: некротизированные участки грязно-серые, в случае пропитывания желчными пигментами — коричневато-зеленого цвета. 3) стадияобразования «грязных» язв — связан с секвестрацией и отторжением некротических масс. В конце 2-й или в начале 3-й недели происходит постепенное отторжение некротизированных масс («стадия образования язв»). Вследствие этого здесь возникают изъязвления, очертания которых повторяют размеры лимфатических фолликулов. Края свежих язв имеют форму валика и нависают над ее дном. Дно язвы неровное, на нем видны остатки некротизированной ткани. Раньше всего язвы, которые называют «грязными», появляются в нижнем отрезке подвздошной кишки, затем — в вышележащих отделах. В этой стадии появляется опасность внутрикишечных кровотечений, реже — перфорации стенки кишки. 4) стадия чистых язв — на 3-4-й неделе заболевания изъязвления уплощаются, некротические массы на них отсутствуют; язвы расположены по длине кишки, края их ровные, слегка закругленные, дно чистое, образовано мышечным слоем, реже серозной оболочкой. В этой стадии велика опасность перфорации стенки кишки. 5) стадия заживления (регенерации) — на месте язв образуются нежные рубчики. Лимфоидная ткань кишки частично или полностью восстанавливается, становится лишь слегка пигментированной. Общие изменения. Возможны изменения и других органов. В частности, отмечается поражение печени, которая несколько увеличена в размерах. В ней, помимо тифозных узелков, выявляется белковая и жировая дистрофия. В лимфатических узлах брыжейки, особенно илеоцекального угла, отмечаются изменения, развивающиеся в той же последовательности, что и в лимфатическом аппарате кишки. Сначала они увеличиваются за счет полнокровия, пролиферации моноцитарных фагоцитов и ретикулярных клеток, вытесняющих лимфоциты. Затем появляются брюшнотифозные гранулемы, происходят их некроз, организация и петрификация некротических масс. Селезенка при брюшном тифе, как правило, увеличена в 3-4 раза, капсула напряжена, ткань темно-красного цвета, дает обильный соскоб пульпы. Отмечаются гиперплазия красной пульпы, пролиферация моноцитарных элементов и ретикулярных клеток с образованием брюшнотифозных гранулем. В костном мозге наблюдается пролиферация ретикулярных клеток, иногда развиваются мелкие очажки некроза. Изредка развиваются серозный или серозно-гнойный менингит и даже менингоэнцефалит. Характерным является развитие очагов некроза в мышцах, особенно прямых мышц живота и приводящих бедер, а также диафрагмы. Здесь же могут встречаться кровоизлияния. Осложнения. Кишечные: внутрикишечные кровотечения; перфорация язв с развитием перитонита. Внекишечные: гнойный перихондрит гортани; восковидный некроз (ценкеровский некроз) прямых мышц живота; внутримышечные абсцессы; пневмония; гнойный остеомиелит; брюшнотифозный сепсис. Причины смерти: внутрикишечное кровотечение, перитонит, пневмония, сепсис.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Сдача сессии и защита диплома — страшная бессонница, которая потом кажется страшным сном. 8576 — 

193.124.117.139 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник
Остеомиелит вызывается гноеродными микроорганизмами. Однако присутствие в костном мозге микроорганизмов не всегда влечет за собой развитие остеомиелита. При некоторых местных воспалительных процессах и общей гнойной инфекции (сепсис) наблюдаются бактериемия и бактерии в костном мозге, но остеомиелит развивается редко. Острый и хронический остеомиелит вызван стафилококком у 60—80 % больных, стрептококком — у 5-30 %, у 10—15 % больных обнаруживаются пневмококки, грамотрицательная или смешанная флора.
Из первичного очага (фурункулы, карбункулы, панариции, флегмоны, абсцессы, рожа, инфицированные ссадины и раны, кариозные зубы, тонзиллиты, хронические воспалительные процессы в придаточных полостях носа и уха и др.) микроорганизмы попадают в костный мозг через ток крови и при определенных условиях вызывают его воспаление. На развитие остеомиелита влияют анатомо-физиологические особенности кровоснабжения костей у детей; биологические и иммунологические особенности организма; предрасполагающие моменты.
Значение реакции организма на внедрение возбудителя было доказано С.М. Дерижановым (1940), создавшим теорию сенсибилизации. Микроорганизмы, проникшие в кость, проявляют вирулентность лишь тогда, когда обстановка позволяет им размножаться. Остеомиелит развивается в сенсибилизированном организме и протекает по типу гиперергического воспаления.
Кроме сенсибилизации, большое значение имеют и предрасполагающие факторы. К ним относятся травма кости, общее или местное охлаждение, предшествующее инфекции, авитаминоз, общее истощение, которые значительно снижают защитные силы организмы.
Воспалительный процесс развивается сначала в одном или нескольких участках костного мозга, что выражается в гиперемии, отеке, стазе крови в расширенных мелких сосудах с изменением их стенок и выходом через них форменных элементов. Серозно-кровянистый экссудат вскоре становится гнойным и, захватывая все новые участки, переходит во флегмону костного мозга.
Реже воспалительные явления могут начинаться во внутренних слоях надкостницы. В этих случаях серозно-геморрагический выпот, распространяясь по тканевым промежуткам периоста и разрыхляя надкостницу, отделяет ее от кости.
Начавшись в метафизе, остеомиелит у большинства больных быстро распространяется на диафиз или на всю кость. Воспалительный процесс через костные (гаверсовы) канальцы из костного мозга распространяется на корковый слой и надкостницу, а при первоначальной эпифизарной локализации в процесс оказывается вовлеченным сустав. Сустав нередко вовлекается в воспалительный процесс и при метафизарной локализации очага, так как в раннем возрасте суставные сумки плечевого, бедренного и коленного суставов частично прикрепляются к метафизу. Кроме того, несмотря на эпифизарную линию, резистентную к инфекции и защищающую от нее суставы, они могут вовлекаться в воспалительный процесс.
Под влиянием микроорганизмов и их токсинов надкостница утолщается, разрыхляется, ее сосуды переполняются кровью. Скапливающийся серозно-геморрагический экссудат и жидкий гной, проникающий из костного мозга через костные канальцы под надкостницу, отслаивают ее на значительном протяжении (поднадкостничный абсцесс). У детей этому способствует эластичность и рыхлая связь надкостницы с костью.
Поднадкостничный абсцесс перфорирует и разрушает надкостницу, вскоре гной изливается между мышцами, нередко образуя затеки, флегмоны и абсцессы мягких тканей (параоссальная флегмона). Вовлекая в воспалительный процесс кожу, гной прорывается наружу — образуется свищ.
В результате нагноительного процесса в кости и отслоения надкостницы на большем или меньшем протяжении разрушается значительная часть питающих кость сосудов. Кроме того, в них развиваются тромбофлебиты и тромбартерииты, которые наряду с гиперергическим воспалением и воздействием токсинов, выделяемых микроорганизмами и образующихся в результате распада тканей, ведут к омертвению различных участков кости и образованию секвестров. У некоторых больных флегмона костного мозга и отслойка надкостницы на большом протяжении могут вести к изоляции диафиза от надкостницы и эпифизов с нарушением питания диафиза и образованием тотального секвестра. Однако чаще образуются частичные секвестры: кортикальные, или корковые, центральные, или компактные, и проникающие.
Процесс секвестрации продолжается 2 мес и более в зависимости от величины отторгающегося участка кости. Омертвевший кусочек костной ткани не только поддерживает нагноение, но и вызывает реакцию окружающих участков живой ткани. Морфологически воспаление проявляется в виде очагового разрастания грануляционной ткани, способствующей более быстрому распаду секвестра на мелкие отломки под влиянием протеолитических ферментов и их отхождению через свищи. Визуально и рентгенологически отторгшийся секвестр окружен секвестральной полостью, заполненной гноем и продуктами аутолиза костной ткани и отделенной от окружающей живой кости демаркационным валом. Разрушение кости может привести к патологическому перелому.
Параллельно происходит оссифицирующий процесс, который способствует утолщению костных балок. Сливаясь в одну компактную массу, губчатый гной окончательно исчезает, а костномозговая полость облитерируется. Разрастание кости может привести к дополнительному нарушению ее питания и развитию вторичных некрозов, что, по-видимому, является одним из моментов, поддерживающих воспалительный процесс. В резко утолщенной надкостнице и окружающих мягких тканях также возникает остеопластический процесс (оссифицирующий периостит), в результате которого надкостница покрывается ноздреватыми бугристостями, еще более утолщается и спаивается с костью.
Острый гематогенный остеомиелит может протекать в виде сепсиса (часто с образованием множественных пиемических очагов в других костях и органах), в виде локализованной формы с типичным расположением очага и секвестрацией или в виде атипических и стертых форм.
В течение 1-2 дней у больного отмечаются общее недомогание, ломота в конечности, мышечные боли. Затем появляются озноб со стойким повышением температуры, слабость, разбитость, усиливается головная боль, иногда возникает рвота.
Общее состояние больного становится тяжелым, сознание — спутанным, появляются бред, симптомы раздражения мозговых оболочек, а иногда и судороги. Аппетит исчезает, язык обложен, сухой. Лицо становится бледным, глаза — запавшими, губы и слизистые оболочки — цианотичными, кожа — сухой, с желтушным оттенком, сниженным тургором.
Артериальное давление понижено, тоны сердца глухие, пульс частый, слабого наполнения и, как правило, соответствует температуре. Дыхание учащенное, поверхностное. Иногда обнаруживаются симптомы бронхопневмонии. Печень и селезенка увеличены, болезненны при пальпации. Мочи выделяется мало, в осадке выявляются белок и цилиндры.
Температура в первые дни держится на уровне 39-40 °С, по мере развития нагноения становится ремиттирующей с большими колебаниями на протяжении суток.
Число лейкоцитов достигает 15—20,0х10 9 /л и даже 30,0х10 9 /л. Отмечаются сдвиг лейкоцитарной формулы, снижение числа эозинофилов и моноцитов. Нарастает анемия (снижение содержания гемоглобина в тяжелых случаях до 20,0 г/л и эритроцитов до 2,5—Зх10 12 /л). С первых дней заболевания появляется строго локализованная рвущая, сверлящая, распирающая боль в пораженной конечности. Больные, особенно дети, при малейших движениях пораженной конечностью, толчках кровати, перекладывании нередко кричат от сильной боли. Чтобы уменьшить боль, они лежат совершенно неподвижно.
При расположении очага вблизи сустава конечность вследствие рефлекторного сокращения мышц принимает полусогнутое положение.
В связи с глубоким расположением очага видимые местные симптомы заболевания отсутствуют, поэтому важное значение приобретает методичная и осторожная пальпация. Она позволяет определить место наибольшей болезненности, соответствующее центру процесса. Этот симптом является довольно ранним и весьма ценным. Поколачивание по пятке или по локтю вызывает сильные боли в месте поражения конечности.
В последующие 2 сут местные явления выступают отчетливее. На месте поражения появляется болезненная припухлость мягких тканей, которая быстро нарастает, выявляются умеренная краснота кожи, отечность, местное повышение температуры. Несмотря на то что рентгенологическое исследование в этот период еще не обнаруживает никаких изменений, диагноз становится ясным. Припухлость конечности быстро увеличивается, начинают просвечивать расширенные вены, увеличиваются регионарные лимфатические узлы.
В конце 1-й недели болезни у детей и через 2 нед у подростков в центре припухлости начинает определяться флюктуация.
При развитии межмышечной флегмоны общее состояние больного несколько улучшается. Нарушения функции пораженной конечности становятся основными. Если общее состояние больного остается тяжелым, необходимо искать осложнения (переход процесса на близлежащий сустав, множественное поражение костей, образование пиемических очагов и др.).
Без хирургического лечения межмышечная флегмона может самостоятельно вскрыться с последующим образованием свища. В неблагоприятных случаях она прогрессирует и приводит к вторичному гнойному артриту, параартикулярной флегмоне и сепсису.
Выделяют очень бурно протекающую септическую форму острого остеомиелита, когда болезнь начинается внезапно с резкого повышения температура до 40 °С и выше, сильнейшего озноба, быстрой потери сознания, иногда бреда. Вслед за этим развивается картина септического шока (частый пульс слабого наполнения, поверхностное дыхание, снижение артериального давления, сухой язык, геморрагические высыпания на коже, увеличение печени и селезенки, изменения в крови и моче). Такие больные обычно умирают в течение 1-х или 2-х суток. Местные проявления заболевания, как правило, не успевают обнаружиться, вследствие чего диагностика затруднена. Эту форму остеомиелита обычно смешивают с тифом, токсической скарлатиной, менингитом. Иногда вскрытие все же выявляет гнойные очаги в кости с метастазами во внутренние органы: печень, селезенку, легкие.
Течение острого гематогенного остеомиелита зависит от своевременности начала лечения, в частности от раннего применения антибиотиков. На это указывает учащение подострых форм и значительное уменьшение частоты острых и септических случаев заболевания.
Рентгенологическое исследование при остром гематогенном остеомиелите дает важную и ценную информацию. С его помощью уточняют диагноз, определяют локализацию и протяженность патологического процесса и патологоанатомических изменений. Первые рентгенологические симптомы начинают выявляться на 10—14-й день заболевания. В связи с этим обстоятельством, а также в связи с особенностями быстро прогрессирующего гнойного процесса в кости рентгенологический диагноз острого гематогенного остеомиелита устанавливают с опозданием, когда изменения в кости могут быть уже необратимыми.
Ранний рентгенологический симптом остеомиелита длинной трубчатой кости — утолщение и отслоение надкостницы. Это тонкая линейная тень с гладким наружным и несколько неровным внутренним контуром, приподнятая над тенью коркового слоя диафиза. Она более выражена у детей, активная, сочная и толстая надкостница которых богата кровеносными сосудами, а сравнительно тонкий слой мышц не препятствует исследованию.
Изменения кости наблюдаются сначала в метафизе и рентгенологически выражаются смазанностью структуры, расплывчатостью костных перекладин. В дальнейшем рисунок кости становится еще более пестрым вследствие чередования участков разрежения и уплотнения. Очаги разрежения имеют удлиненную форму соответственно ходу костных канальцев. Корковый слой, лежащий против периостальной каймы, утрачивает нормальные гладкие контуры и выглядит как бы изъеденным, с отдельными дефектами. Процесс секвестрации определяется к концу 2—4-го месяца от начала заболевания.
КТ расширяет возможности диагностики острого гематогенного остеомиелита. Метод позволяет раньше выявить воспалительные изменения в кости, костномозговом канале, надкостнице по сравнению с рентгенографией.
При радиосцинтиграфии отмечают увеличение накопления радиофармпрепарата в очаге воспаления в кости. Метод имеет важное значение на доклинической стадии или при ранних клинических проявлениях в первые 10—15 дней. При подозрении на множественную локализацию процесса визуализация всего скелета представляет несомненные преимущества сцинтиграфии.
Большое значение в распознавании ранних стадий заболевания придают внутрикостному давлению, которое повышено, особенно в детском возрасте.
Диагностика гематогенного остеомиелита в типичных случаях не вызывает трудностей. Однако нередко остеомиелит протекает как острое инфекционное заболевание без четкой местной симптоматики. Острый гематогенный остеомиелит иногда трудно отличить от менингита, тифа и паратифа, милиарного туберкулеза, прикорневой пневмонии, скарлатины и даже малярии. Диагностику затрудняет состояние тяжелой интоксикации с признаками раздражения мозговых оболочек и появлением геморрагической сыпи.
Правильной диагностике помогает целенаправленное выявление местных симптомов, в частности мышечной контрактуры близлежащих суставов при эпифизарном остеомиелите, локальной болезненности, болей при нагрузке конечности по оси и др.
Хронический остеомиелит — это особая фаза гнойно-некротического заболевания костной системы, которой обязательно предшествует острая стадия. Исключение составляют лишь первично-хронический и атипичные формы остеомиелита. Заболевание становится хроническим не во всех случаях острого остеомиелита, а лишь у тех больных, у которых не удалось подавить патогенную микрофлору и у которых наступили некротическо-деструктивные изменения в пораженных костях.
Причины перехода острого остеомиелита в хронический многообразны. Основные из них: позднее обращение и запоздалая диагностика при остром гематогенном остеомиелите, позднее или недостаточное хирургическое лечение и нерациональная антибактериальная терапия. Частота хронического остеомиелита как исхода острого процесса составляет от 10 до 33—35 % (Гринев М.В., 1977; Акжигитов Г.Н., 1986). Точные сроки перехода острого остеомиелита в хронический не определены. Многое зависит от распространенности острого процесса, деструктивных изменений, вирулентности инфекции и эффективности лечения. Наибольшее влияние на течение острого остеомиелита оказывает антибиотикотерапия.
Переход острого остеомиелита в хронический возможен в сроки от 1 до 1 1/2 мес от начала заболевания. Однако переход процесса в хроническую стадию становится достоверным в более поздние сроки (2—4 мес), так как лишь за этот промежуток времени можно окончательно отличить латентный, нерационально леченный, затухающий острый остеомиелит от хронического. Для формирования хронической стадии время имеет второстепенное значение. Решающие аргументы в пользу этого перехода — клинические проявления и морфологические изменения в костях. Диагноз хронического остеомиелита считается достоверным при обнаружении гнойного свища, костного секвестра и рецидивирующем течении.
Таким образом, срок перехода острой стадии остеомиелита в хроническую во многом зависит от скорости секвестрообразования. Правильнее ожидать формирования хронического остеомиелита через несколько месяцев от начала заболевания.
В хроническую стадию может переходить любой вид острого остеомиелита: гематогенный, травматический, огнестрельный. Имеющиеся в остром периоде морфологические и клинические различия между этими видами заболевания обнаруживаются и при хроническом остеомиелите, но они менее выражены. Имеется тенденция к еще большему сглаживанию этих различий при длительном хроническом гематогенном и травматическом остеомиелитах.
В клиническом течении хронического остеомиелита различают фазы окончательного перехода острого процесса в хронический, ремиссии и рецидива воспаления. Однако такое разграничение схематично и условно. Так, например, трудно точно определить момент наступления хронической фазы при вялотекущем бессвищевом остром остеомиелите.
При переходе острого гематогенного остеомиелита в хронический самочувствие больного улучшается, боли в области поражения вместо острых распирающих становятся ноющими и постепенно ослабевают. Уменьшаются или исчезают признаки интоксикации: температура тела понижается до нормы или становится субфебрильной; функции дыхательной и сердечно-сосудистой систем тоже нормализуются, уменьшаются слабость, проливные поты, улучшается аппетит, сон в результате прекращения боли становится длительным и глубоким. При лабораторном исследовании обнаруживают уменьшение лейкоцитоза, снижение СОЭ, улучшаются формула белой крови, показатели красной крови. В моче уменьшается содержание белка, лейкоцитов. Изменения общего состояния больного сопровождаются заметными изменениями в области остеомиелитического очага.
При хроническом остеомиелите происходит окончательное формирование гнойных свищей на месте операционных разрезов, произведенных при хирургическом лечении острого остеомиелита, или самостоятельно вскрывшихся флегмон после перехода гнойного процесса из поднадкостничного абсцесса в мягкие ткани. Как правило, свищевой канал подходит к деструктивно измененному участку костной ткани. Может быть один или несколько свищей, нередко они соединяются друг с другом в мягких тканях, образуя сложную сеть инфицированных каналов. Наружное отверстие свища иногда располагается на значительном удалении от остеомиелитического очага. Количество гнойного отделяемого у больных остеомиелитом бывает различным, но при переходе в хроническую стадию гноетечение значительно уменьшается.
Мягкие ткани в области остеомиелитического поражения сохраняют отечность. По мере перехода в стадию ремиссии эта воспалительная инфильтрация постепенно уменьшается. При остеомиелите конечностей их функция обычно полностью не восстанавливается. При наступлении фазы хронического воспаления сохраняется тугоподвижность в суставах, прилегающих к остеомиелитическому очагу. В связи с деструктивными процессами в костной ткани в этой стадии заболевания может установиться уже заметное патологическое искривление конечности, нередко с изменением ее длины.
Эти клинические изменения при переходе острого остеомиелита в хронический сопровождаются определенными морфологическими изменениями. Отмечают заметное стихание перифокального воспаления, уменьшение лейкоцитарной инфильтрации и серозной экссудации. Одновременно происходят отграничение гнойных очагов в костной ткани, резорбция костных структур и продуктивные реакции, особенно в периосте.
Основным признаком перехода заболевания в хроническую фазу является постепенная секвестрация, которая в течение нескольких недель, иногда месяцев завершается полным отделением некротизированных участков от сохранившей жизнеспособность костной ткани. Чаще встречаются центральные, кортикальные и проникающие секвестры. Кроме того, при переходе остеомиелита в хроническую стадию образуется секвестральная капсула, внутри которой обычно располагаются уже полностью отторгшийся секвестр и гной, а по внутренним стенкам образуется грануляционная ткань.
Присутствие секвестров в остеомиелитических очагах необязательно. При переходе острого гематогенного остеомиелита в хронический в пораженной части кости нередко образуется множество полостей различной величины без секвестров, в которых также имеются гной и грануляции. Эти остеомиелитические очаги, диффузно вкрапленные в кость, могут соединяться внутрикостно расположенными узкими инфицированными ходами или быть изолированными оболочкой, представленной в основном фиброзной тканью. Знание этих патологических изменений в костной ткани совершенно необходимо для выполнения как можно более радикального хирургического вмешательства при хроническом остеомиелите.
В фазе ремиссии хронического гематогенного остеомиелита большинство больных отмечают исчезновение боли, улучшение общего состояния, как правило, нормализацию температуры тела, лейкоцитоз отсутствует, СОЭ умеренно повышена. Из свищей выделяется небольшое количество гноя, нередко свищи временно закрываются. Длительность ремиссий от нескольких недель до многих лет. Секвестр в остеомиелитическом очаге резко уменьшает шансы на продолжительную ремиссию.
Хронический остеомиелит в фазе обострения по клиническим признакам напоминает начало острого остеомиелита, но воспалительные изменения и интоксикация при этом менее выражены. Рецидиву хронического остеомиелита чаще предшествует временное закрытие гнойного свища. Рецидив сопровождается усилением болей в области остеомиелитического очага; там же определяются воспалительная отечность тканей, нередко гиперемия кожных покровов, местная гипертермия; нарушения функции конечности вновь усиливаются. Одновременно появляются общие признаки гнойной интоксикации.
Рецидив остеомиелитического процесса приводит к формированию флегмоны или к возобновлению функционирования свища с выделением большого количества гноя. Это обычно способствует быстрому улучшению общего состояния больного и стиханию локальных воспалительных изменений. Если самопроизвольного вскрытия флегмоны не произошло, а хирургическое вмешательство запоздало, интоксикация продолжается и усугубляется образованием новых гнойных затеков.
Диагностика хронического гематогенного остеомиелита обычно не представляет трудностей. Основными критериями диагностики заболевания являются указания в анамнезе на перенесенный острый остеомиелит, гнойный свищ, рецидивирующее течение и рентгенологические признаки. Большие диагностические трудности возникают при бессвищевых формах остеомиелита, которые и в остром периоде остаются торпидными и почти без деструкции костной ткани.
Рентгенография и томография обнаруживают изменения в костной ткани: «ассимилированный периостит» — тень утолщенной надкостницы; выраженный остеосклероз, окаймляющий остеомиелитические полости и соответствующий секвестральной коробке, секвестры, чередование участков остеосклероза и остеопороза, сужение или полное исчезновение просвета костномозгового канала на уровне остеомиелитического поражения и др. Фистулография позволяет исследовать расположение, направление, форму свищевых ходов и их связь с очагом в кости. Компьютерная томография дает информацию о тонкой структуре кости и мягких тканей.
Сцинтиграфия устанавливает воспалительный процесс в кости и его распространенность. Этот метод имеет большое значение для выявления различий хронического остеомиелита и опухоли кости.
Лабораторные исследования крови не дают специфической информации при хроническом остеомиелите. В фазе обострения могут быть умеренно выраженная анемия и лейкоцитоз со сдвигом формулы влево при заметном повышении СОЭ.
Однако хронический остеомиелит иногда приходится дифференцировать с посттравматическим периоститом, сифилисом, туберкулезом, актиномикозом костей, ревматизмом, опухолью кости, а в редких случаях с внутрикостной гемангиомой, лимфогранулематозом, подагрой и др.
При посттравматическом периостите в отличие от хронического остеомиелита в анамнезе нет указаний на острый гнойный процесс, чередование ремиссий и рецидивов. На рентгенограммах не определяются остеомиелитические полости, секвестры, чередование участков остеосклероза и остеопороза и др.
При сифилитическом остеомиелите округлые или овальные очаги деструкции располагаются чаще в диафизе и метафизе большеберцовой, плечевой, бедренной кости, реже — в других трубчатых костях. При диффузном сифилитическом поражении наблюдают множество мелких очагов и продуктивные склеротические изменения в костях. Процесс безболезненный, без признаков гнойного воспаления, бессимптомно открывающиеся свищи располагаются на симметричных участках костей. Серологические исследования в значительной степени помогают отличить хронический неспецифический остеомиелит от сифилиса костей.
При туберкулезе рано наступает атрофия мягких тканей пораженной конечности, симптом Александрова (утолщение кожной складки на стороне поражения) положительный, свищи окружены блеклыми грануляциями, а в гнойном отделяемом нередко присутствуют казеозные массы. Рентгенологически при туберкулезе костей долго отмечается лишь остеопороз без периостита. При туберкулезе определяют секвестры в виде «кусочка тающего сахара».
Кроме того, при туберкулезе участки поражения кости локализуются в эпифизах, а при хроническом гематогенном остеомиелите очаги деструкции в большинстве случаев обнаруживаются в метафизах и диафизах.
Актиномикоз имеет медленное подострое течение с довольно поздним образованием язв с гнойным отделяемым, которые можно принять за остеомиелитические свищи. Достоверный диагноз актиномикоза устанавливают при обнаружении в гное из язв или в соскобах из язв (свищей) актиномикотических друз, а также при серологической реакции связывания комплемента и реакции с актинолизатом.
При ревматизме чаше наблюдается полиартрит мелких суставов, нет деструктивных изменений и перестройки костной ткани, свойственных как хроническому, так и первично-хроническому остеомиелиту.
При остеогенной саркоме заболевание нарастает постепенно, в анамнезе нет указаний на острое начало заболевания и явления интоксикации, значительное ухудшение общего состояния больного. Боли при саркоме костей, в отличие от болей при хроническом остеомиелите, более интенсивные и постоянные, не ослабевают при иммобилизации конечности. При рентгенографии остеолитические и остеопластические формы саркомы, в отличие от хронического остеомиелита, проявляются разрушением кортикального слоя кости и отслойкой надкостницы в виде «козырька», радиально направленными периостальными спикулами идр. Дифференциальной диагностике помогает КТ.
При пункции в зоне новообразования кости получают не гнойный экссудат, а серозно-геморрагическую жидкость, в которой можно обнаружить опухолевые клетки. Если приведенные методы исследования не позволяют четко дифференцировать хронический остеомиелит и опухоль костной ткани, то необходима биопсия.
Под первично-хроническим остеомиелитом понимают те случаи, в которых с самого начала болезнь протекает атипично — подостро или вообще обнаруживается уже в хронической стадии. К атипичным формам заболевания относятся абсцесс Броди, склерозирующий остеомиелит Гарре, альбуминозный остеомиелит Оллье.
Абсцесс Броди был описан в 1928 г. При абсцессе Броди нет выраженной клинической картины заболевания. Оно начинается в раннем возрасте. Внешне проявления болезни скудны; болезненность обнаруживается только при перкуссии кости. На рентгенограммах виден очаг просветления округлой или эллиптической формы, вокруг которого определяется склеротическая зона. При вскрытии абсцесса выделяется гной, секвестрации кости не наступает.
Склерозирующий остеомиелит Гарре был подробно описан в 1893 г. швейцарским хирургом Гарре. Заболевание начинается подостро, без резких болей в конечности, без гиперемии. Образование флегмон и гнойных свищей наблюдается крайне редко. Течение воспалительного процесса вялое, боли в конечности наблюдаются чаще в ночное время, отмечаются нарушение функции конечности, умеренное повышение температуры, СОЭ и незначительный лейкоцитоз. При этой форме остеомиелита резко выраженный склероз чаще поражает длинную трубчатую кость. На фоне склероза выявляются небольшие очаги разрежения костной ткани. Костномозговой канал постепенно суживается и может полностью исчезнуть; одновременно диафиз кости веретенообразно утолщается.
Альбуминозный остеомиелит Оллье, описанный в 1864 г., сначала не сопровождается выраженными признаками инфекционного заболевания. Вместо гноя в остеомиелитическом очаге скапливается серозная жидкость, богатая белком или муцином. Из этой жидкости удается высеять стафилококк, стрептококк.
Патогенез альбуминозного остеомиелита не совсем ясен. Считается, что вследствие вирулентности патогенной флоры или высокого уровня иммунобиологических защитных сил организма либо по каким-то другим причинам в первом гематогенном остеомиелитическом фокусе не происходит нагноения. Воспаление остается на первой стадии — экссудации, в связи с чем в остеомиелитической полости содержится серозная или слизистая жидкость. Вялое течение заболевания иногда осложняется деструкцией кости с образованием секвестров или вторичным присоединением гнойной инфекции. Лечение альбуминозного остеомиелита хирургическое для ликвидации очага хронического гнойного воспаления.
Помимо первично-хронических остеомиелитов, описаны следующие формы заболевания. «Антибиотический остеомиелит» изначально протекает вяло, без выраженного болевого синдрома и гиперемии, с умеренными лейкоцитозом и повышением СОЭ. Параоссальные флегмоны и свищи, как правило, не возникают. В костной ткани образуются мелкие остеомиелитические очаги, наблюдается чередование участков остеопороза и склероза. Такое развитие заболевания связывают с длительным приемом антибиотиков.
Послетифозный остеомиелит — собирательное название остеомиелитов, которые начинаются вскоре после различных инфекционных болезней или в их конце. Заболевание может развиваться после скарлатины, гриппа и др., но наиболее часто возникает после тифа (брюшного, сыпного, паратифа), чем и объясняется его название.
Остеомиелитические изменения происходят чаще под влиянием обычной гноеродной микрофлоры, а не возбудителя перенесенного инфекционного заболевания. Вирулентность микрофлоры при этом обычно снижена, в связи с чем течение остеомиелитического процесса вялое с медленным переходом в хроническую стадию. Для правильной диагностики учитывают развитие остеомиелита сразу после перенесенного инфекционного заболевания и его торпидное течение. Лечение обычное для хронического гематогенного остеомиелита.
Фиброзный остеомиелит — особая форма остеомиелитического процесса, при котором подострое воспаление костного мозга и самой кости (паностит) приводит не к деструктивным изменениям (секвестрации и образованию полостей), а к замещению костного мозга соединительной тканью, которая в последующем почти полностью склерозируется и метаплазируется в костную ткань.
Опухолевидный остеомиелит — редкая форма хронического остеомиелита. Отмечаются опухолеподобный инфильтрат мягких тканей, спаянный с костью, боли в области поражения, отсутствие флегмонозных изменений, секвестрации и гнойного свища. Дифференциальная диагностика затруднена, так как тень периостальных разрастаний на рентгенограммах напоминает картину остеогенной саркомы. Правильной диагностике помогают биопсия, микробиологические исследования и неизменность рентгенологической картины при динамическом исследовании в течение нескольких месяцев.
источник
Сайт предоставляет справочную информацию исключительно для ознакомления. Диагностику и лечение заболеваний нужно проходить под наблюдением специалиста. У всех препаратов имеются противопоказания. Консультация специалиста обязательна!
Брюшной тиф относится к заболеваниям, уровень распространенности которых во многом зависит от социально-экономических условий. Так, в прошлом вспышки этой болезни приходились на период войн, экономического кризиса и других социальных бедствий.
С учетом статистических данных Всемирной Организации Здравоохранения, все страны мира в зависимости от распространенности брюшного тифа условно делятся на несколько групп. В первую группу входит Канада, Бельгия, Швеция и другие страны с высоким уровнем экономического развития. В этих регионах на 100 000 человек приходится не больше 1 ежегодного случая этой инфекции. К последней группе относятся такие страны как Чили, Колумбия, Перу. Ежегодно в этих странах регистрируется более 30 случаев заболевания на 100 000 человек.
На территории Российской Федерации с 2007 года число случаев брюшного тифа значительно уменьшилось. Если с 2003 по 2006 год ежегодное количество пациентов варьировало от 150 до 180, то с 2007 по 2013 год этот показатель не превышал 80 человек. В 2014 году было зарегистрировано 14 больных (13 взрослых и 1 ребенок).
Возбудителем брюшного тифа является Salmonella typhi – подвижная палочка со сложным антигенным строением. Это довольно устойчивая во внешней среде бактерия, которая сохраняется в течение многих месяцев в водоемах, почве, овощах и фруктах, а также в молочных продуктах (в них сальмонеллы могут длительное время размножаться). Бактерии можно убить 96-процентным этиловым спиртом или 3-процентным раствором хлорамина. Основной характеристикой сальмонелл является сложная антигенная структура. Она представлена соматическим и жгутиковым антигеном.
Сальмонеллы продуцируют и выделяют сильный эндотоксин, который и определяет клиническую картину заболевания.
К антигенной структуре сальмонелл относятся:
- О-соматический антиген, представлен липосахаридным, устойчивым к действию высоких температур комплексом;
- Н-жгутиковый антиген, быстро разрушающийся под действием высоких температур.
Бактерии брюшного тифа способны к L-трансформации, то есть могут переходить в хроническую форму. При этом процессе бактерии как бы засыпают, но сохраняют свои патогенные свойства. Через некоторое время, когда иммунные силы человека снижаются, они вновь активируются. Этим объясняется возможность длительного персистирования (нахождения) бактерий в организме.
Брюшной тиф относится к инфекциям с фекально-оральным механизмом передачи, что означает, что проникновение патогенных бактерий в организм происходит преимущественно через рот. Заражение может осуществляться пищевым или водным путем. В почве или воде сальмонеллы сохраняются длительное время, что и делает этот путь заражения наиболее частым. Контактный или бытовой путь заражения встречается исключительно редко, в основном у детей. Это может происходить при непосредственном контакте с источником инфекции (например, ребенок может взять в рот игрушку, которая была заражена сальмонеллами).
Попадая через ротовую полость в организм человека, сальмонеллы далее мигрируют в кишечник. Известно, что внедрение возбудителя происходит в подвздошной кишке, которая является отделом тонкого кишечника. Изначально бактерии начинают паразитировать в скоплениях лимфатической ткани подвздошной кишки. Потом вместе с током лимфы они проникают уже в мезентериальные лимфатические узлы. Здесь они также начинают интенсивно размножаться, а достигнув определенной концентрации, проникают в кровь. Находясь в лимфатических узлах, сальмонеллы не только растут и размножаются в них, но и запускают развитие воспалительного процесса. Период времени с момента попадания бактерий в организм и до их выхода в кровь называется периодом инкубации. После его окончания появляются первые симптомы заболевания. Известно, что для возникновения заболевания необходимо, чтобы в желудочно-кишечный тракт попало не менее 10 миллионов микробных клеток. В кишечном тракте их концентрация может достигнуть одного миллиарда.
Попадая в кровь, сальмонеллы приводят к развитию бактериемии. Бактериемией называется циркуляции в крови (которая в норме стерильна) бактерий. Этот процесс совпадает с появлением первых симптомов брюшного тифа и окончанием периода инкубации. Чем массивнее бактериемия, тем сильнее и выраженнее симптомы заболевания.
Патогенезом называется весь комплекс механизмов, необходимых для развития болезни. При брюшном тифе патогенез реализуется на нескольких этапах.
Этапами патогенеза брюшного тифа являются:
- проникновение сальмонелл в желудочно-кишечный тракт вместе с источником заражения (едой, водой);
- внедрение бактерий в слизистую подвздошной кишки;
- размножение сальмонелл в солитарных фолликулах и пейеровых бляшках, откуда они мигрируют в мезентериальные лимфатические узлы;
- развитие воспаления в мезентериальных лимфатических узлах и увеличение концентрации сальмонелл в них;
- выход бактерий в кровь и развитие бактериемии;
- распространение с током крови бактерий по всем органам и тканям;
- формирование очагов инфекции в селезенке, печени и других органах.
Важным моментом в патогенезе брюшного тифа является бактериемия. Она бывает первичной и вторичной. Первичная бактериемия – это, когда сальмонеллы впервые из лимфатических узлов попадают в кровь. Однако когда бактерии попадают в кровь, они гибнут вследствие ее бактерицидного действия. Погибая, они выделяют эндотоксин, который обладает нейротропным действием. Таким образом, часть бактерий, находящихся в кровеносном русле, постоянно погибает и выделяет эндотоксин. Чтобы продлить циркуляцию сальмонелл, из внутренних органов в кровь вновь начинают мигрировать бактерии. Процесс выхода сальмонелл в кровь уже из внутренних органов называется вторичной бактериемией.
Таким образом, развивается порочный круг – бактерии выходят в кровь, где они погибают и выделяют эндотоксин, а им на смену поступают новые сальмонеллы из внутренних органов и лимфатических узлов. В то же время, эндотоксин, обладая сильнейшим нейротропным эффектом, определяет клиническую картину брюшного тифа.
Эффектами эндотоксина сальмонелл являются:
- нейротоксическое действие с поражением центральной нервной системы и развитием токсической энцефалопатии;
- поражение нервных окончаний и вегетативных ганглий, что приводит к развитию язв на слизистой кишечника;
- кардиотоксическое действие, которое проявляется в дистрофических изменениях сердца, что в конечном итоге приводит к развитию токсического миокардита;
- нарушение тонуса периферических сосудов, приводящее к падению артериального давления и развитию коллапса;
- развитие инфекционно-токсического шока, что сопровождается нарушением водно-электролитного баланса;
- поражение почек и развитие синдрома «шоковая почка».
Все эти эффекты приводят к развитию многочисленных симптомов и обуславливают разнообразную клиническую картину.
Источником сальмонеллы тифа для здорового человека в большинстве случаев является бактерионоситель. Носителем называют того, кто практически оставаясь здоровым, не проявляя никаких признаков болезни выделяет в окружающую среду патогенные бактерии. Выделение может продолжаться от нескольких недель до нескольких десятков лет. Данный феномен может объясняться несколькими причинами. В первую очередь, это может быть бактерионоситель-реконвалесцент, то есть выздоравливающий после перенесенного заболевания человек. В период выздоровления бактерионосительство может быть как кратковременным, так и длительным. Кратковременное носительство наблюдается при дизентерии или при дифтерии (от 3 до 4 месяцев). Что касается брюшного тифа, то в данном случае носительство затягивается до 10 лет.
Отдельной категорией бактерионосительства являются иммунные носители. Это те лица, которые ранее были привиты.
Источником инфекции также могут быть больные с атипичными формами брюшного тифа. В этом случае заболевание протекает без классических симптомов и поэтому не диагностируется вовремя. Люди с такими формами брюшного тифа длительное время лечатся амбулаторно (то есть на дому) и остаются не изолированными от членов семьи. В этом случае, заражение может происходить при употреблении зараженной пищи, воды. Большую опасность представляют собой молочные продукты, так как в них бактерии могут не только длительное время сохраняться, но и размножаться.
Восприимчивость населения к брюшному тифу очень высока. В очагах, где регистрируется вспышка брюшного тифа, могут заболевать до 50 – 60 процентов от общего населения.

К периодам (этапам) заболевания брюшного тифа относятся:
- инкубационный период;
- начальный период;
- период разгара заболевания;
- период угасания основных симптомов;
- период выздоровления.
Инкубационный период – это период с момента проникновения сальмонелл в организм человека до момента, когда появляются первые симптомы. При брюшном тифе период инкубации, как правило, длится от 9 до 14 дней. Максимально он может затягиваться до 25 дней. За это время попавшие в организм сальмонеллы активно размножаются в слизистой подвздошной кишки и лимфатических узлах. В тот момент, когда бактерии выходят в кровь, инкубационный период заканчивается, и появляются первые признаки заболевания.
Длительность этого периода зависит от концентрации изначально попавших в организм микробов и от пути заражения. При пищевом заражении инкубационный период короткий — от 7 до 9 дней, а заболевание отличается высокой тяжестью. Водный путь заражения характеризуется более длительным периодом инкубации.
Период угасания основных симптомов начинается с момента снижения температуры, очищения языка, нормализации стула. Все проявления общей интоксикации – головная боль, слабость, разбитость – уходят. Температура тела начинает снижаться, но все еще не доходит до нормы.
Несмотря на редукцию симптомов, этот период болезни является очень опасным. Именно в этот момент болезнь может заново проявить себя, то есть возможен рецидив брюшного тифа. Поэтому в период угасания основных клинических симптомов пациент продолжает оставаться в стационаре под постоянным наблюдением.
Симптомами брюшного тифа являются:
- лихорадка;
- сыпь;
- кишечное кровотечение;
- поражение внутренних органов.
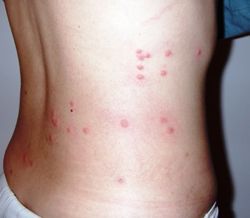
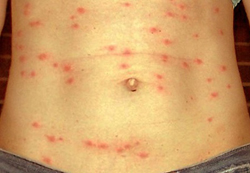
Специфическим проявлением брюшного тифа является сыпь. Она обусловлена нарушением проницаемости кровеносных сосудов и пропитыванием эпидермиса элементами крови. При брюшном тифе сыпь, как правило, розеолезная, а элементом такой сыпи является розеола. Розеола – это округлое красное пятнышко, размером от 1 до 5 миллиметров. Она не шелушится и не создает зуд, а потому не причиняет беспокойства пациенту. Однако, несмотря на это, сам период высыпания сопровождается резким поднятием температуры тела и ухудшением состояния пациента. Сознание пациента еще больше затуманивается, и он становится сонным, вялым, апатичным.
При брюшном тифе сыпь появляется на 8 – 9 день от начала заболевания. Она локализуется на верхних отделах живота и грудной клетки. Иногда элементы сыпи могут выступать над уровнем кожи и приобретать четкие границы. Чаще всего сыпь необильная и держится от 3 до 5 дней. Она может исчезнуть уже через один — два дня, но потом вновь появится. При тяжелом течении заболевания сыпь приобретает петехиально-геморрагический характер. Элементы сыпи в данном случае пропитываются кровью, что говорит о неблагоприятном прогнозе.
В редких случаях характерная для брюшного тифа сыпь может отсутствовать. Отсутствие сыпи на теле пациента не должно исключать диагноз брюшного тифа.
При брюшном тифе из-за специфического поражения сальмонеллами желудочно-кишечного тракта выявляются признаки энтерита. На начальных стадиях отмечается задержка стула, однако уже во время стадии развернутых клинических проявлений присутствует стул энтерического характера (то есть понос). У некоторых же больных остаются запоры.
Живот больного брюшным тифом вздут, при пальпации болезненный. В умеренных и тяжелых случаях развивается парез кишечника, для которого характерно полное отсутствие перистальтизма. При этом газы и кишечное содержимое скапливаются в просвете кишечника, делая живот напряженным и болезненным.
В результате специфического воздействия эндотоксина сальмонелл на нервные окончания в слизистой кишечника развиваются трофические и сосудистые изменения. Они, в свою очередь, приводят к нарушению питания слизистого слоя кишечника и развитию трофических язв. Трофические язвы – это те, которые развиваются вследствие нарушенного питания (трофики) слизистой оболочки. В своем развитии язвы проходят несколько этапов.
Этапами развития язв являются:
- первая неделя – увеличение лимфатических фолликулов слизистой кишечника;
- вторая неделя – некроз (омертвение) увеличенных образований;
- третья неделя – отторжение некротических (омертвевших) масс и формирование на их месте небольших углублений, то есть язв;
- четвертая неделя – стадия чистых язв;
- пятая неделя – стадия заживления язв.
Все эти стадии могут следовать одна за другой без развития последствий для слизистой оболочки кишечного тракта. Однако, при формировании обширных и глубоких язв течение брюшного тифа осложняется кишечным кровотечением. Происходит это вследствие перфорации (прободения) язвы слизистой. В этом случае целостность оболочек кишечника нарушается, а вместе с ними и тех кровеносных сосудов, которые в них заложены. Нарушение целостности кровеносных сосудов приводит к излитию крови в просвет кишечника, что и является причиной кишечного кровотечения.
Кишечное кровотечение при брюшном тифе, как правило, встречается на 3 – 4 недели от начала заболевания. Неотъемлемым симптомом перфорации кишечной язвы является боль. Пациент предъявляет жалобы на внезапно появившуюся боль острого характера.
Часто боли локализуются внизу животу справа, но могут быть и разлитыми. Болевой синдром сопровождается выраженным напряжением мышц живота, учащенным дыханием и падением артериального давления. Симптомы перфорации язвы ярко выражены при умеренных формах брюшного тифа. Объясняется это тем, что сознание пациента в этом случае не сильно затуманено, и болевая чувствительность сохраняется. Если же кишечное кровотечение начинается на фоне высокой температуры и затуманенного сознания пациента, то клиника его очень стертая.
При осмотре выявляется выраженное защитное напряжение мышц живота. Живот плотный болезненный, движения брюшной стенки во время акта дыхания еле заметны или вовсе отсутствуют. Появляются признаки раздражения брюшины, такие как симптом Щеткина-Блюмберга.
После того как бактерии брюшного тифа выходят в кровь, они разносятся с током крови по всему организму к различным органам и системам. Так, вместе с током крови они попадают в печень, селезенку, почки, сердце.
Поражение сердца
Эндотоксин сальмонелл приводит к дистрофическим изменениям в сердце с развитием токсического миокардита. Термин «миокардит» означает, что воспалительным процессом охвачен мышечный слой сердца. Это приводит к тому, что сердце перестает выполнять свои основные функции. В норме основной функцией сердца является «функция насоса», которая обеспечивает кровоснабжение по всему организму. Из-за поражения мышечного слоя сердце перестает эффективно сокращаться и качать кровь. Сокращения становятся слабыми, глухими, что объясняет брадикардию (редкие сердечные сокращения), артериальную гипотонию (снижение артериального давления). При обследовании пациента сердечные тоны глухие, слабые, артериальное давление низкое, пульс в пределах 50 ударов в минуту.
Следствием поражения сердца, является гипоксия или же кислородное голодание, нарушение водно-электролитного баланса, гиповолемия (уменьшение объема циркулирующей крови).
Поражение почек и легких
На фоне гиповолемии развивается синдром «шоковой почки» и «шокового легкого». Шоковая почка – это состояние, при котором нарушаются все функции почки — фильтрация, секреция и выделения. Диурез (суточный объем мочи) при этом осложнении резко снижается, вплоть до анурии. Вследствие нарушенной выделительной функции в организме начинают накапливаться продукты обмена – креатинин, мочевина. Это еще больше отягощает течение заболевания и обуславливает развитие инфекционно-токсического шока. Лечение шоковой почки должно быть экстренным и включать меры по восстановлению диуреза, выведению токсических продуктов обмена.
Еще одним следствием гиповолемии является шоковое легкое. При этом синдроме в альвеолах легких скапливается большое количество жидкости. Таким образом, легкие заполняются не воздухом, а водой, что лежит в основе отека легких. Пациенту становится трудно дышать, нарастает одышка.
Брюшной тиф часто путают с сыпным тифом, что является неверным. Сыпной тиф – это острое инфекционное заболевание, которое вызывается бактериями рода риккетсий. В отличие от брюшного тифа это заболевание не относится к кишечным инфекциям. Для сыпного тифа характерно преимущественное поражение нервной и сердечно-сосудистой системы. Передается данная инфекция, в основном через, вшей, чаще всего платяных и реже головных. Заражение происходит через укусы этих насекомых. Сами же вши заражаются от больных людей. Таким образом, платяные вши являются переносчиками заразы.
После того как вошь укусила больного человека, она может прожить от 30 до 45 дней. Укус вши является очень болезненным, из-за чего человек начинает болезненно расчесывать место укуса. Расчесывая укус, он втирает фекалии вши в кожу, посредством чего и происходит заражение. Далее риккетсии проникают в кровоток и разносятся кровью по всему организму. Мишенью для риккетсий являются эндотелиальные клетки, то есть структурные элементы сосудистой стенки. Развиваясь внутри сосудистой стенки, риккетсии разрушают ее, что приводит к деструкции кровеносных сосудов. Для сыпного тифа характерен феномен васкулита, то есть поражение эндотелиальной стенки сосудов. Это и обуславливает развитие в клинической картине заболевания таких симптомов как кровоизлияния в кожные покровы и в слизистые, увеличение селезенки, снижение артериального давления.
Еще одной отличительной особенностью сыпного тифа является поражение нервной системы. Сознание пациента спутанное, иногда могут развиваться признаки менингизма. Крайне тяжелым проявлением сыпного тифа является тифозный статус. Во время него у пациента отмечается психомоторное возбуждение, расстройства памяти, прогрессирует бессонница. Если же пациент засыпает, то ему сняться кошмарные сновидения. Иногда может развиваться бред, галлюцинации и другие психотические симптомы.
В эту категорию входят те последствия, которые характерны только для брюшного тифа. Наибольшим значением среди специфических последствий этого заболевания обладает инфекционно-токсический шок. Развивается такое состояние в разгар заболевания по причине массового поступления в кровь токсинов, которые выделяют брюшнотифозные бактерии. Эти токсины провоцируют спазм сосудов, в результате чего циркуляция крови нарушается.
Также токсины способствуют усиленному выбросу в кровь адреналина и других гормонов, которые усиливают сосудистый спазм. Кровь перестает выполнять свою транспортную функцию, что приводит к ишемии тканей (недостаточному кровоснабжению тканей) и к метаболическому ацидозу (повышенному содержанию в крови кислых продуктов). Все это становится причиной дегенеративных (разрушительных) изменений органов и тканей, отеков и других патологических состояний, которые могут привести к летальному исходу. Начинается инфекционно-токсический шок с увеличения температуры тела и развивается в несколько этапов.
Этапами инфекционно-токсического шока являются:
- Ранний. Сознание пациента сохраняется ясным, может наблюдаться тревога, двигательное беспокойство, отек лица и верхней половины туловища. Дыхание при этом учащенное, артериальное давление волнообразно повышается и снижается. У детей ранний этап обычно сопровождается рвотой, поносом, болями в животе (в верхней части).
- Выраженный. Тревожность и общее возбуждение первого этапа сменяется апатичным состоянием, двигательной заторможенностью. Кожные покровы пациента становятся бледными, холодными и влажными. Со временем возможно появление на коже кровоизлияний. Конечности приобретают синеватый оттенок. Температура и артериальное давление снижается, дыхание и пульс становятся слабыми. Резко уменьшается объем мочи. В этот период развиваются различные патологии со стороны почек, дыхательной системы.
- Декомпенсированный. Артериальное давление и температура тела продолжают падать. Пациента мучают судороги, возможна потеря сознания или кома. Кожа приобретает выраженный синий оттенок. Мочеиспускание отсутствует. Начинают проявляться симптомы дисфункции со стороны всех органов.
В эту группу входят заболевания, которые могут выступать в роли последствий не только брюшного тифа, но и других болезней. Брюшнотифозные бактерии кроме кишечника могут поражать и другие органы, провоцируя воспалительные процессы. Ситуация усложняется, когда к первичному воспалению присоединяется вторичная бактериальная инфекция.
К неспецифическим последствиям брюшного тифа относятся:
- со стороны дыхательной системы – пневмония (воспаление легочной ткани);
- со стороны сосудов – тромбофлебит (воспаление вен);
- со стороны сердца – миокардит (воспаление сердечной мышцы);
- со стороны почек – пиелит (воспаление в почечной лоханке), пиелонефрит (воспаление почечной ткани);
- со стороны нервной системы – периферический неврит (воспаление нервов), менингоэнцефалит (воспаление головного мозга и, в некоторых случаях, спинного мозга с последующим параличом);
- со стороны опорно-двигательного аппарата – артрит (воспаление суставов), хондрит (воспаление хрящевой ткани), периостит (воспаление надкостницы);
- со стороны мочеполовых органов – цистит (воспаление мочевого пузыря), простатит (воспаление простаты).
Основными симптомами, наличие которых вызывает подозрение на брюшной тиф, являются:
- сухость и бледность кожных покровов;
- повышенная температура;
- изменения языка – его увеличение, сухость и покрытие по центру налетом;
- появление красноватой сыпи на теле;
- диспепсические расстройства;
- проявления интоксикационного синдрома.
Когда у пациента наблюдаются подобные симптомы в течение 5 – 6 дней, необходимо сдать лабораторные анализы на брюшной тиф и пройти ряд диагностических исследований, посредством которых выявляется возбудитель заболевания.
Анализы на брюшной тиф назначаются как с целью выявления возбудителя болезни, так и для определения степени тяжести заболевания и контроля эффективности лечения.
К анализам, которые назначаются при диагностике брюшного тифа, относятся:
- общеклинические анализы;
- бактериологические анализы (посевы);
- серологические анализы.
Результаты общеклинических анализов указывают на присутствие воспалительного процесса в организме, на степень дегидратации и состояние организма больного в целом.
Бактериологические исследования помогают обнаружить самого возбудителя брюшного тифа в биологических жидкостях организма. К серологическим исследованиям прибегают с целью определения в организме человека антигенов возбудителя брюшного тифа. Серологические анализы особенно важны при диагностике бактерионосительства.
- реакция Видаля;
- реакция непрямой гемагглютинации;
- реакции флюоресцирующих антител.
Общеклинические анализы при брюшном тифе
Общеклинические анализы при брюшном тифе назначаются с момента обращения больного к врачу. Изменения в анализах не являются специфическими для данного заболевания, однако они помогают определить состояние организма больного в целом. Основными анализами являются гемограмма и общий анализ мочи.
Возможными изменениями клинического анализа крови при брюшном тифе являются:
- умеренное повышение лейкоцитов (белых клеток крови);
- лейкопения (уменьшение числа лейкоцитов);
- отсутствие эозинофилов (подвида лейкоцитов);
- умеренное повышение числа лимфоцитов (подвида безъядерных лейкоцитов);
- умеренное ускорение оседания эритроцитов.
Число лейкоцитов может быть повышенным только в первые дни заболевания. На протяжении последующей недели болезни их уровень резко падает. Лейкопения сохраняется на весь период выраженной клинической картины брюшного тифа.
Возможными изменениями в общем анализе мочи при брюшном тифе являются:
- присутствие белка;
- высокий уровень эритроцитов (красных клеток крови);
- высокий уровень цилиндров.
Ранняя специфическая диагностика брюшного тифа начинается с бактериологических исследований на основе посевов. В качестве материала для посева выступают различные биологические жидкости организма.
К биологическим жидкостям, которые используют для посева при брюшном тифе, относятся:
- кровь;
- моча;
- каловые массы;
- содержимое двенадцатиперстной кишки (желчь);
- грудное молоко.
Возбудителя брюшного тифа можно также обнаружить при бактериологическом исследовании розеол и костного мозга.
Для постановки диагноза забор биологических жидкостей должен проводиться до начала этиотропной терапии.
Посев крови
При ранней диагностике брюшного тифа чаще всего прибегают к посеву крови, в которой возбудитель легко обнаруживается даже в период инкубации. Лучше всего выполнять забор крови в период повышения температуры тела. В случае начала антибактериальной терапии кровь берется непосредственно перед тем как вводится следующая доза препарата. До 20 миллилитров крови засеваются на специальные жидкие питательные среды. Наиболее часто используемой средой для посева крови при брюшном тифе является среда Раппопорта, состоящая из бульона на основе желчи с добавлением глюкозы и специального красителя. Питательную среду с кровью помещают на 10 дней в инкубатор с температурой в 37 градусов Цельсия. Лаборанты проверяют посевы каждый день на наличие признаков роста бактериальных колоний – помутнение жидкости, изменение ее окраски. Если по окончании десяти дней рост отсутствует, результат анализа отрицательный. Если обнаруживаются признаки роста колоний, производят высевы на плотные среды в чашках Петри. Новые посевы вновь инкубируют при 37 градусах Цельсия в течение суток. В итоге на поверхности плотной среды разрастаются бактериальные колонии, которые подлежат идентификации при помощи ряда биохимических тестов. Параллельно с этим определяется также чувствительность бактерий к различным антибактериальным препаратам. Окончательные результаты гемокультуры получают через четверо суток.
Посев мочи
Исследование мочи на выявление возбудителя брюшного тифа можно проводить на протяжении всего периода болезни. Учитывая тот факт, что возбудитель выделяется с мочой непостоянно и кратковременно, посевы мочи следует повторять каждые 5 – 7 дней. Собранная моча должна быть доставлена в лабораторию для засева не позже двух часов с момента забора. Чем дольше хранится материал, тем больше шансов отмирания возбудителя или роста других бактерий. Урокультура получается тем же путем засева и инкубации, как и гемокультура.
Посев каловых масс
Посевы каловых масс для диагностики брюшного тифа выполняют, начиная со второй недели болезни. Забор испражнений производится при помощи стерильного шпателя, проволочной петли или ложечки. Для перевозки материала используется стерильный контейнер. В лаборатории готовится копрокультура путем посева кала на плотные питательные среды и инкубации при 37 градусах Цельсия в течение 18 – 24 часов.
Серологические анализы при диагностике брюшного тифа выявляют в крови больного особые антигены и антитела. Существует несколько основных антигенов, которые обнаруживаются при исследовании крови пациента.
Основными антигенами, которые обнаруживаются в крови больного при брюшном тифе, являются:
- О-антиген;
- Н-антиген;
- Vi-антиген.
О-антигены и Vi-антигены представлены частицами оболочек возбудителя, а Н-антигены являются структурными элементами жгутиков.
В качестве антител выступают особые белки, которые вырабатываются иммунной системой человека для нейтрализации антигенов возбудителя. Высокие уровни антител указывают на формирование стойкого иммунитета к возбудителю, что наблюдается в период выздоровления либо при бактерионосительстве. Антигены и антитела определяются в крови больного с помощью особых серологических реакций.
К реакциям серологического обследования на брюшной тиф относятся:
- реакция Видаля;
- реакция непрямой гемагглютинации;
- реакции флюоресцирующих антител.
Серологическую диагностику брюшного тифа проводят не раньше второй недели болезни.
Реакцией Видаля называется реакция прямой агглютинации (склеивания), которая позволяет определить присутствие О-антигена в сыворотке больного. Данная реакция широко применяется при диагностике брюшного тифа, однако она не является специфической, давая ложноположительные результаты за счет распознавания других видов сальмонелл. Для реакции Видаля необходимо 2 – 3 миллилитра венозной крови – обычно из локтевой вены. Кровь оставляют на некоторое время в пробирке до ее полного свертывания. Стерильным шприцем отсасывается образовавшаяся на поверхности сыворотка и помещается в другую пробирку. Реакция агглютинации состоит в поэтапном разведении сыворотки больного до соотношения 1 к 800 и добавлении специального диагностикума (антитела к искомым антигенам).
Этапами реакции Видаля являются:
- наполнение ряда пробирок по 1 миллилитру физиологического раствора;
- добавление 1 миллилитра сыворотки в первую пробирку и получение разведения 1 к 50;
- отсос пипеткой из первой пробирки 1 миллилитра и добавление его во вторую пробирку – получается разведение 1 к 100;
- повтор манипуляций до получения растворов в соотношении 1 к 800;
- добавление специального диагностикума в каждую пробирку;
- двухчасовая инкубация при 37 градусов Цельсия;
- последующее содержание пробирок при комнатной температуре в течение суток.
Реакция агглютинации проявляется в виде образования небольшого осадка на дне пробирки. Реакция Видаля является положительной, если агглютинация присутствует в пробирке с разведением 1 к 200 и более. Положительный результат может указывать не только на присутствие болезни, но и на возможное носительство. Для дифференциации этих состояний реакция повторяется через 5 – 6 дней. Если агглютинация появляется в пробирках с высокими титрами антител, это указывает на наличие болезни. У бактерионосителей титры антител не меняются при повторных исследованиях.
Реакция непрямой гемагглютинации
Реакция непрямой гемагглютинации является более специфической и чувствительной для диагностики брюшного тифа. С ее помощью определяются все три основных антигена возбудителя. В качестве диагностикума выступают эритроциты, сенсибилизированные к антигенам сальмонеллы. Методика выполнения реакции схожа с техникой реакции Видаля, однако разведения начинаются с 1 к 10. Гемагглютинация проявляется в виде образования осадка красного цвета на дне пробирки, похожего на перевернутый зонтик. Положительной считается реакция, при которой осадок образовался в пробирке с разведением 1 к 40 и более. При последующих анализах через 5 и 10 дней титры антител увеличиваются в 2 – 3 раза, особенно О-антител. Повышение титра Vi- и Н-антител наблюдается у больных в период выздоровления. Их уровень также может быть высок у носителей.
Реакции флюоресцирующих антител
С первых дней болезни возбудителя можно опознать при помощи реакций флюоресцирующих антител. Эти реакции заключаются в обнаружении антигенов возбудителя при помощи антител, отмеченных флюоресцирующими веществами. В биологический диагностический материал (кровь, кал, моча) добавляют «маркированные» антитела и изучают его при помощи специальных микроскопов. Когда антитело связывается с антигеном возбудителя, в микроскопе видно свечение. Предварительные результаты реакций готовы в течение одного часа, а окончательные – через 10 – 20 часов. Реакции флюоресцирующих антител достаточно специфичны и высокочувствительны, однако используются редко в диагностике брюшного тифа.
источник