Сальмонеллы (род Salmonella)
Брюшной тиф как самостоятельную нозологическую единицу впервые попытался выделить русский врач А. Г. Пятницкий еще в 1804 г. Род получил название в честь Д. Сальмона, который в 1885 г описал микроб, выделенный из свиньи и известный в настоящее время под названием S. Choleraesuis.
Возбудители брюшного тифа и паратифов (S. Typhi, S. Paratyphi В, S. Paratyphi A) Род включает лишь один вид — Salmonella enterica (S. enteritidis) и семь подвидов – патогенен для теплокровных лишь — S. Cholerae-suis. Для удобства будет использоваться не совсем корректная таксономия, раасматривающая серовары как виды (например – S. Typhi вместо Salmonella enterica, подвид Cholerae-suis серовар Typhi)
Брюшной тиф представляет собой острую антропонозную системную инфекцию, характеризующуюся циклическим течением, поражением лимфатического аппарата тонкого кишечника, бактериемией, лихорадкой, сыпью и интоксикацией организма.
Возбудителем брюшного тифа является S. Typhi, впервые обнаруженный К. Эбертом в 1880 г. в срезах селезенки, лимфатических узлов и пейеровых бляшек людей, умерших от брюшного тифа. В 1884 г. Т. Гаффки выделил возбудитель в чистой культуре. S. Paratyphi А, описанный А. Брионом и X. Кайзером, и S. Paratyphi В, описанный Г. Шоттмюллером, являются возбудителями паратифов, которые схожи с брюшным тифом по патогенезу, клиническим проявлениям и эпидемиологии заболевания. Брюшной тиф и паратифы являются антропонозами, т. е. S. Typhi, S. Paratyphi A, S. Paratyphi В вызывают заболевание только у человека.
Морфологические и Культуральные свойства. Подвижные грамотрицательные палочки, размером 0,7×1,5×2—5 мкм. Капсулу не образуют. Хорошо растут на простых питательных и желчесодержащих средах. На плотных средах могут образовывать колонии в R- и S-формах, на жидких — S-диффузное помутнение, R-осадок. Колонии в S-форме средних размеров, гладкие, блестящие, полупрозрачные, с голубоватым оттенком, R-сухие шероховатые. Серовар S. Schottmuelleri (S. Paratyphi В) при росте на плотных средах образует слизистые валики (феномен валообразования), колонии S. Typhi, имеющие Vi-Аг, мутные. На средах Эндо колонии всех трех сальмонелл бесцветны или розоватые, на агаре Плоскерева – бесцветные и выглядят более плотными и мутными , на висмут-сульфитном агаре – черно-коричневые с металлическим блеском, среда под колонией окрашивается в черный цвет (парататиф А – коричнево-зеленоватые). Жидкими средами обогащения при посеве крови является желчный бульон, при посеве содержащих дополнительную флору материалов (фекалий, желчи, мочи) — селенитовый бульон (пептон+NaHSeO3-ингибитор контаминирующей флоры и т. д.). На лакгозосодержащих дифференциальных средах образуют бесцветные колонии, на висмут-сульфитном агаре — колонии черного цвета.
Обладают выраженной биохимической активностью. По биохимическим свойствам род однороден. Основные биохимические свойства, необходимые для идентификации:
ф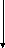
отсутствие ферментации лактозы,
— отсутствие индолообразования (в 1% пептонную воду) (среда Хисса). Среда Хисса – пептон+индикатор Андраде +набор углеводов-бесцветны, при образовании к-ты – малиновый цвет. Могут быть добавлены лошадиная или бычья сыворотка, при кислотообразовании – последняя сворачивается
S. Typhi по способности ферментировать ксилозу и арабинозу подраздиляются на 4 биохимических типа.
Антигенная структура и классификация.
— К-антигеном (Некоторые сальмонеллы) – разновидность – Vi-Аг
В связи с тем, что по основным биохимическим свойствам представители рода Salmonella однотипны, дифференциация внутри рода проводится по антигенной структуре.
Имеется несколько классификаций сальмонелл. Наиболее старой является классификация по Кауфману—Уайту. В основе этой классификации лежит подразделение сальмонелл на:
—серогруппы по общности строения О-антигена
-внутри серогруппы — на серовары, в соответствии с различиями в строении Н-антигена.
О-антиген состоит из R-ядра и боковой S-цепи. К S-цепи присоединяются сахара, которые называют рецепторами и обозначают цифрами. Критерием для объединения в серогруппу является общность конечного сахара, который по химической природе является 3,6 -д идезоксигексозой.
Н-антиген является двухфазным. Это связано с тем, что его синтез кодируется двумя независимыми генами, работа одного из которых исключает работу другого. Поэтому в каждой клетке может быть синтезирован только один белок (фаза). Первая фаза обозначается буквами, она считается специфической, вторая фаза — цифрами, ее принято считать неспецифической.
В таблице Кауфмана—Уайта (табл. 16.12) внутри серогруппы серовары расположены в алфавитном порядке. В прежних классификациях каждый серовар соответствовал виду, которых насчитывалось более 2500.
Согласно последней классификации, род Salmonella состоит из двух видов — вида S. enterica, в который включены все сальмонеллы, являющиеся возбудителями человека и теплокровных животных, и вида & bongori, который подразделяется на 10 сероваров и включает в себя сальмонеллы, изолированные от холоднокровных животных.
Вид S. enterica разделен на 6 подвидов, которые в свою очередь подразделены на серовары. Все серовары подвида enterica имеют названия, которые соответствуют прежним видовым названиям. Например: S. typhi — S. Typhi.
Некоторые серовары сальмонелл, в частности S. Typhi, имеют полисахаридный Vi-антиген, являющийся разновидностью К-антигена. Vi-антиген по химической структуре является полимером N-ацетилгалактозоаминоуроновой кислоты. Этот антиген является рецептором для бактериофагов. По спектру чувствительности к набору Vi-фагов устанавливается фаговар S. Typhi, который необходим для эпидемического анализа вспышек брюшного тифа с целью определения источника инфекции. Vi-антиген (находясь более поверхностно) может придавать бактерии явление О-инагглютинабельности. Напротив утрата Vi-антигена ведет к высвобождения О-Аг и восстановлению О-агглютинации, но при этом утрачивается Vi- агглютинация. Количественное содержания Vi-антигена может сильно варьировать, поэтому Кауфман предложил классифицировать S. Typhi по содержанию Vi-антигена на три группы:
Патогенность и патогенез. Сальмонеллы обладают множественностью факторов патогенности, многие из которых еще недостаточно изучены. Совокупность действия факторов патогенности обеспечивает сальмонеллам трансцитоз, т. е. инвазию слизистой через М-клетки, а также резистентность к фагоцитозу, позволяющую сальмонеллам сохраняться и размножаться внутри фагоцитов. Трансцитоз обеспечивается белками секреторной системы 3 типа, синтез которых детерминируется «островком патогенности 1», среди которых имеется белок наружной мембраны инвазии. Особенность синтеза этих белков заключается в том, что он индуцируется в среде с высоким осмотическим давлением, соответствующим таковому в тонком кишечнике.
Резистентность к фагоцитозу обеспечивается многими факторами. В этом процессе принимают участие продукты генов, расположенных на «островке патогенности 2», синтез которых индуцируется внутрифагоцитарным окружением. Установлено, что в формировании антифагоцитарной активности сальмонелл принимает также участие фермент су-пероксиддисмутаза, инактивирующая О2-ра-дикалы.
Все сальмонеллы обладают эндотоксином, который вызывает развитие лихорадки в случае бактериемии, вызванной сальмонеллами. При достижении критической концентрации эндотоксин активирует каскад арахидоновои кислоты в тканях. Некоторые сальмонеллы образуют белковый энтеротоксин, который обладает гомологией с холерным энтероток-сином и LT-токсином ЭТКП.
Попав после перорального заражения в тонкий кишечник, сальмонеллы инвазиру-ют трансцитозом слизистую кишечника через М-клетки без повреждения слизистой. Из М-клеток сальмонеллы транспортируются в субэпителиальное пространство, где захватываются макрофагами и привносятся в прилегающие к М-клеткам пейеровы бляшки, где, размножаясь в макрофагах, формируют первичный очаг инфекции
Резистентность. Сальмонеллы устойчивы к воздействию факторов внешней среды. Выдерживают рН в диапазоне 4—9; в водоемах, сточных водах, почве сохраняют жизнеспособность до 3 месяцев, в комнатной пыли — от 80 до 550 дней. Хорошо переносят низкие температуры. В зараженных продуктах сохраняются:
в колбасе — 3 месяца, в замороженном мясе и яйцах — до 1 года, на овощах и фруктах — 5—10 дней. При нагревании до 56 «С сальмонеллы гибнут в течение 45—60 мин, температура 100 °С убивает их мгновенно. Растворы дезинфицирующих веществ (5% фенол, 3% хлорамин, 3% лизол) убивают сальмонеллы в течение 2—3 мин. При неблагоприятных условиях сальмонеллы могут переходить в некультиви-руемую форму.
Вызываемые заболевания. В зависимости от источника инфекции, путей передачи и особенностей патогенеза и форм проявления инфекционного процесса, среди заболеваний, вызываемых сальмонеллами, различают: брюшной тиф и паратифы, сальмонеллезы, госпитальный (нозокомиальный) сальмонеллез.
Источником инфекции является больной или бактерионоситель, которые выделяют возбудитель во внешнюю среду с испражнениями, мочой, слюной. Возбудители этих инфекций, как и другие сальмонеллы, устойчивы во внешней среде, сохраняются в почве, воде. Благоприятной для них средой являются пищевые продукты (молоко, сметана, творог, мясной фарш, студень), в которых сальмонеллы способны размножаться.
1.-водным путем, играющим в настоящее время существенную роль,
Заражающая доза равняется приблизительно 1000 клеток. Естественная восприимчивость людей к возбудителям тифа и паратифа высокая.
Патогенез и клиника. Сформировав первичный очаг инфекции в пейеровых бляшках, после инвазии трансцитиозом слизистой тонкого кишечника, возбудители тифа и паратифов вызывают их воспаление с развитием лимфаденита. В результате воспаления нарушается их барьерная функция, и сальмонеллы попадают в кровь, вызывая бактериемию. Это совпадает с концом инкубационного периода, который длится 10—14 суток. Во время бактериемии, которая сопровождает весь лихорадочный период, возбудители тифа и паратифов с током крови разносятся по организму, оседая в ретикулоэндотелиальных элементах паренхиматозных органов: печени, селезенке, легких, а также в костном мозге, где размножаются в макрофагах, а также в желчном пузыре, куда они попадают по желчным протокам, диффундируя из Купферовских клеток печени. К концу 2-й недели заболевания возбудитель начинает выделяться из организма с мочой, путом, материнским молоком, слюной. Накапливаясь в желчном пузыре, сальмонеллы вызывают его воспаление и с током желчи реинфицируют тонкий кишечник. Повторное внедрение сальмонелл в сенсибилизированные пейеровы бляшки приводит к развитию в них гиперергического воспаления по типу феномена Артюса, их некрозу и изъязвлению, что может привести к кишечному кровотечению и прободению кишечной стенки. Выделяются сальмонеллы из организма с испражнениями и мочой.
Клиника брюшного тифа и паратифов характеризуется циклическим течением и проявляется лихорадкой (повышение температуры до 39—40°), интоксикацией, появлением розеолезной сыпи, нарушениями со стороны нервной системы (бред, галлюцинации) и сердечно-сосудистой системы (падение кровяного давления, коллапс и др.). Паратифы протекают в основном так же, как брюшной тиф.
Иммунитет. Иммунитет после перенесенного заболевания напряженный и длительный. Протективный иммунный ответ обеспечивается синергичным действием клеточного иммунного ответа, в котором ведущая роль принадлежит активированным макрофагам.
Гуморальный иммунитет самостоятельно не обладает протективной активностью, а является свидетелем инфекционного процесса.
-Причем первыми к концу 1-й недели заболевания появляются антитела к О-антигену, которые максимальных титров достигают к разгару заболевания, а затем исчезают.
—Антитела к Н-антигену появляются в период реконвалесценции и у привитых лиц и длительно сохраняются.
— У бактерионосителей брюшного тифа обнаруживаются антитела к Vi-антигену. Возникновение бактерионосительства связано с функциональной недостаточностью макрофагов.
Микробиологическая диагностика. Учитывая цикличность течения заболеваний, материал для исследования и метод исследования определяются стадией течения болезни.
В первые дни заболевания наблюдается бактериемия, поэтому на 1-й неделе заболевания и в течение всего лихорадочного периода используют метод гемокультуры: посев крови в желчный бульон с последующим пересе-
вом на дифференциально-элективные среды (Эндо, Плоскирева, висмут-сульфитный агар). Выделенную культуру идентифицируют по биохимическим свойствам и антигенной структуре, а выделенную культуру S. Typhi типируют Vi-фагами для определения источника инфекции. С конца 2-й недели заболевания производят выделение копро-, урино- и биликультур, т. е. материалом для исследования являются моча, испражнения, желчь.
Начиная со 2-й недели заболевания проводят серологическое исследование с целью определения наличия и типа антител. Исследование проводится постановкой РНГА. РНГА ставят с О-, Н- и Vi-диагностикумами. Положительным считают диагностический титр не менее 1:200. Ранее для серологической диагностики применяли развернутую реакцию агглютинации Видаля. В настоящее время серологическое исследование проводят также постановкой ИФА.
диагностика бактерионосительства- Диагностика бактерионосительства. Единственным доказательством бактерионосительства ляются выделение от носителя культур . Материалом исследования являются дуоденальное содержимое, испражнения и моча. Сложность проблемы чается в том, что у носителей возбудитель не всегда выделяется е этими субстратами, бывают па; и довольно продолжительные. В качестве вспомогательных методов, которые позволяют сузить обследуемых лиц, используют серологические реакции (одновременное обнаружение О, Н-, Vi-или О-, Vi-антител говорит о возможном присутствии возбудителя в организме) и аллергическую пробу с Vi-тифином. Последний содержит Vi-антиген, который при взаимодействии с Vi-aнтителом дает местную аллергическую реакцию в виде покраснения и припухлости в течение 20-30 минут Положительная реакция с Vi-тифином свидетельствует о наличии в организме Vi-антител и о возможности носительства. Исследование тампонов одновременно забрасываемых в канализационные люки населенного пункта.
Профилактика и Лечение. Для специфической профилактики брюшного тифа используют брюшнотифозную сорбированную и брюшнотифозную спиртовую, обогащенную Vi-антигеном, вакцины. Для профилактики, по эпидемическим показаниям, лицам, которые проживают совместно с больным и которые употребляли продукты и воду, зараженные или подозрительные на заражение S. Typhi, назначают сухой брюшнотифозный бактериофаг.
Лечение — этиотропная антибиотикотерапия.
Не специфическая профилактика включает: санитарно-бактериологический контроль за системами водоснабжения, соблюдение санитарно-гигиенических правил при приготовлении пищи, выявление бактерионосителей среди работников пищеблоков, торговли, своевременное выявление и изоляцию больных.
источник
Возбудитель брюшного тифа Salmonella typhi был впервые об-
наружен в 1880 г. К. Эбертом в органах людей, погибших от брюшного тифа. Позже у больных, у которых наблюдалась клиническая картина брюшного тифа, были обнаружены палочки, по биохимическим и серологическим свойствам отличающиеся от палочки брюшного тифа. Они были названы Г. Шоттмюллером палочками паратифа А и В. Современные их названия: Salmonella paratyphi A, Salmonella paratyphi B (schottmuelleri).
Морфология, культуральные биохимические свойства. Сальмонеллы брюшного тифа и паратифов — это короткие палочки с закругленными концами, в среднем 1-2 мкм длиной. Все они подвижны (перитрихи), спор и капсул не образуют. Грамотрицательны.
Факультативные анаэробы. Хорошо растут на простых питательных средах, при рН 7,2-7,4, оптимум роста при 37 о С. Элективной средой для них являются среды, содержащие желчь, которая препятствует росту кишечных палочек и других бактерий.
Ферментативные свойства сальмонелл используются для определения вида (Таблица 5). В отличие от эшерихий, сальмонеллы не сбраживают лактозу и сахарозу, сбраживают глюкозу и маннит, причем палочка брюшного тифа только до кислоты, а паратифозные палочки — до кислоты и газа. Палочка паратифа А, в отличие от палочки паратифа В, не образует сероводорода.
Антигены. Сальмонеллы содержат О-антигены, Н-антигены и К-антиген. Идентификация проводится по антигенной структуре в соответствии с классификацией, разработанной Кауфманом и Уайтом (Таблица 6). По этой схеме все сальмонеллы по О-антигенам разделены на группы: A, B, C, D, E и т.д. каждая группа имеет специфический О-антиген (например, в группе D — это О9). Некоторые группы имеют общие О-антигены (например, группы F, B и D имеют общий антиген о12). S. typhi, ее вирулентные штаммы, содержат Vi-антиген, который располагается более поверхностно, чем О-антиген. У Н-антигенов сальмонелл различают I и II фазу. По I (специфической) фазе внутри групп сальмонеллы делятся на виды.
Пользуясь схемой Кауфмана-Уайта, определяют виды сальмонелл: с помощью монорецепторных О-сывороток определяют группу, к которой принадлежит выделенная культура сальмонелл, с помощью Н-сывороток определяют вид. Таблица 7.
СХЕМА АНТИГЕННОЙ СТРУКТУРЫ САЛЬМОНЕЛЛ (ПО КАУФМАНУ-УАЙТУ) 1
| Группа | Наименование бактерий | Антигены | ||
| соматиче- ский | жгутиковый | |||
| первая фаза (специфи- ческая) | вторая фаза (неспецифическая) | |||
| А B C D E | S. paratyphi A S. scottmuelleri S. typhimurium S. heidelberg S. reading S. cholerae suis S. paratyphi C S. newport S. typhi S. enteritidis S. dublin S. moscow S. anatum S. london S. cambridge | 1, 2, 12 1, 4, 5, 12 1, 4, 5, 12 4, 5, 12 4, 12 6, 7 6, 7, Vi 6, 8 9, 12, Vi 9, 12 1, 9, 12 9, 12 3, 10 3, 10 3, 15 | a b i r e, h c j e, h d g, m g, p g, q e, h l, v e, h | — 1, 2 1, 2 1, 2 1, 5 1, 5 1, 5 1, 2 — — — — 1, 6 1, 6 1, w |
1 Печатается в сокращенном виде.
Факторы патогенности. Сальмонеллы не продуцируют экзотоксина, содержат эндотоксин, который выделяется при их гибели, разрушении. Патогенность их связана также со способностью проникать в клетки и размножаться в них (инвазивность).
Устойчивость. Возбудители тифо — паратифозных инфекций относительно устойчивы во внешней среде. В воде открытых водоемов, в почве, куда они попадают с испражнениями людей, они могут сохраняться в течение 1-3 месяцев, на овощах и фруктах 5-10 дней,во льду — до 2 месяцев. При 50 о С погибают в течение часа, при100 о С — немедленно. Дезинфицирующие вещества убивают их в течение нескольких минут.
Заболевания у человека. Брюшным тифом болеет только человек. Источником заражения являются больные люди и бактерионосители. Механизм заражения фекально-оральный. Возбудители проникают через рот, попадают в тонкий кишечник, размножаются в лимфатических тканях тонкого кишечника. Это происходит в инкубационном периоде, который длится в среднем 10-14 дней. Затем бактерии проникают в кровь, наступает бактериемия — начало заболевания. С током крови они разносятся по всему организму, внедряясь в печень, селезенку, почки, костный мозг. Бактерии разрушаются, выделяется эндотоксин, вызывающий интоксикацию. Попадая из печени в желчный пузырь, возбудители находят здесь благоприятные условия для размножения и вместе с желчью на третьей неделе заболевания вновь поступают в кишечник, в лимфатические образования. В результате повторного заноса бактерий в уже сенсибилизированные лимфатические ткани развивается воспаление аллергического характера, приводящее к некрозу и образованию язв. Это может привести к опасным последствиям: кровотечению из язв и прободению кишечника. Сальмонеллы в это время выводятся из организма с испражнениями и мочой.
У некоторых больных возбудители могут обнаруживаться в испражнениях и моче после выздоровления в течение нескольких месяцев, а иногда и лет. Бактерии сохраняются у них в желчном пузыре, откуда время от времени попадают в кишечник и выделяются с испражнениями, а у некоторых носителей — через почки выделяются с мочой.
Бактерионосители представляют опасность для окружающих как возможный источник инфекции.
Иммунитет. Во время болезни вырабатываются антитела, титр которых нарастает со второй недели болезни. Антитела способствуют лизису бактерий, усилению фагоцитоза. Определение антител используется для диагностики. Возникновение рецидивов болезни и бактерионосительства объясняется недостаточностью иммунитета.
Микробиологическая диагностика. На первой неделе заболевания берут кровь для выделения гемокультуры. С соблюдением правил асептики из локтевой вены берут кровь в количестве 10 мл, засевают в 100 мл желчного бульона, направляют в лабораторию. Выделенную чистую культуру (гемокультуру) идентифицируют по морфологии, биохимическим свойствам и антигенной структуре, определяют фаговар.
Начиная с третьей недели заболевания, возбудителя выделяют из испражнений, мочи, желчи.
В сыворотке крови определяют антитела, титр которых нарастает к концу первой — началу второй недели заболевания. Ставят реакцию агглютинации по Видалю, РНГА с эритроцитарными диагностикумами, ИФА.
Для выявления бактерионосительства исследуют с целью обнаружения возбудителя испражнения, мочу, желчь; с целью обнаружения Vi-антигена ставят РНГА с эритроцитарным Vi-диагностикумом.
Профилактические и лечебные препараты. Массовой вакцинации не проводится, так как заболеваемость носит спорадический характер. Существуют химическая брюшнотифозная вакцина, содержащая О-антиген (применяется по показаниям), и лечебная брюшнотифозная убитая (спиртовая) вакцина, обогащенная Vi-антигеном. Лицам, которые были в контакте с больным, назначают брюшнотифозный бактериофаг. Из антибиотиков чаще всего применяют левомицетин.
Сальмонеллы — возбудители гастроэнтероколитов (сальмонеллезов)
Сальмонеллы чаще всего вызывают пищевые токсикоинфекции. В последнее время описаны внутрибольничные сальмонеллезы, возбудители которых являются «госпитальные» штаммы сальмонелл.
Сальмонеллы — возбудители пищевых токсикоинфекций
Пищевые токсикоинфекции — это острые кишечные заболевания, возникающие в результате употребления пищи, обсемененной сальмонеллами. Возбудителями являются нетифозные сальмонеллы. По схеме Кауфмана-Уайта известно около 700 сероваров, вызывающих гастроэнтероколит, чаще всего это S. typhimurium, S. enteritidis, S. heidelberg, S. choleraesuis, S. anatum, S, infantis. Они относительно устойчивы к действию внешних факторов и способны размножаться в пищевых продуктах. Соление и копчение не убивает их. Большинство патогенных для человека сальмонелл вызывают заболе-
вания у животных (домашние животные и птицы, грызуны).
Заболевание у человека. Чаще всего заболевание связано с употреблением в пищу мяса крупного рогатого скота, кур и яиц. Мясо может быть инфицировано при жизни больного животного или после убоя, при разделке туши, хранении мяса и приготовлении и хранении готовых блюд. Чаще всего это мясные, молочные продукты, а также кондитерские изделия, содержащие яйца, не подвергнутые термической обработке.
Для возникновения заболевания имеет значение количество сальмонелл, которые попали с пищей в желудок. При массовой их гибели освобождается эндотоксин, который попадает в кровь и вызывает интоксикацию уже через несколько часов после приема пищи. В некоторых случаях сальмонеллы проникают в кровь, вызывая кратковременную бактериемию.
Развитие болезни связано с действием самих возбудителей и их эндотоксина, то есть это токсикоинфекция. Основные симптомы: боли в животе, тошнота, рвота, частый жидкий стул, озноб, повышение температуры тела. Заболевание продолжается не более 4-5 дней. Возбудители быстро исчезают из крови и кишечника. Лица в окружении больного не заражаются.
Иммунитет. В крови больных и реконвалесцентов обнаруживаются антитела, и это можно использовать для диагностики. После перенесения заболевания невосприимчивости не создается.
Микробиологическая диагностика. Исследуемым материалом служат рвотные массы, промывные воды желудка, испражнения, моча, кровь, остатки пищи, которую употребляли заболевшие. Проводятся бактериологические исследования, выделенную чистую культуру идентифицируют по морфологии, биохимическим свойствам и по антигенной структуре в соответствии со схемой Кауфмана-Уайта с помощью монорецепторных сывороток.
В сыворотке крови определяют антитела с помощью реакции агглютинации с возбудителем, выделенным из исследуемых материалов и со стандартными диагностикумами, а также РНГА с эритроцитарными диагностикумами. Диагностическое значение имеет нарастание титра антител в парных сыворотках крови, взятых в первый день заболевания и на второй неделе. Сальмонеллы — возбудители внутрибольничных инфекций
Возбудителями внутрибольничного сальмонеллеза являются
«госпитальные» штаммы сальмонелл, чаще всего Salmonella typhimurium. В отличие от «диких» (природных) штаммов тех же видов, они не вызывают гибели мышей при заражении через рот, но более патогенны для человека, и обладают множественной лекарственной устойчивостью блакодаря наличию R-плазмид. «Госпитальные» штаммы обнаружены также среди S. enteritidis.
Заболевание у человека. Источником инфекции являются больные люди. Распространение внутрибольничных сальмонеллелоз происходит контактно-бытовым, воздушно-пылевым и пищевым путем.
Проявления болезни разнообразны: бессимптомные бактерионосительство, легкие формы, тяжелые кишечные расстройства с интоксикацией, бактериемией, иногда с септическими осложнениями. Особенно тяжело протекает болезнь у детей раннего возраста.
Микробиологическая диагностика. Исследуются испражнения, кровь. Выделенные чистые культуры идентифицируют по морфологии, биохимическим свойствам, антигенной структуре.
Профилактика и лечение. Необходимо соблюдение санитарно-гигиенического режима в лечебных учреждениях, на предприятиях общественного питания; выявление носителей сальмонелл и санация их. С целью экстренной профилактики внутрибольничной инфекции назначают поливалентный сальмонеллезный бактериофаг детям, контактировавшим с больными и носителями, а также матерям.
Антибактериальные препараты (левомицетин, ампициллин) применяют для лечения больных генерализованными формами сальмонеллеза.
Не нашли то, что искали? Воспользуйтесь поиском:
источник
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Брюшной тиф — тяжелое острое инфекционное заболевание, характеризующееся глубокой общей интоксикацией, бактериемией и специфическим поражением лимфатического аппарата тонкого кишечника. Интоксикация проявляется сильной головной болью, помрачением сознания, бредом (тиф от греч. typhos — туман). Брюшной тиф как самостоятельную нозологическую единицу впервые попытался выделить русский врач А. Г. Пятницкий еще в 1804 г., но окончательно это сделал в 1822 г. Р. Бретонно, который дифференцировал эту болезнь от туберкулеза кишечника и высказал предположение о контагиозной природе брюшного тифа.
Возбудитель брюшного тифа — Salmonella typhi — был обнаружен в 1880 г. К. Эбертом, а выделен в чистой культуре в 1884 г. К. Гаффки. Вскоре были выделены и изучены возбудители паратифов А и В — S. paratyphi А и S. paratyphi В. Род Salmonella включает в себя большую группу бактерий, но только три из них — S. typhi, S. paratyphi А и S. paratyphi В — вызывают заболевание у человека с клинической картиной брюшного тифа. Морфологически они неразличимы — короткие грамотрицательные палочки с закругленными концами, длиной 1-3,5 мкм, диаметром 0,5-0,8 мкм; спор и капсул не образуют, обладают активной подвижностью (перитрихи). Содержание Г + Ц в ДНК составляет 50-52 мол %.
Возбудители брюшного тифа и паратифов — факультативные анаэробы, температурный оптимум для роста 37 °С (но могут расти в диапазоне от 10 до 41 °С), рН 6,8-7,2; не требовательны к питательным средам. Рост на бульоне сопровождается помутнением, на МПА образуются нежные круглые, гладкие, полупрозрачные колонии диаметром 2-4 мм. Однако колонии S. typhi, имеющие Vi-антиген, мутные. Колонии S. paratyphi В более грубые, через несколько дней у них по периферии формируются своеобразные валики. На средах Эндо колонии всех трех сальмонелл бесцветны, на висмут-сульфитагаре — черного цвета. В случае диссоциации на плотных средах вырастают колонии R-формы. Избирательной средой для возбудителей брюшного тифа и паратифов является желчь или желчный бульон.

Возбудители брюшного тифа и паратифов дают положительную реакцию с MR, не образуют индола, не разжижают желатин, восстанавливают нитраты в нитриты, не образуют ацетоина. S. typhi не растет на голодном агаре с цитратом. Основные биохимические различия между возбудителями брюшного тифа и паратифов заключаются в том, что S. typhi ферментирует глюкозу и некоторые другие углеводы с образованием только кислоты, a S. paratyphi А и S. paratyphi В — с образованием и кислоты, и газа.
S. typhi по способности ферментировать ксилозу и арабинозу подразделяют на четыре биохимических типа: I, II, III, IV.

Сальмонеллы имеют О- и Н-антигены. По О-антигенам они разделяются на большое количество серогрупп, а по Н-антигенам — на серотипы (подробнее о серологической классификации сальмонелл см. в следующем разделе). S. typhi, S. paratyphi А и S. paratyphi В отличаются друг от друга как по О-антигенам (относятся к разным серогруппам), так и по Н-антигенам..
В 1934 г. А. Феликс и Р. Питт установили, что S. typhi помимо О- и Н-антигенов имеет еще один поверхностный антиген, который они назвали антигеном вирулентности (Vi-антигеном). По химической природе Vi-антиген отличается от О- и Н-антигенов, он состоит из трех различных фракций, но его основу составляет сложный полимер N-ацетилгалактозаминоуроновая кислота с м. м. 10 МД. Vi-антиген, как правило, обнаруживается у свежевыделенных культур, но он легко утрачивается под влиянием различных факторов (в частности, при выращивании при температуре выше 40 °С и ниже 20 °С, на средах с карболовой кислотой и т. п.), при длительном хранении культур, разрушается при температуре 100 °С в течение 10 мин. Поскольку он располагается более поверхностно, чем О-антиген, его наличие препятствует агглютинации культуры S. typhi О-специфической сывороткой, поэтому такую культуру обязательно проверяют в реакции агглютинации с Vi-сывороткой. Напротив, утрата Vi-антигена ведет к освобождению О-антигена и восстановлению О-агглютинации, но при этом утрачивается Vi-агглютинация. Количественное содержание Vi-антигена у S. typhi может сильно варьировать, поэтому Ф. Кауффманн предложил классифицировать S. typhi по содержанию Vi-антигена на три группы:
- чистые v-формы (нем. viel — много);
- чистые w-формы (нем. wenig — мало);
- промежуточные vw-формы.
Обнаружены 3 необычных мутанта S. typhi: Vi-I — R-форма, клетки лишены Н- и О-антигенов, но стойко сохраняют Vi-антиген; О-901 — лишен Н- и Vi-антигенов; Н-901 — содержит О- и Н-антигены, но лишен Vi-антигена. Все три антигена: О-, Н- и Vi- имеют выраженные иммуногенные свойства. Наличие Vi-антигенов позволяет подвергать культуры S. typhi фаготипированию. Есть 2 типа фагов, лизирующих только те культуры, которые содержат Vi-антиген: Vi-I — универсальный фаг, лизирует большинство Vi-содержащих культур S. typhi; и набор Vi-II-фагов, лизирующих избирательно культуры S. typhi. Впервые это было показано в 1938 г. Дж. Крейджем и К. Иеном. С помощью Vi-фагов II типа они разделили S. typhi на 11 фаготипов. К 1987 г. было выявлено уже 106 различных Vi-фаготипов S. typhi. Чувствительность их к соответствующим фагам является стабильным признаком, поэтому фаготипирование имеет важное эпидемиологическое значение.
Разработаны также схемы фаготипирования S. paratyphi А и S. paratyphi В, по которым они разделяются на десятки фаготипов. Существенно, что фаготипы сальмонелл могут ни по каким другим признакам не отличаться друг от друга.

Возбудители брюшного тифа и паратифов во внешней среде (вода, почва, пыль) сохраняются, в зависимости от условий, от нескольких дней до нескольких месяцев. В проточной воде могут выживать до 10 дней, в застойной — до 4 нед., на овощах и фруктах — 5-10 дней, на посуде — до 2 нед., в масле, сыре — до 3 мес, во льду — до 3 мес. и больше; нагревание при температуре 60 °С убивает через 30 мин, а кипячение — мгновенно. Обычные химические дезинфектанты убивают их через несколько минут. Содержание в водопроводной воде активного хлора в дозе 0,5-1,0 мг/л или озонирование воды обеспечивают ее надежное обеззараживание как от сальмонелл, так и от других патогенных кишечных бактерий.
Важнейшей биологической особенностью возбудителей брюшного тифа и паратифов А и В является их способность противостоять фагоцитозу и размножаться в клетках лимфоидной системы. Экзотоксинов они не образуют. Основным фактором патогенности их, помимо Vi-антигена, является эндотоксин, отличающийся необычно высокой токсичностью. Такие факторы патогенности, как фибринолизин, плазмокоагулаза, гиалуронидаза, лецитиназа и т. п., обнаруживаются у возбудителей брюшного тифа и паратифов очень редко. С наибольшей частотой встречается ДНК-аза (у 75-85 % изученных культур S. typhi и S. paratyphi В). Установлено, что штаммы S. typhi, имеющие плазмиду с м. м. 6 МД, обладают более высокой вирулентностью. Поэтому вопрос о факторах патогенности этих сальмонелл остается еще мало изученным.

Прочный, продолжительный, повторные заболевания брюшным тифом и паратифами бывают редко. Иммунитет обусловлен появлением антител к Vi-, О- и Н-антигенам, клеток иммунной памяти и повышением активности фагоцитов. Поствакцинальный иммунитет, в отличие от постинфекционного, непродолжителен (около 12 мес).
Источником брюшного тифа и паратифа А является только человек, больной или бактерионоситель. Источником паратифа В, кроме человека, могут быть и животные, в том числе птицы. Механизм заражения — фекально-оральный. Заражающая доза S. typhi 105 клеток (вызывает заболевание 50 % добровольцев), заражающие дозы сальмонелл паратифов А и В значительно выше. Заражение происходит главным образом в результате прямого или непрямого контакта, а также через воду или пищу, особенно молоко. Наиболее крупные эпидемии вызывало инфицирование возбудителями водопроводной воды (водные эпидемии).

Инкубационный период при брюшном тифе 15 дней, но он может варьировать от 7 до 25 дней. Это зависит от заражающей дозы, вирулентности возбудителя и иммунного статуса больного. Патогенез и клиническая картина брюшного тифа и паратифов А и В очень сходны. В развитии болезни четко выявляются следующие стадии:
- стадия вторжения. Возбудитель через рот проникает в тонкий кишечник;
- через лимфатические пути сальмонеллы проникают в лимфоидные образования подслизистой оболочки тонкого кишечника (пейеровы бляшки и солитарные фолликулы) и, размножаясь в них, вызывают лимфангоит и лимфаденит (своеобразные брюшно-тифозные гранулы);
- бактериемия — выход возбудителя в большом количестве в кровь. Стадия бактериемии начинается в конце инкубационного периода и может (в отсутствие эффективного лечения) продолжаться в течение всей болезни;
- стадия интоксикации наступает вследствие распада бактерий под действием бактерицидных свойств крови и высвобождения эндотоксинов;
- стадия паренхиматозной диффузии. Из крови сальмонеллы поглощаются макрофагами костного мозга, селезенки, лимфатических узлов, печени и других органов. В большом количестве возбудитель брюшного тифа накапливается в желчных ходах печени и в желчном пузыре, где он находит благоприятные условия для своего размножения и где бактерицидные свойства крови ослаблены влиянием желчи;
- выделительно-аллергическая стадия. По мере формирования иммунитета начинается процесс освобождения от возбудителя. Этот процесс осуществляют все железы: слюнные, кишечника, потовые, молочные (во время кормления ребенка), мочевыделительная система и особенно активно — печень и желчный пузырь. Выделяющиеся из желчного пузыря сальмонеллы опять поступают в тонкий кишечник, откуда часть их выделяется с испражнениями, а часть вторгается вновь в лимфатические узлы. Вторичное внедрение в уже сенсибилизированные узлы вызывает в них гиперергическую реакцию, которая проявляется в виде некроза и образования язв. Эта стадия опасна возможностью прободения стенки кишечника (язв), внутреннего кровотечения и развития перитонита;
- стадия выздоровления. Процесс заживления язв происходит без возникновения обезображивающих рубцов на местах, очистившихся от некротических налетов.
В свою очередь, в клинической картине болезни различают следующие периоды:
- I начальная стадия — stadium incrementi (1-я неделя): постепенное повышение температуры до 40-42 °С, нарастание интоксикации и других проявлений болезни.
- II — стадия максимального развития всех симптомов — stadium acme (2-3-я недели болезни): температура держится на высоком уровне;
- III — стадия спада болезни — stadium decrementi (4-я неделя болезни): постепенное снижение температуры и ослабление проявления других симптомов;
- IV — стадия выздоровления.
На 8-9-й день болезни, а иногда и позднее, у многих больных появляется розеолезная сыпь на коже живота, груди и спины. Появление сыпи (мелких красных пятен) является следствием местных продуктивно-воспалительных процессов аллергической природы в поверхностных слоях кожи около лимфатических сосудов, которые в изобилии содержат возбудителя болезни. Клиническое выздоровление не всегда совпадает с бактериологическим. Примерно 5 % переболевших становятся хроническими носителями сальмонелл тифа или паратифов. Причины, лежащие в основе длительного (более 3 мес, а иногда многие годы) носительства сальмонелл, остаются неясными. Известное значение в формировании носительства играют местные воспалительные процессы в желчевыводящих (иногда в мочевыводящих) путях, которые часто возникают в связи с тифо-паратифозными инфекциями или обостряются в результате этих инфекций. Однако не менее важную роль в формировании длительного носительства сальмонелл брюшного тифа и паратифов А и В играет L-трансформация их. L-формы сальмонелл утрачивают Н-, частично 0-и Vi-антигены, располагаются, как правило, внутриклеточно (внутри макрофагов костного мозга), поэтому становятся не доступными ни для химиопрепаратов, ни для антител и могут длительно персистировать в организме переболевшего человека. Возвращаясь в исходные формы и полностью восстанавливая свою антигенную структуру, сальмонеллы вновь становятся вирулентными, вновь проникают в желчные ходы, вызывают обострение процесса бактерионосительства, выделяются с испражнениями, а такой носитель становится источником заражения для окружающих. Не исключено также, что формирование бактерионосительства зависит от какого-то дефицита иммунной системы.
Самым ранним и основным методом диагностики брюшного тифа и паратифов является бактериологический — получение гемокультуры или миелокультуры. С этой целью исследуют кровь или пунктат костного мозга. Кровь лучше засевать на среду Рапопорт (желчный бульон с добавлением глюкозы, индикатора и стеклянного поплавка) в соотношении 1:10 (на 10 мл среды 1 мл крови). Посев следует инкубировать при температуре 37 С не менее 8 дней, а с учетом возможного наличия L-форм — до 3-4 нед. Для идентификации выделенной культуры сальмонелл используют (с учетом их биохимических свойств) диагностические адсорбированные сыворотки, содержащие антитела к антигенам 02 (S. paratyphi А), 04 (S. paratyphi В) и 09 (S. typhi). Если выделенная культура S. typhi не агглютинируется 09-сывороткой, ее необходимо проверить с Vi-сывороткой.
Для выделения S. typhi можно использовать экссудат, полученный путем скарификации розеол — вырастают розеолокультуры.
Бактериологическое исследование испражнений, мочи и желчи проводят для подтверждения диагностики, контроля бактериологического выздоровления при выписке реконвалесцентов и для диагностики бактерионосительства. В этом случае материал предварительно засевают на среды обогащения (среды, содержащие химические вещества, например селенит, которые угнетают рост Е. coli и других представителей микрофлоры кишечника, но не угнетают роста сальмонелл), а затем со среды обогащения — на дифференциально-диагностические среды (Эндо, висмутсульфитагар) с целью выделения изолированных колоний и получения из них чистых культур, идентифицируемых по указанной выше схеме. Для обнаружения О- и Vi-антигенов в сыворотке крови и испражнениях больных могут быть использованы РСК, РПГА с антительным диагностикумом, реакции коагглютинации, агрегат-гемагглютинации, ИФМ. Для ускоренной идентификации S. typhi перспективно применение в качестве зонда фрагмента ДНК, несущего ген Vi-антигена (время идентификации 3-4 ч).
С конца 1-й недели болезни в сыворотке больных появляются антитела, поэтому для диагностики брюшного тифа в 1896 г. Ф. Видалем была предложена реакция развернутой пробирочной агглютинации. Динамика содержания антител к S. typhi своеобразна: раньше всего появляются антитела к О-антигену, но титр их быстро снижается после выздоровления; Н-антитела появляются позднее, но зато сохраняются после болезни и прививок годами. С учетом этого обстоятельства реакцию Видаля ставят одновременно с раздельными О- и Н-диагностикумами (а также с паратифозными А- и В-диагностикумами) для исключения возможных ошибок, связанных с прививками или ранее перенесенным заболеванием. Однако специфичность реакции Видаля недостаточно высока, поэтому более предпочтительным оказалось применение РПГА, в которой эритроцитарный диагностикум сенсибилизирован либо О- (для обнаружения О-антител), либо Vi-антигеном (для обнаружения Vi-анти-тел). Наиболее надежной и специфической является последняя реакция (Vi-гемагглютинации).
Единственным доказательством бактерионосительства является выделение от носителя культур S. typhi, S. paratyphi А, S. paratyphi В. Материалом для исследования являются дуоденальное содержимое, испражнения и моча. Сложность проблемы заключается в том, что у носителей возбудитель не всегда выделяется с этими субстратами, бывают паузы, и довольно продолжительные. В качестве вспомогательных методов, которые позволяют сузить круг обследуемых лиц, используют серологические реакции (одновременное обнаружение О-, Н-, Vi- или О-, Vi-антител говорит о возможном присутствии возбудителя в организме) и аллергическую кожную пробу с Vi-тифином. Последний содержит Vi-антиген, который при взаимодействии с Vi-антителами дает местную аллергическую реакцию в виде покраснения и припухлости в течение 20-30 мин. Положительная реакция с Vi-тифином свидетельствует о наличии в организме Vi-антител и о возможном присутствии S. typhi. Для идентификации L-форм S. typhi предложены специальные иммунофлуоресцирующие антитела (к антигенам L-форм возбудителя). Оригинальный метод выявления бактерионосителей был предложен В. Муром. Он заключается в исследовании тампонов, одновременно забрасываемых в канализационные люки на всем протяжении канализационной сети населенного пункта.

Лечение брюшного тифа основано на применении различных антибиотиков, к которым возбудители проявляют высокую чувствительность (левомицетин, ампициллин, тетрациклины и др.). Антибиотики снижают тяжесть течения болезни и сокращают ее продолжительность. Однако перенос R-плазмид сальмонеллам от Е. coli или других энтеробактерий может привести к появлению среди них опасных эпидемических клонов.
Вместо семи различных брюшно-тифозных вакцин, применявшихся ранее, с 1978 г. в нашей стране выпускается только одна — химическая сорбированная брюшно-тифозная моновакцина. Однако в связи с тем, что брюшной тиф из эпидемического заболевания перешел в разряд спорадических (а это стало возможным, прежде всего, благодаря улучшению систем водоснабжения и канализации и повышению санитарной культуры населения), необходимость массовой иммунизации против него отпала. Поэтому прививка от брюшного тифа проводится только в случае эпидемических показаний.
источник
Острая кишечная зоонозная инфекция, вызываемая сероварами сальмонелл, характеризующаяся поражением ЖКТ.
Морфологические свойства: подвижные, грам «-» палочки, капсулы нет. Хорошо растут на простых питательных и желчесодержащих средах. На плотных – образуют колонии в R-и S-формах, на жидких – помутнение. На лактозособержащих средах образуют бесцветные колонии.
Биохимическая активность: ферментация глк. до кислоты и газа, отсутствие ферментации лактозы, продукция сероводорода, отсутствие индолообразования.
Антигенная структура: соматический О-антиген, жгутиковый Н-антиген, Некоторые – К-антиген. Род Salmonella состоит из двух видов — вида S. enterica, в который включены все сальмонеллы, являющиеся возбудителями человека и теплокровных животных, и вида S. bongori, который подразделяется на 10 сероваров.
Вид S. enterica разделен на 6 подвидов, которые подразделены на серовары. Некоторые серовары сальмонелл, в частности S. Typhi, имеют полисахаридный Vi-антиген, являющийся разновидностью К-антигена.
Эпидемиология. Возбудителями сальмонеллеза является большая группа сальмонелл, входящая в подвид enterica. Наиболее часто возбудителями сальмонеллезов у человека являются серовары S. Typhimurium, S. Dublin, S. Choleraesuis. Основные факторы передачи — мясо, молоко, яйца, вода.
Патогенез и клиника. Заболевание протекает в локальной форме гастроэнтерита, ведущий синдром — диарейный. Инвазировав слизистую тонкого кишечника через М-клетки и проникнув в подслизистую, сальмонеллы захватываются макрофагами, переносясь ими в пейеровы бляшки, где формируют первичный очаг инфекции. При этом выделяются эндотоксин и белковый энтеротоксин. Энтеротоксин активирует поступление в просвет кишечника большого количества жидкости, К,Na. Понос, рвота.
Иммунитет: Ненапряженный, серовароспецифический, опосредован секреторным IgA, который предотвращает процесс пенетрации сальмонеллами слизистой тонкого кишечника. В крови могут определяться антитела.
Микробиологическая диагностика. Бактериологическому исследованию подвергают рвотные массы, промывные воды желудка, испражнения, желчь, мочу, кровь. При идентификации выделенных культур необходим широкий набор диагностических О- и Н- сывороток.
Для серологического исследования применяют РНГА, ИФА. Важное диагностическое значение имеет нарастание титра антител в динамике заболевания.
Лечение. Применяется патогенетическая терапия, направленная на нормализацию водно-солевого обмена. При генерализованных формах — этиотропная антибиотикотерапия.
Сальмонеллезные групповые, адсорбированные О- и Н-агглютинирующие сыворотки. Применяются для установления серогрупп и сероваров сальмонелл в реакции агглютинации.
Сальмонеллезные О- и Н-монодиагностикумы представляют собой взвеси сальмонелл, убитых нагреванием (О-диагностикумы) или обработкой формалином (Н-диагностикумы). Применяются для серодиагностики брюшного тифа.
Профилактика. Специфическая профилактика сальмонеллеза у с/х животных и птиц. Неспецифичес-кая профилактика — проведение ветеринарно-санитарных мероприятий
Брюшной тиф и паратифы А и В — острые кишечные инфекции, характеризующиеся поражением лимфатического аппарата кишечника, выраженной интоксикацией. Их возбудителями являются соответственно Salmonella typhi, Salmonella paratyphi А и Salmonella schottmuelleri.
Таксономическое положение. Возбудители брюшного тифа и паратифов А и В относятся к отделу Gracilicutes, семейству Enterobacteriaceae, роду Salmonella.
Морфологические и тинкториальные свойства. Сальмонеллы — мелкие грамотрицательные палочки с закругленными концами. В мазках располагаются беспорядочно. Не образуют спор, имеют микрокапсулу, перитрихи.
Культуральные свойства. Сальмонеллы — факультативные анаэробы. Оптимальными для роста являются температура 37С. Растут на простых питательных средах. Элективной средой для сальмонелл является желчный бульон.
Биохимическая активность сальмонелл достаточно высока, но они не сбраживают лактозу. S.typhi менее активна, чем возбудители паратифов.
Антигенные свойства и классификация. Сальмонеллы имеют О- и H-антигены, состоящие из ряда фракций. Каждый вид обладает определенным набором антигенов. Все виды сальмонелл, имеющие общую так называемую групповую фракцию 0-антигена, объединены в одну группу. Таких групп в настоящее время насчитывается около 65. S.typhi и некоторые другие сальмонеллы имеют Vi-антиген (разновидность К-антигена), с этим антигеном связывают вирулентность бактерий, их устойчивость к фагоцитозу.
Факторы патогенности. Сальмонеллы образуют эндотоксин, обладающий энтеротропным, нейротропным и пирогенным действием. С белками наружной мембраны связаны адгезивные свойства, наличие микрокапсулы обусловливает устойчивость к фагоцитозу.
Резистентность. Сальмонеллы довольно устойчивы к низкой т-ре. Очень чувствительны к дезинфицирующим веществам, высокой температуре, ультрафиолетовым лучам. В пищевых продуктах (мясе, молоке) сальмонеллы могут не только долго сохраняться, но и размножаться.
Эпидемиология. Брюшной тиф и паратиф А — антропонозные инфекции; источником заболевания являются больные люди и бактерионосители. Источником паратифа В могут быть также сельскохозяйственные животные. Механизм заражения фекально-оральный. Среди путей передачи преобладает водный.
Патогенез. Возбудители попадают в организм через рот, достигают тонкой кишки, где в ее лимфатических образованиях размножаются и затем попадают в кровь (стадия бактериемии). С током крови они разносятся по всему организму, внедряясь в паренхиматозные органы (селезенку, печень, почки, костный мозг). При гибели бактерий освобождается эндотоксин, вызывающий интоксикацию. Из желчного пузыря, где С. могут длительно сохраняться, они вновь попадают в те же лимфатические образования тонкой кишки. В результате повторного поступления С. может развиться аллергическая реакция, проявляющаяся в виде воспаления, а затем некроза лимфатических образований. Сальмонеллы выводятся из организма с мочой и калом.
Клиника. Клинически брюшной тиф и паратифы неразличимы. Инкубационный период составляет 12 дней. Болезнь начинается остро: с повышения температуры тела, появления слабости, утомляемости; нарушаются сон и аппетит. Для брюшного тифа характерны помутнение сознания, бред, галлюцинации, сыпь. Очень тяжелыми осложнениями являются прободение стенки кишки, перитонит, кишечное кровотечение, возникающие в результате некроза лимфатических образований тонкой кишки.
Иммунитет. После перенесенной болезни иммунитет прочный и продолжительный.
Микробиологическая диагностика. Основной метод диагностики — бактериологический: посев и выделение S. typhi из крови (гемокультура), фекалий (копрокультура), мочи (урино-культура), желчи, костного мозга. РИФ для обнаружения антигена возбудителя в биологических жидкостях. Серологический метод обнаружения 0- и Н- антител в РПГА. Бактерионосителей выявляют по обнаружению Vi-антител в сыворотке крови с помощью РПГА и положительному результату бактериологического; выделения возбудителя. Для внутривидовой идентификации применяют фаготипирование.
Лечение. Антибиотики. Иммуноантибиотикотерапия.
Профилактика. Санитарно-гигиенические мероприятия. Вакцинация — брюшнотифозная химическая и брюшно-тифозная спиртовая вакцина, обогащенная Vi-антигеном. Для экстренной профилактики — брюшнотифозный бактериофаг.
источник
Возбудитель брюшного тифа (Salmonella typhi) открыт в 1880 г К. Эбертом, выделен в чистой культуре в 1884 г. Г. Гафки. Ш. Ашар, Р. Бансод и Г. Шоттмюллер установили этиологию паратифа В (Salmonella schottmuelleri), А. Брион и Х. Кайзер — паратифа А (Salmonella paratyphi A).
Морфология. Соответствует общей характеристике семейства Enterobacteriaceae. Большая часть штаммов подвижна, количество жгутиков у них колеблется от 8 до 20; возможно, что жгутики образуют различное число пучков.
Сальмонеллы паратифов по форме, величине, характеру жгутиков и тинкториальным свойствам не отличаются от брюшнотифозных.
Цитоплазма клеток гранулярная, в ней имеются включения. Нуклеоид расположен в центре клетки, состоит из густой сети осмиофильных фибрилл ДНК. Содержание Г+Ц в ДНК нуклеоида 45 — 49%.
Культивирование. Брюшнотифозные и паратифозные сальмонеллы — факультативные анаэробы, температурный оптимум 37° С, но могут расти и при температуре 15 — 41° С. Культивируются на обычных средах при рН 6,8-7,2. На мясо-пептонном агаре брюшнотифозная сальмонелла образует полупрозрачные нежные колонии, которые меньше колоний кишечной палочки. На скошенном агаре через 18-20 ч влажный прозрачный налет без пигмента, в бульоне — равномерное помутнение.
На средах Плоскирева и Эндо сальмонеллы брюшного тифа и паратифов образуют полупрозрачные, бесцветные или бледно-розовые колонии, на висмут-сульфит агаре — черные блестящие колонии.
Сальмонеллы паратифа А на питательных средах (Плоскирева, Эндо и др.) образуют колонии, сходные с брюшнотифозными.
Колонии сальмонелл паратифа В более грубые, после суточного роста в термостате и последующего выдерживания в течение нескольких дней при комнатной температуре по периферии их возникают слизистые валики, что является характерным культуральным дифференциальным признаком.
Ферментативные свойства. Сальмонеллы брюшного тифа желатин не разжижают, индола не образуют, но продуцируют сероводород, восстанавливают нитраты в нитриты, молоко не свертывают.
Сальмонеллы брюшного тифа ферментируют с образованием кислоты глюкозу, маннит, мальтозу, левулезу, галактозу, раффинозу, декстрин, глицерин, сорбит, иногда и ксилозу.
Сальмонеллы паратифов А и В ферментируют углеводы с образованием кислоты и газа; они отличаются от сальмонелл брюшного тифа и по другим признакам. В естественных условиях брюшнотифозные сальмонеллы встречаются в виде двух биохимических вариантов: ксилозоположительных и ксилозоотрицательных.
В процессе диссоциации сальмонеллы брюшного тифа переходят из S-форм в R-формы, причем этот переход сопровождается утратой соматического О-антигена, наиболее полноценного в иммуногенном отношении.
Условные обозначения К — образование кислоты, КГ — образование кислоты и газа, + образование сероводорода, отсутствие ферментации углеводов и образование сероводорода, ± ферментация арабинозы и образование сероводорода происходит не всегда.
Токсинообразование. Сальмонеллы брюшного тифа содержат в своем составе глюцидо-липидно-протеиновые комплексы. Эндотоксин термостабилен, выдерживает температуру 120 °С в течение 30 мин, характеризуется высокой специфичностью, выраженным токсическим свойством. Имеются исследования, подтверждающие наличие у брюшнотифозных сальмонелл термолабильных веществ, инактивирующихся под влиянием света, воздуха, тепла (80° С), энтеротропного токсина, фосфатазы и пирогенных субстанций.
Антигенная структура. Брюшнотифозные сальмонеллы обладают Н-, О- и Vi-антигенами, вызывающими в организме выработку Н-, О-, Vi-агглютининов; Н-агглютинины обусловливают крупнохлопчатую, О- и Vi-агглютинины — мелкозернистую агглютинацию.
Ф. Эндрюс доказал, что жгутиковый Н-антиген неоднороден; он состоит из двух фаз: первой, или специфической, фазы, агглютинирующейся специфической видовой сывороткой, и второй, или неспецифической, фазы, агглютинирующейся не только видовой, но и групповой сывороткой. Сальмонеллы, имеющие две фазы Н-антигена, называются двухфазными в отличие от монофазных, имеющих только специфический Н-антиген.
Антигены отличаются различной чувствительностью к химическим веществам, 0-антиген разрушается от действия формалина, но не изменяется под влиянием слабых растворов фенола. Н-антиген, наоборот, не изменяется под влиянием формалина, но разрушается от воздействия фенола.
Vi- и 0-антигены расположены на поверхности бактериальной клетки. Наличие Vi-антигена препятствует агглютинации сальмонелл 0-сыворотками, утрата Vi-антигена сопровождается восстановлением 0-агглютинабельности. Брюшнотифозные сальмонеллы, содержащие Vi-антиген, не агглютинируются 0-сыворотками. Путем истощения Н- и 0-антигенами брюшнотифозных сывороток, полученных иммунизацией животных свежевыделенными сальмонеллами, можно получить Vi-агглютинирующую сыворотку.
Vi-антиген является лабильным веществом, он исчезает при выращивании микробов в питательных средах при добавлении к ним фенола, а также в условиях низкой (20° С) или высокой (40° С) температуры, полностью разрушается от кипячения в течение 10 мин и действия фенола, частично изменяется от воздействия формалина и температуры 60° С в течение 30 мин.
Антигенная структура сальмонелл подвержена изменчивости при переходе из S в R-форму в результате мутации, а также фаговой конверсии.
Установлено, что содержание Vi-антигена в культурах вариабельно: одни штаммы содержат Vi-антиген в больших, другие — в малых количествах. Ф. Кауфман все сальмонеллы, содержащие Vi-антиген, подразделяет на три группы: 1) чистые V-формы с высоким содержанием Vi-антигена; 2) чистые W-формы, не содержащие Vi-антигена и агглютинирующиеся 0-сывороткой; 3) промежуточные VW-формы; у паратифозных сальмонелл выявлены общие антигены с изоантигенами эритроцитов человека.
В соответствие с содержанием О-антигенов все сальмонеллы разделены на 65 серогрупп, обозначенных прописными буквами латинского алфавита (А, В, С, D и т.д.). Они представлены в схеме Кауфмана-Уайта, где О-антиген обозначен цифрами. В каждую группу включены сальмонеллы с идентичным одним или несколькими О-антигенами.
источник