Абсцессы малого таза возникают в местах, где имеются благоприятные условия. К располагающим факторам относится застой воспалительного экссудата или выливание крови. Жидкость скапливается в самом низком месте брюшной полости — дугласовом пространстве. У женщин очаг болезни располагается между маткой и прямой кишкой, у мужчин в углублении между мочевым пузырем и прямой кишкой. Воспаление тканей с гнойной полостью возникает как осложнение хирургических вмешательств, аппендицита, гинекологических инфекций.
- травмы и операции на органах брюшной полости;
- острый аппендицит;
- несоблюдение правил асептики;
- недостаточное дренирование и санирование брюшной полости;
- гнойные гинекологические воспаления.
Предрасположенность к патологии наблюдается у пациентов с сахарным диабетом, болезнью Корна, а также беременных.
Патология характерна для любого пола и возраста, наблюдается у детей как форма осложнения после операции.

- ухудшение общего состояния;
- сильные боли внизу живота;
- проблемы с мочеиспусканием;
- позывы к дефекации;
- тенизмы;
- жажда;
- учащение пульса;
- тошнота;
- слизистые выделения из прямой кишки, влагалища.
Клиническая картина не одинакова для всех пациентов, патология может иметь минимальные проявления или совсем не проявляться до определенного момента. Симптоматика зависит от локализации очага нагноения. Пока капсула целая, брюшина не раздражается. Перфорация абсцесса в кишечник приводит к появлению свищей. Обычно они наблюдаются в толстой кишке.
В процессе сбора анамнеза врач учитывает недавние хирургические вмешательства и гинекологические проблемы. При подозрении на абсцесс проводится ректальное (для мужчин) и вагинальное (для женщин) обследование. Пальпаторно определяется плотный инфильтрат с размягченным участком в центре. Образование болезненное, при разрастании давит на прямую кишку. Возникают ложные позывы к дефекации.
Консистенция инфильтрата различается в зависимости от продолжительности формирования. Вначале образование плотное, с появлением гноя размягчается. У женщин шейка матки смещается в сторону. Более полную картину патологии дает инструментальное обследование и лабораторные анализы:
- УЗИ малого таза;
- КТ или МРТ для уточнения локализации очага нарыва;
- общий и биохимический анализ крови;
- анализ мочи — при вовлечении мочевого пузыря выявляются лейкоциты, белок.
Если при пальпации обнаружена флюктация (образование гноя), показана пункция. Она проводится через прямую кишку или задний свод влагалища. Для процедуры используется шприц с пункционной иглой. После извлечения жидкости проводится бактериологическое исследование.
Лечение абсцесса проводится оперативно, с госпитализацией пациента. На стадии плотного инфильтрата назначаются клизмы и спринцевание теплыми отварами лекарственных трав. Процедуры способствуют скорейшему образованию гноя и размягчению абсцесса. Также на этой стадии проводится консервативная терапия по снятию интоксикации. Пациенту прописываются антибиотики широкого спектра действия. Препараты подавляют аэробные и анаэробные бактерии.
В процессе консервативного лечения возможен произвольный прорыв абсцесса. Пациенты замечают вытекание гноя с мочой или калом. Их состояние улучшается. В большинстве случаев прибегают к дренированию очага нагноения. Перед операцией больному ставят очистительную клизму. Хирургическое лечение проходит под общим наркозом. Выбор метода зависит от пола пациента:
- У мужчин производится вскрытие стенки прямой кишки. Для проведения операции выполняется расширение ануса. В наиболее мягком месте происходит вскрытие по игле. Процесс контролируется с помощью аппарата УЗИ. Разрез увеличивают корнцангом. Происходит опорожнение и санирование полости нарыва. Вставляется трубка для дренажа.
- У женщин тазовые абсцессы вскрываются через задний свод влагалища. Слизистая разрезается скальпелем, полость нарыва расширяется зажимам для лучшего оттока содержимого. На 3-4 суток вставляется трубка дренажа.
При выборе места доступа хирург ориентируется по данным о локализации нарыва. Операционный разрез может выполняться в промежности или над лоном. Установка вагинального дренажа не рекомендуется девственницам. В отсутствии возможности сделать пункцию под контролем УЗИ, добраться до патологического образования трансректально и трансвагинально, проводится лапаротомия.
Продолжительность периода восстановления зависит от выбранного метода операции и возраста пациента. Дренажную трубку удаляют через 2-3 дня, после прекращения оттока гноя. Больного располагают в полусидящем положении для обеспечения оттока жидкости. Антибактериальная терапия продолжается. Температура и общее самочувствие быстро приходит в норму.
В первые дни рекомендуется питание бульонами и жидкой кашей. Дальше назначается бесшлаковая диета. В период реабилитации запрещен подъем тяжестей, продолжительная ходьба.
Среди медиков патология считается менее опасной, чем нагноение в других отделах брюшной полости – поддиафрагмальном и межкишечном. Степень угрозы зависит от размеров гнойника. В некоторых случаях он может быть объемом до 500 мл. Существует риск прорыва абсцесса, который приведет к перитониту. Расплавление тканей ближайших органов обернется попаданием гноя в кишечник, мочевой пузырь или матку. Дальнейшее развитие событий: прорыв в матку и мочевой пузырь ведет к их воспалению, вытекание в прямую кишку способствует улучшению состояния пациента.
Меры по предотвращению возникновения и развития абсцессов:
- качественное удаление экссудата, сгустков крови, гноя во время операций;
- правильный выбор наркоза, позволяющий выполнить хирургическое вмешательство в полном объеме;
- своевременное лечение гинекологических и проктологических болезней, связанных с гнойными образованиями;
- проведение ректального и влагалищного обследования пациентов после удаления аппендицита.
Профилактические мероприятия касаются медицинских работников. От их профессионализма и ответственности зависит здоровье пациентов.
Патология успешно лечится, прогноз благоприятный. Это касается одиночных очагов воспаления. Своевременность вмешательства играет значимую роль. Грамотное лечение нагноения предотвращает распространение патологии на ближайшие органы.
источник
К острым инфекциям органов малого таза (ОИОМТ) у госпитализированных женщин относят инфекционные осложнения после кесарева сечения, плановой гистерэктомии и септического неполного аборта.
Классификация:
- эндомиометрит, осложненный или не осложненный параметритом, флегмоной и (или) абсцессом, развившийся после кесарева сечения в группах низкого риска, высокого риска, или при естественных родах;
- ОИОМТ после гистерэктомии: культит, тазовый целлюлит, флегмона, абсцесс малого таза;
- неполный септический аборт (самопроизвольный или индуцированный).
Эти осложнения, в том числе эндомиометрит, тазовый целлюлит, параметрит, флегмона и абсцессы малого таза, могут быть вызваны различными видами аэробов и анаэробов, относящихся к эндогенной микрофлоре дистальных отделов половых путей. Особенно большое значение имеют анаэробные бактерии, в связи с чем терапия должна быть прямо направлена против этих микроорганизмов. Роль энтерококков, хламидий и микоплазм остается неопределенной. Клинический материал для микробиологического исследования следует получать в условиях, сводящих к минимуму возможность контаминации влагалищной микрофлорой.
Когда антимикробные препараты еще не были широко введены в клиническую практику, указанные осложнения являлись одной из главных причин смерти женщин детородного возраста. В настоящее время возникновение таких осложнений удается успешно контролировать с помощью эффективной антимикробной профилактики или общей антимикробной терапии.
Неосложненные инфекции следует лечить не менее 4 дней; осложненные случаи могут потребовать более длительного лечения. В течение, по меньшей мере, первых 4 дней лечения рекомендуется вводить антибактериальные препараты парентерально; последующее пероральное применение можно исследовать как завершающую часть более длительных курсов. Ожидаемая частота клинической эффективности — около 90%.
Несмотря на то, что наиболее важна клиническая эффективность, необходимо принимать во внимание также микробиологическую эффективность. При заключительном анализе исход лечения классифицируют как эффективность, неэффективность или неопределенный результат.
Родоразрешение с помощью кесарева сечения. Больные, у которых родоразрешение производят с помощью кесарева сечения, подвержены риску инфекции эндотелиального слоя (эндометрит) и мышечного слоя матки (миометрит). Инфекция может распространяться на мягкие ткани латерально от матки (параметрит) и в дальнейшем осложняться развитием флегмоны или абсцесса в параметрии над мочевым пузырем или в ретроутеральном пространстве. На придатки матки патологический процесс обычно не распространяется.
Основные факторы риска инфекции после кесарева сечения:
- Социально-экономический статус
- Длительность безводного периода
- Длительность I периода родов
- Число влагалищных исследований
- Внутренний мониторинг плода
- Слабость родовой деятельности
- Анемия до операции
- Анемия после операции
- Кровопотеря во время операции
- Тип анестезии
- Продолжительность операции
- Квалификация хирурга
- Возраст роженицы
- Продолжительность мониторинга плода
- Число ректальных исследований
- Нарушения правил асептики
- Вагинальный операционный доступ
- Отсутствие околоплодных вод
- Ожирение
- Раса
Главные среди них — социально-экономический статус, продолжительность безводного периода, продолжительность родов и число влагалищных исследований в родах.
Антимикробная профилактика значительно снижала частоту лихорадки в родах и послеродовом периоде. Частота инфекционных осложнений после кесарева сечения, когда не проводили антимикробной профилактики, составляла от 5 до 80% среди различных популяций в зависимости от факторов риска. В некоторых группах высокого риска даже на фоне профилактики частота развития инфекции может достигать 20%. В общем ожидаемая частота развития инфекции у женщин с минимальным числом факторов риска составляет около 5%.
В группу женщин с минимальным риском инфекции входят больные, подвергаемые плановому повторному кесареву сечению при отсутствии родовой деятельности или в ее начальном периоде, если цел плодный пузырь. Антимикробная профилактика в этой группе низкого риска обычно не показана.
Гистерэктомия. После гистерэктомии инфекция чаще всего развивается в области вагинального края зоны операции (культит). Культит развивается у всех больных, перенесших гистерэктомию, как физиологическая реакция на хирургическое вмешательство и обычно не требует лечения. Сочетание факторов защиты организма и антимикробной профилактики позволяют предупредить развитие осложнений.
Инфекция, требующая антимикробной терапии, может дать клинические проявления еще до того, как больная выписалась из стационара или через несколько недель после выписки. Инфекция обычно распространяется на одну или обе стороны параметрия (тазовый целлюлит). Если придатки не удалены, может развиться аднексит. Иногда инфекцию осложняет флегмона или абсцесс в области культи влагалища, в параметрии или придатках матки.
Риск инфекции при выполнении чрезвлагалищной гистерэктомии выше, чем при использовании абдоминального доступа. Антимикробная профилактика показана при чрезвлагалищной гистерэктомии, но мнения о ее целесообразности при абдоминальной гистерэктомии остаются противоречивыми.
Основные факторы риска инфекции после гистерэктомии:
- Нестерильное операционное поле
- Иммунные нарушения
- Низкий социально-экономический статус
- Длительная операция
- Пониженное питание
- Диабет
- Большая кровопотеря
- Предшествующие хирургические вмешательства
- Пременопауза
- Пожилой возраст
- Ожирение
- Абдоминальный хирургический доступ
- Квалификация хирурга
- Использование катетера
Септический неполный аборт. Женщины с неполным септическим абортом подвержены высокому риску тяжелых форм инфекции с серьезными осложнениями. В тактике лечения этого патологического состояния существенное место занимает антимикробная терапия, расширение шейки матки и выскабливание ее полости.
Осложнения. Любая из этих ОИОМТ может привести к развитию флегмоны или формированию абсцесса, септическому тазовому тромбофлебиту, который нередко служит источником тромбоэмболии, некротизирующему фасцииту и смерти. Результаты посева крови чаще всего положительны у женщин, входящих в группы высокого риска и подвергаемых кесаревому сечению, а также у больных, перенесших септический аборт (5-21%). При большинстве инфекций достаточно применения антимикробных препаратов и не требуется хирургического вмешательства. В некоторых случаях необходимо чрескожное дренирование.
Диагноз. Диагноз ОИОМТ основывается на анамнестических указаниях на предрасполагающие факторы, жалобах, клинических симптомах, обнаруженных при физическом исследовании, наличии лихорадки, а также результатах лабораторного обследования. Больные часто жалуются на острое начало болей в низу живота, спине и (или) ноге. Температура тела обычно 38 °С и выше, причем лихорадка носит ремиттирующий характер. Нередко наблюдается лейкоцитоз, повышение СОЭ и уровня СРБ, однако эти изменения часто не помогают поставить диагноз. Конкретный диагноз зависит от результатов физического исследования, но болезненность брюшной стенки при пальпации нередко препятствует полноценному исследованию. В этих случаях поставить диагноз помогают такие методы, как УЗИ.
Микроорганизмы. Инвазия микроорганизмов происходит из нижнего отдела половых путей; эти микроорганизмы представляют собой часть их эндогенной микрофлоры и включают широкий спектр грамположительных и грамотрицательных аэробных и анаэробных бактерий. Этиология большинства инфекций носит полимикробный характер, но отдельные виды могут доминировать в зависимости от объема инокулята и факторов вирулентности. Идентифицировать основной возбудитель обычно затруднительно, так как часто выделяют сразу не менее четырех различных видов бактерий.
Микроорганизмы, чаще всего выделяемые у больных с ОИОМТ: Staphylococcus epidermidis и другие коагулазанегативные стафилококки, Enterococcus faecalis (и другие энтерококки), Streptococcus agalactiae и другие виды стрептококков, Escherichia coli, Enterobacter spp, Proteus spp, Klebsiella spp, Peptostreptococcus spp, Clostridium spp, Bacteroides spp (включая группы В. bivius и В. fragilis) и другие бактерии, обитающие в женских половых путях.
До введения эффективной антимикробной профилактики и терапии большинство ОИОМТ вызывались грамположительными аэробными и анаэробными бактериями. С появлением антимикробных препаратов для борьбы с большей частью инфекций успешно применяли монотерапию пенициллином. В 60-е годы потребовались антибиотики более широкого спектра действия. Облигатные анаэробы впервые были выделены при ОИОМТ в 70-е годы. И хотя было установлено, что Васteroides fragilis — важный патогенный микроорганизм, его выделяли только из 0—10% очагов острой инфекции органов малого таза, включая фаллопиевы трубы. Чаще выделяли Bacteroides bivius.
Этиологическая роль Enterococcus faecalis в развитии ОИОМТ остается неясной. Хотя этот микроорганизм выделяют из очага инфекции у 60% больных с ОИОМТ, клиническая эффективность отмечена у 90% больных, получавших лекарственные средства, не обладающих активностью против энтерококков. Неясна также этиологическая роль Chlamydia trachomatis, Mycoplasma spp и Ureaplasma.
Микробиологические исследования. Материал для культивирования у больных с эндометритом или септическим абортом необходимо брать из полости матки. Эту процедуру следует производить под контролем влагалищного зеркала, чтобы уменьшить возможность контаминации микрофлорой влагалища, используя для получения проб патологического материала всасывающий шприц-канюлю или специальный многоканальный тампон-щетку, снабженную защитным покрытием. Количественный критерий для правильной оценки бактериального роста в пробах, полученных с помощью отсасывающего шприца — более 10 5 в 1 мл, в пробах, полученных с помощью щетки с защитным покрытием — более 10 3 на тампон.
Пробы для культуральной диагностики у больных с ОИОМТ после гистерэктомии получают из очага инфекции стерильными тампонами, используя хирургический доступ через свод влагалища. Следует также проводить бактериологическое исследование гнойного материала, аспирированного из абсцесса. Посевы должны быть выполнены как можно раньше после взятия проб. Для сохранения анаэробных бактерий следует использовать специальные транспортные среды.
Чувствительность к антимикробным средствам должна быть определена как у аэробных, так и анаэробных бактерий. Определение МПК предпочтительно, но возможно и использование дискодифузионного метода Кирби-Бауэра. Для характеристики чувствительности микроорганизмов, определенной тем или другим методом, к антимикробным средствам следует использовать такие категории как резистентность, умеренная чувствительность и чувствительность.
Если возникло предположение о септицемии, необходимо получить для посева по меньшей мере две пробы крови после соответствующей обработки кожи в одном и том же месте с интервалом 15-30 минут или в разных местах. Пробы следует брать до или сразу после начала лечения. Если результат исходного бактериологического исследования крови окажется положительным, посев крови необходимо повторить в течение 72 часов и продолжать проводить до получения отрицательного результата.
Если предполагают развитие инфекции мочевыводящих путей, для посева собирают в стерильную посуду среднюю порцию мочи, выделенной при самопроизвольном мочеиспускании или полученной с помощью катетера до начала лечения. Анализ мочи должен включать количественное определение бактериурии, выделение и идентификацию возбудителя и определение его чувствительности к антибиотикам.
Современная терапия острых инфекций органов малого таза. В настоящее время общепризнано, что терапия должна быть прямо направлена против аэробного и анаэробного компонентов полимикробной флоры, которую чаще всего выделяют у больных с ОИОМТ. В середине и конце 60-х годов схемы лечения состояли из комбинации пенициллина или цефалоспоринов I поколения с аминогликозидами. Частота неэффективности этого режима лечения составляла 22-37%, причем в большинстве случаев неудачи можно было связать с безуспешностью эрадикации анаэробных бактерий.
Большое значение применения лекарственных средств, эффективно действующих против анаэробных бактерий, при лечении ОИОМТ после кесарева сечения было показано G. diZerega и соавт. (США). В начале 80-х годов комбинация клиндамицина с гентамицином становится «золотым стандартом» при лечении ОИОМТ. Эффективность этой комбинации составила примерно 88%.
С тех пор появились другие эффективные схемы, в которых используют монотерапию или комбинацию антибактериальных средств. Выбирают препараты, активные в отношении грамположительных и грамотрицательных аэробов и анаэробов. «Приемлемая» в настоящее время клиническая эффективность должна быть не менее 90%. Начальные проявления реакции больных на адекватную антибактериальную терапию выражаются исчезновением жалоб и болезненности при пальпации. Нормализация температуры тела может быть последним признаком, предшествующим констатации клинической эффективности.
В начале терапии антимикробные препараты обычно вводят парентерально (из-за нарушения функций желудочно-кишечного тракта). Длительность терапии зависит от того, имеются ли осложнения, такие например, как флегмона или абсцесс. В общем парентеральную терапию нужно продолжать еще 24 часа после того как температура становиться ниже 37,8 °С. Если у больной развивается флегмона или абсцесс, большинство экспертов предпочитает продолжать парентеральную терапию еще 48 часов после нормализации температуры тела. Необходимость проводить антимикробную терапию более 4 дней у больных с целлюлитом возникает редко.
Курс терапии при осложненной инфекции редко превышает 10 дней. Хирургической установки дренажа чаще всего не требуется; опасностей, связанных с большой операцией, можно избежать, применив чрескожное дренирование. Если проведен полный курс антимикробной парентеральной терапии, то в проведении пероральной терапии после выписки из стационара нет необходимости.
Длительность лечения. Продолжительность лечения не должна быть меньше 4 дней и больше 10 дней. Терапия не должна удлинять пребывание в стационаре. Стационарное лечение больных эндометритом или культитом следует продолжать по меньшей мере 24 часа после нормализации температуры тела. Лечение в стационаре при абсцессе или флегмоне следует продолжать не менее 48 часов после нормализации температуры тела. Если во время пребывания в стационаре проведен полный курс терапии, нет необходимости продолжать лечение после выписки.
Если возможно использовать как пероральный, так и парентеральный пути введения лекарственного средства, допустимо продолжить терапию в амбулаторных условиях в объеме запланированного полного курса, соответственно сократив курс парентеральной терапии в стационаре.
Врач по своему усмотрению может принять решение продолжить терапию более 10 дней на основании реакции больной, тяжести инфекции, общего состояния больной и наличия сопутствующих заболеваний, но лечение в этом случае следует расценивать как неэффективное.
Эндомиометрит — это инфекция внутреннего слоя матки (эндометрия) и миометрия. Он может развиваться после кесарева сечения, естественных родов или неполного септического аборта. Клинические проявления включают боли, болезненность при пальпации в области малого таза, ремиттирующую лихорадку (температура в полости рта выше 38 °С) и лейкоцитоз (более 10500 лейкоцитов в 1 мкл крови).
Параметрит, флегмона и абсцесс. Эти инфекции поражают структуры, прилегающие к матке: связки матки, фаллопиевы трубы, яичники и прилежащие структуры малого таза. Они иногда развиваются как осложнения эндомиометрита после родов, септического аборта или гистерэктомии. Поставить точный диагноз не всегда просто. Предположительный диагноз ставят на основе данных тщательного исследования органов малого таза у больных с длительной лихорадкой или персистирующим лейкоцитозом. УЗИ и другие специфические методы исследования часто помогают определить локализацию очага и распространенность инфекции.
Инфекции органов малого таза после гистерэктомии. К ним относятся инфекции во влагалищной части области операционного разреза (культит), распространение воспаления на мягкие тканевые структуры вокруг удаленной матки (тазовый целлюлит), распространенная воспалительная реакция мягких тканей малого таза (флегмона) и локальные очаги инфекции с тяжелыми проявлениями воспаления и некрозом тканей (абсцесс в области малого таза). Культит проявляется уплотнением и болезненностью при пальпации в вагинальной части культи матки и лихорадкой, которая продолжается больше 1 дня после операции. Тазовый целлюлит характеризуется болезненностью при пальпации в зоне параметрия. Если при пальпации болезненность локализуется спереди и сверху параметрия, наиболее вероятен диагноз аднексита. Абсцесс и флегмону в тканях малого таза диагностируют на основании пальпаторного обнаружения объемных образований, а также данных УЗИ или других неинвазивных сканирующих методов.
Септический аборт — инфекция эндометрия и часто миометрия, вызванная присутствием в матке частей инфицированного плодного яйца. Инфекционный процесс может распространяться на параметрий.
Эндомиометрит. К клиническим критериям включения в исследование относятся боли в низу живота и болезненность при пальпации матки, появившиеся в течение 24—72 часов после кесарева сечения или естественных родов, и, по крайней мере, однократное повышение температуры в ротовой полости больше 38 °С.
Параметрит, флегмона и абсцесс. Критериями включения служат пальпируемые образования, расположенные латерально в зоне параметрия, спереди под мочевым пузырем или позади матки. Диагноз следует подтвердить с помощью УЗИ или другого неинвазивного метода.
Инфекция органов малого таза после гистерэктомии. Критериями включения являются жалобы на боли в низу живота и в спине, болезненность при пальпации в низу живота, культе влагалища, параметрии и придатках матки через 1—3 дня после операции. Повторные подъемы температуры тела (>38 °С) сохраняются больше 24 часов после операции. Как отмечено выше, могут сформироваться параметрит, флегмона и абсцесс. Если возможно, следует провести дифференциальный диагноз культита, тазового целлюлита и абсцесса.
Септический аборт. Этот диагноз ставят больным с аменореей или с ациклическими кровянистыми выделениями из половых путей при положительном тесте на беременность, температуре тела >38 °С при двух последовательных измерениях, болях в низу живота или малом тазу, напряжении матки, связанной с ее болезненностью или болезненностью параметрия. Внутренний зев шейки матки обычно открыт. Следует отметить характер аборта (самопроизвольный, плановый или вызванный самой больной). Необходимо исключить инфекцию другой локализации, например в мочевыводящих путях, или четко доказать лабораторными и клиническими методами, что она не имеет отношения к септическому аборту.
С использованием техники, описанной выше, должны быть выделены клинически значимые аэробные и анаэробные бактерии из проб эндометрия или гнойного отделяемого из культи влагалища, или содержимого абсцесса, полученного с помощью аспирации, по дренажу либо с помощью стерильного ватного тампона. Следует установить гнойный характер полученных образцов с помощью микроскопии мазков, окрашенных по Граму, и провести соответствующее бактериологическое исследование для выделения микроорганизмов.
Факторы риска для больных, родоразрешенных посредством планового кесарева сечения, указаны выше. На основе этих критериев определяют больных, подверженных высокому или низкому риску инфекции. В целом в группу высокого риска включают больных с низким социально-экономическим статусом, с затянувшимися родами, с длительным безводным периодом, с повторными влагалищными исследованиями.
Эффективность лечения. Эффективность лечения определяют как исчезновение клинических проявлений инфекции после завершения лечения и в период наблюдения после лечения. Больные должны получать лечение в течение определенного минимального периода времени. Определение «эффективность лечения» употребляют только в отношении больных, которым не требовалось другой терапии, оказывающей прямое воздействие на очаг инфекции, в течение, по крайней мере, 28 дней после выписки из стационара.
Улучшение. Это определение применяют, чтобы обозначить прекращение лихорадки, болей в животе и других жалоб и объективных признаков, типичных для активной инфекции, в течение или в конце курса терапии. Оно представляет собой только промежуточную оценку и не может использоваться для окончательной оценки эффективности лечения.
Неэффективность лечения. Неэффективность лечения может быть констатирована в любое время на протяжении лечения или наблюдения в отдаленный период. Лечение признают неэффективным, если клиническая картина инфекции остается прежней через 48 часов после начала лечения или ухудшается в процессе лечения, а также если возникает необходимость изменения антимикробной терапии или требуется хирургическое лечение. Единственное исключение — ситуация, в которой диагноз установлен во время операции. Как неэффективность лечения расценивают также случаи, когда после первичной эффективности или улучшения на фоне терапии признаки инфекции рецидивируют в сроки до 28 дней после выписки из стационара.
Неопределенный результат. В некоторых случаях оценить клиническую эффективность невозможно. К причинам этого относятся несоблюдение протокола исследования, неправильный диагноз, развитие внутрибольничной инфекции, требующей назначения дополнительной антимикробной терапии, или применение дополнительной антимикробной терапии, необходимое для борьбы с инфекциями другой локализации, возникшими в период наблюдения после выписки из стационара.
Смерть. Если смерть наступила от сопутствующего заболевания неинфекционной природы, причем вначале объективно отмечалась клиническая эффективность лечения изучаемой инфекции или улучшение, то клиническую реакцию расценивают как предположительную эффективность. Если причина смерти связана с инфекционным процессом, клиническую реакцию расценивают как неэффективность лечения.
На момент поступления в стационар. Следует собрать полный медицинский анамнез и провести физическое исследование с подтверждением инфекции, подлежащей лечению, и отсутствие других инфекций. Необходимо выполнить лабораторные и микробиологические исследования.
Микробиологические исследования:
- Локусы, из которых следует получать материал для культивирования аэробов и анаэробов:
- при эндометрите, эндомиометрите, септическом аборте материал должен быть получен из полости матки с помощью специальных устройств, обеспечивающих защиту полученного материала от контаминации;
- при культите, тазовом целлюлите материал для исследования берут в надвлагалищном пространстве с помощью защищенных стерильных ватных тампонов;
- при абсцессе малого таза материал для микробиологического исследования получают из надвлагалищного пространства (полость абсцесса) с помощью защищенного стерильного тампона или путем аспирации содержимого шприцем, при дренировании под контролем РКТ или при хирургическом дренировании.
- Кровь. Если предполагают возможность бактериемии, кровь получают путем двух отдельных венопункций. Используют аэробную и анаэробную технику культивирования.
- Моча. Если возможна сопутствующая инфекция мочевых путей, производят посев мочи и определяют чувствительность микрофлоры к антимикробным препаратам. Для посева используют среднюю порцию мочи, полученной или при самопроизвольном мочеиспускании, или с помощью катетера.
Следует провести специальные методы исследования. Такие исследования, как УЗИ, рентгенологическое исследование грудной клетки и сканирующая РКТ, чтобы исключить сопутствующие инфекционные процессы либо подтвердить диагноз абсцесса или флегмоны.
Оценка в процессе терапии. Клиническую оценку эффективности терапии и нежелательных реакций на применяемые препараты следует производить ежедневно. Необходимо регистрировать максимальную суточную температуру тела. Нежелательные эффекты отмечают в тот день, когда они возникли. Окончательно оценить результат лечения можно только после посещения врача больной в отдаленный период. Неэффективность лечения может быть констатирована после 48 часов от его начала вплоть до последнего посещения в отдаленный период.
Лабораторное обследование повторяют в следующих случаях: а) при неэффективности терапии; б) перед выпиской из стационара и в) по показаниям при посещении больной врача в отдаленный период.
Следует провести бактериологическую оценку. Если терапия неэффективна, следует получить материал из очага инфекции для бактериологического исследования. Если терапия предположительно эффективна, повторять посевы нет необходимости. Если результаты бактериологического исследования положительны, посевы крови повторяют через 48—72 часа до получения отрицательного результата исследования. Ожидается, что у большинства больных микробиологическая эффективность (эрадикация возбудителей) окажется предположительной, поскольку когда их выписывают из стационара, материал для посева получить обычно не удается, а поздние рецидивы инфекции наблюдаются редко. Неэффективность терапии может сопровождаться персистенцией возбудителя или развитием суперинфекции.
Оценка после завершения терапии и в отдаленный период. Клиническая оценка должна включать описание клинического течения заболевания и физического исследования после окончания курса терапии. Больная должна пройти повторную оценку через 28 дней после завершения курса терапии для определения клинической эффективности и выявления поздних нежелательных реакций.
Лабораторные исследования следует повторить при контрольном посещении врача тем больным, у которых результаты этих исследований не отвечали критериям нормы при выписке из стационара, или если была зарегистрирована неэффективность лечения.
Микробиологическое обследование при последнем посещении врача необязательно, если больная клинически здорова.
Заключительная оценка. Заключительная оценка о выздоровлении может быть сделана только после обследования больной в отдаленный период. Главный конечный показатель эффективности терапии — клиническое выздоровление. Микробиологическая эффективность имеет меньшее значение. Неэффективность (клиническая или микробиологическая) терапии может быть отмечена в любой момент лечения или в отдаленный период. Если при последнем посещении врача микробиологическое исследование не может быть выполнено из-за отсутствия клинического материала, исход лечения регистрируют как предположительную микробиологическую эрадикацию на фоне клинической эффективности терапии.
Общая схема исследования, клинической и микробиологической оценки
источник
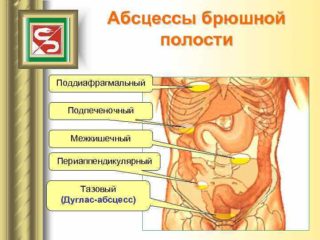
Локализуются у женщин в дугласовом, а у мужчин в прямокишечно-пузырном пространстве. Развитию их в значительной мере способствует анатомическая локализация указанных пространств, уровень которых в брюшной полости наиболее низок при любом положении тела больного.
Формирование абсцессов малого таза (AMT), как и межкишечных, начинается с 5-7-го дня после операции вследствие воспаления, затекания патологической жидкости в наиболее низкие пространства (прямокишечно-пузырное, прямокишечно-маточное углубления) при распространенном перитоните и других причинах. Это осложнение наблюдается у 0,06 % больных, перенесших операцию на органах брюшной полости [К.Д. Тоскин, В.В. Жебровский, 1986; М.Г. Сачек, 1987; Д.И. Кривицкий и соавт, 1990].
Относительно частому возникновению AMT способствует анатомическое строение брюшной полости. Оно способствует затеканию и скоплению воспалительного экссудата, гноя, образующихся при деструктивных процессах в 40, желчном пузыре и ПЖ, в других органах пищеварительного канала, а также содержимого желудка, тонкой и толстой кишок при их перфорации, изливающейся при травмах крови в полость малого таза.
При неадекватном дренировании полости малого таза или в том случае, если в конце операции не производится ее тщательный туалет, возникают предпосылки для образования абсцесса. Наиболее часто это происходит после операций, сопровождающихся общим или диффузным перитонитом при тазовом расположении деструктивно измененного 40, после гинекологических операций, операций на прямой и сигмовидной кишке [О.Б. Милонов и соавт, 1990].
В формировании AMT основную роль играют спайки, отграничивающие скопления гноя от свободных отделов брюшной полости. Вначале образуется инфильтрат, затем острая воспалительная реакция стихает, образуется пиогенная капсула абсцесса. При этом может произойти расплавление протеолитическими ферментами гноя и прорыв абсцесса в просвет прямой, сигмовидной или тонкой кишки, мочевого пузыря, матки. Опророжнение абсцесса в просвет кишечника может закончиться самоизлечением, а прорыв в просвет мочевого пузыря или матки ведет к развитию гнойного воспаления этих органов.
Доступность большинства AMT для пальцевого ректального (у женщин еще и вагинального) исследования, относительно несложные методы их дренирования через ПК (у женщин дополнительно и через задний свод влагалища) делают эти абсцессы относительно безопасными для здоровья и жизни больного по сравнению с поддиафрагмальными и особенно межкишечными абсцессами [Д.И. Кривицкий и соавт, 1990].
Частота образования AMT по отношению к общему числу послеоперационных внугрибрюшных абсцессов составляет от 10,8 до 24 % [Ю.М. Портной, 1984; АЛ. Быстрицкий, 1985; H.H. Малиновский, Б.Ю. Савчук, 1986].
К непосредственным причинам образования AMT относят недостаточное санирование и дренирование брюшной полости, недостаточный объем лечения в послеоперационном периоде, нерациональный выбор оперативного доступа, недостаточный гемостаз, частичная НША, неправильный выбор анестезии, необоснованно раннее удаление дренажей, соскальзывание лигатуры, оставление в ране ИТ, прокол кишки, нарушение правил асептики и техники выполнения операции в ситуациях, когда абсцессы возникают после пробных лапаротомий, и др. [Г.Л. Александрович, 1984; Б.К. Шуркалин и соавх, 1987; Д.И. Кривишсий исоавт., 1990 и др.].
АМТ часто образуются и после операций по поводу злокачественных опухолей прямой кишки, реже — сигмовидной ободочной, восходящей ободочной, поперечной ободочной, нисходящей ободочной и слепой кишок. Причина возникновения послеоперационных абсцессов у большинства больных —- ШЛА после резекции сигмовидной О К, левосторонней гемикоэктомии, резекции поперечной О К, правосторонней гемикоэктомии и паллиативной операции илеотрансаерзостомии.
Потенциально опасной в плане образования послеоперационных инфильтратов и абсцессов после радикальных резекций желудка, гастрэктомии по поводу РЖ является несостоятельность желудочно-кишечного и пищеводно-кишечного соустья в раннем послеоперационном периоде.
НШК ДПК после радикальных операций наблюдается нечасто в связи с крайне редкими случаями перехода злокачественного процесса на ДПК и возможностью тщательного ушивания культи кишки у подавляющего большинства больных.
Клинические признаки тазовых абсцессов достаточно характерны. При этом обычно на 5—6-е сут отмечаются жалобы больных на боли в нижней части живота, повышение температуры до 38-39 °С (постоянная или гектическая), дизурическое расстройство (частое болезненное мочеиспускание), учащенные позывы на стул, тенезмы. Температура тела больного зависит от выраженности воспалительных явлений. В стадии инфильтрата температура обычно постоянно повышена. Для сформировавшегося тазового абсцесса характерна гектическая температура, сопровождающаяся ознобами и обильным потоотделением.
Развитие тазового перитонита приводит к ухудшению общего самочувствия больного даже по сравнению с первыми сутками послеоперационного периода. Усиливаются боли внизу живота, сильная жажда, не проходящая даже при проведении адекватной инфузионной терапии. Отмечаются также тошнота, иногда рвота, не приносящая облегчения, задержка самостоятельного мочеиспускания. Учащается пульс, причем его частота не соответствует температуре.
Прогрессирующе нарастает метеоризм, временный эффект дают газоотводная трубка и микроклизма. Перистальтика кишечника либо вялая, либо отсутствует, она плохо корригируется стимулирующей терапией. Язык становится сухим, покрывается налетом. Отмечаются лейкоцитоз со сдвигом лейкоцитарной формулы влево, увеличение СОЭ, гипопротеинемия, уменьшение альбумино-глобулинового соотношения. В воспалительный процесс вовлекаются стенки мочевого пузыря, в моче появляются лейкоциты, эритроциты, белок.
Симптом раздражения брюшины обычно отсутствует. При нарушении капсулы, отграничивающей гнойник от свободной брюшной полости, появляется вздутие кишечника, а также симптом раздражения брюшины. При подозрении на тазовые инфильтраты и абсцессы обязательны ректальное и вагинальное исследования. При этом обнаруживают малоподвижный болезненный инфильтрат, который по мере «созревания» размягчается, нависание передней стенки ПК увеличивается, раздражение чувствительных рецепторов провоцирует появление ложных позывов к акту дефекации, сопровождающихся выделением белесоватой слизи, секрета кишечного эпителия [H.H. Малиновский, БД. Савчук, 1986].
Ректальное исследование (рисунок 22) определяет болезненный инфильтрат, выступающий в просвет кишки. СО над ним отечна, неподвижна. Аналогичные изменения в области заднего свода наблюдаются при влагалищном исследовании у женщин.
Рентгенологическая диагностика AMT затруднена ввиду того, что абсцесс окружен полыми органами, содержащими воздух и жидкость. Иногда в боковой проекции удается определять небольшую полость с горизонтальным уровнем жидкости на фоне диффузного затемнения.
Большое значение в диагностике абсцессов имеют специальные методы исследования (тепловидение, KT, УЗ И, радиосканирование). С помощью этих методов, а также пункции удается верифицировать диагноз.
При диагностировании AMT с наличием флюктуации показана его пункция через ПК или же через задний свод влагалища у женщин в зоне формирования гнойника (рисунок 23). При выявлении тазового инфильтрата без признаков размягчения лечебные мероприятия сводятся к детоксикационной и антибактериальной терапии (ампициллин, гентаминин, метронидазол). Хороший эффект дает инфузионная терапия с коррекцией энергетического, белкового, водно-солевого и других видов обмена, а также теплые клизмы из растворов ромашки, шалфея, физиотерапевтические процедуры (диатермия, УВЧ) [Д.И. Кривицкий и соавт, 1990].
В редких случаях происходит самопроизвольный прорыв содержимого тазового абсцесса в ПК, в свободную брюшную полость, в просвет кишки, в мочевой пузырь (рисунок 24). Прорыв абсцесса в ПК, влагалище или мочевой пузырь обычно сопровождается выздоровлением больного. При этом у больного внезапно появляется обильное истечение гноя при мочеиспускании или дефекации. Самочувствие резко улучшается, температура тела снижается. Появление флюктуации в области тазового инфильтрата или других характерных симптомов абс-цедирования — показание к срочному оперативному лечению. Перед операцией обязательны очистительная клизма и опорожнение мочевого пузыря.
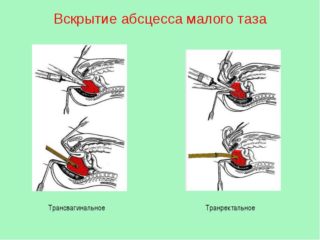
AMT чаще всего вскрывают через переднюю стенку ПК или задний свод влагалища у женщин (рисунок 25). В ПК вводят ректальное зеркало, СО тщательно очищают марлевыми тампонами, смоченными спиртом или фурацилином. С помощью пункции через ПК у мужчин и детей и задний свод влагалища у женщин по пальцу пунктируют полость абсцесса и толстой иглой в зоне наибольшего размягчения проникают в нее, аспирируют гной для идентификации микрофлоры, микроскопии мазка и определения чувствительности микрофлоры к антибиотикам.
Операцию проводят под наркозом. Абсцесс вскрывают скальпелем по ходу иглы разрезом 1-1,5 см, затем расширяют рану корнцангом. Полость обследуют пальцем. Полностью опорожняют полость абсцесса, санируют и дренируют ее толстой двухпросветной трубкой, которую фиксируют в слизистой оболочке ПК кетгутовым швом. Дренаж оставляют на 3-4 сут
Помимо ректального и вагинального доступа, возможно использование других доступов: промежностный (при скоплении гноя в околопузырной ямке) доступ или же абсцесс вскрывают и дренируют, делая поперечный разрез над лоном. При скоплении гноя в забрюшинном пространстве малого таза (ретроректальное пространство) используют промежностный и сакральный доступы. Дренирование абсцессов таза возможно и через седалищно-прямокишечную ямку.
Трансвагинальное дренирование не рекомендуется у девственниц и женщин преклонного возраста.
Эффективным методом лечения AMT считается аспирационно-промывной метод по H.H. Каншину (АЛ. Быстрицкий, 1985) (см. рисунок 18).
В послеоперационном периоде проводится фракционное промывание полости абсцесса растворами антисептиков и антибиотиков. Для временной задержки стула больным назначают бесшлаковую диету и соответствующие препараты. Дренаж удаляют после нормализации температуры и прекращения выделения гнойного экссудата.
В случаях, когда невозможно провести вскрытие абсцесса через ПК или влагалище, когда обнаружены признаки распространения воспалительного процесса в остальные отделы брюшной полости или абсцесс занимает более переднее положение, вскрытие производят разрезами в подвздошных областях с введением дренажей в малый таз.
Трансректальное или трансвагинальное дренировние AMT дает быстрый эффект [О.Б. Милонов и соавт., 1990].
Обобщая сказанное, следует отметить, что послеоперационные AMT легче диагностируются, более доступны оперативному лечению и адекватному дренированию, более благоприятны по своим исходам, нежели межкишечные и поддиафрагмальные абсцессы.
После операций по поводу перитонита и при развитии гнойно-септических осложнений после других операций больному следует придать фовлеровское (полусидячее) положение. Это способствует скоплению экссудата в прямокишечно-пузырном углублении у мужчин и в прямокишечно-влагалищном углублении у женщин. Регулярное ректальное и влагалищное исследование в послеоперационном периоде способствует своевременной диагностике AMT.
При наличии гноя в околопузырной ямке делают поперечный разрез над лоном или же используют промежностный доступ. Срединную лапаротомию выполняют только в случаях вскрытия абсцесса в свободную брюшную полость, отсутствия контакта абсцесса с ПК и влагалищем, при формировании абсцесса вокруг ИТ, при невозможности чрескожной пункции под контролем УЗИ или KT. Очень важна полноценная предоперационная подготовка этой категории больных. После операции проводится комплексная интенсивная терапия, включающая детоксикацию организма, переливание крови, адекватное парентеральное питание, форсированный диурез, целенаправленную антибиотикотерапию, сердечные средства, мероприятия, направленные на предупреждение осложнения со стороны дыхательной, сердечно-сосудистой и других систем организма.
Перейти к списку условных сокращений
источник
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Гнойно-воспалительные заболевания органов малого таза — инфекции репродуктивных органов женщины. Репродуктивные органы включают матку, маточные трубы, яичники и шейку матки. Инфекции могут быть вызваны различными видами бактерий. Распространенные симптомы — боль в низу живота, выделения из влагалища, повышение температуры, жжение и боль при мочеиспускании или нарушение менструального цикла.

В основе развития и формирования гнойных ВЗОМТ лежит множество взаимосвязанных процессов, начиная от острого воспаления и заканчивая сложными деструктивными изменениями тканей. Основным пусковым механизмом развития воспаления считают бактериальную инвазию. И если в патогенезе неосложненного острого гнойного воспаления (острый эндомиометрит, сальпингит) основную роль играет бактериальная инвазия «сексуальной инфекции нового типа» (гонококки, хламидии, микоплазмы, вирусы, условно-патогенные штаммы аэробных и анаэробных возбудителей), то при осложненных формах гнойного воспаления микрофлора более агрессивна и включает ассоциации следующих патогенных возбудителей: грамотрицательные неспорообразующие анаэробные бактерии (strongacteroides fragilis, Prevotella spр., Prevotella bivius, Prevotella disiens и Prevotella melaninogenica), грамположительные анаэробные стрептококки (Pep tostreptococcus spp.), аэробные грамотрицательные бактерии семейства Enterobacteriacea (E. coli, Proteus), аэробные грамположительные кокки (энтеро-, стрепто- и стафилококки).
В настоящее время основной причиной развития деструктивных, осложненных форм гнойного воспаления, в том числе и генерализованных, считают длительное использование ВМК, приводящее к возникновению тубоовариальных, а в отдельных случаях — множественных экстрагенитальных абсцессов с крайне неблагоприятным септическим клиническим течением, обусловленным Actinomycetes Israeli и анаэробами.
Далее в порядке убывания (по частоте) идут тяжелые гнойные послеродовые заболевания, затем гнойные осложнения на фоне обострения длительно существующих хронических заболеваний, далее — послеоперационные осложнения. Более редкие причины: нагноение гематом и плодного яйца при эктопической беременности, нагноение опухолей, первичный деструктивный аппендицит с тазовой флегмоной и прочие.

Кроме бактериальной инвазии, в этиологии гнойного процесса значительную роль играют так называемые провоцирующие факторы. Данное понятие включает физиологическое (менструацию, роды) или ятрогенное (аборты, ВМК, гистероскопию, гистеросальпингографию, операции) ослабление или повреждение барьерных механизмов, способствующее формированию входных ворот для патогенной микрофлоры и дальнейшему ее распространению.
Основные факторы, способствующие прогрессированию заболевания и формированию осложненных форм гнойного воспаления:
- необоснованно длительное консервативное ведение гнойных гинекологических больных;
- использование с целью лечения паллиативных вмешательств, не ликвидирующих очаг деструкции (пункции, дренирование).

Особенности течения гнойных ВЗОМТ в настоящее время:
- Повышение вирулентности и резистентности микрофлоры, преимущественно ассоциативной, в которой анаэробные и грамотрицательные микроорганизмы относят к основным патогенам. В это же время гонококк как возбудитель гнойного процесса не только не утратил своего значения, но и повысил степень своей агрессии за счет сопутствующей микрофлоры, в частности ИППП.
- Изменение клинического течения гнойных заболеваний внутренних половых органов: на современном этапе они изначально протекают как первично хронические и характеризуются длительным, рецидивирующим течением при крайней неэффективности медикаментозной терапии. Например, у большинства женщин, применяющих ВМК, манифестация заболевания происходит тогда, когда уже имеется тяжелое инфильтративное поражение гениталий.
Чаще всего гнойный сальпингит начинается остро, с повышения температуры (иногда сопровождается ознобами), появления болей внизу живота (типичная локализация болей — левая и правая гипогастральные области, при наличии сопутствующего эндомиометрита наблюдают так называемые «срединные» боли), обильных гнойных белей и резей при мочеиспускании. Вскоре у больных отмечают симптомы гнойной интоксикации (слабость, тахикардия, мышечные боли, чувство сухости во рту), присоединяются диспептические, эмоционально-невротические и функциональные расстройства. Нарушения функции прямой кишки проявляются чаще в виде симптома «раздраженной» кишки (частый жидкий стул). Частая жалоба — наличие выраженной диспареунии.
При влагалищном исследовании выявляют болезненность при движении за шейку матки, пастозность или наличие пальпируемого образования небольших размеров с нечеткими контурами в области придатков, а также чувствительность при пальпации бокового и заднего сводов.
Лабораторные исследования: у больных выявляют лейкоцитоз с умеренным сдвигом лейкоцитарной формулы влево (палочкоядерных лейкоцитов 6–9%), повышенная СОЭ (20–40 мм/ч), наличие резко положительного C-реактивного белка, гиперфибриногенемия.
Эхографические признаки острого гнойного сальпингита: наличие «расширенных, утолщенных, вытянутых маточных труб, характеризующиеся повышенным уровнем звукопроводимости, у каждой второй больной в прямокишечно-маточном углублении отмечают скопление свободной жидкости».
Высокоинформативной лечебно-диагностической процедурой при гнойном сальпингите (особенно при невозможности проведения лапароскопии) до настоящего времени считают пункцию заднего свода влагалища. Манипуляция позволяет получить гнойный экссудат для микробиологического исследования и провести дифференциальный диагноз с другой ургентной ситуацией, например с внематочной беременностью, апоплексией яичника.
По мнению G. strongalbi и соавт., классические признаки острого гнойного сальпингита: наличие болей в животе, болезненность при движении за шейку матки и чувствительность в области придатков в сочетании, по крайней мере, с одним из следующих дополнительных признаков (температура >38 °С; лейкоцитоз >10,5 9 /л и наличие гноя, полученного при пункции заднего свода влагалища).
- Нарастание симптомов гнойной интоксикации (появление гектической лихорадки, тошноты, рвоты, постоянного чувства сухости во рту, резкой мышечной слабости).
- Появление преимущественно в нижних отделах живота симптомов раздражения брюшины (пельвиоперитонит). Влагалищное исследование у больных пельвиоперитонитом малоинформативно из-за выраженной болезненности при пальпации. Определяют умеренное нависание и резкую болезненность сводов, особенно заднего, резко усиливающуюся при малейшем движении за шейку матки. Пропальпировать небольшие объемные образования в малом тазе обычно не удается.
- Появление «чувства резкого давления на прямую кишку» и учащенной дефекации (свидетельствует о формирующемся на фоне пельвиоперитонита абсцессе маточно-прямокишечного углубления). При гинекологическом осмотре в соответствующей анатомической области выявляют патологическое образование неравномерной консистенции, без четких контуров, пролабирующее через задний свод и переднюю стенку прямой кишки, резко болезненное при пальпации (так называемый «крик Дугласа»).
Относят все осумкованные воспалительные придатковые опухоли — пиосальпинкс, пиовар, гнойные тубоовариальные образования и их дальнейшие осложнения, обусловленные рядом факторов: длительностью заболевания, стадией воспаления, глубиной деструктивного процесса и характером поражения органов и систем. Основной клинический симптом у данного контингента больных, кроме болей и температуры, — наличие изначально тяжелой гнойной эндогенной интоксикации. Гнойные бели наблюдают у послеродовых, послеабортных больных и пациенток с ВМК (гнойный эндомиометрит). Следует отметить наличие у больных выраженных невротических расстройств, при этом наряду с симптомами возбуждения (повышенной раздражительности) на фоне интоксикации появляются и симптомы угнетения ЦНС: слабость, быстрая утомляемость, нарушение сна и аппетита.

Течение гнойного процесса на фоне ношения ВМК отличается особой тяжестью, при этом консервативное, даже интенсивное лечение малоэффективно. Извлечение ВМК даже на самых ранних этапах развития гнойного воспаления придатков матки не способствует купированию воспаления, выскабливание полости матки после удаления ВМК резко усугубляет тяжесть процесса.
Для больных с гнойными послеоперационными осложнениями характерно наличие преходящего пареза кишечника, сохранение или нарастание основных признаков интоксикации на фоне проводимой интенсивной терапии, а также их возобновление после короткого «светлого» промежутка.
Для акушерских больных основной клинический симптом — наличие прогрессирующего гнойного (некротического) эндомиометрита, не купирующегося даже при адекватно проводимой терапии: размеры матки не соответствуют срокам нормальной послеродовой инволюции, отсутствует тенденция к формированию шейки матки: шейка свободно в виде «паруса» свисает во влагалище, свободно пропускает один или два пальца. Наличие гематом (инфильтратов) в параметрии и/или позадипузырной клетчатке — неблагоприятный клинический признак, резко снижающий шансы на благоприятный исход консервативного лечения у данных больных.
Одной из отличительных особенностей клинического течения хронических гнойных ВЗОМТ считают волнообразность процесса. В стадии ремиссии воспалительного процесса клинические проявления выражены не резко, из всех симптомов сохраняется интоксикация легкой или средней степени тяжести. В стадии обострения проявляются основные признаки острого гнойного воспаления, при этом часто происходит появление новых осложнений.
Чаще всего обострению сопутствует острый пельвиоперитонит, характеризующийся ухудшением самочувствия и общего состояния больной, гипертермией, нарастанием явлений интоксикации, появлением в нижних отделах живота болей и слабоположительных симптомов раздражения брюшины. Острый пельвиоперитонит у больных с гнойными тубоовариальными образованиями может в любой момент привести к дальнейшим серьезным осложнениям, таким как перфорация гнойника в соседние органы, бактериальный шок, разлитой гнойный перитонит.
Разлитой гнойный перитонит развивается достаточно редко (3,1%), поскольку хронический гнойный процесс, как правило, ограничен полостью малого таза за счет многочисленных плотных сращений, брюшины и связок малого таза, сальника и прилежащих органов, т.е. превалирует гнойно-инфильтративный, «конгломератный» тип воспаления.
Чаще при прогрессировании заболевания появляются такие осложнения гнойного процесса, как параметрит, межкишечные абсцессы, гнойные свищи. О наличии параметрита у больных с гнойными тубоовариальными образованиями могут свидетельствовать клинические признаки:
- боли при мочеиспускании, пиурия (передний параметрит);
- запоры, затруднения при дефекации (задний параметрит);
- нарушение функции почек: появление мочевого синдрома, отеки, снижение диуреза (боковой параметрит);
- появление инфильтрата и гиперемии кожи над пупартовой связкой (передний параметрит);
- явления перифлебита наружной подвздошной вены (отек и цианоз кожи бедра, распирающие боли в ноге) — верхний боковой параметрит;
- проявления паранефрита (на ранних стадиях характерны проявления псоита: вынужденное положение больной с приведенной ногой) — верхний боковой параметрит.
Появление болей в мезогастральных отделах брюшной полости, сопровождающихся явлениями преходящего пареза кишечника или частичной кишечной непроходимости (тошнота, рвота, задержка стула), может свидетельствовать о формировании межкишечных абсцессов.
Появление на стороне поражения болей в грудной клетке, болезненности в области реберной дуги и шеи в месте проекции диафрагмального
нерва может косвенно свидетельствовать о формировании поддиафрагмального абсцесса.
Перфорацию тазового абсцесса (гнойное тубоовариальное образование, абсцесс маточно-прямокишечного пространства) в полые органы наблюдают у больных с длительным и рецидивирующим течением гнойного процесса. Ей предшествует так называемое состояние «предперфорации»:
- ухудшение общего состояния на фоне ремиссии имеющегося гнойного воспалительного процесса;
- повышение температуры до 38–39 °С, ознобы;
- появление болей внизу живота «пульсирующего», «дергающего» характера;
- появление тенезмов, жидкого стула (угроза перфорации в дистальные отделы кишечника, реже — в прилежащие к абсцессу отделы тонкой кишки);
- появление учащенного мочеиспускания, микрогематурии или пиурии (угроза перфорации в мочевой пузырь);
- появление инфильтрата и болей в области послеоперационно го шва.
Многократная перфорация в прилежащий отдел кишечника приводит к формированию генитальных свищей. Наиболее часто свищи формируются в различных отделах толстой кишки, чаще в верхнеампулярном отделе или ректосигмоидном углу, реже в слепой и сигмовидной кишке. Придатково-пузырные свищи встречают значительно реже, так как брюшина пузырно-маточной складки и предпузырная клетчатка расплавляются значительно медленнее. Свищи чаще диагностируют на стадии их формирования по клинике так называемой угрозы перфорации в мочевой пузырь.
При проведении влагалищного исследования гнойные тубоовариальные образования в стадии обострения характеризуются нечеткими контурами, неравномерной консистенцией, полной неподвижностью и выраженной болезненностью. При этом они всегда находятся в едином конгломерате с маткой, пальпация и определение которой крайне затруднены. Размеры гнойных образований придатков весьма вариабельны, но в острой стадии воспаления они всегда несколько больше истинных. В стадии ремиссии конгломерат имеет более четкие контуры, хотя сохраняет неравномерность консистенции и полную его неподвижность.
При сопутствующем параметрите у больных определяют инфильтраты различной (в зависимости от стадии воспалительного процесса) консистенции — от деревянистой плотности в стадии инфильтрации до неравномерной, с участками размягчения при нагноении. Воспалительные инфильтраты могут иметь различные размеры. В тяжелых случаях они достигают костей таза (боковые отделы таза, крестец, лоно) и могут распространяться на переднюю брюшную стенку и даже паранефральную клетчатку. Поражение параметрия, особенно задних его отделов, особенно хорошо выявляют при прямокишечно-влагалищном исследовании, при этом косвенно оценивают степень поражения воспалительным инфильтратом прямой кишки (слизистая подвижна, ограниченно подвижна, неподвижна).
За рубежом применяют в основном классификацию G. Monif (1982), включающую острые воспалительные процессы внутренних половых органов:
- острый эндометрит и сальпингит без признаков воспаления тазовой брюшины;
- острый эндометрит и сальпингит с признаками воспаления брюшины;
- острый сальпингоофорит с окклюзией маточных труб и развитием тубоовариальных образований;
- разрыв тубоовариального образования.
В Женевской международной статистической классификации болезней, травм и причин смерти (ВОЗ, 1980) имеются следующие нозологические формы воспалительных заболеваний внутренних половых органов.
- Острый сальпингит и оофорит:
- абсцесс: маточной трубы, яичника, тубоовариальный;
- оофорит;
- пиосальпинкс;
- сальпинит;
- воспаление придатков матки (аднекстумор).
- Острый параметрит и тазовая флегмона.
- Хронический или неуточненный параметрит и тазовая флегмона:
- абсцесс: широкой связки матки, прямокишечно-маточного углубления, параметрия, тазовая флегмона.
- Острый или неуточненный тазовый перитонит.
С практической точки зрения удобной считают классификацию, предложенную В.И. Краснопольским и соавт., позволяющую определять тактику ведения и прогноз развития и исхода заболевания. По клиническому течению заболевания и на основании патоморфологических исследований авторы выделяют две клинические формы гнойных воспалительных заболеваний гениталий: неосложненные и осложненные.
- К неосложненным формам относят острый гнойный сальпингит. При своевременной диагностике и целенаправленной терапии процесс может ограничиться поражением эндосальпинкса с последующей регрессией воспалительных изменений и выздоровлением. В случае запоздалой или неадекватной терапии острый гнойный сальпингит ос ложняется пельвиоперитонитом с частичным отграничением гнойного экссудата в маточно-прямокишечном углублении (Дуглас-абсцесс) или переходит в хроническую или осложненную форму — пиосальпинкс или гнойное тубоовариальное образование. В этих случаях изменения всех слоев маточной трубы и стромы яичника носят необратимый характер, что подтверждается результатами морфологических иссле дований.
- К осложненным формам относят все осумкованные воспалительные придатковые опухоли: пиосальпинкс, пиовар, гнойные тубоовариальные образования, при этом перспектива на последующее деторождение резко снижена или проблематична, а выздоровление больной может наступить только после хирургического лечения. При запоздалом хирургическом вмешательстве и дальнейшем прогрессировании процесса развиваются тяжелые гнойные осложнения, угрожающие жизни больной: простые и сложные генитальные свищи, микроперфорации абсцесса в брюшную полость с образованием межкишечных и поддиафрагмальных абсцессов, гнойно-инфильтративный оментит. Конечный исход гнойного процесса — сепсис.

Даже при возможности использования самых современных методов исследования основным способом диагностики, определяющим профессиональную квалификацию и клиническое мышление врача, является клинический. Все гнойные заболевания имеют специфические симптомы, отражающиеся в субъективных жалобах или данных объективного исследования. Развитие осложнений также «проходит» последовательные стадии и их четко отражают все больные при сборе информации об истории заболевания при условии знания врачом возможного течения заболевания и постановке направленных вопросов. Даже если заболевания в определенной степени имеют сходную клиническую картину (например, гнойный сальпингит и гнойные тубоовариальные образования в стадии обострения), всегда имеются клинические признаки (инициация заболевания, его продолжительность, степень интоксикации, симптоматика), позволяющие уточнить первичный клинический диагноз.
У больных с гнойными воспалительными заболеваниями внутренних половых органов целесообразна 3-этапная система обследования.
- При неосложненных формах:
- первый этап — клиническое обследование, включающее бимануальное исследование, бактериологическую и лабораторную диагностику;
- второй этап — трансвагинальная эхография органов малого таза;
- третий этап — лапароскопия для гинекологических больных (гистероскопия для послеродовых больных).
- При осложненнных формах:
- первый этап — клиническое обследование, включающее бимануальное и ректовагинальное исследование, бактериологическую и лабораторную диагностику;
- второй этап — трансабдоминальная и трансвагинальная эхография органов малого таза, брюшной полости, почек, печени и селезенки, эхокардиография, эхография с дополнительным контрастированием прямой кишки;
- третий этап — рентгенологическое исследование легких, дополнительные инвазивные методы обследования: цисто- и колоноскопия, фистулография.
В настоящее время даже при наличии тяжелых форм гнойного воспаления часто наблюдают «стертую» лабораторную симптоматику, обусловленную, в том числе, применением массивной антибактериальной терапии и местной санации. Поэтому нецелесообразно ориентироваться на лейкоцитоз как на основной маркер гнойного процесса (наблюдают только у 1/3 больных). Кроме того, лейкопению отмечают у 11,4% больных с тяжелыми формами гнойных ВЗОМТ у женщин. Она сопряжена с персистенцией в крови патологических аутоантитела к мембранам нейтрофилов.
В целом для данных пациенток наиболее характерно повышение СОЭ, наличие лимфопении и анемии. Анемию считают интоксикационной и степень ее коррелирует с тяжестью состояния больных.
Показатели периферической крови отражают стадию гнойного процесса. В стадии обострения чаще выявляют лейкоцитоз, повышение СОЭ (до 60–70 мм/ч), C-реактивный белок. При ремиссии гнойного процесса наблюдают снижение числа эритроцитов и гемоглобина, лимфопению и повышенную СОЭ.
Длительное течение гнойного процесса сопровождается нарушением белкового (гипо- и диспротеинемия), минерального, липидного обмена и ферментативной функции печени.
Выраженные нарушения системы гемостаза (с преобладанием процессов гиперкоагуляции) отмечают у 35,7% пациенток с осложненными формами гнойного воспаления, нарушения системы кровообращения — у 69,4% (гипокинетический тип кровообращения у 22% больных, снижение сократительной функции миокарда у 13% и нарушение скорости мозгового кровотока у 52% больных).
Основной дополнительный метод диагностики — эхография. Для гнойных тубоовариальных образований характерно:
- форма их чаще бывает неправильной, но все-таки приближается к овоидной;
- внутренняя структура отличается полиморфизмом: неоднородна и, как правило, представлена среднедисперсной эхопозитивной взвесью на фоне повышенного уровня звукопроводимости;
- контуры гнойного тубоовариального образования могут быть представлены: эхопозитивной толстой капсулой с четкими контурами, капсулой с участками неравномерной толщины и участками резкого истончения, а также образованием без четких контуров; при этом выявляют отсутствие сосудистой сети внутри образования.

Острый сальпингит дифференцируют.
- Острый аппендицит. Нехарактерна связь заболевания с перечисленными ранее факторами риска; заболевание возникает внезапно, ранний признак — приступообразная боль, вначале локализующаяся в области пупка или в эпигастрии, затем в области слепой кишки. Решающее значение в диагностике острого аппендицита — выявление симптомов Ситковского (усиление болей в правой подвздошной области при положении больного на левом боку) и Ровсинга (усиление болей в области слепой кишки при толчкообразном надавливании в левой подвздошной области). Для острого аппендицита также характерно почасовое нарастание количества лейкоцитов в анализе крови при исследовании в динамике.
- Эктопическая беременность, особенно в случае формирования и нагноения заматочных гематом, когда присоединяющиеся вторичные воспалительные изменения маскируют исходное заболевание. Для эктопической беременности характерны: нарушения менструального цикла (чаще задержка менструации с последующими длительными кровянистыми выделениями мажущего характера), наличие болей с иррадиацией в прямую кишку, периоды кратковременного на рушения сознания (головокружение, обморок и т.д.). Проведению дифференциального диагноза помогает определение ХГТ в крови и моче (в лаборатории или методом экспресс-тестов). В сложных случаях проведение пункции заднего свода или лапароскопии решает диагностическую проблему.
Гнойные тубоовариальные образования следует дифференцировать:
- при правосторонней локализации — с аппендикулярным инфильтратом;
- при преимущественно левосторонней локализации процесса — с дивертикулитом;
- с первичной карциномой трубы;
- с раком яичника;
- с инфильтративными формами эндометриоза.

В отдельных случаях есть показания для консультации хирурга, уролога, нефролога, сосудистого хирурга (см. 3-й этап обследования при осложненных формах).

Цель лечения гнойно-воспалительных заболеваний органов малого таза – ликвидация гнойного процесса (очага) в брюшной полости: сохранение жизни, здоровья, по возможности – детородной, менструальной и гормональной специфических женских функций. Отсутствие лечения у всех больных с гнойными ВЗОМТ приводит к тяжелым осложнениям (гнойный перитонит, сепсис) и летальности.
Абсолютные. Все пациентки с гнойными ВЗОМТ или подозрением на наличие данных заболеваний (см. группы риска и клинику) должны быть госпитализированы. Промедление с госпитализацией, проведение амбулаторного лечения, отсутствие своевременного оперативного вмешательства лишь усугубляет состояние пациенток и ограничивает в дальнейшем проведение органосберегающего лечения.
У данных больных из-за тяжести патологии не имеет решающего значения.
Ввиду тяжести общих и местных изменений у больных с гнойными заболеваниями органов малого таза и чрезвычайном риске генерализации процесса важными считают следующие тактические положения: при любой форме гнойного воспаления лечение может быть только комплексным, консервативно-хирургическим, состоящим из:
- патогенетически направленной предоперационной подготовки;
- своевременного и адекватного объема хирургического вмешательства, направленного на удаление очага деструкции;
- интенсивного и рационального ведения послеоперационного периода, причем чем раньше выполнена хирургическая санация очага, тем лучше исходы заболевания.
Предоперационная подготовка у больных с гнойным сальпингитом направлена на купирование острых проявлений воспаления и подавление агрессии микробного возбудителя. Для лечения больных с острым гнойным сальпингитом целесообразно использовать антибиотики (или их комбинации) с обязательным интраоперационным (во время лапароскопии) внутривенным их введением и продолжением антибактериальной терапии в послеоперационном периоде в течение 5–7 сут.
- Ингибиторозащищенные пенициллины, например амоксициллин + клавулановая кислота (клавуланат). Разовая доза препарата 1,2 г в/в, суточная доза 4,8 г, курсовая доза 24 г с интраоперационным (при проведении лапароскопии) внутривенным введением 1,2 г препарата.
- Фторхинолоны (хинолоны II поколения) в комбинации с нитроимидазолами (метронидазолом), например ципрофлоксацин или офлоксацин в разовой дозе 0,2 г в/в капельно (суточная доза 0,4 г, курсовая доза 2,4 г) с интраоперационным внутривенным введением 0,2 г препарата.
- Цефалоспорины III поколения в комбинации с нитроимидазолами (метронидазолом).
- проведение инфузионной терапии (кристаллоиды, корректоры электролитного обмена, плазмозамещающие и белковые препараты) в объеме трансфузий 1000–1500 мл/сут. Продолжительность терапии индивидуальна (в среднем 3–5 сут);
- назначение десенсибилизирующих и антигистаминных препаратов;
- применение НПВС, обладающих противовоспалительным, анальгетическим и антиагрегационным эффектом (препараты назначают после отмены антибиотиков);
- использование иммунокорректоров с первых суток лечения. С этой целью целесообразно применять аминодигидрофталазиндион натрия по следующей схеме: в 1-й день 0,2 г в/м, затем 3 дня ежедневно по 0,1 г в/м, с 5-х суток лечения — по 0,1 г 5 инъекций через день (на курс 10 инъекций препарата). Всем пациенткам, не получившим иммунокорригирующую терапию в стационаре, при выписке следует рекомендовать ее проведение в амбулаторных условиях с целью профилактики рецидива гнойного процесса.
На фоне проводимого консервативного лечения в первые 2–3 сут необходимо эвакуировать гнойный экссудат (хирургический компонент лечения). Наиболее эффективным методом хирургического лечения гнойного сальпингита на современном этапе считают лапароскопию, особенно у молодых, нерожавших пациенток.
При гнойном сальпингите адекватный объем вмешательства — адгезиолизис, санация и трансвагинальное (через кольпотомное отверстие) дренирование малого таза. В случаях гнойного сальпингоофорита и пельвиоперитонита с образованием осумкованного абсцесса в прямокишечно-маточном углублении адекватным пособием считают мобилизацию придатков матки, опорожнение абсцесса, санацию и активное аспирационное дренирование через кольпотомное отверстие. При сформировавшемся пиосальпинксе необходимо удалять маточную трубу или трубы. При пиоваре небольших размеров (до 6–8 см в диаметре) и сохранении интактной яичниковой ткани целесообразно произвести вылущивание гнойного образования. При абсцессе яичника проводят удаление яичника. Показанием к удалению придатков матки служит наличие в них необратимых гнойно-некротических изменений. Все операции необходимо заканчивать повторным тщательным промыванием малого таза и ревизией надпеченочного пространства для исключения затекания гноя и крови. С целью создания благоприятных условий для репарации и активной эвакуации экссудата целесообразно проводить активную аспирацию при помощи аппарата ОП-1 [19]. Это особенно важно у пациенток с выраженными гнойно-некротическими изменениями, когда после разъединения сращений образуются большие раневые поверхности, что приводит к продуцированию значительного количества раневого секрета и способствует образованию серозных или гнойных полостей, т.е. затяжному течению заболевания и его рецидивам.
Для проведения аспирационно-промывного дренирования (АПД) одну или две двухпросветные трубки из силиконовой резины диаметром 11 мм подводят к зонам наибольшей деструкции в малом тазе и выводят наружу через кольпотомное отверстие (или, при отсутствии условий для кольпотомии, через дополнительные контрапертуры в гипогастральных отделах). Подключают хирургический отсос (ОП-О1). АПД осуществляют введением раствора фурацилина (1:5000) по узкому просвету трубки со скоростью 20 капель в минуту и аспирацией под давлением 30 см вод.ст. в течение 2–3 сут в зависимости от тяжести процесса с периодическим струйным промыванием трубок при наличии гнойных «пробок».
Данный способ является методом патогенетической терапии, который воздействует на первичный очаг. При этом:
- осуществляется активное вымывание и механическое удаление инфицированного и токсичного содержимого брюшной полости;
- гипотермическое действие охлажденного фурацилина приостанавливает дальнейшее нарастание микробной инвазии, способствует снятию отека в пораженном органе и окружающих тканях, предотвращает поступление токсинов и микроорганизмов в кровеносную и лимфатическую системы;
- надежный отток промывной жидкости при отрицательном давлении исключает возможность накопления раствора в брюшной полости, позволяет очистить брюшину от фибрина, некротического детрита и уменьшить отек и инфильтрацию тканей;
Альтернативой служит методика проведения динамических лапароскопий, начиная со 2-х суток послеоперационного периода с периодичностью в 2 дня. Методика позволяет осуществить контроль за динамикой воспалительного процесса, разделить формирующиеся спайки, подводить лекарственные препараты непосредственно к очагу инфекции, проводить программированную санацию брюшной полости.
В послеоперационном периоде (до 7 дней) рекомендовано проведение антибактериальной, инфузионной и рассасывающей терапии. Необходимо подчеркнуть, что больные с гнойным сальпингитом после купирования острого воспаления нуждаются в длительной реабилитации, направленной на профилактику рецидива заболевания и восстановление фертильности.
Базовый компонент — хирургическое лечение. «Точки приложения» антибактериальной терапии у больных с осложненными формами гнойных ВЗОМТ определены особыми временными отрезками сложного и длительного течения заболевания. Применение антибиотиков целесообразно в следующих клинических ситуациях:
- у всех больных с острой гнойной инфекцией (манифестация заболевания);
- при клинических проявлениях активизации подострой или хронической гнойной инфекции и возникновении угрозы перфорации абсцесса или генерализации инфекции;
- интраоперационно у всех пациенток с целью периоперационной защиты и профилактики септического шока (препарат вводят в максимальной разовой дозе);
- в послеоперационном периоде у всех больных.
При генерализованных формах инфекции (перитонит, сепсис) антибактериальную терапию назначают немедленно, продолжительностью в интраоперационном (профилактика бактериального шока и послеоперационных осложнений) и в послеоперационном периоде.
Несмотря на существенный прорыв в микробиологической диагностике за последние 10–15 лет, первоначальный выбор антибактериальной терапии остается эмпирическим. В зависимости от тяжести заболевания препараты назначают в средней или максимальной разовой и суточной дозе. Для лечения данных больных целесообразно использовать следующие препараты.
- Ингибиторозащищенные пенициллины, например тикарциллин + клавулановая кислота (тиментин), пиперациллин + тазобактам (тазоцин). Преимущество этих препаратов заключается в их высокой активности в отношении аэробных и анаэробных бактерий, в том числе энтерококков и микроорганизмов, продуцирующих β-лактамазу.
- Цефалоспорины III поколения в комбинации с нитроимидазолами (метронидазолом). Обладают высокой активностью в отношении грамотрицательных бактерий, а также стафилококков, однако они имеют низкую антианаэробную активность, что требует их комбинации с антианаэробными препаратами.
- Ингибиторозащищенные цефалоспорины III поколения (цефоперазон + сульбактам). Препарат широкого спектра действия, обладающий, в числе прочего, и высокой антианаэробной активностью.
- Комбинацию линкозамидов и аминогликозидов, например комбинацию клиндамицин + аминогликозиды. Линкозамиды высокоактивны в отношении анаэробной и грамположительной кокковой флоры, аминогликозиды — в отношении грамотрицательных бактерий, при этом «пульс-терапия» аминогликозидами (введение суточной дозы за один прием) имеет преимущество перед традиционными схемами назначения (2–3 раза в сутки) как в плане клинической эффективности, так и более низкой нефро- и ототоксичности.
- Карбапенемы: имипенем + циластин (тиенам) или меропенем (меронем) — препараты, обладающие наиболее широким спектром антимикробной активности, в том числе против штаммов грамотрицательных бактерий, устойчивых к цефалоспоринам. Первостепенное значение в проведении предоперационной подготовки имеет дезинтоксикационная и детоксикационная терапия. Эффект детоксикации и подготовки больных к операции значительно повышается при эвакуации гнойного экссудата.
Показания для проведения дренирующих паллиативных операций (пункция или кольпотомия) у больных с осложненными формами гнойного воспаления:
- угроза перфорации абсцесса в брюшную полость или полый орган (с целью предупреждения перитонита или формирования свищей);
- наличие острого пельвиоперитонита, на фоне которого хирургическое лечение наименее благоприятно;
- тяжелая степень интоксикации.
По достижении ремиссии пациенток необходимо оперировать. Проведение повторных пункций заднего свода и кольпотомий нецелесообразно, поскольку это способствует формированию придатково-влагалищных свищей. Продолжительность предоперационной подготовки определяется индивидуально. Оптимальной для операции считается стадия ремиссии гнойного процесса.
Интенсивное консервативное лечение должно продолжаться не более 5 дней, а при развитии клинических проявлений угрозы перфорации — не более 12–24 ч, если нельзя провести паллиативного вмешательства с целью устранения угрозы перфорации.
В случае появления экстренных показаний к операции в течение 1,5–2 ч проводят предоперационную подготовку, включающую катетеризацию подключичной вены и трансфузионную терапию под контролем ЦВД в объеме как минимум 1200 мл коллоидов, белков и кристаллоидов в объеме 1:1:1.
Показания к экстренному вмешательству:
- перфорация абсцесса в брюшную полость с развитием разлитого гнойного перитонита;
- перфорация абсцесса в мочевой пузырь или ее угроза;
- септический шок.
Отличается характер хирургического лечения от тактики ведения больных с неосложненными формами. Таким пациенткам показана только лапаротомия.
Объем хирургического вмешательства индивидуален и зависит от следующих основных моментов: характера процесса, сопутствующей патологии гениталий и возраста больных. Представления об объеме операции должны складываться еще до операции после получения данных обследования и выявления степени поражения матки, придатков, определения характера осложнений и наличия экстрагенитальных гнойных очагов. Показания к выполнению реконструктивной операции с сохранением матки в первую очередь — отсутствие гнойного эндомиометрита или панметрита, множественных экстрагенитальных гнойных очагов в малом тазу и брюшной полости, а также сопутствующей тяжелой генитальной патологии (аденомиоз, миома). При наличии двусторонних гнойных тубоовариальных абсцессов, осложненных генитальными свищами, выраженного обширного гнойно-деструктивного процесса в малом тазу со множественными абсцессами и инфильтратами тазовой и параметральной клетчатки, подтверждении гнойного эндомиометрита или панметрита необходимо производить экстирпацию матки с сохранением, по-возможности, хотя бы части неизмененного яичника.
Основной принцип дренирования — установление дренажей по основным путям миграции жидкости в брюшной полости и малом тазе, т.е. основная часть дренажей должна находиться в латеральных каналах и позадиматочном пространстве, что обеспечивает полное удаление патологического субстрата. Целесообразно использование аспирационно-промывного дренирования с введением двухпросветных дренажных трубок:
- трансвагинально через открытый купол влагалища после экстирпации матки (дренажи диаметром 11 мм);
- посредством задней кольпотомии при сохраненной матке (целесообразно использовать дренаж диаметром 11 мм или два дренажа диаметром 8 мм);
- трансабдоминально (дополнительно трансвагинальному) через контрапертуры в мезо- или эпигастральных областях при наличии подпеченочных или межкишечных абсцессов — дренажи диаметром 8 мм.
Оптимальным режимом разряжения в аппарате при дренировании брюшной полости считают 30–40 см вод.ст. Средняя продолжительность дренирования 3 сут. Критериями прекращения дренирования служит улучшение состояния больной, восстановление функции кишечника, купирование воспалительного процесса в брюшной полости, тенденция к нормализации клинических анализов крови и температуры тела.
- Применение адекватного обезболивания. Оптимальный метод — применение длительной эпидуральной анестезии. Если по каким-либо причинам, не связанным с наличием противопоказаний, во время операции не проводилась комбинированная анестезия, то в послеоперационном периоде следует применить данный метод обезболивания и лечения. При наличии противопоказаний к использованию метода ДЭА в течение первых 3 сут обезболивание следует проводить наркотическими анальгетиками. Для потенцирования действия их следует сочетать с антигистаминными и седативными препаратами.
- Инфузионная терапия. Для коррекции нарушений в послеоперационном периоде важно как качество инфузионных сред, так и объем инфузии. Показано введение коллоидов (400–800 мл/сут), белковых препаратов из расчета 1–1,5 г нативного белка на 1 кг массы тела (при тяжелом течении процесса доза белка может быть увеличена до 150–200 г/сут); остальной объем замещают кристаллоидами. Количество вводимой жидкости, при условии сохраненной функции почек, составляет 35–40 мл/кг/сут. При тяжелых формах осложнений (перитонит, сепсис) количество вводимой жидкости может быть увеличено до 4–6 л (режим гиперволемии) с регуляцией мочеотделения (форсированный диурез). При септическом шоке количество вводимой жидкости не должно превышать количество выделенной мочи более чем на 800–1000 мл.
- Стимуляция кишечника. Адекватна «мягкая», физиологическая стимуляция кишечника за счет применения в первую очередь эпидуральной блокады, во вторую — адекватной инфузионной терапии в объеме нормо- или незначительной гиперволемии, в третью — за счет преимущественного использования препарата метоклопрамида, оказывающего регулирующее влияние на моторику ЖКТ. В лечении пареза кишечника немаловажную роль также играет коррекция гипокалиемии. Вводить препараты калия необходимо под контролем его содержания в сыворотке крови медленно, в разведенном виде, лучше в отдельную вену. В среднем в сутки вводят 6–8 г калия с учетом его содержания в других растворах (свежезамороженная плазма, гемодез и прочие).
- Целесообразно применять ингибиторы протеаз.
- У всех больных при отсутствии противопоказаний целесообразно использовать низкомолекулярный гепарин — надропарин кальция в дозе 0,3 мл (285 ME анти-Ха активности соответственно) под кожу живота в течение 5–7 дней, а также средств, улучшающих реологические свойства крови. Необходимо использование компрессионных чулков (эластичных бинтов), а также пневматической манжеточной компрессии с первых суток послеоперационного периода.
- Лечение глюкокортикоидами. Целесообразно использование преднизолона в суточной дозе 90–120 мг/сут (в зависимости от массы тела) с постепенным снижением и отменой препарата через 5–7 дней.
- Показано применение НПВС (назначают после отмены антибиотиков).
- По показаниям проводят терапию органных нарушений гепатотропными [фосфолипиды + поливитамины (эссенциале)] и кардиологическими средствами, применяют спазмолитики, экстракорпоральные методы детоксикации (плазмаферез).
- Иммунокоррекция. Целесообразно использование препарата аминодигидрофталазиона натрия, обладающего также выраженным противовоспалительным и антиоксидантным действием. Препарат применяют по следующей схеме: в первые сутки 0,2 г в/м, затем 3 дня ежедневно по 0,1 г в/м, далее через день 5 инъекций; затем 2 раза в неделю по 0,1 г в/м (курс лечения — 20 инъекций).
Все пациентки, перенесшие гнойно-воспалительные заболевания органов малого таза, нуждаются в длительной реабилитации.
источник