— Каким же образом действует интерферон на вирус? Может ли он соединяться с вирусом и нейтрализовать его, как это делают антитела?
— Нет, инферферон с вирусом не соединяется, и в этом одно из его решающих отличий от антител.
— Но, может быть, интерферон не дает вирусу адсорбироваться на клеточной оболочке, или как-то мешает ему проникнуть внутрь клетки, или, действуя на вирусную нуклеиновую кислоту, инактивирует ее?
— Вот здесь вы несколько ближе к истине, Люди часто стараются найти уже известные аналогии для объяснения нового и непонятного. Так произошло и с интерфероном, действие которого на вирусы совершенно необычное.
Многие ученые в разных странах мира обнаружили, что интерферон наделен необычайно широким «спектром» противовирусной активности: он подавляет размножение большинства известных вирусов. Препятствует размножению вируса оспы в коже, вируса гриппа в легких, вируса энцефалита в мозгу, вируса лейкоза в костном мозге или в лейкоцитах крови.
Механизм такого бесконечного универсализма должен быть единым, направленным на какой-то общий этап размножения всех этих паразитов. В этом огромное преимущество интерферона перед антителами, которые соединяются, а затем нейтрализуют строго специфически лишь тот вирус, который вызвал их образование (например, антитела против вируса гриппа типа А не действуют даже на вирус гриппа типа В).
Подавление.
Уже первые поиски установили, что непосредственного воздействия на вирус интерферон не оказывает. Действительно, пробовали соединить в пробирке вирусную суспензию с концентрированными препаратами интерферона, а затем заразить этой смесью животное. И убедились, что инфекционный процесс развивается с такой же интенсивностью, как и при использовании вируса без интерферона.
Расшифровали механизм действия интерферона совсем недавно. И сделали это американский вирусолог С. Барон и наши советские ученые, москвичи Ф. Ершов и В. Жданов в Институте вирусологии имени Д. Ивановского. Они доказали, что весь процесс защиты организма от внедрившегося вируса происходит внутри еще не зараженных клеток, а в 1975 году группа ученых Йельского университета (США) установила, что в ядрах клеток человека, в хромосоме № 21, находится специальная группа генов (специфический участок ДНК, с которым соединяется молекула интерферона, как только она проникает в клетку), отвечающая за этот процесс.
Небольшая молекула интерферона способна свободно проходить через клеточные оболочки и, проникая в цитоплазму, воздействовать на синтетический аппарат клетки так, что он становится непригодным для размножения вирусов. Этот механизм коренным образом отличается от действия антител, которые для выполнения своей функции должны обязательно соединиться с вирусами, находящимися вне клетки. Только таким путем антитела препятствуют переходу вируса от зараженной клетки к здоровой.
К сожалению, процессы, происходящие на уровне таких мелких молекул, какой является интерферон, нельзя увидеть. Но тончайшие методы современной вирусологии и генетики позволяют косвенно проследить за ходом этих процессов.
В. Жданов, Ф. Ершов и их сотрудники установили, что интерферон как бы пробуждает от спячки группу генов, отвечающих за синтез особых информационных РНК, с помощью которых клетка быстро строит антивирусный белок. Дальше события разворачиваются совершенно необычным образом. Вновь синтезированный антивирусный белок используется клеткой не для нейтрализации самого вируса, а для того, чтобы нарушить так хитро налаженный механизм печатания копий вирусных РНК и сделать невозможным воспроизводство вирусного потомства. Все синтетические процессы, необходимые для нормального функционирования самой клетки, сохраняются.
Каждая молекула антивирусного белка присоединяется к одной из рибосом, слегка изменяя этим ее конфигурацию. Такие рибосомы по-прежнему сохраняют способность соединяться под влиянием информационных РНК в полисомные комплексы и строить новые клеточные белки. Однако если полисома сформируется под воздействием вирусной информационной РНК, то дальнейшей передачи информации не будет и синтеза вирусных белков не произойдет.
Некоторые вирусологи считают, что молекула интерферона или даже отдельные ее фрагменты могут соединяться с рибосомами и делать их непригодными для передачи вирусной информации и синтеза компонентов вирусной частицы. Так или иначе, но после контакта с молекулой интерферона каждая клетка превращается в своеобразную ловушку, куда вирус легко попадает и где он находит свою могилу, не выполнив главной задачи паразита — произвести потомство.
Многие ученые говорили о преимущественной защитной роли интерферона при таких кратковременных и остротекущих инфекциях, как грипп. В Научно-исследовательском институте эпидемиологии и микробиологии имени Л. Пастера обследовали большое число сывороток крови людей, заболевших гриппом и лечившихся в больнице имени С. Боткина в Ленинграде. Оказалось, что чем больше интерферона образовывалось в первые дни болезни, тем легче протекал грипп и тем быстрее поправлялся больной. У некоторых людей интерферон вообще препятствовал развитию болезни, хотя скрытая инфекция была и это подтверждалось образованием антител.
Полезное влияние интерферона зависит от степени болезнетворности, зловредности вируса для организма, а также от общего состояния здоровья человека. Защитный эффект интерферона снижается, если возбудитель вирусной инфекции чрезмерно разрушителен, токсичен, а человек ослаблен переутомлением, нервными переживаниями, хроническими заболеваниями сердца, печени, легких.
Когда система интерферона не срабатывала, грипп становился фатальным для больного. Именно это доказал известный английский ученый Д. Тиррелл, обследуя большое число людей, для которых грипп стал причиной смерти. Все они погибли в первые дни заболевания гриппом. Ни у одного из этих людей не удалось обнаружить интерферон ни в легких, ни в крови.
И наоборот, можно считать, что благополучный исход вирусной инфекции является результатом активной оборонительной деятельности зараженных клеток, вырабатывающих интерферон, который нарушает синтез новых вирусных частиц и ликвидирует опасность появления и распространения по организму новых генераций вируса.
Ученые не только доказали, что одним из факторов, определяющих сопротивляемость организма вирусной инфекции, служит его способность вырабатывать интерферон, но и что у разных людей она неодинакова. Большую роль играют врожденные особенности организма. Около трети населения обладают характерными наследственными чертами, вследствие которых их организм плохо производит интерферон. Зависит эта способность и от возраста: интерферон слабее вырабатывается у детей до двухлетнего возраста, а также у пожилых людей старше 60-65 лет.
Формирование интерферона идет по-разному в зависимости от внешних условий
Формирование интерферона идет по-разному в зависимости от внешних условий, например, погоды, температуры воздуха, времени года. Зимой или осенью организм медленнее производит интерферон и в меньших количествах, чем в теплое время. Поэтому летом люди гораздо реже страдают от гриппа и других заболеваний верхнего дыхательного тракта.
Таким образом, фронт борьбы с вирусами пролегает внутри живых клеток. Очень сложен путь его познания и долог. Исследователи находятся сейчас лишь в самом его начале. Однако новые факты, которыми человечество овладело совсем недавно, помогли разгадать, пожалуй, самую сложную загадку — универсальный механизм, с помощью которого природа помогла всем живущим на земле существам одерживать победу над вирусами.
источник
Вирусы оспы (ВО) — самые крупные вирусы, содержащие ДНК, молекулярная масса которой больше, чем у любого другого вируса животных. Они широко распространены в природе, вызывают заболевания позвоночных и беспозвоночных с летальным исходом или в виде легко протекающей продолжительной инфекции с образованием доброкачественных опухолей. ВО передаются членистоногими при прямом контакте, аэрозольно или механически. ВО обычно имеют узкий круг хозяев, хотя некоторые из них представляют исключения, в том числе вирусы вакцины и оспы птиц. Вирусы оспы позвоночных включают восемь родов (орто-, пара-, ави-, капри-, лепори-, суи-, моллюсци- и ятапоксвирусы).
Разделение вирусов оспы позвоночных на роды проведено с учетом массы и структуры генома, размера и формы вириона, способности к генетической рекомбинации, антигенной связи и спектра патогенности.
Ортопоксвирусы. Типичный представитель — вирус осповакцины (ВОВ). Спектр естественных хозяев узкий, обычно ограничен одним видом животных: вирусы агглютинируют эритроциты цыплят; варьируют по вирулентности для естественных хозяев и лабораторных животных. Другие виды: вирусы оспы буйволов, верблюдов, крупного рогатого скота, мышей, обезьян и вирус натуральной оспы.
Парапоксвирусы. Типичный представитель — вирус контагиозного пустулёзного дерматита (эктимы) овец и коз (вирус орф). Представители рода серологически связаны между собой, но отличаются от представителей других родов; гемагглютинин не образуют. Другие виды: вирусы пустулёзного стоматита крупного рогатого скота, контагиозной эктимы серн и сыпи доярок.
Авипоксвирусы. Естественные хозяева — птицы; типичный представитель — вирус оспы кур. Члены рода серологически связаны между собой. Другие виды: вирусы оспы канареек, голубей, перепелов, воробьев, скворцов, индеек и оспы Юнко. Передаются членистоногими.
Каприпоксвирусы. Естественные хозяева — парнокопытные; типичный представитель — ВО мелких жвачных (овец и коз). В данный род входит также вирус кожной бугорчатки крупного рогатого скота.
Лепорипоксвирусы. Типичный представитель — вирус миксомы кроликов. Передается механически членистоногими. Другие виды: вирусы фибромы зайцев, кроликов (вирус Шоупа) и белок. Вирус злокачественной фибромы кроликов — летальный туморогенный поксвирус, возникший, по-видимому, вследствие рекомбинации между вирусами фибромы и миксомы кроликов.
Суипоксвирусы. Типичный представитель — вирус оспы свиней. В инфицированных клетках образуются несколько типов цитоплазматических включений и наблюдается вакуолизация ядра. Другие члены рода не определены.
Моллюсципоксвирусы. Типичный представитель — вирус контагиозного моллюска. Возможные члены рода — вирусы однокопытных и обезьян.
Ятапоксвирусы включают вирус опухолей обезьян Яба и вирус оспы Тана.
Вирусы оспы — наиболее крупные из всех вирусов животных. Под электронным микроскопом они выглядят как большие овальные (кирпичеобразные) частицы размером около 250-350×200-270 нм.
Орто-, ави-, лепорипоксвирусы более вытянуты, а вирус оспы свиней шире, чем другие ВО. Парапоксвирусы имеют овальную (коконообразную) форму и размер 260×160 нм.
В структуре вирусов оспы различают три основных компонента: двояковогнутую сердцевину, овальные боковые тела и оболочку вириона. Сердцевину вириона составляют ДНК и связанные с нею белки. Сердцевина окружена гладкой мембраной (толщиной около 5 нм), снаружи покрытой слоем вертикально уложенных и плотно прилегающих друг к другу цилиндрических субъединиц (5×10 нм). Вогнутость сердцевины с обеих сторон занята овальными образованиями (неизвестной природы), называемыми боковыми телами. Они как бы сдавливают сердцевину, придавая ей форму двояковогнутого диска, имеющего на разрезе вид гантели.
Вирионы заключены в липопротеиновую супероболочку, которая имеет толщину 20—30 нм и содержит липиды клетки и вирусспецифические белки.
Вирионы большинства вирусов оспы окружены слоем беспорядочно расположенных трубчатых структур, придающих им характерный вид. Эти структуры состоят из сферических субъединиц диаметром около 5 нм. Субъединицы построены из молекул протеина или гликопротеина. В состав ворсинок длиной 20 нм покрывающих поверхность вируса осповакцины (ВОВ), входит белок с молекулярной массой 58 кД, относящийся к главным полипептидам вириона. Поверхность парапоксвирусов покрыта длинными нитеподобными трубочками, уложенными крест-накрест, напоминающими клубок пряжи.
Вирус осповакцины содержит белки, липиды и ДНК, которые соответственно составляют 90, 5 и 3,2% массы вириона (5х10
15 г). В вирусе оспы птиц около 1/3 массы составляют липиды.
Вирион образуется включением ДНК внутрь незрелых вирусоподобных частиц, которые затем созревают, покрываясь дополнительно наружными оболочками. Репликация и сборка вирионов происходят в разных местах цитоплазмы (в виропластах или вирусных фабриках), и вирионы освобождаются почкованием или при лизисе клеток.
Вирионы, освободившиеся из клетки почкованием до ее разрушения, покрыты оболочкой, которая содержит клеточные липиды и несколько вирусспецифических белков.
источник
ТРАНСКРИПЦИЯ
Транскрипция — это переписывание ДНК на РНК по законам генетического кода. Это означает, что РНК состоит из нуклеотидных последовательностей, комплементарных ДНК. Нити ДНК в участке транскрипции разделяются и функционируют как матрицы, к которым присоединяются комплементарные нуклеотиды благодаря спариванию комплементарных оснований (аденин связывается с тимином, урацил — с аденином, гуанин — с цитозином и цитозин — с гуанином). Транскрипция осуществляется с помощью специального фермента — РНК-полимеразы, который связывает нуклеотиды путем образования 3′-5′-фосфодиэфирных мостиков. Такое связывание происходит лишь в присутствии ДНК-матрицы.
Продуктами транскрипции в клетке являются иРНК. Сама клеточная ДНК, являющаяся носителем генетической информации, не может непосредственно программировать синтез белка. Передачу генетической информации от ДНК к рибосомам осуществляет РНК-посредник. На этом основана центральная догма молекулярной биологии, которая выражается следующей схемой:
ДНК — (транскрипция) –и РНК – (трансляция) — белок
где стрелки показывают направление переноса генетической информации.
Реализация генетической информации у вирусов. Стратегия вирусного генома в отношении синтеза иРНК у разных вирусов различна. У ДНК-содержащих вирусов иРНК синтезируется на матрице одной из нитей ДНК. Формула переноса генетической информации у них такая же, как и в клетке.
ДНК-содержащие вирусы, репродукция которых происходит в ядре, используют для транскрипции клеточную полимеразу. К этим вирусам относятся паповавирусы, аденовирусы, вирусы герпеса. ДНК-содержащие вирусы, репродукция которых происходит в цитоплазме, не могут использовать клеточный фермент, находящийся в ядре. Транскрипция их генома осуществляется вирусспецифическим ферментом — ДНК-полимеразой, которая проникает в клетку в составе вируса. К этим вирусам относятся вирусы оспы и иридовирусы.
РНК-содержащие вирусы, у которых хранителем генетической информации является не ДНК, а РНК, решают эту проблему особым образом. У РНК-содержащих «плюс-нитевых» вирусов, у которых функции иРНК выполняет сам геном, передача генетической информации осуществляется по наиболее простой схеме:
К этой группе вирусов относятся пикорнавирусы, тогавирусы, коронавирусы. У них нет необходимости в акте транскрипции для синтеза вируспецифических белков. Поэтому транскрипцию как самостоятельный процесс у этих вирусов не выделяют. Иначе обстоит дело у вирусов, геном которых не может выполнять функцию иРНК. В клетке синтезируется комплементарная геному РНК, которая и является информационной. Передача генетической информации у этих вирусов осуществляется по схеме:
РНК– иPHK — белок
У этих вирусов транскрипция выделена как самостоятельный процесс в инфекционном цикле. К ним относятся две группы вирусов животных.
1.Вирусы, геном которых представлен однонитчатой РНК: ортомиксовирусы, парамиксовирусы, рабдовирусы, буньявирусы. Поскольку геномная РНК этих вирусов является «минус-нитью», указанную группу вирусов называют «минус-нитевыми» вирусами.
2. Вирусы, геном которых представлен двунитчатой РНК (диплорнавирусы). Среди вирусов животных к ним относятся реовирусы.
В клетке нет фермента, который может полимеризовать нуклеотиды на матрице РНК. Эту функцию выполняет вирусспецифический фермент — РНК-полимераза, или транскриптаза, которая находится в составе вирусов и вместе с ними проникает в клетку.
Среди РНК-содержащих вирусов животных есть семейство ретровирусов, которые имеют уникальный путь передачи генетической информации. РНК этих вирусов переписывается на ДНК, ДНК интегрирует с клеточным геномом и в его составе переписывается на РНК, которая обладает информационными функциями. Путь передачи генетической информации в-этом случае осуществляется по более сложной схеме:
В составе этих вирусов есть уникальный вирусспецифический фермент, который переписывает РНК на ДНК. Этот процесс называется обратной транскрипцией, а фермент — обратная транскриптаза, или ревертаза. Тот же фермент синтезирует нить ДНК на матрице ДНК. Двунитчатая ДНК после замыкания в кольцо интегрирует с клеточным геномом, и транскрипцию интегрированной ДНК в составе клеточных геномов осуществляет клеточная РНК-полимераза. Поскольку иРНК ретровирусов гомологична геномной РНК (а не комплементарна ей), ретровирусы являются «плюс-нитевыми» вирусами.
Ферменты, транскрибирующие вирусный геном. Транскрипция ряда ДНК-содержащих вирусов — паповавирусов, аденовирусов, вирусов герпеса, парвовирусов, гепадна-вирусов осуществляется в ядре клетки, и в этом процессе широко используются механизмы клеточной транскрипции — ферменты транскрипции и дальнейшей модификации транскриптов. Транскрипция этих вирусов осуществляется клеточной РНК-полимеразой II — ферментом, который осуществляет транскрипцию клеточного генома. Однако особая группа транскриптов аденовируса синтезируется с помощью другого клеточного фермента — РНК-полимеразы III. У двух других семейств ДНК-содержащих вирусов животных — вирусов оспы и иридовирусов — транскрипция происходит в цитоплазме. Поскольку в цитоплазме нет клеточных полимераз, транскрипция этих вирусов нуждается в специальном вирусном ферменте — вирусной РНК-полимеразе. Этот фермент является структурным вирусным белком.
У РНК-содержащих вирусов транскрипция осуществляется вирусспецифическими транскриптазами, т. е. ферментами, закодированными в вирусном геноме. Вирусспецифические транскриптазы могут быть как структурными белками, входящими в состав вириона (эндогенная транскриптаза), так и неструктурными белками, которые синтезируются в зараженной клетке, но не включаются в вирион.
Транскрипция в зараженной клетке. Синтез комплементарных РНК на родительских матрицах с помощью родительской транскриптазы носит название первичной транскрипции в отличие от вторичной транскрипции, происходящей на более поздних стадиях инфекционного цикла на вновь синтезированных, дочерних матрицах, с помощью вновь синтезированной транскриптазы. Большая часть иРНК в зараженной клетке является продуктом вторичной транскрипции.
Транскриптивные комплексы. У сложно устроенных РНК-содержащих вирусов животных транскрипция происходит не на матрице голой РНК, а в составе вирусных нуклеокапсидов или сердцевин (транскриптивные комплексы). Связанные с геномом капсидные белки не только не препятствуют транскрипции, но и необходимы для нее, обеспечивая правильную конформацию тяжа РНК, защиту его от клеточных протеаз, связь отдельных фрагментов генома друг с другом, а также регуляцию транскрипции.
Регуляция транскрипции. Транскрипция вирусного генома строго регулируется на протяжении инфекционного цикла. Регуляция осуществляется как клеточными, так и вирусспецифическими механизмами. У некоторых вирусов, в основном ДНК-содержащих, существует три периода транскрипций — сверхранняя, ранняя и поздняя. К этим вирусам относятся вирусы оспы, герпеса, паповавирусы, аденовирусы. В результате сверхранней и ранней транскрипции избирательно считываются сверхранние и ранние гены с образованием сверхранних или ранних иРНК. При поздней транскрипции считывается другая часть вирусного генома — поздние гены, с образованием поздних иРНК. Количество поздних генов обычно превышает количество ранних генов. Многие сверхранние гены являются генами для неструктурных белков — ферментов и регуляторов транскрипции и репликации вирусного генома. Напротив, поздние гены обычно являются генами для структурных белков. Обычно при поздней транскрипции считывается весь геном, но с преобладанием транскрипции поздних генов.
Фактором регуляции транскрипции у ядерных вирусов является транспорт транскриптов из ядра в цитоплазму, к месту функционирования иРНК — полисомам.
Продуктом сверхранней транскрипции вирусов герпеса являются ά-белки. Функция одного или нескольких из них необходима для транскрипции следующей группы генов, кодирующих γ-белки. В свою очередь ά-белки включают транскрипцию последней группы поздних генов, кодирующих γ-белки. Такой тип регуляции получил название «каскадной».
У РНК-содержащих вирусов синтез транскриптов также строго контролируется в отношении как количества каждого класса транскриптов, так и периода инфекции, когда определенные транскрипты синтезируются с максимальной скоростью. На ранней стадии инфекции преимущественно синтезируются транскрипты двух генов вируса гриппа — NP и NS, на поздней стадии инфекции — транскрипты генов М, НА и NA. Остальные три гена для Р-белков синтезируются примерно с одинаковой скоростью на протяжении всего периода инфекции. У реовирусов на ранней стадии инфекции преимущественно транскрибируется 4 из 10 фрагментов генома и лишь на поздней стадии транскрибируется весь геном. Однако если поместить геном вируса в бесклеточную РНК-синтезирующую систему, будет происходить равномерная транскрипция всех 10 фрагментов генома. Эти факты говорят о жестком контроле транскрипции со стороны клетки-хозяина и возможном наличии специфических клеточных регуляторов.
У парамиксовирусов и рабдовирусов весь геном представляет собой одну транскрипционную единицу с единственным промотором (участок связывания транскриптазы и начала транскрипции) у З’-конца. Вдоль генома существует как бы градиент эффективности транскрипции. Ближайший к З’-концу ген (ген наиболее обильного белка NP) считывается наиболее часто. Напротив, ген для самого высокомолекулярного белка — транскриптазы,— содержащегося лишь в количестве нескольких молекул на вирион, находится на противоположном конце генома и транскрибируется значительно реже. Такая регуляция экспрессии генов путем порядка их расположения в геноме носит название «полярность». При этом способе регуляции количество молекул полипептидов определяется полярностью гена, т. е. расстоянием его от промотора.
Синтез белка в клетке происходит в результате трансляции иРНК. Трансляцией называется процесс перевода генетической информации, содержащейся в иРНК, на специфическую последовательность аминокислот. Иными словами, в процессе трансляции осуществляется перевод 4-буквенного языка азотистых оснований на 20-буквенный язык аминокислот.
Транспортные РНК.Свою аминокислоту тРНК узнают по конфигурации ее боковой цепи, а специфический фермент аминоацил-синтетаза катализирует ассоциацию тРНК с аминокислотой. В клетке существует большое количество разнообразных видов тРНК. Поскольку для каждой аминокислоты должна быть своя тРНК, количество видов тРНК должно быть не меньше 20, однако в клетке их значительно больше. Это связано с тем, что для каждой аминокислоты существует не один, а несколько видов тРНК. Молекула тРНК представляет собой однонитчатую РНК со сложной структурой в виде кленового листа (рис. 18). Один ее конец связывается с аминокислотой (конец а), а противоположный — с нуклеоти-дами иРНК, которым они комплементарны (конец б). Три нуклеотида на иРНК кодируют одну аминокислоту и называются «триплет» или «кодон», комплементарные кодону три нуклеотида на конце тРНК называются «антикодон».
Рибосомы. Синтез белка в клетке осуществляется на рибосоме. Рибосома состоит из двух субъединиц, большой и малой, малая субъединица примерно в два раза меньше большой. Обе субъединицы содержат по одной молекуле рибосомальной РНК и ряд белков. Рибосомальные РНК синтезируются в ядре на матрице ДНК с помощью РНК-полимеразы. В малой рибосомальной субъединице есть канал, в котором находится информационная РНК. В большой рибосомальной субъединице есть две полости, захватывающие также малую рибосомальную субъединицу. Одна из них содержит аминоацильный центр (А-центр), другая — пептидильный центр (П-центр).
Фазы трансляции. Процесс трансляции состоит из трех фаз: 1) инициации, 2) элонгации и 3) терминации.
Инициация трансляции. Это наиболее ответственный этап в процессе трансляции, основанный на узнавании рибосомой иРНК и связывании с ее особыми участками. Рибосома узнает иРНК благодаря «шапочке» на 5′-конце и скользит к 3′-концу, пока не достигнет инициаторного кодона, с которого начинается трансляция. В эукариотической клетке инициаторным кодоном является кодон АУГ или ГУГ, копирующие метионин. С метионина начинается синтез всех полипептидных цепей.
Вначале с иРНК связывается малая рибосомальная субъединица. К комплексу иРНК с малой рибосомальной субъединицей присоединяются другие компоненты, необходимые для начала трансляции. Их по крайней мере три в прокариотической клетке и более девяти в эукариотической клетке. Инициаторные факторы определяют узнавание рибосомой специфических иРНК и, таким образом, являются определяющим фактором в дискриминации между различными иРНК, присутствующими в клетке, как правило, в избыточном количестве.
В результате формируется комплекс, необходимый для инициации трансляции, который называется инициаторным комплексом. В инициаторный комплекс входят: 1) иРНК; 2) малая рибосомальная субъединица; 3) аминоацил-тРНК, несущая инициаторную аминокислоту; 4) инициаторные факторы; 5) несколько молекул ГТФ.
В рибосоме осуществляется слияние потока информации с потоком аминокислот. Аминоацил-тРНК входит в А-центр большой рибосомальной субъединицы, и ее антикодон взаимодействует с кодоном иРНК, находящейся в малой рибосомальной субъединице. При продвижении иРНК на один кодон тРНК перебрасывается в пептидильный центр, и ее аминокислота присоединяется к инициаторной аминокислоте с образованием первой пептидной связи. Свободная от аминокислоты тРНК выходит из рибосомы и может опять функционировать в транспорте специфических аминокислот.
Элонгация трансляции. Это процесс удлинения, наращивания полипептидной цепи, основанный на присоединении новых аминокислот с помощью пептидной связи. Происходит постоянное протягивание нити иРНК через рибосому и. «декодирование» заложенной в ней генетической информации. иРНК функционирует на нескольких рибосомах, каждая из которых синтезирует одну и ту же полипептидную нить, кодируемую данной иРНК. Группа рибосом, работающих на одной молекуле иРНК, называется полирибосомой, или полисомой. Размер полисом значительно варьирует в зависимости от длины молекулы иРНК, а также от расстояния между рибосомами. Так, полисомы, которые синтезируют гемоглобин, состоят из 4—6 рибосом, высокомолекулярные белки синтезируются на полирибосомах, содержащих 20 и более рибосом.
Терминация трансляции. Терминация трансляции происходит в тот момент, когда рибосома доходит до терминирующего кодона в составе иРНК. Трансляция прекращается, и полипептидная цепь освобождается из полирибосомы. После окончания трансляции полирибосомы распадаются на субьединицы, которые могут войти в состав новых полирибосом.
Не нашли то, что искали? Воспользуйтесь поиском:
источник
мельчайшие микроорганизмы, не имеющие клеточного строения, белоксинтезирующей системы и способные к воспроизведению лишь в клетках высокоорганизованных форм жизни. Они широко распространены в природе, поражают животных, растения и другие микроорганизмы. В. характеризуются рядом уникальных свойств, отличающих их от простейших, грибков, бактерий — микроорганизмов, имеющих клеточное строение и генетический материал, представленный двунитчатыми ДНК. Вирусы не имеют рибосом и цитоплазматических органелл, их воспроизводство обеспечивает клетка-хозяин. Молекула вирусного генома наделена необычайной способностью перестраивать жизнедеятельность клетки таким образом, что она перестает узнавать собственную генетическую информацию и функционирует в соответствии с генетической программой вируса, синтезируя вирусоспецифические молекулы. С этой точки зрения В. являются генетическими паразитами клетки.
Вирусы содержат нуклеиновую кислоту только одного типа: либо ДНК, либо РНК. РНК-содержащие В. — единственные представители в природе, имеющие генетический материал, представленный РНК. Вирусные геномы гаплоидны, т.е. содержат только одну копию генов, за исключением ретровирусов, геном которых является диплоидным. Генетический материал может иметь вид разнообразных структур (двунитчатых, однонитчатых, линейных, кольцевых, фрагментированных молекул). В основе необычного способа воспроизводства В. лежит разобщенный во времени и пространстве (на территории клетки) синтез вирусных нуклеиновых кислот и белков, которые затем независимо друг от друга прибывают к местам сборки вирусных частиц.
Природу В. как генетических паразитов клетки характеризует их способность к интеграции, т.е. к объединению вирусного генома с клеточным. Группа вирусных генов, являющихся частью клеточного генома, называется провирусом. Провирус способен длительное время существовать в виде так называемых молчащих генов, однако в соответствующих условиях он может активироваться, что приводит к развитию болезни. На способности В. к интеграции основан механизм персистенции В. в организме, с которой связано возникновение персистентных вирусных инфекций. Интеграция характерна для умеренных ДНК-содержащих бактериофагов, онкогенных ДНК-содержащих вирусов, для вируса гепатита В, обязательна для ретровирусов, к которым относятся онкогенные РНК-содержащие В. и вирусы иммунодефицита человека. Персистенция В. в организме возможна также при существовании их в клетке в виде кольцевых нуклеиновых кислот типа плазмид бактериальной клетки, реплицируемых самой клеткой. Такие кольцевые ДНК, лишенные собственных белков, описаны при персистенции паповавирусов, В. герпеса.
К вирусам близки вироиды и вирусоиды. Вироиды представляют собой небольшие по размерам молекулы кольцевой суперспирализованной РНК, лишенные белка: они вызывают болезни растений. Вирусоиды также являются лишенными белков молекулами РНК, они отличаются от вироидов зависимостью от вируса-помощника (дефектностью) и отсутствием способности кодировать синтез собственных белков.
Существует ряд агентов белковой природы, лишенных нуклеиновой кислоты и обладающих способностью вызывать энцефалопатии у человека и животных (типа болезни скрепи у овец) в результате прогрессирующего разрушения нервных клеток. Эти агенты получили название «прион» (белковая инфекционная частица). По-видимому, прион одновременно является индуктором какого-то клеточного гена, ставшего автономным.
Вирусы, вироиды, вирусоиды и даже прионы имеют нечто общее, их объединяющее. Они представляют собой автономные генетические структуры, способные функционировать и репродуцироваться в восприимчивых к ним клетках животных, растений и микроорганизмов.
Несмотря на чрезвычайную простоту строения, В. обладают всеми признаками жизни: способностью размножаться, наследственностью, изменчивостью, приспособляемостью к условиям окружающей среды, они занимают определенную экологическую нишу в природе, на них распространяются законы эволюции органического мира. Однако В. не являются организмами из-за отсутствия собственных белок-синтезирующих систем, разобщенного способа репродукции, способности интегрировать с клеточным геномом, наличия вироидов, прионов, вирусов-сателлитов и дефектных вирусов, генетических феноменов (множественной реактивации и комплементации).
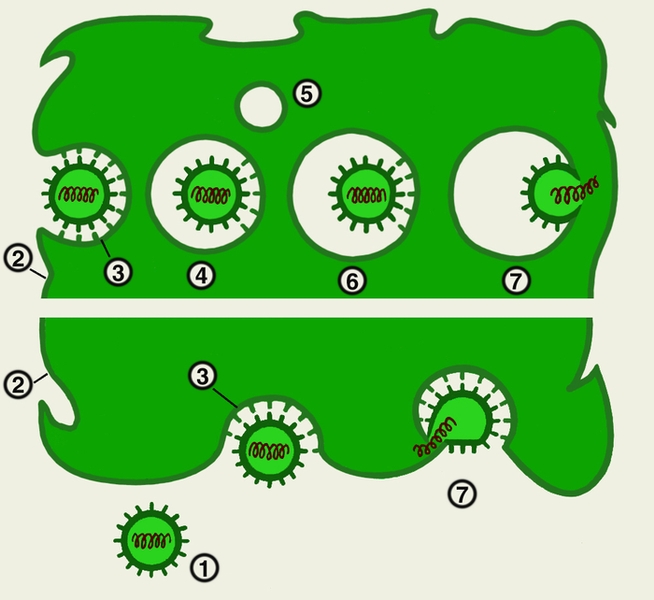
Зрелая вирусная частица называется вирионом. У простых вирусов (например, вирусов полиомиелита) вирион состоит из одной молекулы нуклеиновой кислоты, окруженной белковым футляром — капсидом. Капсид вместе с нуклеиновой кислотой называется нуклеокапсидом. У более сложных вирусов (например, аденовирусов, ротавирусов) капсид окружает сердцевину, содержащую помимо нуклеиновой кислоты внутренние белки. У еще более сложно устроенных В. (вирусы гриппа, кори, бешенства, вирус иммунодефицита человека) капсид окружен липопротеиновой оболочкой — суперкапсидом (рис. 1). Капсид состоит из определенного количества капсомеров, связанных нековалентными связями, каждый из которых содержит несколько симметрично расположенных полипептидных цепей. Вирионы патогенных для человека В. имеют два типа симметрии. При спиральной симметрии капсомеры ассоциируются с геномом и образуют спиралевидную винтообразную структуру, при кубическом типе симметрии капсомеры формируют изометрическое полое тело, внутри которого находится геном Изометрические вирусные частицы имеют форму икосаэдра — многогранника, состоящего обычно из 60 или кратных 60 геометрически идентичных элементов.
Липопротеиновые оболочки В. являются дериватами плазматической мембраны или мембран цитоплазматических вакуолей, куда почкуются В. Поэтому липиды вирусной оболочки имеют такой же состав, как и липиды клетки-хозяина. В липопротеиновые оболочки В. встроены наружные вирусные белки, которые обычно представлены гликопротеидами. Эти белки формируют шипы на поверхности вирусной частицы, их функция связана с проникновением вируса в клетку. Наружные вирусные белки вызывают образование защитных, вирус-нейтрализующих антител.
Вирусные нуклеиновые кислоты характеризуются разнообразием форм. Вирусный геном может быть представлен как однонитчатыми, так и двунитчатыми молекулами РНК или ДНК, ДНК может быть как линейной, так и кольцевой молекулой, РНК — как линейной, так и фрагментированной, и вместе с белками нуклеокапсида образовывать кольцевые структуры В., содержащие однонитчатые РНК, делят на две группы. К одной группе относятся В., геном которых обладает свойствами информационной РНК, т.е. может связываться с рибосомами и кодировать вирусные белки. Такие В. обозначают как плюс-нитевые, или плюс-геномные (условно информационная РНК обозначена знаком плюс). Это пикорнавирусы, тогавирусы, коронавирусы, ретровирусы. Другая группа включает В., у которых функции информационной РНК выполняет РНК, комплементарная геному. Эти В. называют минус-нитевыми, или минус-геномными. Минус-нитевыми являются ортомиксовирусы, парамиксо-вирусы, рабдовирусы. Существуют В., содержащие как плюс-нитевые, так и минус-нитевые гены (амбисенс-вирусы). К ним относятся аренавирусы и буньявирусы.
В зараженной клетке вирусный геном кодирует синтез двух групп белков: структурных, входящих в состав образующихся вирионов, и неструктурных, которые обнаруживаются в зараженной клетке, но в состав вирионов не входят. Число структурных белков варьирует от 2—3 у простых В. до 100 и более у сложно организованных, например вирусов оспы. В зависимости от локализации в вирионе различают капсидные и суперкапсидные структурные белки. В составе капсида, помимо идентичных белков, образующих капсомеры, находится ряд других белков: геномные белки, ковалентно связанные с геномом, ферменты, осуществляющие транскрипцию и репликацию вирусного генома, белки с другими ферментативными функциями. Эти белки представлены в виде единичных молекул. Основной функцией собственно капсидных белков является защита генома от факторов внешней среды. Суперкапсидные белки (обычно гликопротеиды) относятся к типичным внутримембранным белкам. Их гликозилирование осуществляют клеточные ферменты в процессе синтеза и транспорта полипептида. Углеводный компонент защищает полипептид от протеаз, придает определенную конформацию молекуле, влияет на ее антигенные свойства. Все циркулирующие в природе В. принято делить на вирусы, поражающие позвоночных и человека, насекомых, растения и бактерии. Вирусы классифицируют на большие группы, называемые семействами (-viridae), которые подразделяют на подсемейства (-virinae), роды (genus) и типы. Основными критериями для характеристики семейства являются морфология вирионов, природа генома, репликация генома. Морфология вирионов включает размер, форму, симметрию нуклеокапсида, наличие суперкапсида. Деление на подсемейства и роды обусловлено такими критериями, как круг восприимчивых хозяев, патогенность, патологические изменения в клетках, феномены генетических взаимодействий, географическое распространение, способ передачи; наиболее частым признаком при делении на роды являются антигенные свойства (антигенные перекресты). Дифференциация на типы, подтипы, штаммы и варианты также основана на антигенных свойствах при использовании как поликлональных, так и моноклональных антител. Современная классификация охватывает 4 /5 всех известных В. позвоночных и человека, из них 6 семейств включают ДНК-содержащие вирусы и 12 — РНК-содержащие.
Некоторые свойства этих семейств приведены в таблице. Схематическое изображение строения В., патогенных для человека, показано на рис. 2.
Классификация, некоторые свойства и типовые представители ряда вирусов животных и человека
| Семейство вирусов | Наличие суперкапсида | Размер вириона в нанометрах | Типовые представители |
|---|---|---|---|
| ДНК-содержащие вирусы | |||
| Аденовирусы | Отсутствует | 70—90 | Аденовирусы человека 42 типов |
| Гепаднавирусы | Имеется | 45—50 | Вирус гепатита В |
| Герпесвирусы | Имеется | 200 | Вирусы простого герпеса, цитомегалии, Эпстайна — Барр |
| Паповавирусы | Отсутствует | 45—55 | Вирусы папилломы, полиомы |
| Парвовирусы | Отсутствует | 18—26 | Аденоассоциированный вирус |
| Поксвирусы | Имеется | 130—240 | Вирусы осповакцины |
| РНК-содержащие вирусы | |||
| Аренавирусы | Имеется | 50—300 | Вирусы Лаоса, Мачупо |
| Буньявирусы | Имеется | 90—100 | Возбудители геморрагической лихорадки с почечным синдромом |
| Калицивирусы | Отсутствует | 20—30 | Калицивирусы человека |
| Коронавирусы | Имеется | 80—130 | Коронавирусы человека |
| Ортомиксовирусы | Имеется | 80—120 | Вирусы гриппа типов А, В, С |
| Парамиксовирусы | Имеется | 150—300 | Вирусы кори, паротита, парагриппа, респираторно-синцитиальный вирус |
| Пикорнавирусы | Отсутствует | 20—30 | Вирусы полиомиелита, ECHO, Коксаки, гепатита А |
| Рабдовирусы | Имеется | 70—175 | Вирус бешенства |
| Реовирусы | Отсутствует | 60—80 | Реовирусы, ротавирусы человека и животных |
| Ретровирусы | Имеется | 80—100 | Вирусы лейкоза человека, иммунодефицита человека |
| Тогавирусы | Имеется | 30—90 | Вирусы Синдбис, леса Семлики, лошадиных энцефалитов |
| Флавивирусы | Имеется | 30—90 | Вирусы клещевого и японского энцефалитов, денге, желтой лихорадки, краснухи |
Вирусы являются возбудителями многих болезней. Респираторные инфекции вызывают более 200 вирусов, включая их серотипы, вирусы гриппа типов А, В, С, вирусы парагриппа человека 4 типов, реовирусы, респираторно-синцитиальный вирус, риновирусы (115 серотипов), кишечные вирусы, коронавирусы, аденовирусы (42 серотипа) и др. Вирусные гастроэнтериты вызывают вирусы 7 групп: ротавирусы, наиболее распространенные и особенно часто поражающие детей первых лет жизни, кишечные аденовирусы (типы 40 и 41), вирус Норфолка, коронавирусы, калицивирусы, астровирусы, тогавирусы. Возбудителями вирусных гепатитов являются вирусы гепатита А, В, ни А, ни В. Распространенными вирусными инфекциями являются корь, герпетическая инфекция. В. полиомиелита продолжают циркулировать, но не вызывают паралитической формы заболевания благодаря плановой вакцинации. В определенных регионах распространены арбовирусные инфекции, передаваемые насекомыми (в основном клещами и комарами), в частности клещевой энцефалит. Встречаются также геморрагические лихорадки, в частности геморрагическая лихорадка с почечным синдромом, передаваемая грызунами. На широкой территории распространены В. бешенства, персистирующие в организме диких животных.
Некоторые В. (например, вирусы краснухи, цитомегалии, паротита и др.) могут передаваться трансплацентарно и вызывать выкидыши, гибель плода, врожденные пороки развития. В. являются возбудителями медленных инфекций, характеризующихся поражением ц.н.с. Возможны вирусные поражения разных органов и систем в результате постинфекционных процессов: миокардиты, панкреатиты, иммунодефицитные состояния. В. имеют отношение к канцерогенезу, способствуя превращению нормального клеточного гена в онкоген в результате процессов, связанных с интеграцией вирусного генома с клеточным геномом.
Вирусы представляют собой важный фактор эволюции органического мира. Преодолевая видовые барьеры, В. могут переносить отдельные гены или группы генов из клетки в клетку, а интеграция вирусной ДНК с хромосомой клетки может приводить к изменчивости генома клетки в результате введения в геном дополнительной наследственной информации или изменения экспрессии клеточных генов.
Наиболее эффективными факторами изменчивости генома являются ретровирусы, поскольку они обладают способностью в виде ДНК-провируса включаться в разные локусы ДНК хромосом. Ретровирусы могут переносить гены животных из клетки в клетку у организмов разных видов и классов, когда половая гибридизация исключена, например, одинаковые провирусы обнаружены в геномах мыши, крысы, кошки, свиньи и человека.
Циркуляция в биосфере различных В. обусловливает их генетические взаимодействия, которые могут принести к возникновению рекомбинантов с измененным тропизмом к определенному хозяину и с повышенной вирулентностью. Особенно часто это происходит у В. с фрагментированным геномом (вирусы гриппа, ротавирусы). Так, например, современная концепция возникновения пандемических вариантов В. гриппа основана на рекомбинации В. гриппа человека и животных, когда в результате обмена генами появляется вирус с высокой патогенностью для человека, преодолевающий популяционный иммунитет.
В репродукции В. различают ранние и поздние этапы. Ранние этапы подготавливают инфекционный процесс. К ним относят адсорбцию В. на клетке, проникновение в нее и так называемое раздевание вируса.
Адсорбция В на клетке основана на специфическом узнавании вирусными прикрепительными белками клеточных рецепторов, которые обычно находятся на поверхности чувствительных к В. клеток. В связи с тем, что рецепторы бывают общими для больших групп В., а процесс адсорбции может нарушаться под воздействием некоторых соединений, перспективно проведение антивирусной терапии с учетом блокирования этого этапа репродукции за счет разрушения рецепторов, использования моноклональных антител синтетических пептидов, конкурирующие с рецепторами и узнающими их вирусными белками.
Проникновение В. в клетку происходит двумя способами: путем рецепторного эндоцитоза (с последующим слиянием вирусной оболочки с клеточной мембраной) и непосредственно через плазматическую мембрану клетки (рис. 3). Большинство В. проникает в клетку путем рецепторного эндоцитоза. После адсорбции вирус в комплексе с клеточными рецепторами попадает в клеточную вакуоль, где осуществляется слияние мембран за счет взаимодействия вирусного белка с липидами мембраны вакуоли. В большинстве случаев слияние мембран происходит лишь при низких значениях рН. Однако некоторые В. (вирус Сендай, вирус иммунодефицита человека) обладают активным белком слияния, функционирующим при нейтральном рН, и проникают в клетку прямо через плазматическую мембрану путем слияния с ней вирусной оболочки. Одновременно с проникновением происходит и так называемое раздевание К. — удаление его наружной оболочки и выход внутреннего компонента, вызывающего инфекционный процесс.
На поздних этапах происходит синтез вирусспецифических молекул и сборка вирусных частиц, заканчивающаяся выходом их из клетки. Поздними этапами являются транскрипция, трансляция, репликация, сборка вирусных частиц.
Транскрипцией называется переписывание генетической информации на РНК с образованием молекул информационной РНК. Это переписывание осуществляет ДНК-РНК-полимераза (транскриптаза). ДНК-содержащие В. используют для транскрипции клеточную полимеразу. У некоторых РНК-содержащих В. собственная геномная РНК может выполнять функции информационной, но у большинства В. (минус-нитевые вирусы) информационная РНК комплементарна геномной РНК и является продуктом транскрипции. В этом случае транскрипцию обеспечивает вирусная РНК-РНК- полимераза.
Трансляция осуществляется путем перевода информации с нуклеотидов, в результате чего из аминокислот образуются белки. Этот процесс происходит в рибосомах, с которыми связывается информационная РНК, направляющая синтез белка. В зараженной клетке рибосомы не «узнают» свою клеточную информационную РНК и связывают вирусспецифическую информационную РНК. Синтез белков в клетке разобщен: одни вирусные белки синтезируются на свободных полирибосомах, гликопротеиды — на рибосомах, связанных с клеточными мембранами. Вирусные белки подвергаются различным модификациям в процессе трансляции и после трансляции — гликозилированию, ацилированию, протеолитическому нарезанию, фосфорилированию и т.д.
Репликация — процесс, ведущий к образованию дочерних вирусных геномов, которые являются точной копией родительских геномных молекул. Механизм репликации широко варьирует В репликации двунитчатых вирусных ДНК участвуют клеточные ферменты (ДНК-полимеразы). Репликация вирусных РНК происходит с участием вирусспецифических полимераз и образованием антигенома — полноразмерной зеркальной копии вирусного генома, комплементарной ему С участием антигенома образуется репликативный предшественник — многонитчатая структура, где осуществляется репликация.
Все компоненты В. независимо друг от друга прибывают к местам сборки в клетке. Чаще сборка компонентов В. происходит с участием клеточных мембран. Эти компоненты обычно прокрашиваются красителями и видны в световом микроскопе в виде включений. Включения характерны для определенной инфекции и в ряде случаев (при оспе, бешенстве) имеют диагностическое значение. Белки простых В. способны к саморазборке с образованием капсомеров, формирующих при взаимодействии друг с другом прокапсиды. Встраивание в прокапсиды нуклеиновой кислоты приводит к образованию капсида. У сложных В. формируются нуклеокапсиды и сердцевины, которые затем взаимодействуют с наружными белками. Большинство оболочечных В. приобретают оболочку за счет почкования через плазматическую мембрану клетки-хозяина. При этом нуклеокапсиды и сердцевины транспортируются к участкам плазматической мембраны, на поверхности которых уже встроены оболочечные вирусные белки, и начинается выпячивание этих участков. Образующаяся почка отделяется от клетки с образованием вирусной частицы (рис. 4, 5). Выход В. в межклеточное пространство возможен также путем «взрыва»; т.е. после разрушения клетки.
Основой взаимодействия В. с организмом является инфекционный процесс на уровне клетки, развивающийся в результате конкуренции вирусного генома с клеточным (см. Вирусные инфекции). Методы изучения биологии вирусов и их идентификации — см. Вирусологические методы исследования.
Библиогр.: Букринская А.Г. Вирусология, М., 1986; Жданов В.М. и Львов Д.К. Эволюция возбудителей инфекционных болезней, М., 1984, библиогр.; Зуев В.А. Медленные вирусные инфекции человека и животных, М., 1988; Общая и частная вирусология, под ред. В.М. Жданова и С.Я. Гайдамович, т. 1—2, М., 1982; Тихоненко Т.И. и др. Вирусы, БМЭ, 3-е изд., т. 4, с. 232, М., 1976.
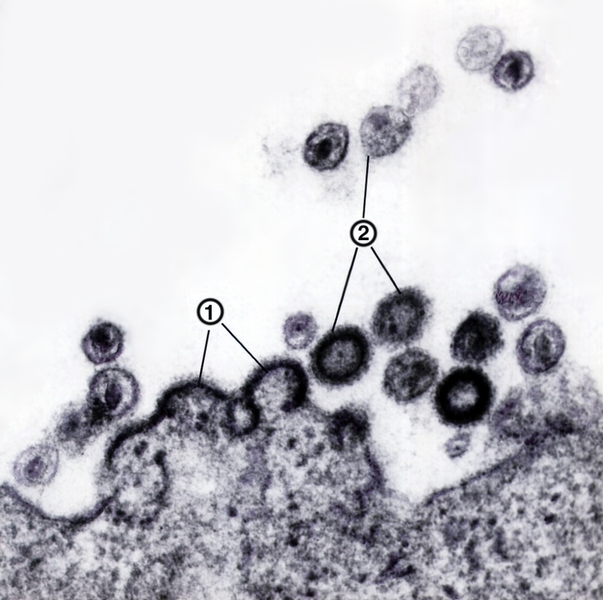
Рис. 5. Электронограмма почкующихся (1) и зрелых (2) частиц вируса иммунодефицита человека; × 100 000.
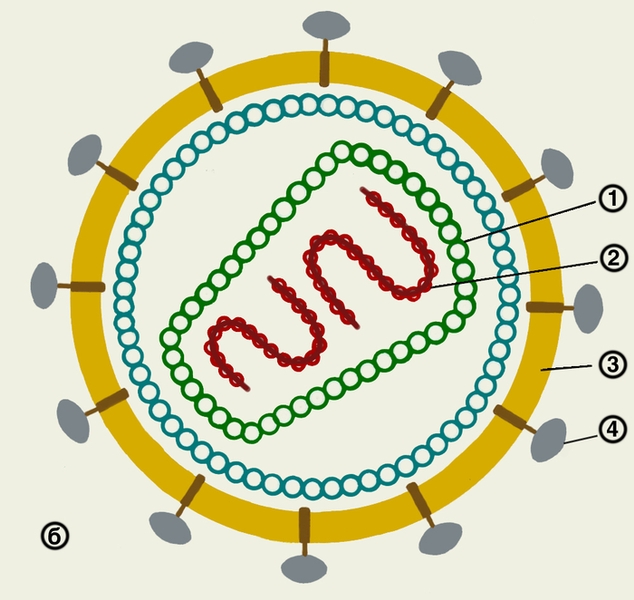
Рис. 1б). Схема строения вируса иммунодефицита человека: 1 — капсомеры; 2 — геном; 3 — липопротеиновая оболочка (суперкапсид); 4 — гликопротвиды.
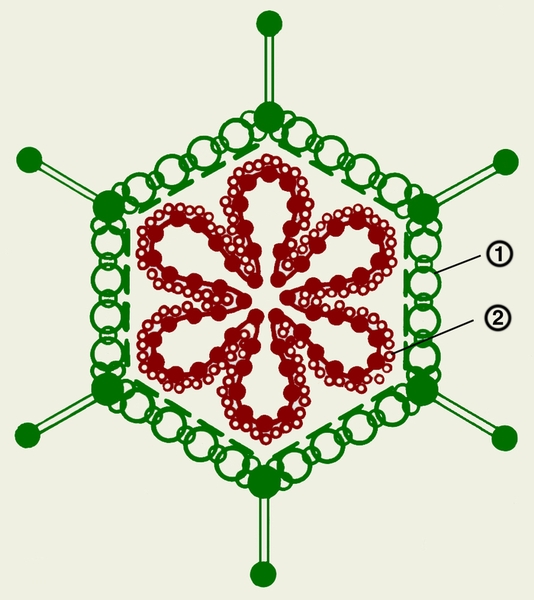
Рис. 1а). Схема строения аденовируса: 1 — капсомеры; 2 — геном.
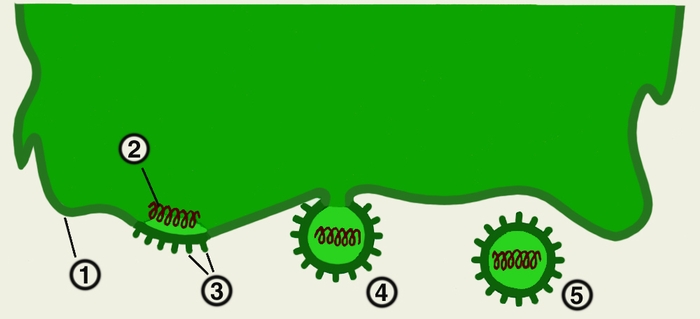
Рис. 4. Схема выхода вирусных частиц из клетки путем почкования: 1 — плазматическая мембрана клетки; 2 — сердцевина вируса; 3 — вирусные поверхностные белки, встроенные в плазматическую мембрану клетки; 4 — почкование через плазматическую мембрану; 5 — зрелая вирусная частица.
Рис. 2. Схема строения вирусов, патогенных для человека: ДНК-содержащие вирусы (1—6), РНК-содержащие вирусы (7—17). 1 — вирусы оспы; 2 — вирусы герпеса; 3 — аденовирусы; 4 — паповавирусы; 5 — гепаднавирусы; 6 — парвовирусы; 7 — парамиксовирусы; 8 — вирусы гриппа; 9 — коронавирусы; 10 — аренавирусы; 11 — ретровирусы; 12 — реовирусы; 13 — пикорнавирусы; 14 — капицивирусы; 15 — рабдовирусы; 16 — тогавирусы, флавивирусы; 17 — буньявирусы.
Рис. 3. Схема проникновения вирусов в клетку путем рецепторного эндоцитоза (вверху) и через плазматическую мембрану клетки (внизу): 1 — вирусная частица; 2 — плазматическая мембрана клетки; 3 — ямка на поверхности клетки, содержащая рецепторы; 4 — образующаяся клеточная вакуоль; 5 — сливающаяся клеточная вакуоль; 6 — клеточная вакуоль, образующаяся после слияния (рецептосома); 7 — выход генетического материала вируса в цитоплазму.
источник
При внутриклеточной репродукции вирусов формируются структуры, отсутствующие в незаряженных вирусом клетках. Эти образования – места синтеза и сборки субвирусных структур (компонентов дочерних вирионов) получили разные наименования – клеточные матриксы «фабрики», виропласты, включения. Эти структуры являются продуктами кооперативных процессов клетки и вируса, где главенствующая роль принадлежит клетке.
Морфологически матриксы выглядят по-разному у разных вирусов. Обычно это места синтеза белков, и поэтому в матриксах обнаруживаются значительные скопления рибосом (полисомы). В их состав входят также разные клеточные структуры – мембраны, микротрубочки, и т. п. При этом матриксы проделывают определенный цикл развития. Если вначале в них превалируют полисомы, то позже являются субвирусные компоненты, которые можно выявить при использовании серологических методов исследования типа ИФ или ИЭМ, а нередко и при обычной ЭМ. При ряде инфекций матриксы связаны с мембранами эндоплазматической сети, аппаратом Гольджи и другими клеточными структурами, куда транспортируются все вирусные компоненты.
Образования, сходные с цитоплазматическими матриксами, обнаружены также в ядрах, где происходит репродукция большинства ДНК-содержащих вирусов. При окрашивании клеток они имеют вид внутриядерных включений. На поздних стадиях инфекции в матриксах или по соседству с ними накапливается большое число вирионов, часто образующих кристаллоподобные формирования. Внутриядерные кристаллоподобные включения обнаружены, например, у реовирусов, аденовирусов, паповавирусов, парвовирусов. Процесс формирования вирионов у вирусов, имеющих липопротеидные оболочки, значительно более сложен, чем у просто устроенных вирусов, и протекает многоступенчато. Так, например, изометрические нуклеокапсиды вируса герпеса формируются в ядрах и в дальнейшем транспортируются в цитоплазму путем почкования через ядерную мембрану. После этого вирионы транспортируются к аппарату Гольджи, проходя через мембрану эндоплазм этической сети и захватывая ее, как это было при прохождении через ядерную мембрану. Поэтому внеклеточный вирус имеет две оболочки, одна из которых формируется из ядерной, вторая – из цитоплазматической мембраны.
Формирование РНП вирионов парамиксовирусов происходит в цитоплазме, где они накапливаются в виде тяжей и затем транспортируются к плазматической мембране. В это время плазматическая мембрана клетки уже модифицирована, так как в нее встроены с наружной стороны вирусные гликопротеиды, а с внутренней стороны – матриксный белок. При приближении к таким модифицированным участкам плазматической мембраны рибонуклеопротеидные тяжи свертываются в плотно упакованные клубки и, проходя через плазматическую мембрану, покрываются ею, приобретая таким путем внешнюю оболочку. Этот тип формирования вирионов называется почкованием. Почкование может происходить и во внутриклеточные вакуоли.
Морфогенез вируса оспы еще более сложен. В цитоплазме образуются сложные матриксы, в которых происходит синтез многочисленных вирусспецифических структур. Здесь же происходит и формирование вирионов, которые вначале представляют пузырчатые образования, и лишь позже из этих предшественников формируются зрелые вирионы. Выход вирусных частиц из клетки осуществляется либо путем почкования через мембраны во внутриклеточные вакуоли, либо при разрушении клетки.
Биофизические свойства вирусов характеризуются многими показателями – седиментацией, плотностью, вязкостью вирусных суспензий, диффузионными свойствами. Все эти характеристики относятся также к субвирусным компонентам. Наиболее важными биофизическими характеристиками вирусов являются седиментационные и плотностные свойства. Они чаще всего измеряются при исследовании вирусов.
Седиментационные свойства вирусов и субвирусных компонентов измеряют с помощью центрифугирования в аналитических и препаративных ультрадентрифугах. Коэффициент седиментации выражают в единицах Сведберга в переводе на стандартные условия при температуре 20 °С в воде и обозначают как S20w.
Коэффициенты седиментации вирионов зависят от многих факторов: от их размера и массы, плотности, формы. Для определения плотности вирионов и субвирусных структур применяют равновесное центрифугирование в градиентах плотности. Для вирионов и вирусных нуклеопротеидов обычно используют градиенты плотности сахарозы и хлорида цезия.
Плотность вирионов и субвирусных структур зависит, прежде всего, от их состава. Она увеличивается с увеличением процента содержания нуклеиновых кислот и уменьшается при повышении содержания белков и липидов.
Разные группы вирусов обладают неодинаковой устойчивостью во внешней среде. Наименее устойчивыми являются вирусы, имеющие липопротеидные оболочки, наиболее устойчивыми – изометрические вирусы. Так, например, ортомиксовирусы и парамиксовирусы инактивируются на поверхностях в течение нескольких часов, тогда как вирусы полиомиелита, аденовирусы, реовирусы сохраняют инфекционную активность в течение нескольких дней.
Однако из этого общего правила имеются и исключения. Так, вирус оспы устойчив к высыханию и сохраняется в экскретах в течение многих недель и месяцев. Вирус гепатита В устойчив к действию неблагоприятных внешних факторов и сохраняет свою активность в сыворотке даже при кратковременном кипячении.
Чувствительность вирусов к ультрафиолетовому и рентгеновскому облучению зависит преимущественно от размеров их генома. Поэтому, например, вирус осповакцины (молекулярная масса генома около 2 × 10 8 ) инактивируется при рентгеновском облучении около 5 × 10 4 рад, в то время как мелкий вирус папилломы (молекулярная масса генома 3 × 10 6 ) для инактивации требует облучения 4 × 10 5 рад.
Чувствительность вирусов к инактивации формальдегидом и другими химическими веществами, инактивирующими генетический материал, зависит от многих условий, среди которых следует назвать плотность упаковки нуклеиновой кислоты в белковый футляр, размеры генома, наличие или отсутствие внешних оболочек и т.п. Вирусы, имеющие липопротеидные оболочки, чувствительны к эфиру, хлороформу и детергентам, в то время как просто устроенные изометрические и палочковидные вирусы устойчивы к их действию.
Наконец, важной особенностью вирусов является чувствительность к рН. Есть вирусы, устойчивые к кислым значениям рН (2,2 – 3,0), например, вирусы, вызывающие кишечные инфекции и проникающие в организм алиментарным путем. Однако большинство вирусов инактивируется при кислых и щелочных значениях рН.
Современная классификация вирусов является универсальной для вирусов позвоночных, беспозвоночных, растений и простейших. Она основана на фундаментальных свойствах вирионов, из которых ведущими являются признаки, характеризующие нуклеиновую кислоту, морфологию, стратегию генома и антигенные свойства (рисунок 3). Фундаментальные свойства поставлены на первое место, поскольку вирусы со сходными антигенными свойствами обладают и сходным типом нуклеиновой кислоты, сходными морфологическими и биофизическими свойствами.
Рисунок 3 – Схематическое строение семейств вирионов, поражающих позвоночных
Важным признаком для классификации, который учитывается наряду со структурными признаками, является стратегия вирусного генома, под которой понимают используемый вирусом способ репродукции, обусловленный особенностями его генетического материала. Например, полярность вирусной РНК является основным критерием для группировки вирусов и при отсутствии общих антигенных свойств.
Антигенные и другие биологические свойства являются признаками, лежащими в основе формирования вида и имеющими значение в пределах рода.
В основу современной классификации положены следующие основные критерии:
1) тип нуклеиновой кислоты (РНК или ДНК), ее структура (количество нитей);
2) наличие липопротеидной оболочки;
3) стратегия вирусного генома;
4) размер и морфология вириона, тип симметрии, число капсомеров;
5) феномены генетических взаимодействий;
6) круг восприимчивых хозяев;
7) патогенность, в том числе патологические изменения в клетках и образование внутриклеточных включений;
8) географическое распространение;
На основании перечисленных признаков вирусы делятся на семейства, подсемейства, роды и типы. Деление на семейства произведено по критериям, изложенным в пунктах 1 и 2, деление на роды и типы – на основании нижеперечисленных признаков. Схематически строение семейств вирионов, поражающих позвоночных, приведено на рисунке 5 Дополнительно выделены еще 2 семейства: Gepadnaviridae и Flaviviridae (выделенные из семейства Togaviridae).
Современная классификация вирусов человека и животных охватывает более 4/5 всех известных вирусов, которые распределены в 19 семейств, из них 7 – ДНК-содержащих и 12 – РНК-содержащих вирусов. Некоторые допускаются привычные латинизированные обозначения, цифры при обозначении типов, сокращения, буквы и их сочетания.
В начале 1940-х годов стало более или менее ясно, что вирусы, как и другие живые организмы, содержат нуклеиновые кислоты. Однако, особенность строения вирусного генома заключается в том, что наследственная информация может быть записана как на ДНК, так и РНК в зависимости от типа вируса. Уникальное свойство вирусной РНК хранить наследственную информацию впервые было продемонстрировано Гирером, Шраммом и Френкель-Конратом при изучении инфекционности РНК вируса табачной мозаики (ВТМ). Было показано, что очищенные препараты РНК ВТМ сохраняют инфекционность при полном отсутствии белка. Это открытие противоречило всеобщему убеждению, что единственная роль РНК заключается в передаче информации от ДНК к белку. В настоящее время способность РНК служить хранилищем генетической информации уже ни у кого не вызывает сомнений.
Следует учитывать, что наличие одного вида нуклеиновой кислоты является характеристикой вириона, но не вируса. В жизненном цикле ДНК-содержащих вирусов геномная нуклеиновая кислота транскрибируется, образуя РНК. Присутствие у ДНК-содержащих вирусов (вирус осповакцины) ДНК-зависимой РНК-полимеразы было показано в 1967 г. Катес и МакАусланом. РНК-содержащие вирусы транскрибируют свой геном с использованием РНК-зависимой РНК-полимеразы, впервые обнаруженной у реовирусов в 1968 г. Целый ряд РНК-содержащих вирусов имеют в жизненном цикле стадию обратной транскрипции и синтезируют ДНК на матрице РНК с помощью фермента обратной транскриптазы (РНК-зависимая ДНКполимераза или ревертаза). Открытие этого фермента в составе онкогенных РНК-содержащих вирусов сделано Балтимором в 1970 г.
Примерно 20 % вирусов имеют ДНК-геном, 80 % – РНК-геном. При этом РНК-геномные вирусы более древние в эволюционном отношение, нежели ДНК-геномные. Современные гипотезы предполагают, что примерно 4 миллиарда лет назад существовал мир РНК, в основе которого лежала РНК-самокопирующаяся система, обладающая каталитической активностью. Не исключается, что на этом этапе молекулярной эволюции уже существовали примитивные самореплицирующиеся вирусоподобные системы, отражением чего являются дошедшие до нашего времени вироиды – кольцевые РНК, обладающие рибозимазной активностью. На следующем этапе молекулярной эволюции РНК приобрела РНК-связывающие белки, которые выполняли роль кофакторов, стабилизирующих рибозимы. Возникновение систем РНК/белок явилось основой для появления сначала грубо-специфических белковферментов, а затем полимераз, совершенствование которых составило предмет эволюции механизмов репликации нуклеиновых кислот.
По своей химической природе нуклеиновые кислоты вирусов не отличаются от нуклеиновых кислот клеток (организмов) и представляют собой полинуклеотидные цепи, образованные чередованием четырех дезоксирибонуклеотидов в случае ДНК или рибонуклеотидов в случае РНК, соединенных фосфодиэфирными связями. Нуклеотид представляет собой азотистое основание (аденозин (А), гуанозин (G), цитидин (C), тимидин (T) или уридин (U) в случае РНК), связанное с дезоксирибозой (в ДНК), или рибозой (в РНК) гликозидной связью. Фосфорная кислота в нуклеиновых кислотах присоединяется сложноэфирной связью к 3’– и 5’-ОН группам сахаров смежных нуклеотидов. Отличительной особенностью ДНК целого ряда вирусов бактерий является наличие метилированных оснований (5’-метилцитозина, 6’метиламинопурина), которые могут входить в состав ДНК в качестве минорных или мажорных оснований. Так, ДНК фагов fd и φХ174 (колифаги) содержит 1-2 метилированных основания, а в ДНК фага Х12, лизирующего морскую бактерию Xantomonas oryza, вообще нет обычного цитозина, который полностью замещен 5метилцитозином. Источником происхождения таких оснований является энзиматическое метилирование уже синтезированной цепи ДНК. Данный процесс осуществляют вирусспецифические метилазы, которые используют в качестве донора метильных групп S-аденозилметионин клетки хозяина.
Вирусные нуклеиновые кислоты характеризуются поразительным разнообразием форм. Вирусный геном может быть представлен как однонитчатыми, так и двунитчатыми молекулами РНК и ДНК. ДНК может быть как линейной, так и кольцевой молекулой (таблица 1), РНК – как непрерывной, так и фрагментированной и кольцевой молекулой (таблица 2, рисунок 4).
Таблиц 1 – Виды ДНК-геномов вирусов
Таблица 2 – Виды РНК-геномов вирусов
При обсуждении вопроса организации генома вирусов необходимо выделить ряд его характерных отличий от геномов организмов.
Размеры . Если ориентировочно учесть, что геном эукариот имеет размер 4×10 9 п.н. и длину, достигающую 1,5-2 метра, а геном прокариот – 6×10 6 п.н., то размеры геномов вирусов значительно меньше. Так, размер генома крупных ДНК-содержащих вирусов составляет только 2-4×10 5 п. н. (200-450 т.п.н. у поксвирусов и вирусов герпеса), минимальные вирусы имеют геном длиной 1 мкм и состоящий из 1,2 т.п.н. Самый маленький геном среди вирусов, поражающих человека, имеет вирус гепатита В (3,2 т.п.н.).
Экономичность . Размеры геномов вирусов определяются емкостью капсида вириона. В связи с этим, вирусы очень экономно хранят генетическую информацию, что проявляется отсутствием многократно повторяющихся генов и, часто, наличием перекрывающихся открытых рамок считывания.
Наличие двух типов геномов . Носителем генетической информации у вирусов может быть как ДНК, так и РНК.
Многообразие структурных форм ДНК и РНК . Природа как бы испробовала на вирусах все возможные варианты структурной организации нуклеиновых кислот, которые представлены на рисунок 4.
Рисунок 4 – Схема, иллюстрирующая виды нуклеиновых кислот вирусов
Способ укладки. Способ укладки зависит от вида генома: (+)РНК может быть «голой»; (-)РНК, как правило, ассоциирована с белками нуклеокапсида и образует структуру под названием рибонуклеопротеид (РНП); ДНК вирусов ассоциирована с белками, подобными гистонам эукариот, и организована в виде типичных нуклеосом.
Разнообразие стратегий репликации, основанных на ДНК-зависимом синтезе ДНК, РНК-зависимом синтезе РНК и РНК-зависимом синтезе ДНК.
Изменчивость РНК. Полимеразы, катализирующие репликацию РНК, и обратная транскриптаза имеют минимальные возможности для исправления ошибок синтеза. В результате, частота возникновения ошибок при синтезе РНК приблизительно в 10 тысяч раз выше, чем при репликации ДНК, и она зависит от числа нуклеотидов, составляющих вирусный геном. Это означает, что геном любой индивидуальной частицы РНК- содержащего вируса будет содержать одну или несколько мутаций, отличающих его от последовательности дикого типа данной вирусной разновидности. Этот простой факт имеет далеко идущие последствия для биологии и эволюции РНК-содержащих вирусов, потому что потомство РНК-вируса (природное или лабораторное) представляет собой не совокупность однородных двойников, а скорее молекулярный рой родственных нуклеотидных последовательностей, сгруппированных в месте синтеза последовательностей. Этот молекулярный рой или “квази-разновидность” обеспечивает источник фенотипических вариантов, которые могут быстро ответить на изменяющееся давление естественного отбора. Как следствие, РНК-содержащие вирусы могут эволюционировать в миллион раз быстрее чем, ДНК-организмы. В тоже время высокая изменчивость РНК не обеспечивает быструю эволюцию РНК-содержащих вирусов, так, как размеры генома вирусов налагают верхние пределы на высокую норму ошибок полимеразы. Комбинация уровня репликационных ошибок и размера генома определяют “порог ошибки”, выше которого вирус не может поддерживать целостность последовательности квазиразновидностей. В результате, немногие РНК вирусы имеют размер генома более 30 килобаз (kb), чаще всего он колеблется в пределах 5-15 kb.
Принимая во внимание, что генетически разнообразное потомство может нести летальные мутации, что снижает потенциал для быстрого эволюционного ответа, РНК-геномы этого размера сбалансированы ниже их порогов ошибки.
Детально рассмотрим особенности организации вирусных ДНК и РНК.
Молекулярная масса вирусных ДНК варьирует в широких пределах от 1×10 6 до 250×10 6 . Самые большие вирусные геномы содержат несколько сотен генов, а самые маленькие содержат информацию, достаточную для синтеза лишь нескольких белков.
В геномах, представленных двунитчатыми ДНК, информация обычно закодирована на обеих нитях ДНК. Это свидетельствует о максимальной экономии генетического материала у вирусов, что является неотъемлемым свойством их как генетических паразитов. В связи с этим оценка генетической информации не может быть проведена по молекулярной массе молекул.
Хотя в основном структура ДНК уникальна, т. е. большинство нуклеотидных последовательностей встречаются лишь по одному разу, однако на концах молекул имеются повторы, когда в концевом фрагменте линейной ДНК повторяется ее начальный участок. Повторы могут быть прямыми и инвертированными.
Способность к приобретению кольцевой формы, которая потенциальнозаложена в концевых прямых и, инвертированных повторах, имеет большое значение для вирусов. Кольцевая форма обеспечивает устойчивость ДНК к экзонуклеазам. Стадия образования кольцевой формы обязательна для процесса интеграции ДНК с клеточным геномом. Наконец, кольцевые формы представляют собой удобный и эффективный способ регуляции транскрипции и репликации ДНК.
В составе вирионов, содержащих однонитчатую ДНК, обычно содержатся молекулы ДНК одной полярности. Исключение составляют аденоассоциированные вирусы, вирионы которых содержат ДНК либо одной полярности (условно называемой «плюс»), либо ДНК с противоположным знаком (условно – «минус»). Поэтому тотальный препарат вируса состоит из двух типов частиц, содержащих по одной молекуле «плюс» – ДНК или «минус» – ДНК.
Инфекционный процесс при заражении этими вирусами возникает лишь при проникновении в клетку частиц обоих типов.
Из нескольких сотен известных в настоящее время вирусов человека и животных РНК-геном содержит около 80 % вирусов. Способность РНК хранить наследственную информацию является уникальной особенностью вируса.
У просто организованных и некоторых сложно организованных вирусов вирусная РНК в отсутствие белка может вызвать, инфекционный процесс. Впервые инфекционная активность РНК вируса табачной мозаики была продемонстрирована X. Френкель-Конратом и соавт. в 1957 г. и А. Гирером и Г. Шраммом в 1958 г. Впоследствии положение об инфекционной активности РНК было перенесено на все РНК-содержащие вирусы, однако долголетние усилия доказать это для таких вирусов, как вирусы гриппа, парамиксовирусы, рабдовирусы (так называемые минуснитевые вирусы), оказались бесплодными: у этих вирусов инфекционной структурой являются не РНК, а комплекс РНК с внутренними белками. Таким образом, геномная РНК может обладать инфекционной активностью в зависимости от своей структуры.
Структура вирусных РНК чрезвычайно разнообразна. У вирусов обнаружены однонитчатые и двунитчатые, линейные, фрагментированные и кольцевые РНК. РНК-геном в основном является гаплоидным, до геном ретровирусов – диплоидный, т.е. состоит из двух идентичных молекул РНК (таблица 2).
Многообразие видов РНК-геномов расширяется за счет существования последовательностей, отличающихся направлением связей сахаро-фосфатного остова. Однонитевые РНК могут иметь позитивную полярность – (+)РНК, негативную полярность – (-)РНК или могут быть представлены обоюдозначащей цепью – (+/-)РНК (амбисенс стратегия кодирования). В свою очередь, РНК позитивной полярности могут иметь разную структурную организацию. Являясь матричной РНК, могут иметь на 5’– конце кэп (7-метилгуанозин), а на 3’-конце – поли-А последовательность; могут не иметь кэпа или поли-А; могут иметь на 5’-конце геномный белок; могут иметь на 3’-конце тРНК-подобную или шпильковую структуру.
Однонитчатые РНК. Молекулы однонитчатых вирусных РНК существуют в форме одиночной полинуклеотидной цепи со спирализованными ДНК-подобными участками. При этом не комплементарные нуклеотиды, разделяющие комплементарные участки, могут выводиться из состава спирализованных участков в форме различных «петель» и «выступов» (рисунок 5). Суммарный процент спирализации вирусных РНК не обнаруживает, каких-либо особенностей по сравнению с таковыми у клеточных РНК.
Рисунок 5 – Вторичная структура вирусных РНК
Вирусы, содержащие однонитчатые РНК, делятся на две группы. У вирусов первой группы вирусный геном обладает функциями информационной РНК, т.е. может непосредственно переносить закодированную в нем информацию на рибосомы. По предложению Д. Балтимора (1971) РНК со свойствами информационной условно обозначена знаком «плюс» и в связи с этим вирусы, содержащие такие РНК (пикорнавирусы, тогавирусы, коронавирусы, ретровирусы), обозначены как «плюснитевые» вирусы, или вирусы с позитивным геномом.
Вторая группа РНК-содержащих вирусов содержит геном в виде однонитчатой РНК, которая сама не обладает функциями иРНК. В этом случае функцию иРНК выполняет РНК, комплементарная геному. Синтез этой РНК (транскрипция) осуществляется в зараженной клетке на матрице геномной РНК с помощью вирусоспецифического фермента – транскриптазы. В составе «минус-нитевых» вирусов обязательно присутствие собственного фермента, осуществляющего транскрипцию геномной РНК и синтез иРНК, так как аналога такого фермента в клетках нет. Геном этих вирусов условно обозначают как «минус» – РНК, а вирусы этой группы как «минус-нитевые» вирусы, или вирусы с негативным геномом. К этим вирусам относятся ортомиксовирусы, парамиксовирусы, буньявирусы, рабдовирусы. РНК этих вирусов не способна вызвать инфекционный процесс.
В соответствии с разными свойствами вирусных РНК между двумя группами вирусов есть и структурные различия. Поскольку РНК «плюс-нитевых» вирусов выполняет функцию иРНК, она имеет специфические структурные особенности, характерные для 5’– и 3′-концов этих РНК. 5′-Конец клеточных и вирусных РНК обычно имеет структуру так называемой шапочки (по-английски «cap»):
где m 7 G представляет собой 7-метилгуанин, присоединенный через пирофосфатную связь к гуаниловому нуклеотиду, сахарный остаток которого также метилирован по второму углеродному атому. Эти модификации концов иРНК, осуществляемые после синтеза долинуклеотидной цепи, имеют существенное значение для функции иРНК: «шапочка» нужна для специфического узнавания иРНК рибосомами, функции поли (А) менее точно определены и, по-видимому, заключаются в придании стабильности молекулам иРНК. Такими же модифицированными концами обладают геномные РНК «плюс-нитевых» вирусов. Исключение составляет 5′-конец геномной РНК вируса полиомиелита, которая не содержит «шапочку», и вместо нее имеет на 5′-конце ковалентно присоединенный к остатку урацила низкомолекулярный терминальный белок. Геномные РНК «минус-нитевых» вирусов не имеют ни «шапочки», ни поли (А); модифицированные концы характерны для иРНК этих вирусов, синтезирующихся в клетке на матрице вирионной РНК и комплементарных ей. Геномная РНК ретровирусов, хотя и является «плюс-нитевой», однако не содержит «шапочку»; эту структуру содержит гомологичная РНК, синтезируемая на матрице интегрированной провирусной ДНК.
Существуют вирусы, содержащие как «плюс-нитевые», так и «минуснитевые» РНК гены (амбисенс-вирусы). К ним относятся аренавирусы.
В основном однонитчатые РНК являются линейными молекулами, однако РНК-фрагменты буньявирусов обнаружены в виде кольцевой формы. Кольцевая форма возникает за счет образования водородных связей между концами молекул.
Двунитчатые РНК. Этот необычный для клетки тип нуклеиновой кислоты, впервые обнаруженный у реовирусов, широко распространен среди вирусов животных, растений и бактерий. Вирусы, содержащие подобный геном, называют диплорнавирусы.
Общей особенностью диплорнавирусов является фрагментированное состояние генома. Так, геном реовирусов состоит из 10 фрагментов, ротавирусов – из 11 фрагментов.
источник