Геморрагическая лихорадка с почечным синдромом (ГЛПС) – зоонозная природно-очаговая вирусная инфекционная болезнь. Характеризуется цикличным течением, синдромом интоксикации, лихорадкой, геморрагическими проявлениями и развитием у большинства больных острой почечной недостаточности. В Российской Федерации ГЛПС занимает одно из первых мест по заболеваемости людей среди природно-очаговых инфекционных болезней. На территории Российской Федерации эпидемически активные очаги этой инфекции расположены в основном в умеренных широтах Европейской части и на Дальнем Востоке. Заболеваемость ГЛПС регистрируются на территории Российской Федерации, практически, в течение всего года с максимумом случаев в сезоны наибольшей эпизоотической активности очагов.
В 2015 году на территории Западного административного округа города Москвы зарегистрировано 22 случая ГЛПС. Все случаи зарегистрированы среди взрослого населения и связаны с инфицированием за пределами города Москвы: Московская область – 12 случаев, Калужская область – 3 случая, Тульская область – 2 случая, Владимирская область – 1 случай, Ярославская область – 2 случая, Смоленская область – 2 случая.
Возбудители ГЛПС – хантавирусы Пуумала, Хантаан, Сеул, Амур и Добрава, относятся к роду Хантавирус (семейство Буньявириде). К этому же роду принадлежат непатогенные для человека хантавирусы, циркулирующие на тех же территориях.
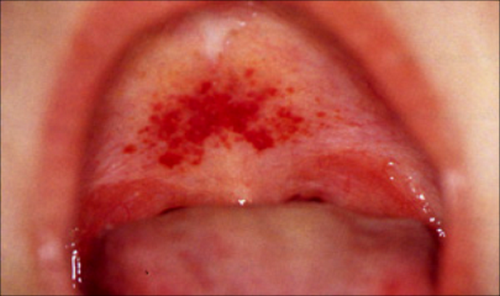
| Источником заражения людей хантавирусами являются мышевидные грызуны — хронические носители хантавирусов, у которых инфекция протекает бессимптомно. Инфицированные грызуны выделяют вирус во внешнюю среду со слюной, мочой, экскрементами. Основным путем заражения человека ГЛПС является аэрогенный (воздушно-капельный и воздушно-пылевой), при котором возбудитель, содержащийся в биологических выделениях зверьков, в виде аэрозоля попадает через верхние дыхательные пути в легкие человека, где условия для его размножения наиболее благоприятны, и затем с кровью переносится в другие органы и ткани. Заражение возможно также через поврежденную кожу при контакте с экскрементами инфицированных грызунов или со слюной в случае покуса зверьком человека. Редко заражение происходит при употреблении в пищу продуктов, загрязненных экскрементами грызунов. От человека к человеку инфекция не передаётся. Инкубационный период колеблется от 7 до 45 дней, в среднем составляет – 3 недели. лихорадочный период (до 3 дней), в течение которого заболевшего беспокоят озноб, сильные головные боли, лихорадка, выраженная слабость и недомогание, покраснение (гиперемия) кожных покровов шеи и лица, иногда период сопровождается сыпью;В развитии болезни различают 4 периода: олигурический период (с 4 по 10-12 день), во время которого на теле появляется сыпь в виде мелких кровоизлияний (петехий), гиперемия зева и конъюнктив, сухость кожных покровов, инъецированность сосудов склер, присоединяется рвота, беспокоят боли в поясничной области различного характера, уменьшается количество выделяемой мочи (олигурия); полиурический период (около 3-х дней), характеризуется улучшением самочувствия, увеличением диуреза до 8 л в сутки, ввиду чего заболевшие испытывают слабость и жажду; период реконвалесценции (выздоровления). Иммунитет после перенесенной болезни довольно стойкий. Повторные случаи заболевания наблюдаются редко. Меры профилактики Общественная профилактика:
Индивидуальная профилактика:
источник Геморрагические лихорадки – это группа острых инфекционных заболеваний, вызванных представителями четырех видов вирусов: аренавирусами, буньявирусами, флавивирусами и филовирусами. Общим для этих заболеваний является тяжелая интоксикация и характерный тромбогеморрагический синдром. Вирусы, вызывающие геморрагические лихорадки, широко распространены во многих странах мира. Некоторые встречаются и в развитых странах, однако эндемичными районами для большинства видов возбудителей являются Африка, Азия и Южная Америка. Течение геморрагической лихорадки, в зависимости от возбудителя, может варьироваться от умеренного до крайне тяжелого. Смертность от отдельных вариантов инфекции составляет от 10 до 90 %. Определенные варианты геморрагической лихорадки приводят к тяжелому поражению внутренних органов и нередко к летальному исходу. Прогноз заболевания зависит от типа вируса, возраста и общего состояния пациента, в частности от активности его иммунной системы. Viral hemorrhagic fevers, hemorrhagicfevers, VHF, VHFs. Симптомы геморрагических лихорадок различаются в зависимости от типа вируса, вызвавшего заболевание. Общими проявлениями для всех инфекций являются сама сильная лихорадка и повышенная кровоточивость. Симптомы в начальной стадии болезни чаще всего неспецифичны, однако в процессе дальнейшего развития патологического процесса могут появляться признаки поражения определенных органов и систем организма. Основные симптомы геморрагических лихорадок:
Общая информация о заболевании Геморрагические лихорадки могут быть вызваны представителями четырех семейств РНК-содержащих вирусов: аренавирусами (Arenaviridae), буньявирусами (Bunyaviridae), филовирусами (Filoviridae) и флавивирусами (Flaviviridae). Аренавирусы вызывают лихорадку Ласса, аргентинскую, бразильскую, венесуэльскую и боливийскую лихорадку, буньявирусы – лихорадку Крым-Конго, лихорадку долины Рифт, геморрагическую лихорадку с почечным синдромом, филовирусы – лихорадку Эбола, флавивирусы – желтую лихорадку, лихорадку Денге и др. «Резервуарами» вирусов служат некоторые животные и насекомые, чаще всего мелкие грызуны, летучие мыши, москиты, клещи. Как правило, определенные типы геморрагических лихорадок встречаются в основном на территории обитания тех животных, которые являются источником конкретного возбудителя. Например, источник вируса лихорадки долины Рифт, которая распространена на территории Африки, – это москиты. Геморрагическая лихорадка Крым-Конго встречается в Европе, Азии, Африке, ее распространяют клещи. Источник некоторых заболеваний, например лихорадки Эбола, остается неизвестен, предполагают, что им могут быть летучие мыши. Некоторые типы вирусов передаются через кровь или семенную жидкость зараженного животного или человека, через нестерильные иглы. Определенными возбудителями геморрагических лихорадок можно инфицироваться при вдыхании микрочастиц фекалий и мочи животных-переносчиков. Все представители вирусов, вызывающих геморрагические лихорадки, объединены общим патогенезом. Они склонны поражать эндотелий сосудов, что объясняет развитие геморрагического синдрома при большинстве геморрагических лихорадок. После проникновения вируса в кровь через укусы насекомых, расчесы, ссадины, инъекции, слизистую дыхательных путей сначала формируется локальная реакция на инфекцию, вслед за которой быстро развивается вирусемия и генерализованное поражение системы микроциркуляции (вирус поражает также клетки сосудистой стенки). При проникновении возбудителя в кровь он прилипает к мембране клетки, проникает внутрь нее, активно размножается и распространяется по другим тканям организма. Это сопровождается выделением биологически активных веществ, которые нарушают проницаемость сосудов, реологические свойства крови. Проявлением этого процесса является сыпь, гиперемия кожи, покраснение сосудов склер, могут возникать внутренние кровотечения, сопровождаемые резким падением артериального давления, шоком. Ряд вирусов вызывает поражение костного мозга, в частности мегакариоцитов. Ослабление иммунной системы организма, слабый или запоздалый ответ защитных механизмов может приводить к стремительному развитию патологического процесса, сопровождаемому массивными кровотечениями, полиорганным поражением.
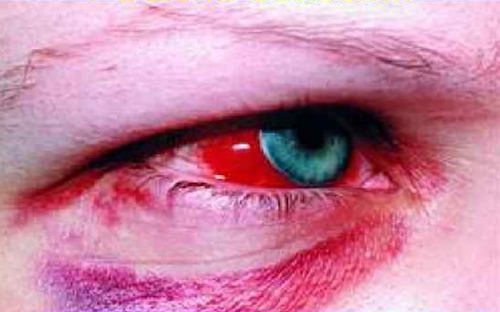
Диагностика основана на анамнезе, осмотре, результатах лабораторных и инструментальных исследований. При опросе пациента обращается внимание на возможный контакт с возбудителем – путешествие в эндемичные по заболеванию регионы, контакт с животными-переносчиками или инфицированными людьми. Инкубационный период большинства геморрагических лихорадок составляет 10-21 день, поэтому болезнь может развиться уже после возвращения из путешествия в опасный район. При подозрении на наличие геморрагической лихорадки необходимо в условиях стационара в кратчайшие сроки провести ряд исследований, позволяющих дифференцировать болезнь от других заболеваний и установить тип возбудителя:
Оставьте ваш E-mail и получайте новости, а также эксклюзивные предложения от лаборатории KDLmed источник Геморрагическая лихорадка с почечным синдромом (ГЛПС) – острое вирусное природно- очаговое инфекционное заболевание с нетрансмиссивным механизмом передачи, регистрируемое на территории России в основном в умеренных широтах европейской части и на Дальнем Востоке. Возбудители ГЛПС – вирусы Пуумала, Добрава, Хантаан, Сеул и Амур – относятся к роду Hantavirus, семейства Bunyaviridae. Вирус Пуумала в основном приурочен к лесным ландшафтам европейской части России, наибольшее число случаев ГЛПС регистрируется в Среднем Поволжье и Приуралье (Республика Башкирия, Челябинская, Оренбургская области). Вирус Добрава в последнем десятилетии XX века и в 2000-е годы регистрируется на территории центральных областей России: Рязанской, Тульской, Воронежской, Липецкой, Тамбовской, Курской, а также в Краснодарском крае – в районе Большого Сочи. В европейской части России заболеваемость регистрируется с марта, нарастает в мае-августе, пик приходится на сентябрь-ноябрь, спад – на декабрь-январь. В очагах вируса Добрава выражена осеннее-зимняя сезонность. Очаги вирусов Хантаан, Сеул и Амур находятся в дальневосточных регионах России. Для вируса Амур характерна весенне-летняя или осенне-зимняя сезонность; для вируса Сеул – весенняя, для вируса Хантаан – осенне-зимняя. Источником заражения ГЛПС являются дикие грызуны, механизм передачи вируса – аэрозольный (воздушно-капельный и воздушно-пылевой). Возможен и алиментарный путь заражения через загрязненные продукты питания и воду. Заражение вирусом Пуумала наиболее часто происходит при посещении леса, во время рыбной ловли, при работе на садовом участке, заражение вирусом Добрава – при уходе за домашними сельскохозяйственными животными, работе с фуражом, сеном. Таким образом в очагах вируса Пуумала 6080% заболевших – городские жители, в очагах ГЛПС, вызываемых хантавирусами Добрава, Амур и Хантаан, среди больных преобладают сельские жители. Иммунитет у переболевших сохраняется пожизненно, повторные случаи заболевания ГЛПС, как правило, исключены. Клиника ГЛПС характеризуется острым началом, цикличностью течения: выделяют начальный период, длящийся 1-3 дня, олигурический период – 4-11-й дни болезни, полиурический период – 12-30-й дни болезни, период реконвалесценции – с 20-30-го дня болезни. Начальный период характеризуется повышением температуры тела, головной болью, миалгиями и артралгиями, жаждой. Могут появиться абдоминальные боли, тошнота, рвота. Часто развивается гиперемия кожи лица, верхней половины туловища, отмечается инъекция сосудов склер. На 3-4-й дни болезни может начаться развитие олигурического периода, характеризующегося уменьшением суточного диуреза, вплоть до анурии и развития острой почечной недостаточности. Геморрагический синдром может проявляться в виде геморрагической сыпи на коже, кровоизлияниях под кожу, носовыми и желудочно-кишечными кровотечениями, гематурией, кровоизлияниями во внутренние органы, субсклеральные гематомы. Могут развиться отек легких и головного мозга, инфекционно-токсический шок. Переход к полиурии связан с улучшением общего состояния больных, в период реконвалесценции при нормализации диуреза в основном сохраняется только астенический синдром. Наряду с тяжелыми и среднетяжелыми формами ГЛПС регистрируются также легкие и стертые формы. Инфекционные заболевания: лептоспироз, менингококковая инфекция, инфекционный мононуклеоз, клещевой энцефалит и боррелиоз, острые кишечные инфекции; соматические заболевания: пиелонефрит, панкреатит, почечная колика, заболевания крови, отравления. Показания к обследованию Лихорадка с общеинтоксикационным синдромом, возникшая у лиц, в последние 1,5 месяца находившихся на территории, эндемичной по ГЛПС, особенно при наличии симптомов: сухость во рту, жажда, нарушение зрения, геморрагические проявления. Материал для исследований
Этиологическая лабораторная диагностика включает обнаружение специфических АТ IgM и IgG или суммарных АТ к АГ вируса; обнаружение РНК вируса в крови; изоляцию вируса. Сравнительная характеристика методов лабораторной диагностики Диагностическая чувствительность выявления РНК вируса методом ПЦР в крови пациентов, взятой на первой неделе заболевания, составляет 85–100%, на второй неделе заболевания – около 40%. При использовании метода ИФА АТ IgM можно определить начиная с 1-го по 7-й, АТ Ig G – со 2-го по 9-й дни болезни, уровень достигает максимальных значений к 8-25-му дню и через 18-22 дня, соответственно. При определении АТ методом ИФА для лабораторного подтверждения ГЛПС необходимо исследовать образцы крови, взятые с интервалом в одну неделю. При использовании метода непрямого МФА (нРИФ) АТ можно определить со 2-3-го дня болезни, к концу второй недели заболевания их уровень достигает пиковых значений. Для подтверждения диагноза ГЛПС с использованием метода МФА также исследуют образцы крови, взятые в динамике: первый – на 2-4-й день болезни, второй – через 2-3 дня; полученные образцы необходимо исследовать одновременно для выявления диагностически значимого нарастания титров АТ к хантавирусам. Клинический диагноз ГЛПС считают подтвержденным при выделении инфекционного агента, идентифицированного как патогенный для человека вид хантавируса; при выявлении методом ИФА АТ IgM и роста титров IgG в образцах крови, взятых в динамике; при выявлении методом непрямого МФА (РИФ) нарастания титров АТ в образцах крови, взятых в динамике. Обнаружение РНК хантавирусов в крови пациента является основанием для предварительной постановки диагноза. Продолжая использовать наш сайт, вы даете согласие на обработку файлов cookie, пользовательских данных (сведения о местоположении; тип и версия ОС; тип и версия Браузера; тип устройства и разрешение его экрана; источник откуда пришел на сайт пользователь; с какого сайта или по какой рекламе; язык ОС и Браузера; какие страницы открывает и на какие кнопки нажимает пользователь; ip-адрес) в целях функционирования сайта, проведения ретаргетинга и проведения статистических исследований и обзоров. Если вы не хотите, чтобы ваши данные обрабатывались, покиньте сайт. Copyright ФБУН Центральный НИИ Эпидемиологии Роспотребнадзора, 1998 — 2019 Центральный офис: 111123, Россия, Москва, ул. Новогиреевская, д.3а, метро «Шоссе Энтузиастов», «Перово» ! Продолжая использовать наш сайт, вы даете согласие на обработку файлов cookie, пользовательских данных (сведения о местоположении; тип и версия ОС; тип и версия Браузера; тип устройства и разрешение его экрана; источник откуда пришел на сайт пользователь; с какого сайта или по какой рекламе; язык ОС и Браузера; какие страницы открывает и на какие кнопки нажимает пользователь; ip-адрес) в целях функционирования сайта, проведения ретаргетинга и проведения статистических исследований и обзоров. Если вы не хотите, чтобы ваши данные обрабатывались, покиньте сайт. источник Геморрагическая лихорадка с почечным синдромом (ГЛПС, мышиная лихорадка) – заболевание, которое вызывает контакт с выделениями грызунов. Инфицирование происходит группой вирусов, принадлежащих к роду Hantavirus семейства Bunyaviridae. Патогенез неизвестен, но по данным исследований установлено, что иммунные механизмы играют важную роль. Тяжелые формы ГЛПС регистрируют в странах Востока. Количество заболевших в Китае составляет примерно 100-250 тысяч в год. Мягкая форма чаще встречается в скандинавских странах Скандинавии. Заболеть ГЛПС можно в течение года, но заболеваемость зависит от динамики популяции грызунов-носителей. Сезонные вспышки ГЛПС весной и осенью происходят из-за активного размножения мышей и связаны с увеличением контактов с грызунами на фоне садово-полевых работ. Наиболее тяжелая форма геморрагической лихорадки с синдромом почечной недостаточности вызвана вирусом Хантаан (HTNV) в Азии. Пуумала – наиболее распространенный хантавирус, но заболевание протекает легче. Встречается в Европе, России, и Балканах. Вирус Dobrava инициирует более тяжелую форму ГЛПС. Причины различий в клинической тяжести неизвестны. Смертность и заболеваемость варьируются от 5-15% в зависимости от патогенности штамма возбудителя. Повышенная заболеваемость у мужчин обусловлена их более высокой активностью на открытом воздухе, что приводит к контакту с инфицированными грызунами. Геморрагическая лихорадка с синдромом почечной недостаточности обычно развивается у лиц старше 15 лет (20-60). У детей и подростков младше 15 лет болезнь является легкой и часто протекает в субклинической форме. Вирусы рода Hantavirus (семейство Bunyaviridae) вызывают различные формы геморрагической лихорадки с синдромом почечной недостаточности. Тяжесть заболевания зависит от штамма вируса и географического распределения. Хантавирусы, связанные с ГЛПС, включают вирус Хантаан (HTNV), Добрава / Белград (DOBV), Сеул (SEOV), Пуумала (PUUV) и Сааремаа (SAAV). • Корейская геморрагическая лихорадка – тяжелый тип болезни, наблюдаемый в Азии, вызван хантавирусом и передается зараженной полосатой полевой мышью A agrarius mouse. • Балканская геморрагическая лихорадка, тяжелый тип, встречается в балканских странах, вызван вирусом Добрава, грызун — A flavicollis. • Легкая и умеренная форма геморрагической лихорадки с синдромом почечной недостаточности вызвана вирусом Сеула и передается зараженными грызунами рода Раттусратута и Rattusnovergicus. • Умеренная форма геморрагической лихорадки с синдромом почечной недостаточности, наблюдаемая в Европе, вызвана вирусом Puumala и передается грызунами Clethrionomysglariolus. Вирус обычно попадает к человеку через вдыхание экскрементов зараженных животных (например, мочи, фекалий, слюны). Укус грызуна может также привести к инфицированию человека. На сегодняшний день не существует подтверждения для передачи болезни между людьми. В группу риска входят лица, связанные с сельскохозяйственной деятельностью, военные (полевые учения), любители походов, дачники и пр. Проживание в зонах обитания грызунов, вероятность контакта с продуктами их жизнедеятельности (например, уборка дачи после зимы), клиническая картина и лабораторные данные, включая положительный анализ крови на ГЛПС, позволяют поставить окончательный диагноз. Выполнение биопсии почек не является необходимой мерой. • ПЦР-тест; Инструментальная диагностика проводится по показаниям и включает: • УЗИ почек; Клинические особенности при геморрагической лихорадке с синдромом почечной недостаточности состоят из триады: • повышение температурной реакции; К распространенным симптомам на начальном этапе заболевания относят: • низкое артериальное давление; Инкубационный период – 12-16 дней. У детей ГЛПС чаще протекает в субклинической форме и при тяжелом течении может осложниться гиповолемическим шоком. Период с момента инфицирования до клинических проявлений – 4-42 дня. Болезнь имеет 5 прогрессирующих стадий: • инкубационная; Только 1/3 пациентов проходит через все стадии. Фебрильная стадия типична для всех пациентов и продолжается 3-7 дней. Болезнь характеризуется резким повышением температуры до 40° C. Пациенты предъявляют жалобы на головную боль, озноб, боль в животе и пояснице, недомогание, снижение остроты зрения. На фоне лихорадки появляется геморрагическая сыпь на грудной клетке, в подмышечных впадинах, шее. На слизистой мягкого неба визуализируются петехии. Субконъюнктивальное кровоизлияние отмечено у 30% пациентов. Брадикардия и пастозность лица встречаются достаточно часто. Тахикардия может указывать на предстоящий шок. С почечной недостаточностью и низким давлением сталкиваются 11% пациентов. При тяжелом течении осложнением присоединяется острый живот на фоне пареза кишечника. Повышенный уровень амилазы и липазы в сыворотке крови, в сочетании с острой болью в животе, указывает на острый панкреатит. Диагноз можно подтвердить при компьютерной томографии поджелудочной железы, которая показывает отек самого органа и окружающих тканей. У пациентов могут быть судороги или бесцельные движения. • повышенный уровень гематокрита, вызванный гемоконцентрацией; В моче временная протеинурия (как правило, разрешается в течение 2 недель) и микрогематурия. Олигурическая стадия происходит у 65% пациентов и длится около 3-6 дней. Для нее характерно острое поражение почек, характеризующееся резким снижением выработки мочи, гипертонией, склонностью к кровотечениям, вызванной уремией, отеками. На этом этапе мочевина и сывороточный креатинин крови достигают наивысшего уровня. Гипонатриемия, гиперфосфатемия и гиперкалиемия также могут возникать во время олигурической фазы. Серьезное осложнение при неадекватной терапии – отек легких. На данной стадии уровень тромбоцитов возвращается к норме. Выделение большого количества мочи обычно происходит в течение 2-3 недель. Суточный диурез составляет 3-6 литров, симптомы предыдущих стадий исчезают. На данном этапе может возникнуть обезвоживание, если инфузионная терапия недостаточна. Реконвалесценция продолжается до 3-6 месяцев. Клиническое выздоровление обычно начинается в середине второй недели с постепенным разрешением симптомов и азотемии. Важно! Концентрационная способность почечных канальцев восстанавливается в течение многих месяцев, поэтому необходимо соблюдать все рекомендации врача и сдавать анализы. Жалобы пациентов на стадии выздоровления: • слабость; Во время выздоровления постепенно восстанавливается привычная масса тела. Терапия зависит от стадии заболевания, уровня дегидратации и состояния гемодинамики. Самый важный шаг в лечении геморрагической лихорадки с почечным синдромом – поддержание гемодинамики пациента и регидратация. Во время активной стадии болезни жизненно необходимо восполнение баланса жидкости и электролитов. Показания к различным лекарствам основаны на клинике в разные стадии заболевания. При шоковом состоянии используют препараты, повышающие давление и внутривенно вводят альбумин. Чрезмерная инфузионная терапия может привести к экстравазации, состоянию, когда стенки капилляров начинают пропускать кровь. Во время олигоурической стадии показаны диуретики (Фуросемид), в случае неэффективности – проведение заместительной почечной терапии, особенно, если есть перегрузка жидкостью, гиперкалиемия и ацидоз. Если повышено артериальное давление, используют гипотензивные препараты. Антибиотики показаны только при подозрении на вторичное инфицирование. При кровотечении переливают кровь и ее компоненты и назначают антагонисты Н 2 –рецепторов. В случае диссеминированной внутрисосудистой коагуляции вводят свежую плазму или плазмозаменители. Рекомендуется питание с низким содержанием натрия и с ограничением жидкости во время олигурической фазы. В период полиурии потребление жидкости свободное. Восстановление обычно начинается с 10-11 дня. Период ранней реконвалесценции может продолжаться от нескольких суток до нескольких недель, поэтому необходим тщательный контроль электролитных нарушений и признаков обезвоживания. Фаза выздоровления длится 3-6 месяцев. Гломерулярные повреждения, как правило, проходят, и концентрационная способность почечных канальцев постепенно улучшается. Последующее наблюдение проводят еженедельно, пока состояние не нормализуется. В последующем анализы контролируют 1 раз в месяц, так как у некоторых пациентов сохраняется протеинурия и повышенное артериальное давление. У 10-12 % пациентов может развиться пиелонефрит (при присоединении бактериальной флоры), нефросклероз, поэтому наблюдение нефролога обязательно. Поведение человека может увеличить заболеваемость, поэтому основные превентивные меры включают следующее: • Правильное хранение пищи и борьба с грызунами. Разработка недорогой, безопасной, эффективной и многовалентной вакцины против этой группы вирусов могла бы стать лучшей формой профилактики в эндемичных регионах. Однако высокое генетическое и антигенное разнообразие патогенных хантавирусов в сочетании со спорадическим характером вспышек заболеваний создают серьезные проблемы для разработки эффективных профилактических вакцин. ГЛПС в редких случаях может привести к развитию следующих состояний: • забрюшинное кровотечение: ГЛПС является самоограничивающейся болезнью, и большинство пациентов восстанавливается без осложнений; однако у некоторых людей могут сохраняться симптомы неблагополучия со стороны нервной системы и почек. Нарушение реабсорбции натрия наблюдается через 12 месяцев после болезни, вызывая его повышенную экскрецию с мочой. В ряде случаев диагностируют гиперкальциурию и гиперфосфатурию. Приблизительно у 1 из 10 взрослых с терминальной стадией почечной недостаточности в крови присутствуют специфичные к хантавирусу антитела. В литературе есть данные, что панкреатит и орхит могут быть осложнениями при ГЛПС. источник Изобретение относится к области медицины, в частности к вирусологии, и может быть использовано в диагностике геморрагической лихорадки с почечным синдромом /ГЛПС/. Цель — повышение точности диагностики, проводимой с 5-й по 13-й дни болезни, и упрощения способа. Диагностику ГЛПС проводят путем однократного определения в одном и том же образце свежесобранной мочи больного антигена вируса ГЛПС с помощью твердофазного иммуноферментного анализа /ИФА/ и антител к нему с помощью непрямого метода флюоресцирующих антител /НМФА/ в ранний период болезни /с 5-й по 13-й дни/. 2 табл. Изобретение относится к медицине, в частности к вирусологии, и может быть использовано в диагностике геморрагической лихорадки с почечным синдромом (ГЛПС) тяжелого вирусного природно-очагового заболевания, широко распространенного на территории СССР и в других странах Европы, Азии и Америки. Известен способ диагностики ГЛПС путем определения антител в крови. Однако он недостаточно точен, поскольку диагноз ставится на основании сероконверсии четырехкратного нарастания титров антител при использовании парных сывороток, полученных в первые дни болезни и повторно на 14-й 21-й дни. В последнее время появились сведения о получении результатов реакции в начале второй недели болезни, в связи с чем появляется необходимость более раннего взятия крови. Однако это затруднено, так как больные обычно поступают в стационар не ранее 4-го дня болезни. Таким образом, нарушается принцип четырехкратного нарастания титров антител. Также известен способ ранней диагностики ГЛПС путем определения антигена вируса в составе иммунного комплекса в крови больных с помощью твердофазного иммуноэнзиматического метода. Однако определение антигена этим способом достигается опосредованно через специфический иммунный комплекс и нуждается в подтверждении, также не уточнены сроки диагностики заболевания. Все способы диагностики, где в качестве образца для исследования используется кровь, связаны с определенной степенью риска заражения другими заболеваниями (гепатит, СПИД). В настоящее время известен способ ранней диагностики ГЛПС путем определения антигена в моче больных с помощью прямого твердофазного иммуноферментного анализа (ИФА) [1] Однако диагностика этим способом нуждается в уточнении в связи с возможным получением ложноположительных результатов (2%). Кроме того, известны способы диагностики по содержанию антител в моче с помощью иммуноблотинга и ИФА при СПИДе; обнаружению цитомегаловирусных антигенов и антител в моче новорожденных и детей с помощью ИФА; цитомегаловируса в моче с использованием амплификации ДНК в цепной полимеразной реакции. Диагностика же по содержанию антител в моче больных ГЛПС ранее не проводилась. Для определения антител в моче при других заболеваниях не использовался НМФА. Целью изобретения является повышение надежности, точности диагностики заболевания и упрощения способа. Указанная цель достигается тем, что диагностику ГЛПС проводят путем однократного определения в одном и том же образце свежесобранной мочи больного антигена вируса с помощью твердофазного иммуноферментного анализа (ИФА) и антител к нему с помощью непрямого метода флюоресцирующих антител (НМФА) в ранний период болезни (с 5-й по 13-й день). Способ осуществляется следующим образом. В образце свежесобранной утренней порции мочи определяют антиген вируса ГЛПС с помощью ИФА и антитела к нему с помощью НМФА. 1. При определении антигена вируса в каждую лунку полистироловой панели для иммунологических реакций вносят по 75 мкл иммуноглобулина, выделенного из сыворотки переболевшего ГЛПС человека, в рабочем разведении согласно указанного титра. Контакт 18 часов при 4 o С. После трехкратной отмывки 0,1 М фосфатно-буферным раствором (ФБР) рН 7,4 с 0,05% твина панель заполняют раствором 1% альбумина на ФБР и помещают в термостат при 37 o С на 30 минут. Панель трижды отмывают и добавляют исследуемую нативную мочу в объеме 50 мкл на лунку с иммунным покрытием. В качестве контроля используют мочу здоровых людей и больных другими заболеваниями. После контакта в течение 2 часов при 37 o С панель трижды отмывают ФБР с твином и в каждую лунку добавляют по 50 мкл меченного пероксидазой хрена иммуноглобулина. Панель помещают в термостат на 1 час, отмывают и добавляют в каждую лунку по 10 мкл субстрата, содержащего ортофенилендиамин в 0,1 М цитратнофосфатном буфере рН 5,0 и перекись водорода (0,06%). После 50-минутного контакта в темной камере при комнатной температуре реакцию останавливают добавлением 2 М раствора H2SO4. Учитывают реакцию визуально, сравнивая окраску исследуемых образцов с контролем. По появлению желтой окраски в исследуемом образце судят о наличии антигена вируса ГЛПС. 2. С целью определения специфических антител в этом же образце мочи используется культуральный поливалентный диагностикум геморрагической лихорадки с почечным синдромом производства Института полиомиелита и вирусных энцефалитов АМН СССР. На первом этапе каждое разведение исследуемого образца, начиная с максимального, наносят на отдельную каплю мазок фиксированного антиген-содержащего диагностикума. Серийные 2-кратные разведения исследуемого материала предварительно готовят на микропанелях, начиная с разведения 1:5. В опыте на каждом стекле присутствуют контрольные сыворотки: анти-ГЛПС иммунные сыворотки 1-го и 2-го серотипов в рабочем разведении соответственно указанного титра. После инкубации во влажной камере при 37 o С в течение 30 минут препараты 2-кратно по 2 минуты выдерживают в ФБР рн 7,2-7,4, промывают дистиллированной водой и высушивают при комнатной температуре. На втором этапе окрашивают люминесцирующей сывороткой против глобулинов человека (производства ИЭМ им.Гамалеи) в рабочем разведении, указанном на этикетке. С целью контрастирования специфического сведения добавляют краситель «Голубой Эванс» в конечной концентрации 1:10000. Экспозиция и обработка окрашенного препарата аналогична первому этапу. Препараты просматривают в люминесцентном микроскопе марки ЛЮМАМ с масляной системой (объектив х 90, окуляр х 7, светофильтры ФС 1-2, БС 8-3, СЭС 24-4). За титр антител в исследуемом образце принимают последнее наибольшее разведение, дающее специфическое свечение. Пример. Больной К-о О.В. 42 года. Диагноз: ГЛПС, средней тяжести. Антиген вируса ГЛПС и антитела к нему в моче больного определяли на 6-й, 9-й, 13-й, 16-й дни болезни. Антиген вируса ГЛПС с помощью ИФА обнаружен во всех исследуемых образцах мочи. Антитела к вирусу ГЛПС с помощью НМФА обнаружены в образце мочи, взятой на 6-й день болезни, в титре 1:160; на 9-й день в титре 1:20, на 13-й день — в титре 1:5. В образцах мочи, взятой на 16-й и 23-й день болезни, антитела не обнаружены. При обследовании 44 проб мочи от 20 больных ГЛПС, собранных в различные сроки заболевания, антиген к вирусу ГЛПС и специфические антитела обнаруживались в сроки от 5-го по 13-й день болезни у 100% обследуемых. У больных другими заболеваниями и клинически здоровых людей антигены вируса и специфические антитела не обнаружены (табл.1, табл.2). В ранний период заболевания вследствие нарушения проницаемости кровеносных сосудов почек в мочу больных ГЛПС из крови проникают с белками (пропотевание в мочеточник) антитела, которые и выявляются с помощью НМФА. Ранее антитела в моче НМФА никем не определялись. Согласно проведенным исследованиям, антигены вируса ГЛПС с помощью ИФА и специфические антитела с помощью НМФА в моче выявляются у всех обследованных больных с 5-й по 13-й дни болезни. Таким образом, по сравнению с известными способами диагностики преимуществом заявленного способа является впервые обнаруженные антитела в моче НМФА и их использование в комплексе с определением антигена в одном и том же образце свежеполученной мочи для диагностики ГЛПС в ранние сроки болезни (с 5-й по 13-й дни). Одновременное однократное определение антигена вируса ГЛПС и антител к нему в одной и той же пробе мочи больного упрощает способ, позволяет установить окончательный диагноз в первые дни болезни, поскольку обнаружение антигена вируса и специфических антител в моче однозначно свидетельствует о протекающей в данный момент острой инфекции ГЛПС. Одновременное определение в одном и том же образце мочи антигена вируса и антител к нему двумя различными методами (ИФА и НМФА) повышает точность, надежность способа позволяет избежать ошибок при постановке диагноза. Преимуществом предлагаемого способа является также использование в качестве материала для исследования мочи, а не крови, что исключает дополнительный риск заражения другими заболеваниями (гепатит, СПИД). Необходимое для диагностики количество мочи (0,5-1,0 мл) столь невелико, что его возможно получить у больного даже при анурии (катетором). Способ ранней диагностики геморрагической лихорадки с почечным синдромом путем определения специфического антигена в моче с помощью иммуноферментного анализа, отличающийся тем, что, с целью повышения точности диагностики, проводимой в сроки с 5 по 13 дни болезни, и упрощения способа, одновременно ведут определение специфических антител в другом образце этой же пробы мочи с помощью непрямого метода флюоресцирующих антител и при наличии антигена и антител диагностируют геморрагическую лихорадку с почечным синдромом. источник Геморрагическая лихорадка – это понятие, объединяющее группу инфекционные заболевания с похожими клиническими, патогенетическими и этиологическими признаками . Каждое из них проявляется симптомами психоневрологических расстройств, геморрагического и интоксикационного синдромов и полиорганной недостаточностью . Но имея характерную клиническую картину, каждая лихорадка имеет отдельное название. Современной медицине известно не менее 15 независимых подвидов этой патологии. Геморрагическая лихорадка относится к природно-очаговым заболеваниям и распространена в регионах обитания переносчиков – клещей и комаров. У пострадавших от геморрагической лихорадки возникает озноб, жар, кровотечения, развиваются дисфункции органов, на теле появляется сыпь. В большинстве случаев, общий анализ крови сначала выявляет лейкопению , а потом тромбоцитопению . Правильный диагноз позволяет поставить лабораторная диагностика. Больным предписывают стационарное лечение и проводят гемостатическую, дезинтоксикационную, противовирусную и иммуномодулирующую терапию. Как правило, болеют люди, чья профессиональная деятельность связана с пребыванием в дикой природе или с сельскохозяйственными работами. В городе этому заболеванию подвержены те, кто по долгу службы имеют контакт с грызунами, и лица без определенного места жительства. В регионах с влажным и теплым климатом регистрируют отдельные случаи геморрагической лихорадки, в субтропиках и тропиках это принимает характер эпидемии. Особенно тяжело переносят болезнь дети, преимущественно те, которые впервые посещают инфекционный очаг. Чаще всего этому заболеванию подвержены люди в возрасте 20-60 лет. Половая принадлежность роли не играет. Смертность от этого заболевания очень высокая и достигает 70%. Возбудителями геморрагической лихорадки являются вирусы разнообразных семейств. Их переносят комары и клещи. Естественные хозяева вирусов – белки, летучие мыши, грызуны, приматы и дикобразы. Инфекция распространяется трансмиссивным путём через укусы насекомых. Выделяют следующе пути заражения:
Геморрагическая лихорадка очень опасное заболевание, которое даже при правильной и своевременной терапии может закончиться летальным исходом. Патологический процесс заболевания проходит следующие стадии развития.
Все признаки геморрагических лихорадок разнообразных типов можно объединить в следующие синдромы.
Диагностика заболевания начинается со сбора анамнеза и опроса пострадавшего. Специалисты определяют, в каком регионе больной проживает, имели ли место быть контакты с животными, был ли укушен насекомым. Геморрагические проявления и высокая температура тела должны врачей насторожить. Предполагаемый диагноз можно подтвердить или опровергнуть только при помощи лабораторной диагностики. Для этого используют следующие информативные методики:
При геморрагической лихорадке требуется срочная госпитализация. Лечение проводится в реанимационном отделении или в боксе инфекционного стационара, где осуществляется заместительная, гемостатическая, симптоматическая и десенсибилизирующая терапия. При заместительной терапии пострадавшему назначают переливание компонентов крови — введение внутривенно препаратов железа, факторов свертывания, тромбоцитарной массы. При дезинтоксикационной терапии вводят внутривенно солевые растворы, раствор глюкозы, «Реополиглюкина», «Гемодеза». При противовирусной терапии назначают «Ингавирин», «Амиксин», «Кагоцел», «Анаферон». При витаминотерапии – витамин С и витамин Р. При кровоостанавливающей терапии – «Дицинон», «Викасол», «Этамзилат». В качестве противогистаминных средств прописывают «Диазолин», «Супрастин», «Тавегил». Жаропонижающие средства – «Нурофен», «Ибуклин». Противоболевые средства – «Спазган», «Пенталгин», «Кеторол». Дезагреганты – «Тромбоасс», «Кардиомагнил», «Аспирин». Для улучшения микроциркуляции – «Фраксипарин», «Клексан», «Гепарин». Антиоксиданты и ангиопротекторы – «Винпоцетин», «Актовегин». В случае развития почечных осложнений мочегонные средства – «Фуросемид», «Лазикс». При поражении почек – гемодиализ. Если пострадавший поступает в отделение в шоковом состоянии, ему вводят сердечные гликозиды, «Допамин», «Реополиглюкин». Больным назначается диетотерапия и строгий постельный режим. В разгар болезни питание парентеральное, в период выздоровления – легкая растительно-молочная пища, богатая витаминами С, В, РР или К. Очень полезны фруктовые и овощные отвары, настои, морсы, соки. При грамотном комплексном лечении значительно снижается риск развития осложнений, и ускорятся процесс выздоровления. Специфические методы профилактики разработаны только в отношении омской и желтой геморрагических лихорадок. Развитие остальных форм с помощью вакцины предупредить нельзя. Геморрагическая лихорадка – очень тяжелое заболевание, поэтому вместо того, чтобы упорно и долго лечиться, лучше соблюдать профилактические меры, чтобы обезопасить себя. Для предупреждения развития патологии, рекомендуются следующие профилактические мероприятия:
Прогноз выздоровления неоднозначный и зависит как от степени тяжести болезни, так и от общего состояния больного. Нередко геморрагическая лихорадка заканчивается летальным исходом. Медицинская помощь, оказанная своевременно позволяет спасти жизнь пострадавшему. Согласно классификации М.Чумакова (1977) геморрагические лихорадки по механизму передачи инфекции делятся на:
источник Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам. У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования. Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter. При доминировании синдрома менингоэнцефалита — консультация невролога; при сердечно-сосудистой недостаточности, шоке — реаниматолога; симптомов миокардита — кардиолога; при подозрении на перитонит — хирурга; при метроррагии — гинеколога. Больные крымской геморррагической лихорадкой подлежат скорейшей госпитализации в инфекционный стационар, независимо от тяжести и периода течения заболевания, с максимально щадящей транспортировкой, исключением толчков и тряски. Транспортировка пациента противопоказана в период кровотечений. Пациента с крымской геморррагической лихорадкой нужно размещать в боксе с соблюдением правил противоэпидемического режима для возбудителей I группы патогенности. Клиническая диагностика крымской геморрагической лихорадки основывается на признаках заболевания.
Крымская геморрагическая лихорадка с геморрагическим синдромом, период разгара, тяжёлое течение. Осложнение: ДВС-синдром, инфекционно-токсический шок II степени.
источник Геморрагическая лихорадка с почечным синдромом (ГЛПС, мышиная лихорадка) – заболевание, которое вызывает контакт с выделениями грызунов. Инфицирование происходит группой вирусов, принадлежащих к роду Hantavirus семейства Bunyaviridae. Патогенез неизвестен, но по данным исследований установлено, что иммунные механизмы играют важную роль. Тяжелые формы ГЛПС регистрируют в странах Востока. Количество заболевших в Китае составляет примерно 100-250 тысяч в год. Мягкая форма чаще встречается в скандинавских странах Скандинавии. Заболеть ГЛПС можно в течение года, но заболеваемость зависит от динамики популяции грызунов-носителей. Сезонные вспышки ГЛПС весной и осенью происходят из-за активного размножения мышей и связаны с увеличением контактов с грызунами на фоне садово-полевых работ. Наиболее тяжелая форма геморрагической лихорадки с синдромом почечной недостаточности вызвана вирусом Хантаан (HTNV) в Азии. Пуумала – наиболее распространенный хантавирус, но заболевание протекает легче. Встречается в Европе, России, и Балканах. Вирус Dobrava инициирует более тяжелую форму ГЛПС. Причины различий в клинической тяжести неизвестны. Смертность и заболеваемость варьируются от 5-15% в зависимости от патогенности штамма возбудителя. Повышенная заболеваемость у мужчин обусловлена их более высокой активностью на открытом воздухе, что приводит к контакту с инфицированными грызунами. Геморрагическая лихорадка с синдромом почечной недостаточности обычно развивается у лиц старше 15 лет (20-60). У детей и подростков младше 15 лет болезнь является легкой и часто протекает в субклинической форме. Вирусы рода Hantavirus (семейство Bunyaviridae) вызывают различные формы геморрагической лихорадки с синдромом почечной недостаточности. Тяжесть заболевания зависит от штамма вируса и географического распределения. Хантавирусы, связанные с ГЛПС, включают вирус Хантаан (HTNV), Добрава / Белград (DOBV), Сеул (SEOV), Пуумала (PUUV) и Сааремаа (SAAV). • Корейская геморрагическая лихорадка – тяжелый тип болезни, наблюдаемый в Азии, вызван хантавирусом и передается зараженной полосатой полевой мышью A agrarius mouse. • Балканская геморрагическая лихорадка, тяжелый тип, встречается в балканских странах, вызван вирусом Добрава, грызун — A flavicollis. • Легкая и умеренная форма геморрагической лихорадки с синдромом почечной недостаточности вызвана вирусом Сеула и передается зараженными грызунами рода Раттусратута и Rattusnovergicus. • Умеренная форма геморрагической лихорадки с синдромом почечной недостаточности, наблюдаемая в Европе, вызвана вирусом Puumala и передается грызунами Clethrionomysglariolus. Вирус обычно попадает к человеку через вдыхание экскрементов зараженных животных (например, мочи, фекалий, слюны). Укус грызуна может также привести к инфицированию человека. На сегодняшний день не существует подтверждения для передачи болезни между людьми. В группу риска входят лица, связанные с сельскохозяйственной деятельностью, военные (полевые учения), любители походов, дачники и пр. Проживание в зонах обитания грызунов, вероятность контакта с продуктами их жизнедеятельности (например, уборка дачи после зимы), клиническая картина и лабораторные данные, включая положительный анализ крови на ГЛПС, позволяют поставить окончательный диагноз. Выполнение биопсии почек не является необходимой мерой. • ПЦР-тест; Инструментальная диагностика проводится по показаниям и включает: • УЗИ почек; Клинические особенности при геморрагической лихорадке с синдромом почечной недостаточности состоят из триады: • повышение температурной реакции; К распространенным симптомам на начальном этапе заболевания относят: • низкое артериальное давление; Инкубационный период – 12-16 дней. У детей ГЛПС чаще протекает в субклинической форме и при тяжелом течении может осложниться гиповолемическим шоком. Период с момента инфицирования до клинических проявлений – 4-42 дня. Болезнь имеет 5 прогрессирующих стадий: • инкубационная; Только 1/3 пациентов проходит через все стадии. Фебрильная стадия типична для всех пациентов и продолжается 3-7 дней. Болезнь характеризуется резким повышением температуры до 40° C. Пациенты предъявляют жалобы на головную боль, озноб, боль в животе и пояснице, недомогание, снижение остроты зрения. На фоне лихорадки появляется геморрагическая сыпь на грудной клетке, в подмышечных впадинах, шее. На слизистой мягкого неба визуализируются петехии. Субконъюнктивальное кровоизлияние отмечено у 30% пациентов. Брадикардия и пастозность лица встречаются достаточно часто. Тахикардия может указывать на предстоящий шок. С почечной недостаточностью и низким давлением сталкиваются 11% пациентов. При тяжелом течении осложнением присоединяется острый живот на фоне пареза кишечника. Повышенный уровень амилазы и липазы в сыворотке крови, в сочетании с острой болью в животе, указывает на острый панкреатит. Диагноз можно подтвердить при компьютерной томографии поджелудочной железы, которая показывает отек самого органа и окружающих тканей. У пациентов могут быть судороги или бесцельные движения. • повышенный уровень гематокрита, вызванный гемоконцентрацией; В моче временная протеинурия (как правило, разрешается в течение 2 недель) и микрогематурия. Олигурическая стадия происходит у 65% пациентов и длится около 3-6 дней. Для нее характерно острое поражение почек, характеризующееся резким снижением выработки мочи, гипертонией, склонностью к кровотечениям, вызванной уремией, отеками. На этом этапе мочевина и сывороточный креатинин крови достигают наивысшего уровня. Гипонатриемия, гиперфосфатемия и гиперкалиемия также могут возникать во время олигурической фазы. Серьезное осложнение при неадекватной терапии – отек легких. На данной стадии уровень тромбоцитов возвращается к норме. Выделение большого количества мочи обычно происходит в течение 2-3 недель. Суточный диурез составляет 3-6 литров, симптомы предыдущих стадий исчезают. На данном этапе может возникнуть обезвоживание, если инфузионная терапия недостаточна. Реконвалесценция продолжается до 3-6 месяцев. Клиническое выздоровление обычно начинается в середине второй недели с постепенным разрешением симптомов и азотемии. Важно! Концентрационная способность почечных канальцев восстанавливается в течение многих месяцев, поэтому необходимо соблюдать все рекомендации врача и сдавать анализы. Жалобы пациентов на стадии выздоровления: • слабость; Во время выздоровления постепенно восстанавливается привычная масса тела. Терапия зависит от стадии заболевания, уровня дегидратации и состояния гемодинамики. Самый важный шаг в лечении геморрагической лихорадки с почечным синдромом – поддержание гемодинамики пациента и регидратация. Во время активной стадии болезни жизненно необходимо восполнение баланса жидкости и электролитов. Показания к различным лекарствам основаны на клинике в разные стадии заболевания. При шоковом состоянии используют препараты, повышающие давление и внутривенно вводят альбумин. Чрезмерная инфузионная терапия может привести к экстравазации, состоянию, когда стенки капилляров начинают пропускать кровь. Во время олигоурической стадии показаны диуретики (Фуросемид), в случае неэффективности – проведение заместительной почечной терапии, особенно, если есть перегрузка жидкостью, гиперкалиемия и ацидоз. Если повышено артериальное давление, используют гипотензивные препараты. Антибиотики показаны только при подозрении на вторичное инфицирование. При кровотечении переливают кровь и ее компоненты и назначают антагонисты Н 2 –рецепторов. В случае диссеминированной внутрисосудистой коагуляции вводят свежую плазму или плазмозаменители. Рекомендуется питание с низким содержанием натрия и с ограничением жидкости во время олигурической фазы. В период полиурии потребление жидкости свободное. Восстановление обычно начинается с 10-11 дня. Период ранней реконвалесценции может продолжаться от нескольких суток до нескольких недель, поэтому необходим тщательный контроль электролитных нарушений и признаков обезвоживания. Фаза выздоровления длится 3-6 месяцев. Гломерулярные повреждения, как правило, проходят, и концентрационная способность почечных канальцев постепенно улучшается. Последующее наблюдение проводят еженедельно, пока состояние не нормализуется. В последующем анализы контролируют 1 раз в месяц, так как у некоторых пациентов сохраняется протеинурия и повышенное артериальное давление. У 10-12 % пациентов может развиться пиелонефрит (при присоединении бактериальной флоры), нефросклероз, поэтому наблюдение нефролога обязательно. Поведение человека может увеличить заболеваемость, поэтому основные превентивные меры включают следующее: • Правильное хранение пищи и борьба с грызунами. Разработка недорогой, безопасной, эффективной и многовалентной вакцины против этой группы вирусов могла бы стать лучшей формой профилактики в эндемичных регионах. Однако высокое генетическое и антигенное разнообразие патогенных хантавирусов в сочетании со спорадическим характером вспышек заболеваний создают серьезные проблемы для разработки эффективных профилактических вакцин. ГЛПС в редких случаях может привести к развитию следующих состояний: • забрюшинное кровотечение: ГЛПС является самоограничивающейся болезнью, и большинство пациентов восстанавливается без осложнений; однако у некоторых людей могут сохраняться симптомы неблагополучия со стороны нервной системы и почек. Нарушение реабсорбции натрия наблюдается через 12 месяцев после болезни, вызывая его повышенную экскрецию с мочой. В ряде случаев диагностируют гиперкальциурию и гиперфосфатурию. Приблизительно у 1 из 10 взрослых с терминальной стадией почечной недостаточности в крови присутствуют специфичные к хантавирусу антитела. В литературе есть данные, что панкреатит и орхит могут быть осложнениями при ГЛПС. источник |


 [1], [2], [3], [4], [5], [6], [7], [8], [9], [10], [11], [12]
[1], [2], [3], [4], [5], [6], [7], [8], [9], [10], [11], [12]