Дифтерия — острое инфекционное заболевание, вызываемое дифтерийной палочкой (Corynebacterium diphtheriae), характеризующеесяместным фибринозным поражением слизистых оболочек рото- и носоглотки (diphthera – пленка), а также тяжелой интоксикацией с поражением сердечно-сосудистой, нервной системы и надпочечников. Лабораторная диагностика дифтерии осуществляется в соответствии со схемой 14.
Схема 14.Микробиологическая диагностика дифтерии
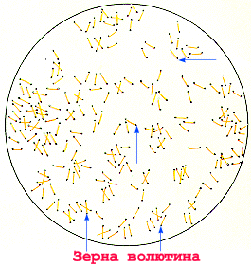
Микроскопический метод в настоящее время фактически не применяется из-за его низкой информативности в связи с субъективизмом учета и выполняется только по требованию лечащего врача. Микроскопии подвергают мазки, окрашенные по Граму, метиленовым синим, по Нейссеру (для выявления включений волютина). Дифтерийные палочки (Corynebacteriumdiphtheriae) при окраске по Нейссеру содержат полярно расположенные темно-синие, почти черные, включения волютина и располагаются в виде римских цифр V или Х, тогда как сходные с ними дифтероиды и ложнодифтерийные бактерии (Corynebacteriumpseudodiphtheriae) зерен волютина не имеют и располагаются в виде частокола. Разработан также метод прямого флюорохромирования дифтерийных палочек корифосфином, окрашивающим включения волютина в красно-коричневый цвет, а цитоплазму в зеленый или желтый цвет, что позволяет повысить эффективность бактериоскопического метода.
Бактериологический метод-основной метод диагностики дифтерии. Исследуемый материал засевают на одну из специальных питательных сред для культивирования дифтерийных палочек, наиболее часто на среду Клауберга (МПА с глицерином, дефибринированной кровью и теллуритом натрия, задерживающим рост сопутствующей непатогенной микрофлоры). На среде Клауберга Corynebacterium diphtheriae образует 2 типа колоний:
а) серовато-черного цвета с радиальной исчерченностью поверхности, напоминающие цветок маргаритки или розетку (биовар gravis);
б) черные, круглые, выпуклые колонии колонии за счет восстановления теллурита (биовар mitis).
В мазке из типичной для дифтерийной палочки колонии обнаруживают грамположительные палочки булавовидной формы, расположенные в виде римских цифр V или Х, содержащие зерна волютина (рис. 16). Оставшуюся часть колонии пересевают на кровяной МПА для выделения чистой культуры.
Рис. 16. Возбудитель дифтерии — Corynebacteriumdiphtheriae. Окраска по Нейссеру. Расположение в виде римских цифр V или Х, включения волютина по полюсам. х900
Идентификацию выделенной культуры проводят с учетом, прежде всего, ключевых свойств (токсигенность, наличие цистиназы). Токсигенность обычно определяют с помощью реакции преципитации в геле («чашечный» метод). Для этого в чашку Петри с питательной средой (МПА, 15—20 % лошадиной сыворотки, 0,3 % мальтозы, 0,03 % цистина) накладывают полоску фильтровальной бумаги, пропитанную антитоксической противодифтерийной сывороткой (5000 АЕ/мл), чашку подсушивают 30 минут в термостате, после чего засевают штрихами исследуемые культуры перпендикулярно полоске бумаги. В качестве контроля используют токсигенную культуру. Посевы инкубируют в термостате при 37 0 С в течение 18-20 часов. При наличии токсигенности в местах соединения токсина с антитоксическими антителами в питательной среде образуются белые линии преципитата, напоминающие усики. Для определения токсигенности дифтерийных бактерий также разработаны ИФА и ПЦР.
Цистиназу у выделенных культур (проба Пизу) определяют путем посева методом укола петли исследуемой культуры на цистиновый МПА с азотнокислым свинцом. Посевы помещают на сутки в термостат при 37 0 С. При наличии цистиназы в среде образуется почернение (образование сульфида свинца) по ходу укола, вокруг которого появляется коричневое облачко.
Выделенную культуру идентифицируют и дифференцируют от сходных с ней непатогенных коринебактерий по биологическим свойствам (табл. 16). Для определения уреазы петлю исследуемой культуры вносят в пробирку, содержащую спиртовый раствор мочевины и индикатор феноловый красный. Пробирку выдерживают 30 минут в термостате при 37 0 С, при наличии уреазы содержимое пробирки окрашивается в красный цвет.
При выделении нетоксигенной культуры ставят реакцию агглютинации с противодифтерийной сывороткой для выявления видового антигена Corynebacterium diphtheriae.
Серологический метод –РА, РНГА с целью определения антител в парных сыворотках крови больных дифтерией.
Таблица 16.Биологические свойства коринебактерий
| Вид | Волютин | Гемолиз | ферментация | токсин | цистиназа | уреаза | РА с ПДС | ||
| сахарозы | глюкозы | крахмала | |||||||
| C. diphtheriae биовар биовар | + + | — + | — | + + | + — | ± ± | + + | — — | + + |
| C.xerosis | ± | — | + | + | — | — | — | — | — |
| C. pseudodiphtheriae | ± | — | — | — | — | — | — | + | — |
195.133.146.119 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник
Дифтерийная палочка – возбудители дифтерии.
Дифтерия – острое инфекционное заболевание, характеризующееся токсическим поражением сердечно-сосудистой и нервной систем, а также специфическим фибринозным (дифтеритическим) воспалением в месте входных ворот.
Возбудитель был открыт в 1883 г. Клебсом, в 1884 г. Ф. Леффлер выделил его в чистой культуре. В 1888 г. Ру и Йерсен получили дифтерийный токсин, а в 1895 г. Беринг и Ру независимо друг от друга получили противодифтерийную сыворотку. В 1923 г. Рамон разработали технологию получения дифтерийного анатоксина, а позднее получил противодифтерийную сыворотку. Н.Г. Габричевский применил противодифтерийную сыворотку с лечебной целью и организовал ее производство в России.
В род Corynebacterium входят около 60 видов. Согласно Международной классификации Берджи этот род разделен на 3 секции:
1) патогенные для человека и животных;
2) патогенные для растений;
Прямые или слегка изогнутые палочки размером 0,3 — 0,6 х 4 — 8 мкм, спор не образуют, имеют микрокапсулу, неподвижны.
Особенностями дифтерийной палочки является наличие булавовидных утолщениях на концах; палочки отличаются также полиморфизмом; характерно взаимного расположения бактерий в мазках – в виде цифр V,X, L (не полное расхождение при делении);
В толстых мазках располагаются в виде «пучка булавок». Булавовидные утолщения на концах связаны с наличием зерен волютина (тельца Бабеша-Эрнста) – производные нуклеиновых кислот, метахроматиновые гранулы полиметафосфата. Бактерии могут образовывать фильтрующиеся и L-формы.
Грамположительные микроорганизмы. При окраске по методу Нейссера тело клетки окрашивается в синий цвет, а зерна волютина — в желтый. Метод Леффлера окрашивает цитоплазму в голубой цвет, а зерна волютина – в темно-синий.
Культуральные свойства.
Возбудители дифтерии — факультативные анаэробы, отимальная температура их культивирования 37 о С, рН 7,3-8,0. Требовательны к питательной среде, для роста необходимо наличие цистина, гистидина, фенилаланина, метионина и т.д. Факторами роста являются Са 2+ , Mg 2+ , Fe 2+ , Zn 2+ , Mn 2+ , Cu 2+ . Для культивирования применяют сывороточные (среда Леффлера), среды с добавлением крови, хинозальную среду Бучина. Дифференциально-диагностические среды: теллуритовая среда (Конради, Трох, 1913г.), глицериновокровяная среда с теллуритом (среда Клауберг ΙΙ), сывороточно-теллуритовый агар с цистином (Тиндаль), теллурит-шоколадный агар Маклеода.
На среде Леффлера бактерии растут в виде серовато-кремовых колоний, по типу «шагреневой кожи».
На теллуритовых средах возбудитель образует серовато-черные колонии, что обусловлено восстановлением теллурита до металлического теллура, имеющего черный цвет и аккумулирующегося бактериями.
Биохимическая активность.
Дифтерийные палочки малоактивны, сбраживают с образованием кислоты глюкозу, мальтозу, галактозу, декстрин, не разлагают сахарозу, лактозу, маннит, восстанавливают нитраты в нитриты. Не гидролизуют мочевину (проба Закса отрицательная), не образуют индол. Разлагают цистеин (проба Пизу положительная).
По культуральным, биохимическим, патогенетическим и некоторым другим свойствам дифтерийные палочки разделяются на 3 биовара.
1) биовар митис, характеризуется свойствами:
- ферментирует глюкозу, крахмал, мальтозу, не сбраживает сахарозу, гликоген, декстрин;
- обладает цистиназной активностью;
- восстанавливает нитраты;
- уреазная проба отрицательная;
- на средах с теллуритом образует мелкие гладкие блестящие черные колонии с ровным краем;
- на жидкой среде дает равномерное помутнение и порошкообразный осадок;
- дает зоны гемолиза на кровяных средах;
- малотоксичен;
- возбудители вызывают легкую спорадическую заболеваемость.
2) биовар гравис, характеризуется свойствами:
- ферментирует глюкозу, крахмал,декстрин, мальтозу,
- обладает цистиназной активностью;
- восстанавливает нитраты;
- уреазная проба отрицательная;
- на средах с теллуритом формирует крупные, сухие, матовые, плоские, серо-черные колонии, приподнятые в центре, с радиальной исчерченностью и неровным краем (напоминают маргаритку);
- на жидкой среде образуется пленка, помутнение, крошковидный или крупнозернистый осадок;
- дает гемолиз на кровяных средах;
· обладает выраженными токсигенными свойствами;
· выделяется от больных с тяжелой формой дифтерии, вызывает групповые вспышки.
3) биовар интермедиус, характеризуется свойствами:
· на средах с теллуритом образует мелкие сухие матовые серо-черные колонии с прозрачной периферией и неровным краем;
· на жидкой среде дает помутнение с последующим просветлением и образованием мелкозернистого осадка;
· гемолиз на кровяных средах отсутствует.
Антигенная структура.
Дифтерийная палочка имеет 2 антигена
1. О – антиген (групповой), полисахарид клеточной стенки, термостабильный, дает перекрестные реакции с микобактериями и нокардиями;
2. К – антиген (типовой), капсульный, термолабильный, иммуногенный, видоспецифичный.
На практике серотипирование не применяется, однако выпускаются диагностические сыворотки для РА, РПГА.
Для идентификации используют фаготипирование (22 фага) и бактериоцинотипирование (25 бактериоцинов).
Факторы патогенности.
Токсины. Палочка выделяет токсин – дифтерийный экзотоксин. По силе он занимает 3-е место после ботулинического и столбнячного. Термолабильный, высокотоксичный, иммуногенный, протективный, обладает анестезирующим действием. Гистотоксин обладает дермонекротическими, гемолитическими свойствами. Синтезируется в виде неактивного предшественника — единой полипептидной цепи с молекулярной массой 61 кД. Активируется под действием собственной протеазы, которая разрезает полипептид на 2 связанные между собой дисульфидными связями пептида: А (21 кД) и В (39 кД). Пептид В выполняет акцепторную функцию – распознает рецептор, связывается с ним, формирует внутримембранный канал, через который проникает в клетку пептид А. Пептид А – это фермент, который обеспечивает перенос аденозиндифосфатрибозы из НАД на один из аминокислотных остатков (гистидина) белкового фактора элонгации EF-2. В результате модификации EF-2 утрачивает свою активность, что приводит к подавлению синтеза белка рибосомами на стадии транслокации. Токсин синтезируют только С. diphtheriae, лизогенные умеренным конвертирующим tox-профагом, интегрирующимся с помощью сайт-специфической рекомбинации. Оперон, кодирующий синтез токсина имеет промотор tox Р и 3 участка: tox S, tox А, tox В. Тox S – обеспечивает выход токсина через мембрану в периплазматическое пространство бактериальной клетки. Утрата клеткой профага или мутации в tox-опероне делают клетку малотоксичной.
Ферменты патогенности: гиалуронидаза, нейраминидаза, фибринолизин, каталаза – факторы инвазии, лейкоцидин – обеспечивает устойчивость к фагоцитозу;
Структурные и химические компоненты клетки – пили (способствуют адгезии на чувствительных клетках), микрокапсула (обеспечивает устойчивость к фагоцитозу), корд-фактор (6-6-дифосфоэфир трегалозы, коринемиколовая и коринемиколиновая кислоты, обладающие нарушает фосфорилирование в митохондриях), бактериоцины (корицины) кодирование синтеза которых передается плазмидами.
Резистентность.
При нагревании до 60 о С палочки погибают за 10 мин, при 100 о С наступает мгновенная гибель. 5% раствор карболовой кислоты обеспечивает инактивацию через – 1 мин. Под действием прямого солнечного света палочка выживает несколько часов, в высохших пленках и кале – 3-4 мес., на предметах обихода и одежде сохраняется до 15 дней, на мягких игрушках – 3 мес., в воде и молоке – до 20 дней, в пыли – до 5 мес. Дифтерийные палочки чувствительны к пенициллину, тетрациклину, эритромицину.
Эпидемиология.
Источник инфекции – больной человек, носитель или реконвалесцент.
Механизмы передачи инфекции:
– аэрогенный (пути — воздушно-капельный и воздушно-пылевой);
– контактный (путь — непрямой контактный).
Больной опасен (в смысле заражения) с последних дней инкубационного периода.
Входные ворота – слизистые оболочки носа, зева, гортани, трахеи, бронхов, конъюнктивы глаз, наружных половых органов; раневая поверхность, пупочная рана.
Инкубационный период – 2-14-20 дней.
Возбудители адсорбируются на чувствительных клетках, колонизируют эпителий. Секретируют гистотоксин, который инициирует развитие местного фибринозного воспаления, некроз эпителия, паретическое расширение сосудов с нарушением их проницаемости, отек тканей и выход фибриногена из сосудов. Фибриноген под влиянием тканевого тромбопластина, некротизированных тканей и атмосферным кислородом свертывается. На поверхности образуется фибринозная пленка. На многослойном плоском эпителии — плотная, спаянная с прилежащими тканями; на однослойном – тонкая, легко снимается. Разрастание пленок в воздухоносных путях может привести к асфиксии (истинный круп). Процесс сопровождают регионарные лимфадениты. Системное действие токсина приводит к гемодинамическим нарушениям. Развивается токсический миокардит и ранний паралич сердца. Возможно поражение канальцевого аппарата почек, некроз коркового слоя. В нервной системе – цитолиз нервных клеток с развитием поздних параличей мягкого неба, диафрагмы, сердца, блуждающего нерва. Смерть при дифтерии может наступить от раннего или позднего паралича сердца и диафрагмы, а также в результате истинного крупа (закупорки дыхательных путей оторвавшимися пленками).
У детей грудного возраста чаще развивается дифтерия зева (насмокр, слабая выраженность общих проявлений). Необходимо осматривать пупочную ранку для исключения местного процесса.
После перенесенного заболевания развивается стойкий напряженный антитоксический и мало выраженный антимикробный иммунитет. Возможно развитие носительства (10%) и повторное заражение (6-8%). Уровень иммунитета можно установить в РПГА. Диагностические – титры — 1:200 и выше. С той же целью применяется реакция Шика – внутрикожное введение микродоз дифтерийного токсина (1/40 Dlm 0,2 мл) внутрикожно. Через 48 ч появляется покраснение и инфильтрат, что свидетельствует об отсутствии антитоксических антител; при их наличии реакция не возникает. Из-за опасности сенсибилизации организма эту пробу проводят редко.
Микробиологическая диагностика.
Исследуемый материал – слизь из зева, носа, пленки с миндалин, раневое отделяемое, кровь
1. Бактериоскопический метод – микроскопия мазков из исследуемого материала (окраска по Граму, Нейссеру, Леффлеру).
2. Бактериологический метод – выделение чистой культуры возбудителя и ее идентификация. Необходимо не только выделить из исследуемого материала дифтерийную палочку, но и определить ее токсигенность.
Определение токсигенности С. dphtheriae:
а) биологическая проба на животных – внутрикожное заражение морских свинок фильтратом культуры дифтерийных бактерий – вызывает некроз в месте введения. Минимальная смертельная доза (20-30 нг) убивает морскую свинку на 4-5 день;
б) заражение куриных эмбрионов (наблюдается гибель под действием токсина);
в) внесение в культуру клеток ( выявление ЦПД);
г) метод твердофазного ИФА с меченными пероксидазой антителами;
д) использование ДНК-зонда для обнаружения tox-оперона в геноме;
е) тест Илека и Оухтерлони (1948 г.) – основу составляет способность токсина и антитоксина диффундировать в агар и образовывать преципитаты (усы, стрелы) по ходу диффузии – метод двойной преципитации в геле, предварительный ответ может быть выдан через 48 часов, через 72 часа – заключение о наличии токсигенных коринебактерий, через 96 часов – окончательный ответ.
3. Серодиагностика – РПГА, ИФА, РИА, реакция ко-агглютинации, реакция Шика.
4. Экспресс – диагностика – РИФ, ИФА, РПГА, реакция ко-агглютинации.
5. Биохимический и молекулярно-биологический метод – ПЦР (обнаружение tox-гена).
источник
Диагностика дифтерии основана на клинических данных с последующим подтверждением диагноза бактериологическим исследованием. Лабораторная диагностика дифтерии включает в себя ряд исследований, основным из которых является микробиологическое.
- Зачастую для постановки диагноза бывает достаточно тщательно собранного анамнеза заболевания и осмотра ротоглотки. Всякая задержка при установлении диагноза и назначения адекватного лечения увеличивает вероятность неблагоприятного исхода заболевания.
- Выделение культуры возбудителей с последующим определением у выделенных возбудителей токсикогенности является основным и единственным методом микробиологической диагностики дифтерии. Предварительный результат получается через 24 часа, через 48 часов получается результат исследования дифтерийных палочек на токсикогенность, через 72 часа определяется биовар возбудителя.
- Микроскопическое исследование при дифтерии нерационально.
- Серологическая диагностика основана на определении роста титра антибактериальных антител. Результаты получаются на 2-й неделе заболевания.
- При диагностике дифтерии применяется генетический метод (ПЦР), позволяющий определить ДНК бактерий.
- Реакция латекс агглютинации относится к экспресс-методам. Результат получается уже через два часа.
- Иммунофлуоресцентный анализ результативен. Однако его проведение должно осуществляться только высококвалифицированным персоналом.
Рис. 1. Пленка грязно-белого цвета и выраженный отек подкожной жировой клетчатки шеи — «бычья шея» — классические признаки дифтерии.
Микробиологическое исследование является основным методом лабораторной диагностики дифтерии.
Бактериологическое исследование проводится в следующих случаях:
- с целью диагностики дифтерии зева, носа и глотки у взрослых и детей,
- с целью выявления возможного бактерионосительства у лиц, которые поступают в детские дошкольные учреждения и специализированные учреждения для взрослых,
- с целью выявления заболевания среди контактирующих лиц.
Материал для исследования (мазок на дифтерию) собирается натощак или спустя 2 часа после еды. Для исследования используются дифтерийные пленки или кусочки тканей, расположенных по соседству, отделяемое из мест поражения и носоглоточная слизь.
Забор материала (мазок на дифтерию) осуществляется ватным тампоном. Корень языка прижимается шпателем. Ватным тампоном необходимо коснуться слизистой оболочки миндалин на границе пленки, дужек и задней стенки глотки. Далее тампон опускается в стерильную пробирку, не касаясь ее стенок.
В течение первых 3-х часов должен быть отправлен в лабораторию. При невозможности произвести посев в ближайшие 3 — 4 часа, забор материала осуществляется стерильным ватным тампоном, который смачивают в 5% растворе глицерина в изотоническом растворе хлорида натрия или 2% растворе теллурита калия.
Забор материала (мазок на дифтерию) осуществляется двумя ватными тампонами, один из которых используется для посева, другой — для микроскопии.
При подозрении на дифтерию необходимо оповестить сотрудников лаборатории, чтобы собранный материал был посеян на соответствующие среды (кровяной агар, среда Леффлера или теллуритовая среда).
Посев осуществляется на питательные среды (кровяной агар, среда Леффлера или теллуритовая среда). Теллурит в большой концентрации подавляет рост сопутствующей микрофлоры.
Рис. 2. На фото рост колоний палочки дифтерии на разных средах — кровяном агаре и теллуритовой среде.
При росте бактерий на кровяном агаре колонии приобретают беловатую окраску, они непрозрачные, округлые, выпуклой формы, 1 — 2 мм в диаметре, чаще маслянистой консистенции.
При росте бактерий на теллуритовых средах колонии серого цвета, выпуклые, края ровные. Через двое суток колонии приобретают темно-серый или черный цвет, они имеют металлический блеск, ровные или фестончатые края, поверхность гладкая или радиально исчерчена.
Идентификации разновидностей штаммов возбудителей дифтерии основана на способности бактерий расщеплять гликоген и крахмал. Для этих целей используется методика «длинного» ряда углеводов.
Принимая во внимание ферментативные признаки возбудителей и структуру колоний при росте на теллуритовых средах, выделяют 4 биотипа коринебактерий дифтерии: Corynebacterium diphtheriae gravis, Corynebacterium diphtheriae mittis, Corynebacterium diphtheriae intermedius и Corynebacterium diphtheriae belfanti.
Рис. 3. На фото слева колонии коринебактерий дифтерии гравис (Corynebacterium diphtheriae gravis). Они имеют большой размер, выпуклые по центру, радиально исчерчены, с неровными краями. На фото справа Corynebacterium diphtheriae mittis. Они небольшого размера, темной окраски, гладкие и блестящие, с ровными краями.
Токсикогенность возбудителей дифтерии определяется после выделения культуры бактерий. Для этих целей используется методика диффузной преципитации в геле и методика определения токсикогенности бактерий в живом организме (на морских свинках).
Лабораторная диагностика с применением микроскопии является второстепенным по значимости. Ввиду того, что возбудители дифтерии плохо впитывают красители, окраска по Граму считается не специфичной, однако она позволяет косвенно определить непатогенные коринебактерии, которые в мазке располагаются параллельно друг другу.
При окраске по Нейссеру выявляются характерные для дифтерийных палочек зерна Бабеша-Эрнста, которые располагаются на полюсах клеток, придавая им вид булавы.
В мазках патогенные дифтерийные палочки располагаются под углом друг к другу.
Для выявления зерен Бабеша-Эрнста применяется методика люминесцентной микроскопии. При окрашивании мазков корифосфином в микроскопе можно увидеть желто-зеленые тела бактериальных клеток с оранжево красными зернами волютина.
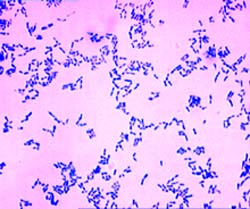
Рис. 4. Дифтерийные палочки под микроскопом. Окраска по Граму.
Рис. 5. На фото слева ложнодифтерийные палочки Гоффмана. Они часто обнаруживаются в носоглотке. Они толстые, короткие, располагаются в мазках параллельно друг другу. На фото справа патогенные бактерии. В мазке располагаются под углом друг к другу.
Серологические исследования позволяют обнаружить антибактериальные и антитоксические антитела. Значимым является обнаружение антибактериальных антител, так как содержание антитоксина изменяется в связи с применением с первых дней антитоксической сыворотки. Наиболее распространенными в настоящее время является реакция пассивной гемагглютинации (РНГА и РПГА).
Иммуноглобулины G и M говорят об остроте инфекционного процесса.
Иммуноглобулины G говорят о недавно перенесенном заболевании.
Иммуноглобулины М говорят об остропротекающей дифтерии.
При дифтерии титр антител со временем повышается. Понижение концентрации антител свидетельствует о выздоровлении больного.
Противодифтерийные антитела образуются после вакцинации. В крови привитого человека они циркулируют многие годы.
Благодаря применению методики флуоресцирующих антител стало возможным проведение качественного и количественного анализа внутриклеточных и поверхностных антигенов в образцах клеточных суспензий. Антигены визуализируются с помощью специфических антител с флуоресцентными маркерами. Использование данной методики доверяется только высококвалифицированному персоналу.
Методика ПЦР применяется для раннего выявления дифтерийных палочек, подтверждения диагноза и в случаях атипичной ангины. Обнаружение гена токсикогенности методом ПЦР является наиболее быстрым и надежным методом лабораторной диагностики дифтерии.
Рис. 6. ПЦР является наиболее быстрым и надежным методом лабораторной диагностики дифтерии.
- При токсическом поражении сердечной мышцы отмечаются изменения на электрокардиограмме, фонокардиограмме и УЗИ сердца. Исследуется активность целого ряда ферментов (лактатдегодрогиназа, креатинфосфокиназа, аспартатаминотрансфераза).
- Поражение почек при дифтерии проявляется в виде токсического нефроза. При подозрении на это осложнение производится общий анализ крови и мочи, биохимические исследования (определение креатинина, мочевины, остаточного азота), производится УЗИ почек.
- Токсическое поражение печени протекает с явлениями гипогликемии (снижение уровня глюкозы в крови) и глюкозурии (наличие глюкозы в моче).
- Развитие анемии связано с гемолизом эритроцитов.
к содержанию ↑
Наличие или отсутствие противодифтерийного иммунитета устанавливается при помощи внутрикожной пробы Шика, которая проводится с дифтерийным токсином.
В случае отрицательной реакции говорят о невосприимчивости к дифтерии. Реакцию Шика сегодня используют только по эпидпоказаниям. На ее проведение уходит несколько дней. Однако несмотря на это она помогает определить степень восприимчивости к дифтерии лиц, находившихся в контакте с больным и уточнить их иммунный статус.
Рис. 7. Реакция Шика проводится с дифтерийным токсином. Стандартный дифтерийный токсин в дозе 0,2 мл вводится внутрикожно в среднюю треть предплечья туберкулиновым шприцом.
источник
Материалом для исследования при дифтерии могут быть пленки и слизь из зева и носа, а при редких локализациях дифтеритических воспалений — из глаза, уха, с поверхности раны и кожи. Отделяемое забирают сухим ватным тампоном или смоченным 5% раствором глицерина в физиологическом растворе с рН-8.
До этого уровня его доводят 20% раствором однозамещенного фосфорно-кислого натрия (Na2HPO4).
Исследование осуществляют не позднее 3-4 часов после забора, с поэтапной выдачей ответов о подтверждении диагноза.
Морфологические и тинкториальные признаки дифтерийных бактерий настолько своеобразны, что микроскопический метод может примениться как самостоятельный или предварительный к бактериологическому анализу. Кроме того, он дает представление и о сопутствующей микрофлоре.
Для выявления дифтерийных палочек могут быть использованы три метода окраски: Грама, Леффлера, Нейccера.
МЕТОД ГPAМA позволяет выявить способность дифтерийных бактерий вступить во взаимодействие с генцианвиолетом. Дифтерийные бактерии грампозитивиы, но это свойство непостоянно. При контакте с антибиотиками, при длительном пребывании в голодной среде резко изменяется обмен веществ и грамположительность микробов теряется. Поэтому ориентироваться на этот признак нельзя.
МЕТОД НЕЙССЕРА — наиболее ценный дифференциально-диагностический способ, позволяющий не только окрасить микроорганизмы, но и выявить полярно вкрапленные зерна волютина и характерное расположение бактериальных особей под углом.
РЕАКТИВЫ
- УКСУСНОКИСЛАЯ СИНЬКА НЕЙСЕРА: метиленовая синька -0,1 г, спирт 96° -2 мл; 5% раствор ледяной уксусной кислоты в дистиллированной воде — 50 мл.
- РАСТВОР ЛЮГОЛЯ: 2 г йодистого калия растворить в 10 г дистиллированной воды. Затем к этому раствору прибавить; 1 г кристаллического йода и добавить воды до 300 мл.
- РАСТВОР ХРИЗОИДИНА: 2 г хризоидина на 300 мл горячей дистиллированной воды.
Вместо раствора хризоидина можно использовать раствор везувина (краситель бисмаркбраун): везувин-1 г; 96° cпирт-10 мл; кипящая дистиллированная вода-100 мл.
ТЕХНИКА ОКРАСКИ
- Синька Нейссора- 1 минута
- Раствор Люголя — 30 секунд.
- Ополаскивание дистиллированной водой.
- Докраска расвором хризоидина или везувина — 10-15 секунд.
Тело микробной клетки окрашивается в желтый или желто-коричневый цвет, зерна волютина — коричнево-черного цвета.
ОКРАСКА ПО СПОСОБУ ЛЕФФЛЕРА
Метод Леффлера прост, но по своим дифференциально-диагностическим возможностям он не уступает сложному способу Нейссера. Поэтому он применяется значительно чаще.
Для окраски нужен один реактив — щелочная метиленовая синька Леффлера следующего состава: Дистиллированная вода — 99 мл; 1% раствор едкого калия (КОН) — 1 мл; профильтрованный спиртовой раствор метиленовой синьки (0,5 г синьки на 30 мл спирта) — 30 мл.
Окраска осуществляется 1-2 минуты. При этом тело бактерий приобретает бледно-голубой цвет, зерна волютина — синий или cине-черный.
При выполнении микроскопического исследования важно отличить истинные дифтерийные бактерии от дифтериеподобных палочек Гоффмана и бактерий ксерозис.
| Микроскопическая дифференциация дифтерийных бактерий и дифтероидов | ||
| Бактерии | Взаимное расположение особей в препарате | Наличие и количество зерен волютина |
| Дифтерии | Под углом в виде римской цифры V или кисти рук с разведенными пальцами | 2 зерна с полярной локализацией |
| Бактерии Гоффмана | Параллельное, в виде часткола | Зерен нет или единичные без типичной локализации |
| Бактерии Keepоза | Хаотичное | Зерен много, распределение беспорядочное |
II. БАКТЕРИОЛОГИЧЕСКИЙ МЕТОД
Дифтерийные бактерии требовательны к питательным средам. Для их выделения и накопления используется комплекс специальных элективных и дифференциально-диагностических сред.
СВЕРНУТАЯ СЫВОРОТКА РУ: 3 мл стерилыной сыворотки лошади (быка или человека) вносят в пробирку, укладывают с наклоном в 45-50° в свертывателе Коха, предварительно нагретом до +50 °C. Затем температуру доводят до 80° и прогревают в течение 1 часа. Готовую среду охлаждают, ставят в термостат для проверки стерильности. В случае прорастания среды последнюю повторно прогревают при + 80 °C в течение 2 часов.
На этой среде бактерии дают шероховатые R-формы, напоминающие в комплексе шагреневую кожу.
ТЕЛЛУРИТОВЫЕ ДИФФЕРЕНЦИАЛЬНЫЕ СРЕДЫ
Дифтерийные бактерии обладают выраженной способностью восстанавливать теллуровокислый калий до металлического теллурита. Для выявления этой способности в среды добавляется дифференцирующий компонент-2% раствор теллурита калия следующего состава: дистиллированная вода-100 мл; теллурит калия (K2FeO4)-2 г. Раствор стерилизуют кипячением 30 минут. Для приготовления сред можно использовать также готовый 2% раствор теллурита калия в 40% глицерине, выпускаемый в ампулах для клинических теллуритовых проб.
СЫВОРОТОЧНО-ТЕЛЛУРИТОВЫИ АГАР: к 80 мл расплавленного и охлажденного до +50 °C 2% МПА добавляют 20 мл лошадиной или 30 мл бычьей сыворотки и 1 мл 2% раствора теллурита калия. Готовую среду разливают в стерильные чашки.
КРОВЯНО-ТЕЛЛУРИТОВЫЙ АГАР: к 100 мл расплавленного и охлажденного до +50 °C 2-3% МПА добавляют 5-10% дефибринированной крови человека (донорской, плацентарной) или животного (крупного рогатого окота, кролика, барана, морской свинки) и 1 мл 2% теллурита калия, смешивают и разливают в чашки.
СРЕДА КЛАУБЕРГА: 100 мл 3% МПА расплавляют, добавляют 3 мл 2% теллурита калия, 10 мл глицериновой смеси и 50 мл лаковой крови. Последнюю готовят следующим образом: к 34 мл дистиллированной стерильной воды добавляют 16 мл дефибринированной крови (любой). Состав глицериновой смеси: к 40 мл дефибринироваиной крови крупного рогатого скота или человека добавляют 20 мл химически чистого стерильного глицерина и выдерживают до употребления в холодильнике 3-6 недель.
По характеру роста на теллуритовых средах удается отдифференцировать дифтерийные бактерии как внутри вида, так и от других микроорганизмов.
| Дифференциация дифтерийных палочек от других микробов на теллуритовых и хинозольной средах | ||
| Бактерии | Характер роста на средах | |
| теллуритовых | хинозольной | |
| Дифтерийные бактерии | серые, розеткообразные | синие |
| тип гравис | с радиальностью | |
| тип митис | черные, матовые, гладкие | |
| тип интермедиус | серо-черные, гладкие | |
| Ложнодифтерийные бактерии Гофмана | серые, блестящие, выпуклые, конусовидные | голубоватые |
| Дифтериоиды Ксероза | серо-черные, как истинные дифтерийные | бесцветные |
| Стафилококки | черные, влажные, блестящие | — |
ХИНОЗОЛЬНУЮ СРЕДУ БУЧИНА готовят по следующей прописи: на 100 мл воды добавляют 3 г хлористого натрия, 1,5 г, глюкозы, 1 мл 3% раствора цистина в 1% растворе соды, 2 мл водного раствора хинозола (1:1000), 0,08 г индикатора водноголубого, 4,0 сухого питательного агара. Смесь растворяют при нагревании. Устанавливают pH = 7,4-7,6. Охлаждают до +50 °C, добавляют 5 мл дефибринированной крови и, соблюдая стерильность, разливают в чашки Петри.
СРЕДА ТИНСДАЛЯ-САДЫКОВОЙ является селективной средой для дифтерийных бактерий. Посторонняя микрофлора на ней не растет или развивается очень скудно. Другим преимуществом среды является то, что она не нуждается в добавлении крови. Ее состав следующий: 100 мл мартеновского или обычного мясопептонного агара, 15-20 мл нормальной лошадиной сыворотки, 12 мл 1% раствора цистина (сначала растворить в 0,1 N р-ре NaOH, потом в воде), 11-12 мл 0,1N HCl (для нейтрализации NaOH); 1,8 мл 2% раствора теллуристого калия и 1,8 мл 2,5% раствора гипосульфита натрия.
Дифтерийные бактерии обладают рядом характерных биохимических признаков. Они хорошо ферментируют глюкозу и крахмал, высвобождают значительные количества активной цистиназы, выявляемой в пробе Пизу. Вместе с тем, названные микроорганизмы инертны в отношении сахарозы и не имеют фермента уреазы, обнаруживая отрицательную пробу Закса. Очень важным видовым признаком этих микробов является токсигенность. С эпидемиологической точки зрения, весьма существенное значение имеет серологическая неоднородность дифтерийных бактерий и наиболее широкое участие в распространении инфекции I и VI серологических типов. Это необходимо учитывать при диагностике дифтерии.
ОПРЕДЕЛЕНИЕ УГЛЕВОДОЛИТИЧЕСКОИ АКТИВНОСТИ дифтерийных бактерий производится на комплексе углеводных сред, состоящих из 1% пептонной воды с pH-7,6, в которую добавляют различные углеводы: 0,5% сахарозы, 0,5% глюкозы, 0,2% крахмала. В качестве индикатора используется реактив Андреде (кислый фуксин, обесцвеченный щелочью).
Среды разливают по 2 мл и стерилизуют текучим паром 3 дня подряд :по 30 минут. До работы они бесцветны, при ферментации углеводов — краснеют.
На углеводных сывороточно-водных средах, основа которых состоит из дистиллированной воды (80 мл) и сыворотки (20 мл), углеводолитические свойства культур проявляются плохо и ферментация углеводов идет очень медленно.
ОПРЕДЕЛЕНИЕ ПРОТЕОЛИТИЧЕСКИХ СВОЙСТВ
ПРОБА ПИЗУ — ОПРЕДЕЛЕНИЕ ФЕРМЕНТА ЦИСТИНАЗЫ
К 90 мл расплавленного 2% МПА с pH -7,6 добавляют 2 мл раствора цистина (1% раствор цистина в 0,1N растворе NaOH). Среду стерилизуют при +112 °C 30 минут. K расплавленной и охлажденной до +50 °C среде добавляют 1 мл 10% уксуснокислого свинца (простерилизованного дважды текучим паром) перемешивают и добавляют 9 мл нормальной лошадиной сыворотки. Среду стерильно разливают в маленькие пробирки по 2 мл. Посев производится уколом.
Вместо МПА с цистином можно использовать 2% МПА, приготовленный на переваре Хоттингера, с содержанием аминного азота в 250 мг%.
Дифтерийные бактерии активно перерабатывают белки и цистин с высвобождением сероводорода, который, соединяясь с уксусным свинцом, переходит в сернистый свинец коричнево-черного цвета. Дифтероиды подобных изменений не дают.
ПРОБА ЗАКСА — ОПРЕДЕЛЕНИЕ ФЕРМЕНТА УРЕAЗЫ
Проба Закса служит для отличия дифтериеподобных бактерий, обладающих уреазной активностью, от истинных дифтерийных палочек, не имеющих этого фермента.
- 1. ВАРИАНТ СРЕДЫ: к 100 мл МПБ или Хоттингеровского бульона добавляют 1 г мочевины и 0,2 мл 1,6% спиртового раствора крезолрот, разливают по 2-3 млв пробирки и стерилизуют текучим паром 10 минут. Результаты учитывают через 20-24 часа после посева. Покраснение среды свидетельствует о наличии уреазы.
- 2. ВАРИАНТ СРЕДЫ: готовят два реактива: А и В.
Реактив А: мочевина — 1 г, спирт 96°- 2 мл, дистиллированная вода — 4 мл.
Реактив В: 0,2% раствор фенолрота-1 мл, однозамещенный фосфат калия (КН2Р04)-0,1 г, двузамещенный фосфат калия (К2НРО4)-0,1 г, хлористый натрий — 0,5 г, дистиллированная вода — 100 мл.
Реактив А стерилизуют фильтрованием и хранят при + 4 °C, реактив В — в автоклаве текучим паром.
Перед работой оба реактива смешивают ex tempore из расчета 1 часть раствора А и 19 частей раствора В, смесь разливают по 0,1 мл в узкие пробирки. Испытуемые культуры вносят в количестве 2-6 капель, помещают в термостат на 30 минут. При положительной реакции смесь краснеет.
Дифференциация дифтерийных бактерий и дифтероидов по биохимическим признакам приведена ниже.
В отдельных случаях после определения биохимических свойств дифтерийных бактерий выясняется серотип штамма. Для этой цели используется ориентировочная агглютинация. Последнюю проводят на стекле с чистыми культурами, которые смывают со среды 1 мл солевого раствора и осторожно набирают стерильной пастеровской пипеткой. Агглютинирующие монотииовые сыворотки (I, II, III, IV, VI серотипы) разводят 1:25 солевым раствором с pH-7,6 (к 100 мл дистиллированной воды прибавляют 3,0 NaOH и устанавливают pH-7,6, доливая 5% раствор Na2HPO4). Для контроля испытуемой культуры ставят реакцию с выше указанным солевым раствором без сыворотки.
Положительная реакция характеризуется быстрым появлением хлопьев агглютината (2-3 минуты), особенно заметных при учете реакции над вотеутым зеркалом.
Неиспользованную сыворотку запаивают в ампулу или переливают в стерильную пробирку.
Агглютинирующие сыворотки хранятся в сухом месте при температуре от +4° до +10 °C.
При использовании высушенных сывороток последние перед употреблением растворяют в стерильной дистиллированной воде (1 мл на ампулу). Срок годности сухой сыворотки не ограничен.
УСКОРЕННЫЕ МЕТОДЫ ДИАГНОСТИКИ
ТЕЛЛУРНТОВАЯ ПРОБА — КЛИНИЧЕСКАЯ
Тампоном, смоченным 2% раствором теллуровокислого калия в 40% глицерине (выпускается в ампулах), смазывают пораженные миндалины и слизистую. При наличии дифтерийных бактерий тампон чернеет сразу или после 2-4-часовой инкубации в термостате.
ОПРЕДЕЛЕНИЕ ТОКСИГЕННОСТИ ДИФТЕРИЙНЫХ БАКТЕРИИ
Определение токсигенности дифтерийных бактерий осуществляется биологическим (в специализированных лабораториях) и диффузионным (на плотных средах) методами.
Рекомендуемая литература:
- Профилактика дифтерии. Методические материалы для практических работников. М., 1961, стр. 37.
- Сборник официальных материалов по лабораторному делу. Книга первая. Медгиз, 1961, стр. 331-337.
- Сборник схем бактериологического исследования при некоторых инфекционных заболеваниях. Методическое пособие для врачей-курсантов заочников, под ред. проф. П. Н. Кашкина, Л., 1965, стр. 17-20.
- Дяченко С. С. Микробиологические методы диагностики инфекционных заболеваний. Киев, 1962, стр. 224,
- Пяткин К. Д., Трофимова Н. Д., Маркова Н. С. Руководство к практическим занятиям по медицинской микробиологии, 1962, стр. 219.
- Руководство по микробиологии, клинике и эпидемиологии инфекционных заболеваний, 1964, т. VI, стр. 375.
- Руководство по микробиологической диагностике инфекционных болезней под ред. Матвеева К. И. и Соколова М. И. 1964, стр. 422-430.
Источник: Мотавкина Н.С., Пьянова Р.Е. Микробиологическая диагностика некоторых капельных инфекций и токсоплазмоза. Методическая разработка для студентов. ВГМУ, 1973
источник
C. diphtheriae — палочковидные бактерии; вызывают дифтерию (греч. diphtheria — кожа, пленка) — острую инфекцию, характеризующуюся фибринозным воспалением в зеве, гортани, реже в других органах, и явлениями интоксикации.
Морфологические и культуральные свойства.
Corinebacterium diphteriae – тонкие, слегка изогнутые или прямые грамположительные палочки, расположенные под углом друг к другу в виде римских пятерок. Они утолщены на концах за счет наличия зерен валютина на одном или обоих полюсах клетки. Зерна валютина состоят из полифосфатов, они воспринимают анилиновые красители более интенсивно, чем цитоплазма клетки и легко выявляются при окраске по Нейссеру в виде гранул сине-черного цвета, тогда как тела бактерий – окрашивается в желто-зеленый. При окраске по Граму зерна валютина не выявляются.
Рисунок мазка из чистой культуры. Окраска по Нейссеру Мазок из чистой культуры.
Окраска щелочной синькой Леффлера
Дифтерийная палочка не обладает кислотоустойчивостью, неподвижна, спор не образует, имеет микрокапсулу с входящим в ее состав корд-фактором. В состав клеточной стенки входят галактоза, манноза, арабиноза, а также большое количество липидов, в том числе некислотоустойчивые миколовые кислоты.
Возбудитель дифтерии – факультативный анаэроб, гетеротроф, растет при 37 о С на сложных питательных средах: свернутая кровяная сыворотка, кровяной теллуритовый агар.
На элективных средах через 8-14 часов образует точечные, выпуклые желтовато-кремовые колонии с гладкой или слегка зернистой поверхностью. Колонии не сливаются и имеют вид шагреневой кожи.
На теллуритовых средах возбудитель дифтерии через 24-48 час образует черные или черно-серые колонии в результате восстановления теллурита до металлического теллура.
Возбудитель дифтерии обладает высокой ферментативной активностью. Дифференциально-диагностическими признаками C. diphteriae являются:
отсутствие способности ферментировать сахарозу и разлагать мочевину,
способность продуцировать фермент цистиназу.
Возбудитель дифтерии не однороден по культуральным и биохимическим свойствам. В соответствии с рекомендациями Европейского регионального бюро ВОЗ вид C. diphteriae подразделяют на 4 биовара: gravis, mitis, intermedius, belfanti.
На теллуритовой среде биовар gravis образует сухие, матовые, крупные, плоские, серовато-черные колонии, приподнятые в центре. Периферия колонии светлая с радиальной исчерченностью и неровным краем. Такие колонии напоминают цветок маргаритку. Биовар mitis образует мелкие, гладкие, блестящие, черные, выпуклые колонии с ровным краем, окруженные зоной гемолиза. Биовары intermedius и belfanti фактически относятся к биовару mitis, так как не разлагают крахмал, а этот признак у C. diphteriae является наиболее стабильным.
Антигенная структура. C. diphteriae имеют О-антиген (липидные и полисахаридные фракции, расположенные в глубине клеточной стенки) и К-антиген (поверхностный термолабильный белок). О-антиген является межвидовым. На основании К-антигена различают около 58 сероваров.
Факторы патогенности. Основными факторами патогенности C. diphteriae являются поверхностные структуры, ферменты и токсины.
Поверхностные структуры (пили, компоненты микрокапсулы: корд-фактор, К-антиген, миколовые кислоты) имеют белковую и липидную природу, способствуют адгезии микробов в месте входных ворот, препятствуют фагоцитозу бактерий, оказывают токсическое воздействие на клетки макроорганизма, разрушают митохондрии.
Ферменты патогенности: нейраминидаза, гиалуронидаза, гемолизин, дермонекротоксин. Нейраминидаза отщепляет N-ацетилнейраминовую кислоту от гликопротеидов слизи и поверхности клеток, лиаза расщепляет ее на пируват и N-ацетилманнозамин, а пируват стимулирует рост бактерий. В результате действия гиалуронидазы повышается проницаемость кровеносных сосудов и выход плазмы за их пределы, что ведет к отеку окружающих тканей. Дермонекротоксин вызывает некроз клеток в месте локализации возбудителя. Вышедший за пределы сосудов фибриноген плазмы контактирует с тромбокиназой некротизированных клеток организма и превращается в фибрин, что и является сущностью дифтерийного воспаления. Внутри дифтерийной пленки C. diphteriae находят защиту от эффекторов иммунной системы и антибиотиков, размножаясь, они образуют в большом количестве основной фактор патогенности — дифтерийный гистотоксин.
Дифтерийный гистотоксин оказывает блокирующее действие на синтез белка в органах, наиболее интенсивно снабженных кровью: сердечно-сосудистая система, миокард, нервная система, почки и надпочечники.
Эпидемиология. В естественных условиях дифтерией болеет только человек, не обладающий устойчивостью к возбудителю и антитоксическим иммунитетом. Заболевание распространено повсеместно. Наибольшее количество больных наблюдается во второй половине сентября, октябре и ноябре. Наиболее восприимчивы дети дошкольного и младшего школьного возраста. Среди взрослых к группе повышенного риска относятся работники общественного питания и торговли, школ, детских дошкольных и медицинских учреждений.
C. diphteriae обладает устойчивостью к факторам окружающей среды: в капельках слюны, прилипших к посуде или игрушкам, на ручках дверей они могут сохраняться до 15 дней, на предметах окружающей среды – 5,5 мес., могут размножаться в молоке. При кипячении C. diphteriae погибают в течение 1 мин, в 10% растворе перекиси водорода – через 3 мин, в 5% растворе карболовой кислоты и 50-60% спирте – через 1 мин.
Дифтерийный гистотоксин очень неустойчив и быстро разрушается при действии света, нагревании, окислении.
Источником инфекции являются:
1.носители токсигенных штаммов — особенно опасны те носители, у которых нет клинических проявлений заболевания, так как они обладают антитоксическим иммунитетом.
2.больные: Среди больных наибольшее значение имеют лица с локализацией процесса в верхних дыхательных путях. Больной эпидемиологически опасен в течение всего периода болезни, даже в период выздоровления он выделяет токсигенные штаммы в окружающую среду.
Основным механизмом заражения является аэрозольный. Пути передачи:
ведущая роль принадлежит воздушно-капельному,
иногда могут осуществляться воздушно-пылевой, контактно-бытовой, а также алиментарный (через молоко) пути передачи.
Входными воротами инфекции служат слизистые оболочки ротоглотки (небные миндалины и окружающие их ткани), носа, гортани, трахеи, а также слизистые оболочки глаз и половых органов, поврежденные кожные покровы, раневая или ожоговая поверхность, незажившая пупочная ранка.
Наиболее часто встречается дифтерия зева (90-95%). Инкубационный период длится от 2 до 10 дней. По патогенезу дифтерия относится к токсинемическим инфекциям, когда микроб остается в месте входных ворот инфекции, а все клинические проявления связаны с действием экзотоксина.
Начальным этапом инфекционного процесса является адгезия микроба в месте входных ворот. Размножаясь там, микроб выделяет гистотоксин, который оказывает местное действие на клетки тканей, а также поступает в кровь, что ведет к возникновению токсинемии.
В области входных ворот развивается воспалительная реакция, которая сопровождается некрозом эпителиальных клеток и отеком, образуется налет белого цвета с сероватым или желтоватым оттенком, содержащим большое количество микробов, продуцирующих токсин.
Характерным признаком дифтерии является фибринозная пленка:
Если слизистая оболочка образована однослойным эпителием (гортань, трахея, бронхи), возникает крупозное воспаление, здесь пленка располагается поверхностно и легко отделяется от подлежащих тканей.
Если слизистая оболочка образована многослойным эпителием (ротоглотка, надгортанник, голосовые связки), возникает дифтерическое воспаление, когда все клетки прочно связаны между собой и с подлежащей соединительнотканной основой. Фибринозная пленка в этом случае плотно спаяна с подлежащими тканями и не снимается тампоном. При попытке сделать это слизистая оболочка кровоточит.
Иммунитет. После перенесенного заболевания формируется стойкий и напряженный гуморальный антитоксический иммунитет. Продолжительность поствакцинального иммунитета – 3-5 лет.
Материалом для исследования является фибринозная пленка, слизь из зева или носа.
Сбор материала необходимо проводить в течение 3-4 ч (не позднее 12 ч) с момента обращения больного. Для взятия материала используют сухие ватные тампоны, если посев будет произведен в течение 2-3 ч, при транспортировке материала тампоны смачивают 5% раствором глицерина.
Основным методом диагностики является бактериологический. Бактериологическая лаборатория через 48 ч должна дать ответ о наличии или отсутствии C. diphteriae в анализах.
Материал засевают на питательную среду. Отбирают подозрительные колонии и выделенную культуру идентифицируют:
По наличию цистиназы (проба Пизу): в столбик питательного агара с цистином уколом засевают исследуемую культуру. Посевы инкубируют при 37 о С 24 ч. C. diphteriae вызывает почернение среды по ходу укола в результате образования сульфида свинца.
По наличию уреазы (проба Закса): готовят спиртовый раствор мочевины и раствор индикатора – фенолового красного, которые перед употреблением смешивают в соотношении 1:9 и разливают в агглютинационные пробирки. Исследуемые бактерии вносят петлей и растирают по стенке прибирки. В положительном случае через 20-30 мин инкубации при 37 о С среда приобретает красный цвет в результате расщепления мочевины уреазой.
Способности C. diphteriae продуцировать токсин (устанавливается в реакции преципитации в агаре). Для этого в чашку Петри с питательным агаром, содержащим 15-20% лошадиной сыворотки, 0,3% мальтозы и 0,03% цистина помещают полоску фильтровальной бумаги, пропитанную антитоксической противодифтерийной сывороткой, содержащей 5000 АЕ/мл. Чашку подсушивают при 37 0 С 30 мин и бляшками засевают испытуемые штаммы на расстоянии 0,6-0,8 см от края бумаги. Посевы инкубируют при 37 0 С 24 ч. В положительном случае в месте соединения токсина с антитоксином в среде образуется преципитат в виде белых линий – «усиков».
Для определения токсигенности возбудителя дифтерии может быть использована биопроба. Морской свинке внутрикожно или подкожно вводят испытуемую культуру. Токсигенные культуры убивают животных в течение 3-5 суток, при вскрытии обнаруживаются гиперемированные надпочечники, а при внутрикожном заражении – некроз кожи.
Для бактериоскопического исследования (как самостоятельный диагностический метод применяется редко ввиду полиморфизма возбудителя, но может быть проведен по просьбе врача) из материала готовят мазки на нескольких стеклах, один мазок окрашивают по Граму, другой по Нейссеру, третий – обрабатывают флюорохромом – корифосфином для люминесцентной микроскопии.
О наличии антитоксического иммунитета судят по реакции Шика – реакции нейтрализации токсина антитоксином. В кожу предплечья вводят 1/40 DLM дифтерийного токсина. Покраснение и припухлость в месте введения свидетельствует об отсутствии антитоксинов в крови. Отрицательная реакция Шика говорит о наличии антитоксинов.
Для ускоренного обнаружения дифтерийного токсина, как в бактериальных культурах, так и в сыворотке крови, применяют: РНГА с антительным эритроцитарным диагностикумом, РИА и ИФА. Из молекулярно-генетических методов исследования применяют ПЦР.
Препараты для специфического лечения дифтерии.
В целях нейтрализации дифтерийного гистотоксина применяют специфическую противодифтерийную лошадиную очищенную концентрированную сыворотку, которую получают путем гипериммунизации лошадей дифтерийным антитоксином.
Специфическое лечение противодифтерийной сывороткой начинают немедленно при клиническом подозрении на дифтерию. Необходимо выбрать оптимальный режим введения сыворотки, так как антитоксин может нейтрализовать только не связанный с тканями токсин. Для профилактики развития анафилактического шока сыворотку вводят дробно по А.М. Безредке. Введение сыворотки позднее 3-го дня болезни нецелесообразно.
Разработан противодифтерийный иммуноглобулин человека для внутривенного введения. Его применение дает меньше побочных реакций.
Для подавления размножения C. diphteriae в месте входных ворот обязательно назначают антибиотики. Препаратами выбора являются пенициллин или эритромицин, либо другие β-лактамы и макролиды.
Препараты для специфической профилактики дифтерии.
Для создания искусственного активного антитоксического иммунитета применяют дифтерийный анатоксин. Очищенный и концентрированный препарат входит в состав ассоциированных вакцин:
1. адсорбированной коклюшно-дифтерийно-столбнячной вакцины (АКДС-вакцина),
2. адсорбированного дифтерийно-столбнячного анатоксина (АДС-анатоксин),
3. адсорбированного дифтерийно-столбнячного анатоксина с уменьшенным содержанием антигенов (АДС-М),
4. адсорбированного дифтерийного анатоксина с уменьшенным содержанием антигена (АД-М).
Базисный иммунитет создается у детей согласно календарю прививок. Только 95% охват населения прививками гарантирует эффективность вакцинации.
источник
Занятие № 2.2.2
Дифтерия и туберкулез. Лабораторная диагностика
ЦЕЛЬ ЗАНЯТИЯ:
изучить биологические свойства коринебактерий и патогенных микобактерий , принципы лабораторной диагностики дифтерии и туберкулеза. Классифицировать препараты для идентификации, лечения и профилактики дифтерии и туберкулеза
СТУДЕНТ ДОЛЖЕН ЗНАТЬ:
1. Характеристику биологических свойств возбудителей дифтерии.
2. Эпидемиологию, патогенез, восприимчивость и иммунитет при дифтерии.
3. Основные клинические проявления дифтерии
4. Характеристику биологических свойств возбудителей туберкулеза.
5. Эпидемиологию, патогенез, восприимчивость и иммунитет при туберкулезе
6. Основные клинические проявления туберкулеза.
7. Принципы лабораторной диагностики.
8. Препараты для идентификации, лечения и профилактики заболеваний.
СТУДЕНТ ДОЛЖЕН УМЕТЬ:
· дифференцировать возбудителей дифтерии и туберкулеза по морфологическим, тинкториальным,биохимическим и токсигенным свойствам;
· интерпретировать результаты серологических реакций;
· классифицировать препараты в соответствии с их назначением.
СТУДЕНТ ДОЛЖЕН ВЛАДЕТЬ: алгоритмом лабораторной диагностики инфекционных болезней;
методами анализа и оценки результатов лабораторной диагностики по выявлению возбудителей дифтерии и туберкулеза.
ЛАБОРАТОРНАЯ ДИАГНОСТИКА ДИФТЕРИИ
БАКТЕРИОСКОПИЯ
Работа № 1. Морфологические и тинкториальные свойства коринебактерий.
Цель: изучить морфологические и тинкториальные свойства коринебактерий.
Самостоятельная работа: микроскопировать готовые препараты — мазки. Зарисовать. Сделать вывод.
Corynebacterium diphtheriaе (простой способ окраски по Леффлеру)
Corynebacterium diphtheriaе(сложный способ окраски — по Нейссеру)
БАКТЕРИОЛОГИЯ
Работа № 2. Культуральные свойства возбудителей дифтерии
Цель:изучитькультуральные свойства возбудителей дифтерии
Самостоятельная работа: описатьхарактер роста возбудителей дифтерии на плотной питательной среде. Сделать вывод.
Среда Клауберга (элективная среда)
Работа № 3. Дифференциация коринебактерий.
Цель: научиться дифференцировать дифтерийную палочку от дифтероидов.
Самостоятельная работа: на основании биохимических свойств и пробы на токсигенность, как основного признака возбудителя дифтерии дифференцировать дифтерийную палочку от дифтероидов. Сделать вывод.
Проба Пизу (на цистиназу)
дифтерийная палочка ложнодифтерийная
Результат:_____________________________________________________________________
____________________________________________________________________________________________________________________________________________________________
Проба Закса (на уреазу)
дифтерийная палочка ложнодифтерийная
Результат:_____________________________________________________________________
____________________________________________________________________________________________________________________________________________________________
Ферментация углеводов
глю сах крах глю сах крах
дифтерийная палочка gravis дифтерийная палочка mitis
глю сах крах глю сах крах
палочка ксерозы ложнодифтерийная палочка
Результат:_____________________________________________________________________
____________________________________________________________________________________________________________________________________________________________
Проба на токсигенность
Дифференциация дифтерийной палочки от дифтероидов
| Виды | Ферментация | Уреазная актив-ность | Цистиназ-ная активность | Токсиген ность |
| глюкоза | сахароза | крахмал | ||
| Дифтерийная палочка а) gravis б) mitis | ||||
| Дифтероиды: а) ложнодифтерий- ная палочка б) палочка ксерозы |
СЕРОДИАГНОСТИКА
Работа № 4. Серологические исследования
Цель:оценить напряженность коллективного антитоксического иммунитетас помощью основного метода диагностики – РПГА.
Самостоятельная работа:Учесть готовый результат РПГА, поставленной с сывороткой больного и эритроцитарным дифтерийным антигенным диагностикумом для определения уровня антитоксического иммунитета. Записать вывод.
1/10 1/20 1/40 1/80 1/160 1/320 1/640 КС КД
Работа № 5. Принципиальная схема лабораторной диагностики дифтерии
Самостоятельная работа:разобрать особенности лабораторной диагностикидифтерии. Отметить наиболее информативные методы лабораторной диагностики.
Исследуемый материал:
ЛАБОРАТОРНАЯ ДИАГНОСТИКА ТУБЕРКУЛЕЗА
БАКТЕРИОСКОПИЯ
А) Mycobacterium tuberculosis в мазке из мокроты.
Б) микроколонии (корд-фактор) M.tuberculosis: ускоренный метод диагностики (метод Прайса).Окраска по Цилю-Нильсену.
БАКТЕРИОЛОГИЯ
СЕРОДИАГНОСТИКА
Токсин Шика
1. Вакцина БЦЖ
Стрептомицин
II. Заполнить контрольные карты по предложенным нозоформам:
Таксономия возбудителя:
Морфологические и тинкториальные свойства__________________________________________________________________________________________________________________________________________________
Культуральные и биохимические свойства____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Резистентность_________________________________________________________________________________________________________________________________________________________________________________________________________________________
Эпидемиология
Патогенез и клиника
Основные факторы патогенности ________________________________________________
Основные фазы патогенеза_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Иммунитет___________________________________________________________________
Основные направления лабораторной диагностики_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Специфическая профилактика (препараты)____________________________________________________________________________________________________________________________________________________________________________________________________________________________
Лечение (препараты)_______________________________________________________________________________________________________________________________________________
Таксономия возбудителя:
Морфологические и тинкториальные свойства_______________________________________________________________________________________________________________________________________________________________________________________________________________________________
Культуральные и биохимические свойства____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Антигенная структура______________________________________________________________________________________________________________________________________________________________________________________________________________________________
Резистентность_________________________________________________________________________________________________________________________________________________________________________________________________________________________
Эпидемиология
Патогенез и клиника
Основные факторы патогенности ________________________________________________
Основные фазы патогенеза________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Иммунитет___________________________________________________________________
Основные направления лабораторной диагностики_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Специфическая профилактика (препараты)____________________________________________________________________________________________________________________________________________________________________________________________________________________________
Лечение (препараты)_______________________________________________________________________________________________________________________________________________
Подпись преподавателя ___________________________________
Ситуационные задачи
1. В инфекционную больницу поступила девочка 2-х лет с высокой температурой, жалобами на боли в горле. На слизистой зева с трудом снимающиеся серовато-белые налеты. Лечащий врач поставил диагноз «дифтерия зева», ввел немедленно 5000 МE противодифтерийной сыворотки и отправил в лабораторию материал для исследования.
Оцените результат бактериологического исследования.
Вопросы1. Какой материал взят на исследования? 2. Какие исследования назначить?
3. Подтвердился ли клинический диагноз «дифтерия»? Почему? 4. Правильна ли была тактика лечащего врача? Почему?
2. Всем детям начальной школы была своевременно проведена ревакцинация дифтерийным анатоксином. Спустя 2 месяца одна ученица заболела дифтерией. Для оценки уровня антитоксического иммунитета в коллективе была поставлена РПГА. Оценить результаты РПГА при обследовании школьников. Оформить протокол исследования. Сделать вывод.
(Для учета результатов исследования выделяется планшет с реакцией РПГА.)
Вопросы1. У кого из обследованных школьников напряженный антитоксический иммунитет к дифтерии? Почему? 2. Кому из обследованных необходимо ввести специфический препарат? Какой? Почему? 3. Как объяснить причину заболевания дифтерией одной ученицы?
| Обследуе-мые школьники | Метод диагностики | Исследуемый материал | Диагностический препарат для РПГА | Разведения сыворотки | Единица измерения активности анатоксина | |||
| 1/100 | 1/200 | 1/400 | К | |||||
| А. Б. Е. | Серологический | Сыворотка крови | Дифтерийный эритроци-тарный диагностикум | + + — | + — — | + — — | — — — | ИЕ — иммуногенная единица |
| «+» — склеенные эритроциты в виде «зонтика» «-» — отсутствие гемагглюти-нации — «пуговка» |
3. В туберкулезном диспансере при лабораторном обследовании семьи, состоящей из девочки 7 лет и трех взрослых людей (матери, отца и дяди ребенка), установлено следующее:- у девочки положительная реакция Манту, Микроскопия мокроты, посев ее и биологическая проба дали отрицательные результаты.
— у матери обнаружены туберкулезные палочки только в посеве мокроты.
— у отца туберкулезная палочка обнаружена при микроскопии мокроты.
— у брата матери — положительная реакция Манту, результаты всех остальных исследований отрицательные.
| Обследуемые | Реакция Манту | Микроскопия мокроты | Посев мокроты | Биологическая проба |
| Ребенок | + | — | — | — |
| Отец | — | + | Не проводился | — |
| Мать | — | — | + | Не проводилась |
| Брат матери | + | — | — | — |
Вопросы: 1. У кого из них лабораторно подтверждается диагноз «туберкулез»? 2. Кто из них должен быть оставлен под наблюдением врача диспансера?
4. Ребенок 2 лет с положительной реакцией Манту заболел корью. Через 2 недели после выздоровления у него появились субфебрильная температура, общее недомогание. Повторная реакция Манту оказалась отрицательной. Что заподозрил врач? Почему повторно была поставлена реакция Манту? Как объяснить исчезновение аллергической реакции к туберкулину?
5. В инфекционную больницу поступила девочка 2-х лет с высокой температурой, жалобами на боли в горле. На слизистой зева с трудом снимающиеся серовато-белые налеты. Лечащий врач поставил диагноз дифтерия зева, ввел немедленно 5000 МE противодифтерийной сыворотки и отправил в лабораторию материал для исследования.
Оцените результат бактериологического исследования.
Вопросы1. Какой материал взят на исследования? 2. Какие исследования назначить?
3. Подтвердился ли клинический диагноз дифтерии? Почему? 4. Правильна ли была тактика лечащего врача? Почему?
Пример решения задачи
Всем детям начальной школы была своевременно проведена ревакцинация дифтерийным анатоксином. Спустя 2 месяца одна ученица заболела дифтерией. Для оценки уровня антитоксического иммунитета в коллективе была поставлена РПГА. Оценить результаты РПГА при обследовании школьников. Оформить протокол исследования. Сделать вывод.
Для учета результатов исследования выделяется планшет с реакцией РПГА.
Вопросы1. У кого из обследованных школьников напряженный антитоксический иммунитет к дифтерии? Почему? 2. Кому из обследованных необходимо ввести специфический препарат? Какой? Почему? 3. Как объяснить причину заболевания дифтерией одной ученицы?
| Обследуемые школьники | Метод диагностики | Исследуемый материал | Диагностический препарат для РПГА | Разведения сыворотки | Единица измерения активности анатоксина | |||
| 1/100 | 1/200 | 1/400 | К | |||||
| А. Б. Е. | Серологический | Сыворотка крови | Дифтерийный анатоксинный эритроци-тарный диагностикум | + + — | + — — | + — — | — — — | ИЕ-имму- ногенная единица |
| «+» — склеенные эритроциты в виде «зонтика» «-» — отсутствие гемагглютинации -«пуговка» |
Решение. Студент учитывает данные ему результаты, заполняет протокол и делает выводы:
1. Напряженный антитоксический иммунитет к дифтерии выявлен только у школьника А., так как по результатам РИГА в сыворотке крови обследуемого обнаружен высокий титр антитоксических антител (1/400).
2. Обследуемым детям Б. и Е., у которых не выявлен напряженный иммунитет, необходимо провести вакцинопрофилактику путем введения дифтерийного анатоксина, для того чтобы создать напряженный антитоксический иммунитет.
3. Объяснить причину заболевания одной из учениц в школе можно отсутствием у ней напряженного антитоксического иммунитета против дифтерии. Возможные причины: врожденный иммунодефицит, вторичный иммунодефицит, слабая экспрессия генов иммунного ответа, отсутствие вакцинации.
Подпись преподавателя_________________________________________________________
Теоретическая справка
К работе № 2
К работе № 3
К работе № 4
Серодиагностика дифтерии
Антитела к С. diphtheriae определяют в крови больных, начиная с первых дней болезни и повторно через 10-14 дней. Обязательным условием является определение специфических антител в динамике болезни в парных сыворотках. Диагностическое значение имеют результаты серологических исследований при нарастании титра антител не менее чем в 3-4 раза.
Для определения уровня дифтерийного антитоксина в сыворотке человека применяют несколько реакций:
РПГА — двухкомпонентная реакция, предполагающая взаимодействие диагностикума эритроцитарного дифтерийного антигенного (представляет собой эритроциты с адсорбированным на них дифтерийным анатоксином) и антитоксических противодифтерийных антител, находящихся в сыворотке крови обследуемых. При наличии в исследуемой сыворотке антитоксина образуется специфический комплекс: антитоксин + сенсибилизированные анатоксином эритроциты.В результате формируется осадок в виде агглютината эритроцитов.
В нашей странеРПГА рекомендована в качестве основного метода для определения напряженности антитоксического иммунитета к С. diphtheriae, а также для оценки вакцинального иммунитета.
Оценка состоянияколлективного иммунитета требует более детальной характеристики, чем только установление процента серонегативных людей. Для этого следует давать развернутыепо каждому титру данные в РНГА т.е. с учетом степени напряженности. Отсутствие антител является безусловным показателем незащищенности; титры 1:10 и 1:20 можно считать индикатором пограничного иммунитета, не обеспечивающего безусловной защиты; однако заболевание при этом, как правило, протекает в легкой форме без летального исхода. Титры 1:80 и выше являются показателем защищенности группы.
Таким образом, процентное распределение показателей титров в каждом разведении дает качественную характеристику состояния иммунитета к дифтерии в обследованной группе. Например, выявление у 50% обследованных показателей пограничного иммунитета (титры 1:10, 1:20) свидетельствует о слабой защищенности группы, в которой с годами будет увеличиваться число лиц, не защищенных от дифтерии.
В настоящее время приняты следующие количественные критерии, характеризующие степень восприимчивости к дифтерии в зависимости от уровней антитоксических антител.
| Содержание антитоксических антител | Интерпретация результатов |
| 1,0 МЕ/мл | уровень антитоксина, обеспечивающий стойкуюдлительную невосприимчивость к дифтерии |
ИФА предназначен дляколичественного определения антибактериальных и антитоксических иммуноглобулинов М, G человека в сыворотке крови больных дифтерией, бактерионосителей издоровых людей. Принцип ИФА основан на образовании специфического комплекса антиген-антитело, выявляемого с помощью второго антитела, меченного пероксидазой хрена. При последующем добавлении субстратной смеси развивается ферментативная реакция, регистрируемая по появлениюокрашенного продукта. Интенсивность реакции учитывается с помощью иммуноферментного анализатора или визуально.
3.Определение титра антител к дифтерийному токсину в сыворотке крови человека в реакции нейтрализации (РН) на культуре клеток.
Метод основан на том, что метаболическая активность и рост клеток культуры ингибируется дифтерийным токсином, который, в свою очередь, может быть нейтрализован антитоксином, содержащимся в сыворотке крови. Последовательное разведение сыворотки крови человека добавляют в лунки микропланшета, в которые затем вносят дифтерийный токсин в рабочей дозе и культуру клеток. Обнаружение по окончании инкубации (t 37 о С 5-6 суток) живых клеток культуры в лунках, содержащих определенные разведения сывороток, будет указывать на соответствующий титр антител к дифтерийному токсину в тестируемых сыворотках + проба на токсигенность.
К работе № 5
К работе № 7
К работе № 8
Серодиагностика
Для выявления специфических антител к антигенам микобактерий предложено большое количество серологических реакций: РПГА, РА, РСК.
В последние годы интенсивно разрабатываются тесты на выявление антител к МБТ в крови больного в конкурентной иммуноферментной реакции с применением стандартных концентраций антигена микобактерий и моноклональных антител, конъюгированных с ферментом — пероксидазой. Разработаны диагностические тест-системы «ИФА — туберкулез», предназначенные для выявления с помощью иммуноферментного анализа антител к МБТ и позволяющие распознавать как легочные, так и внелегочные формы туберкулеза. Тест-система «ИФА-туберкулез» может быть использована как для диагностики у отдельных больных, так и при массовых обследованиях населения. Чувствительность тест-системы при различных локализациях туберкулезного процесса составляет от 68% до 100%, специфичность — 94%.
К работе № 9
Занятие № 2.2.2
Дифтерия и туберкулез. Лабораторная диагностика
ЦЕЛЬ ЗАНЯТИЯ:
изучить биологические свойства коринебактерий и патогенных микобактерий , принципы лабораторной диагностики дифтерии и туберкулеза. Классифицировать препараты для идентификации, лечения и профилактики дифтерии и туберкулеза
СТУДЕНТ ДОЛЖЕН ЗНАТЬ:
1. Характеристику биологических свойств возбудителей дифтерии.
2. Эпидемиологию, патогенез, восприимчивость и иммунитет при дифтерии.
3. Основные клинические проявления дифтерии
4. Характеристику биологических свойств возбудителей туберкулеза.
5. Эпидемиологию, патогенез, восприимчивость и иммунитет при туберкулезе
6. Основные клинические проявления туберкулеза.
7. Принципы лабораторной диагностики.
8. Препараты для идентификации, лечения и профилактики заболеваний.
СТУДЕНТ ДОЛЖЕН УМЕТЬ:
· дифференцировать возбудителей дифтерии и туберкулеза по морфологическим, тинкториальным,биохимическим и токсигенным свойствам;
· интерпретировать результаты серологических реакций;
· классифицировать препараты в соответствии с их назначением.
СТУДЕНТ ДОЛЖЕН ВЛАДЕТЬ: алгоритмом лабораторной диагностики инфекционных болезней;
методами анализа и оценки результатов лабораторной диагностики по выявлению возбудителей дифтерии и туберкулеза.
ЛАБОРАТОРНАЯ ДИАГНОСТИКА ДИФТЕРИИ
БАКТЕРИОСКОПИЯ
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
источник