Материалом для исследования при дифтерии могут быть пленки и слизь из зева и носа, а при редких локализациях дифтеритических воспалений — из глаза, уха, с поверхности раны и кожи. Отделяемое забирают сухим ватным тампоном или смоченным 5% раствором глицерина в физиологическом растворе с рН-8.
До этого уровня его доводят 20% раствором однозамещенного фосфорно-кислого натрия (Na2HPO4).
Исследование осуществляют не позднее 3-4 часов после забора, с поэтапной выдачей ответов о подтверждении диагноза.
Морфологические и тинкториальные признаки дифтерийных бактерий настолько своеобразны, что микроскопический метод может примениться как самостоятельный или предварительный к бактериологическому анализу. Кроме того, он дает представление и о сопутствующей микрофлоре.
Для выявления дифтерийных палочек могут быть использованы три метода окраски: Грама, Леффлера, Нейccера.
МЕТОД ГPAМA позволяет выявить способность дифтерийных бактерий вступить во взаимодействие с генцианвиолетом. Дифтерийные бактерии грампозитивиы, но это свойство непостоянно. При контакте с антибиотиками, при длительном пребывании в голодной среде резко изменяется обмен веществ и грамположительность микробов теряется. Поэтому ориентироваться на этот признак нельзя.
МЕТОД НЕЙССЕРА — наиболее ценный дифференциально-диагностический способ, позволяющий не только окрасить микроорганизмы, но и выявить полярно вкрапленные зерна волютина и характерное расположение бактериальных особей под углом.
РЕАКТИВЫ
- УКСУСНОКИСЛАЯ СИНЬКА НЕЙСЕРА: метиленовая синька -0,1 г, спирт 96° -2 мл; 5% раствор ледяной уксусной кислоты в дистиллированной воде — 50 мл.
- РАСТВОР ЛЮГОЛЯ: 2 г йодистого калия растворить в 10 г дистиллированной воды. Затем к этому раствору прибавить; 1 г кристаллического йода и добавить воды до 300 мл.
- РАСТВОР ХРИЗОИДИНА: 2 г хризоидина на 300 мл горячей дистиллированной воды.
Вместо раствора хризоидина можно использовать раствор везувина (краситель бисмаркбраун): везувин-1 г; 96° cпирт-10 мл; кипящая дистиллированная вода-100 мл.
ТЕХНИКА ОКРАСКИ
- Синька Нейссора- 1 минута
- Раствор Люголя — 30 секунд.
- Ополаскивание дистиллированной водой.
- Докраска расвором хризоидина или везувина — 10-15 секунд.
Тело микробной клетки окрашивается в желтый или желто-коричневый цвет, зерна волютина — коричнево-черного цвета.
ОКРАСКА ПО СПОСОБУ ЛЕФФЛЕРА
Метод Леффлера прост, но по своим дифференциально-диагностическим возможностям он не уступает сложному способу Нейссера. Поэтому он применяется значительно чаще.
Для окраски нужен один реактив — щелочная метиленовая синька Леффлера следующего состава: Дистиллированная вода — 99 мл; 1% раствор едкого калия (КОН) — 1 мл; профильтрованный спиртовой раствор метиленовой синьки (0,5 г синьки на 30 мл спирта) — 30 мл.
Окраска осуществляется 1-2 минуты. При этом тело бактерий приобретает бледно-голубой цвет, зерна волютина — синий или cине-черный.
При выполнении микроскопического исследования важно отличить истинные дифтерийные бактерии от дифтериеподобных палочек Гоффмана и бактерий ксерозис.
| Микроскопическая дифференциация дифтерийных бактерий и дифтероидов | ||
| Бактерии | Взаимное расположение особей в препарате | Наличие и количество зерен волютина |
| Дифтерии | Под углом в виде римской цифры V или кисти рук с разведенными пальцами | 2 зерна с полярной локализацией |
| Бактерии Гоффмана | Параллельное, в виде часткола | Зерен нет или единичные без типичной локализации |
| Бактерии Keepоза | Хаотичное | Зерен много, распределение беспорядочное |
II. БАКТЕРИОЛОГИЧЕСКИЙ МЕТОД
Дифтерийные бактерии требовательны к питательным средам. Для их выделения и накопления используется комплекс специальных элективных и дифференциально-диагностических сред.
СВЕРНУТАЯ СЫВОРОТКА РУ: 3 мл стерилыной сыворотки лошади (быка или человека) вносят в пробирку, укладывают с наклоном в 45-50° в свертывателе Коха, предварительно нагретом до +50 °C. Затем температуру доводят до 80° и прогревают в течение 1 часа. Готовую среду охлаждают, ставят в термостат для проверки стерильности. В случае прорастания среды последнюю повторно прогревают при + 80 °C в течение 2 часов.
На этой среде бактерии дают шероховатые R-формы, напоминающие в комплексе шагреневую кожу.
ТЕЛЛУРИТОВЫЕ ДИФФЕРЕНЦИАЛЬНЫЕ СРЕДЫ
Дифтерийные бактерии обладают выраженной способностью восстанавливать теллуровокислый калий до металлического теллурита. Для выявления этой способности в среды добавляется дифференцирующий компонент-2% раствор теллурита калия следующего состава: дистиллированная вода-100 мл; теллурит калия (K2FeO4)-2 г. Раствор стерилизуют кипячением 30 минут. Для приготовления сред можно использовать также готовый 2% раствор теллурита калия в 40% глицерине, выпускаемый в ампулах для клинических теллуритовых проб.
СЫВОРОТОЧНО-ТЕЛЛУРИТОВЫИ АГАР: к 80 мл расплавленного и охлажденного до +50 °C 2% МПА добавляют 20 мл лошадиной или 30 мл бычьей сыворотки и 1 мл 2% раствора теллурита калия. Готовую среду разливают в стерильные чашки.
КРОВЯНО-ТЕЛЛУРИТОВЫЙ АГАР: к 100 мл расплавленного и охлажденного до +50 °C 2-3% МПА добавляют 5-10% дефибринированной крови человека (донорской, плацентарной) или животного (крупного рогатого окота, кролика, барана, морской свинки) и 1 мл 2% теллурита калия, смешивают и разливают в чашки.
СРЕДА КЛАУБЕРГА: 100 мл 3% МПА расплавляют, добавляют 3 мл 2% теллурита калия, 10 мл глицериновой смеси и 50 мл лаковой крови. Последнюю готовят следующим образом: к 34 мл дистиллированной стерильной воды добавляют 16 мл дефибринированной крови (любой). Состав глицериновой смеси: к 40 мл дефибринироваиной крови крупного рогатого скота или человека добавляют 20 мл химически чистого стерильного глицерина и выдерживают до употребления в холодильнике 3-6 недель.
По характеру роста на теллуритовых средах удается отдифференцировать дифтерийные бактерии как внутри вида, так и от других микроорганизмов.
| Дифференциация дифтерийных палочек от других микробов на теллуритовых и хинозольной средах | ||
| Бактерии | Характер роста на средах | |
| теллуритовых | хинозольной | |
| Дифтерийные бактерии | серые, розеткообразные | синие |
| тип гравис | с радиальностью | |
| тип митис | черные, матовые, гладкие | |
| тип интермедиус | серо-черные, гладкие | |
| Ложнодифтерийные бактерии Гофмана | серые, блестящие, выпуклые, конусовидные | голубоватые |
| Дифтериоиды Ксероза | серо-черные, как истинные дифтерийные | бесцветные |
| Стафилококки | черные, влажные, блестящие | — |
ХИНОЗОЛЬНУЮ СРЕДУ БУЧИНА готовят по следующей прописи: на 100 мл воды добавляют 3 г хлористого натрия, 1,5 г, глюкозы, 1 мл 3% раствора цистина в 1% растворе соды, 2 мл водного раствора хинозола (1:1000), 0,08 г индикатора водноголубого, 4,0 сухого питательного агара. Смесь растворяют при нагревании. Устанавливают pH = 7,4-7,6. Охлаждают до +50 °C, добавляют 5 мл дефибринированной крови и, соблюдая стерильность, разливают в чашки Петри.
СРЕДА ТИНСДАЛЯ-САДЫКОВОЙ является селективной средой для дифтерийных бактерий. Посторонняя микрофлора на ней не растет или развивается очень скудно. Другим преимуществом среды является то, что она не нуждается в добавлении крови. Ее состав следующий: 100 мл мартеновского или обычного мясопептонного агара, 15-20 мл нормальной лошадиной сыворотки, 12 мл 1% раствора цистина (сначала растворить в 0,1 N р-ре NaOH, потом в воде), 11-12 мл 0,1N HCl (для нейтрализации NaOH); 1,8 мл 2% раствора теллуристого калия и 1,8 мл 2,5% раствора гипосульфита натрия.
Дифтерийные бактерии обладают рядом характерных биохимических признаков. Они хорошо ферментируют глюкозу и крахмал, высвобождают значительные количества активной цистиназы, выявляемой в пробе Пизу. Вместе с тем, названные микроорганизмы инертны в отношении сахарозы и не имеют фермента уреазы, обнаруживая отрицательную пробу Закса. Очень важным видовым признаком этих микробов является токсигенность. С эпидемиологической точки зрения, весьма существенное значение имеет серологическая неоднородность дифтерийных бактерий и наиболее широкое участие в распространении инфекции I и VI серологических типов. Это необходимо учитывать при диагностике дифтерии.
ОПРЕДЕЛЕНИЕ УГЛЕВОДОЛИТИЧЕСКОИ АКТИВНОСТИ дифтерийных бактерий производится на комплексе углеводных сред, состоящих из 1% пептонной воды с pH-7,6, в которую добавляют различные углеводы: 0,5% сахарозы, 0,5% глюкозы, 0,2% крахмала. В качестве индикатора используется реактив Андреде (кислый фуксин, обесцвеченный щелочью).
Среды разливают по 2 мл и стерилизуют текучим паром 3 дня подряд :по 30 минут. До работы они бесцветны, при ферментации углеводов — краснеют.
На углеводных сывороточно-водных средах, основа которых состоит из дистиллированной воды (80 мл) и сыворотки (20 мл), углеводолитические свойства культур проявляются плохо и ферментация углеводов идет очень медленно.
ОПРЕДЕЛЕНИЕ ПРОТЕОЛИТИЧЕСКИХ СВОЙСТВ
ПРОБА ПИЗУ — ОПРЕДЕЛЕНИЕ ФЕРМЕНТА ЦИСТИНАЗЫ
К 90 мл расплавленного 2% МПА с pH -7,6 добавляют 2 мл раствора цистина (1% раствор цистина в 0,1N растворе NaOH). Среду стерилизуют при +112 °C 30 минут. K расплавленной и охлажденной до +50 °C среде добавляют 1 мл 10% уксуснокислого свинца (простерилизованного дважды текучим паром) перемешивают и добавляют 9 мл нормальной лошадиной сыворотки. Среду стерильно разливают в маленькие пробирки по 2 мл. Посев производится уколом.
Вместо МПА с цистином можно использовать 2% МПА, приготовленный на переваре Хоттингера, с содержанием аминного азота в 250 мг%.
Дифтерийные бактерии активно перерабатывают белки и цистин с высвобождением сероводорода, который, соединяясь с уксусным свинцом, переходит в сернистый свинец коричнево-черного цвета. Дифтероиды подобных изменений не дают.
ПРОБА ЗАКСА — ОПРЕДЕЛЕНИЕ ФЕРМЕНТА УРЕAЗЫ
Проба Закса служит для отличия дифтериеподобных бактерий, обладающих уреазной активностью, от истинных дифтерийных палочек, не имеющих этого фермента.
- 1. ВАРИАНТ СРЕДЫ: к 100 мл МПБ или Хоттингеровского бульона добавляют 1 г мочевины и 0,2 мл 1,6% спиртового раствора крезолрот, разливают по 2-3 млв пробирки и стерилизуют текучим паром 10 минут. Результаты учитывают через 20-24 часа после посева. Покраснение среды свидетельствует о наличии уреазы.
- 2. ВАРИАНТ СРЕДЫ: готовят два реактива: А и В.
Реактив А: мочевина — 1 г, спирт 96°- 2 мл, дистиллированная вода — 4 мл.
Реактив В: 0,2% раствор фенолрота-1 мл, однозамещенный фосфат калия (КН2Р04)-0,1 г, двузамещенный фосфат калия (К2НРО4)-0,1 г, хлористый натрий — 0,5 г, дистиллированная вода — 100 мл.
Реактив А стерилизуют фильтрованием и хранят при + 4 °C, реактив В — в автоклаве текучим паром.
Перед работой оба реактива смешивают ex tempore из расчета 1 часть раствора А и 19 частей раствора В, смесь разливают по 0,1 мл в узкие пробирки. Испытуемые культуры вносят в количестве 2-6 капель, помещают в термостат на 30 минут. При положительной реакции смесь краснеет.
Дифференциация дифтерийных бактерий и дифтероидов по биохимическим признакам приведена ниже.
В отдельных случаях после определения биохимических свойств дифтерийных бактерий выясняется серотип штамма. Для этой цели используется ориентировочная агглютинация. Последнюю проводят на стекле с чистыми культурами, которые смывают со среды 1 мл солевого раствора и осторожно набирают стерильной пастеровской пипеткой. Агглютинирующие монотииовые сыворотки (I, II, III, IV, VI серотипы) разводят 1:25 солевым раствором с pH-7,6 (к 100 мл дистиллированной воды прибавляют 3,0 NaOH и устанавливают pH-7,6, доливая 5% раствор Na2HPO4). Для контроля испытуемой культуры ставят реакцию с выше указанным солевым раствором без сыворотки.
Положительная реакция характеризуется быстрым появлением хлопьев агглютината (2-3 минуты), особенно заметных при учете реакции над вотеутым зеркалом.
Неиспользованную сыворотку запаивают в ампулу или переливают в стерильную пробирку.
Агглютинирующие сыворотки хранятся в сухом месте при температуре от +4° до +10 °C.
При использовании высушенных сывороток последние перед употреблением растворяют в стерильной дистиллированной воде (1 мл на ампулу). Срок годности сухой сыворотки не ограничен.
УСКОРЕННЫЕ МЕТОДЫ ДИАГНОСТИКИ
ТЕЛЛУРНТОВАЯ ПРОБА — КЛИНИЧЕСКАЯ
Тампоном, смоченным 2% раствором теллуровокислого калия в 40% глицерине (выпускается в ампулах), смазывают пораженные миндалины и слизистую. При наличии дифтерийных бактерий тампон чернеет сразу или после 2-4-часовой инкубации в термостате.
ОПРЕДЕЛЕНИЕ ТОКСИГЕННОСТИ ДИФТЕРИЙНЫХ БАКТЕРИИ
Определение токсигенности дифтерийных бактерий осуществляется биологическим (в специализированных лабораториях) и диффузионным (на плотных средах) методами.
Рекомендуемая литература:
- Профилактика дифтерии. Методические материалы для практических работников. М., 1961, стр. 37.
- Сборник официальных материалов по лабораторному делу. Книга первая. Медгиз, 1961, стр. 331-337.
- Сборник схем бактериологического исследования при некоторых инфекционных заболеваниях. Методическое пособие для врачей-курсантов заочников, под ред. проф. П. Н. Кашкина, Л., 1965, стр. 17-20.
- Дяченко С. С. Микробиологические методы диагностики инфекционных заболеваний. Киев, 1962, стр. 224,
- Пяткин К. Д., Трофимова Н. Д., Маркова Н. С. Руководство к практическим занятиям по медицинской микробиологии, 1962, стр. 219.
- Руководство по микробиологии, клинике и эпидемиологии инфекционных заболеваний, 1964, т. VI, стр. 375.
- Руководство по микробиологической диагностике инфекционных болезней под ред. Матвеева К. И. и Соколова М. И. 1964, стр. 422-430.
Источник: Мотавкина Н.С., Пьянова Р.Е. Микробиологическая диагностика некоторых капельных инфекций и токсоплазмоза. Методическая разработка для студентов. ВГМУ, 1973
источник
Цель занятия: знатьклассификацию и основные биологические свойства, факторы патогенности возбудителей, методы микробиологической диагностики, биопрепараты для этиотропной терапии и специфической профилактики указанных инфекций
уметь:микроскопироватьс масляной иммерсией микропрепараты, описывать морфологические и тинкториальные свойства бактерий; описывать культуральные свойства бактерий; определять токсигенность дифтерийных палочек
Задание на дом:
I. Вопросы для самоподготовки:
1) Характеристика биологических свойств и особенностей микробиологической диагностики возбудителей туберкулеза
2) Характеристика биологических свойств и особенностей микробиологической диагностики возбудителей дифтерии
II. Базовый текст
1. Классификация и таксономия
Туберкулез — хроническое гранулематозное инфекционное заболевание, при котором чаще всего поражаются легкие. Но бывают и внелегочные формы заболевания — туберкулез кожи, костей и суставов, мочеполовой системы, кишечника, центральной нервной системы и др.
Основным возбудителем туберкулеза является Mycobacterim tuberculosis, которыйотносится к домену Bacteria, типу Actinomycetеae, классу Actinobacteria, семейству Mycobacteriaceae, роду Mycobacterim (старое название BK — бацилла Коха).
По классификации Раньона различают четыре группы:
1. фотохромогенные микобактерии, приобретающие темно-оранжевую окраску при выращивании на свету. В полной темноте они не образуют пигмента. Основной представитель — М. kansassii;
2. фотохромогенные микобактерии, приобретающие ярко-оранжевую окраску независимо от выращивания на свету или в темноте. Основные представители — М. scrofu1асеum, М.gordonae, М. аguае и др.;
3. нефотохромогенные микобактерии, могут быть неокрашенными или иметь желтовато-оранжевые оттенки. Однако пигментация не зависит от экспозиции на свету. Основные представители — М. intractlulareе, М. battey;
4. быстрорастущие микобактерии образуют колонии в течение недели при 25 ° С и 37 ° С. Представители — М. рhlei, М. smegmatis, М. fortuitum.
2. Нозологичекие формы
К патогенным видам принадлежат:
M.tuberculosis вызывает туберкулез у человека в ≈ 92% случаев.
M.bovis вызывает туберкулез у крупного рогатого скота, свиней, овец, коз, верблюдов, буйволов, оленей, маралов, собак, кошек и других видов животных, а также человека в ≈ 5% случаев.
M.avium вызывает туберкулез в основном у птиц, кроликов, белых мышей, свиней; могут вызывать патологические изменения в органах у человека.
M.africanum вызывает туберкулез у людей в тропической Африке в ≈ 3% случаев.
M.paratuberculosis вызывает туберкулез у крупного рогатого скота, коз, верблюдов, овец, северных оленей.
К потенциально патогенным видам для людей принадлежат:
M.chelonei вызывают проходящие поражения у мышей, морских свинок, хомяков и кроликов, у человека — патологические изменения в синовиальной ткани коленного сустава и поражения в ягодичной части, подобно абсцессам.
M.xeponi выделены от жабы. Потенциально патогенны для человека.
M.ulcerans выделены из кожных поражений людей в Австралии, Мексике, Новой Гвинеи, Африке и Малайских островах.
Остальные более 16 видов микобактерий — не патогенны для человека.
3. Эпидемиология и пути передачи
Для современного периода характерно увеличение заболеваемости, особенно среди заключенных и бомжей, повышение тяжести течения туберкулеза и смертности, распространение форм возбудителей, обладающих повышенной вирулентностью и множественной устойчивостью к химиотерапевтическим препаратам.
Благодаря особому химическому строению оболочки, связанному с наличием большого количества липидов и липидсодержащих соединений, микобактерии туберкулеза обладают значительной устойчивостью к физическим и химическим агентам. Во влажной мокроте микобактерии выдерживают нагревание в течение 30 мин при 75 °С, при кипячении погибают через 5 мин. В выделенной мокроте микобактерии (МБТ) погибают при 100º С через 45 мин. В воде палочки выживают не менее 150 дней. МВТ выдерживают процессы гниения и могут несколько месяцев сохраняться в погребенных трупах. Препараты хлора и йода эффективно действуют на микобактерии.
Основными путями заражения являются воздушно — капельный и воздушно — пылевой. Основным источником заражения является больной туберкулезом человек. Способ передачи заболевания обусловлен развитием гиперчувствительности замедленного типа (ГЗТ), которая способствует распаду тканей, образованию полостей (каверн), из которых некротические массы, содержащие множество туберкулезных микобактерий, попадают в бронхи и выделяются с мокротой при кашле во внешнюю среду, инфицируя окружающих людей. Прорыв туберкулезных гранулем в кровь может привести к распространению туберкулезного процесса на другие ткани и органы. При запущенных формах вторичного туберкулеза прогноз неблагоприятен.
4. Морфология и тинкториальные свойства
Микобактерии туберкулеза (МБТ) были открыты Р. Кохом в мокроте больного туберкулезом. Это тонкие, слегка изогнутые, гомогенные или зернистые палочки длинной от 0,8 до 3-5 мкм и шириной от 0,3 до 0,5 мкм. Величина палочек зависит от возраста микроба и условий его обитания. В казеозных массах палочки располагаются неровными кучами по 2—3 и более. В различных условиях пребывания в организме палочки могут проявлять полиморфизм — образовать нитевидные, ветвящиеся формы с булавовидными образованиями на концах нитей.
При применении наиболее распространенного способа окраски (Циль-Нильсен) в палочках отмечаются более яркие красные или фиолетовые гранулы. Исследование в электронном микроскопе позволило установить сложное строение их стенки из 3 слоев, а также наличие в цитоплазме гранул. В препаратах из культур, особенно на жидких средах, вирулентные МБТ располагаются в виде жгутов. В препаратах почти всегда имеются разной степени окраски округлые тельца (зерна). Это вегетативные формы, которые получаются в результате размножения микроба поперечным делением. Доказано существование некислотоустойчивых культур МБТ, которые названы L-формами. Эти формы способны расти на обычных средах и трансформироваться в бактерии.
5. Питательные среды и культуральные свойства
Микобактерии туберкулеза вне организма растут в чистых культурах на плотных и жидких средах с хорошим доступом воздуха. Используются глицериновые, белковые (яичные, сывороточные, картофельные) и синтетические. Они должны содержать факторы роста, такие как витамины группы В, биотин, никотин, рибофлавин. На твердых средах рост туберкулезных микобактерий появляется на 14-20 сутки в виде светло-кремового морщинистого или суховато-чешуйчатого налета, колонии с неровными краями (R-формы), по мере роста приобретают бородавчатый вид, напоминающий «цветную капусту».
1. Среда Левенштейн-Йенсена содержит суспензию свежих куриных яиц, глицерин, аспарагин, крахмал, минеральные соли, раствор малахитовой зелени. Свертывают среду в пробирках в наклонном положении при 85°С 30-45 минут.
2. Среда Финна II содержит суспензию свежих куриных яиц, глицерин, натрия глутамат, минеральные соли, раствор малахитовой зелени. Свертывают среду по 4-5 мл в пробирках в наклонном положении при 85°С 30-45 минут.
3. Картофельно-глицериновая среда. Куски тщательно вымытого сырого картофеля вымачивают сутки в растворе бикарбоната натрия, а затем 2 суток в 6% растворе глицерина. Кладут приготовленные куски картофеля в широкие пробирки или пробирки с перетяжкой, наливают немного раствора глицерина, стерилизуют.
4. Среда Сотона — жидкая синтетическая среда содержит аспарагин, глицерин, лимонную кислоту, гидрофосфат калия, сульфат магния, дигидрофосфат натрия, цитрат аммиачного железа.
6. Антигенная структура
Микобактерии туберкулеза имеют сложный и мозаичный набор антигенов. Вирулентность туберкулезных микобактерии в значительной степени обусловлена строением их трехслойных клеточных стенок, представленных жирными кислотами, восками, сульфолипидами, а главное — миколовыми кислотами и их производными. Миколовые кислоты обуславливают кислотоустойчивость микобактерии, участвуют в формировании комплекса пептидогликан-арабиногалактат-миколовая кислота. Этот комплекс образует прочный каркас клеточной стенки микобактерии. При нахождении микобактерии внутри клеток (они являются факультативными внутриклеточными паразитами) они покрываются защитным восковым налетом. У микобактерии обнаружена полисахаридная микрокапсула.
МБТ выделяют токсины и эндотоксин.
7. Биохимические свойства
Микобактерии туберкулеза имеют достаточно выраженную биохимическую активность. Ферменты эстераза и липаза расщепляют жиры; дегидраза — органические кислоты, в том числе аминокислоты; уреаза — мочевину, перигалоза — углеводы, каталаза — переоксид водорода; протеолитические ферменты (протеаза) — белок. Микобактерии ферментируют алкоголь, глицерин и многочисленные углеводы, лецитин, фосфатиды. У молодых культур микобактерий туберкулеза сильно выражены редуцирующие свойства, что, в частности, проявляется в их способности восстанавливать теллурит.
8. Факторы патогенности
А. Липидные фракции, входящие в состав клеточной стенки.
1. Корд-фактор — основной фактор патогенности. Это токсический гликолипид — эфир трегалозы и 2-х остатков миколовой кислоты (трегалоза-6,6-димиколат). Корд-фактор является фактором адгезии и колонизации, антифагоцитарным фактором, оказывает токсическое действие на митохондрии после проникновения в клетки хозяина, нарушает окислительные процессы в тканях. Корд-фактор содержат только вирулентные бактерии. Он расположен на поверхности клеточной стенки туберкулезных микобактерий, способствуя их гидрофобности, тесному склеиванию между собой, расположению в виде «жгутов». Выявляется при микрокультивировании по методу Прайса.
2. Воск Д — пептидогликолипид, содержащий миколовые кислоты, является антифагоцитарным фактором.
3. Сульфолипиды — располагаются в наружном слое клеточной стенки и в сочетании с димикоцерозат-фтиоцеролом (воск С) рассматриваются как фактор патогенности, так как способствует выживанию микобактерий внутри макрофагов, угнетают выделение лизосомальных ферментов.
4. Ацетонрастворимые липиды — усиливают иммунодепрессивные свойства микобактерий, при участии туберкулина способны модифицировать мембраны клеток организма таким образом, что иммунные силы организма принимают эти клетки за инфицированные и разрушают их (вместо того, чтобы направлять свое действие на инфицированные туберкулезными микобактериями клетки).
Б. Белковые факторы микобактерий туберкулеза.
5. Туберкулин — комплекс веществ, высвобождающихся при распаде туберкулезных микобактерий. Туберкулин не токсичен для здоровых людей. Он состоит из нескольких белковых фракций и содержит высокомолекулярные полисахариды. Это основной антиген, против которого направлен иммунный ответ инфицированного организма. Туберкулин обладает выраженными свойствами аллергена и токсичен только для инфицированных и больных туберкулезом людей и животных, у которых развилось состояние гиперчувствительности замедленного типа (ГЗТ), как форма клеточного иммунного ответа. По своим антигенным свойствам туберкулин имеет сходство с антигенами главного комплекса гистосовместимости человека (HLA). Это сходство у разных людей выражено в разной степени. Чем такое сходство больше, тем более человек восприимчив к туберкулезной инфекции, тем менее выражен иммунный ответ, ГЗТ не развивается. Таким образом, имеется генетическая предрасположенность к туберкулезной инфекции и ее хроническому течению.
9. Патогенез
В патогенезе заболевания различают два периода: первичный и вторичный. Туберкулезные микобактерий проникают аэрогенным путем в дыхательный тракт, вплоть до альвеол, где они фагоцитируются альвеолярными макрофагами, в которых долго остаются жизнеспособными. Незавершенный фагоцитоз связан с наличием у микобактерий антифагоцитарных факторов. Основной из них — корд-фактор, который повреждает мембраны митохондрий макрофагов, нарушает процесс слияния фагосом с лизосомами, а также оказывает токсическое действие на полиморфноядерные фагоциты. Таким образом, часто первая линия защиты — фагоцитоз — оказывается несостоятельной и развивается первичный туберкулез. Он характеризуется формированием специфического туберкулезного воспалительного очага или мелких очажков — туберкулезных гранулем, имеющих сходное строение. Воспаление распространяется на отходящие лимфатические пути и региональный лимфатический узел, образуя первичный комплекс: гранулематозный воспалительный очаг + лимфангоит + лимфаденит. Воспалительный туберкулезный очаг (гранулема) содержит характерные элементы: в центре формируется творожистый некроз, окруженный эпителиоидными клетками (образуются из гистиоцитов и макрофагов) и клетками Пирогова-Лангерганса. (образующиеся из эпителиоидных клеток при их слиянии или при пролиферации макрофагов). Туберкулезные микобактерии находятся в воспалительном очаге как внеклеточно, так и внутри клеток. Очаг (гранулема) содержит также лимфоидные клетки и нейтрофилы, располагающиеся ближе к периферии. При заживлении воспалительного очага творожистые массы кальцинируются, вокруг очага образуется капсула из соединительной ткани, но внутри могут остаться жизнеспособные микобактерий, часто в виде L-форм. Такие зажившие очаги называются очагами Гона. Они формируются в легочной ткани и внутригрудных лимфоузлах. На этом первичный период может закончиться, но бывает и менее благоприятное течение. Воспалительные очаги в легких и лимфоузлах могут приобретать более распространенный характер, захватывать бронхи и плевру. Вследствие лимфо-и гематогенного заноса возбудителей в другие ткани и органы в них тоже возможно формирование постпервичных гранулематозных очагов. При достаточной напряженности иммунитета первичный период часто заканчивается клиническим выздоровлением и заболевание больше не возобновляется. Этому способствует своевременно проведенная, полноценная химиотерапия.
Реже отмечается возврат болезни с развитием вторичного туберкулеза. Вторичный период легочного туберкулеза может возникать через различные сроки после первичного туберкулеза и рассматривается как эндогенная инфекция. При этом происходит реактивация старых очагов на фоне сниженного иммунитета. Преимущественно заболевают люди зрелого и пожилого возраста. Для вторичного туберкулеза характерно хроническое волнообразное течение болезни с периодами обострения и улучшения состояния. При отсутствии или недостаточности лечения развиваются множественные воспалительные очаги в легких, бронхах, внутригрудных лимфоузлах, в процесс может вовлекаться плевра.
10. Иммунитет
Человек обладает определенной естественной резистентностью к туберкулезной инфекции. Часто возбудители туберкулеза, попав в организм еще в детском возрасте, не вызывают видимых проявлений инфекции, за исключением виража туберкулиновой пробы. Тем не менее, возникает приобретенный иммунитет, развивается ГЗТ. Сходная картина наблюдается и после иммунизации живой вакциной BCG /БЦЖ.
Иммунитет при туберкулезе носит преимущественно клеточный характер, имеют значение и антитела. Фагоцитоз, ГЗТ и антитела осуществляют комплексное защитное действие. Каждый из этих механизмов в отдельности не может обеспечить состояние иммунитета. Фагоцитоз возбудителей, осуществляемый макрофагами, является незавершенным. С развитием ГЗТ и появлением специфических антител эффективность фагоцитоза повышается. Иммунные лимфоциты также участвуют в разрушении туберкулезных микобактерий: Т-лимфоциты при участии белков главной системы гистосовместимости класса I распознают клетки, инфицированные микобактериями туберкулеза, атакуют и разрушают их.
Иммунитет при туберкулезе считается нестерильным, т.е. для поддержания состояния иммунитета необходимо присутствие живых туберкулезных микобактерий (вирулентных или вакцинного штамма BCG).
11. Методы лабораторной диагностики
Применяют микроскопический, бактериологический (основной), биологический, серологический методы, кожные аллергические пробы, ПЦР.
Исследуемые материалы многообразны и зависят от локализации туберкулезных поражений, а именно: мокрота, бронхо-легочные аспираты, плевральная жидкость, ликвор, моча, костный мозг, гной, кровь и др. В данном пособии лабораторная диагностика разбирается на примере исследования мокроты.
А. Микроскопическое исследованиеявляется предварительным, так как не дает возможности надежно дифференцировать возбудителей туберкулеза от других микобактерий. Существует несколько вариантов микроскопического исследования.
Прямая микроскопия исследуемого материала. Готовят мазки, растирая гнойный комочек мокроты между предметными стеклами, и окрашивают их по способу Циля-Нильсена. При микроскопии хорошо видны рубиново-красные кислотоустойчивые микобактерии на общем голубом фоне мокроты, некислотоустойчивые бактерии и форменные элементы имеют синий цвет. Для положительного заключения необходимо просмотреть 100 полей зрения, указав количество обнаруженных в них кислотоустойчивых бактерий. Прямая микроскопия — это сравнительно малочувствительный метод, позволяющий обнаружить микобактерии при их содержании в мокроте не менее 100000 клеток/мл.
Непрямая микроскопия предварительно обогащенного материала. Методы обогащения основаны на принципе извлечения микобактерии из мокроты и их концентрации в малом объеме.
а) Гомогенизация.В банку с мокротой, собранной в течение суток, добавляют 1 % раствор NaOH и энергично встряхивают в шюттель-аппарате. Гомогенизированную мокроту центрифугируют при 3000 об/мин, осадок нейтрализуют, добавив 1 -2 капли 10% раствора НСl. Мазки из осадка окрашивают по Цилю-Нильсену.
б) Флотация.Гомогенизированную мокроту помещают в колбу, добавляют 1-2 мл ксилола (или бензола) и встряхивают в течение 10 минут, доливают дистиллированную воду до горлышка колбы и дают отстояться. В горлышке колбы образуется сливкообразный слой, состоящий из всплывших мельчайших капелек ксилола с сорбированными на них микобактериями. Из этого слоя готовят мазки на предметном стекле путем повторного наслаивания и окрашивают их по Цилю-Нильсену.
Методы обогащения повышают вероятность обнаружения микобактерии на 10%.
Люминесцентная микроскопия. Основана на способности липидов микобактерий поглощать люминесцентные красители и светиться в люминесцентном микроскопе. Мазки, приготовленные из осадка гомогенизированной мокроты (или флотационные мазки), окрашивают водным раствором флюоресцентных красителей — ауромин + родамин С — и микроскопируют в люминесцентном микроскопе с объективом х40, х90, х100. Туберкулезные микобактерии светятся золотисто-желтым светом на темно-зеленом фоне, нетуберкулезные микобактерии дают зеленое свечение. Люминесцентная микроскопия повышает вероятность выявления микобактерии на 17%, т.е. наиболее чувствительна из микроскопических методов.
Б. Микрокультивирование — метод Прайса.Ускоренный метод, сочетающий микроскопическое исследование с элементами бактериологического метода (предварительное микрокультивирование). Дает возможность выявить туберкулезные микобактерии при их малом содержании, а также наличие у них корд-фактора и тем самым доказать их вирулентность. Этапы микрокультивирования микобактерий туберкулеза по методу Прайса:
1. приготовление мазка из осадка (центрифугата) гомогенизированной мокроты или флотационного слоя;
2. обработка мазков серной кислотой для уничтожения посторонней микрофлоры;
3. промывают мазки стерильной дистиллированной водой;
4. инкубация нескольких стекол с мазками в пробирке с жидкой синтетической питательной средой (или разведенной цитратной кровью);
5. ежедневное окрашивание по одному мазку способом Циля-Нильсена.
При проведении иммерсионной микроскопии вирулентные туберкулезные микобактерии, содержащие корд-фактор, образуют микроколонии из тесно склеенных между собой рубиново-красных палочек в виде изогнутых «жгутов» или «кос». Микроколонии невирулентных туберкулезных микобактерии представляют собой беспорядочные рыхлые скопления бактериальных клеток.
В. Бактериологическое исследование является основным методом, позволяющим получить чистую культуру возбудителя туберкулеза, идентифицировать ее и определить лекарственную устойчивость (степень ее чувствительности) к химиотерапевтическим противотуберкулезным препаратам. Бактериологическим методом удается выделять микобактерий при их концентрации от 20-100 живых бактерий в 1 мл клинического материала. Основной недостаток — длительность исследования.
Исследуемый материал подвергают предварительной обработке (обогащению) для концентрации микобактерий и уничтожения посторонней микрофлоры. Мокроту обрабатывают щелочью (2% раствор NaCl) или кислотой (10% раствор H2SO4) подвергая встряхиванию, затем центрифугируют. Полученный осадок нейтрализуют и засевают в несколько пробирок с яичной средой Левенштейна-Йенсена. Используют и другие среды — яичную среду Финна II, картофельно-глицериновую, жидкую среду Сотона. Засеянные пробирки плотно укупоривают во избежание высыхания и инкубируют при 37°С до 2-3 месяцев, еженедельно просматривая. Видимый рост появляется, начиная с 10-12-14 дней и позже.
Ниациновая проба — ценный тест, с помощью которого M.tuberculosis дифференцируют от M.bovis и нетуберкулезных микобактерий. Только M.tuberculosis способны синтезировать никотиновую кислоту (ниацин) при культивировании на яичных средах. Для выявления ниацина к выросшей культуре добавляют растворы 10% цианистого бромида и 4% анилина. В положительном случае появляется ярко-желтое окрашивание.
Кроме того, у чистой культуры изучают скорость роста, образование пигмента (на свету или в темноте), способность к росту при 20-25°С и к росту на простых питательных средах, наличие каталазы и пероксидазной активности и некоторые другие биологические пробы. Эти пробы позволяют дифференцировать возбудителей туберкулеза.
У выделенных культур туберкулезных микобактерий в обязательном порядке определяют степень лекарственной устойчивости к противотуберкулезным химиопрепаратам. Для этой цели культуру засевают в пробирки со средой Левенштейна-Йенсена, в которые перед свертыванием были внесены различные концентрации химиопрепаратов. Окончательную оценку проводят после 3-х недель инкубации. Учитывают отсутствие роста или степень его интенсивности в присутствии различных концентраций химиопрепаратов. Полученные результаты используют для назначения рациональной химиотерапии.
Г. Биологический метод в настоящее время применяют редко в диагностике туберкулеза легких, чаще всего при диагностике туберкулеза почек. Материалом от больного заражают лабораторных животных (морских свинок, чувствительных к M.tuberculosis, кроликов, восприимчивых к M.bovis), Наблюдают за животными в течение 1-2 месяцев до их гибели. С 5-10 дня после заражения можно исследовать пунктат лимфатических узлов.
Д. Серологический метод проводят для выявления антител в сыворотках больных туберкулезом или микобактериозом, а также для обнаружения антигенов микобактерий в исследуемом материале. С этой целью используют различные серологические реакции, такие как РСК, РИГА, РИА, ИФА.
Е. Кожно-аллергическая проба (туберкулинодиагностика) выявляет ГЗТ, развивающуюся у вакцинированных вакциной БЦЖ, инфицированных и больных туберкулезом. Осуществляется с помощью препаратов туберкулина, который вводят накожно или внутрикожно.
Проба Манту — внутрикожная проба — применяется как основной метод туберкулинодиагностики при массовых ежегодных обследованиях. Ее назначение:
— отбор контингентов лиц для ревакцинации БЦЖ;
— перед первичной вакцинацией детей в возрасте 2 месяцев и более;
— для диагностики туберкулеза, в том числе для раннего выявления начальных и локальных форм туберкулеза у детей и подростков;
— для определения инфицирования микобактериями туберкулеза.
При постановке пробы Манту туберкулин вводят на внутреннюю поверхность предплечья строго внутрикожно. Учитывают реакцию через 72 часа. Гиперемия учитывается только в случае отсутствия инфильтрата.
Проба Манту считается отрицательной при наличии только уколочной реакции (0-1 мм), сомнительной при гиперемии без папулы или наличии папулы диаметром 2-4 мм; положительной — при папуле диаметром 5 мм и более.
12. Лечение и профилактика
Специфическая профилактика осуществляется вакциной БЦЖ (BCG — Bacillus Calmette-Guérin). Вакцина БЦЖ и БЦЖ-М (со сниженной антигенной нагрузкой) содержит живые, ослабленные микобактерии вакцинного штамма БЦЖ-1, лиофильно высушенные в 1,5% растворе натрия глютамината. Вакцина была получена А.Кальметтом и М.Гереном из штамма M.bovis длительным пассированием (230 пересевов в течение 13 лет) на картофельно-глицериновой среде с добавлением желчи (метод аттенуации). Штамм сохранил остаточную вирулентность.
Вакцинацию проводят всем новорожденным на 5-6 день в роддоме внутрикожно. Ревакцинацию проводят в 7 лет и далее с интервалом в 5 лет до 30 летнего возраста при отрицательных туберкулиновых пробах.
Лечение туберкулеза проводится химиопрепаратами (антибиотиками и синтетическими препаратами). Их подразделяют на препараты первого ряда (изониазид, этамбутол, стрептомицин, пиразинамид, рифампицин и др.) и альтернативные (канамицин, циклосерин, ПАСК, этионамид и др.)
1. Классификация и таксономия
Дифтерия — острое инфекционное заболевание, характеризующееся фибринозным воспалением на месте входных ворот (чаще всего глотки) и тяжелой интоксикацией организма с преимущественным поражением сердца, почек и нервной системы.
Возбудителем дифтерии является Corynebacterium diphtheriae, который относится к домену Bacteria, типу Actinomycetеae, порядку Actinomycetales, классу Actinobacteria, семейству Corynebacteriaceae, отделу Firmicutes, роду Corynebacterium (старое название BL — бацилла Леффлера).
2. Нозологические формы
Дифтерия как заболевание выделена в самостоятельную нозологическую форму.
Клиническая классификация дифтерии подразделяет заболевание на следующие формы с вариантами течения заболевания:
1. Дифтерия ротоглотки: дифтерия ротоглотки локализованная с катаральным, островчатым и плёнчатым вариантами; дифтерия ротоглотки распространённая; дифтерия ротоглотки субтоксическая; дифтерия ротоглотки токсическая (I, II и III степеней); дифтерия ротоглотки гипертоксическая.
2. Дифтерийный круп: дифтерия гортани (дифтерийный круп локализованный); дифтерия гортани и трахеи (круп распространённый); дифтерия гортани, трахеи и бронхов (нисходящий круп).
4. Дифтерия половых органов.
7. Комбинированные формы с одновременным поражением нескольких органов.
3. Эпидемиология и пути передачи
Источником инфекции при дифтерии является человек (больной, реконвалесцент, бактерионоситель); наибольшую эпидемическую опасность представляют больные лица. Реконвалесценты выделяют дифтерийную палочку в течение 15-20 суток. Основной путь передачи дифтерийной палочки — воздушно-капельный; также возможно заражение через предметы, используемые больным, и инфицированные пищевые продукты (обычно молоко).
4. Морфология и тинкториальные свойства
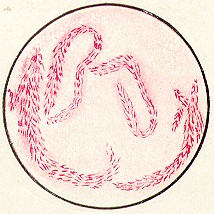
Возбудитель дифтерии Corynebacterium diphtheriae — это палочки, с колбовидными вздутиями на концах, что придает микробу сходство с булавой, длинной 1-6 мкм, толщиной 0,3-0,8 мкм. Отличительные признаки: наличие включений волютина на концах клеток (тельца Бабеша-Эрнета) и расположение бактерий в микропрепарате под углом — в виде латинских букв V, Y, L, «растопыренных пальцев». Живые микробы неподвижны, жгутиков не имеют, спор не образуют, характеризуются наличием пили и микрокапсулы. Грамположительны.
У Corynebacterium diphtheriae выделяют три биовара — gravis, mitis и intermedius. Бактерии биовара дифтерииgravis — короткие неправильной формы, с небольшим количеством метахроматических гранул. Биовар дифтерииmitis образуют длинные изогнутые полиморфные палочки, содержащие много волютиновых зёрен (тельца Бабеша-Эрнста). Бактерии биовара дифтерииinmtermedius наиболее крупные, с бочковидными очертаниями; для них характерны поперечные перегородки, разделяющие клетку на несколько сегментов. В настоящее время биовар дифтерии intermedius относят в группу gravis.
5. Питательные среды и культуральные свойства
Бактерии хорошо развиваются при свободном доступе кислорода, при температуре от 15 до 40ºС. Могут расти на обычных питательных средах, но лучше и с характерной морфологией развиваются на средах, содержащих кровь или сыворотку любого вида животного.
Среды должны содержать в качестве источников азота аминокислоты: β-аланин, цистин, метионин, валин и др. Дифтерийная палочка способна восстанавливать металлический теллур из его солей. Теллурит калия является ингибитором микрофлоры, встречающейся в зеве.
1. Кровяной теллуритовый агар (КТА) состоит из питательного агара, 2% раствора теллурита калия и дефибринированной или гемолизированной лошадиной или бычьей крови (10%). Колонии C.diphtheriae появляются через 18-24 часа черного цвета или серого с черным центром.
2. Среда Клауберга II состоит из питательного агара, 2% раствора теллурита калия, глицерина, гемолизированной крови. Через 24 часа вырастают матово-черные, неслившиеся плоские колонии, Через 48-72 часа возможна их дифференциация на биотипы. Тип gravis образует серовато-черные колонии с несколько изрезанными краями, колонии типа mitis растут в виде мелких блестящих серовато-черных колоний с ровными краями.
3. Свернутая сыворотка — среда Ру — представляет собой чистую сыворотку крови любого происхождения. Ее разливают по 3 мл в пробирки и в наклонном положении пробирки нагревают в течение 1 часа при 80°С для свертывания. Колонии на среде Ру вырастают через 12-18 часов мелкие, диаметром 0,5-1,0 мм, круглые, суховатые, кремово-желтого цвета, не сливающиеся даже при сплошном посева.
6. Антигенная структура
Дифтерийные бактерии имеют довольно сложную антигенную структуру и серологически неоднородны. Выделяют О-и К-антигены. Полисахаридные компоненты О-антигенов клеточной стенки обладают межродовыми свойствами, обусловливая неспецифические перекрестные реакции с микобактериями, актиномицетами (нокардиями). Поверхностные К-антигены — капсульные белки, обладают видовой специфичностью и иммуногенностью.
7. Биохимические свойства
Дифтерийная палочка вырабатывает кислоту без газообразования в средах с глюкозой, мальтозой и галактозой, но не с лактозой, сахарозой и маннитом. Сбраживание крахмала и гликогена считают характерной особенностью типа gravis. Многие штаммы дают гемолиз на кровяном агаре и лизируют эритроциты, добавленные к культуре.
Дифтерию вызывают только токсичные штаммы, обладающие способностью продуцировать экзотоксины. Степень токсичности дифтерийных микробовможет быть различной. Единицей измерения силы токсина служит минимальная смертельная доза (DLM) — наименьшее количество токсина, убивающее морскую свинку массой 250 г в течение 3-4 суток. Кроме экзотоксина дифтерийная палочка продуцирует дермонекротоксин, гемолизин, нейраминидазу и гиалуронидазу.
Синтез дифтерийного токсина микробными клетками детерминирован специальным геном tox, локализующимся в ДНК лизогенного фага. Токсин продуцируют крупных размеров особи возбудителя, в которых отмечается спонтанная продукция фага. Генетические структуры, управляющие синтезом дифтерийного токсина, функционируют независимо от всех органоидов, обеспечивающих жизнедеятельность микробов. В связи с этим коринебактерии могут терять ген tox, и, собственно, патогенные свойства.
8. Факторы патогенности
1.Факторы адгезии и колонизации, которые до настоящего времени не идентифицированы. Возможно, эти функции выполняют: пили, микрокапсула, компоненты клеточной стенки, с помощью которых C.diphtheriae прикрепляются к эпителиоцитам слизистой и колонизируют их.
2.Инвазивные свойства связаны с гиалуронидазой, нейраминидазой и гемолизином, которые участвуют в развитии некротических процессов слизистой оболочки и разжижении основного вещества соединительной ткани.
3.Дифтерийный токсин (гистотоксин) — основной фактор патогенности. Подобно многим бактериальным токсинам, он состоит из фрагментов А и В, выполняющих, соответственно ферментативную и рецепторную функции. Фрагмент В связывается с белковыми рецепторами на клетке-мишени, способствуя проникновению в нее фрагмента А, который обладает НАД-гликогидролазной и АДФ-рибозилтрансферазной активностью. Действуя внутриклеточно, фрагмент А расщепляет НАД и инактивирует фактор элонгации-2, который отвечает за построение пептидных цепей на рибосомах в эукариотических клетках. В результате прекращается биосинтез белка и наступает гибель клеток.
4. Корд-фактор (димиколат трегалозы) нарушает процессы дыхания в митохондриях эукариотических клеток, прежде всего в фагоцитах, обладает антифагоцитарной активностью.
9. Патогенез
Входные ворота инфекции — слизистые оболочки носоглотки, гортани, в редких случаях слизистая оболочка глаза, поврежденная кожа. В подавляющем большинстве случаев входными воротами является слизистая оболочка глотки и развивается дифтерия зева. При дифтерии зева процесс может распространиться на нижележащие дыхательные пути или пойти вверх, поражая слизистые оболочки носа и среднего уха. В зависимости от тяжести заболевания, различают три формы этой инфекции: локализованную, распространенную и токсическую.
C.diphtheriae прикрепляются к поверхности эпителия миндалин и окружающих тканей мягкого неба (адгезия) и, колонизируя эту область, продуцируют дифтерийный гистотоксин и другие факторы патогенности, что приводит к развитию фибринозно-некротического фарингита и общей интоксикации организма больного.
Дифтерийный токсин вызывает гибель клеток эпителия, подавляет фагоцитоз, повреждает эндотелий сосудов субэпителиальной ткани. Происходит обильная экссудация плазмы на поверхность некротизированного эпителия, где содержащийся в плазме фибриноген превращается в фибрин. Образуется толстая серовато-белая пленка (псевдомембрана), тесно спаянная с подлежащей тканью. Такой тип воспаления называют дифтеритическим. Пленка состоит из сгустков фибрина, некротизированной ткани, содержит множества дифтерийных бактерий, которые здесь защищены от воздействий факторов иммунитета и имеют прекрасные условия для размножения и выработки токсина.
Развитию процессов некротизации эпителия способствуют ферменты, вырабатываемые C.diphtheriae.
10. Иммунитет
Иммунитет после перенесенной дифтерии отличается значительной стойкостью, носит преимущественно антитоксический характер. В последнее время уделяется внимание и антибактериальному иммунитету, его роли в предотвращении развития инфекции на начальном этапе и в противодействии формированию бактерионосительства.
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
Папиллярные узоры пальцев рук — маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.
Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ — конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.
источник
Вопросы для самоподготовки:
Возбудитель туберкулеза, его основные свойства, патогенез, лечение и профилактика туберкулеза. Методы микробиологической диагностики туберкулеза.
Возбудители дифтерии, их свойства, отличия от дифтероидов и ложнодифтерийных бактерий. Патогенез, лечение, профилактика и микробиологическая диагностика дифтерии.
Возбудители коклюша, их свойства. Патогенез, лечение, профилактика и микробиологическая диагностика коклюша.
Туберкулез – первично хроническое заболевание человека и животных, сопровождающееся поражением различных органов и систем (органов дыхания, лимфатических узлов, кишечника, костей, суставов, глаз, кожи, почек и мочевыводящих путей, половых органов, ЦНС).
Возбудители туберкулеза относятся к семейству Mycobacteriaceae, роду – Mycobacterium. Заболевание вызывается 3 видами:
M. tuberculosis – человеческий вид (в 92% случаев),
M. вovis – бычий вид (в 5% случаев),
M. аfricanum – промежуточный вид (в 3% случаев).
Морфологические и культуральные свойства.
— прямые или изогнутые палочки,
— грамположительны (но из-за большого содержания липидов в клеточной стенке плохо воспринимают красители),
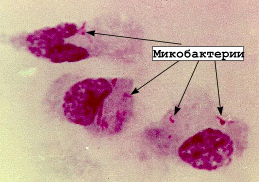
— чаще применяют окраску по Цилю–Нильсену, при этом микобактерии обнаруживаются в препаратах в виде ярко-красных кислотоустойчивых палочек, расположенных поодиночке или небольшими скоплениями.
— в состав клеточной стенки входят миколовая, фтионовая, туберкулостеариновая и другие жирные кислоты.
Родовой признак микобактерий – кислото-, спирто- и щелочеустойчивость.
Рис.Туберкулезные палочки в чистой культуре (рисунок)
Рис. Мазок из чистой культуры M. вovis Рис. M.tuberculosis в мазке
(окраска по Цилю-Нильсену) из мокроты (окраска по Цилю-Нельсену)
Растут на сложных питательных средах, содержащих яйца, глицерин, картофель, аспарагин, витамины, соли. Для подавления токсического действия образуемых в процессе метаболизма жирных кислот к средам добавляют активированный уголь или сыворотки животных, для подавления роста сопутствующей микрофлоры – красители (малахитовый зеленый) и антибиотики, не действующие на микобактерии. Элективной средой является среда Левенштейна–Йенсена.
При внутриклеточном размножении, а также при росте на жидких питательных средах и микрокультивировании на стеклах в жидкой среде (метод микрокультур Прайса) через 48–72 ч у вирулентных штаммов выявляется корд-фактор, благодаря которому микобактерии склеиваются и растут в виде «жгутов» или «кос».
Рис. Корд-фактор M.tuberculosis: палочки, Рис. Незавершенный фагоцитоз микобактерий
расположены в виде «косы», жгутов (окраска по Цилю-Нильсену)
В отличие от условно-патогенных микобактерий, M. tuberculosis и M. bovis в большом количестве образуют никотиновую кислоту (ниацин), которая накапливается в жидкой питательной среде.
В отличие от M. bovis, M. tuberculosis обладают способностью редуцировать нитраты в нитриты.
К факторам патогенности микобактерий относятся компоненты клеточной стенки бактерий: туберкулопротеины, липиды и их комплексы.
— Туберкулопротеины являются основными носителями антигенных свойств микобактерий, они – высокотоксичны и вызывают развитие гиперчувствительности 4-го типа.
— Липиды (миколовая и фтионовая кислоты, корд-фактор) вызывают развитие гранулем, подавляют активность фагоцитарных клеток.
— Корд-фактор – это гликолипид, состоящий из трегалозы и димиколата. Он разрушает митохондрии клеток инфицированного организма, чем нарушает функцию дыхания.
Экзотоксины микобактерии не образуют.
Устойчивость в окружающей среде.
В естественных условиях при отсутствии солнечного света жизнеспособность микобактерий сохраняется в течение нескольких месяцев, при рассеянном свете – погибают через 1-1,5 мес.
В уличной грязи они сохраняются до 4 мес., в речной воде – до 7 мес., в сточной воде – до 15 мес., в навозе – до 2-х лет.
При кипячении они погибают через 5 мин, при пастеризации – в течение 30 мин, под воздействием ультрафиолетовых лучей – через 2-3 мин.
Возбудители туберкулеза устойчивы к действию дезинфицирующих веществ. Для дезинфекции используются активированные растворы хлорамина и хлорной извести, вызывающие гибель бактерий в течение 3-5 ч.
1.Основной — больной туберкулезом органов дыхания человек, выделяющий микробы в окружающую среду с мокротой.
2. Второстепенную роль играют больные сельскохозяйственные животные (крупный рогатый скот, верблюды, свиньи, козы, овцы) и люди, страдающие внелегочными формами туберкулеза (пищеварительного тракта или урогенитальной системы) и выделяющие микробактерии с мочой и калом.
Основной механизм заражения – аэрогенный с соответствующими ему воздушно-капельным и воздушно-пылевым путями передачи инфекции. Входными воротами при этом могут быть слизистая оболочка полости рта, миндалин, бронхи и легкие.
Реже заражение туберкулезом может происходить пищевым путем при употреблении термически не обработанных мясных или молочных продуктов, что особенно характерно для заболеваний, вызванных M. bovis, чаще поражающих детей.
Возможен контактный путь передачи инфекции от больных туберкулезом через поврежденные кожные покровы и слизистые оболочки при использовании инфицированной одежды больных, игрушек, книг, посуды. Известны случаи заражения людей при уходе за больными животными. Описаны редкие случаи заражения хирургов, паталогоанатомов, мясников.
Возможен и трансплацентарный путь передачи, но он, как правило, не реализуется вследствие тромбоза кровеносных сосудов плаценты в местах поражения. Внутриутробное заражение плода может происходить не только через пупочную вену и плаценту, но и при заглатывании амниотической жидкости, содержащей микобактерии.
Организм человека обладает высокой устойчивостью к действию патогенных микобактерий, поэтому большое значение для возникновения заболевания имеют длительность контакта с источником инфекции, массивность инфицирования, вирулентность микобактерий и снижение резистентности макроорганизма.
Инкубационный период длится от 3-8 недель до 1 года и более (40 лет). Возбудитель в течение длительного времени сохраняется в фагоцитирующих клетках региональных лимфатических узлов.
В развитии заболевания выделяют первичный туберкулез, диссеминированный и вторичный.
Первичный туберкулез возникает у ранее неинфицированных людей и характеризуется выраженными токсикоаллергическими осложнениями и некротическими изменениями в тканях, возникающими на фоне высокой чувствительности макроорганизма к возбудителям туберкулеза. Для него характерна гематогенная диссеминация.
В зоне проникновения и размножения бактерий возникает специфический воспалительный очаг – инфекционная гранулема. Затем развивается специфический воспалительный процесс в региональных лимфатических узлах и наблюдается сенсибилизация организма — формируется первичный туберкулезный комплекс. Обычно первичный очаг имеет доброкачественное течение, он рассасывается, пораженный участок кальцинируется и рубцуется. Но бактерии полностью не уничтожаются. В первичном очаге и лимфатических узлах они могут сохраняться долгие годы и при неблагоприятных условиях может произойти активация возбудителя и генерализация процесса.
Из первичного туберкулезного комплекса микобактерии разносятся:
в результате чего образуются очаги в других органах и тканях и возникает диссеминированный легочный или внелегочный туберкулез.
Вторичный туберкулез возникает у ранее инфицированных людей, процесс, чаще всего, локализуется в каком-либо органе. Возникновение вторичного туберкулеза – результат активации старых эндогенных очагов или нового экзогенного заражения возбудителями туберкулеза (суперинфекция) вследствие тесного контакта с бактериовыделителем.
Различают 3 клинические формы заболевания: первичная туберкулезная интоксикация у детей и подростков, туберкулез органов дыхания, туберкулез других органов и систем.
Чаще всего возникает туберкулез органов дыхания (легких и внутригрудных лимфатических узлов). Он проявляется субфебрильной температурой тела, кашлем с мокротой, кровохарканьем, одышкой. Симптомов, характерных только для туберкулеза, нет.
В отличие от M. tuberculosis, M. bovis чаще поражает детей и вызывает такие внелегочные формы заболевания, как туберкулез периферических лимфатических узлов и мочеполовых органов, туберкулез костей и суставов, сопровождающиеся лекарственной устойчивостью к изониазиду.
Иммунитет нестерильный, что обусловлено длительной персистенцией L-форм бактерий в макроорганизме. Он появляется через 4-8 недель после попадания микробов в макроорганизм.
Материалом для исследования служит мокрота.
Обязательными методами микробиологической диагностики туберкулеза являются бактериоскопическое и бактериологические исследования, биопроба и туберкулинодиагностика. Обнаружение в патологическом материале возбудителей является прямым доказательством активности инфекционного процесса.
Бактериоскопическое исследование. Из материала готовят мазки, окрашивают по Цилю–Нильсену и микроскопируют. В препаратах обнаруживают единичные или слипшиеся по 2-3 красные палочки, если в 1 мл мокроты их содержится не менее 10 4 -10 5 бактериальных клеток (предел метода). При получении отрицательных результатов прибегают к методам обогащения материала: гомогенизации и флотации.
Метод гомогенизации: к суточной порции мокроты добавляют равный объем 1% раствора едкого натра, флакон закрывают пробкой и встряхивают 10-15 мин, центрифугируют, нейтрализуют кислотой и из осадка готовят мазок.
Чаще применяют метод флотации: мокроту гомогенизируют и прогревают при 55 0 С 30 мин на водяной бане. Затем добавляют 1-2 мл ксилола, дистиллированную воду и повторно встряхивают в течение 10 мин. Оставляют стоять 25-30 мин при комнатной температуре. На поверхности образуется пена, состоящая из всплывших капелек ксилола с адсорбированными бактериями. Мазок готовят из пенообразного слоя, несколько раз наслаивая материал на стекло. Метод флотации на 10% повышает обнаружение микобактерий в патологическом материале.
Широкое распространение получил высокочувствительный метод люминесцентной микроскопии, основанный на способности липидов микобактерий воспринимать люминесцентные красители и светиться при облучении ультрафиолетовыми лучами.
Бактериологическое исследование является основным методом диагностики туберкулеза Исследуемый материал перед посевом в течение нескольких минут подвергают действию 10% серной кислоты или 4-6% едкого натра для освобождения от сопутствующей микрофлоры, затем тщательно встряхивают и центрифугируют. Осадок нейтрализуют и засевают в несколько пробирок со средой Левенштейна–Йенсена. Посевы инкубируют при 37 0 С 4-6 нед и более, просматривая посевы 1 раз в неделю. Выделенную культуру микобактерий туберкулеза дифференцируют от условно-патогенных микобактерий по морфологическим, тинкториальным, биохимическим свойствам и др.
Из биохимических свойств чаще всего определяют способность исследуемой культуры синтезировать никотиновую кислоту (ниациновая проба). Для определения ниацина к культуре микобактерий в жидкой питательной среде добавляют 1 мл КСN и 1 мл 5% раствора хлорамина. При наличии ниацина через несколько минут появляется ярко-желтая окраска. После учета результатов для нейтрализации КСN в пробирки добавляют 3-5 мл 10% гидрокарбоната натрия.
2.А. Для ускорения диагностики используют метод микрокультур Прайса. На нескольких предметных стеклах делают толстые мазки из исследуемого материала, высушивают, обрабатывают несколько минут 2-6% серной кислотой и нейтрализуют. Затем стекла опускают во флаконы с гемолизированной цитратной кровью в разведении 1/4-1/8 и ставят в термостат. Через 4-14 дней извлекают стекла, фиксируют препарат, окрашивают по Цилю–Нильсену и микроскопируют. Вирулентные штаммы образуют микрокультуры, имеющие вид кос или жгутов.
2.Б. Определение лекарственной устойчивости микобактерий проводят перед началом лечения, спустя 3 мес. и далее при продолжающемся выделении бактерий туберкулеза через каждые 6 мес. методом серийных разведений.
С этой целью по 0,1 мл взвеси микобактерий засевают в пробирки со средой Левенштейна–Йенсена, содержащей различные концентрации антибактериальных препаратов: 5, 10, 50 мкг/мл стрептомицина, 1, 5, 10, 25 мкг/мл тубазида и т.п. Результаты исследования учитывают по истечении определенного срока выращивания, достаточного для получения обильного роста в контрольных пробирках.
Устойчивость штамма выражается максимальной концентрацией антибактериального препарата (количество микрограммов в 1 мл питательной среды), при которой еще наблюдается рост, приближающийся к росту в контроле.
Биологический метод является наиболее надежным при выявлении микобактерий туберкулеза, он позволяет обнаружить от 1 до 5 микробных клеток в исследуемом материале. Исследуемый материал обрабатывают серной кислотой для освобождения от посторонней микрофлоры, нейтрализуют и вводят подкожно по 2-3 мл морской свинке и кролику с отрицательными туберкулиновыми реакциями. Через 4 мес., если животное не погибнет, его забивают и проводят микроскопическое исследование его органов. M. tuberculosis – высокопатогенны для морских свинок и малопатогенны для кроликов, M. bovis –высокопатогенны для кроликов.
4.Туберкулодиагностика – это ведущий метод диагностики туберкулеза у детей и подростков, основан на определении повышенной чувствительности макроорганизма к туберкулину, наступившей в результате заражения возбудителями туберкулеза или вакцинации ВСG, с помощью кожно-аллергических проб. Туберкулин – это белковые фракции – протеины, выделенные из бульонной культуры микобактерий путем добавления химических веществ, осаждающих белок, с последующей очисткой и лиофилизацией. Туберкулин вводят внутрикожно в строго определенной дозировке – проба Манту. Результаты оценивают через 48-72 ч. Реакция считается положительной при наличии выраженного инфильтрата (папулы) диаметром 5 мм и более.
5. Для экспресс-диагностики применяют реакцию иммунофлюоресценции (РИФ) с использованием видоспецифических моноклональных антител, иммуноферментный анализ (ИФА) и полимеразно-цепную реакцию (ПЦР). Эти методы направлены на обнаружение как антигенов возбудителей туберкулеза, так и антител к ним.
Международный союз борьбы с туберкулезом в связи с распространением в настоящее время множественно-резистентных штаммов предложил все противотуберкулезные препараты по степени их эффективности разделить на 3 группы:
группа А – наиболее эффективные – изониазид, рифампицин и их производные;
группа В – препараты средней эффективности – стрептомицин, канамицин, этионамид (пропионамид), этамбутол, пиразинамид, флоримицин, циклосерин, производные фторхинолонов; группа С – препараты малой эффективности – ПАСК, тибон (тиоацетозон).
В России препараты группы С в последнее время не применяются, а также получены препараты, превосходящие рифампицин по лечебным свойствам: рифапентин, рифабутин и комбинированные препараты: рифатер, рифанг.
Период лечения состоит из 2 этапов. Цель первого — подавить репликацию активно размножающейся бактериальной популяции, располагающейся в основном внеклеточно, добиться снижения ее численности. Цель второго этапа – долечивание в результате воздействия на оставшуюся бактериальную популяцию, в большинстве своем находящуюся внутриклеточно в виде персистирующих форм микобактерий.
Большинство больных перестают быть источником инфекции в течение 2 недель с начала соответстующей противотуберкулезной терапии.
Препараты для специфической профилактики.
Для специфической профилактики используют живую вакцину БЦЖ – BCG, полученную путем длительного культивирования M. bovis на картофельно-глицериновом агаре с добавлением бычьей желчи. Вакцинацию проводят новорожденным на 2-5 день в роддоме внутрикожно с последующей ревакцинацией согласно календарю прививок. Ревакцинацию проводят лицам с отрицательной туберкулиновой пробой с интервалом 5-7 лет до 30-летнего возраста.
источник