Брюшной тиф —это острое системное заболевание, вызываемое S. typhi. Возбудители брюшного тифа и паратифов А и В относятся к отделу Gracilicutes, семейству Enterobacteriaceae, роду Salmonella, включающему более 2000 видов. Сальмонеллы — мелкие, длиной 2.3 мкм, шириной 0,5 — 0,7 мкм, грамотрицательные палочки с закругленными концами. В мазках располагаются беспорядочно. Не образуют спор, имеют микрокапсулу, перитрихи, факультативные анаэробы.
Брюшной тиф встречается только у людей. Основные симптомы — недомогание, лихорадка, нарушение деятельности желудочно-кишечного тракта, кратковременная сыпь, спленомегалия, а также лейкопения. Важнейшими осложнениями являются кишечное кровотечение и перфорация кишечника. Это заболевание можно рассматривать как классический пример кишечной лихорадки, вызываемой сальмонеллами. Вскоре после заглатывания возбудитель инфекции попадает в тонкую кишку и размножается там. Далее с минимальным повреждением эпителия он проникает в слизистую оболочку и, возможно, через пейеровы бляшки, в лимфатические сосуды, а по ним в кровоток
Первичная бактериемия отмечается, по-видимому, в интервале 24—72 ч после заражения После внутриклеточного размножения брюшнотифозные палочки снова попадают в кровоток, вызывая продолжающуюся в течение нескольких дней или недель бактериемию. Появление повторной бактериемии соответствует началу клинических проявлений болезни- головной боли, недомогания, потери аппетита и повышения температуры тела. На ранней стадии болезни часто отмечается нарушение деятельности желудочно-кишечного тракта — вздутие живота и запоры. Примерно у 60% больных начинается сухой кашель, причем иногда он бывает настолько выражен, что уводит внимание от системного характера проявлений инфекции. На ранней стадии болезни возможны носовые кровотечения.
Борьба с брюшным тифом включает мероприятия по улучшению санитарного состояния, удалению сточных вод, водоснабжению, а также выявлению и лечению хронических носителей или контролю за ними. Хотя иммунизация брюшнотифозной вакциной обеспечивает существенную защиту против заболевания, степень иммунитета при этом не столь велика, и он может быть легко прерван при заражении большой дозой возбудителя. Тем не менее иммунизацию рекомендуется проводить лицам, проживающим или путешествующим в эндемичных по брюшному тифу районах, равно как и лицам, работающим с возбудителями инфекции в лабораториях.
Ботулизм — острое токсико-инфекционное заболевание, связанное с употреблением в пищу продуктов, содержащих токсин Clostridium botulinum и самих возбудителей. Характерно развитие парезов и параличей мускулатуры в связи с блокадой токсином выделения ацетилхолина в нервных синапсах.
Под названиями аллантиазис (от гр. allantiksa — колбаса), ихтиозизм (от гр. ichtis— рыба) заболевание известно с XVIII века, когда были зарегистрированы случаи отравления рыбой и кровяной колбасой. Термин «ботулизм» (от лат. botulus —колбаса) ввёл бельгийский бактериолог Э. Ван-Эрменгем (1896), выделивший возбудитель из кишечника погибшего больного. Вместе с тем ещё в IX-X веках в Византии, а несколько позже в Германии наблюдали случаи заболевания, связанные с употреблением кровяной колбасы. В 1818 г. в России описано нервно-паралитическое заболевание, связанное с употреблением в пищу копчёной рыбы.
Возбудитель — подвижная грамположительная, строго анаэробная спорообразуюшая бактерия Clostridium botulinum. В мазках имеет вид палочек с закруглёнными концами, располагающихся беспорядочными скоплениями или небольшими цепочками. В неблагоприятных условиях образует субтерминальные и терминальные споры, в виде которых и сохраняется в окружающей среде. В высушенном состоянии споры могут сохранять жизнеспособность десятилетиями. Известно 8 сероваров ботулизма — А, В, Са2beta, D, E, F, G, однако в патологии человека доминируют серовары А, В, Е и F. Оптимальный рост клостридий и токсинообразование происходят в анаэробных условиях при температуре 35 °С. Вегетативные формы бактерий погибают при 80 °С в течение 30 мин, при кипячении — в течение 5 мин. Споры выдерживают кипячение продолжительностью более 30 мин и разрушаются только при автоклавировании. Токсин (ботулотоксин) быстро разрушается при кипячении, устойчив к действию пепсина и трипсина, выдерживает высокие концентрации (до 18%) поваренной соли, не разрушается в продуктах, содержащих различные специи. Присутствие ботулотоксина в пищевых продуктах не изменяет их органолептических свойств. Ботулотоксин является одним из самых сильных биологических ядов. Возможны случаи отравления людей и животных сразу несколькими токсинами, продуцируемыми бактериями различных сероваров.
Основной источник заражения ботулизмом – это пища, в которой содержится токсин возбудителя Клостридиум ботулинум — ботулотоксин. Особенностью этих бактерий является то, что они вырабатывают токсины только в безвоздушной (анаэробной) среде, которая создается при производстве большинства консервированных продуктов.
Таким образом, наибольший риск заразиться ботулизмом связан с употреблением в пищу консервированных продуктов домашнего приготовления (грибы, мясо, сало, овощи и пр.)
Для того чтобы нейтрализовать опасный токсин ботулизма достаточно перед употреблением прокипятить консервированную пищу в течение 15 минут.
Если вам кажется, что пища (в том числе консервированная) может быть испорчена – выбросьте ее. Не пытайтесь даже попробовать ее. Ботулотоксин это один из самых сильных ядов, известных в настоящее время. Для сильного отравления достаточно просто недолго подержать во рту, а затем выплюнуть отравленную пищу.
Споры возбудителя ботулизма широко распространены в природе, и иногда обнаруживаются в пыльце цветов. Пчелиный мед, получаемый из такой пыльцы, может содержать споры возбудителя ботулизма, которые совершенно не опасны для детей старше 1 года и взрослых людей, но могут приводить к развитию ботулизма у детей первого года жизни. Ботулизм у грудных детей протекает очень тяжело и может привести к инвалидности или даже смерти ребенка. В связи с этим настоятельно не рекомендуется включать в рацион детей до года пчелиный мед и продукты его содержащие.
Возбудители ботулизма также содержатся в почве, в связи с чем возможно заражение ботулизмом при попадании земли в открытую рану. Раневой ботулизм был актуален в военное время, а в настоящее время встречается достаточно редко.
Инкубационный период (время от заражения до появления первых симптомов) при ботулизме составляет в среднем 12-36 часов. Длительность инкубационного периода зависит от того, какое количество токсина попало в организм: так, при массивном попадании ботулотоксина первые симптомы могут развиться уже спустя 2 часа после заражения. От того, какое количество токсина попало в организм, зависит также и тяжесть течения заболевания. При тяжелом течении ботулизма смерть может наступить уже спустя сутки после заражения.
Основные симптомы и признаки ботулизма:
Ухудшение общего самочувствия, сильная мышечная слабость, боли в животе, тошнота и рвота являются наиболее ранними признаками пищевого отравления.
Возможно (но не обязательно) появление жидкого стула в начале заболевания. Позднее развивается запор.
Температура тела, как правило, остается нормальной. В редких случаях может отмечаться повышение температуры до 37-38С.
Сухость во рту и сильная жажда.
Нарушения зрения: двоение в глазах, снижение остроты зрения, «сетка» перед глазами и пр.
Нарушения речи: осиплость голоса, невнятная речь и т.д.
Нарушения глотания: больной не может нормально глотать пищу, поперхивается, во время питья вода выходит через нос.
Одышка, затруднения при дыхании, больному надо приложить усилия для того, чтобы осуществить вдох — все эти симптомы указывают на вероятное развитие паралича дыхательных мышц. Паралич дыхательных мышц может привести к смерти.
При подозрении на пищевое отравление нужно: немедленно вызвать скорую помощь. Давать больному пить больше жидкости. Обеспечить больному доступ к свежему воздуху: открыть окно, придать положение полусидя, расстегнуть рубашку. При остановке дыхания произвести искусственное дыхание. Постараться найти остатки пищи, съеденной больным накануне, для лабораторного анализ.
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.
источник
Дизентерия —инфекционное заболевание, характеризующееся синдромом общей инфекционной интоксикации и синдромом поражения желудочно-кишечного тракта, преимущественно дистального отдела толстой кишки.
Бактериальная дизентерия —острое антропонозное инфекционное заболевание с фекально-оральным механизмом передачи. Характерны общая интоксикация и преимущественное поражение слизистой оболочки дистального отдела толстой кишки, схваткообразные абдоминальные боли, частый жидкий стул с примесью слизи и крови, тенезмы.
Бактерии возбудители дизентерии относятся к отделу Gracilicutes, семейству Enterobacteriaceae, роду Shigella. названы в честь японского бактериолога К. Шига, впервые описавшего возбудителя бактериальной дизентерии.
Шигеллы — кишечные патогены человека и приматов, грамотрицательные палочки с закругленными концами, длиной 2.3 мкм, толщиной 0,5.7 мкм; не образуют спор, не имеют жгутиков, неподвижны. У многих штаммов обнаруживают ворсинки общего типа и половые пили. Некоторые шигеллы обладают микрокапсулой. Вызываемые ими поражения называют бактериальной дизентерией или шигеллезом.
Бактериальная дизентерия связана с поражением слизистой оболочки толстого кишечника, склонное к эпидемическому распространению.
Наибольшее значение в распространении дизентерии имеет контактный путь. Немытые руки, загрязненные микроскопическими частицами фекалий больного с наличием в них возбудителей дизентерии, играют в передаче болезни активную роль.
При заражении через пищевые продукты наибольшее значение имеют те из них, которые не подвергаются термической обработке — огурцы, салат, редиска, а также любой продукт, инфицированный грязными руками больного или бактерионосителя. Вспышки дизентерии пищевого происхождения чаще встречаются в теплое время года.
Инкубационный период дизентерии продолжается от 2 до 5 дней, в отдельных случаях 12—24 часа. Заболевание развивается довольно быстро: слабость нарастает, повышается температура, которая у большинства больных держится не больше 2—3 дней. Заболевание может протекать и при нормальной температуре. Больные дизентерией зябнут, у них исчезает аппетит, отмечается головная боль, одновременно вследствие судорожного сокращения толстых кишок появляются боли в животе, носящие схваткообразный характер. Боли в животе могут быть разлитые, но чаще всего они локализованы в левой подвздошной области. Появляется повторный жидкий стул калового характера. Вскоре в испражнениях появляется слизь с прожилками крови.
Распознавание болезни дизентерия основывается на клинических признаках. Диагноз уточняется при помощи бактериологического исследования — обнаружение в кале возбудителя болезни. В более поздние сроки заболевания (с 10— 12-го дня болезни) пользуются серологическими исследованиями— реакция агглютинации. Кровь берут в таких же количествах, как и для реакции Видаля при брюшном тифе. Этим методом чаще пользуются когда хроническая дизентерия в тех случаях, когда бактериологическая диагностика отрицательна.
Холера — инфекционное острое заболевание, вызываемая некоторыми представителями вида Vibrio cholerae, характеризуется поражением тонкого кишечника, нарушением водно-солевого обмена, различной степенью обезвоживания из-за потери жидкости с водянистыми испражнениями и рвотными массами. Относится к числу карантинных инфекций. Возбудитель — холерный вибрион, был выделен в 1883 г. Р. Кохом от больного холерой. В 1906 г. на карантинной станции Эль-Тор в Египте при обследовании паломников Ф. и У. Готшлихи выделили вибрион Эль-Тор. Холерный вибрион относится к отделу Gracilicutes-, семейству Vibrionaceae, роду Vibrio. Внутри вида Vibrio cholerae различают 2 основных биовара: biovar cholerae classic (выделенный Р. Кохом) и biovar eltor (открытый Ф. и Е. Готшлихами). Холерный вибрион — небольшая грамотрицательная изогнутая палочка длиной 2 — 4 мкм, толщиной 0,5 мкм, не образует спор, не имеет капсулы, монотрих и чрезвычайно подвижен. При кипячении погибает через 1 минуту. Некоторые биотипы длительно сохраняются и размножаются в йоде, в иле, в организмах обитателей водоемов. Источником инфекции является человек (больной и бациллоноситель). Вибрионы выделяются с фекалиями, рвотными массами. Эпидемии холеры бывают водные, пищевые, контактно-бытовые и смешанные. Восприимчивость к холере высокая.
Больной заразен в течение всей болезни — с момента появления первых клинических симптомов, а также в стадии реконвалесценции. Наибольшую эпидемическую опасность представляют больные с явно выраженной, типичной клинической картиной холеры, выделяющие в первые 4—5 дней заболевания в сутки до 10-20 л испражнений, содержащих в 1 мл 106—1010 высоковирулентных вибрионов. Всего, если имеет место ярко выраженная болезнь, такой больной сохраняет угрозу до 3 недель.
Механизм передачи возбудителя холеры фекально-оральный. Ведущий путь передачи — водный, возможно распространение холеры пищевым путем, некоторые авторы не исключают бытовую передачу. В возникновении эпидемических вспышек и распространении холеры внутри очага ведущая роль принадлежит поверхностным водоемам, загрязненным не обезвреженными сточными водами. Заражение человека происходит при употреблении воды для хозяйственно-питьевых нужд и использовании водоемов для купания. Заболевания людей холерой связывают также с использованием в пищу продуктов моря (мидий, устриц, креветок, морских гребешков, омаров, крабов, рыбы и т. д.), употребление которых в сыром или недостаточно проваренном виде приводило, как уже упоминалось, к заражению людей.
Профилактика вспышек холеры и борьба с ними.У 80% людей из тех, у кого развиваются симптомы заболевания, болезнь принимает форму легкой или средней тяжести. В оставшихся 10-20% случаев развивается тяжелая водянистая диарея с признаками дегидратации. При отсутствии лечения каждый второй человек может умереть. При надлежащем лечении летальность не должна превышать 1%.
За последние десятилетия меры по профилактике холеры практически не изменились и заключаются, главным образом, в обеспечении чистой воды и надлежащей санитарии для групп населения, потенциально подверженных заболеванию холерой. Также важны просвещение и надлежащая гигиена пищевых продуктов. В частности, необходимо пропагандировать систематическое мытье рук. В случае выявления вспышки холеры обычно стратегия направлена на снижение смертности путем быстрого обеспечения доступа к лечению и установления контроля над распространением болезни.
Для большинства пациентов — до 80% — достаточно проводить лечение путем введения солей для пероральной регидратаци. Пациентам с тяжелой дегидратацией необходимо проводить внутривенные вливания . В тяжелых случаях можно давать соответствующие антибиотики для сокращения длительности диареи, уменьшения объема жидкостей для регидратации и сокращения периода выделения вибрионов. Обеспечение чистой водой и санитарией является сложной задачей, но остается решающим фактором для снижения воздействия вспышек холеры.
Не нашли то, что искали? Воспользуйтесь поиском:
источник
Сайт предоставляет справочную информацию исключительно для ознакомления. Диагностику и лечение заболеваний нужно проходить под наблюдением специалиста. У всех препаратов имеются противопоказания. Консультация специалиста обязательна!
Брюшной тиф относится к заболеваниям, уровень распространенности которых во многом зависит от социально-экономических условий. Так, в прошлом вспышки этой болезни приходились на период войн, экономического кризиса и других социальных бедствий.
С учетом статистических данных Всемирной Организации Здравоохранения, все страны мира в зависимости от распространенности брюшного тифа условно делятся на несколько групп. В первую группу входит Канада, Бельгия, Швеция и другие страны с высоким уровнем экономического развития. В этих регионах на 100 000 человек приходится не больше 1 ежегодного случая этой инфекции. К последней группе относятся такие страны как Чили, Колумбия, Перу. Ежегодно в этих странах регистрируется более 30 случаев заболевания на 100 000 человек.
На территории Российской Федерации с 2007 года число случаев брюшного тифа значительно уменьшилось. Если с 2003 по 2006 год ежегодное количество пациентов варьировало от 150 до 180, то с 2007 по 2013 год этот показатель не превышал 80 человек. В 2014 году было зарегистрировано 14 больных (13 взрослых и 1 ребенок).
Возбудителем брюшного тифа является Salmonella typhi – подвижная палочка со сложным антигенным строением. Это довольно устойчивая во внешней среде бактерия, которая сохраняется в течение многих месяцев в водоемах, почве, овощах и фруктах, а также в молочных продуктах (в них сальмонеллы могут длительное время размножаться). Бактерии можно убить 96-процентным этиловым спиртом или 3-процентным раствором хлорамина. Основной характеристикой сальмонелл является сложная антигенная структура. Она представлена соматическим и жгутиковым антигеном.
Сальмонеллы продуцируют и выделяют сильный эндотоксин, который и определяет клиническую картину заболевания.
К антигенной структуре сальмонелл относятся:
- О-соматический антиген, представлен липосахаридным, устойчивым к действию высоких температур комплексом;
- Н-жгутиковый антиген, быстро разрушающийся под действием высоких температур.
Бактерии брюшного тифа способны к L-трансформации, то есть могут переходить в хроническую форму. При этом процессе бактерии как бы засыпают, но сохраняют свои патогенные свойства. Через некоторое время, когда иммунные силы человека снижаются, они вновь активируются. Этим объясняется возможность длительного персистирования (нахождения) бактерий в организме.
Брюшной тиф относится к инфекциям с фекально-оральным механизмом передачи, что означает, что проникновение патогенных бактерий в организм происходит преимущественно через рот. Заражение может осуществляться пищевым или водным путем. В почве или воде сальмонеллы сохраняются длительное время, что и делает этот путь заражения наиболее частым. Контактный или бытовой путь заражения встречается исключительно редко, в основном у детей. Это может происходить при непосредственном контакте с источником инфекции (например, ребенок может взять в рот игрушку, которая была заражена сальмонеллами).
Попадая через ротовую полость в организм человека, сальмонеллы далее мигрируют в кишечник. Известно, что внедрение возбудителя происходит в подвздошной кишке, которая является отделом тонкого кишечника. Изначально бактерии начинают паразитировать в скоплениях лимфатической ткани подвздошной кишки. Потом вместе с током лимфы они проникают уже в мезентериальные лимфатические узлы. Здесь они также начинают интенсивно размножаться, а достигнув определенной концентрации, проникают в кровь. Находясь в лимфатических узлах, сальмонеллы не только растут и размножаются в них, но и запускают развитие воспалительного процесса. Период времени с момента попадания бактерий в организм и до их выхода в кровь называется периодом инкубации. После его окончания появляются первые симптомы заболевания. Известно, что для возникновения заболевания необходимо, чтобы в желудочно-кишечный тракт попало не менее 10 миллионов микробных клеток. В кишечном тракте их концентрация может достигнуть одного миллиарда.
Попадая в кровь, сальмонеллы приводят к развитию бактериемии. Бактериемией называется циркуляции в крови (которая в норме стерильна) бактерий. Этот процесс совпадает с появлением первых симптомов брюшного тифа и окончанием периода инкубации. Чем массивнее бактериемия, тем сильнее и выраженнее симптомы заболевания.
Патогенезом называется весь комплекс механизмов, необходимых для развития болезни. При брюшном тифе патогенез реализуется на нескольких этапах.
Этапами патогенеза брюшного тифа являются:
- проникновение сальмонелл в желудочно-кишечный тракт вместе с источником заражения (едой, водой);
- внедрение бактерий в слизистую подвздошной кишки;
- размножение сальмонелл в солитарных фолликулах и пейеровых бляшках, откуда они мигрируют в мезентериальные лимфатические узлы;
- развитие воспаления в мезентериальных лимфатических узлах и увеличение концентрации сальмонелл в них;
- выход бактерий в кровь и развитие бактериемии;
- распространение с током крови бактерий по всем органам и тканям;
- формирование очагов инфекции в селезенке, печени и других органах.
Важным моментом в патогенезе брюшного тифа является бактериемия. Она бывает первичной и вторичной. Первичная бактериемия – это, когда сальмонеллы впервые из лимфатических узлов попадают в кровь. Однако когда бактерии попадают в кровь, они гибнут вследствие ее бактерицидного действия. Погибая, они выделяют эндотоксин, который обладает нейротропным действием. Таким образом, часть бактерий, находящихся в кровеносном русле, постоянно погибает и выделяет эндотоксин. Чтобы продлить циркуляцию сальмонелл, из внутренних органов в кровь вновь начинают мигрировать бактерии. Процесс выхода сальмонелл в кровь уже из внутренних органов называется вторичной бактериемией.
Таким образом, развивается порочный круг – бактерии выходят в кровь, где они погибают и выделяют эндотоксин, а им на смену поступают новые сальмонеллы из внутренних органов и лимфатических узлов. В то же время, эндотоксин, обладая сильнейшим нейротропным эффектом, определяет клиническую картину брюшного тифа.
Эффектами эндотоксина сальмонелл являются:
- нейротоксическое действие с поражением центральной нервной системы и развитием токсической энцефалопатии;
- поражение нервных окончаний и вегетативных ганглий, что приводит к развитию язв на слизистой кишечника;
- кардиотоксическое действие, которое проявляется в дистрофических изменениях сердца, что в конечном итоге приводит к развитию токсического миокардита;
- нарушение тонуса периферических сосудов, приводящее к падению артериального давления и развитию коллапса;
- развитие инфекционно-токсического шока, что сопровождается нарушением водно-электролитного баланса;
- поражение почек и развитие синдрома «шоковая почка».
Все эти эффекты приводят к развитию многочисленных симптомов и обуславливают разнообразную клиническую картину.
Источником сальмонеллы тифа для здорового человека в большинстве случаев является бактерионоситель. Носителем называют того, кто практически оставаясь здоровым, не проявляя никаких признаков болезни выделяет в окружающую среду патогенные бактерии. Выделение может продолжаться от нескольких недель до нескольких десятков лет. Данный феномен может объясняться несколькими причинами. В первую очередь, это может быть бактерионоситель-реконвалесцент, то есть выздоравливающий после перенесенного заболевания человек. В период выздоровления бактерионосительство может быть как кратковременным, так и длительным. Кратковременное носительство наблюдается при дизентерии или при дифтерии (от 3 до 4 месяцев). Что касается брюшного тифа, то в данном случае носительство затягивается до 10 лет.
Отдельной категорией бактерионосительства являются иммунные носители. Это те лица, которые ранее были привиты.
Источником инфекции также могут быть больные с атипичными формами брюшного тифа. В этом случае заболевание протекает без классических симптомов и поэтому не диагностируется вовремя. Люди с такими формами брюшного тифа длительное время лечатся амбулаторно (то есть на дому) и остаются не изолированными от членов семьи. В этом случае, заражение может происходить при употреблении зараженной пищи, воды. Большую опасность представляют собой молочные продукты, так как в них бактерии могут не только длительное время сохраняться, но и размножаться.
Восприимчивость населения к брюшному тифу очень высока. В очагах, где регистрируется вспышка брюшного тифа, могут заболевать до 50 – 60 процентов от общего населения.

К периодам (этапам) заболевания брюшного тифа относятся:
- инкубационный период;
- начальный период;
- период разгара заболевания;
- период угасания основных симптомов;
- период выздоровления.
Инкубационный период – это период с момента проникновения сальмонелл в организм человека до момента, когда появляются первые симптомы. При брюшном тифе период инкубации, как правило, длится от 9 до 14 дней. Максимально он может затягиваться до 25 дней. За это время попавшие в организм сальмонеллы активно размножаются в слизистой подвздошной кишки и лимфатических узлах. В тот момент, когда бактерии выходят в кровь, инкубационный период заканчивается, и появляются первые признаки заболевания.
Длительность этого периода зависит от концентрации изначально попавших в организм микробов и от пути заражения. При пищевом заражении инкубационный период короткий — от 7 до 9 дней, а заболевание отличается высокой тяжестью. Водный путь заражения характеризуется более длительным периодом инкубации.
Период угасания основных симптомов начинается с момента снижения температуры, очищения языка, нормализации стула. Все проявления общей интоксикации – головная боль, слабость, разбитость – уходят. Температура тела начинает снижаться, но все еще не доходит до нормы.
Несмотря на редукцию симптомов, этот период болезни является очень опасным. Именно в этот момент болезнь может заново проявить себя, то есть возможен рецидив брюшного тифа. Поэтому в период угасания основных клинических симптомов пациент продолжает оставаться в стационаре под постоянным наблюдением.
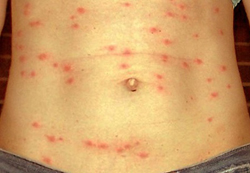
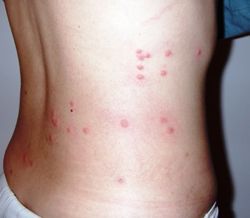
Симптомами брюшного тифа являются:
- лихорадка;
- сыпь;
- кишечное кровотечение;
- поражение внутренних органов.
Специфическим проявлением брюшного тифа является сыпь. Она обусловлена нарушением проницаемости кровеносных сосудов и пропитыванием эпидермиса элементами крови. При брюшном тифе сыпь, как правило, розеолезная, а элементом такой сыпи является розеола. Розеола – это округлое красное пятнышко, размером от 1 до 5 миллиметров. Она не шелушится и не создает зуд, а потому не причиняет беспокойства пациенту. Однако, несмотря на это, сам период высыпания сопровождается резким поднятием температуры тела и ухудшением состояния пациента. Сознание пациента еще больше затуманивается, и он становится сонным, вялым, апатичным.
При брюшном тифе сыпь появляется на 8 – 9 день от начала заболевания. Она локализуется на верхних отделах живота и грудной клетки. Иногда элементы сыпи могут выступать над уровнем кожи и приобретать четкие границы. Чаще всего сыпь необильная и держится от 3 до 5 дней. Она может исчезнуть уже через один — два дня, но потом вновь появится. При тяжелом течении заболевания сыпь приобретает петехиально-геморрагический характер. Элементы сыпи в данном случае пропитываются кровью, что говорит о неблагоприятном прогнозе.
В редких случаях характерная для брюшного тифа сыпь может отсутствовать. Отсутствие сыпи на теле пациента не должно исключать диагноз брюшного тифа.
При брюшном тифе из-за специфического поражения сальмонеллами желудочно-кишечного тракта выявляются признаки энтерита. На начальных стадиях отмечается задержка стула, однако уже во время стадии развернутых клинических проявлений присутствует стул энтерического характера (то есть понос). У некоторых же больных остаются запоры.
Живот больного брюшным тифом вздут, при пальпации болезненный. В умеренных и тяжелых случаях развивается парез кишечника, для которого характерно полное отсутствие перистальтизма. При этом газы и кишечное содержимое скапливаются в просвете кишечника, делая живот напряженным и болезненным.
В результате специфического воздействия эндотоксина сальмонелл на нервные окончания в слизистой кишечника развиваются трофические и сосудистые изменения. Они, в свою очередь, приводят к нарушению питания слизистого слоя кишечника и развитию трофических язв. Трофические язвы – это те, которые развиваются вследствие нарушенного питания (трофики) слизистой оболочки. В своем развитии язвы проходят несколько этапов.
Этапами развития язв являются:
- первая неделя – увеличение лимфатических фолликулов слизистой кишечника;
- вторая неделя – некроз (омертвение) увеличенных образований;
- третья неделя – отторжение некротических (омертвевших) масс и формирование на их месте небольших углублений, то есть язв;
- четвертая неделя – стадия чистых язв;
- пятая неделя – стадия заживления язв.
Все эти стадии могут следовать одна за другой без развития последствий для слизистой оболочки кишечного тракта. Однако, при формировании обширных и глубоких язв течение брюшного тифа осложняется кишечным кровотечением. Происходит это вследствие перфорации (прободения) язвы слизистой. В этом случае целостность оболочек кишечника нарушается, а вместе с ними и тех кровеносных сосудов, которые в них заложены. Нарушение целостности кровеносных сосудов приводит к излитию крови в просвет кишечника, что и является причиной кишечного кровотечения.
Кишечное кровотечение при брюшном тифе, как правило, встречается на 3 – 4 недели от начала заболевания. Неотъемлемым симптомом перфорации кишечной язвы является боль. Пациент предъявляет жалобы на внезапно появившуюся боль острого характера.
Часто боли локализуются внизу животу справа, но могут быть и разлитыми. Болевой синдром сопровождается выраженным напряжением мышц живота, учащенным дыханием и падением артериального давления. Симптомы перфорации язвы ярко выражены при умеренных формах брюшного тифа. Объясняется это тем, что сознание пациента в этом случае не сильно затуманено, и болевая чувствительность сохраняется. Если же кишечное кровотечение начинается на фоне высокой температуры и затуманенного сознания пациента, то клиника его очень стертая.
При осмотре выявляется выраженное защитное напряжение мышц живота. Живот плотный болезненный, движения брюшной стенки во время акта дыхания еле заметны или вовсе отсутствуют. Появляются признаки раздражения брюшины, такие как симптом Щеткина-Блюмберга.
После того как бактерии брюшного тифа выходят в кровь, они разносятся с током крови по всему организму к различным органам и системам. Так, вместе с током крови они попадают в печень, селезенку, почки, сердце.
Поражение сердца
Эндотоксин сальмонелл приводит к дистрофическим изменениям в сердце с развитием токсического миокардита. Термин «миокардит» означает, что воспалительным процессом охвачен мышечный слой сердца. Это приводит к тому, что сердце перестает выполнять свои основные функции. В норме основной функцией сердца является «функция насоса», которая обеспечивает кровоснабжение по всему организму. Из-за поражения мышечного слоя сердце перестает эффективно сокращаться и качать кровь. Сокращения становятся слабыми, глухими, что объясняет брадикардию (редкие сердечные сокращения), артериальную гипотонию (снижение артериального давления). При обследовании пациента сердечные тоны глухие, слабые, артериальное давление низкое, пульс в пределах 50 ударов в минуту.
Следствием поражения сердца, является гипоксия или же кислородное голодание, нарушение водно-электролитного баланса, гиповолемия (уменьшение объема циркулирующей крови).
Поражение почек и легких
На фоне гиповолемии развивается синдром «шоковой почки» и «шокового легкого». Шоковая почка – это состояние, при котором нарушаются все функции почки — фильтрация, секреция и выделения. Диурез (суточный объем мочи) при этом осложнении резко снижается, вплоть до анурии. Вследствие нарушенной выделительной функции в организме начинают накапливаться продукты обмена – креатинин, мочевина. Это еще больше отягощает течение заболевания и обуславливает развитие инфекционно-токсического шока. Лечение шоковой почки должно быть экстренным и включать меры по восстановлению диуреза, выведению токсических продуктов обмена.
Еще одним следствием гиповолемии является шоковое легкое. При этом синдроме в альвеолах легких скапливается большое количество жидкости. Таким образом, легкие заполняются не воздухом, а водой, что лежит в основе отека легких. Пациенту становится трудно дышать, нарастает одышка.
Брюшной тиф часто путают с сыпным тифом, что является неверным. Сыпной тиф – это острое инфекционное заболевание, которое вызывается бактериями рода риккетсий. В отличие от брюшного тифа это заболевание не относится к кишечным инфекциям. Для сыпного тифа характерно преимущественное поражение нервной и сердечно-сосудистой системы. Передается данная инфекция, в основном через, вшей, чаще всего платяных и реже головных. Заражение происходит через укусы этих насекомых. Сами же вши заражаются от больных людей. Таким образом, платяные вши являются переносчиками заразы.
После того как вошь укусила больного человека, она может прожить от 30 до 45 дней. Укус вши является очень болезненным, из-за чего человек начинает болезненно расчесывать место укуса. Расчесывая укус, он втирает фекалии вши в кожу, посредством чего и происходит заражение. Далее риккетсии проникают в кровоток и разносятся кровью по всему организму. Мишенью для риккетсий являются эндотелиальные клетки, то есть структурные элементы сосудистой стенки. Развиваясь внутри сосудистой стенки, риккетсии разрушают ее, что приводит к деструкции кровеносных сосудов. Для сыпного тифа характерен феномен васкулита, то есть поражение эндотелиальной стенки сосудов. Это и обуславливает развитие в клинической картине заболевания таких симптомов как кровоизлияния в кожные покровы и в слизистые, увеличение селезенки, снижение артериального давления.
Еще одной отличительной особенностью сыпного тифа является поражение нервной системы. Сознание пациента спутанное, иногда могут развиваться признаки менингизма. Крайне тяжелым проявлением сыпного тифа является тифозный статус. Во время него у пациента отмечается психомоторное возбуждение, расстройства памяти, прогрессирует бессонница. Если же пациент засыпает, то ему сняться кошмарные сновидения. Иногда может развиваться бред, галлюцинации и другие психотические симптомы.
В эту категорию входят те последствия, которые характерны только для брюшного тифа. Наибольшим значением среди специфических последствий этого заболевания обладает инфекционно-токсический шок. Развивается такое состояние в разгар заболевания по причине массового поступления в кровь токсинов, которые выделяют брюшнотифозные бактерии. Эти токсины провоцируют спазм сосудов, в результате чего циркуляция крови нарушается.
Также токсины способствуют усиленному выбросу в кровь адреналина и других гормонов, которые усиливают сосудистый спазм. Кровь перестает выполнять свою транспортную функцию, что приводит к ишемии тканей (недостаточному кровоснабжению тканей) и к метаболическому ацидозу (повышенному содержанию в крови кислых продуктов). Все это становится причиной дегенеративных (разрушительных) изменений органов и тканей, отеков и других патологических состояний, которые могут привести к летальному исходу. Начинается инфекционно-токсический шок с увеличения температуры тела и развивается в несколько этапов.
Этапами инфекционно-токсического шока являются:
- Ранний. Сознание пациента сохраняется ясным, может наблюдаться тревога, двигательное беспокойство, отек лица и верхней половины туловища. Дыхание при этом учащенное, артериальное давление волнообразно повышается и снижается. У детей ранний этап обычно сопровождается рвотой, поносом, болями в животе (в верхней части).
- Выраженный. Тревожность и общее возбуждение первого этапа сменяется апатичным состоянием, двигательной заторможенностью. Кожные покровы пациента становятся бледными, холодными и влажными. Со временем возможно появление на коже кровоизлияний. Конечности приобретают синеватый оттенок. Температура и артериальное давление снижается, дыхание и пульс становятся слабыми. Резко уменьшается объем мочи. В этот период развиваются различные патологии со стороны почек, дыхательной системы.
- Декомпенсированный. Артериальное давление и температура тела продолжают падать. Пациента мучают судороги, возможна потеря сознания или кома. Кожа приобретает выраженный синий оттенок. Мочеиспускание отсутствует. Начинают проявляться симптомы дисфункции со стороны всех органов.
В эту группу входят заболевания, которые могут выступать в роли последствий не только брюшного тифа, но и других болезней. Брюшнотифозные бактерии кроме кишечника могут поражать и другие органы, провоцируя воспалительные процессы. Ситуация усложняется, когда к первичному воспалению присоединяется вторичная бактериальная инфекция.
К неспецифическим последствиям брюшного тифа относятся:
- со стороны дыхательной системы – пневмония (воспаление легочной ткани);
- со стороны сосудов – тромбофлебит (воспаление вен);
- со стороны сердца – миокардит (воспаление сердечной мышцы);
- со стороны почек – пиелит (воспаление в почечной лоханке), пиелонефрит (воспаление почечной ткани);
- со стороны нервной системы – периферический неврит (воспаление нервов), менингоэнцефалит (воспаление головного мозга и, в некоторых случаях, спинного мозга с последующим параличом);
- со стороны опорно-двигательного аппарата – артрит (воспаление суставов), хондрит (воспаление хрящевой ткани), периостит (воспаление надкостницы);
- со стороны мочеполовых органов – цистит (воспаление мочевого пузыря), простатит (воспаление простаты).
Основными симптомами, наличие которых вызывает подозрение на брюшной тиф, являются:
- сухость и бледность кожных покровов;
- повышенная температура;
- изменения языка – его увеличение, сухость и покрытие по центру налетом;
- появление красноватой сыпи на теле;
- диспепсические расстройства;
- проявления интоксикационного синдрома.
Когда у пациента наблюдаются подобные симптомы в течение 5 – 6 дней, необходимо сдать лабораторные анализы на брюшной тиф и пройти ряд диагностических исследований, посредством которых выявляется возбудитель заболевания.
Анализы на брюшной тиф назначаются как с целью выявления возбудителя болезни, так и для определения степени тяжести заболевания и контроля эффективности лечения.
К анализам, которые назначаются при диагностике брюшного тифа, относятся:
- общеклинические анализы;
- бактериологические анализы (посевы);
- серологические анализы.
Результаты общеклинических анализов указывают на присутствие воспалительного процесса в организме, на степень дегидратации и состояние организма больного в целом.
Бактериологические исследования помогают обнаружить самого возбудителя брюшного тифа в биологических жидкостях организма. К серологическим исследованиям прибегают с целью определения в организме человека антигенов возбудителя брюшного тифа. Серологические анализы особенно важны при диагностике бактерионосительства.
- реакция Видаля;
- реакция непрямой гемагглютинации;
- реакции флюоресцирующих антител.
Общеклинические анализы при брюшном тифе
Общеклинические анализы при брюшном тифе назначаются с момента обращения больного к врачу. Изменения в анализах не являются специфическими для данного заболевания, однако они помогают определить состояние организма больного в целом. Основными анализами являются гемограмма и общий анализ мочи.
Возможными изменениями клинического анализа крови при брюшном тифе являются:
- умеренное повышение лейкоцитов (белых клеток крови);
- лейкопения (уменьшение числа лейкоцитов);
- отсутствие эозинофилов (подвида лейкоцитов);
- умеренное повышение числа лимфоцитов (подвида безъядерных лейкоцитов);
- умеренное ускорение оседания эритроцитов.
Число лейкоцитов может быть повышенным только в первые дни заболевания. На протяжении последующей недели болезни их уровень резко падает. Лейкопения сохраняется на весь период выраженной клинической картины брюшного тифа.
Возможными изменениями в общем анализе мочи при брюшном тифе являются:
- присутствие белка;
- высокий уровень эритроцитов (красных клеток крови);
- высокий уровень цилиндров.
Ранняя специфическая диагностика брюшного тифа начинается с бактериологических исследований на основе посевов. В качестве материала для посева выступают различные биологические жидкости организма.
К биологическим жидкостям, которые используют для посева при брюшном тифе, относятся:
- кровь;
- моча;
- каловые массы;
- содержимое двенадцатиперстной кишки (желчь);
- грудное молоко.
Возбудителя брюшного тифа можно также обнаружить при бактериологическом исследовании розеол и костного мозга.
Для постановки диагноза забор биологических жидкостей должен проводиться до начала этиотропной терапии.
Посев крови
При ранней диагностике брюшного тифа чаще всего прибегают к посеву крови, в которой возбудитель легко обнаруживается даже в период инкубации. Лучше всего выполнять забор крови в период повышения температуры тела. В случае начала антибактериальной терапии кровь берется непосредственно перед тем как вводится следующая доза препарата. До 20 миллилитров крови засеваются на специальные жидкие питательные среды. Наиболее часто используемой средой для посева крови при брюшном тифе является среда Раппопорта, состоящая из бульона на основе желчи с добавлением глюкозы и специального красителя. Питательную среду с кровью помещают на 10 дней в инкубатор с температурой в 37 градусов Цельсия. Лаборанты проверяют посевы каждый день на наличие признаков роста бактериальных колоний – помутнение жидкости, изменение ее окраски. Если по окончании десяти дней рост отсутствует, результат анализа отрицательный. Если обнаруживаются признаки роста колоний, производят высевы на плотные среды в чашках Петри. Новые посевы вновь инкубируют при 37 градусах Цельсия в течение суток. В итоге на поверхности плотной среды разрастаются бактериальные колонии, которые подлежат идентификации при помощи ряда биохимических тестов. Параллельно с этим определяется также чувствительность бактерий к различным антибактериальным препаратам. Окончательные результаты гемокультуры получают через четверо суток.
Посев мочи
Исследование мочи на выявление возбудителя брюшного тифа можно проводить на протяжении всего периода болезни. Учитывая тот факт, что возбудитель выделяется с мочой непостоянно и кратковременно, посевы мочи следует повторять каждые 5 – 7 дней. Собранная моча должна быть доставлена в лабораторию для засева не позже двух часов с момента забора. Чем дольше хранится материал, тем больше шансов отмирания возбудителя или роста других бактерий. Урокультура получается тем же путем засева и инкубации, как и гемокультура.
Посев каловых масс
Посевы каловых масс для диагностики брюшного тифа выполняют, начиная со второй недели болезни. Забор испражнений производится при помощи стерильного шпателя, проволочной петли или ложечки. Для перевозки материала используется стерильный контейнер. В лаборатории готовится копрокультура путем посева кала на плотные питательные среды и инкубации при 37 градусах Цельсия в течение 18 – 24 часов.
Серологические анализы при диагностике брюшного тифа выявляют в крови больного особые антигены и антитела. Существует несколько основных антигенов, которые обнаруживаются при исследовании крови пациента.
Основными антигенами, которые обнаруживаются в крови больного при брюшном тифе, являются:
- О-антиген;
- Н-антиген;
- Vi-антиген.
О-антигены и Vi-антигены представлены частицами оболочек возбудителя, а Н-антигены являются структурными элементами жгутиков.
В качестве антител выступают особые белки, которые вырабатываются иммунной системой человека для нейтрализации антигенов возбудителя. Высокие уровни антител указывают на формирование стойкого иммунитета к возбудителю, что наблюдается в период выздоровления либо при бактерионосительстве. Антигены и антитела определяются в крови больного с помощью особых серологических реакций.
К реакциям серологического обследования на брюшной тиф относятся:
- реакция Видаля;
- реакция непрямой гемагглютинации;
- реакции флюоресцирующих антител.
Серологическую диагностику брюшного тифа проводят не раньше второй недели болезни.
Реакцией Видаля называется реакция прямой агглютинации (склеивания), которая позволяет определить присутствие О-антигена в сыворотке больного. Данная реакция широко применяется при диагностике брюшного тифа, однако она не является специфической, давая ложноположительные результаты за счет распознавания других видов сальмонелл. Для реакции Видаля необходимо 2 – 3 миллилитра венозной крови – обычно из локтевой вены. Кровь оставляют на некоторое время в пробирке до ее полного свертывания. Стерильным шприцем отсасывается образовавшаяся на поверхности сыворотка и помещается в другую пробирку. Реакция агглютинации состоит в поэтапном разведении сыворотки больного до соотношения 1 к 800 и добавлении специального диагностикума (антитела к искомым антигенам).
Этапами реакции Видаля являются:
- наполнение ряда пробирок по 1 миллилитру физиологического раствора;
- добавление 1 миллилитра сыворотки в первую пробирку и получение разведения 1 к 50;
- отсос пипеткой из первой пробирки 1 миллилитра и добавление его во вторую пробирку – получается разведение 1 к 100;
- повтор манипуляций до получения растворов в соотношении 1 к 800;
- добавление специального диагностикума в каждую пробирку;
- двухчасовая инкубация при 37 градусов Цельсия;
- последующее содержание пробирок при комнатной температуре в течение суток.
Реакция агглютинации проявляется в виде образования небольшого осадка на дне пробирки. Реакция Видаля является положительной, если агглютинация присутствует в пробирке с разведением 1 к 200 и более. Положительный результат может указывать не только на присутствие болезни, но и на возможное носительство. Для дифференциации этих состояний реакция повторяется через 5 – 6 дней. Если агглютинация появляется в пробирках с высокими титрами антител, это указывает на наличие болезни. У бактерионосителей титры антител не меняются при повторных исследованиях.
Реакция непрямой гемагглютинации
Реакция непрямой гемагглютинации является более специфической и чувствительной для диагностики брюшного тифа. С ее помощью определяются все три основных антигена возбудителя. В качестве диагностикума выступают эритроциты, сенсибилизированные к антигенам сальмонеллы. Методика выполнения реакции схожа с техникой реакции Видаля, однако разведения начинаются с 1 к 10. Гемагглютинация проявляется в виде образования осадка красного цвета на дне пробирки, похожего на перевернутый зонтик. Положительной считается реакция, при которой осадок образовался в пробирке с разведением 1 к 40 и более. При последующих анализах через 5 и 10 дней титры антител увеличиваются в 2 – 3 раза, особенно О-антител. Повышение титра Vi- и Н-антител наблюдается у больных в период выздоровления. Их уровень также может быть высок у носителей.
Реакции флюоресцирующих антител
С первых дней болезни возбудителя можно опознать при помощи реакций флюоресцирующих антител. Эти реакции заключаются в обнаружении антигенов возбудителя при помощи антител, отмеченных флюоресцирующими веществами. В биологический диагностический материал (кровь, кал, моча) добавляют «маркированные» антитела и изучают его при помощи специальных микроскопов. Когда антитело связывается с антигеном возбудителя, в микроскопе видно свечение. Предварительные результаты реакций готовы в течение одного часа, а окончательные – через 10 – 20 часов. Реакции флюоресцирующих антител достаточно специфичны и высокочувствительны, однако используются редко в диагностике брюшного тифа.
источник
Дизентерию вызывают шигеллы, энтеробактерии рода Shigella (S.dysenteriae, S. flexneri, S.sonnei, S.boydii) — Гр- неподвижные палочки длиной 2-3 мкм. Спор и капсул не образуют. Имеют фимбрии (адгезины). Факультативные анаэробы. Хорошо растут на простых питательных средах, часто диссоциируют в авирулентную R-форму. Расщепляют углеводы до кислоты без газа. Идентификацию возбудителя проводят по биохимическим и антигенным свойствам.
Возбудители дизентерии нестойки во внешней среде: погибают при высушивании, действии солнечного света, конкурентной микрофлоры; чувствительны к кипячению и действию обычных дезинфектантов. Нередко выделяются штаммы, обладающие лекарственной устойчивостью, в том числе полирезистентные.
Шигеллы — безусловно-патогенные инвазивные бактерии, возбудители антропонозной инфекции (дизентерии, шигеллеза). Они способны колонизировать слизистую оболочку кишечника, проникать внутрь эпителиоцитов и размножаться в них. В результате инвазии и действия цитотокси-нов эпителиоциты погибают, развивается катарально-язвенное воспаление — колит.
Источник инфекции — микробоноситель или больней человек, у которых возбудитель выделяется с фекалиями. Заражение — алиментарным, реже контактно-бытовым путем (через инфицированные предметы, руки). Заболевание сопровождается интоксикацией организма, болями в животе, диареей (фекалии с примесью крови), нарушением обмена веществ, дисбактериозом кишечника. У детей, особенно при заражении токсигенными S.dysenteriae, дизентерия протекает тяжело, нередко с летальным исходом. При несвоевременном и неадекватном лечении происходит хронизация инфекции, нередко формируется микробоносительство. Иммунитет очень нестойкий, видоспецифический, возможны повторные заболевания.
Микробиологическая диагностика основана на выделении возбудителя и его идентификации (микробиологический метод). Дополнительным методом является серодиагностика (выявление сывороточных антител к шигеллам в РА, РПГА и др.).
Специфическое лечение: нитрофурановые препараты, антибиотики (в соответствии с чувствительностью возбудителя); дизентерийный бактериофаг (в первые дни заболевания); препараты для восстановления нормальной микрофлоры (колибактерин, лактобактерин, бифидумбактерин).
Специфическая профилактика: для экстренной — дизентерийный бактериофаг; для плановой разрабатывается вакцина.
Тифо-паратифозные заболевания вызывают энтеробактерии рода Salmonella (брюшной тиф -S.typhi; паратифы А и В — S. paratyphi А и S, schottinuelleri (В), соответственно. Это Гр- подвижные палочки (перитрихи) длиной 1 -3 мкм; спор и капсул не образуют. ‘Факультативные анаэробы. Хорошо растут на простых средах, в том числе в присутствии желчи, образуя прозрачные колонии диаметром 2-4 мм, в бульоне — равномерное помутнение. Биохимические и антигенные свойства сальмонелл разнообразны и лежат в основе их идентификации. Чувствительны к обычным дезин-фектантам, кипячению, пастеризации; во внешней среде (в воде) могут сохраняться до нескольких месяцев. Являются безусловно-патогенными, типичными инвазивными бактериями — возбудителями антропонозов (S. schottmuelleri патогенна также для телят, цыплят).
Источник инфекции — больной человек или микробоноситель, от которых возбудитель выделяется с фекалиями и мочой. Заражение — алиментарным путем (чаще инфицированной водой, молоком). Адгезины обеспечивают сальмонеллам прикрепление к эпителиоцитам кишечника, инва-зины — проникновение в лимфатический аппарат и брыжеечные лимфоузлы, где происходит их размножение. Зачало заболевания совпадает с поступлением бактерий в кровь (обычно через 2 недели после заражения). Период бактериемии сопровождается лихорадкой ‘и интоксикацией (при гибели сальмонелл в крови освобождается их эндотоксин). В дальнейшем происходит гематогенная диссеминация возбудителя в печень, селезенку, костный мозг и другие органы; в больших количествах сальмонеллы накапливаются в жёлчных протоках и желчном пузыре. С желчью они вновь поступают в кишечник и повторно внедряются в уже сенсибилизированные лимфатические фолликулы. Развивается аллергическая реакция феномен Артюса с образованием язв в стенке кишки. При прободении кишечной стенки или кишечном кровотечении возможен летальный исход. Иммунитет стойкий, повторные заболевания редки.
Микробиологическая диагностика основана на выделении возбудителя из крови, фекалий, мочи или желчи, а также на обнаружении сывороточных антител к возбудителю (в реакции агглютинации по Видалю, РПГА, ИФА и др.).
Специфическое лечение: антибиотики (чаше используют левомицетин).
Специфическая профилактика; для экстренной контактным назначают внутрь брюшнотифозный бактериофаг, антибиотики; для плановой (по эпидемическим показаниям) используют убитую или химическую брюшнотифозные вакцины.
Сальмонеллёзы вызывают многочисленные представители рода Salmonella — S. typhimurium, S.enteritidis, S.choleraesuis, S.haifa, S.anatum, реже — другие. Они отличаются от возбудителей тифо-паратифозных заболеваний экологическими особенностями, антигенной структурой и некоторыми патогенными свойствами.
Источник инфекции — различные животные (рогатый скот, свиньи, лошади, собаки, кошки, грызуны) и домашние птицы. Заражение чаще происходит при употреблении а пишу инфицированного мяса (говядины), кур и яиц; инфицирование мяса может быть прижизненным или по- стмортальным (при убое, разделке, хранении, транспортировке, кулинарной обработке). Возбуди тели относительно устойчивы во внешней среде, могут размножаться при температуре -4 (в условиях бытового холодильника) без заметного органолептического изменения продукта; сохраняется в замороженном мясе и яйцах до 1 года; кипячение убивает же мгновенно.
Сальмонеллы являются энтеротоксигенными, инвазивными и цитотоксичными микробами, повреждающими эпителиоциты кишечника; они размножаются в макрофагах, проникает в лимфатическую систему, а в некоторых случаях — в Кровь (с интоксикацией, диссеминацией и размножением во внутренних органах). Обычно заболевание протекает как острый гастроэнтерит (без генерализации) и в течение 3-5 дней заканчивается выздоровлением. Иммунитет нестойкий, типоспецифический.
В больничных условиях могут формироваться особые госпитальные штаммы сальмонелл. отличающиеся высокой вирулентностью, устойчивостью к антимикробным воздействиям и способностью вызывать среди больных вспышки госпитальной (внутрибольничной) инфекции, заражение которой происходит контактно-бытовым, воздушно- пылевым или пищевым путем.
Специфическое лечение: применяет при лечении генерализованных форм (левомицетин и другие антибиотики).
Специфическая профилактика: плановая не разработана; для экстреннрй предложен поливалентный сальмонеллезный бактериофаг.
Холеру вызывает холерный вибрион (Vibrio cholerae биовар cholerae, Vibrio cholerae биовар El-tor, Vibrio cholerae серовар О-139 «Бенгал») — Гр- небольшая изогнутая в виде запятой или прямая палочка без спор и капсул. Очень подвижен (монотрих). Факультативный анаэроб. Растет на простых средах. При выделении чистой культуры для посевов используют элективные среды — щелочную пептонную воду, щелочной питательный агар и др., где отмечают характерный рост: через 6 часов на пептонной воде — нежная голубоватая пленка, на агаре (через 12-18 ч) — прозрачные круглые гладкие колонии с голубым оттенком в косопроходящем свете. Биохимически активен. Холерные вибрионы, в отличие от нехолерных. Ферментируют до кислоты сахарозу, маннозу и не ферментируют арабинозу. По О-антигену холерные вибрионы относятся к группе 01, внутри которой различают серовары Огава, Инаба и Гикошима. Вибрионы других серогрупп (02, 03. 0138) не агглютинируются сывороткой серогруппы 01 и поэтому названы вибрионы «не 0-1 серогруппы». Некоторые из них могут вызывать кишечные инфекции у человека, а при наличии у них холерного экзотоксина — холероподобное заболевание. У холерных вибрионов (V.cholerae 01) различают 2 биовара: cholerae и el-tor, которые близки но антигенной структуре. Биовар el-tor является причиной 7-й пандемии холеры и отличается от биовара cholerae способностью к росту на среде с полимиксином, гемолизу бараньих эритроцитов, агглютинации куриных эритроцитов, образованию ацетона из глюкозы и чувствительностью к холерным фагам.
Возбудитель холеры чувствителен к высушиванию, действию солнечного света, конкурентной микрофлоры, кислот (а том числе слабых), обычных дезинфектантов, кипячению; он может длительно сохраняться в проточных водоема;;, морской воде, в организме гидробионтов (лягушек, устриц, крабов).
Важнейшими факторами патогенности холерного вибриона является экзотоксин (энтеротоксин) — холероген, а также пили адгезии, нейраминидаза.
Источник инфекции — микробоноситель или больной холерой человек, от которых возбудитель выделяется с фекалиями, рвотными массами.
Заражение происходит алиментарным путем (чаще с инфицированной водой). Попавшие в кишечник вибрионы колонизируют эпителий, выделяют холероген, который при участии нейрами нидазы проникает внутрь эпителиоцитов, активируя их аденилатциклазную систему, что приводит к выбросу из клеток солей и скоплению жидкости в просвете кишки. У больных отмечается неукротимая рвота, профузный понос, обезвоживание организма, которое может привести к гибели больного. Для холеры характерно быстрое эпидемическое распространение и относительно высокая летальность, поэтому ее относят к особо опасным инфекциям.
Микробиологическая диагностика проводится в соответствии с утверждёнными инструкция-ми в специальных лабораториях и включает: методы экспресс-диагностики, выделение чистой культуры и ее идентификацию (по морфолого-культуральньш, биохимическим, антигенным свойствам и чувствительности к холерным фагам) с определением чувствительности возбудителя к антибиотикам.
Специфическое лечение: при выраженном обезвоживании наиболее значима патогенетическая терапия (введение солевых растворов для восстановления водно-солевого баланса организма); для этиотропной терапии используют антибиотики — тетрациклин, левомицетин.
Специфическая профилактика: для экстренной профилактики контактным назначают антибиотик (в соответствии с чувствительностью возбудителя), холерный бактериофаг; плановую профилактику проводят вакцинами (убитая холерная вакцина Эль-Тор; холероген-анатоксин с О-антигеном и ферментами вибриона). Большое значение в профилактике холеры имеет микробиологический контроль за импортируемой продукцией и водоемами, своевременное выявление больных и холерных микробоносителей, их изоляция и санация.
Эшерихии — типичные представители семейства энтеробактерий (Enterobacteriaceae). Род Escherichia представлен 1 видом (E.coli). Эшерихиозы вызывают патогенные варианты Е.соli -Гр-палочки длиной 2-6 мкм,чаще подвижные (перитрихи), без спор. Имеют пили (фимбрии), а некоторые штаммы микро- или макрокапсулу. Факультативные анаэробы. Хорошо растут на простых средах, образуя через 24 часа в питательном бульоне равномерное помутнение, на агаре — гладкие или шероховатые колонии средних размеров. На дифференциальных средах (Эндо, Левина) ферментируют (иногда медленно) лактозу и образуют окрашенные колонии. Обладают выраженными сахаролитическими свойствами (разлагают углеводы до кислоты и газа) и протеолитическими -разлагают белки до индола и сероводорода. В антигенной структуре различают 0-, К- и Н-антигены (термостабильные и термолабильные), по которым эшерихии делят на большое количество серогрупп и сероваров, обозначаемых в виде формулы (например: E.coli 0126:К60: Н2). Резистентность во внешней среде и к антимикробным воздействиям такая же, как у большинства энтеробактерий; эшерихии чувствительны к антибиотикам (аминогликозидам, тетрациклину), за исключением полирезистентных штаммов, например, госпитальных.
Среди возбудителей эшерихиозов различают энтеротоксигенные (0-1, 0-8), энтеропатогенные (0-55. O-l 11) и энтероинвазивные кишечные палочки (ЭТКП, ЭПКП и ЭИКП, соответственно), энтерогеморрагические (0-1576), энтероагрегативные (различные группы). Они отличаются набором факторов патогенности (адгезины, инвазины, цитотоксины) и по антигенной структуре, вызывают характерные для каждого варианта заболевания. Холероподобные заболевания чаще вызывают ЭТКП серогрупп 01, 015, 0148 и др.; дизентериеподобные — ЭИКП 0124, 0151 и др.; колиэнтериты у детей раннего возраста — ЭПКП 026. 055, 0111.
Источник инфекции — больной человек или микробоноситель. Заражение — алиментарным путем. Болеют чаще дети до 2 лет (колиэнтериты). Иммунитет слабый, типоспецифический. Местный иммунитет у детей и взрослых обеспечивают секреторные IgA; пассивный иммунитет у детей к дизентериеподобному эшерихиозу связан с поступлением через плаценту IgG к ЭИКП. Сывороточные IgM против ЭПКП не проходят через плаценту, поэтому к ЭПКП дети более восприимчивы.
Микробиологическая диагностика основанана на выделении от больных возбудителя в чистой культуре и его идентификации по морфолого-физиологическим, антигенным свойствам и факторам патогенности. Принадлежность к той или иной серогруппе определяют в РА с диагностическими коли-сыворотками.
Специфическое лечение: препараты из микробов-антагонистов (лактобактерин, бифидумбактерин, поливалентный коли-протейный бактериофаг против сероваров 0-55, 0-111); при тяжелом течении — антибиотики в соответствии с чувствительностью штамма-возбудителя.
Специфическая профилактика: не разработана.
Условно-патогенные E.coli способны вызвать эндогенные и экзогенные гнойно-воспалительные процессы различной локализации, сепсис; они, как правило, возникают в результате ослабления иммунной системы, фагоцитарной реакции, барьерных функций организма. Как эндогенные инфекции часто возникают циститы, пиелиты, холециститы, перитониты. Повреждающее действие на ткани организма оказывает, в основном, эндотоксин эшерихий. Уропатогенные варианты E.coli обладают особыми Р-ворсинками (адгезинами), которые обеспечивают распознавание рецепторов клеток мочевого тракта и прикрепление к ним.
Банальные эшерихий являются важным компонентом нормальной микрофлоры кишечника, участвуют в ее антагонистической, иммунизаторной, ферментативной и витаминообразуюшей функциях. Высоко-адаптированный штамм E.coli М-17 входит в состав лечебно-профилактических препаратов «Колибактерин», «Бификол».
Бактерии группы кишечной палочки (БГКП), включая E.coli, являются санитарно-показательными микробами; их обнаружение в объектах внешней среды позволяет судить о степени фекального загрязнения объектов и, следовательно, потенциальной опасности заражения кишечными инфекциями (дизентерией, брюшным тифом, полиомиелитом и др.).
Ботулизм вызывают клостридии (Clostridium botulinum) — крупные спорообразующие Гр+ палочки. Овальная спора придаёт клетке сходство с теннисной ракеткой. Подвижен (перитрих), капсулу не образует. Облигатный анаэроб. Растет на специальных средах; на жидких дает помутнение, на кровяном агаре — неправильной формы колонии с зоной гемолиза. Активно ферментирует белки и углеводы. При температуре 22-25 в анаэробных условиях на органических субстратах (например, в пищевых продуктах, консервах) продуцирует высокоядовитый экзотоксин (нейротоксин) одного из 7 серовара (А, В, С, D, E, F, G). Ботулотоксин — самый сильный биологический яд, поражающий различных животных, птиц и человека. Гибель наступает после приема 0,001 мг и более ботулотоксина.
Вегетативные клетки С. botulinum менее устойчивы во внешней среде, чем споры, которые выдерживают высушивание, замораживание, многочасовое кипячение, действие дезинфектантов. Ботулотоксин при кипячении разрушается в течение 20 минут. С. botulinum обитает в кишечнике животных, человека, рыб, а также в почве, где отмечается его размножение.
Ботулизм — тяжелое токсинемическое заболевание, пищевой токсикоз, сопровождающийся поражением бульбарных нервных центров. Отравление наступает после употребления в пишу продуктов с ботулотоксином, накопившимся в результате размножения С. botulinum (обычно это консервы домашнего приготовления: мясные, рыбные, грибные, овощные). Инкубационный период -6-24 часа, иногда — до 10 суток. Токсин не разрушается в пищеварительном тракте, быстро всасывается в кровь и избирательно блокирует функциональную активность нейронов. Отмечается об-нщя интоксикация, афония, поражение органов зрения (двоение, «сетка перед глазами»), затруднение глотания. Летальность достигает 60 % . Иммунитет слабый, типоспецифический; возможны повторные заболевания.
Микробиологическая диагностика направлена на обнаружение ботулотоксина и определение его серовара, а также выделение чистой культуры возбудителя. Токсин определяют в реакции нейтрализации на белых мышах, для чего животным вводят (после 5-минутного контакта) смесь экстракта из исследуемого материала (рвотных масс, фекалий, крови, подозреваемого продукта) с антитоксическими противоботулиническими сыворотками (поливалентной и наиболее распространенных типов А, В, С, и S). Для быстрого обнаружения и типирования токсина рекомендуется ставить РПГА с антитоксическими эритроцитарными диагностикумами. Выделение культуры ведут на специальных жидких средах в анаэробных условиях с последующей идентификацией но морфолого-физиологическим свойствам и определением типа токсина в культуральной жидкости.
Специфическое лечение: срочное введение противоботулинических сывороток (вначале поливалентной — А, В, С, Е, а после установления типа токсина — сыворотку соответствующего серовара).
Специфическая профилактика: экстренная проводится лицам, употреблявшим отравленный ботулотоксином продукт (вводится та же противоботулиническая сыворотка); плановая (при угрозе отравления) — введение полианатоксинов (А, В,Е) в составе препаратов «Тетраанатоксин», «Пентаанатоксин», «Секстаанатоксин».
Возбудители этого зооноза — бруцеллы 3 видов (Brucella melitensis, В. abortus, B.suis) — Гр- мелкие (0,5-1,0 мкм) палочки или кокки без спор, жгутиков и капсул. Аэробы. Культивируют их на специальных средах с добавлением крови, глюкозы и витаминов (обычно через 1-3 недели они образуют круглые бесцветные гладкие колонии). Идентификация и дифференциация бруцелл основана на биохимических свойствах, устойчивости к некоторым красителям и лизабельности бактериофагом. Патогенность связана с наличием инвазивных свойств, способности к внутриклеточному паразитизму, действием эндотоксина и наиболее выражена у В. melitensis. Возбудитель устойчив к факторам внешней среды, выдерживает пастеризацию.
Источник инфекции — больные бруцеллезом животные:
B-mеlitensis вызывает заболевание мелкого рогатого скота, B.suis — свиней. Бруцеллы относительно устойчивы во внешней среде, особенно при низкой температуре (в выделениях животных, почве, шерсти, мясе, брынзе они сохраняются до нескольких месяцев), высокочувствительны к обычным дезинфектантам и кипячению. Заражение происходит алиментарным путем (при употреблении в пищу молока и других продуктов животноводства), а также контактным и аэрозольным путем (при уходе за больными животными или работе с инфицированным сырьем). Бруцеллы способны проникать через неповрежденные слизистые оболочки. Распротраняются лимфогенно и гемагогенно, могут длительно сохраняться и размножаться в клетках лимфоидно-макрофагальной системы, поражая опорно-двигательный аппарат, нервную, сердечно-сосудистую и другие системы организма. Инкубационный период — 1-3 недели. Заболевание протекает в острой и хронической форме, сопровождается длительной лихорадкой, слабостью, потливостью, болями в суставах. С первых дней развивается аллергия по типу ГЗТ, которая сохраняется длительное время. Иммунитет клеточный и гуморальный, длительный. Он обусловлен фагоцитарной реакцией и действием ГЗТ.
Микробиологическую диагностику проводят иммунологическими методами: выявляют антитела к бруцеллам в сыворотке крови (в РА, РСК, РИГА и др.), выявляют ГЗТ к кожно-аллергической пробе Бюрне с бруцеллином. В специальных лабораториях проводят выделение и идентификацию чистой культуры (из крови, мочи, костного мозга).
Спешкпическос лечение: антибиотики (тетрациклин, левомицетин, стрептомицин), при хронических формах — вакцинотерапия (убитой бруцеллезной вакциной).
Специфическая профилактика: для плановой профилактики (животноводам, работающим в бруцеллёзных хозяйствах) вводят живую бруцеллезную вакцину.
источник