Реакция Видаля. Со второй недели заболевания в крови больных накапливаются антитела против возбудителя инфекции. Для их выявления исследуют сыворотку крови больного в реакции агглютинации. В качестве антигена используют убитые культуры сальмонелл — диагностикумы.
Для постановки реакции Видаля используют сыворотку больного, набор диагностикумов, изотонический раствор натрия хлорида.
Кровь (2-3 мл) из мякоти пальца или локтевой вены собирают в стерильную пробирку и доставляют в лабораторию. В лаборатории пробирку ставят в термостат на 20-30 мин для образования сгустка, затем пастеровской пипеткой обводят сгусток, чтобы отделить от стенки пробирки, и ставят на 30-40 мин на холод. Отделившуюся сыворотку отсасывают и используют для постановки реакции агглютинации с диагностикумами из сальмонелл тифа и паратифов. Для получения сыворотки кровь можно отцентрифугировать.
При возникновении инфекционного процесса — брюшного тифа или паратифов — в организме вырабатываются О- и Н-антитела к одноименным антигенам возбудителя.
О-антитела появляются первыми и исчезают довольно быстро. Н-антитела сохраняются долго. То же самое происходит и при вакцинации, поэтому положительная реакция Видаля с О- и Н-антигенами свидетельствует о наличии заболевания, а реакция только с Н-антигенами может быть и у переболевших (анамнестическая реакция), и у привитых (прививочная). Исходя из этого, реакцию Видаля ставят раздельно с О- и Н-антигенами (диагностикумы).
Так как клинически брюшной тиф и паратифы А и В сходны, то для выявления природы заболевания сыворотку больного испытывают одновременно с диагностикумами из сальмонелл тифа и паратифа А и В.
Реакцию Видаля широко используют, так как она проста и не требует специальных условий.
Поставить реакцию можно двумя способами: капельным и объемным (см. главу 12). В практике чаще используют объемный метод. При постановке линейной реакции агглютинации количество рядов должно соответствовать количеству антигенов (диагностикумы). Возбудителем заболевания считают микроорганизм, диагностикум из которого агглютинировался сывороткой больного. Иногда отмечают групповую агглютинацию, так как возбудители тифа и паратифов обладают общими групповыми антигенами. В этом случае положительным считают результат реакции в ряду, в котором агглютинацию отмечают в большем разведении сыворотки (табл. 36).
Таблица 36. Возможный результат реакции агглютинации
Примечание. В практике реакцию Видаля ставят с четырьмя диагностикумами: брюшного тифа «О» и «Н», а паратифов А и В — с диагностикумами «ОН».
Если агглютинация возникает только в небольших разведениях сыворотки — 1:100, 1:200, то для отличия реакции при заболевании от прививочной или анамнестической прибегают к повторной постановке реакции агглютинации через 5-7 дней. У больного титр антител повышается, а у привитого или переболевшего не изменяется. Таким образом, нарастание титра антител в сыворотке крови служит показателем заболевания.
В ответ на внедрение в организм возбудителей брюшного тифа, обладающих Vi-антигеном, в крови больного появляются Vi-агглютинины. Их определяют со 2-й недели болезни, но титр их обычно не превышает 1:10. Обнаружение Vi-антител связывают с наличием в организме возбудителей брюшного тифа, поэтому определение этих антител имеет большое эпидемиологическое значение, так как позволяет выявить бактерионосителей.
Реакция Vi-гемагглютинации. Это наиболее чувствительная реакция для выявления антител.
Принцип реакции заключается в том, что эритроциты человека (I группы) или барана после специальной обработки могут адсорбировать на своей поверхности Vi-антиген и приобретают при этом способность агглютиниповаться соответствующими Vi-антителами.
Эритроциты с адсорбированными на поверхности антигенами называют эритроцитарными диагностикумами.
Для постановки реакции Vi-гемагглютинации берут:
1) сыворотку крови больного (1-2 мл); 2) эритроцитарный сальмонеллезный Vi-диагностикум; З) Vi-сыворотку; 4) О-сыворотку; 5) изотонический раствор натрия хлорида.
Реакцию ставят в агглютинационных пробирках или в пластмассовых пластинах с лунками.
Кровь у больного берут так же, как для реакции Видаля. Получают сыворотку. Из сыворотки готовят двукратные серийные разведения, начиная с 1:10 до 1:160.
По 0,5 мл каждого разведения вносят в лунку и прибавляют по 0,25 мл эритроцитарного диагностикума. Реакцию ставят в объеме 0,75 мл.
Контролем служат: 1) стандартная агглютинирующая монорецепторная сыворотка + диагностикум — реакция должна быть положительной до титра сыворотки; 2) диагностикум в изотоническом растворе натрия хлорида (контроль) — реакция должна быть отрицательной.
Содержимое лунок тщательно перемешивают, ставят в термостат на 2 ч и оставляют при комнатной температуре до следующего дня (на 18-24 ч).
Учет начинают с контроля. Реакцию оценивают в зависимости от степени агглютинации диагностикума.
Результаты учитывают по четырехкрестной системе:
++++ эритроциты полностью агглютинированы — осадок на дне лунки в виде «зонтика»;
+++ «зонтик» меньше, не все эритроциты агглютинировались;
++ «зонтик» маленький, на дне лунки имеется осадок из неагглютинированных эритроцитов;
— реакция отрицательная; эритроциты не агглютинировались и осели на дно лунки в виде пуговки.
1. В какой период заболевания ставят реакцию Видаля?
2. Какие ингредиенты необходимы для постановки реакции Видаля?
3. С какими диагностикумами ставят реакцию Видаля?
4. Какая из серологических реакций является самой чувствительной при диагностике тифопаратифозных инфекций?
5. Каким диагностикумом пользуются при постановке реакции Vi-гемагглютинации?
6. Какой сывороткой определяют наличие Vi-антигена у исследуемой культуры?
7. Какое значение имеет определение Vi-фаготипа?
Возьмите у преподавателя О- и Н-диагностикумы из сальмонелл тифа, паратифа А и паратифа В и сыворотку больного. Поставьте реакцию Видаля.
Питательные среды
Среды ЭМС, Плоскирева, висмут-сульфитный агар выпускаются медицинской промышленностью в виде сухого порошка. Их готовят согласно указаниям на этикетке: отвешивают определенное количество порошка, наливают соответствующее количество воды, кипятят и разливают в стерильные чашки Петри.
Среда Рассела. В 950 мл дистиллированной воды добавляют 40 г сухой питательной среды и прибавляют 5 г питательного агара. Нагревают до кипения и растворения порошков. В 50 мл дистиллированной воды растворяют 1 г х. ч. глюкозы и добавляют к приготовленной смеси. Среду разливают в стерильные пробирки по 5-7 мл, стерилизуют текучим паром (2 дня по 2 мин) и скашивают так, чтобы оставался столбик. Среду Рассела с маннитом и сахарозой готовят так же.
Среда Олькеницкого из сухого агара. 2,5 г сухого питательного агара расплавляют в 100 мл дистиллированной воды. В остуженный до 50° С агар прибавляют все ингредиенты, указанные в рецептуре (этикетке). Среду, разлитую в пробирки, стерилизуют текучим паром (3 дня по 20 мин) и затем скашивают. Готовая среда должна быть бледно-розового цвета.
Дата добавления: 2016-11-22 ; просмотров: 495 | Нарушение авторских прав
источник
Брюшной тиф представляет собой острое инфекционное поражение тонкого кишечника. Возбудителем заболевания является сальмонелла, которая проникает в организм вместе с пищей или грязной водой. Характеризуется фекально-оральным путем передачи, поэтому заразиться можно не только от продуктов, но и от заболевшего человека или носителя бактерии.
Чтобы диагностировать кишечную инфекцию, используется несколько основных методов. Они включают в себя исследования биологических жидкостей человеческого организма различными способами.
Попадая в пищеварительный тракт, бактерия начинает активно размножаться. Инкубационный период длится около 2 недель, после чего симптоматика брюшного тифа уверенно нарастает. Зачастую первичными признаками можно считать кишечные проявления, которые дают о себе знать в течение нескольких первых дней.
Очень часто наблюдаются вспышки брюшного тифа среди определенной группы лиц: работников одной службы или деток, которые посещают детский сад. Это становится главной причиной для проведения тщательной и своевременной диагностики.

- Общие признаки интоксикации. После заражения происходит устойчивое повышение температуры, организм отличается вялостью, тифозный пациент ощущает тошноту, аппетит отсутствует.
- Расстройство пищеварения. Тошнота, диарея и рвота проявляются в первые дни заражения, сопровождая пациента на протяжении всей болезни до выздоровления.
- Нервные проявления. Такой симптом обуславливается тем, что сальмонелла поражает нервную систему, благодаря чему наблюдается депрессия, спутанность сознания, полная апатия. Пострадавший может бредить, видеть галлюцинации. Именно эти признаки отличают брюшной тиф от других кишечных заболеваний.
- Сбой в работе сердечно-сосудистой системы. Состояние ухудшается за счет стремительного падения артериального давления. Ритм сердца становится слабым, нечетким. Такая симптоматика может стать причиной кислородного голодания мозга и всех тканей организма.
- Если увеличилась печень или селезенка, пациент будет ощущать дискомфорт в подреберье.
- Попадание сальмонеллы в дыхательную систему провоцирует кашель, одышку. В некоторых случаях развивается пневмония.
Наличие всех этих симптомов служит достаточным поводом для проведения тщательной диагностики. Как правило, пострадавшего с такими признаками госпитализируют в стационар для дальнейшего обследования.
Самолечением заниматься категорически запрещено. Это становится опасно не только для заболевшего брюшным тифом, но и для всего его окружения.
Точный диагноз может поставить только врач, после всех лабораторных исследований. Для выявления заболевания производится тщательный опрос и осмотр пациента, назначаются общеклинические исследования, серодиагностика брюшного тифа и бакпосев. Также проводится дифференциальная диагностика для исключения других болезней, которые обладают схожей симптоматикой.

Основные вопросы специалиста:
- где и как происходило питание пострадавшего в последнее время;
- употреблял ли воду, не предназначенную для этого;
- купался ли человек в каком-либо водоеме.
Также важной информацией для врача становится рассказ о недавнем путешествии, если оно было. Во время опроса специалист выявляет круг лиц, с которым контактировал зараженный брюшным тифом. Это необходимо для предотвращения дальнейшего заражения других людей.

Визуально на брюшине можно увидеть сыпь, которая при надавливании бледнеет. Увеличение печени и селезенки диагностируются путем пальпации.
Инфекционист обращает внимание на состояние и поведение больного. Если имеют место быть психологические проявления при повышении температуры и диарее, брюшной тиф становится предварительным диагнозом. Полную клиническую картину можно получить после проведения анализов.
Лабораторная диагностика брюшного тифа включает в себя проведение общего анализа крови и мочи. При заражении сальмонеллой в крови происходит резкое повышение лейкоцитов, после чего возникает лейкопения, то есть снижение их до низких отметок. Наблюдается отсутствие эозинофилов, повышение СОЭ отмечается незначительное.
При заражении брюшным тифом моча изобилует большим количеством эритроцитов, белка и цилиндров.
Высевание микрофлоры желчи проводится после полного выздоровления пострадавшего. Это помогает исключить хроническое носительство.
Наиболее быстро исследование даст положительный результат, если высевать бактерию из крови. Кал и моча изобилуют сальмонеллой спустя полторы недели после заражения. При подозрении на повреждение костного мозга его также могут исследовать методом бакпосева.
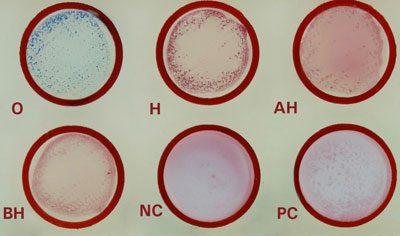
- Реакция Видаля на брюшной тиф. Определяет в сыворотке О- и Н-антигены. Клетки крови смешиваются со специальным веществом, после чего сильно склеиваются, опадая в виде осадка. Реакция будет наблюдаться не только у пациента, который заболел, но также у хронического носителя или лица, перенесшего прививку от брюшного тифа. Поэтому для обнаружения роста и развития бактерий такой анализ проводится несколько раз.
- Пассивная гемагглютинация. Во время исследования наблюдается, как эритроциты крови аглютенируют, то есть склеивают свои же клетки, пораженные антигенами бактерий. Титр антител можно наблюдать только в динамике, поэтому анализ на брюшной тиф проводится также неоднократно.
Дифференциальный метод диагностики помогает отличить брюшной тиф от других заболеваний со схожей симптоматикой. Это также играет огромную роль в назначении последующего лечения.
- бруцеллез;
- кишечную инфекцию;
- сыпной тиф;
- осложненный грипп;
- менингококковую инфекцию;
- отравление медикаментами.
Благодаря методам диагностики брюшной тиф удается диагностировать на относительно ранних стадиях болезни, что отражается на качестве дальнейшего лечения. Верная постановка диагнозов в большинстве случаев гарантирует полное исцеление пациента без развития последующих осложнений.
источник
Для постановки реакции берут:
1) сыворотку исследуемого больного для определения в ней
антител;
2) О — и Н-диагноста кумы бактерий брюшного тифа, паратифа А и паратифа В;
3) физиологический раствор.
Кровь для получения сыворотки берут в количестве—15—20 капель путем укола мякоти пальца или 2 —3 мл при помощи венепункции.
Дают крови свернуться в термостате в течение 30—60 минут, затем простерилизованной петлей обводят сгусток, отделяя его от стенки пробирки, и дают отстояться сыворотке на холоду до образования над сгустком прозрачного слоя. Сыворотку помещают пипеткой в отдельную пробирку. Первое разведение (1:50) делают при помощи пипетки—0,1 мл сыворотки + 4,9 мл физиологического раствора. Дальнейшие разведения (1:100— 1:200 — 1 : 400—1:800) готовят по обычной схеме.
Берут 6 рядов пробирок по 6 пробирок в каждом. По 1 мл сыворотки разведения 1: 100 наливают в первую пробирку каждого ряда, 1: 200 — во вторую, 1 : 400 — в третью и т. д.; в шестую, контрольную, пробирку наливают 1 мл физиологического раствора.
Во все пробирки первого ряда добавляют по 1—2 капли брюшнотифозного Н-диагностикума; в пробирки второго ряда — брюшнотифозный 0-диагностикум; в пробирки третьего я четвертого ряда добавляют А-паратифозный, Н — и 0-диагностикумы, а в 5-й и 6-й ряд— В-паратифозный H — и 0-диагностикум. Пробирки ставят в термостат на 2 часа, отмечают результат реакции, затем оставляют при комнатной температуре на сутки; после этого срока дают заключение об окончательном результате реакции.
Возбудителем заболевания считается тот микроб, который агглютинируется сывороткой больного. Реакция считается положителыной, если агглютинация произошла хотя бы в первой пробирке с разведением 1: 100; обычно она наступает в больших разведениях. Если происходит групповая агглютинация с двумя или с тремя антигенами, то за возбудителя болезни принимается тот микроб, с которым произошла агглютинация в наиболее высоком разведении сыворотки.
5. РСК с целью серодиагностики сыпного тифа
Тип реакции — реакция связывания комплемента.
Исследуемый материал — парные сыворотки крови больного (сыворотки одного и того же больного, взятые у него с временным промежутком не менее 5-7 дней).
Диагностический препарат — сыпнотифозный антиген для РСК.
Дополнительные ингредиенты реакции: комплемент в рабочей дозе; гемолитическая сыворотка в рабочей дозе; эритроциты барана (3 % взвесь).
Положительная реакция — задержка гемолиза; отрицательная — гемолиз.
Диагностическим критерием является нарастание титра антител не менее, чем в 4 раза (во второй сыворотке по сравнению с первой).
Обычно реакцию применяют для ретроспективной диагностике.
В данном случае. (результат и вывод).
Реакции Вассермана (серодиагностика сифилиса)
Исследуемый материал: сыворотка обследуемого.
1. Неспецифический кардиолипиновый АГ (антиген) для реакции Вассермана — спиртовая липидная вытяжка из миокарда быка, обогащенная холестерином.
2. Специфический ультраозвученный трепонемный АГ – содержит АГ культуральных трепонем, разрушенных ультразвуком.
Дополнительные ингредиенты реакции: комплемент в рабочей дозе; гемолитическая сыворотка в рабочей дозе; эритроциты барана (3 % взвесь).
Положительная реакция — задержка гемолиза; отрицательная — гемолиз.
Качественный метод — сыворотку обследуемого вносят в 2 лунки, добавляют соответственно АГ 1 и АГ 2, а затем в обе лунки — дополнительные ингредиенты реакции. Применение: отбор лиц для постановки количественной реакции Вассермана.
В данном случае обследованы пациенты . (результат, вывод).
Количественный метод — диагностика сифилиса, контроль эффективности терапии. Готовят разведения положительной сыворотки (по качественной реакции). К каждому разведению добавляют трепонемный ультраозвученный АГ (АГ2) и дополнительные ингредиенты реакции. Положительный результат — ЗГ (задержка гемолиза), отрицательный — Г (гемолиз).
Результат интерпретируют, основываясь на количестве антител.
В данном случае. (результат и вывод).
7. РСК с целью раздельного определения IgM и IgG
Тип реакции — реакция связывания комплемента.
Исследуемый материал — сыворотка крови больного (нативная и обработанная меркаптоэтанолом).
Диагностический препарат — известный антиген для РСК.
Дополнительные ингредиенты реакции: комплемент в рабочей дозе; гемолитическая сыворотка в рабочей дозе; эритроциты барана (3 % взвесь).
Положительная реакция — задержка гемолиза; отрицательная — гемолиз.
Принцип метода: при обработке сыворотки меркаптоэтанолом разрушаются IgM.
Следовательно, с обработаной сывороткой реакция идет только за счет IgG.
Постановка реакции: готовят разведения нативной и обработанной сывороток, добавляют диагностический препарат и дополнительные ингредиенты реакции.
Трактовка результатов: если с обработанной сывороткой реакция идет практически таком же титре, как с необработанной, значит она содержит преимущественно IgG Если в обработанной сыворотке титр антител резко снизился по сравнению с необработанной, значит она содержит преимущественно IgM.
В данном случае. (результат и вывод).
8. РНГА с Vi-эритроцитарным диагиостикумом
Тип реакции — реакция непрямой гемагглютинации.
Исследуемый материал — сыворотка крови обследуемого.
Диагностический препарат — Vi-эритроцитарный диагностикум (взвесь в физиологическом растворе эритроцитов барана с нагруженными на них Vi — антигенами S.typhi ).
Принцип реакции: к разведениям сыворотки обследуемого добавляют Vi-эритроцитарный диагностикум.
Положительный результат – гемагглютинат («зонтик»); отрицательный результат — плотный осадок эритроцитов на дне лунки («пуговка»).
Диагностический тигр реакции 1/ 40.
Применение: отбор лиц, имеющих титр антител к Vi – антигенам S.typhi выше диагностического.
Трактовка результатов: лица с положительной реакцией в титре выше, чем 1/40 считаются подозрительными на бактерионосительство S.typhi и подлежат бактериологическому обследованию на наличие S.typhi в кале, моче и желчи.
В данном случае. (результат и вывод).
Реакция флоккуляции
Тип реакции: частный случай реакции преципитации (нейтрализации).
Исследуемый материал: антитоксическая сыворотка.
Диагностический препарат: токсин или анатоксин в строго определенном количестве.
Принцип метода: к серийным разведениям антитоксической сыворотки добавляют одинаковое количество антигенных единиц токсина или анатоксина.
Положительный результат — образование хлопьев преципитата (флоккулята); отрицательный результат — прозрачная жидкость.
Применение: определение активности антитоксической сыворотки (количества ME — международных единиц в 1 мл сыворотки).
Трактовка результатов: первичная (инициальная) флоккуляция наступает в пробирке, где АГ (антиген) и АТ (антитело), находятся в эквивалентных количествах. Зная количества ингредиентов в пробирке, где произошла инициальная флоккуляция, можно рассчитать активности антитоксической сыворотки. Например, инициальная флоккуляция наступила в пробирке, где находится 0,02 мл сыворотки и 4 АЕ (антигенных единиц) токсина или анатоксина. Составляем пропорцию: 0,02 мл сыворотки эквивалентно 4 АЕ токсина или анатоксина.
Одна АЕ — это такое количество токсина или анатоксина, которое связывается одной ME антитоксической сыворотки, следовательно, 0,02 мл данной сыворотки содержит 4 ME.
Титр антитоксической сыворотки — это количество ME в 1 мл этой сыворотки.
В данном случае, составив пропорцию, можно определить титр:
В данном случае. (результат и расчет).
Титрование комплемента
Тип реакции — реакция иммунного гемолиза.
Исследуемый материал — свежая сыворотка крови.
Дополнительные ингредиенты реакции: гемолитическая система (гемолитическая сыворотка в рабочей дозе и 3% взвесь эритроцитов барана).
Положительная реакция — гемолиз; отрицательная — задержка гемолиза.
Титр комплемента — наибольшее разведение комплемента, в котором наблюдается гемолиз.
Применение: для определения титра комплемента. Если речь идет о титровании комплемента перед постановкой РСК, то титр определяют для дальнейшего расчета рабочей дозы. Используется разведение на 25% концентрированнее, чем титр.
В данном случае. (результат).
Дата добавления: 2018-09-22 ; просмотров: 58 ; ЗАКАЗАТЬ РАБОТУ
источник
• Микробиологическая диагностика брюшного тифа и паратифов
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: исходя из особенностей патогенеза брюшного тифа, на 1-й неделе заболевания, в период бактериемии, возбудителей выделяют из крови (получение гемокультуры), со 2-й недели заболевания — из испражнений (получение копрокультуры), мочи или желчи.
Бактериологическое исследование(схема 13.2.1).
Получение гемокультуры. В 1-й день из локтевой вены больного берут 5—10 мл крови и засевают в колбу с 50—100 мл селективной среды Раппопорт, содержащей желчный бульон (для подавления роста других бактерий), глюкозу, индикатор Андреде и поплавок для обнаружения газа. Указанные соотношения крови и среды необходимы для подавления бактерицидного действия белков крови. Посевы инкубируют при 37 «С в течение 18—20 ч. На 2-й день при росте сальмонелл наблюдается помутнение и изменение цвета среды. При росте паратифозных бактерий (биовары paratyphi А, Си schottmuelleri) наряду с указанными изменениями появляются пузырьки газа в поплавке. Для ускорения ответа из среды Раппопорт делают мазки и препараты «висячая» капля. При наличии чистой культуры грамотрицательных подвижных палочек и изменении цвета среды (или наличии газа) дают первый предварительный ответ. Затем культуру из среды Раппопорт пересевают в пробирку со средой Ресселя, полагая при этом, что из крови выделена чистая культура и можно сразу приступить к ее идентификации. Одновременно со среды Раппопорт делают посевы на среду Эндо для получения изолированных колоний с целью проверки чистоты выделенной культуры.
На 3-й день отмечают ферментацию глюкозы на среде Ресселя и ставят ориентировочную реакцию агглютинации на стекле. На основании полученных данных дают второй предварительный ответ. Для дальнейшего исследования отбирают несколько бесцветных колоний со среды Эндо и пересевают их в среду Ресселя или скошенный питательный агар (для контроля полученных результатов). Чистую культуру пересевают на среды «пестрого» ряда и серотипируют в реакции агглютинации на стекле со смесью групповых сывороток, а затем с
адсорбированными монорецепторными О- и Н-сальмонеллез-ными сыворотками. Окончательный диагноз устанавливают на основании биохимических (табл. 13.2.1) и антигенных свойств.
Таблица 13.2.1. Биохимические свойства сальмонелл — возбудителей брюшного тифа и паратифов
| Биовар S.enterica | Ферментация | Образование | |||||
| лактозы | глюкозы | мальтозы | сахарозы | ман-нита | H2S | NH3 | индола |
Paratyphi А — КГ КГ — КГ — —
Schottmuelleri — КГ КГ — КГ + +
Условные обозначения: К — образование кислоты; КГ — образование кислоты и газа; (+) — обнаружение признака; (—) — отсутствие признака.
Биохимические признаки (развернутый «пестрый» ряд) позволяют дифференцировать сальмонеллы от схожих сними энтеробактерий: Citrobacter, Hafnia (табл. 13.2.2).
Таблица 13.2.2. Дифференциация сальмонелл и других энтеробакте рий по биохимическим признакам
| Род | Лизин- декар- бокси- лаза | Ферментация углеводов | р- Галак-този-даза | ||
| дуль-цита | сорбита | ксилозы | рам-нозы | салицина | 4% лактозы |
Citrobacter — К(-) К К К К(±) К(±) К
Hafnia + — — К К К(+) — К
Условные обозначения: (+) — положительная реакция; (—) — отрицательная реакция; ± — вариабельная реакция; К — образование кислоты; К(—) — образование кислоты (редко); К(±) — образование кислоты (вариабельно).
Выделенную чистую культуру бактерий используют для определения чувствительности к антимикробным препаратам.
Фаготипирование. С помощью набора стандартных Vi-фагов определяют до 78 фаготипов S.enterica биовара typhi. При этом необходимым условием является наличие в культуре FZ-антигена. Культуры S.enterica биовара paratyphi В (schottmuelleri) дифференцируются на11 фаготипов и подтипов.
Получение копрокультуры. Испражнения засевают на одну из дифференциально-диагностических сред (Эндо или Левина) или элективные среды обогащения (Мюллера, селени-
товая или висмут-сульфит агар). Для посева петлю фекалий вносят в пробирку с изотоническим раствором хлорида натрия и готовят суспензию. После оседания крупных комочков суспензию петлей наносят на поверхность агаровой среды — на одну половину чашки. Материал тщательно растирают шпателем по одной, а затем по другой половине чашки для получения изолированных колоний. Посевы инкубируют при 37 °С в течение 18—20 ч. На 2-й день изучают характер колоний, выросших на чашках (рис. 13.2.1; на вклейке), пересевают 2—3 бесцветные колонии (со среды Эндо или Левина) или колонии черного цвета (висмут-сульфит агар) на среду Ресселя и в пробирки со скошенным питательным агаром. При отсутствии подозрительных колоний на чашках делают высевы из среды Мюллера или селенитовой среды на чашки со средой Эндо для получения изолированных колоний. Для ускорения ответа ставят ориентировочную реакцию агглютинации на стекле с материалом, взятым из бесцветной колонии. Далее поступают так же, как и при идентификации гемокультуры.
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования.Молеку-лярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз.
Серодиагностика. Влабораторной практике широко применяют развернутую реакцию агглютинации Видаля, основанную на обнаружении в сыворотке крови людей антител — агглютининов, которые появляются в конце 1-й — начале 2-й недели заболевания. Реакцию ставят одновременно с четырьмя антигенами: О- и Н-брюшнотифозными, А- и В-паратифозными диагностикумами. Брюшнотифозные монодиагностикумы применяют для установления стадии болезни, так как содержание О- и Н-антител в разные ее периоды неодинаково. О-антитела появляются на 1-й неделе, накапливаются в разгар заболевания и исчезают к моменту выздоровления. Н-антитела появляются в разгар заболевания, накапливаются к концу заболевания и сохраняются у переболевших в течение длительного времени. У людей, вакцинированных против брюшного тифа и парати-фов, также наблюдается положительная реакция Видаля, причем в довольно высоком титре, поэтому «инфекционный Ви-даль» удается отличить от «прививочного» только по нарастанию титра агглютининов у больных в процессе заболевания. Реакцию Видаля ставят в четырех рядах пробирок по 7 пробирок в каждом ряду, из которых 5 опытных и 2 контрольные. Для контроля каждого диагностикума в пробирки вносят по 1 мл изотонического раствора хлорида натрия, в который добавляют 2 капли диагностикума. В контрольной пробирке с
1 мл сыворотки (без диагностикума) не должно быть хлопьев. При спонтанной агглютинации реакция не учитывается. Диагностический титр реакции Видаля равен 1:200. Для серологического исследования реконвалесцентов и выявления бактерионосителей широко используют реакцию непрямой И-гемаг-глютинации, с помощью которой в сыворотке крови людей определяют присутствие антител к К/-антигену. В качестве антигена используют эритроцитарный Р?-диагностикум, представляющий собой взвесь эритроцитов человека 1(0) группы, обработанных формалином и сенсибилизированных Fz’-антиге-ном S.enterica биовара typhi. Готовят разведения испытуемой сыворотки от 1:10 до 1:1280. При положительной реакции эритроциты покрывают дно пробирки в виде диска с зазубренными краями, а надосадочная жидкость остается прозрачной. При отрицательной реакции, так же как и в контроле, эритроциты осаждаются на дно пробирки и имеют виддиска с ровными краями («пуговки»). Диагностическое значение имеет титр пассивной Й-гемагглютинации, начиная с 1:40 и выше. Всех лиц, сыворотка крови у которых дает положительный результат в РНГА с эритроцитарным F/f-диагностикумом, рассматривают как подозрительных на носительство S.enterica биовара typhi и подвергают многократному бактериологическому обследованию.
• Микробиологическая диагностика сальмонеллезов
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: испражнения, при генерализованной форме — кровь.
МЕТОДЫ ДИАГНОСТИКИ: микробиологическая диагностика сальмонеллезов принципиально не отличается от диагностики брюшного тифа и паратифов. Серодиагностика не применяется по причине большого числа сероваров возбудителей.
• Микробиологическая диагностика кишечного иерсиниоза
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: испражнения, при генерализованной форме — кровь, моча, спинномозговая жидкость.
МЕТОДЫДИАГНОСТИКИ:
Бактериологическое исследование.Посев материала на дифференциально-диагностические (среда Эндо, Мак-Конки, СБТС-агар с желчью и бромтимоловым синим) и селективные (CIN-arap с антибиотиками цефсулодином и новобиоцином) плотные среды или жидкие среды обогащения (буферно-казе-иново-дрожжевой бульон, 1 %, пептонная вода с рН 7,6—7,8). Посевы инкубируют при 25 «С в течение 24—48 ч. Идентификация чистой культуры осуществляется на основании морфологии, подвижности, тинкториальных свойств (грамотрица-
тельные палочки с закругленными концами и характерным биполярным окрашиванием, неспорообразующие, перитрихи), культуральных, биохимических признаков.
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования.Молеку-лярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР.В случае обнаружения соответствующих молекул можно поставить предварительный диагноз.
Серодиагностика.Диагностическое значение имеет обнаружение антител к поверхностным антигенам возбудителей наиболее распространенных серотипов (03, 04, 05, 06, 08, 09) в РА. Положительной считается РА в титре не менее 1:160. Разработаны также ИФА-тесты.
• Микробиологическая диагностика кишечного дисбактериоза
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: фекалии. МЕТОДЫ ДИАГНОСТИКИ:
Бактериоскопическое исследование.Имеет ориентировочное значение. При резко выраженном дисбактериозе в мазках преобладают микроорганизмы определенных видов (например, дрожжеподобные грибы, стафилококки и др.) на фоне существенного уменьшения грамотрицательной микрофлоры.
Бактериологическое исследование.Проводится количественное исследование состава микрофлоры кишечника. Для этого из исследуемого материала готовят разведения Ю -2 , 10 -4 , Ю -6 и т.д. Первичные посевы по 0,1 мл каждого разведения производят параллельно на несколько питательных сред (Эндо, кровяной агар, ЖСА, агар Сабуро и др.) и инкубируют при 37 °С. Подсчитывают число выросших колоний и определяют число КОЕ в 1 г материала. Проводят отсев 2—3 колоний каждого вида для выделения и идентификации чистых культур микроорганизмов.
Дляобнаружения анаэробных Bifidobacterium spp. делают мерные посевы материала в разведениях 10″ 7 и выше в пробирки с 13—15 мл модифицированной среды Блаурокка, в состав которой входит печеночный бульон, пептон — 1 %, лактоза — 1 %, хлорид натрия — 0,5 %, цистин — 0,01 %, агар-агар — 0,75%, твин-80 — 0,1 %. При росте Bifidobacterium spp. через 24—48 ч происходит помутнение всей среды с образованием тяжей или отдельных колоний. Готовят мазки и окрашивают по методу Грама. Выделение чистых культур Bifidobacterium spp. является весьма трудоемким и практически необязательным. При необходимости идентификацию представителей рода осуществляют по биохимическим свойствам.
Для оценки результатов бактериологического исследования
сопоставляют полученные данные с количественным содержанием микроорганизмов в норме. Ориентировочные критерии нормальной микрофлоры толстой кишки представлены в табл. 13.2.3.
Таблица 13.2.3. Критерии нормы кишечной флоры
Патогенные микробы сем. Enterobacteriaceae О
Общее количество E.coli, млн/г 300—400
E.coli со слабовыраженными ферментативными
свойствами, % До 10
E.coli с гемолитическими свойствами, % Нет
Энтеробактерии (лактозоотрицательные и лактозополо
жительные): Hafnia, Aerobacter, Citrobacter, Klebsiella,
Serratia, % До 5
Гемолитический стафилококк по отношению ко
всем кокковым формам, % Нет
Bifidobacterium spp. (рост при посеве разведения) 10 и выше
Бактерии рода Proteus Нет
При кишечном дисбактериозе происходит значительное снижение облигатной анаэробной микрофлоры, и в первую очередь Bifidobacterium spp., а также увеличение аэробных видов, в частности E.coli, содержание которых может превышать 10 11 микробных клеток в 1 г испражнений. Увеличивается частота обнаружения штаммов E.coli со слабой ферментацией лактозы и имеющих гемолитические свойства (до 30—40 %), гемолитических и негемолитических стафилококков, бактерий рода Proteus, грибов рода Candida (до 15—16 %). У лиц с дис-бактериозами более часто обнаруживают лактозоотрицательные и лактозоположительные энтеробактерии, относящиеся к родам Hafnia, Aerobacter, Citrobacter. Для микроорганизмов, в норме отсутствующих в испражнениях или имеющихся в небольшом количестве, показателем дисбактериоза будет содержание их 10 5 —10 6 и выше КОЕ в 1 г материала (Proteus spp., Klebsiella pneumoniae, Pseudomonas aeruginosa, Staphylococcus aureus, Candida spp.). Для окончательного заключения о кишечном дисбактериозе важное значение имеет повторное его выявление в динамике обследования больного.
• Диагностические, профилактические и лечебные препараты
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: При сдаче лабораторной работы, студент делает вид, что все знает; преподаватель делает вид, что верит ему. 9094 — 

193.124.117.139 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник
С 8-го дня заболевания в крови у больных брюшным тифом можно обнаружить агглютинины. Для постановки реакции агглютинации необходимо иметь сыворотку больного и диагностикумы – взвеси убитых бактерий брюшного тифа, паратифы А и В (реакция Видаля). У больного из вены берут в пробирку 1-2 мл крови. Для ускорения свертывания крови пробирку ставят на 30 минут в термостат. Затем свернувшуюся кровь некоторое время дают отстояться на холоде, далее осторожно отделяют сгусток обожженной петлей от стенок пробирки, после чего сыворотку отсасывают. Кровь для» получения сыворотки можно взять и посредством укола мякоти безымянного пальца. Из сыворотки с помощью физиологического раствора готовят три ряда разведений: 1:100, 1:200, 1:400, 1:600 каждое в объеме 1 мл. Затем в пробирки с разведенной сывороткой добавляют по 1-2 капле диагностикумов тифа и паратифа А и В. Для контроля реакции в конце каждого ряда помещают пробирку, в которой смешивают по 1 мл физиологического раствора и по 1-2 капле соответствующих диагностикумов. Пробирки ставят на 2 часа в термостат, после чего учитывают предварительный результат реакции. Окончательный результат отмечают на второй день после стояния пробирок в условиях комнатной температуры. Реакция считается положительной при наличии агглютинации в разведении сыворотки не менее чем 1:200.
Реакция Видаля может дать положительный результат не только у больных, но и у лиц, до того перенесших брюшной тиф («анамнестический Видаль»). Кроме того, положительная реакция иногда является результатом проведенных ранее прививок («прививочный Видаль»). «Анамнестический» и «прививочный Видаль» отличают от инфекционного следующим образом. Реакцию Видаля ставят повторно на протяжении болезни. В случае заболевания брюшным тифом с каждым днем происходит нарастание титра антител, то есть положительная реакция отмечается все в больших разведениях сыворотки. Этого не наблюдается при «анамнестическом» или «прививочном Видале».
Для этиотропного лечения используют антибиотики или другие химиотерапевтические препараты.
Специфическая профилактика тифо-паратифозного заболевания проводится убитыми и химическими вакцинами по эпидемическим показаниям, контактным лицам — экстренная фагопрофилактика сальмонеллезными поливалентными бактериофагами.
Вопросы для обсуждения
1. Классификация и общая характеристика семейства энтеробактерий.
2. Патогенез брюшного тифа и паратифа А и В.
3. Методы лабораторной диагностики брюшного тифа и паратифа А и В в
различные сроки заболевания.
4. Бактериологический метод исследования брюшного тифа и
паратифа А и В в разные стадии патогенеза заболевания.
5. Выявление бактерионосительства при брюшном тифе.
6. Серологический метод диагностики брюшного тифа и паратифа А и В.
7. Лечение и профилактика брюшного тифа и паратифа А и В.
Самостоятельная работа
Бактериологическое исследование крови брюшнотифозного больного на гемокультуру:
1. Произвести посев исследуемого материала на среду Рапопорт.
2. Изучить изменение цвета среды (помутнение; наличие пузырьков газа в поплавке).
3. Пересеять на среду Эндо.
4. Занести полученные данные в протокол.
5. Изучить различия колоний на среде Эндо. Отобрать подозрительные колонии и произвести посев для накопления чистой культуры. Описать культуральные свойства.
6. Исследовать чистую культуру по морфологическим, тинкториальным, биохимическим, антигенным свойствам. Полученные данные занести в протокол.
7. Идентифицировать чистую культуру возбудителя.
Серологическая диагностика брюшного тифа
1. Учесть результаты реакции Видаля.
2. Полученные данные занести в протокол.
Протокол бактериологического исследования
Материал для исследования:
| Этапы исследования | Ход исследования | Результаты исследования с предварительными выводами |
Дата добавления: 2015-10-19 ; просмотров: 4365 . Нарушение авторских прав
источник
Тема: Серодиагностика брюшного тифа, паратифов А и В. Сальмонеллы – возбудители острых гастроэнтеритов.
Цель: Освоение методов микробиологической диагностики сальмонеллезов и серологической диагностики брюшного тифа и паратифов А и В.
Модуль 2. Специальная, клиническая и экологическая микробиология.
Содержательный модуль 10. Патогенные прокариоты и эукариоты.
Тема занятия 25. Серодиагностика брюшного тифа, паратифов А и В. Сальмонеллы – возбудители острых гастроэнтеритов.
Сальмонеллез – острая кишечная инфекция. характеризующаяся преимущественным поражением желедочно-кишечного тракта, возбудителями которой являются многочисленные бактерии рода Salmonella (кроме S. typhi, S, paratyphi A, S. schottmuelleri).
Таксономическое положение и свойства. см. в методичке 26.
Морфология и тинкториальные свойства.
Эпидемиология. Основной источник заболевания – животные, преимущественно домашние и птицы. Реже источниками заболевания являются люди – больные и носители. Механизм заражения – фекально-оральный. Основной путь передачи инфекции – пищевой. Факторами передачи могут быть не только мясо животных и птиц, инфицированное при жизни животного либо при его обработке, но и яйца. Наиболее восприимчивы к заболеванию люди со сниженным иммунным статусом (в том числе грудные дети) и больные, получающие антибиотики. Подъем заболеваемости наблюдается летом.
Патогенез. Сальмонеллы проникают в организм через рот, достигают тонкого кишечника, где и развертывается патологический процесс. Бактерии благодаря факторам адгезии прикрепляются к слизистой оболочке, проникают в ее глубокие слои, где захватываются макрофагами. Сальмонеллы размножаются и погибают с освобождением эндотоксина, который, помимо общей интоксикации, вызывает диарею и нарушение вводно-солевого обмена. Находящаяся в нормальном состоянии микрофлора кишечника в значительной мере препятствует накоплению сальмонелл. В некоторых случаях (при снижении иммунного статуса и высокой вирулентности возбудителя) возможно развитие бактериемии и поражение костей, суставов, мозговых оболочек и других органов.
Клиническая картина. Инкубационный период равен в среднем 12-24 часа. Заболевание характеризуется повышением температуры, тошнотой, рвотой, поносом, болью в животе. Как правило, продолжительность болезни составляет 7 дней. но в некоторых случаях наблюдается молниеносная токсическая форма, приводящая к смерти больного.
Иммунитет после перенесенного заболевания сохраняется менее года.
Микробиологическая диагностика. Основной материал для исследования — рвотные массы, испражнения, промывные воды желудка. Применяют бактериологический и серологический (РА, РПГА) методы диагностики.
Лечение сальмонеллеза заключается в промывании желудка, диете, введении жидкостей для нормализации вводно-солевого обмена. Антибиотики при формах средней тяжести и легких не назначают, т.к. их применение приводит к дисбактериозу и в результате более длительному течению болезни; кроме того, очень велико число антибиотикорезистентных сальмонелл.
Профилактика неспецифическая — санитарно-гигиенические мероприятия, заключающиеся, в частности, в правильной кулинарной обработке мяса и яиц.
Серологическая диагностика брюшного тифа и паратифов А и В.
Для постановки диагноза применяется реакция агглютинации Видаля, основанная на обнаружении в сыворотке крови людей агглютининов, которые появляются в конце 1-й — начале 2-й недели заболевания. Особенности реакции заключаются в том, что реакция ставится одновременно с 4 разными диагностикумами (антигенами): ОН-диагностикум брюшного тифа, О-диагностикум брюшного тифа, ОН-диагностикум паратифа А и ОН-диагностикум паратифа В. Брюшнотифозные монодиагностикумы применяются для установления стадии болезни, т.к. содержание О- и Н-антител в разные ее периоды неодинаково. О-антитела накапливаются в разгвр заболевания и исчезают к моменту выздоровления. Н-антитела появляются к концу заболевания и сохраняются у переболевших в течение длительного времени.
Это помогает дифференцировать острую стадию заболевания и «прививочную» или анамнестическую реакции.
У больных брюшным тифом в сыворотке крови определяются О- и Н-антитела, а в сыворотке крови людей, перенесших брюшной тиф или вакцинированных против него, сохраняются только Н-антитела.
Для серологического исследования реконвалесцентов и выявления бактерионосителей широко используют реакцию пассивной Vi-гемагглютинации (РПГА), с помощью которой определяют Vi-антитела в сыворотке крови людей, появляющиеся только к концу заболевания, но постоянно обнаруживающиеся у носителей брюшного тифа.
Ознакомиться с биологическими свойствами и классификацией представителей семейства Salmonella.
Описывать патогенез сальмонеллезов.
Изучить методы микробиологической диагностики сальмонеллезов.
Ознакомиться с методами серологической реакции брюшного тифа, паратифов А и В.
Ознакомиться с методами профилактики и специфической терапии брюшного тифа, паратифов А и В.
Трактовать результаты бактериологического и серологического исследования.
Проводить дифференциацию сальмонелл – возбудителей сальмонеллезов.
Забирать материал для исследования от больных сальмонеллезами.
Выделять чистые культуры сальмонелл.
Трактовать результаты бактериологического и серологического исследования.
Сальмонеллы – возбудители пищевых токсикоинфекций.
Антигенная структура, факторы патогенности.
Патогенез и иммуногенез заболеваний. Бактерионосительство.
Методы микробиологической диагностики сальмонеллезов.
Специфическая профилактика и лечение сальмонеллезов.
Практические задания, выполняемые на занятии:
Выделение чистой культуры S. typhi :
Изучение посевов «фекалий» больного брюшным тифом на среде Ресселя.
Проверка чистоты культур: приготовление мазков, окраска по Грамму, микроскопия и зарисовывание.
Пересев чистой культуры на среду Гиса и МПБ для выявления индола и сероводорода.
Постановка реакции агглютинации на стекле с диагностическими сыворотками для идентификации выделенной чистой культуры.
Микроскопия демонстрационных микропрепаратов чистых культур S. typhimurium, S. choleraesuis, S. enteritidis.
Зарисовывание демонстрационных микропрепаратов в протокол.
Пяткин К.Д., Кривошеин Ю.С. Микробиология с вирусологией и иммунологией.– Киев: Высшая школа, 1992.- 431с.
Воробьев А.В., Быков А.С., Пашков Е.П., Рыбакова А.М. Микробиология.- М.: Медицина, 1998.- 336с.
Медицинская микробиология /Под редакцией В.П. Покровского.– М.: ГЕОТАР-МЕД, 2001.– 768с.
Коротяев А.И., Бабичев С.А. Медицинская микробиология, иммунология и вирусология /Учебник для медицинских ВУЗов, С-Пб.: «Специальная литература», 1998.- 592с.
Тимаков В.Д., Левашев В.С., Борисов Л.Б. Микробиология /Учебник.- 2-е изд., перераб. и доп.– М.: Медицина, 1983.- 512с.
Титов М.В. Инфекционные болезни.- К., 1995.– 321с.
Шувалова Е.П. Инфекционные болезни.– М.: Медицина, 1990.- 559с.
Краткие методические указания для работы на практическом занятии.
В начале занятия проводится проверка уровня подготовки студентов к занятию.
Самостоятельная работа состоит из изучения методов микробиологической диагностики сальмонеллезов и серологической диагностики брюшного тифа, паратифов А и В. Далее студенты знакомятся с правилами забора материала от больных сальмонеллезами для бактериологического и серологического исследования. Потом продолжают выделение чистой культуры S. typhi :
Изучение посевов «фекалий» больного брюшным тифом на среде Ресселя.
Проверка чистоты культур: приготовление мазков, окраска по Грамму, микроскопия и зарисовывание.
Пересев чистой культуры на среду Гиса и МПБ для выявления индола и сероводорода.
Постановка реакции агглютинации на стекле с диагностическими сыворотками для идентификации выделенной чистой культуры.
В состав самостоятельной работы входит также микроскопия демонстрационных микропрепаратов чистых культур S. typhimurium, S. choleraesuis, S. enteritidis и зарисовывают их в протокол.
В конце занятия проводится оформление протокола, тестовый контроль и анализ результатов самостоятельной работы каждого студента.
источник
52. При брюшном тифе во время инкубационного периода возбудители активно размножаются…
1) в просвете тонкого кишечника
2) в просвете толстого кишечника
3) в макрофагах пейеровых бляшек и солитарных фолликулах *
53. Характеристика иммунитета, формирующегося после перенесения брюшного тифа:
54. При подозрении на брюшной тиф в первые дни заболевания осуществляется посев крови больного на среду
55. При посеве испражнений больного брюшным тифом на среду Эндо вырастают колонии…
4) малинового цвета с металлическим блеском
5) бесцветные колонии, окруженные слизистым валом
56. При посеве испражнений больного брюшным тифом колонии черного цвета вырастают на среде…
57. Характер роста сальмонелл на дифференциально-диагностических средах: а) среда Эндо: колонии бесцветные; б) висмут-сульфитный агар: колонии чёрного цвета; в) среда Эндо: малиновые колонии; г) висмут-сульфитный агар: голубые колонии.
58. Сероидентификация сальмонелл обычно проводится с помощью…
1) ориентировочной РА на стекле *
2) реакции иммунофлюоресценции
59. Серодиагностика брюшного тифа проводится обычно с использованием:
1) ориентировочной РА на стекле
60. При постановке реакции Видаля высокие титры антител к брюшнотифозному О-антигену и низкие к Н-антигену характерны для периода…
1) начала заболевания (острого периода) *
2) постинфекционного иммунитета
61. При постановке реакции Видаля высокие титры антител к брюшнотифозному Н-антигену и низкие к О-антигену характерны для периода…
1) начала заболевания (острого периода)
2) постинфекционного иммунитета *
62. С целью предупреждения брюшного тифа проводится профилактика…
63. Для профилактики брюшного тифа применяют:
65. Все перечисленные ниже энтеробактерии обладают жгутиками, кроме…
66. Рецепторами к Vi-фагам обладают сальмонеллы брюшного тифа, имеющие антиген:
67. Препараты, применяемые для специфической терапии дизентерии:
1) сыворотка агглютинирующая сухая
4) поливалентный дизентерийный бактериофаг *
5) дизентерийная вакцина спиртовая *
68. Появление крови и слизи в фекалиях свойственно при заболеваниях:
69. Признаки, характерные для патогенных энтеробактерий:
70. Основные проявления эндотоксинового шока:
3) внутрисосудистое свёртывание *
71. Общие свойства сальмонелл и шигелл:
1) фекально-оральный механизм передачи *
4) отсутствие ферментации лактазы *
72. Питательные среды для ферментации лактозы энтеробактериями:
1) агар с эозином и метиленовым синим *
2) тройной железо-сахарный агар *
73. Энтеробактерии, вызывающие восходящие инфекции мочевого пузыря.
74. Факторы передачи сальмонеллёзов:
75. Наиболее биохимически активными являются возбудители дизентерии:
76. Семейство энтеробактерий разделено на:
77. Внутрибольничные штаммы сальмонелл характеризуются:
1) множественной лекарственной резистентностью *
2) устойчивостью во внешней среде *
3) способностью продуцировать колицины *
78. Основные свойства О- и Н-антигенов энтеробактерий: а) О-антиген: липополисахарид, термостабильный; б) Н-антиген: белковой природы, термолабильный; в) О-антиген: белок, термолабильный; г) Н-антиген: липополисахарид, термостабильный:
79. Компоненты реакции Видаля:
2) брюшнотифозный О-диагностикум *
3) брюшнотифозный Н-диагностикум *
4) паратифозные диагностикумы А и В *
80. Основными факторами патогенности холерных вибрионов являются.
81. Селективными средами для холерного вибриона являются…
82. Истинные возбудители холеры относятся к серогруппе:
83. При подозрении на холеру первичный посев исследуемого материала производится на среды…
84. При посеве исследуемого материала на щелочную воду первые признаки роста холерного вибриона могут появиться через…
85. Характерными признаками роста холерных вибрионов на щелочной воде является…
1) выпадение хлопьевидного осадка
2) появление голубой морщинистой пленки
3) диффузное помутнение питательной среды
4) образование нежной пленки голубого цвета *
86. Серологические методы, используемые для экспресс-диагностики холеры:
87. Основным патогенетическим механизмом при холере является…
1) разрушение лимфоидных клеток пейеровых бляшек
2) обезвоживание и обессоливание организма *
3) резкое угнетение иммунитета
4) поражение функции почек
88. Патогенез холеры, в основном, обусловлен:
1) энтероинвазивными свойствами возбудителя
2) действием энтеротоксина *
89. Для предупреждения холеры проводится профилактика…
90. Профилактика холеры проводится с применением…
4) специфического иммуноглобулина
5) специфической гетерогенной сыворотки
91. Для экстренной профилактики холеры можно использовать:
92. Среди лечебных мероприятий при холере первостепенное значение имеет…
3) применение антибиотиков
4) борьба с обезвоживанием организма *
93. Характерные свойства возбудителя холеры Эль-Тор
1) чувствительность к полимиксину
2) гемолитическая активность *
3) высокая устойчивость во внешней среде *
4) образование ацетилметилкарбинола *
94. Природный резервуар возбудителей холеры
95. Основные свойства возбудителя холеры серовара О139:
1) чувствительность к полимиксину
2) гемолитическая активность
3) чувствительность к бактериофагам Эль-Тор
4) агглютинация О139 – сывороткой *
96. Факторы вирулентности синегнойной палочки:
97. Пигменты синегнойной палочки:
98. Культуральные особенности синегнойной палочки:
1) требует сложных питательных сред
2) растёт на синтетических безбелковых средах *
3) необходимы адсорбенты метаболитов
4) растёт на простых средах *
99. Биохимические особенности Pseudomonas aeruginosa:
1) синтезирует триметиламин *
2) протеолитическая активность умеренная
4) активно ферментирует сахара
100. Основные признаки, идентифицирующие возбудителей холеры и холероподобные вибрионы:
1) ферментативная активность *
2) чувствительность к бактериофагам*
101. Признаки дифференциации биоваров возбудителя холеры:
1) характер роста на питательных средах
4) ферментативная активность *
102. Факторы патогенности у возбудителя столбняка:
103. Механизм заражения при столбняке:
104. Столбняк развивается при попадании в организм
3) экзотоксина возбудителя
4) эндотоксина возбудителя
105. Воротами инфекции при столбняке являются:
1) клетки цилиндрического эпителия
2) желудочно-кишечный тракт
3) раневая поверхность кожи и слизистых оболочек *
106. Патогенез при столбняке обусловлен:
3) инвазивностью возбудителя
107. Для предупреждения столбняка проводится профилактика…
108. Для профилактики столбняка с целью активной иммунизации применяются препараты:
109. Для экстренной профилактики столбняка применяются препараты:
4) противостолбнячная сыворотка *
5) противостолбнячный иммуноглобулин *
110. Правильные суждения: а) для профилактики и лечения столбняка можно применять только гомологичные сывороточные препараты; б) для профилактики и лечения столбняка можно применять как гомологичные, так и гетерологичные сывороточные иммунные препараты; в) перед введением гетерологичных сывороточных противостолбнячных препаратов у больных необходимо проводить кожную пробу; г) проведение кожных проб перед введением гетерологичных сывороток не обязательно; д) гетерологичные сывороточные препараты вводятся подкожно или внутримышечно.
111. Механизм заражения при газовой гангрене:
112. Газовая гангрена развивается при попадании в организм…
3) экзотоксина возбудителя
4) эндотоксина возбудителя
113. Воротами инфекции при газовой гангрене являются:
1) клетки цилиндрического эпителия
3) раневая поверхность кожи и слизистых оболочек *
2) желудочно-кишечный тракт
114. Патогенез при газовой гангрене обусловлен.
3) инвазивностью возбудителя
4) ферментами патогенности *
115. Для профилактики газовой применяются препараты:
4) гетерогенная поливалентная иммунная сыворотка *
116. Для предупреждения газовой гангрены проводится профилактика.
117. Правильные суждения: а) перед введением гетерологичных иммунных противогангренозных сывороток у больных необходимо проводить кожную пробу; б) перед введением гетерологичных сывороточных препаратов проведение кожных проб у больного не обязательно; в) гетерологичную противогангренозную сыворотку можно вводить только подкожно или внутримышечно; г) в критических ситуациях при крайне тяжелом состоянии больных разрешается внутривенное введение противогангренозных сывороток:
118. Факторы патогенности у возбудителя ботулизма:
119. Пути заражения при ботулизме:
120. Ботулизм развивается при попадании в организм.
3) экзотоксина возбудителя *
4) эндотоксина возбудителя
121. Входными воротами инфекции при ботулизме являются:
1) желудочно-кишечный тракт *
3) клетки цилиндрического эпителия
4) слизистая верхних дыхательных путей
122. Патогенез при ботулизме обусловлен:
3) инвазивностью возбудителя
123. Для предупреждения ботулизма проводится профилактика.
124. Для экстренной профилактики ботулизма применяются препараты:
4) противоботулиническая сыворотка *
125. Правильное суждение: а) перед введением гетерологичных иммунных противоботулинических сывороток у больных необходимо проводить кожную пробу; б) перед введением гетерологичных противоботулинических сывороток проведение кожных проб у больного не обязательно; в) гетерологичную противоботулиническую сыворотку можно вводить только подкожно или внутримышечно; г) в критических ситуациях при крайне тяжелом состоянии больных разрешается внутривенное введение противоботулинических сывороток.
126. Соответствие названия анаэробных инфекций и характерных для них первых признаков: а) столбняк: тризм жевательных мышц и «сардоническая улыбка»; б) газовая гангрена: отёчность околораневых тканей и быстрое нарастание явлений интоксикации; в) ботулизм: изменения со стороны органов зрения (расстройство аккомодации, двоение в глазах); г) столбняк: изменения со стороны органов зрения (расстройство аккомодации, двоение в глазах).
127. Реакцию нейтрализации токсина антитоксином в опыте in vitro используют для обнаружения экзотоксина в исследуемом материале при диагностике.
128. Микроорганизмы, вызывающие пищевые токсикоинфекции, связанные с употреблением в пищу жареного риса:
2) Clostridium bifermentans
4) Clostridium perfringens
129. Терминальное расположение спор в виде «барабанных палочек» характерно для возбудителей:
130. Образование нейротоксина у Clostridium tetani происходит в стадии клеточного цикла:
131. При прорастании спор Clostridium botulinum развиваются следующие поражения ЖКТ:
1) псевдомембранозный колит
2) некротизирующий энтерит
5) диарея со стулом типа «рисового отвара»
132. Клостридии, вызывающие развитие псевдомембранозного колита на фоне антибиотикотерапии:
1) Clostridium bifermentas
133. Соответствие типа пищевого отравления и микроорганизмов: а) микотоксикозы: микроскопические грибы; б) токсикоинфекции: кишечная палочка, протей; в) токсикозы (интоксикации): стафилококк, клостридии; г) токсикоинфекции: стафилококк, клостридии; г) токсикозы (интоксикации): кишечная палочка, протей.
134. Морфологические свойства возбудителя дифтерии …
3) грам (+) спорообразующая палочка
4) грам (+) неспорообразующая палочка *
135. Для выявления возбудителя дифтерии в мазке применяется окраска методом…
136. Механизм действия дифтерийного токсина:
1) блокада синтеза белка в клетке *
2) угнетение дыхательного центра
3) блокада передачи нервных импульсов в синапсах
137. Для определения токсигенности возбудителя дифтерии используют:
1) биопробу на котятах-сосунках
2) реакцию преципитации по Оухтерлони *
3) кожную иммунологическую пробу Шика
138. Для специфической профилактики дифтерии используют…
4) противодифтерийную антитоксическую сыворотку
139. Морфологические свойства возбудителя туберкулеза:
3) грам (+) спорообразующая палочка
4) грам (+) неспорообразующая палочка *
140. Факторы патогенности возбудителя туберкулеза:
141. Проба Манту используется с целью…
1) диагностики туберкулеза *
3) отбора лиц, подлежащих вакцинации препаратом БЦЖ *
4) отбора лиц, подлежащих вакцинации АКДС
142. Особенностью подготовки исследуемого материала в процессе лабораторной диагностики туберкулеза является:
1) обработка материала перед исследованием кислотой для устранения сопутствующей микрофлоры *
2) прогревание материала для устранения сопутствующей микрофлоры
3) посев материала у постели больного
4) отсутствие элективных питательных сред для выделения чистой культуры
143. Для выделения чистой культуры возбудителя туберкулеза необходимо:
144. Для лечения туберкулеза используются:
1) антибиотики и химиопрепараты *
2) специфический иммуноглобулин
145. В клинической практике основными методами лабораторной диагностики проказы являются:
146. Факторы патогенности коклюшной палочки:
1) гистаминсенсибилизирующий фактор *
2) лимфоцитозстимулирующий фактор *
147. Соответствие антигенов возбудителя коклюша: а) видовые: 1; б) родоспецифические: 7; в) видовые: 2, 3, 4, 5, 6, 13; г) родоспецифические: 8, 9, 10.
148. Механизм и пути заражения при коклюше:
149. Препараты, применяемые для профилактики коклюша:
150. Больной коклюшем наиболее заразен в клиническую стадию:
151. Отличительный компонент среды Борде-Жангу:
152. Питательная среда с ингибитором жирных кислот при росте коклюшной палочки:
153. Положение, не применяемое к туберкулиновой пробе:
1) внутрикожное введение туберкулина
2) аллергическая реакция замедленного типа
3) аллергическая реакция немедленного типа *
4) проба имеет больше эпидемиологическое, чем диагностическое значение
154. Ключевой лабораторный тест для идентификации возбудителей туберкулёза и микобактериозов:
2) гидролиз миколовой кислоты
3) образование пигмента на свету
5) окраска по Цилю-Нильсену
155. Противотуберкулёзные препараты – средства первого ряда:
156. Характерные свойства дифтеритических плёнок:
1) для их образования необходим синтез токсина
2) способны распространяться *
3) образуются во время пароксизмальной стадии
4) плотно прикреплены к эпителию ротоглотки *
157. Свойства дифтерийного токсина:
2) двухкомпонентная структура *
3) синтезируется при инфицировании клеток бета-фагом *
4) демиелинизирует периферические нервы *
158. Отличительные особенности возбудителей туберкулёза и микобактериозов: а) Mycobacterium tuberculosis: наличие уреазы, образование никотиновой кислоты; б) M. bovis: наличие уреазы; в) M. avium: жёлтый пигмент; 4) M. kansasii: биологическая проба.
159. Биовары gravis, mitis имеют возбудители:
160. Правила взятия исследуемого материала для диагностики коклюша:
1) посев у постели больного *
2) метод «кашлевых пластинок» *
3) транспортирование в портативном термостате *
161. Возбудитель дифтерии имеет следующие включения:
162. К зоонозам относятся инфекционные заболевания:
1) которыми болеют только животные
2) которыми болеют как люди, так и животные
3) источником инфекции которых являются только животные *
4) источником инфекции которых могут быть как люди, так и животные
163. Основные морфологические и тинкториальные свойства возбудителя чумы:
1) короткие, овоидные палочки *
4) спорообразующие бактерии
5) грамположительные палочки
6) неспорообразующие бактерии *
7) грамотрицательные палочки *
164. Факторы патогенности возбудителя чумы:
165. При трансмиссивном пути передачи чумы переносчиками являются.
166. Наибольшую опасность как источник инфекции представляют собой больные, страдающие . формой чумы
167. Латинское название возбудителя сибирской язвы
1) Bordetella bronchiseptica
168. Спорообразование – характерная особенность возбудителя.
169. Факторы патогенности возбудителя сибирской язвы:
170. Максимальным уровнем устойчивости в окружающей среде обладает возбудитель.
171. Для обнаружения сибиреязвенного антигена в исследуемом материале Асколи предложил использовать реакцию.
172. Основным резервуаром возбудителя туляремии в природе являются.
4) больные люди и бактерионосители
173. При отсутствии специализированных лабораторий для диагностики туляремии чаще используют:
1) бактериологический метод
174. Латинские названия возбудителей бруцеллеза, наиболее часто вызывающие заболевания у человека:
175. Факторы патогенности возбудителя бруцеллеза:
176. Пути передачи бруцеллеза человеку:
177. Поражение опорно-двигательного аппарата в виде артритов, бурситов, тендовагинитов инфекционно-аллергической природы характерно для заболеваний:
178. Для диагностики бруцеллеза используются.
1) кожно-аллергическая проба Бюрне *
2) реакции Райта и Хеддельсона *
179. Основным видом профилактики псевдотуберкулеза является … профилактика
источник
