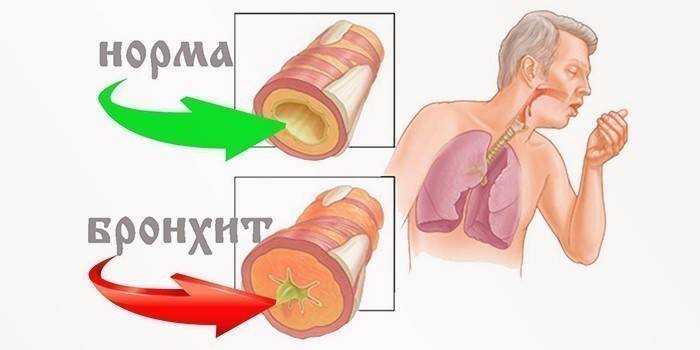
Ботулизм — острое инфекционное заболевание, вызванное токсином Cl.botulinum, которое характеризуется интоксикацией и преимущественным поражением бульбо-понтинного отдела центральной нервной системы.
Заражение человека ботулизмом происходит при употреблении пищевых продуктов, инфицированных возбудителями ботулизма и не подвергнутых термической обработке перед употреблением в пищу: консервов домашнего приготовления, ветчины, вяленой рыбы, балычных изделий, колбас и др.
Патогенез. Первично поражаются крупные мотонейроны передних рогов спинного мозга и аналогичные им ядра двигательных черепных нервов, а также периферический моторный нервно-мышечный аппарат. Ботулотоксин увеличивает активность ацетилхолинэстеразы, подавляет продукцию и высвобождение ацетилхолина, который осуществляет функцию медиатора в передаче нервного импульса от нерва к мышце.
Ведущую роль в развитии ботулинической интоксикации играют все виды гипоксии — гистотоксическая гипоксия, циркуляторная, гемическая, гипоксическая, которые возникают как в результате прямого действия токсина, так и в результате воздействия промежуточных звеньев нарушения обмена. После инкубации, которая может длится от 4 часов до 8-10 дней, развивается начальный период с диспепсическим синдромом, расстройствами зрения, иногда — дыхания (в 1% случаев).
Развернутая клиника заболевания характеризуется тремя основными синдромами:
- миастенический;
- офтальмоплегический — парез аккомодации, мидриаз, птоз, анизокория, диплопия, страбизм, нистагм, нарушение движения глазных яблок;
- бульбарные расстройста — дисфагия, дизартрия, дисфония, афония.
Для тяжёлых случаев ботулизма характерно развитие пареза дыхательной мускулатуры (межрёберных мышц, диафрагмы). Причиной смерти является паралич дыхания — поражение дыхательного центра и ретикулярной формации, нижней группы черепных нервов, которые иннервируют мышцы глотки, языка, гортани и диафрагму. Причинами неотложных состояний при ботулизме чаще является острая дыхательная недостаточность, острая сердечно-сосудистая недостаточность, тромбоэмболические осложнения.
Лечение ботулизма предусматривает проведение мероприятий специфической и неспецифической терапии. Специфическое лечение ботулизма сводится к применению противоботулинической поливалентной сыворотки (после пробы по Безредко) — внутривенно или внутримышечно от 1 до 3 раз в течение 3 суток в зависимости от тяжести состояния:
- при лёгкой форме ботулизма — внутримышечно 2 дозы, следующих суток — 1 дозу каждого из трех видов сыворотки А, В, С (всего на курс лечения — 2-3 дозы);
- при среднетяжёлой форме — в первые сутки 4 дозы каждого типа внутримышечно с интервалом 12 часов, далее — по показаниям (всего на курс лечения — 10 доз);
- при тяж`лой форме ботулизма — в первую сутки 6 доз, на второй день — 4-5 доз (всего на курс лечения — 12-15 доз внутривенно с интервалом 6-8 часов).
С целью подавления вегетирующих клостридий в кишечнике и крови назначают левомицетин или полусинтетические пенициллины 4 раза в сутки по 0,5 г в течение 5 дней.
Неспецифическое лечение ботулизма
- Для удаления токсинов которые не всосались производится промывание желудка 2% раствором гидрокарбоната натрия, очистительная или сифонная клизма; при парезе кишок — церукал, прозерин.
- Неспецифическая детоксикация, форсированный диурез, коррекция водноэлектролитного обмена (дисоль, трисоль, реополиглюкин, раствор Рингера-Локка, 5% раствор глюкозы) со скоростью 0,5 л/ч с добавлением гепарина, дексазона, лазикса — с целью управляемой гемодилюции. Парентеральное питание (жировые эмульсии, аминокислотные смеси, 30% глюкоза).
- Интубация трахеи, искусственная вентиляция лёгких по показаниям.
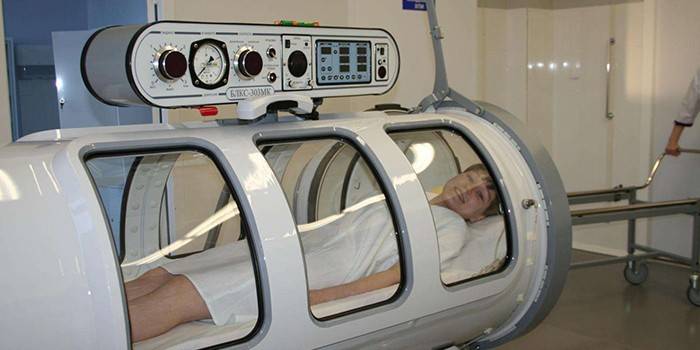
- Оксигенотерапия, гипербарическая оксигенация (ГБО).
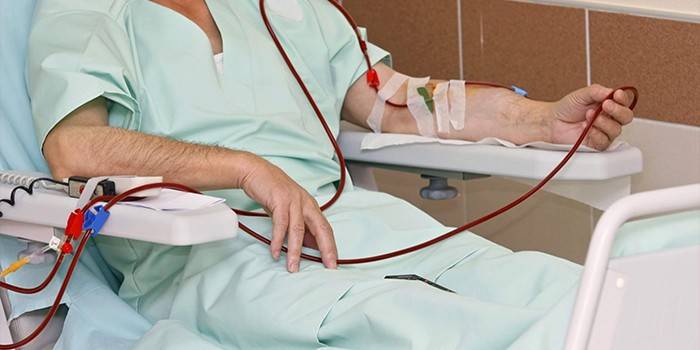
- Гемосорбция.
- Симптоматическая терапия (витамины, антигистаминные, сердечно-сосудистые средства).
источник
23.1 Общая гипоксия
Гипоксия – интегральный патологический процесс, характеризующийся уменьшением содержания кислорода в клетках как результат дисбаланса между процессами его доставки и утилизации. Содержание О2 в клетках зависит от соотношения двух факторов: а) доставки О2 к клеткам в единицу времени; б) потребления О2, которое зависит от уровня аэробного метаболизма клетки. Из этого следует, что гипоксия может устанавливаться как вследствие нарушения процесса снабжения клетки О2 (абсолютная гипоксия), так и вследствие увеличения скорости утилизации О2 клетками (относительная гипоксия).
Гипоксия – один из фундаментальных патологических процессов, а также основной патогенетический механизм во многих нарушениях ЦНС, эндокринной, дыхательной, сердечно-сосудистой систем и системы крови. Гипоксия чаще развивается вторично, однако ее установление усугубляет течение первичной патологии (например: сердечная недостаточность => уменьшение систолического объема => уменьшение сердечного выброса => уменьшение артериального давления => нарушения микроциркуляции => гипоксия => уменьшение образования энергии => снижение сократительной функции миокарда).
Классификация гипоксии. По этиологии и механизмам развития:
- Экзогенная гипоксия (гипоксическая, атмосферная гипоксия) – обусловленная уменьшением содержания кислорода в атмосферном воздухе; в зависимости от атмосферного давления подразделяется на:
- Респираторная гипоксия – результат нарушений дыхательного аппарата, а также диффузионного и конвекционного транспорта кислорода:
а) гиповентиляторная (обструктивного, рестриктивного типа)
в) от нарушения соотношения диффузия-перфузия
- Циркуляторная гипоксия – результат недостаточности конвекционного притока кислорода по кровеносной системе:
- Гемическая гипоксия – результат нарушений системы крови:
- Периферическая гипоксия – результат нарушения диффузионного транспорта кислорода в ткани:
- Гистотоксическая гипоксия – результат нарушения процессов внутриклеточной утилизации кислорода.
- Смешанная гипоксия.
По локализации гипоксия классифицируется на местную и общую, а по развитию – на острую и хроническую.
Экзогенная гипоксия развивается вследствие уменьшения содержания кислорода во вдыхаемом воздухе. Различают два типа экзогенной гипоксии:
а) нормобарическая экзогенная гипоксия – развивается при уменьшении парциального давления О2 во вдыхаемом воздухе на фоне нормального атмосферного давления. Такие состояния могут наблюдаться в случаях, когда человек длительное время находится в недостаточно вентилируемом помещении, угольной шахте, колодце. Уменьшение содержания кислорода во вдыхаемом воздухе ведет к уменьшению степени насыщенности гемоглобина О2 и как следствие развивается гипоксемия и, следовательно, гипоксия.
б) гипобарическая экзогенная гипоксия – развивается в условиях уменьшения общего атмосферного давления. Чаще всего встречается в горах. Основной патогенетический фактор в развитии этого типа гипоксии — это гипоксемия вместе с гипокапнией и дыхательным алкалозом как результат гипервентиляции и повышенного выведения диоксида углерода. В нормобарических условиях уменьшение парциального давления СО2 в крови на 4-5 мм рт. ст. ведет к снижению легочной вентиляции, однако в условиях пониженного давления, одновременно со стимулирующим действием гипоксемии на дыхательный центр, растет и чувствительность дыхательного центра к СО2, поэтому гипервентиляция легких сохраняется и при малых концентрациях СО2 в крови. Гипокапния и, соответственно, увеличение рН крови (дыхательный алкалоз) увеличивают сродство гемоглобина к кислороду, что с одной стороны способствует насыщению гемоглобина в легочных капиллярах, а с другой стороны смещение кривой диссоциации гемоглобина влево т.е. снижается скорость отдачи кислорода оксигемоглобином на уровне тканей большого круга.
Дыхательная гипоксия – развивается как результат нарушения внешнего дыхания (процессов легочной вентиляции, альвеоло-капиллярной диффузии) и изменения соотношения диффузия-перфузия легких. Легочная гиповентиляция появляется при нарушениях дыхательного центра продолговатого мозга и при нарушениях вентиляции обструктивного и рестриктивного типов.
Нарушения вентиляции рестриктивного типа являются следствием уменьшения плевропульмональной эластичности (эмфизема легких, плевропульмональный фиброз, силикоз, туберкулез легких и пневмэктомии), пневмоторакс, при врожденных или приобретенных нарушениях грудной клетки (кифосколиоз, переломы ребер) и при нервно-мышечных нарушениях (полиомиелит, миастения, гипокалиемия). Нервно-мышечные нарушения определены дегенеративными процессами на уровне мотонейронов спинного мозга при полиомиелите, ботулизме, столбняке. Прямым следствием этих инфекций является снижение растяжимости грудной клетки во время вдоха. Уменьшение растяжимости может встречаться и у тучных людей, у которых гиповентиляция ведет к гипоксемии.
Нарушения вентиляции обструктивного типа наблюдаются вследствие повышения сопротивления воздухоносных путей потоку воздуха. Этот тип нарушений устанавливается при бронхиальной астме, хронических бронхитах, сдавлении дыхательных путей увеличенными лимфоузлами или опухолью. Одной из частых причин обструкции является бронхиальная астма, характеризующаяся приступами пароксизмальной экспираторной одышки. Бронхиолярная обструкция и препятствие току воздуха при бронхиальной астме осуществляется тремя основными механизмами: спазм бронхиол, отек слизистой и гиперсекреция слизи.
Нарушения вентиляции центрального типа могут развиваться в результате токсических влияний на дыхательный центр при диабетической или печеночной коме. Дыхательный центр может быть вовлечен и при энцефалитах, опухолях мозга, ишемиях и внутримозговых кровотечениях.
Нарушения диффузии также представляют частую причину респираторной гипоксии. Диффузия представляет собой обмен газов через альвеоло-капиллярную мембрану, при этом кислород переходит из альвеол в кровь, где захватывается гемоглобином и транспортируется в ткани, в то время как СО2 проделывает тот же путь, но в обратном направлении – из крови в альвеолы. Скорость и объем диффузии прямо пропорциональны коэффициенту диффузии, специфическому для каждого газа, градиенту концентрации газов по обе стороны диффузионной мембраны и общей площади диффузии и обратно пропорциональны толщине диффузионного барьера (толщине альвеоло-капиллярной перегородки). Причинами нарушения диффузии могут быть процессы, связанные с утолщением альвеолярной стенки (фиброз, интерстициальные пневмонии, коллагенозы, саркоидоз) и процессы, характеризующиеся снижением общей диффузионной поверхности (пневмэктомии, деструктивные процессы в альвеолах).
Нарушения отношения диффузия-перфузия за счет первичного нарушения диффузии либо перфузии в обоих случаях ведут к гипоксии. В норме соотношение между минутным объемом альвеолярной вентиляции и объемом крови, которая проходит через легочные капилляры (минутный сердечный выброс) находится в пределах 0,8 – 1,2. Уменьшение этого коэффициента наблюдается при легочной гиповентиляции, а увеличение коэффициента имеет место при уменьшении легочной циркуляции или при артерио-венозных шунтах (фистулы сообщающие обе половины сердца), когда большой объем неоксигенированной крови из правого сердца попадает прямо в большой круг (врожденные пороки развития с шунтом, внутрилегочные артерио-венозные шунты).
При респираторной гипоксии содержание кислорода уменьшается как в артериальной, так и в венозной крови (с увеличением артерио-венозной разницы кислорода как показатель извлечения кислорода из артериальной крови), а гипоксемия сопровождается гиперкапнией.
Циркуляторная гипоксия – результат нарушения кровообращения из-за нарушений в сердечно-сосудистой системе и при гиповолемии. Этот тип гипоксии характеризуется уменьшением содержания кислорода в венозной крови наряду с нормальным его содержанием в артериальной.
Циркуляторная кардиогенная гипоксия развивается вследствие уменьшения насосной функции сердца вследствие повреждения кардиомиоцитов, аритмий, тампонады сердца и роста общего периферического сопротивления сосудов.
Циркуляторная гиповолемическая гипоксия устанавливается как результат уменьшения объема циркулирующей крови при массивных кровотечениях или плазморрагиях.
Циркуляторная гиперметаболическая гипоксия (относительная) появляется в результате дисбаланса между возросшими потребностями органов и тканей в О2 и относительно недостаточной доставкой О2 при физической нагрузке, тиреотоксикозе и гипертермии. Сердечный выброс при этом типе гипоксии может быть увеличен, но не в той же степени, как и возросшие потребности организма в кислороде. Кроме того, при физическом усилии увеличивается линейная скорость кровотока и, соответственно, снижается время контакта крови с альвеолярным воздухом, что уменьшает степень насыщения гемоглобина кислородом в легочных капиллярах.
Гемическая гипоксия – характеризуется уменьшением кислородной емкости крови и, следовательно, общего содержания О2 в артериальной крови. Этот тип гипоксии устанавливается как следствие качественных и количественных изменений гемоглобина.
Гемическая анемическая гипоксия развивается как результат уменьшения содержания эритроцитов и гемоглобина в крови вследствие угнетения эритропоэза, кровопотерь и усиления процессов гемолиза.
Гемическая гемоглобинотоксическая гипоксия появляется вследствие образования патологических соединений гемоглобина: карбоксигемоглобина и метгемоглобина. Карбоксигемоглобин представляет соединение гемоглобина с монооксидом углерода (СО). Вследствие большого сродства гемоглобина к СО этот комплекс не диссоциирует и гемоглобин не может присоединять и транспортировать кислород. Метгемоглобин образуется из гемоглобина с двухвалентным железом вследствие окисления железа до трехвалентного под действием бензена, амидопирина, сульфамидов и фенацетина. Метгемоглобин, в отличие от нормального гемоглобина, не присоединяет кислород, что ведет к гипоксемии и, следовательно, к гипоксии. В некоторых случаях гемическая гипоксия может устанавливаться и как результат роста сродства гемоглобина к кислороду. Такие состояния могут устанавливаться после переливаний консервированной крови, при полицитемиях, гипотиреозе, поражениях печени, панкреонекрозе и характеризуются достаточной концентрацией оксигемоглобина в крови и его неспособностью диссоциировать и отдавать тканям кислород.
Периферическая гипоксия – характеризуется нарушением процессов транспорта кислорода из капилляров большого круга в интерстиций и далее в клетки. Она характеризуется нормальным содержанием кислорода в артериальной крови и ростом содержания О2 в венозной крови (уменьшение артерио-венозной разницы).
Интерстициальная гипоксия появляется в результате нарушения транспорта кислорода из капилляра через интерстиций к клетке. Чаще интерстициальная гипоксия определяется местными патологическими процессами, вследствие которых уменьшается проницаемость капиллярных и цитоплазматических мембран для кислорода, отеками, паренхиматозными кровотечениями, лимфостазом.
Внутриклеточная гипоксия развивается вследствие нарушения транспорта О2 через цитоплазму к клеточным органеллам, например, в промежутке между цитоплазматической и митохондриальной мембраной как результат клеточного отека или в иных случаях увеличения клеток в объеме.
Гистотоксическая гипоксия – характеризуется неспособностью клеток утилизировать кислород в результате нарушения процесса транспорта электронов на уровне ферментов дыхательной цепи. Причины этого типа гипоксии:
1) инактивация цитохромоксидазы под действием цианидов, угнетение клеточных дегидраз эфиром, уретаном, спиртом, барбитуратами;
2) нарушение синтеза ферментов дыхательной цепи при недостатке витаминов В1, В2, РР;
3) разобщение процессов окисления и фосфорилирования при интоксикациях нитратами, микробными токсинами, при гиперсекреции тиреоидных гормонов и др.;
4) повреждение митохондрий продуктами перекисного окисления липидов, токсическими метаболитами при уремии, кахексии, тяжелых инфекциях, под действием ионизирующего излучения.
Гистотоксическая гипоксия развивается и при интоксикациях микробными токсинами.
При тканевой гипоксии, характеризующейся разобщением окислительного фосфорилирования, кислород утилизируется интенсивно, однако большое количество продуцируемой энергии выделяется в форме тепла, а лишь малое количество энергии накапливается в форме макроэргических производных, что не обеспечивает потребностей клетки.
Гистотоксическая гипоксия характеризуется как нормальной оксигенацией артериальной крови, так и артериализацией венозной крови (уменьшение артерио-венозной разницы) вследствие отсутствия утилизации кислорода тканями. Цианоз при этом типе гипоксии не появляется.
В самых частых случаях гипоксия представляет собой комбинацию двух или более типов – смешанная гипоксия – с преобладанием одного определенного типа.
Гипоксия может быть острой, когда она развивается за несколько минут и хронической, которая сохраняется в течение нескольких недель, месяцев, лет. Острая гипоксия появляется в рамках асфиксии, при массивных кровопотерях, интоксикациях монооксидом углерода и цианидами, при шоке, коллапсе, приступе сердечной астмы. Хроническая гипоксия развивается медленно в рамках хронических заболеваний дыхательного аппарата, сердечно-сосудистой системы, анемиях и др.
По локализации гипоксия может быть местной и генерализованной.
Локальная гипоксия развивается в результате нарушений местной гемоциркуляции (ишемия, венозная гиперемия, стаз).
Общая гипоксия представляет интегральный патологический процесс с одновременным вовлечением всех органов, а степень нарушений зависит от их резистентности к недостатку О2. Например, костная ткань сохраняет жизнеспособность в условиях полного отсутствия доставки к О2 в течение двух часов; скелетные мышцы – приблизительно два часа, сердце – только 20-40 минут. Самой малой резистентностью к гипоксии обладает мозг. В коре мозга через 2-3 минуты аноксии наступают первые признаки повреждения, а после 6-8 минут появляются необратимые нарушения.
Компенсаторные реакции. Установление гипоксии индуцирует развитие комплекса адаптивно-компенсаторных реакций, способствующее восстановлению адекватного снабжения тканей кислородом. Эти реакции во многих случаях предотвращают развитие выраженной гипоксии и клеточных повреждений. Все компенсаторные реакции при гипоксии подразделяются на экстренные и длительные.
Экстренные компенсаторные реакции при острой гипоксии- это сердечно-сосудистые, дыхательные и метаболические реакции.
Сердечно-сосудистые компенсаторные реакции включают: увеличение сердечного выброса за счет тахикардии и роста систолического объема, увеличение венозного возврата к сердцу, роста артериального давления и скорости кровотока, уменьшения времени циркуляции крови по обоим кругам. Эти реакции способствуют улучшению артериализации крови в легочном круге и снабжения кровью органов большого круга. При выраженной гипоксии происходит централизация кровообращения и перераспределение крови в пользу жизненно важных органов путем расширения сосудов мозга, сердца и легочного круга с увеличением притока крови к этим органам. Параллельно сосуды кожи, жировой ткани, скелетных мышц и паренхиматозных органов суживаются снижая приток крови к этим органам. Другое значение этой сосудистой реакции – мобилизация крови, депонированной в печени и селезенке, мезентериальных сосудах, что ведет к увеличению объема циркулирующей крови. Сосудорасширяющее действие оказывает уменьшение концентрации кислорода, увеличение концентрации метаболитов – продуктов деградации АТФ (АДФ, АМФ, неорганический фосфат), СО2, ионы водорода, молочная кислота (лактат). В условиях ацидоза снижается чувствительность α-адренорецепторов к действию катехоламинов, что также способствует расширению сосудов.
Экстренные дыхательные компенсаторные реакции — это гипервентиляция легких (учащенное и углубленное дыхание) с включением в акт дыхания ранее не функционировавших альвеол. Также улучшается и легочное кровообращение. Таким образом, вместе с увеличением альвеолярной вентиляции растет и перфузия легких, что поддерживает постоянным отношение вентиляция-перфузия, важное условие для оптимальной артериализации венозной крови, поступившей в легкие. Наряду с этим гипокапния в крови легочного круга, обусловленная гипервентиляцией, повышает сродство гемоглобина к кислороду, что снижает время, необходимое для артериализации крови – важный момент в условиях увеличения линейной скорости кровотока и уменьшения времени прохождения эритроцитов через легочные капилляры.
Через два дня постоянной острой гипоксии в эритроцитах увеличивается содержание 2, 3 -глицерофосфата и АТФ, что способствует более легкой диссоциации оксигемоглобина и отдаче кислорода тканям большого круга.
В условиях «кислородного голода» в тканях активируется гликолиз, за счет которого могут быть удовлетворены на некоторое время энергетические потребности клеток. Одновременно, однако, в клетках накапливается лактат, а ацидоз способствует росту скорости диссоциации оксигемоглобина и полной отдаче кислорода тканям.
Механизмы развертывания экстренных компенсаторных реакций при гипоксии различны. Реакции дыхательной и сердечно-сосудистой систем запускаются рефлекторными механизмами – возбуждением дыхательного центра и хеморецепторов дуги аорты и каротидной зоны возросшим парциальным давлением СО2 в крови, избытком ионов водорода и сниженным парциальным давлением кислорода. Тахикардия обусловлена как прямым действием гипоксии на проводящую систему сердца, так и ростом объема циркулирующей крови, увеличением присасывающей силы грудной клетки при глубоком форсированном вдохе, увеличением венозного возврата к сердцу. Эти феномены ведут к переполнению предсердий кровью и развертыванием рефлекса с рецепторов этого отдела.
Механизмы компенсации длительного действия включаются при хронической гипоксии (заболевания сердечно-сосудистой системы, дыхательной, опухоли, проживание в горных областях). В этих условиях усиливается секреция эритропоэтинов клетками юкстагломерулярного аппарата почек, что стимулирует эритропоэз с ростом концентрации эритроцитов и количества гемоглобина в крови и, в конечном итоге, увеличивается кислородную емкость крови. Диффузионная поверхность легких возрастает, гипертрофируется дыхательная мускулатура и кардиомиоциты. В клетках растет количество митохондрий и активность ферментов дыхательной цепи. В условиях хронической гипоксии в жизненно важных органах (например, мозг) увеличивается как емкость мозговых артерий и капилляров, так и васкуляризация тканей вследствие ангиогенеза.
При хронической гипоксии происходят структурно-функциональные изменения тканей компенсаторного и репаративного характера. Установлено, что дефицит макроэргов, обусловленный гипоксией, способствует усилению синтеза нуклеиновых кислот и белков. Усиливаются пластические процессы, стоящие в основе гипертрофии кардиомиоцитов и дыхательных мышц. Вместе с тем параллельно с ростом активности эндогенной энергетической системы клетки (рост числа митохондрий, активация ферментов дыхательной цепи), функционирование дыхательной и сердечно-сосудистой систем становится более экономным.
В рамках хронической гипоксии снижается продукция тиреотропного и тиреоидных гормонов, что ведет к снижению интенсивности основного обмена с уменьшением потребностей клеток в кислороде. Установлено, что гипоксия индуцирует активацию ферментов антиоксидантной системы (супероксиддисмутаза, каталаза) для нейтрализации продуктов перекисного окисления липидов, которые могут повредить клетку.
В различных типах гипоксий компенсаторные механизмы различаются – например, гипоксическая гипоксия индуцирует рост минутного объема сердца, а при циркуляторной гипоксии, обусловленной снижением сократительной способности сердца, реализация этого компенсаторного механизма становится невозможной. При респираторной гипоксии снижена способность компенсаторных реакций дыхательного аппарата, при гипоксии, вызванной анемией (например, арегенеративная анемия) отсутствует реакция на эритропоэтины, а при циркуляторной гипоксии невозможны сосудистые реакции.
Гипоксия – сильный стрессорный фактор, который стимулирует гипоталамо-гипофизарно-надпочечниковую систему с гиперсекрецией глюкокортикоидов, которые активируют ферменты дыхательной цепи и стабилизируют лизосомальные мембраны, задерживая выход из этих органелл гидролаз и предупреждая аутолиз клетки.
Патогенное действие гипоксии. При выраженных гипоксиях адаптивно-компенсаторные механизмы становятся недостаточными, развивается декомпенсированная гипоксия, характеризующаяся биохимическими, функциональными и структурными нарушениями. Конечный результат этих нарушений – повреждения клеток, подверженных гипоксии. Это клеточные повреждения гипоксического, гипонутриционального, гипоэнергетического и ацидотического характера. Повреждения клеток при гипоксии представляют собой типичные патологические клеточные процессы с определенными особенностями в различных органах.
В основе всех гипоксических повреждений клеток стоит недостаток макроэргов, ограничивающий способность клеток поддерживать гомеостаз. Гликолиз незначительно компенсирует недостаточность окислительных процессов, он важен лишь для клеток мозга и сердца. Механизм клеточных повреждений в условиях дефицита макроэргов состоит в нарушении селективного транспорта ионов через клеточную мембрану, как энергозависимого процесса. В результате, ионы Nа накапливаются внутриклеточно, а из клеток выходят ионы К, что ведет к снижению мембранного потенциала и к нарушению возбудимости нервных и мышечных клеток. Вместе с ионами Nа в клетки проникает избыток воды, способствуя набуханию клеток и осмотическому цитолизу. Внутриклеточно в гиалоплазме накапливаются и ионы Са, которые активируют фосфолипазу А2 митохондрий, деградируя мембранные фосфолипидные комплексы, еще глубже нарушая функцию ионных насосов и функции митохондрий. Активированные АТФ-азы разрушают макроэргические соединения, усугубляя энергодефицит, а активация эндонуклеаз инициирует апоптоз.
Стресс-синдром, развивающийся при острой гипоксии, кроме положительных эффектов, определяемых гиперсекрецией глюкокортикоидов, индуцирует и нежелательные эффекты: катаболизм белков, отрицательный азотистый баланс, мобилизацию липидных резервов организма.
Повреждающее действие на клетки имеют и продукты перекисного окисления липидов, процесс, активизирующийся при гипоксии. Ацидоз и продукты перекисного окисления липидов повышают проницаемость лизосомальных мембран и способствуют выходу гидролаз, аутолизирующих клетку.
Как результат метаболических нарушений на клеточном уровне появляются и функциональные нарушения, проявляющиеся соответствующими клиническими симптомами в соответствии со спецификой органа.
Клетки мозга очень чувствительны к гипоксии, т.л., 20% всего количества кислорода, необходимого организму, потребляются мозгом. При гипоксии растет проницаемость мозговых капилляров, что может служить причиной развития отека мозга. Прекращение на 2-3 минуты доставки кислорода ведет к нейрональным нарушениям и появлению очагов некроза на уровне коры головного мозга и мозжечка. При хронической гипоксии в мозге появляются клеточные дистрофии на корковом и подкорковом уровнях, а также отек мозга.
Миокард использует часть энергии, вырабатываемую за счет процессов анаэробного гликолиза, которая может обеспечить энергетические его потребности всего на несколько минут. Запасы гликогена в миокарде расходуются быстро. Уже через 3-4 минуты аноксии сократительная способность миокарда снижается. Гликолиз индуцирует накопление лактата, развивается метаболический ацидоз, ведущий к снижению активности ферментов дыхательной цепи и моноаминоксидазы. В миокарде при гипоксии развивается жировая дистрофия.
В почках в рамках гипоксии определяется некробиоз и некроз эпителиоцитов почечных канальцев, что ведет к почечной недостаточности.
В печени также регистрируется некроз гепатоцитов с последующим склерозированием органа.
Такие же патологические клеточные процессы разворачиваются и в других паренхиматозных органах.
Клинические проявления гипоксии. Симптоматология острой гипоксии определяется нарушениями функций жизненно важных органов. Нарушение активности ЦНС проявляется головной болью, эйфорией, неадекватным поведением и др. Эти симптомы обусловлены нарушением процессов торможения в коре мозга. Параллельно уменьшается тормозное влияние коры мозга на подкорковые структуры. Появляются тошнота, рвота, нарушения координации движений, судороги. Дыхание становится периодическим, снижается сердечная деятельность и тонус сосудов.
При снижении парциального давления кислорода в артериальной крови до 40-20 мм рт. ст. наступает мозговая кома с потерей функций коры мозга, подкорковых структур и бульбарных центров. При парциальном давлении кислорода в артериальной крови ниже 20 мм рт. ст. происходит мозговая смерть и смерть организма.
23.2. Общая гипероксия
Гипероксия – повышение давления кислорода в тканях как результат избыточного притока кислорода к клеткам или уменьшения его потребления.
В обычных условиях на уровне моря парциальное давление кислорода в атмосфере около 160 мм рт. ст., а в альвеолярном воздухе, в артериальной крови и интерстициальной жидкости проксимальной области капилляров – только 100 мм рт. ст. Вследствии захвата и потребления кислорода клетками его давление в венозной крови падает до 40 мм рт. ст. Установлено, что давление 100 мм рт. ст. оптимально для биологических структур, а рост оксигенации среды потенциально вреден из-за образования активных форм кислорода и пероксидации веществ организма с индукцией клеточных повреждений. Патогенное действие гипероксии на организм может проявится при техногенном использовании (гипербария на глубине), так и ятрогенным — применение гипероксии в терапевтических целях. Это требует знания патогенеза вредного влияния гипероксии а также изучение внутренних механизмов защиты и выработки принципов коррекции побочных эффектов гипербарического кислорода.
Этиология гипероксии. Все факторы, ведущие к гипоксии, можно классифицировать в зависимости от патогенетического механизма на несколько классов.
- Факторы, повышающие приток кислорода к клеткам:
а) повышение парциального давления кислорода во вдыхаемом воздухе ассоциированное с нормальным, повышенным или пониженным атмосферным давлением (соответственно гипероксия нормобарическая, гипобарическая и гипербарическая);
б) возрастание транспорта кислорода к тканям в условиях нормального парциального давления кислорода во вдыхаемом воздухе (легочная гипервентиляция, усиление системного или регионального кровотока).
- Факторы, снижающие потребление кислорода клетками (ферментные и субстратные нарушения).
Патогенез гипероксии различается в зависимости от механизма действия этиологических факторов.
При увеличении парциального давления кислорода во вдыхаемом воздухе наблюдается экзогенная гипероксия, характеризующаяся полным насыщением гемоглобина кислородом на уровне легочных капилляров (концентрация оксигемоглобина становится равной 100% вместо 96% в норме) и кроме того, в крови растворяется дополнительное количество кислорода, пропорциональное степени роста давления кислорода в альвеолах. Так, 100 мл артериальной крови в нормобарических условиях содержит только 0,3 мл растворенного кислорода, в то время как при гипербарии – 2-6 мл О2/100 мл крови.
Эндогенная гипероксия – рост парциального давления кислорода на уровне клетки в условиях нормального содержания О2 во вдыхаемом воздухе. Эндогенная гипероксия от гипервентиляции появляется в условиях усиления альвеолярной вентиляции (возможна и в условиях искусственной вентиляции легких смесью газов с повышенным содержанием кислорода), что ведет к росту рО2 в альвеолярном воздухе (которое может приблизиться к 160 мм рт. ст.), а в артериальной крови имеет место сатурация гемоглобина кислородом и дополнительное растворение кислорода в плазме крови.
Гипердинамическая гипероксия появляется в рамках усиления системной гемодинамики (увеличение сердечного выброса и притока крови к органам вместе с избыточной доставкой кислорода, которая превышает реальные потребности). Характеризуется обычной сатурацией гемоглобина артериальной крови (около 96%), обычным количеством кислорода, растворенным в плазме, но из-за увеличения линейной и объемной скорости кровотока растет концентрация оксигемоглобина в венозной крови (артериализация венозной крови, уменьшение артерио-венозной разницы кислорода).
Реактивная гипероксия развивается при усилении региональной циркуляции крови (артериальная гиперемия) и сходна с гипердинамической гипероксией, но носит локальный характер.
Дисметаболическая гипероксия – результат нарушения утилизации кислорода при адекватном притоке кислорода. Встречается при нарушении активности или синтеза ферментов дыхательной цепи в митохондриях (гистотоксическая гипероксия), при недостаточности окислительного субстрата в клетке (субстратная гипероксия).
Проявления. Гипероксия проявляется компенсаторными, защитными реакциями и патологическими процессами, разворачивающимися на различных уровнях организма.
Компенсаторные реакции при гипероксии состоят в сохранении нормального давления кислорода в клетках в условиях гипероксии на различных уровнях транспорта кислорода. Например, гипероксия ведет к спазму мозговых сосудов. Защитные реакции против гипоксии состоят в инактивации активных форм кислорода, образующихся при гипоксии. Защитные механизмы включают различные ферменты и антиоксидантные вещества эндогенного и экзогенного происхождения – супероксиддисмутаза, каталаза, пероксидазы, глютатионредуктаза, церулоплазмин, α-токоферол, селениты.
Гипероксия компенсирована тогда, когда рост парциального давления кислорода на различных уровнях его транспорта не ведут к росту содержания О2 в клетках (существует гипероксемия, но не развивается клеточная гипероксия). Субкомпенсированная гипероксия представляет собой состояние, когда наблюдается клеточная гипероксия, однако усиление антиоксидантной системы позволяет нейтрализовать активные формы кислорода, предотвращая клеточные повреждения. Декомпенсированная гипероксия наблюдается при истощении антиоксидантной системы, свободные радикалы кислорода не нейтрализуются и продукты перекисного окисления липидов, протеинов, нуклеопротеидов накапливаются, обуславливая повреждение клетки.
В лечебных целях гипероксия применяется только в условиях гипероксибарии – вдыхание кислорода под терапевтическими давлениями в 2, максимум 3 атмосферы. При гипероксибарии, наряду с полной сатурацией гемоглобина кислородом, растет и количество кислорода, физически растворенного в плазме, что позволяет обогатить ткани кислородом даже в условиях, когда скорость кровотока в капиллярах мала (венозная гиперемия, ишемия). Так, гипербарическая оксигенация компенсирует любой тип гипоксии (за исключением гистотоксической), особенно гипоксии, обусловленные уменьшением или при блокировании молекулы гемоглобина (гемоглобинотоксическая анемическая гипоксия), за счет повышения содержания кислорода, растворенного в плазме, лимфе, тканевой жидкости. Посредством гипербарической оксигенации обеспечиваются метаболические потребности клеток, даже в условиях снижения тока крови на уровне микроциркуляции.
Кислород под давлением действует на все органы, ткани, клетки и внутриклеточные структуры. В зависимости от интенсивности кислородозависимых реакций, гипероксия может иметь как положительные, так и токсические эффекты, определяемые возросшим окислительным потенциалом кислорода под давлением.
Патогенное действие гипероксии заключается в избыточном образовании активных форм кислорода, пероксидации эндогенных веществ, изменении структуры и функциональных нарушениях клеток, органов, систем.
В условиях гипероксии интенсивно образуются свободные радикалы кислорода – супероксидный анионрадикал (О2 — ), синглетный кислород ( 1 О2), гидроксильный радикал (ОН — ), которые повреждают мембранные фосфолипиды с образованием липидных перекисей и инициацией цепных перекисных реакций. Вредные эффекты состоят в разрушении цитоплазматических мембран и внутриклеточных структур, изменение конформационной структуры белков, нарушение структуры ДНК, РНК, повреждается цитоплазматическая мембрана с нарушениями осмотического, электролитного клеточного гомеостаза, с нарушениями электрогенеза, набуханием и цитолизом клеток.
Повреждение митохондриальных мембран, саркоплазматического ретикулума и лизосом ведут соответственно к нарушению процессов окислительного фосфорилирования и энергогенеза, к деградации рибосом с нарушением синтеза белка, к выделению лизосомальных ферментов с аутолизом и индукцией необратимых нарушений в клетках до некроза.
Одновременно с этим, под влиянием гипербарического кислорода блокируются ферменты дыхательной цепи (цитохромоксидаза, дегидразы), ингибируется активность оксидоредуктаз, вследствие чего клетки теряют способность утилизировать кислород – наступает тканевая гипоксия, которая ведет к нарушению функций и структуры клеточных мембран и внутриклеточных органелл.
Клеточные патологические гипероксические процессы (повреждения клетки, некроз) ведут к патологическим процессам в тканях, органах и системах с последствиями для всего организма (воспаление, реакция острой фазы, лихорадка).
Самые чувствительные структуры к действию гипероксии (в порядке убывания чувствительности): нервная система, печень, яички, почки, легкие, мышцы. Этот феномен определяется различным уровнем метаболизма в этих органах, состоянием антиоксидантных систем каждого вида клеток.
При действии гипероксии нарушается функция ЦНС как следствие нейрональных нарушений, появляются очаги некроза, нарушаются электрофизиологические процессы, возможны судороги.
Клеточные гипероксические повреждения в легких проявляются снижением сурфактанта на поверхности альвеол, снижением содержания фосфолипидов в клеточной мембране, окислением сульфгидрильных групп белков, деструкцией эпителиоцитов воздухоносных путей и альвеолоцитов с последующим воспалением (бронхиты, альвеолиты), отеком легкого, нарушением процесса диффузии на уровне альвеоло-капиллярного барьера. Так, гипероксия может вести к респираторной гипоксии.
Проведенные исследования определили клеточные повреждения со снижением функции сердца в условиях гипероксии, снижение систолического объема, рост периферического сопротивления сосудов, уменьшение скорости кровотока на уровне микроциркуляции. Гипероксибария повышает проницаемость сосудов, индуцирует дистрофические изменения на уровне эндотелиоцитов и миоцитов сосудов, изменяет реологические свойства крови с агрегацией эритроцитов.
В системе крови повышается проницаемость мембраны эритроцита вплоть до гемолиза. В условиях гипероксии повышается сродство гемоглобина к кислороду. Кривая диссоциации оксигемоглобина в перенасыщенной кислородом среде сдвигается влево, так как отдача кислорода оксигемоглобином зависит от содержания кислорода в тканях. В условиях гипероксии ткани насыщены кислородом растворенным в плазме крови, в то время как оксигемоглобин не диссоциирует и, будучи связанным с кислородом, способствует накоплению в тканях диоксида углерода с развитием ацидоза. Этот процесс происходит и благодаря снижению активности гликолитических систем в эритроцитах и снижению содержания в них 2,3-глицерофосфата.
Описанные патологические процессы на уровне органа (легкие, сердце, костный мозг и др.), в свою очередь, ведут к интегральным патологическим процессам – респираторная, циркуляторная, анемическая, гипоксия, гиперкалиемия за счет выхода ионов калия из поврежденных клеток.
Особую важность при экстремальной гипероксии (при превышении терапевтического режима) занимает ацидоз, патогенез которого следующий: при избыточном давлении кислорода во вдыхаемом воздухе имеет место растворение его в плазме крови в количестве, достаточном для обеспечения окислительных процессов в тканях. По этой причине, на уровне капилляров большого круга оксигемоглобин не диссоциирует и, соответственно, не образуется карбгемоглобин – транспортная форма диоксида углерода. Наступает гиперкапния, которая ведет к опасному ацидозу.
Итак, гипероксия индуцирует рост парциального давления кислорода в крови с насыщением тканей кислородом, но при длительном действии наступает смешанная гипоксия со всеми специфическими последствиями. Этот факт требует особого внимания со стороны врача, а также и защитных терапевтических мер при применении гипероксибарии, так как наряду с положительными эффектами появляются и многие опасные эффекты, обусловленные высоким окислительным потенциалом кислорода с необратимыми клеточными повреждениями и патологическими процессами в органах.
Дата добавления: 2014-12-23 ; просмотров: 44 ; Нарушение авторских прав
источник
Состояние организма, при котором клетки и ткани не насыщаются кислородом, называется гипоксией. Она бывает у взрослых, детей и даже у ребенка, находящегося в утробе матери. Такое состояние считается патологическим. Оно приводит к серьезным и иногда необратимым изменениям в жизненно важных органах, включая сердце, мозг, центральную нервную систему, почки и печень. Предотвратить осложнения помогают специальные фармакологические методы и средства. Они направлены на увеличение количества доставляемого к тканям кислорода и уменьшение их потребности в нем.
Медицина определяет это понятие, как патологическое состояние, при котором в организме наблюдается дефицит кислорода. Оно возникает при нарушениях утилизации этого вещества на клеточном уровне или недостатке во вдыхаемом воздухе. Термин образован от двух греческих слов – hypo и oxigenium, которые переводятся как «мало» и «кислород». На бытовом уровне, гипоксия – это кислородное голодание, потому как все клетки организма страдают от его недостатка.
Общей причиной кислородного голодания может выступать недостаток поступающего внутрь организма кислорода или прекращение его усвоения тканями тела. Этому способствуют либо неблагоприятные внешние факторы , либо определенные заболевания и состояния. Если кислородное голодание развивается в результате недостатка кислорода во вдыхаемом воздухе, то форма патологии называется экзогенной. Ее причинами являются:
- пребывание в колодцах, шахтах, подводных лодках или других закрытых помещениях, которые не имеют сообщения с внешней средой;
- смог в городе, сильная загазованность;
- плохая вентиляция помещений;
- неисправность наркозо-дыхательной аппаратуры;
- нахождение в помещении, где много людей;
- разряженная атмосфера на высоте (болезнь летчиков, горная и высотная болезни).
Если патология стала следствием какого-либо заболевания или состояния организма, то она называется эндогенной. Причинами этого вида кислородного голодания выступают:
- заболевания дыхательной системы, такие как асбестоз (оседание асбестовой пыли в легких), пневмоторакс, гемоторакс (заполнение плевральной полости воздухом или кровью), бронхоспазм, бронхит, пневмония;
- наличие в бронхах инородных тел, например, после случайного заглатывания;
- приобретенные или врожденные пороки сердца;
- переломы и смещения костей грудной клетки;
- заболевания или патологии сердца, такие как инфаркт, сердечная недостаточность, облитерация перикарда, кардиосклероз (замещение сердечной мышцы соединительной тканью);
- травмы, опухоли и другие заболевания мозга, повредившие дыхательный центр ЦНС;
- венозная гиперемия (полнокровие);
- застойные явления в системе верхней или нижней полой вены;
- острая кровопотеря;
- асфиксия (удушье) любой природы;
- резкое сужение кровеносных сосудов в разных органах.
Для еще не родившегося малыша кислородная недостаточность очень опасна. Она вызывает серьезные осложнения: на ранней стадии беременности – замедление или патологии развития плода, на поздней – поражения центральной нервной системы. Кислородное голодание ребенка бывает вызвано некоторыми системными заболеваниями беременной женщины, включая:
- патологии сердечно-сосудистой системы, которые приводят к спазмам сосудов и ухудшению кровоснабжения плода;
- заболевания внутренних органов, такие как пиелонефрит и воспаления мочевыделительной системы;
- железодефицитную анемию, которая нарушает поступление к тканям кислорода;
- хронические заболевания дыхательных органов, например, бронхиальная астма или астмоидный бронхит;
- нарушения в работе эндокринной системы.
Гипоксия при беременности часто связана с вредными привычками женщины. Беременной категорически воспрещается курить и пить алкоголь. Все токсины попадают в кровоток малыша и приводят к серьезным осложнениям. Гипоксия плода бывает связана и с другими нарушениями:
- аномалиями в развитии плаценты или пуповины;
- перенашиванием беременности;
- повышенным тонусом матки;
- преждевременной отслойкой плаценты;
- инфицированием плода;
- несовместимостью крови плода с кровью матери по резус-фактору;
- длительным сдавлением головки в родовых путях;
- обвитием пуповины вокруг шеи;
- попаданием в дыхательные пути слизи или околоплодных вод.
Определить у человека гипоксию можно по определенным признакам. Существуют симптомы, общие для всех видов кислородного голодания. Они проявляются, когда мозг поглощает меньше положенной ему части кислорода. При таком нарушении наблюдаются следующие симптомы:
- Заторможенность нервной системы. Имеет выраженный характер. Пациент жалуется на тошноту, головную боль и головокружение. Иногда наблюдаются нарушения зрения и даже потеря сознания.
- Повышенная возбудимость. Человек перестает контролировать речь и движения, ощущает себя в состоянии эйфории.
- Изменение оттенка кожи. Лицо человека начинает бледнеть, а затем синеет или становится покрасневшим. Холодный пот указывает на то, что мозг пытается справиться с состоянием самостоятельно.
- Поражение мозга. Развивается при тяжелой форме кислородного голодания, может привести к отеку мозга. Это состояние сопровождается потерей всех рефлексов и нарушением работы и структуры органов. Пациент впадает в состояние комы.
Симптоматика кислородной недостаточности несколько отличается для острой и хронической формы. В случае молниеносного кислородного голодания ни один симптом проявиться не успевает, потому как в течение 2-3 минут наступает смерть. Такое состояние очень опасно и требует экстренной помощи. Острая форма гипоксии развивается в течение 2-3 часов и характеризуется следующими признаками:
- уменьшение частоты сердечных сокращений;
- падение артериального давления;
- изменение общего объема крови;
- дыхание становится неритмичным;
- кома и агония с последующим летальным исходом, если гипоксия не была устранена на начальной стадии.
Эта форма гипоксии проявляется гипоксическим синдромом. В таком случае наблюдаются симптомы со стороны центральной нервной системы. Чувствительным к кислородному голоданию является головной мозг. В тканях органа развиваются очаги кровоизлияний, некрозов и других признаков разрушения клеток. На ранней стадии эти изменения вызывают у человека состояние эйфории и двигательного беспокойства.
При прогрессировании гипоксии кора головного мозга угнетается. Симптомы напоминают состояние алкогольного опьянения. Пациент испытывает следующие ощущения:
- судороги;
- сонливость;
- тошноту, рвоту;
- непроизвольное отхождение мочи, кала;
- нарушение сознания;
- шум в ушах;
- заторможенность;
- головную боль;
- головокружение;
- нарушения координации движений;
- вялость.
При судорогах возможно развитие опистотонуса – состояния, при котором человек выгибается дугой, его мышцы шеи и спины разгибаются, голова запрокидывается назад, а руки сгибаются в локтях. Поза напоминает фигуру «мостик». Кроме признаков угнетения коры головного мозга, при гипоксии наблюдаются:
- боли в области сердца;
- резкое снижение тонуса сосудов;
- тахикардия;
- пониженная температура тела;
- одышка;
- депрессия;
- падение артериального давления;
- цианоз – синюшность кожных покровов;
- неритмичное дыхание;
- делирий – «белая горячка»;
- корсаковский синдром – потеря ориентации, амнезия, замена реальных событий вымышленными.
По типу распространенности кислородного голодания гипоксия бывает общей или местной. Самая широкая классификация разделяет это состояние на виды в зависимости от этиологии, т.е. причины возникновения. Так, гипоксия бывает:
- Экзогенной. Еще называется гипоксической гипоксией, которая обусловлена факторами окружающей среды. Патология развивается вследствие недостаточного поступления кислорода в организм.
- Эндогенной. Связана со сторонними заболеваниями или расстройствами.
Эндогенная гипоксия разделяется еще на несколько подтипов в зависимости от этиологии. Каждый из видов имеет определенную причину возникновения:
- Дыхательная (легочная, респираторная). Развивается из-за препятствий в районе легочных альвеол, что не дает гемоглобину моментально связываться с кислородом.
- Циркуляторная. Возникает из-за расстройства процессов кровообращения. По механизму развития она разделяется на ишемическую и застойную.
- Гемическая. Наблюдается при стремительном убывании гемоглобина. Гемическая гипоксия бывает анемической или вызванной ухудшением качества гемоглобина.
- Тканевая. Связана с прекращением абсорбции кислорода из-за подавления активности ферментов. Тканевая гипоксия наблюдается при радиации, отравлении ядовитыми веществами микробов, угарным газом или солями тяжелых металлов.
- Субстратная. На фоне нормальной транспортировки кислорода наблюдается нехватка полезных веществ. Чаще отмечается при сахарном диабете или длительном голодании.
- Перегрузочная. Возникает после тяжелых физических нагрузок.
- Смешанная. Является самым серьезным типом, наблюдается при серьезных жизнеугрожающих патологиях, например, при коме или отравлении.
Следующая классификация разделяет гипоксию на виды с учетом скорости развития кислородного голодания. Самой опасной является та, которая проявляется очень быстро, потому как она часто приводит к летальному исходу. В целом существуют следующие виды гипоксии:
- хроническая – длится от нескольких недель до пары лет;
- подострая – развивается в течение 5 часов;
- острая – длится не более 2 часов;
- молниеносная – продолжается 2-3 минуты.
Выделяется классификация гипоксии и в зависимости от уровня выраженности ее симптомов и тяжести дефицита кислорода. С учетом этих факторов кислородная недостаточность имеет следующие степени:
- Критическая. Гипоксический синдром приводит к коме или шоку, может закончиться агонией, смертельным исходом.
- Тяжелая. Нехватка кислорода выражена сильно, высок риск развития коматозного состояния.
- Умеренная. Клинические признаки гипоксии проявляются в состоянии покоя.
- Легкая. Кислородное голодание наблюдается только при физических нагрузках.
Кислородная недостаточность влияет на работу всех органов и систем. Последствия зависят от того, в какой период патология была устранена и как долго она длилась. Если компенсаторные механизмы еще не были истощены, а дефицит кислорода был ликвидирован, то никаких негативных последствий не возникнет. Когда патология появилась в период декомпенсации, то осложнения определяются длительностью кислородного голодания.
Сильнее от этого состояния страдает головной мозг, ведь без кислорода он способен выдержать только 3-4 минуты. Затем клетки могут отмереть. Печень, почки и сердце выдерживают около 30-40 минут. Основные последствия дефицита кислорода:
- истощение адаптационных резервов;
- ослабление противоопухолевой защиты;
- снижение иммунитета;
- ухудшение памяти и скорости реакций;
- нейропсихический синдром;
- психоз;
- слабоумие;
- паркинсонизм (дрожательный паралич);
- непереносимость физических нагрузок;
- жировое перерождение клеток мышц, миокарда, печени.
Кислородная недостаточность выступает одной из частых причин не только смертности плода, но и появления у него пороков развития. Последствия зависят от триместра беременности и степени дефицита кислорода:
- Первый триместр. В этот период происходит закладка органов, поэтому из-за дефицита кислорода возможны замедление развития зародыша, формирование аномалий.
- Второй триместр. На этой стадии возникают проблемы с адаптацией малыша и патологии центральной нервной системы. При хронической форме возможна гибель ребенка.
- Третий триместр. Недостаток кислорода провоцирует отставание в развитии по срокам беременности. Также возможно серьезное повреждение нервной системы ребенка. Во время родов кислородное голодание становится причиной асфиксии.
Перенесенное кислородное голодание после рождения малыша серьезно влияет на его здоровье. Ребенок становится беспокойным, легко возбудимым, страдает от высокого мышечного тонуса. Последний выражается в частом подергивании ножками или ручками, судорогах, дрожании подбородка. Среди других симптомов отмечаются вялость, частые срыгивания и нежелание брать грудь. Список более серьезных последствий включает:
- мертворожденность;
- смерть в раннем послеродовом периоде;
- нарушение или задержка психомоторного и интеллектуального развития;
- поражения сосудов и сердца;
- заболевания нервной системы;
- проблемы с мочевыделительными органами;
- тяжелые заболевания глаз.
Заподозрить у малыша недостаток кислорода можно по высокой двигательной активности. Она является рефлексом, которым ребенок пытается восстановить нормальный кровоток и увеличить кровоснабжение. Беременная женщина ощущает следующее:
- бурное шевеление малыша;
- резкие сильные толчки, которые доставляют боль и неудобство;
- при усилении кислородной недостаточности – постепенное ослабление толчков, которые могут исчезнуть совсем.
При последнем признаке женщина должна насторожиться. В целом активность плода в женской консультации наблюдают с 28 недели срока. При определении внутриутробной кислородной недостаточности врачи используют следующие методы:
- Выслушивание тонов сердца. Для этого применяется стетоскоп – специальный акушерский прибор. Он позволяет оценить тон, ритм и частоту сердечных сокращений, заметить посторонние шумы.
- Кардиотокография. Представляет собой фиксацию на бумаге сердечного ритма при помощи специального ультразвукового датчика.
- Допплерометрия. Заключается в исследовании отклонений кровотока между плодом и женщиной. Метод помогает определить степень тяжести кислородного голодания.
Кроме основных методов, используются лабораторные анализы крови на уровень гормонов и биохимический состав. Для подтверждения гипоксии назначается исследование околоплодных вод на присутствие в них первородного кала – мекония. Он указывает на расслабление мышц прямой кишки малыша, связанное с недостатком кислорода. Этот метод диагностики играет важную роль при нарастании родовой деятельности. От него будет зависеть весь процесс родов.
В большинстве случаев отмечается смешанная форма кислородной недостаточности. По этой причине подход к лечению должен быть комплексным. Для поддержания снабжения клеток кислородом применяется гипербарическая оксигенация – процедура по нагнетанию этого газа в легкие под давлением. Она обеспечивает:
- растворение кислорода непосредственно в крови без связывания с эритроцитами;
- доставку ко всем тканям и органам кислорода;
- расширение сосудов сердца и мозга;
- работу органов в полную силу.
Для циркуляторной формы показан прием сердечных препаратов и лекарств, которые повышают артериальное давление. В случае кровопотери, несовместимой с жизнью, требуется переливание крови. Гемическая гипоксия, кроме гипербарической оксигенации, лечится при помощи следующих процедур:
- переливания крови или эритроцитарной массы;
- введения препаратов, выполняющих функции ферментов;
- плазмафареза и гемосорбции (очищение крови);
- введения переносчиков кислорода, глюкозы или стероидных гормонов.
Во время беременности лечение кислородной недостаточности направлено на нормализацию кровообращения в плаценте. Это помогает обеспечить поступление к плоду питательных компонентов и кислорода. Используемые препараты и методы:
- расслабляют миометрий;
- улучшают реологические параметры крови;
- расширяют маточно-плацентарные сосуды;
- стимулируют метаболизм в плаценте и миометрии.
Ежедневно женщине необходимо дышать смесью кислорода с воздухом. Лекарственные препараты назначает только врач. Специалист может прописать следующие медикаменты:
- Сигетин;
- Трентал;
- Метионин;
- Гепарин;
- Курантил;
- Витамины Е и С;
- глутаминовую кислоту;
- Галоскарбин;
- Липостабил.
В случае кислородного голодания на 28-32 неделе необходимо экстренное родоразрешение. То же касается ухудшения биохимических показателей крови, появления в околоплодных водах мекония, маловодия. В качестве подготовки к акушерскому или хирургическому разрешению родов используют:
- дыхание увлажненным кислородом;
- внутривенное введение глюкозы;
- введение Сигетина, Кокарбоксилазы и аскорбиновой кислоты, Эуфиллина.
Если при рождении у малыша заподозрили кислородную недостаточность, то ему сразу оказывают медицинскую помощь. Из дыхательных путей удаляют слизь и жидкость, ребенка согревают, проводят при необходимости реанимационные мероприятия, добиваясь устранения угрозы для жизни. Когда состояние новорожденного стабилизируется, его располагают в барокамере. Там он получается питательные растворы. По мере взросления возбудимость, судороги, подергивания ручек и ножек постепенно прекращаются, но на 5-6 месяце возможен рецидив патологии.
Мероприятия по профилактике кислородного голодания направлены на недопущение состояний, которые приводят к этому. Человек должен вести активный образ жизни, чаще гулять, заниматься спортом и правильно питаться. Хронические болезни нужно вовремя лечить. При работе в душных помещениях их необходимо регулярно проветривать. Профилактика во время беременности следующая:
- употребление кислородных коктейлей;
- плавание;
- пение (вырабатывает правильное дыхание);
- занятия обычными домашними делами (режим с незначительными физическими нагрузками снабжает мышцы кислородом);
- обеспечение спокойной обстановки;
- прогулки на свежем воздухе;
- полноценный здоровый сон;
- сбалансированный рацион питания с продуктами, богатыми калием, железом, йодом;
- отслеживание шевелений плода (в норме малыш шевелится около 10 раз в день);
- регулярное посещение врача.
источник