Антибиотики при фурункулезе – важная часть комплексной терапии и самый действенный метод, обеспечивающий скорейшее излечение. Препараты с антибактериальным действием особенно незаменимы в тех случаях, когда фурункул расположен в области шеи и головы. То есть в непосредственной близости к важным кровеносным сосудам, через которые инфекция может проникнуть в головной мозг и спровоцировать осложнения, угрожающие жизни.
Основной причиной, вызывающей развитие фурункулеза, является проникновение патогенных микроорганизмов (стафилококков) под кожу. В данном случае речь идет о грамположительном штамме золотистого стафилококка (Staphylococcus aureus). Это самый высокотоксичный штамм, который с кровотоком легко распространяется в организме и быстро образует новые очаги воспаления. Фурункулы могут появиться на любом участке тела, но чаще локализуются на лице, шее, груди, спине, в паховой или подмышечной области. Давайте выясним, какие антибиотики принимать при фурункулезе, как их правильно подбирать и применять?
Фурункулез – это воспалительный процесс гнойно- некротического характера, развивающийся в волосяном фолликуле и затрагивающий окружающие ткани. В народе такие гнойные образования называют чирьями.
Фурункул выглядит как крупный, болезненный прыщ, внутри которого находится гнойное содержимое. При появлении одиночного, не осложненного фурункула, лечение антибактериальными препаратами, как правило, не назначают. В этих случаях с очагом воспаления можно справиться наружными средствами (мазями, антисептиками).
Но, когда на различных участках тела появляются многочисленные фурункулы на разных стадиях развития, и образуются множественные очаги воспаления, специалисты диагностируют фурункулез. Если иммунитет человека ослаблен, болезнь может рецидивировать и переходить в хроническую форму, которая тяжело поддается терапии.
В этом случае нужно не только лечить уже существующие фурункулы, но и предпринимать меры по предупреждению повторного заражения и предотвращению дальнейшего распространения инфекции. Поэтому без применения антибактериальных препаратов не обойтись.
С учетом того, что стафилококк легко распространяется в окружающей среде, заболевание можно отнести к условно заразным. То есть инфекцию можно подхватить бытовым путем, но развивается она только в том случае, когда организм ослаблен. При крепком иммунитете человек может стать пассивным носителем и даже не подозревать о том, что он заражен стафилококком.
Итак, мы выяснили, что основной причиной заболевания, является проникновение стафилококка в организм. Но для того, чтобы он активизировался и начал свою разрушительную работу, нужны провоцирующие факторы. К ним относятся:
- Ослабление иммунитета вследствие инфекционных или хронических болезней;
- Эндокринные заболевания (нарушение обмена веществ, сахарный диабет, гормональные сбой);
- Авитаминоз (нехватка важнейших витаминов и микроэлементов);
- Нарушение правил личной гигиены;
- Неправильное питание, вредные привычки;
- Повышенное потоотделение;
- Механические повреждения кожного покрова (например, микротравмы при бритье).
Основной симптом заболевания – появление на коже очага воспаления (чирья). В месте поражения наблюдается отечность и покраснение кожи, образуется болезненная пустула с формирующейся гнойной головкой. Этот процесс часто сопровождается общим ухудшением состояния больного: повышается температура, отмечается лихорадочное состояние, озноб, головные боли, упадок сил. На протяжении нескольких дней в очаге воспаления скапливается гной, после вскрытия чирья он выходит, и на месте фурункула остается язвочка. В дальнейшем она заживает путем рубцевания тканей.
Главная опасность фурункулеза заключается в риске развития осложнений, угрожающих жизни (гнойный менингит, сепсис, абсцессы). Особенно, если чирьи расположены в тех местах (на голове, лице, шее), где инфекция легко может попасть в важные кровеносные сосуды и с током крови распространиться по организму и проникнуть в мозг. В этом случае, другой альтернативы, кроме применения антибиотиков, нет.
Терапию антибиотиками назначают в следующих случаях:
- При появлении на теле множественных, болезненных фурункулов;
- При фурункулезе, осложненном воспалением лимфатических узлов;
- Если фурункулы расположены в области лица, шеи или на голове;
- При рецидивирующем, хроническом гнойном фурункулезе.
Лечение антибиотиками дополняют иммуностимулирующими препаратами, назначают прием витаминных комплексов, рекомендуют физиотерапевтические процедуры и соблюдение специальной диеты.
Применение антибактериальной терапии при фурункулезе имеет ряд противопоказаний. Так, назначать антибиотики нельзя при следующих состояниях:
- Индивидуальная непереносимость антибактериальных средств;
- Период беременности и грудного вскармливания;
- Тяжелые поражения печени, почек;
- Бронхиальная астма;
- Болезни кишечника;
- Грибковые заболевания кожи;
- Открытая форма туберкулеза;
- Заболевания сердечно — сосудистой системы и органов кроветворения.
Назначать препарат должен врач, заниматься самолечением недопустимо. Специалист в индивидуальном порядке подберет дозировку препарата и схему лечения на основании лабораторных исследований, которые проводят с целью выявления типа возбудителя инфекции. При этом врач обязательно учтет возможные противопоказания, что позволит избежать нежелательных осложнений.
Виды и формы антибиотиков, применяемых при фурункулезе
Для лечения фурункулов применяют следующие виды антибиотиков:
- Пенициллины. Антибиотики этой группы эффективны в отношении большинства типов грамположительных бактерий. Для лечения фурункулеза врач может назначить такие препараты, как Ампициллин, Бициллин, Амоксициллин, Ампиокс.
- Цефалоспорины. Этот вид антибиотиков препятствует распространению инфекции и проникновению ее вглубь мягких тканей. Из препаратов цефалоспоринового ряда наибольшей популярностью пользуются Цефуроксим, Цефалексин, Цефипим, Цефазолин.
- Макролиды. Действие антибиотиков — макролидов несколько отличается от прочих разновидностей. Их прием рекомендуется в тех случаях, когда процесс вызревания фурункулов сопровождается лихорадочным состоянием и повышением температуры. Препараты макролидового ряда одновременно с антибактериальным действием способны быстро останавливать воспалительный процесс, к тому же они самым щадящим образом действуют на кишечную микрофлору. Но принимать подобные антибиотики нужно с особой осторожностью при нарушениях функции печени и почек, так как они способны накапливаться в организме. К числу макролидов относятся Азитромицин, Эритромицин, Сумамед, Макропен
Вопрос выбора антибиотика, который помогает при фурункулезе, должен решить специалист. Он же определит, в какой форме применять антибактериальное средство. Существующая схема лечения фурункулеза предполагает применение наружных средств (мазей), растворов для инъекций и таблеток для перорального приема.
Стандартная схема лечения подразумевает хирургическое вскрытие гнойника после его созревания. При этом хирург обязательно обколет очаг воспаления раствором новокаина с антибиотиками. Это позволит купировать боль и предотвратит дальнейшее распространение гнойного процесса в окружающие ткани.
Зачастую пациенты обращаются за медицинской помощью уже на стадии абсцесса, то есть, когда гнойное воспаление вызвало расплавление окружающих тканей и формирование полости, заполненной гноем. В этом случае хирург вскрывает нарыв и вычищает его гнойное содержимое. Затем рану обрабатывают наружными средствами (мазями) с антибактериальным компонентом широкого спектра действия и накладывают стерильную повязку.
Антибиотики при фурункулезе в таблетках назначают в тяжелых случаях, когда имеются множественные рецидивирующие высыпания или гнойники локализуются в тех зонах, где представляют угрозу здоровью (голова, шея). При назначении препарата врач обязательно должен учесть тип возбудителя. Дело в том, что многие штаммы стафилококка приобрели устойчивость к некоторым группам антибиотиков.
Поэтому перед тем, как назначить препарат, содержимое фурункула исследуют лабораторным путем. Бактериологическое исследование методом посева позволяет определить чувствительность бактерий к антибиотикам. На основании результатов анализа врач в индивидуальном порядке подберет эффективный препарат, который поможет быстро справиться с патогенной микрофлорой.
После вскрытия гнойников на ранку обязательно накладывают повязки, пропитанные антибактериальной мазью. С этой целью применяют следующие препараты:
- Мазь Левомеколь. Один из самых популярных препаратов, в основе которого антибиотик хлорамфеникол и метилурацил. Хлорамфеникол активно уничтожает широкий спектр анаэробных бактерий, а метилурацил стимулирует функции иммунной системы и обеспечивает быструю регенерацию пораженных тканей. Комбинированный препарат предназначен для обработки гнойный ран, фурункулов, язв и ожогов. Его применение предотвращает дальнейшее инфицирование и способствует скорейшему заживлению кожи.
- Лечение заболевания антибактериальными средствами в таблетированной форме осуществляется при рецидивирующих фурункулах и в тех случаях, когда местом их локализации является область головы и верхняя часть туловища. Сложность такой терапии заключается в том, что у возбудителя (стафилококка) со временем выработалась устойчивость ко многим антибиотикам. Поэтому, эффективный препарат нужно подбирать на основании микробиологического исследования на чувствительность.
Для этого специалист должен взять соскоб содержимого из очага воспаления и отправить его в лабораторию для исследования. Результат бактериологического посева определит штамм стафилококка и даст возможность врачу подобрать эффективный антибактериальный препарат. На сегодняшний день в медицинской практике применяют до двух десятков медикаментов в таблетированной форме, способных уничтожить стафилококковый штамм MRSA. Перечислим наиболее популярные из них:
- Линкомицин. Препарат с мощным бактериостатическим действием, действует в отношении обширного спектра болезнетворных микроорганизмов. Предназначен для лечения гнойных инфекций кожи (в том числе фурункулеза ). Начинает действовать уже через два часа после приема внутрь. Препарат производят в капсулах (по 250 мг). Дозировку врач подбирает в индивидуальном порядке. Обычно разовая доза для взрослого человека составляет 500 мг. Ее нужно принимать 3 раза в день перед едой и запивать достаточным объемом воды. Антибиотик может спровоцировать аллергические реакции, скачки артериального давления, головные боли, тошноту, рвоту. Медикамент нельзя назначать беременным и кормящим женщинам, детям младшего возраста, лицам, страдающим заболеваниями печени и почек.
- Цефалексин (Флексин, Кефлекс) – антибиотик из группы цефалоспоринов. Выпускается в разнообразных лекарственных формах: в виде порошка для суспензии, капсул (250мг) и таблеток (250мг). Оказывает мощное бактерицидное действие на большинство патогенных бактерий и штаммов стафилококка. Препарат начинает действовать уже через 60минут после применения. Используется для лечения фурункулеза, абсцессов и пиодермий. Суточная доза приема составляет от одного до четырех грамм, принимать таблетки нужно через равные временные интервалы в 6 часов. Препарат может спровоцировать побочные реакции в виде нарушений работы пищеварительного тракта, слабости, головокружения, дрожания рук(тремора). В период беременности и грудного вскармливания антибиотик разрешено принимать только под наблюдением врача.
- Амоксиклав – комбинированное лекарственное средство, содержащее антибиотик пенициллинового ряда – амоксициллин и клавулановую кислоту, которая предотвращает разрушение активного вещества и позволяет ему активно уничтожать болезнетворные штаммы. Стандартная доза приема при фурункулезе составляет одна таблетка Амоксиклава (375мг), которую принимают через каждые 8 часов. Перед приемом таблетку следует растворить в 100мл воды или хорошенько разжевать и запить большим объемом жидкости. Среди побочных действий медикамента — нарушения со стороны пищеварительного тракта (диарея, тошнота, рвота), аллергические реакции (кожный зуд, супь). Иногда возможно развитие бессонницы, головокружений, анемии, мигрени, судорог. Препарат противопоказан при поражениях печени, индивидуальной чувствительности. Во время беременности и грудного вскармливания медикамент можно принимать по назначению врача и под его контролем.
- Фузидин — натрий (Фузидин, Рамицин). Фузидин в таблетированной форме – это малотоксичный и эффективный антибиотик, который устраняет инфекции стафилококковой природы, в том числе и те из них, которые устойчивы к действию других антибактериальных средств. Препарат назначают при фурункулезе, флегмонах, инфицированных ранах, ожогах. Стандартная дозировка составляет от 0,5 до 1 г препарата, которые принимают трижды на протяжении суток, запивая молоком или водой. Курс лечения занимает от 7 до 10 дней. Антибиотик может спровоцировать диарею, сыпь на коже, тошноту, рвоту или боли в области живота. Поэтому лечение должно проходить под контролем специалиста.
Какому препарату отдать предпочтение, решает лечащий врач. Антибиотики при фурункулезе должен назначать специалист после консультации и обследования пациента. При этом врач учитывает множество нюансов: возраст и состояние больного, тип возбудителя, возможные противопоказания. Он же решает вопрос о целесообразности применения того или иного препарата и в индивидуальном порядке подбирает оптимальную дозировку и схему лечения.
Самолечением заниматься недопустимо, таким образом можно спровоцировать серьезные осложнения и только усугубить ситуацию. Особенно осторожно следует подходить к лечению антибиотиками беременных женщин и детей младшего возраста. В этом случае вопрос о применении препаратов решается лечащим врачом, а терапия проходит под его контролем. Помните, что фурункулез – опасное заболевание, поэтому не стоит затягивать с обращением за медицинской помощью.
источник
Хирургический метод лечения при абсцессах и флегмонах является основным. Необходимо провести первичную хирургическую обработку гнойного очага. Лечение больных с абсцессами, как правило, проводят амбулаторно. .
При локализации абсцесса в жевательной мышце, крыловидно-нижнечелюстном пространстве, подвисочной ямке, височной области у лиц с сопутствующими заболеваниями, старшей возрастной группы лечение проводят в условиях стационара. Больных с флегмонами также лечат в стационаре.
При хирургическом лечении следует учитывать стадию клинического развития воспалительного процесса, протяженность патологических изменений и их характер, индивидуальные особенности организма, а также особенности микробной флоры и ее чувствительность к антибактериальным препаратам.
В стадии отека и серозной инфильтрации хирургическое лечение должно быть направлено на ограничение зоны воспалительных изменений
тканей. Оно заключается во вскрытии воспалительного инфильтрата, снятии напряжения тканей и создании оттока из них, проведении блокад анестетика: 1—2 % 1,8—3,6—5,4 мл на 40—60—80 мл изотонического раствора хлорида натрия в окружности пораженных тканей. Целесообразно в состав блокад добавлять антибиотики, в том числе линкомицин, ферменты и другие средства. Одновременно создают отток экссудата от зуба консервативными методами или по показаниям удаляют зуб.
В стадии некроза и гнойного расплавления тканей проводят первичную хирургическую обработку гнойной раны: вскрытие гнойных очагов, не-кротомию, создают широкий отток для экссудата; осуществляют лекарственное воздействие на рану. При создании оттока из гнойных очагов используют различные методы дренирования, разные способы местного диализа, прерывистое или постоянное отсасывание экссудата, промывание, орошение, повязки, озонотерапию и др.
Особое внимание требуется при хирургическом лечении распространенных флегмон, особенно гнилостно-некротических, когда первичная обработка гнойных очагов дополняется активной, нередко неоднократной некротомией.
Выбор метода обезболивания зависит от характера воспалительного процесса (абсцесс, флегмона, распространенная флегмона), функционального состояния организма и условий проведения операции. Оперативное вмешательство при абсцессах, флегмоне в пределах одной анатомической области проводят под местным обезболиванием после соответствующей медикаментозной подготовки. Околочелюстные флегмоны в 2—3 областях и более вскрывают чаще под наркозом или под комбинированной общей анестезией с использованием седуксена, кетамина, сомбревина. Обязательна кратковременная предоперационная подготовка, направленная на дезинтоксикацию.
При общем обезболивании большое значение имеет локализация гнойного очага. Воспалительный процесс в области дна полости рта, корня языка, окологлоточного пространства, а также вовлечение в воспалительный процесс жевательных мышц ограничивают применение наркоза.
У пациентов с сопутствующими заболеваниями целесообразно провести коррекцию функции органов, систем организма и использовать сочетание местной анестезии с общей (закисью азота или пентраном). Общие анестетики применяют в субнаркотических концентрациях.
Ткани рассекают, руководствуясь анатомическими особенностями той области, где производится вмешательство, и эстетическими правилами: разрезы на лице через кожу делают соответственно ходу ветвей лицевого нерва; целесообразно проводить разрезы по ходу естественных кожных складок, под краем нижней челюсти. Необходимо
знать расположение каждого слоя тканей, подлежащих рассечению, особенно при оперативном вскрытии глубоко расположенных гнойных очагов.
Для достаточного оттока экссудата и предупреждения слипания краев рану дренируют резиновыми, полихлорвиниловыми трубками различного диаметра с перфорационными отверстиями и заостренными концами или полосками перчаточной резины. Целесообразно применение влажных повязок с гипертоническим (10 %) раствором хлорида натрия, а также растворов слабых антисептиков (0,4 % раствор этакридина лактата, 1—2 % растворы хлорамина, хлорфилипта, 0,1 % раствор фурагина, хлоргекседина, корсодила, элюдрина и др.). Можно рекомендовать введение таких антисептиков и антибактериальных препаратов, как 0,1—1 % раствор диоксидина, 2 % спиртовой раствор грамицидина С, нитацида в виде мази, гипо-золя-н в составе аэрозоля, неомицина в комплексном препарате «Лизосорб»; вводят марлевые выпускники, обильно пропитанные 2 % взвесью тетрациклина гидрохлорида в растительном масле или 10 % эмульсией синтомицина, мазью «Лево-миколь», во вскрытую гнойную полость. Также производят промывания раны стафилококковым или стрептококковым бактериофагом либо их сочетанием, стафилококковой плазмой, ферментами, особенно протеолитическими препаратами пролонгированного действия, сорбентами, в том числе дренирующим сорбентом «Регенкур».
При гнилостно-некротическом процессе хорошие результаты дает повторное орошение всех участков раны 3 % раствором перманганата калия, а затем раствором перекиси водорода. После этого накладывают влажную повязку с гипертоническим раствором хлорида натрия. Однако действие этих препаратов кратковременное; более эффективны растворы хлоргекседина, грамицидина С.
Классическую схему оперативного лечения — первичной обработки гнойной раны — дополняют методами активного дренирования, местного диализа, отсасывания экссудата. При диализе используют растворы хлорида натрия, 4—8 % раствор бикарбоната натрия, антисептики, антибиотики, детергенты, ферменты, раствор Рингера—Локка, ко-карбоксилазу, витамины С и группы В, аминокислоты. Эффективны проведение вакуум-гидроок-сигенации, аэрозольное, ультразвуковое, лазерное воздействия, низкочастотный вибромассаж.
Активный местный диализ (непрерывный или фракционный) гнойной раны проводят с учетом фаз воспаления и при соответственном лекарственном воздействии на раневой процесс, что позволяет регулировать его течение.
В I фазе — воспаления — проводятся механическую, физико-химическую и химико-биологическую антисептику; во II фазе — пролиферации и регенерации — химико-биологическую и биохи-
мическую санацию раны; в III фазе — реорганизации и формирования рубца — лечебные мероприятия направлены на стимуляцию репаратив-ной регенерации в ране.
Программу комплексной терапии рекомендуется составлять в зависимости от типа воспалительной реакции, распространенности гнойного процесса, состояния защитных реакций организма.
Удаление зуба, сопряженное в некоторых случаях (при флегмоне) с трудностями, легко выполнить спустя несколько дней после вскрытия околочелюстного гнойного очага. При значительных изменениях в околоверхушечных тканях удаляемого зуба, устанавливаемых по рентгенограмме, вскрытие и выскабливание околоверхушечных очагов показаны после предварительного отслаивания мягких тканей и трепанации стенки альвеолярного отростка.
При общей патогенетической терапии флегмон и абсцессов нужно предусматривать: 1) борьбу с инфекцией; 2) повышение иммунобиологических свойств организма, общеукрепляющее воздействие на организм; 3) коррекцию функций органов и систем.
Построение схем лечения абсцессов и флегмон должно основываться на функциональном состоянии организма и на характере воспалительной реакции — нормергической, гиперергической, ги-пергической, местных особенностях и локализации воспалительного очага или очагов. Особое внимание уделяется коррекции противоинфекци-онных защитных реакций у пациентов с первичными или вторичными иммунодефицитными заболеваниями и состояниями.
При абсцессах с нормергической воспалительной реакцией применяют антибиотики, сульфаниламиды, нитрофураны, десенсибилизирующие и общеукрепляющие средства. У отдельных больных с абсцессами щечной области, челюстно-язычного желобка индивидуально решают вопрос о применении только сульфаниламидов и комплекса противовоспалительных и десенсибилизирующих препаратов.
Лечение абсцессов с гипергической воспалительной реакцией начинают со стимулирующей, общеукрепляющей, активной иммунотерапии.
Общие принципы лечения флегмон такие же, как при остром диффузном остеомиелите челюсти (см. Одонтогенный остеомиелит челюсти).
При нормергическом течении околочелюстных флегмон в пределах одного-двух клетчаточ-ных пространств требуются антибактериальная, десенсибилизирующая, общеукрепляющая и симптоматическая терапия, индивидуальное закрепление эффекта лечения иммунными препаратами.
При гипергическом течении флегмон в пределах одного-двух клетчаточных пространств лечение начинают с общеукрепляющей, десенсибилизирующей терапии, назначения индивидуально подобранных иммунокорректоров и на завершающем этапе проводят антибиотикотерапию (с учетом выделенных микробных возбудителей и их чувствительности).
При распространенных флегмонах, характеризующихся гиперергической воспалительной реакций, комплексная терапия строится в зависимости от длительности заболевания, стадии прогрессирующего гнойного процесса — реактивной, токсической или терминальной. В зависимости от этого проводят предоперационную подготовку.
В реактивной фазе в ходе предоперационной подготовки предусматривается коррекция избыточных защитных реакций и гиповолемии. С этой целью применяют наркотические (1—2 % раствор проме-дола или омнопона — 1—3 мл) и ненаркотические средства (25—50 % раствор анальгина, баралгина — 1—3 мл), анальгетики, гипосенсибилизирующие, нейролептические и транквилизирующие препараты (1 % раствор димедрола — 1—2 мл), дроперидол (0,25 % раствор — 1—2 мл), глюкокортикоидные гормоны (суспензия гидрокортизона — 25—75 мг). Препараты вводят внутримышечно. Для внутривенного введения используют плазмозаменители солевых и глюкозированных растворов (из расчета 15— 25 мл на 1 кг массы тела).
В токсической фазе предоперационная подготовка заключается в увеличении объема циркулирующей крови и снижении интоксикации. С этой целью вводят 400—500 мл одного из плазмозаменителей (полиглюкин, реополиглюкин, гемодез), 100— 200 мл альбумина или протеина, 500—1000 мл 10 % раствора глюкозы с адекватным количеством инсулина, 500—1000 мл раствора электролитов (25— 35 мл/кг). Дополнительно применяют гипосенсибилизирующие средства, анальгетики, нейролептические средства (внутримышечно).
Одновременно с указанными препаратами вводят 0,06 % раствор коргликона — 1 мл, кокарбок-силазу — 10—20 мг внутривенно, АТФ — 1—2 мл и 20 % раствор камфоры — 2—3 мл внутримышечно. При капельном введении 400—500 мл поли-глюкина, гемодеза осуществляется дезинтоксика-ционное и реологическое действие. Вводят 10— 20 % раствор глюкозы (1000—1500 мл) с инсулином и раствор электролитов (800—1000 мл).
В состав инфузионной среды включают 5— 10 мл витамина С, 5—10 мл панангина, 25—75 мг гидрокортизона, 10—15 ЕД гепарина.
При поступлении больного (до получения анти-биотикограммы) назначают антибиотики широкого спектра действия или их сочетания с учетом синергизма действия препаратов (полусинтетические пенициллины, производные метронидазола, линкомицин, тетрациклин).
После проведения антибиотикограммы препараты назначают с учетом чувствительности к ним микробных возбудителей, синергизма, антагонизма химиопрепаратов (полусинтетические пени-циллины — ампициллин, карбенициллин, окса-циллин, стрептомицин, макролиды, эритромицин, олеандомицин, сульфаниламиды, фурановые препараты). Для профилактики побочного действия антибиотиков целесообразно назначение противогрибковых препаратов — нистатина, леворина.
Исследование микробной флоры проводят каждые 3—4 дня. Курс лечения антибактериальными препаратами не менее 6—8 дней.
При лечении распространенных флегмон согласно антибиотикограмме проводят смену антибиотика, используя азлоциллин, левомицетин, гентамицин, неомицин, клиндамицин, линкоми-цин или препараты резерва — фосфомицин, це-фалоспорины, рифампицин, ристомицин, флори-мицин, ванкомицин, бруломицин. Препараты вводят внутримышечно, внутривенно или внутри-артериально. Применяют также препарат метро-нидазола — 0,5 % раствор метрагила. В зависимости от дальнейшего течения гнойного воспалительного заболевания и эффекта антибактериальной терапии проводят ее коррекцию, учитывая: а) динамику общей и местной симптоматики процесса; б) данные повторных микробиологических исследований, в том числе изменения резистентности и лекарственной устойчивости микробных возбудителей; в) появление новых видов возбудителя или «больничной инфекции».
При тяжелом течении инфекционно-воспалите-льного заболевания вводят внутриартериально антибиотики — ежедневно или через день, всего 6—8—10 введений (катетеризация поверхностной височной или лицевой артерии, а также общей сонной артерии). Перед инъекцией антибиотика фракционно вводят 10—15 мл 0,25 % раствора ли-докаина, 25 000 ЕД трасилола или контрикала, 12,5-25 мг гидрокортизона, 5000—10 000 ЕД гепарина.
Одновременно, как указывалось, назначают общеукрепляющую, ферментную терапию, биологически активные препараты.
При лечении гнилостно-некротической флегмоны, сопровождающейся выделением анаэробных микробов, введение препаратов метронидазо-ла дополняют внутримышечными или подкожными инъекциями смеси сывороток против основных анаэробов (сыворотка вводится в 3 приема по инструкции). Для выведения из организма продуктов распада токсинов необходим строгий контроль за достаточным поступлением в организм жидкости. При болезненном или затрудненном глотании показано введение жидкости до 1 — 1,5 л через прямую кишку в виде капельных клизм
(60—80 капель в минуту). Вводят 0,85 % раствор хлорида натрия, 5—5,5 % раствор глюкозы, 8— 8,5 % раствор тростникового сахара, 2,5 % раствор хлорида кальция.
При распространенных флегмонах у больных с сенсибилизацией к стафилококку, у лиц с аллергическими заболеваниями следует следить за побочными реакциями при назначении лекарственных препаратов: сульфаниламидов, антибиотиков, анальгетиков и др. Число перекрестных аллергических реакций у таких больных увеличивается во много раз. Им назначают антигистаминные препараты, кровезаменители, витамины.
Применение антигенных стимуляторов позволяет повышать иммуногенез и неспецифическую реактивность организма. Коррекция иммуногенеза возможна только при учете функциональных резервов организма и данных действия иммунных препаратов на иммунокомпетентные клетки и фагоцитоз. При компенсированных состояниях систем жизнеобеспечения организма и повышении реакций иммунитета выбирают иммунный препарат — стафилококковый анатоксин, левамизол, Т-активин и др. Лицам с распространенными флегмонами, для которых характерна гиперерги-ческая реакция организма, при особо повышенной сенсибилизации к микробным возбудителям, или с флегмонами, сопровождающимися гиперги-ческой (до анергической) реакцией организма, особенно при некоторых тяжелых общих заболеваниях, антигенные стимуляторы не показаны. Для коррекции иммунитета при особо тяжелом течении флегмон эффективны гормоны надпочечника — преднизон, преднизолон. Введение этих гормонов необходимо сочетать с применением антибиотиков. При гиперергическом течении гнойного процесса назначают общеукрепляющие и стимулирующие препараты, корректоры и стимуляторы фагоцитоза (дибазол, метилурацил, пен-токсил, милайф, лимонник, комплексы витаминов, пищевые добавки).
Программа комплексной терапии перед операцией и после нее обеспечивает активную профилактику срыва процессов компенсации в реактивной и токсической фазе распространенных флегмон и устранение симптомов декомпенсации в терминальной фазе. В таких случаях лечение должно осуществляться в отделениях реанимации при совместных консультациях и наблюдении хирургом-стоматологом, невропатологом, офтальмологом, оториноларингологом и общим хирургом.
Особые трудности представляет лечение больных с распространенными флегмонами в терминальной фазе, в том числе осложненными меди-астинитом, тромбофлебитом и тромбозом сосудов лица и мозга, синусов твердой мозговой оболочки, сепсисом.
Следует уделять особое внимание пациентам с общими заболеваниями (диабет, сердечно-сосудистая недостаточность, геморрагические диатезы, тяжелые аллергические заболевания или реакции). Этим больным с момента поступления в клинику необходимо проводить интенсивную терапию, направленную на регуляцию функции дыхания, кровообращения, обмена, нервной и эндокринной систем.
Эффективно применение по показаниям гемо-сорбции, плазмафереза, лимфосорбции, подключение донорской селезенки. Комплексность лечения и проведение реанимационных мероприятий позволяют добиться выздоровления у тяжелобольных, подчас безнадежных. В комплексном лечении используют физические методы. В начальных стадиях развития воспалительных явлений назначают УФО, УВЧ, излучение гелий-неонового, инфракрасного лазера.
После вскрытия гнойных очагов, чаще после прекращения гноетечения из раны, применяют УФО, УВЧ, ультразвук, флюктуоризацию, электрофорез антибиотиков, ферментов, излучение гелий-неонового, инфракрасного лазера. Физические методы воздействия в послеоперационном периоде сочетают с общим кварцевым облучением и гипербаротерапией от 5 до 10 сеансов.
При обратном развитии воспалительного процесса, особенно при локализации гнойных очагов в области мышц, назначают лечебную физкультуру, которая улучшает кровоснабжение тканей, способствует восстановлению функций и, таким образом, ликвидации процесса.
Больные должны получать полноценное питание. При затрудненном открывании рта и болезненном глотании пищу следует измельчать до кашицеобразного состояния; для введения пищи через поильник ее разбавляют бульоном или молоком. Больной должен получать достаточное количество витаминов, особенно С и группы В.
Достаточное хирургическое вмешательство, хороший отток экссудата из инфекционно-воспали-тельных очагов, целенаправленное местное лекарственное воздействие создают условия для очищения раны или ран. В случае прекращения гноетечения и очищения раны от некротических тканей на 3—5-е сутки при абсцессах или на 5—6-е сутки при флегмонах одной-двух областей лица накладывают первично-отсроченные швы; в сроки от 7—8-го до 10—14-го дня — вторичные швы при распространенных флегмонах лица и шеи. В более поздние сроки вторичные швы накладывают у пациентов с сопутствующими заболеваниями, у старшей возрастной группы — при развитии осложнений околочелюстных флегмон (прогрес-сирование инфекции, восходящее или нисходящее распространение ее, вторичный кортикальный остеомиелит).
Первично-отсроченные или вторичные швы накладывают под местной инфильтрационной анестезией, у отдельных больных с премедикацией. После обычной обработки тканей, удаления избыточных грануляций сближают края раны швами с большими промежутками (0,6—1 см). При наложении первично-отсроченных швов оставляют в ране диализационные отсасывающие трубки или вводят дренажи из перчаточной резины. В зависимости от регресса воспалительных явлений дренажи удаляют на 2—3-й день, диализ и отсасывание экссудата прекращают на 3—4-й день, швы снимают на 7—8-й день. В послеоперационном периоде продолжают по показаниям общеукрепляющее, стимулирующее лечение, иммуномодулирую-щую терапию, применяют физические методы и ЛФК.
Прогноз. При своевременном и правильном лечении флегмон челюстно-лицевой области и шеи прогноз в основном благоприятный. Развитие осложнений — медиастинита, внутричерепных гнойных процессов, сепсиса — ведет к длительной нетрудоспособности, инвалидности и нередко — к летальному исходу.
Профилактика околочелюстных абсцессов и флегмон основывается на санации очагов инфекции в полости рта и повышении реактивности организма и его противоинфекционных защитных реакций.
источник
В чем трудность лечения флегмон и абсцессов? Почему нецелесообразно применять мази на вазелиново-ланолиновой основе? Какие местные препараты соответствуют современным представлениям о лечении флегмон и абсцессов? Несмотря на активное внедрение
В чем трудность лечения флегмон и абсцессов?
Почему нецелесообразно применять мази на вазелиново-ланолиновой основе?
Какие местные препараты соответствуют современным представлениям о лечении флегмон и абсцессов?Несмотря на активное внедрение в клиническую практику новых групп антибиотиков, проблема профилактики и лечения гнойно-септических осложнений в хирургии по-прежнему актуальна. Так, согласно литературным данным, частота гнойно-воспалительных осложнений после грыжесечений достигает 28,3%, после резекций желудка — 28,4%, холецистэктомий — 32%, аппендэктомий — 40,4%, панкреатитов — 50% (Прискарь В. И., 1999).
Летальность при перитоните колеблется от 16 до 80% (Даценко Б. М. с соавт., 1998, Гельфанд Б. М. с соавт., 1999, Камзакова Н. И., 2000).
В структуре внутрибольничных инфекций послеоперационные инфекции составляют 12,2%, а постинъекционные инфекции — 17%. Необходимо отметить, что процент тяжелых последствий внутрибольничных инфекций практически одинаков для хирургических стационаров и амбулаторно-поликлинических учреждений — 15,2% и 15,6% соответственно.
Особую тревогу вызывают случаи запоздалой диагностики осложненного течения абсцессов или флегмон. Так, например, в зависимости от локализации первичного гнойного процесса могут формироваться тяжелые гнойные артриты (после внутрисуставного введения гормональных, обезболивающих препаратов), тромбофлебиты (после внутрисосудистого введения различных лекарственных средств) с последующей генерализацией инфекционного процесса, с формированием гнойных очагов во внутренних органах (в сердце, легких, почках).
Ретроспективный анализ тяжелых абсцессов и флегмон, осложнившихся сепсисом после длительного консервативного или недостаточно активного хирургического вмешательства, показывает, что одной из основных причин возникновения осложнений можно считать недостаточное внимание к ранней диагностике формирующихся абсцессов и флегмон различной локализации, предполагающей использование современных неинвазивных методов исследования (ультразвука, компьютерной томографии), а также инвазивных диагностических методов, и прежде всего диагностической пункции области инфильтрата. Особую тревогу вызывает так называемая выжидательная тактика, когда, выполнив диагностическую пункцию и удалив некоторое количество гноя, хирурги пытаются дренировать гнойную полость с помощью резиновой трубки и назначают какой-либо антибактериальный препарат.
Радикальные оперативные вмешательства на уже сформированном гнойном очаге выполняются слишком поздно, дренирование послеоперационной раны бывает, как правило, неадекватным.
Кроме того, не уделяется должного внимания проблеме асептики и антисептики при оказании помощи пострадавшим, а также при выполнении различных диагностических и лечебных манипуляций как на амбулаторно-поликлиническом, так и стационарном этапах лечения. Использование традиционных антисептиков в данных ситуациях, к сожалению, не предупреждает развитие инфекционного процесса, так как проблема устойчивости микроорганизмов в равной степени актуальна как для группы антибактериальных препаратов, так и для традиционных антисептиков.
К примеру, чувствительность S.aureus, E.coli, B.fragilis к раствору фурациллина составляет менее 3, 1 и 3% соответственно. Массивность контаминации P.aeruginosa в растворе фурациллина может достигать 106 КОЕ/мл. Частота контаминации раствора фурациллина грибами достигает 58%.
В табл. 1 приводится далеко не полный перечень традиционных препаратов, от которых необходимо отказаться полностью и которые, тем не менее, используются как в домашних условиях, так и в медицинских учреждениях.
В данном сообщении приводится анализ результатов лечения 166 больных с постинъекционными флегмонами и абсцессами в специализированном отделении ран и раневой инфекции Института хирургии им. А. В. Вишневского РАМН. Больных, как правило, переводили из других хирургических стационаров ввиду прогрессирующего нарастания клиники интоксикации, с полиорганной недостаточностью, с сепсисом.
Возраст пациентов колебался от 18 до 84 лет. 124 больных были в возрасте от 30 до 60 лет. Длительность лечения на предыдущем этапе от начала формирования гнойного процесса составляла от 12 суток до 1,5 месяцев.
Сопутствующие заболевания: гипертоническая болезнь — 46 больных, остеохондроз тазобедренных суставов — 31 пациент, пояснично-крестцовый радикулит — 27 больных, почечная колика — 16 и другие заболевания — 46.
Гнойно-воспалительные процессы возникали после введения обезболивающих препаратов (анальгина, баралгина), гипотензивных (папаверина с дибазолом, магнезии), гормональных препаратов, кордиамина, масляных растворов витаминов, кокарбоксилазы и др.
Инфекционный процесс в 139 случаях возникал после инъекций, выполненных медицинскими работниками (бригады «скорой помощи», процедурные и хирургические кабинеты поликлиник, стационары). В остальных 27 случаях препараты вводились в домашних условиях не медицинскими работниками. Локализация абсцессов: в подавляющем большинстве случаев — это места внутримышечных инъекций (ягодичные области, реже — предплечья и места паранефральных, паравертебральных блокад).
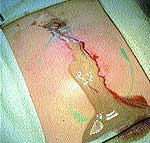
Рис. 1 При первичном обращении больного за помощью по месту жительства в случае появления первых признаков формирования воспалительного процесса в качестве препаратов первой помощи использовались 3%-ный раствор йода («йодная сетка»), компрессы со спиртом, мазью Вишневского, ихтиоловой мазью. Консервативное медикаментозное лечение с подключением физиотерапевтических методов иногда продолжалось до 2–3 недель (рис. 1).
В дальнейшем, уже в условиях хирургических стационаров после хирургического вмешательства, послеоперационные раны тампонировались либо марлевыми тампонами, пропитанными 10%-ным раствором хлорида натрия, мазью Вишневского, раствором фурациллина, либо с дренирующей целью в раны устанавливались перчаточные резинки или резиновые трубки.
Такой метод лечения быстро приводил к распространению гнойного процесса за пределы первичной локализации, нарастанию интоксикации, развитию сепсиса.
Ввиду неэффективности лечения после развития септического состояния больные переводились для дальнейшего лечения в специализированное отделение гнойной хирургии им. А. В. Вишневского.
При поступлении практически все больные сразу помещались в блок интенсивной терапии отделения гнойной хирургии, где они получали необходимую пред- и послеоперационную корригирующую медикаментозную терапию.
В Институте хирургии им. А. В. Вишневского РАМН разработан метод активного хирургического лечения гнойных ран, основанный на следующих принципах:
- хирургическая обработка гнойного очага с тщательным удалением всех девитализированных тканей;
- использование дополнительных методов обработки послеоперационной раны (пульсирующая струя, ультразвуковая кавитация, криовоздействие, вакуумирование и др.);
- дренирование раны с помощью перфорированного силиконового дренажа с последующим длительным промыванием раны растворами антисептиков;
- раннее закрытие послеоперационной раны с помощью первичных, первичных отсроченных, ранних вторичных швов, местными тканями или методом аутодермопластики;
- общая и местная антибактериальная терапия с учетом аэробного и анаэробного компонентов раневого процесса;
- назначение иммунных препаратов по данным лабораторного контроля иммунологических показателей.
Рис. 2 Использование вышеперечисленных дополнительных методов воздействия на раневую поверхность позволяет уменьшить обсемененность раневой поверхности патогенной флорой до уровня ниже «критического» — с 10 7-9 до 10 2-3 микробных тел в 1 г ткани раны.
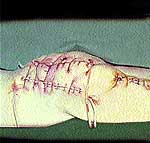
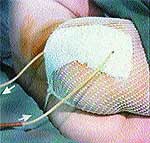
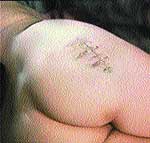
Клинические примеры закрытия ран с помощью швов, дренирования и окончательный результат приведены на рис. 2, 3, 4.
Рис. 3 Во время поступления больного в отделение, а также в процессе лечения (во время перевязок, при повторных хирургических обработках ран, перед окончательным закрытием ран) проводятся бактериологические исследования видового состава ран. Результаты представлены в табл. 2.
Как видно из табл. 2, в подавляющем большинстве случаев из ран была выделена грамположительная микрофлора и в единичных случаях — ассоциация грамположительных и грамотрицательных микроорганизмов. Обращает на себя внимание достаточно большое число случаев выявления в ранах неклостридиальной анаэробной инфекции.
Рис. 4 Все штаммы, выделенные из послеоперационных ран больных, ранее прооперированных в других лечебных учреждениях, были полирезистентны к традиционно используемым антибактериальным препаратам, что указывает на госпитальную принадлежность инфекции.
С учетом видового характера выделяемой из ран микрофлоры и чувствительности ее к антибактериальным препаратам назначались общая и местная антибактериальная терапии.
Наиболее часто (38,5%) использовались полусинтетические пенициллины (карбенициллин, ампиокс, диклоксациллин), в 15,7% случаев — аминогликозиды (гентамицин, тобрамицин, сизомицин, нетилмицин), в 12,5% — фторхинолоны (офлоксацин, пефлоксацин, ципрофлоксан), в 10,3% — цефалоспорины (цефотаксим, цефтазидим, цефтриаксон).
При обнаружении гнойно-воспалительного процесса, вызванного неклостридиальной анаэробной инфекцией (27 больных — 16,3%), как правило, назначалась комбинированная антибактериальная терапия — метронидазол с гентамицином или нетилмицином либо клиндамицин с гентамицином или нетилмицином. В последние годы в подобных ситуациях препаратом выбора считается имипенем, позволяющий активно воздействовать как на аэробный, так и анаэробный компонент микрофлоры ран. При локальном гнойном процессе, в случае выявления чувствительности стафилококков к фузидину, назначение этого препарата в комплексном лечении было также оправданно.
Как уже было сказано, использование раствора фурациллина в настоящее время нецелесообразно ввиду его крайне низкой антимикробной активности. В настоящее время перспективными можно считать растворы диоксидина, мирамистина, фурагина растворимого.
Прежде всего, очень важно следить за чистотой не только самой раны, но и окружающей рану кожи.
При выборе кожных антисептиков, используемых как с профилактической, так и лечебной целью, предпочтение отдается препаратам с универсальным, широким или умеренным спектром действия, активным против смешанной микрофлоры и обладающим микробоцидным или микробостатическим действием.
По-прежнему большой популярностью у медицинских работников пользуются препараты йода. Они обладают почти универсальным спектром активности: подавляют грамположительные бактерии, включая энтерококки и микобактерии, грамотрицательные бактерии, в том числе псевдомонады, ацинетобактерии, клебсиеллы, протей, споры бактерий, грибы, вирусы, включая вирусы гепатита В и С, энтеро- и аденовирусы, а также анаэробные, спорообразующие и аспорогенные бактерии.
1%-ный йодовидон, 1%-ный йодопирон — йодофоры, представляющие собой комплекс поливинилпиролидона с йодом. Различия между этими препаратами связаны со способом их получения, а также разной молекулярной массой поливинилпиролидона. Растворы йодовидона более стабильны при хранении, чем растворы йодопирона, готовящиеся обычно ex tempore. По степени бактерицидного действия эти препараты практически идентичны.
Сульйодопирон представляет собой пенистую жидкость, которая предназначена для мытья грязных инфицированных ран, лечения ран под повязкой, обработки рук хирурга и операционного поля. Сульйодопирон при местном применении оказывает бактерицидное действие.
Бактерицидный эффект при микробной нагрузке 106-107 бактерий на 1 мл среды наступает в течение 1-4 минут, превосходя по этим показателям растворы йодопирона.
1%-ный диоксидин обладает выраженной активностью против большинства аэробных, анаэробных и факультативно анаэробных патогенных бактерий.
К диоксидину чувствительны клинические штаммы бактерий с полирезистентностью к антибиотикам. Препарат используется для промывания и тампонирования гнойных ран, а также может вводиться внутривенно, внутриартериально, интратрахеально через катетер или ингаляционно, внутриплеврально, в брюшную полость через ирригаторы.
Наш 20-летний опыт применения диоксидина в комплексном лечении больных с сепсисом, перитонитом, медиастинитом, с развернутой клиникой интоксикации, прогрессирующей полиорганной недостаточностью не подтверждает мнение некоторых специалистов о высокой токсичности этого препарата. Строгое соблюдение правил введения, разовых, суточных и курсовых доз позволяет избежать таких нежелательных побочных явлений, как тошнота, рвота или судороги.
0,1%-ный фурагин (солафур) — антимикробное средство из группы нитрофуранов. Препарат преимущественно действует на грамположительную микрофлору. Его МПК в 10-20 раз ниже, чем у фурациллина. Используется либо внутривенно при тяжелых формах течения раневой инфекции, при инфекционном процессе в легких, органах мочевыводящих путей, либо местно в виде 0,1%-ного раствора при лечении ран, инфицированных стафилококками, а также для промывания мочевого пузыря.
0,01%-ный мирамистин (миристамидопропилдиметилбензиламмоний хлорид) — новый антисептик из группы катионных ПАВ.
Мирамистин характеризуется широким спектром антимикробных свойств. Препарат губительно действует на грамположительные, грамотрицательные бактерии, грибы, вирусы, простейшие, аэробные и анаэробные, спорообразующие и аспорогенные микроорганизмы в виде монокультур и микробных ассоциаций, включая госпитальные штаммы с полирезистентностью к лекарственным препаратам.
0,01%-ный водный раствор мирамистина с профилактической и лечебной целью используется в хирургии, травматологии и комбустиологии при незначительном количестве гнойного отделяемого в ране. Препаратом орошают поверхность ран и ожогов, рыхло тампонируют раны и свищевые ходы, марлевыми тампонами, смоченными антисептиком, промывают брюшную полость, вводят в плевральную полость и мочевой пузырь.
При обильной гнойной экссудации использование марлевых тампонов с растворами антисептиков для местного лечения ран неоправданно, так как тампоны, помещаемые в рану, быстро высыхают и, следовательно, не обладают необходимой для удаления гноя длительной осмотической активностью. В крайнем случае, рана может заполняться комбинированным тампоном — в центр марлевого тампона помещается силиконовая трубка, через которую 2-3 раза в сутки шприцем в рану вводится антисептик по 10-20 мл. Вместо 10%-ного раствора хлорида натрия для тампонирования послеоперационных ран в настоящее время используются современные мази на водорастворимой основе, высокую клиническую значимость которых можно считать доказанной.
К сожалению, до сих пор в ряде клиник используются мази на жировой основе с антибиотиками: линимент синтомицина, тетрациклиновая, эритромициновая и др. Однако мази на жировой основе с антибиотиками оказывают только кратковременное действие, поскольку вазелин-ланолиновая основа нарушает отток раневого отделяемого, не обеспечивает достаточного высвобождения активного ингредиента из композиции, не способствует проникновению антибиотика в глубь тканей, где находятся микробы, что приводит к переходу острых воспалительных заболеваний в хронические. Ввиду формирования в стационарах высокорезистентных штаммов микроорганизмов практически полностью утратили свою клиническую значимость и ихтиоловая мазь, и мазь Вишневского.
В последние годы в клиническую практику лечения гнойных ран в первой фазе раневого процесса внедрены новые мази — на полиэтиленоксидной основе (комбинации полиэтиленоксидов с молекулярным весом 400 и 1500).
Полиэтиленоксиды являются производными окиси этилена и обладают низкой токсичностью и выраженными осмотическими свойствами. При создании препаратов для лечения гнойных ран чаще всего используются полиэтиленоксид с молекулярным весом 400 (ПЭО-400) и полиэтиленоксид с молекулярным весом 1500 (ПЭО-1500).
В гнойной ране ПЭГ-1500 активно связывает воспалительный экссудат, отдавая его в повязку, с которой жидкость испаряется, а освободившиеся молекулы ПЭГ-1500 вновь присоединяют к себе экссудат, накапливающийся на дне раны.
Более мелкие молекулы (ПЭГ- 400) способны проникать в глубь тканей. Образуя с антибиотиком комплекс, ПЭГ-400 проводит его в ткани раны, где локализуются микробы. Этим он принципиально отличается от мазей на ланолин-вазелиновой основе, которые способны оказывать антимикробное действие только кратковременно и только на поверхности раны.
В состав современных мазей на полиэтиленоксидной основе введены различные антимикробные препараты:
- левомицетин (левосин, обладающий не только антибактериальным и противовоспалительным действием, но и благодаря входящим в него метилурацилу и тримекаину регенерирующим, некролитическим и анальгезирующим эффектами, что существенно облегчает состояние больного);
- диоксидин (5%-ная диоксидиновая мазь, диоксиколь, метилдиоксилин);
- йод с поливинил-пиролидоном (1%-ная йодопироновая мазь, йодметриксид);
- метронидазол + левомицетин (метрокаин);
- нитазол (стрептонитол, нитацид);
- фурациллин (фурагель);
- хинифурил (0,5%-ная мазь хинифурила);
- мафенид ацетат (10%-ная мазь мафенида-ацетата).
Кроме того, в состав мазей введены такие препараты, как тримекаин, имеющий обезболивающий эффект, и метилурацил, обладающий анаболической и антикатаболической активностью, в целях стимуляции процессов клеточной регенерации.
Все мази на основе ПЭО отличаются от традиционных препаратов прежде всего многонаправленностью действия — осмотический эффект наблюдается до 18 часов, что позволяет делать перевязки только один раз в сутки, в то время как при использовании 10%-ного хлорида натрия повторные перевязки необходимо выполнять через каждые 3-4 часа, в противном случае повязка, пропитанная раствором и раневым отделяемым, полностью теряет осмотическую способность.
Еще одно преимущество мазей на полиэтиленоксидной основе — это широкий спектр антимикробной активности.
Причем по эффективности воздействия в силу однотипности мазевой основы все мази практически равноценны. При создании новых мазей особое внимание уделялось их антибактериальной активности. А. В. Вишневский по этому поводу писал: «Мы интересуемся силой, степенью бактерицидных свойств мази, ибо снизить, сбить, уничтожить инфекцию в ране всегда является задачей необходимой и благодарной» (Вишневский А. В., 1937).
Антимикробная активность новых мазей в отношении S.aureus находится на уровне 86-97,3%, Е. coil — 71-97%, Р.aeruginosa — 64-90,8%, Proteus spp. — 76-100%.
Для подавления в ранах грамотрицательных бактерий, в частности синегнойной палочки, широко применяется 10%-ная мазь мафенида-ацетата на гидрофильной основе.
Несмотря на интенсивное применение мазей, содержащих левомицетин или диоксидин, их высокая антимикробная активность сохраняется на протяжении более 20 лет, что указывает на слабый процесс нарастания резистентности госпитальных штаммов.
С внедрением полиэтиленгликолевой основы в технологию создания новых лекарственных форм появилась возможность создать мази с нитрофурановыми соединениями. На их основе выпускаются две мази: 0,5%-ная мазь хинифурила, а также фурагель, где в качестве основы использован сополимер акриловой кислоты (СОКАП) и ПЭГ-400.
Новые отечественные мази, содержащие нитрофурановые соединения, показывают высокую клиническую и бактериологическую эффективность. Так, фурагель более активен (94%) при наличии в ране S.aureus и менее активен (79%) при Р.aeruginosa. Maзь хинифурила одинаково высоко активна при наличии в ране грамположительной и грамотрицательной микрофлоры (87-88%). Оба препарата хорошо переносятся даже в случае их длительного использования при лечении трофических язв. Применение сополимера акриловой кислоты с полиэтиленгликолем в различных весовых соотношениях в качестве мазевой основы позволяет регулировать осмотическую активность мази как в сторону ее повышения, так и снижения, что очень важно при переходе раневого процесса во вторую фазу и необходимости продолжения лечения раны под повязкой.
Клиническая эффективность 1%-ной йодопироновой мази и многокомпонентной йодсодержащей мази (йодметриксилена) в качестве лечебного средства составляет 92,6-93,4%. Бактериологическая активность этих двух препаратов была одинаково высокой (91,8-92,6%) в отношении всех основных возбудителей острых гнойных процессов мягких тканей. Побочные эффекты (клинически значимые) наблюдались в 0,7% случаев и клинически незначимые — в 2,3% случаев. Следует особо подчеркнуть высокую эффективность этих препаратов при лечении ран с грибковым поражением, что часто наблюдается у больных ослабленных, с обширными ожоговыми ранами, трофическими язвами, пролежнями.
В настоящее время в клиническую практику внедрены только зарубежные йодсодержащие мази (повидон-йод и бетадин), хотя отечественный аналог был разработан более десяти лет назад.
Установлено, что уровень обсемененности ран аэробной микрофлорой при лечении мазями на ПЭГ-основе опускается «ниже критического» к 3-5-м суткам. Появление грануляций в среднем достигается к 4-м суткам, начало эпителизации — к 5-м.
Широкий спектр антимикробной активности мазей на полиэтиленгликолевой основе, их высокая и длительная осмотическая активность позволяют более чем в 80% случаев в течение 4-5 суток купировать острый гнойный процесс и закончить лечение неосложненных гнойных ран мягких тканей наложением первично-отсроченных швов, тогда как при использовании гипертонического раствора хлорида натрия в 90% случаев только в конце 2-3-й недели лечения под прикрытием системной антибактериальной терапии удается закрыть рану путем наложения вторичных швов.
Для лечения неспорогенной анаэробной инфекции наряду с диоксидином перспективные возможности открылись после изучения препарата нитазола, показавшего высокое антибактериальное действие на стафилококки, стрептококки, кишечную палочку, аэробные спорообразующие бактерии, патогенные анаэробные микроорганизмы как клостридиальные, так и неклостридиальные в виде монокультур и микробных ассоциаций. По спектру антибактериального действия нитазол имеет преимущества перед метронидазолом, к которому нечувствительны стафилококки, кишечная палочка, стрептококки. Нитазол оказывает противовоспалительное действие, являясь нестероидным противовоспалительным средством.
На основе нитазола были созданы пенообразующий аэрозоль «Нитазол» и две многокомпонентные мази «Стрептонитол» и «Нитацид». По антимикробной активности стрептонитол и нитацид значительно превосходят зарубежный препарат «Клион» (Венгрия), в состав которого входит метронидазол. Осмотическая активность стрептонитола гораздо ниже, чем у нитацида, что обусловлено введением в его состав вазелинового масла с водой. И стрептонитол, и нитацид, созданные для лечения ран с неклостридиальной анаэробной инфекцией, обладают равнозначным широким спектром антимикробной активности как в отношении грамположительной, так и грамотрицательной микрофлоры (84,2-88,5%). Обращает на себя внимание высокая активность этих препаратов при наличии в ране Р.aeruginosa (86,3-91,1%). Обе позиции показывают хорошую клиническую эффективность при наличии в ране анаэробной инфекции (88-89%).
Различие в осмотической активности позволяет использовать эти препараты ступенчато — сначала нитацид (с высокой осмотической активностью), затем стрептонитол.
Специалисты, занимающиеся лечением гнойных ран, хорошо знают, что бывают ситуации, когда одного скальпеля для полного удаления некротических тканей недостаточно: необходимы протеолитические препараты.
В настоящее время доказана высокая клиническая эффективность комплексного ферментного препарата «Протогентин», содержащего фермент природного происхождения «протеаза С» с протеолитическим действием, антибиотики (гентамицин и эритромицин), консерванты.
Мазевая основа препарата состоит из полиэтиленоксида с вазелиновым маслом. Умеренная осмотическая активность обеспечивает удаление из раны гноя.
Протогентин, наиболее активный в отношении P.aeruginosa и Е.coli, подавляет рост 83,4-90,4% штаммов.
Антимикробные компоненты мази «Протогентин» хорошо проникают под струп раны, вследствие чего в тканях раны создаются концентрации, намного превышающие МПК.
Достаточная осмотическая активность, широкий спектр антимикробной активности, хорошие фармакокинетические свойства протогентина способствуют сокращению сроков некролизиса. Мазевая основа не повреждает грануляционную ткань, что позволяет использовать этот препарат в течение длительного времени, пока требуется ферментативная очистка раневой поверхности.
После очищения раны от гнойно-некротического содержимого и достижения ее бактериологической санации наступает вторая фаза раневого процесса. Этот период характеризуется появлением в ране островков грануляционной ткани, которая, развиваясь, покрывает раневую поверхность полностью. Здоровая грануляционная ткань всегда яркая, сочная, легко кровоточит. При малейшем ухудшении процессов биосинтеза в ране изменяется внешний вид грануляций: они теряют яркую окраску, становятся мелкими, покрываются слизистым налетом. Одной из причин такого осложнения считается суперинфекция. Всякое замедление развития грануляций ведет к задержке и остановке процесса эпителизации.
Большое значение для скорейшего заживления ран во второй фазе имеет способность препаратов, используемых для местного лечения, оказывать бактерицидное действие в целях предупреждения вторичной инфекции, защитить грануляционную ткань от механических повреждений, а также оказывать умеренное влагопоглощающее действие и стимулировать рост грануляций.
Оптимальный вариант — сочетание этих факторов в одном препарате. К таким препаратам относятся современные комбинированные мази на регулируемой осмотической основе: метилдиоксилин, стрептонитол, а также пенные аэрозоли «Cульйодовизоль», «Гипозоль-АН», раневые покрытия на основе натриево-кальциевой соли альгиновой кислоты, масла, аэрозоли, гидроколлоидные покрытия (табл. 3).
Мазь «Метилдиоксилин» — многокомпонентная мазь, содержит диоксидин, метилурацил и гидрофобную эмульсионную основу с наличием касторового масла. Композиция винилина с эмульгатором и ПЭГ-400 в качестве основы мази позволила снизить осмотическую активность этого препарата до такого уровня, чтобы новая мазь не пересушивала молодую грануляционную ткань.
Мазь «Стрептонитол» содержит антибактериальные вещества стрептоцид и нитазол на гидрофильной эмульсионной основе, которая оказывает слабое осмотическое действие, удаляя избыток влаги, и одновременно защищает грануляционную ткань от механических повреждений. Препарат показан для лечения во второй фазе воспаления ранее инфицированных анаэробной, грамположительной и грамотрицательной микрофлорой ран при наличии ярких сочных грануляций.
На переходном этапе первой фазы раневого процесса во вторую высокую клиническую эффективность показывают современные пено- и пленкообразующие аэрозоли. Пенные препараты в аэрозольной упаковке перспективны для профилактики и лечения гнойных осложнений. Это обусловлено тем, что пены создают барьер для инфицирования ран, они не обладают «парниковым эффектом»; небольшим количеством препарата в составе пены можно покрывать большие по площади раневые поверхности и заполнять объемные раневые каналы и «карманы». Преимуществом аэрозольной формы является быстрота обработки, что важно при массовом поступлении пострадавших. Аппликации пен атравматичны.
В настоящее время создан ряд пенных препаратов:
- диоксизоль (диоксидин);
- сульйодовизоль (йодовидон);
- сульйодопирон (йодопирон);
- нитазол (нитазол);
- цимезоль (циминаль + тримекаин + порошок окисленной целлюлозы);
- гипозоль-АН (нитазол + аекол + метилурацил).
В состав современных пенных препаратов обязательно входит какое-нибудь антимикробное средство, действующее на аэробную или на анаэробную микрофлору, включая неклостридиальную (бактероиды, пептококки, пептострептококки). Чаще всего используются диоксидин, йодовидон, циминаль и нитазол. Исследования антибактериальных свойств этих препаратов на моделях гнойных ран, вызванных анаэробной инфекцией, показывают выраженный терапевтический эффект, заключающийся в снижении высеваемости бактерий из ран к 3-5-му дню лечения до 10 1-2 микробов на 1 г ткани, уменьшении отечности и гиперемии, прекращении гнойной экссудации и в дальнейшем в заживлении ран.
Цимезоль кроме антисептика циминаля содержит анестетик тримекаин и гемостатик — порошок окисленной целлюлозы. Антисептическое действие циминаля усиливается благодаря сочетанию с димексидом и 1,2-пропилен-гликолем, которые обеспечивают проникновение циминаля в зоны некрозов и умеренный осмотический эффект.
Диоксизоль приготовлен на высокоосмотичной основе, а дегидратирующее действие диоксипласта сведено до минимума. Это определяет их применение соответственно в первой и во второй фазах раневого процесса при отсутствии в ранах большого количества гнойного отделяемого. Изучение антимикробной активности нового аэрозоля-диоксизоля показало преимущество этого препарата в случае выявления в ранах грамотрицательной микрофлоры. Диоксизоль подавляет Ps.aeruginosa в 92,5%.
Сульйодовизоль — пенообразующий аэрозольный препарат, расширяет возможности лечения ран йодовидоном в хирургии. Препарат показан для лечения ран во второй фазе раневого процесса, ранее инфицированных грамположительной и грамотрицательной аэробной микрофлорой.
Широкие клинические исследования показали необходимость использования пенообразующих аэрозолей только при отсутствии выраженного гнойно-воспалительного процесса на этапах подготовки раны к ее закрытию швами или методом пластики.
В настоящее время для лечения ран широко используются различные масла, в том числе и растительного происхождения (масло облепихи, масло шиповника, просяное масло — милиацил). Первые публикации о применении с этой целью различных масел относятся к эпохе Возрождения (Джованни де Виго, 1460-1520, Ambroslse Pare, 1510-1590).
Сравнительные экспериментальные исследования показали, что просяное масло прежде всего обладает более широким антимикробным спектром действия по сравнению с маслом шиповника или облепихи.
Просяное масло (милиацил) имеет высокое кислотное число (151,5-178,3), обусловленное большим содержанием свободных, ненасыщенных жирных кислот (олеиновой, линолевой, линоленовой). Этим объясняются стерильность препарата и его достаточный антимикробный эффект. Кроме того, входящее в состав просяного масла сложное стероидное соединение — пентациклический тритерпеноид — милиацин — обладает анаболическим действием и является стабилизатором мембран. Стабилизируя лизосомальные мембраны, милиацин предохраняет их от действия мембраноповреждающих факторов, например токсинов. В связи с этим уменьшается активность катепсинов, кислых РНК-азы и ДНК-азы, что приводит к уменьшению экссудации ткани, гипоксии, деполяризации РНК и ДНК.
Широкие возможности в местном медикаментозном лечении ран открылись с появлением различных раневых покрытий, обладающих такими ценными качествами, как антимикробная активность, способность надежно предупреждать реинфицирование раневой поверхности, способность обеспечивать локальный гемостаз, ускорять образование грануляций, эпидермиса и активно поглощать раневой экссудат. Кроме того, современные раневые покрытия активно стимулируют образование грануляций и эпидермиса. При смене повязок эти препараты не вызывают болезненных ощущений. При длительном нахождении раневых покрытий на ране не возникает неприятного запаха.
В целях стимуляции процессов регенерации в ране наиболее широко используются перевязочные средства на основе производных белков и полисахаридов. С учетом специфического воздействия коллагеновых соединений на репаративные процессы в ране, а также данных по эффективности полисахаридных соединений с позиций создания оптимальных условий для формирования грануляционной ткани и миграции эпителиальных клеток разработаны раневые покрытия на основе белково-полисахаридных комплексов и их композиций с лекарственными препаратами. В качестве полисахаридных соединений использованы растительный полисахарид (альгинат натрия) и полисахарид животного происхождения (хитозан).
Биологически активные стимулирующие раневые покрытия с антимикробным и местно-анестезирующим действием выпускаются в четырех вариантах:
- дигиспон А (коллаген + гелевин + диоксидин + анилокаин);
- альгикол-ФА (коллаген + альгинат + фурагин + анилокаин);
- коллахит-ФА (коллаген + хитозан + фурагин + анилокаин);
- анишиспон (коллаген + шиконин).
Перечисленные раневые покрытия благотворно влияют на течение регенераторных процессов в ране. Коллаген-альгинатные покрытия стимулируют рост грануляционной ткани, а коллаген-хитозановые — рост эпителиальных клеток.
В последние годы наибольшее распространение получили препараты на основе альгиновой кислоты и коллагена.
На основе смешанного натриево-кальциевой альгиновой кислоты созданы полифункциональные влагопоглощающие препараты для местного лечения ран во второй фазе (альгипор, альгимаф).
Стимулирующие раневые покрытия хорошо моделируются на различных участках тела, обеспечивают нормальный парообмен в ране, сорбируют избыток раневого экссудата, обладают пролонгированным антимикробным и обезболивающим действием, создают влажную среду, оптимальную для миграции эпителиальных клеток. Выход лекарственных средств из стимулирующих раневых покрытий осуществляется в течение 48-72 часов в зависимости от количества раневого экссудата в ране.
Все современные раневые покрытия обладают высокой антимикробной активностью за счет введенных в них противомикробных компонентов (сизомицин — в сипролине, мафенид-ацетат — в альгимафе, фурагин — в альгиколе АКФ и коллахите ФА).
Сравнительная оценка антибактериальной активности этих препаратов показывает, что элиминация S.aureus, Proteus spp. из ран быстрее происходит при использовании альгимафа и сипролина.
В последние годы за рубежом для лечения больных с длительно незаживающими ранами, трофическими язвами, пролежнями нашли применение гидроколлоидные лекарственные средства, в частности содержащие пектин — дуодерм (США), варигесив (США).
В НПО «Биотехнология» (Россия) совместно с Институтом хирургии им. А. В. Вишневского РАМН разработаны две гидроколлоидные лекарственные формы нового поколения на основе пектина: галактон — жидкий гидроколлоид, предназначенный для лечения длительно незаживающих глубоких ран мягких тканей с умеренным количеством гнойного отделяемого; галагран — сухой гидроколлоид (порошок) для лечения поверхностных ран мягких тканей, пролежней, трофических язв.
За счет введенного в состав диоксидина гидроколлоиды показывают лучшую активность по сравнению с другими препаратами в отношении P.auruginosa.
При сравнении гидроколлоидов (галаграна и галактона) с сорбентами (дежизаном и дебризаном) выявляется более широкий спектр положительных свойств гидроколлоидов. Прежде всего, гидроколлоиды стимулируют процессы регенерации и эпителизации, предупреждают реинфицирование раневой поверхности, поддерживают влажную среду под повязкой. Показатель сорбционной способности галаграна невысок: по воде — 3,56 г/г, по крови — 2,57 г/г; при этом верхний слой галаграна не смачивается модельными жидкостями на протяжении всего срока наблюдения (одни сутки).
Основное поглощение воды идет в течение 5 часов, далее наблюдается снижение количества сорбированной жидкости за счет подсыхания верхнего слоя и образования корочки, затрудняющей процесс дренирования. Частицы галаграна в контактном слое набухают, превращаясь в гелеобразную массу, которая равномерно растекается по ране.
По данным цитологического исследования, в первые трое суток использования галаграна в раневых отпечатках выявляется тенденция интенсивного формирования грануляционной ткани.
Учитывая природу биополимера, гидроколлоиды (галагран и галактон) целесообразно применять на стадии развития в ране репаративных процессов.
Высокоэффективным препаратом для лечения длительно незаживающих ран, трофических язв, остеомиелита, диабетической стопы является препарат гентацикол — пролонгированная форма гентамицина на биодеградируемой (коллагеновой) основе.
Содержание антибиотика в биоптатах ран, получаемых от больных различных клинических групп, зависит от количества раневого отделяемого и скорости рассасывания коллагеновой основы.
Длительные и высокие концентрации гентамицина обнаруживаются при использовании гентацикола в лечении остеомиелита или в случаях окончательного закрытия швами остеомиелитической полости.
Гентацикол создает высокие концентрации гентамицина в тканях раны на протяжении 2 недель, причем эти концентрации намного превышают МПК основных возбудителей хирургической инфекции.
Биодеградируемая коллагеновая губка с гентамицином способствует купированию инфекционного процесса, активизирует пролиферацию всех клеточных элементов грануляционной ткани, усиливает коллагеногенез. Препарат может использоваться в ургентной хирургии в качестве местного гемостатика. Использование гентацикола в комплексном лечении различных ран позволяет сократить показания к проведению общей антибактериальной терапии с 16,6 до 5,5%; при этом в 98,2% случаев ранние реконструктивно-восстановительные кожно-пластические операции оказываются успешными.
источник