О взятии, хранении и транспортировке материала для исследования на ВИЧ-инфекцию и СПИД – индикаторные заболевания
Взятие, доставку и оформление материалов для проведения лабораторных исследований методом ИФА на ВИЧ-инфекцию и СПИД — индикаторные заболевания, для проведения лабораторных исследований методом ПЦР на ВИЧ — инфекцию, вирусные гепатиты В и С, а также для иммунологических исследований в КДЛ ГБУЗ РЦПБ СПИД и ИЗ производить строго в соответствии с правилами (приложение 1, 2, 3).
Наиболее частыми нарушениями указанных правил являются следующие:
1) при оформлении сопроводительной документации не указывается наименование диагностической тест-системы, ее серия, срок годности
2) не полностью указываются паспортные данные обследуемых, а также дата и место взятия материала
3) зачастую в лабораторию ГБУЗ РЦПБ СПИД и ИЗ доставляется материал, уже непригодный для исследования: сыворотки, хранившиеся дольше установленного срока хранения (для разных методов исследования сроки хранения составляют от 3 до 48 часов); проросшие, гемолизированные сыворотки, в недостаточном для исследования количестве (в зависимости от метода минимально необходимый объем материала составляет от 2 до 5 мл);
4) номера, проставленные на флаконах, не соответствуют указанным в направлении; количество проб крови не соответствует количеству, указанному в направлении;
5) неправильно производится взятие материала, в пробах крови, доставляемых для исследований методом ПЦР и для иммунологические исследований, обнаруживаются сгустки,
6) при заборе материала не всегда медицинский персонал ЛПУ обращает внимание на сроки годности пробирок.
Правила взятия и доставки крови для проведения лабораторных исследований методом ИФА на ВИЧ-инфекцию и СПИД-индикаторные заболевания.
Взятие крови производится из локтевой вены в чистую сухую пробирку в количестве 3-5 мл. У новорожденных можно брать пуповинную кровь с указанием об этом в направлении. Полученный материал не рекомендуется хранить более 12 часов при комнатной температуре и более 1 суток в холодильнике при +4-8 0С. Наступающий гемолиз может повлиять на результаты анализа. В случае невозможности доставки материала в течение суток следует сразу после взятия крови отобрать из нее сыворотку. Сыворотка отделяется центрифугированием. Отделенная сыворотка переносится в чистую (лучше стерильную) пробирку, флакон или пластиковый контейнер, и в таком виде она может храниться до 7 дней при температуре +4-8 0С. На пробирке следует указать порядковый номер, фамилию и инициалы пациента, в строгом соответствии с направлением. Для транспортировки в КДЛ диагностики ВИЧ штативы с пробирками помещают в термоконтейнер, легко подвергающийся дезинфекции. Полученный материал в КДЛ диагностики ВИЧ доставляет медицинский персонал, прошедший специальный инструктаж в установленном порядке.
Обменный журнал и направление оформляются строго по форме №264/у-88 разборчивым почерком, с четким указанием на какие виды исследований направляется материал; зачеркивать, вносить в направление изменения, поправки категорически запрещено! Обменный журнал и направление помещают в полиэтиленовый пакет и доставляют вместе с образцами крови. При доставке сыворотки по запросу ГБУЗ РЦПБ СПИД и ИЗ в сопроводительных документах необходимо выделять такие образцы пометкой «ПОВТОР», при невозможности взятия второй порции сообщить письменно (!).
Утв. МЗ СССР от 05.09.1988 г. №690
Направление №__________________
на исследование образца крови в ИФА на ВИЧ-инфекцию
В_________________________________________________________
(наименование учреждения)
Должность лица, направляющего материал___________________________________
Дата «________» _________________________________200__ года.
Взятие материала для исследования производить только при предъявлении пациентами паспорта или иного документа, удостоверяющего его личность (кроме анонимного обследования).
В графе «домашний адрес» — указать адрес прописки и проживания отдельно. Для иностранцев указывать: адрес в РФ, а также в место работы или учебы и по линии какого министерства прибыл. При несоответствии адреса прописки и адреса проживания в направлении указывать оба адреса, при возможности направления оформлять на компьютере.
В графе «код контингента» — указать код, который относится к обследуемому лицу, в соответствии с формой №4 «Сведения о результатах исследований крови на антитела к ВИЧ», утвержденной постановлением Госкомстата России от 05 мая 1999г. №30.
Коды контингентов
Наименование кода
Доноры (крови, биологических жидкостей, органов и тканей)
Медицинский персонал, работающий с ВИЧ — инфицированными лицами и инфицированным материалом
Больные заболеваниями, передающимися половым путем
Лица, находящиеся в местах лишения свободы
Обследованные по клиническим показаниям
Беременные (доноры плацентарной и абортной крови)
Обследованные при эпидемиологическом расследовании
Для лабораторий диагностики ВИЧ-инфекции в обменном журнале и направлении обязательно дополнительно указываются результаты исследования (ОП сыворотки, ОП критическое), а также дата постановки, название, серия, срок годности используемой тест-системы.
Правила взятия, хранения и доставки материала для проведения исследований методом полимеразной цепной реакции (ПЦР).
Для проведения анализа ПЦР на обнаружение ДНК ВИЧ (качественный анализ!) используется цельная свежая кровь, взятая в количестве не менее 3 мл в одноразовую пробирку типа Vacuette ® с маркировкой «ЭДТА-К3» (с сиреневой крышкой) . Крышку пробирки не открывать! Пробирку с кровью сразу после забора материала несколько раз переворачивают для перемешивания с консервантом(!). Хранить пробирки с кровью можно не более 24 часов при +4 °С. Обеспечить доставку материала в клинико-диагностическую лабораторию ГБУЗ РЦПБ со СПИДом и ИЗ в течение 30 часов с момента взятия. В контейнер для доставки материала вложить хладоэлемент.
Для проведения ПЦР для определения уровня РНК ВИЧ (количественный анализ – вирусная нагрузка!) используется плазма крови. Взятие крови проводится утром натощак в пробирку типа Vacuette ® с маркировкой «ЭДТА-К3» (с сиреневой крышкой), в количестве не менее 5 мл.Крышку пробирки не открывать! П робирку с кровью сразу после забора материала несколько раз переворачивают для перемешивания с консервантом. Хранить взятый материал при температуре 2-8 0С не более 6 часов. Обеспечить доставку материала в клинико-диагностическую лабораторию ГБУЗ РЦПБ со СПИДом и ИЗ в течение 4 часов с момента взятия. В контейнер для доставки материала вложить хладоэлемент.
Для проведения ПЦР на обнаружение РНК HCV (вирусный гепатит С) (качественный анализ !), используется плазма крови. Взятие крови проводится утром натощак в пробирку типа Vacuette ® с маркировкой «ЭДТА-К3» (с сиреневой крышкой), в количестве не менее 5 мл. Крышку пробирки не открывать! П робирку с кровью сразу после забора материала несколько раз переворачивают для перемешивания с консервантом. Хранить взятый материал при температуре 2-8 0С не более 3 часов. Обеспечить доставку материала в клинико-диагностическую лабораторию ГБУЗ РЦПБ со СПИДом и ИЗ в течение 6 часов с момента взятия. В контейнер для доставки материала вложить хладоэлемент.
Для проведения ПЦР для определения РНК HCV (количественный анализ – вирусная нагрузка гепатита С !), используется плазма крови. Взятие крови проводится утром натощак в пробирку типа Vacuette ® с маркировкой «ЭДТА-К3» (с сиреневой крышкой), в количестве не менее 5 мл. Крышку пробирки не открывать! П робирку с кровью сразу после забора материала несколько раз переворачивают для перемешивания с консервантом. Хранить взятый материал при температуре 2-8 0С не более 3 часов. Обеспечить доставку материала в клинико-диагностическую лабораторию ГБУЗ РЦПБ со СПИДом и ИЗ в течение 6 часов с момента взятия. В контейнер для доставки материала вложить хладоэлемент.
Для проведения ПЦР для определения генотипа HС V , используется плазма крови. Взятие крови проводится утром натощак в пробирку типа Vacuette ® с маркировкой «ЭДТА-К3» (с сиреневой крышкой), в количестве не менее 5 мл. Крышку пробирки не открывать! П робирку с кровью сразу после забора материала несколько раз переворачивают для перемешивания с консервантом. Хранить взятый материал при температуре 2-8 0С не более 3 часов. Обеспечить доставку материала в клинико-диагностическую лабораторию ГБУЗ РЦПБ со СПИДом и ИЗ в течение 6 часов с момента взятия. В контейнер для доставки материала вложить хладоэлемент.
Для проведения ПЦР на обнаружение ДНК HBV (вирусный гепатит В) (качественный анализ !), используется плазма крови. Взятие крови проводится утром натощак в пробирку типа Vacuette ® с маркировкой «ЭДТА-К3» (с сиреневой крышкой), в количестве не менее 5 мл.Крышку пробирки не открывать! П робирку с кровью сразу после забора материала несколько раз переворачивают для перемешивания с консервантом. Хранить взятый материал при температуре 2-8 0С не более 3 часов. Обеспечить доставку материала в клинико-диагностическую лабораторию ГБУЗ РЦПБ со СПИДом и ИЗ в течение 6 часов с момента взятия. В контейнер для доставки материала вложить хладоэлемент.
Для проведения ПЦР для определения ДНК HBV (количественный анализ — вирусная нагрузка !) и РНК HCV (количественный анализ – вирусная нагрузка !), используется плазма крови. Взятие крови проводится утром натощак в пробирку типа Vacuette ® с маркировкой «ЭДТА-К3» (с сиреневой крышкой), в количестве не менее 5 мл. Крышку пробирки не открывать! П робирку с кровью сразу после забора материала несколько раз переворачивают для перемешивания с консервантом. Хранить взятый материал при температуре 2-8 0С не более 3 часов. Обеспечить доставку материала в клинико-диагностическую лабораторию ГБУЗ РЦПБ со СПИДом и ИЗ в течение 6 часов с момента взятия. В контейнер для доставки материала вложить хладоэлемент.
В направлении должны быть четко указаны: учреждение, направившее материал, Ф.И.О. (полностью), год рождения, код контингента, домашний адрес, дата, точное время и место взятия материала, фамилия и подпись ответственного лица с указанием номера контактного телефона.
Правила взятия и доставки материала для проведения иммунологических исследований.
Взятие крови для проведения иммунологических исследований методом проточной цитометрии ( CD 4, CD 8, CD 4/ CD 8) производится натощак из локтевой вены в пробирку типа Vacuette ® с маркировкой «ЭДТА-К3» (с сиреневой крышкой), в количестве не менее 3 мл.Крышку пробирки не открывать! П робирку с кровью сразу после забора материала несколько раз переворачивают для перемешивания с консервантом. Хранить взятый материал при температуре 15-25 0С (взятый материал не охлаждать!) не более 24 часов. Обеспечить доставку материала в клинико-диагностическую лабораторию ГБУЗ РЦПБ со СПИДом и ИЗ в течение 30 часов с момента взятия. В контейнер для доставки материала хладоэлемент не класть!
Материал должен быть доставлен в лабораторию сразу после взятия. Недопустимо замораживание биологического материала. Флаконы должны быть четко промаркированы с указанием фамилии пациента, даты и времени взятия. Маркировка флаконов должна строго соответствовать данным, указанным в направлении.
В направлении должны быть четко указаны: учреждение, направившее материал, Ф.И.О. (полностью), год рождения, код контингента, домашний адрес, дата, время и место взятия материала, фамилия и подпись ответственного лица с указанием номера контактного телефона.
источник
Диагностика вирусных гепатитов: список лабораторных анализов, особенности проведения и расшифровка результатов
Эпидемиология, диагностика и профилактика вирусных гепатитов являются важными вопросами в практической медицине. Ежегодно этими инфекциями болеют десятки миллионов людей. Согласно данным ВОЗ, в настоящее время насчитывается не менее 2 млрд пациентов, инфицированных только вирусом гепатита В. В России сохраняется высокий уровень заболеваемости и увеличивающаяся частота неблагоприятных исходов (переход болезни в хроническую форму и летальный исход), что определяет высокую значимость изучения клиники, диагностики и лечения вирусных гепатитов практикующими врачами и студентами медицинских вузов.
От момента инфицирования до появления первых симптомов болезни проходит от двух — четырех недель при гепатите А до двух — четырех (или даже шести) месяцев при гепатите В. В течение этого периода вирус размножается и адаптируется в организме, а затем начинает проявлять себя. До того как кожа и слизистые приобретают характерный желтый оттенок, моча темнеет, а каловые массы, лишаясь желчи, становятся бесцветными, гепатит напоминает обычный грипп. У пациента повышается температура, возникает головная боль, ломота в теле, общее недомогание. При гепатитах В и С температура может не повышаться, но вирус проявляется болью в суставах, иногда появляются высыпания. Начальные симптомы гепатита С могут ограничиться снижением аппетита и слабостью. При бессимптомном течении диагностика вирусных гепатитов затруднительна.
Через несколько дней клиническая картина меняется. Появляются боли в подреберье справа, тошнота и рвота, пропадает аппетит, темнеет моча, обесцвечиваются каловые массы, медики фиксируют увеличение в размерах печени, иногда — селезенки. На этом этапе в крови обнаруживаются характерные изменения и становится возможной ранняя диагностика вирусных гепатитов: увеличивается билирубин, появляются специфические маркеры вирусов, печеночные пробы увеличиваются в восемь — десять раз. После появления желтухи общее состояние больного улучшается, но это не происходит у хронических наркоманов и алкоголиков, независимо от типа вируса, вызвавшего заболевание, а также при гепатите С. У остальных больных в течение нескольких недель происходит развитие симптомов в обратную сторону.
Клиническое течение может быть легкой, среднетяжелой и тяжелой степени. Фульминантная форма гепатита — самая тяжелая разновидность, при которой стремительно развивается некроз печени и обычно заканчивается летальным исходом. Но большую опасность представляет хроническое течение болезни, что характерно для гепатитов В, С и D. Характерными симптомами являются повышенная утомляемость, снижение работоспособности, невозможность выполнять физические нагрузки прежней интенсивности. Расстройство стула, боли в животе, мышцах и суставах, тошнота могут быть вызваны как основным заболеванием, так и сопутствующими. Потемнение мочи, сосудистые звездочки, кровоточивость, увеличение селезенки и печени, желтуха, похудение обнаруживается уже на серьезных стадиях, когда диагностика вирусных гепатитов не представляет сложности.
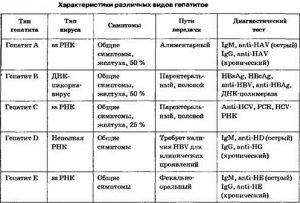
Основными методами диагностики хронического вирусного гепатита или острой формы болезни являются лабораторные исследования: определение маркеров гепатита, характера изменения биохимических показателей крови. Проявляются гепатиты А, В, D и Е относительно одинаковыми симптомами (боль в области правого подреберья и в желудке, нарастающая слабость, диарея, тошнота и рвота, пожелтение кожи и белков глаз, увеличение печени). Гепатиты G и С долгие годы могут проявляться только непреходящей усталостью. При диагностике обязателен ПЦР-анализ на выявление ферментов генетической информации вируса, биохимический анализ крови, иммунологическое исследование, определяющее наличие антител к вирусу, определение уровня ферментов и билирубина.
Вызвать заболевание могут не только вирусы, но токсины растительного или синтетического происхождения. Различные яды и отравляющие вещества, содержащиеся в растениях и грибах, способствуют гибели клеток печени. Диагностика проводится путем выявления уровня протромбина, ферментов, альбумина и билирубина. Лучевой гепатит является одним из проявлений лучевой болезни, возникает из-за радиационного воздействия. В клинической практике заболевание встречается редко, потому что пациент, чтобы попасть в зону риска, должен в течение 3-4 месяцев получать высокие дозы радиации (более 400 рад). Основной метод диагностики — биохимия крови и анализ на билирубин.
Редкой формой гепатита является аутоиммунный. Наука до сих пор не объясняет причины возникновения этого заболевания. При аутоиммунном гепатите организм дает сбой, собственные клетки начинают атаковать печень. Данная форма часто сопровождается другие аутоиммунные заболевания, но в редких случаях может проявляться и самостоятельно. Лабораторная диагностика базируется на исследовании уровня гамма-глобулинов и антител (lgG, АсТ и АлТ). Болезнь можно подозревать, если уровень IgG превышает нормальные показатели в два раза и более.
Вирусные гепатиты распространены гораздо шире, чем другие типы заболеваний, поэтому стоит остановиться на лабораторной диагностике более подробно. Анализ крови может дать максимум информации о течении заболевания. Инструментальные методы, например, МРТ, УЗИ или КТ, малоэффективны. Такие процедуры позволяют оценить состояние и структуру печени, но не дадут информации о том, каким именно гепатитом заражен организм, как давно это произошло. Анализ назначается при подозрении на инфицирование вирусным гепатитом, при наличии симптомов и бессимптомном течении, для контроля иммунитета после вакцинации. Регулярно сдавать кровь для скринингового исследования рекомендуется лицам с повышенным риском инфицирования: работникам здравоохранения, детям инфицированных родителей, людям, не прошедшим вакцинацию, беременным женщинам, лицам с иммунодефицитными состояниями.
Лабораторная диагностика вирусных гепатитов предполагает забор венозной крови с внутренней поверхности локтевого сгиба. Для получения достоверных результатов пациенту необходимо определенным образом подготовиться к исследованию. Правила для всех анализов крови стандартны. За сутки до забора биологического материала из рациона следует исключить жирную пищу, употребление алкоголя, наркотиков и лекарств (только после консультации врача). За 30 минут до исследования исключить курение, физические нагрузки и стрессы. Кровь сдается натощак (после крайнего приема пищи пройти должно минимум 8, желательно — 12 часов), пить можно только минеральную воду без газа. Все анализы проводят до рентгенографии, физиотерапевтических процедур, УЗИ.
Анализ крови является простой диагностической процедурой, которая позволяет заподозрить или подтвердить множество заболеваний. Но иногда можно получить ложноотрицательные или ложноположительные результаты. Повлиять на результат исследования может неправильный забор, хранение или транспортировка венозной крови, длительное хранение биологического материала до поступления в лабораторию, замораживание или термическая обработка крови пациента. Исказить результаты диагностики может прием определенных медикаментов. Ложноположительные результаты можно получить при наличии аутоиммунных заболеваний, в частности присутствия в крови ревматоиодного фактора. Самыми распространенными системными болезнями являются инсулинозависимый сахарный диабет, витилиго, псориаз, язвенный колит, непереносимость глютена, диффузный токсический зоб, СПИД\ВИЧ.
Диагноз устанавливается на основании эпидемиологических данных и расспроса больного. Подозревать гепатит А врач может, если у пациента был контакт с больным желтухой примерно за 7-50 суток до ухудшения самочувствия, факт употребления сырой воды, немытых фруктов и овощей. Обычно заражаются гепатитом А люди в возрасте от 15 до 29 лет. Оцениваются симптомы болезни: резкое ухудшение самочувствия с повышением температуры тела и расстройством ЖКТ, присоединение желтухи, улучшение состояния на фоне желтушности кожных покровов и склер глаз, увеличение селезенки и печени в размерах.
Диагностика острого вирусного гепатита А требует проведения общего и биохимического анализов, анализа на определение РНК вируса, выявления антител к вирусу. Для этого типа заболевания характерны низкий уровень лейкоцитов, высокая СОЭ, пониженный билирубин и альбумин. Специфические антитела удается определить только в начале заболевания, то есть практически сразу после завершения инкубационного периода. Самым надежным методом лабораторной диагностики вирусного гепатита А является ПЦР-анализ, позволяющий обнаружит антитела даже при их незначительной концентрации. ПЦР дает информацию о том, когда произошло заражение. Этот диагностический метод также дает возможность идентифицировать фрагменты РНК вируса. Лабораторные исследования нужно проводить два раза, чтобы исключить возможность получения ложноположительного или ложноотрицательного результата.
В дифференциальной диагностике вирусных гепатитов помогают указания на внутривенное ведение наркотических средств, хирургические вмешательства, переливания крови и другие процедуры, связанные с нарушением целостности слизистых или кожных покровов, контакт с людьми, страдающими хроническими заболеваниями печени или больными гепатитом в сроки от шести недель до шести месяцев до ухудшения состояния, случайные половые связи. Для гепатита В характерно постепенное начало, длительный период с выраженной слабостью, болью в суставах, нарушениями пищеварения, кожными высыпаниями. С появлением желтушности кожных покровов улучшение самочувствия не наблюдается. Состояние некоторых больных даже ухудшается. Врач может зафиксировать увеличение печени. Желтуха при гепатите В проявляется не сразу, а постепенно.
При сочетании вирусного гепатита типа В и дельта-инфекции (гепатита D) заболевание протекает тяжелее, симптомы и лабораторные изменения обычно более выражены. Особое значение для диагностики имеют специфические реакции. Вирус В содержит три антигена, к каждому из которых в ходе инфекционного процесса вырабатываются антитела. Поэтому большое практическое значение среди других методов лабораторной диагностики вирусных гепатитов имеет иммуноферментный анализ. В крови больного определяется ДНК вируса, в результатах ПЦР оцениваются маркеры инфекции. Наличие антител к HB-core Ag может означать, что когда-то пациент переболел гепатитом В, потому что антитела сохраняются продолжительный период после выздоровления. Иногда антитела сохраняются в течение всей жизни.
Для диагностирования гепатита С назначают следующие инструментальные и лабораторные обследования: УЗИ, кровь на антитела к вирусу гепатита, биохимия крови, ПЦР-анализ с целью определения ДНР вируса, биопсия печени. Положительные результаты могут указывать на наличие хронической инфекции или перенесенное в прошлом заболевание. Вызвать изменения в крови может другой инфекционный вирусный процесс. Есть вероятность получения ложноположительного результата. При первом анализе может быть положительный результат, который в дальнейшем (при углубленном исследовании) не подтверждается. Такая реакция может быть связана с различными причинами, но не с вирусом гепатита.
Диагностика вирусного гепатита Е основывается на сочетании симптомом острой формы болезни с особенностями заражения (посещение специфических для типа Е регионов за 2-8 недель до появления признаков болезни, употребление неочищенной воды, наличие схожих болезней у окружающих). Подозревать гепатит Е можно при отсутствии в крови маркеров гепатитов А и С. Подтверждается диагноз при наличии специфических антител к вирусу типа Е, которые можно выявить при помощи анализа ИФА в остром периоде заболевания. Дополнительным методом диагностики является УЗИ печени. Лечение предполагает борьбу с интоксикацией, обусловленной симптоматической терапией и поражением печени. Назначается щадящая диета, гепатопротекторы, дезинтоксикационные инфузии.
Если при симптомах гепатита в лабораторных анализах не обнаружены антитела, то нужно провести серологические тесты и определение антител к вирусу простого герпеса, токсоплазме, цитомегаловирусу. Лабораторные показатели могут изменяться при любой системной вирусной инфекции, сопровождающей поражение печени. При болях в правом подреберье, повышении температуры, желтухе, тошноте и рвоте иногда ставят ошибочных диагноз: острый холецистит, восходящий холангит, холедохолитаз. У пожилых людей требуется дифференцировать гепатит с механической желтухой, вызванной раком поджелудочной или холедохолитиазом. С гепатитом у беременных нередко путают заболевания печени (эклампсия, холестаз беременных, острая жировая дистрофия печени). В некоторых случаях приходится исключать наследственные нарушения обмена веществ.
При назначении противовирусной терапии обязательно проводятся дополнительные исследования. Таким образом, лечение и диагностика вирусного гепатита оказываются связаны. Необходимо полное обследование вируса (вирусная нагрузка, генотип), полная диагностика печени (УЗИ с допплерографией, биохимия, отражающая функциональное и структурное состояние печеночных клеток, оценка степени фиброза), анализы для исключения противопоказаний для назначения терапии (аутоиммунные антитела, анализ крови, гормоны, УЗИ щитовидной железы). Пациентам старше 40 лет назначается обследование дыхательной системы, сердца и сосудов. Если диагностируется гепатит В, то дополнительно при назначении терапии проводится анализ на устойчивость к препаратам, мутацию вируса, вирус-дельта.
источник
Гепатит, диагностика которого носит комплексный характер, представляет собой воспалительно-дистрофическое поражение печени. Чтобы поставить диагноз, врач изучает анамнез и осматривает пациента. Если жалобы указывают на возможное наличие болезни, доктор назначает лабораторные и дифференциальные методы обследования. Результаты анализов указывают на форму и вид патологии. Воспаление печени может быть острым или хроническим. Чаще всего диагностируются вирусные гепатиты A, B, C и D.
Воспалительно-дистрофическое поражение печени на начальной стадии проявляется слабо. Патология подтверждается анализами. Лабораторная диагностика вирусных гепатитов — наиболее достоверный метод обнаружения заболевания. Она позволяет выявить в организме специфические антигены и антитела, появившиеся вследствие активного размножения патогенных клеток. Благодаря лабораторным исследованиям становится известной генетическая информация вирусов.
Полимеразная цепная реакция (ПЦР) — основной вид лабораторной диагностики. Обследование направлено на изучение ДНК возбудителя заболевания. Благодаря ПЦР-диагностике выявляются маркеры (антигены и антитела) вирусов. Это дает возможность определить вид патологии.
Обязательным является биохимический анализ крови. Он назначается всем пациентам, у которых есть подозрения на гепатит. При воспалении печени в крови меняется концентрация глобулинов, фибриногена, билирубина, альбумина, протромбина. В некоторых случаях врач отправляет пациента на коагулограмму. Анализ помогает определить гепатит С. Если свертываемость крови понижена или замедлена, существует вероятность воспалительного процесса в печени.
Современные методы лабораторного исследования включают в себя печеночные пробы, а именно:

Важно вовремя отличить вирусный гепатит от лучевого, аутоиммунного и токсического. Для этого проводится дифференциальная диагностика. На начальной стадии вирусное поражение печени часто путают с алкогольным. Заболевания развиваются по одинаковой схеме. При вирусном гепатите желтушность кожи и слизистых оболочек присутствует длительное время. Болевой и диспепсический синдромы практически отсутствуют. Температура тела повышается редко.
Общий анализ крови играет важную роль в дифференциальной диагностике. При алкогольном гепатите отмечается ярко выраженный лейкоцитоз. Нейтрофильная формула сдвигается влево. Вирусный гепатит А (B, C или D) характеризуется вялотекущим воспалительным процессом, поэтому количество лейкоцитов увеличивается незначительно.
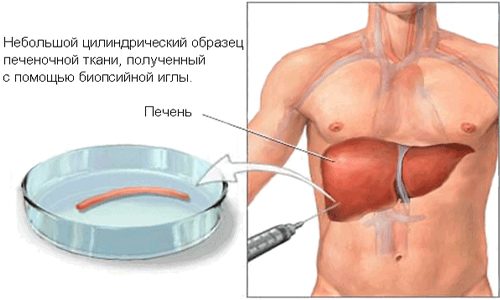
Дифференциальная диагностика включает в себя также биопсию печени. Цель процедуры — исследовать живую ткань органа. Во время биопсии определенное количество клеток печени забирается через иглу в шприц.
Если поражены преимущественно центральные зоны долек, это свидетельствует о наличии алкогольного поражения. Когда патологический процесс затрагивает в основном края, диагностируется вирусное воспаление печени.
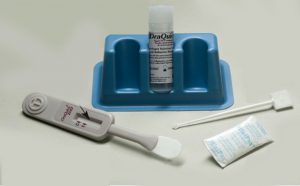
- герметично упакованной полоски;
- скарификатора для прокалывания пальца;
- химического вещества для разбавления крови;
- антисептической салфетки;
- пипетки для забора биологического материала.
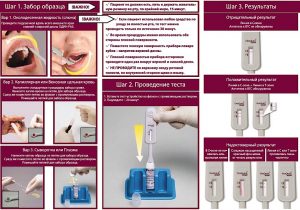
Тест на гепатит В, D, A и C можно сделать самостоятельно без посторонней помощи. Исследование включает в себя следующие этапы:
-
Обеззараживание кожи. Для этого используется антисептическая салфетка из набора.
- Прокол пальца. С помощью скарификатора целостность эпидермиса нарушается.
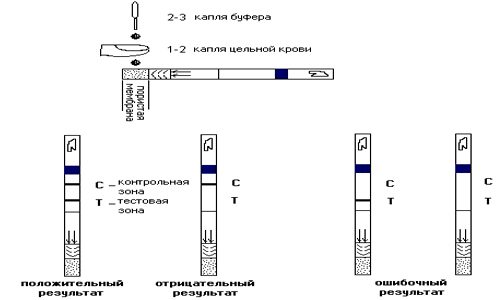
- Забор крови. Биологический материал помещается в специальную пипетку. Для исследования достаточно забрать 2–3 капли крови.
- Помещение биологического материала на тест-полоску. Туда же выливается химическое вещество.
- Ожидание результата. Если через 15 минут на тесте появляются 2 полоски, маркеры гепатита присутствуют. 1 черта свидетельствует о том, что человек здоров. Отсутствие обеих полосок — повод повторить тест.
Домашняя проверка на наличие гепатитов разных видов не отменяет консультации специалиста. Если результат теста положительный, человек должен срочно обратиться к доктору. Вирусное поражение печени быстро прогрессирует. При отсутствии лечения болезнь перерастает в цирроз или онкологию. Даже если с помощью экспресс-теста обнаружился гепатит B, диагностика в медицинском учреждении проводится повторно.
Эффективным диагностическим методом является УЗИ печени и других органов брюшной полости. Ультразвуковое исследование показывает состояние сосудов и ткани органа. На мониторе врач видит полную картину воспалительного процесса. Во время УЗИ определяются размер и плотность печени. При необходимости дополнительно исследуются желудок, поджелудочная железа. Недостатком УЗИ является то, что просматриваются исключительно поверхностные изменения органа.
Инструментальные методы диагностики гепатита включают в себя эластометрию. Это современный и наиболее эффективный способ в короткие сроки поставить верный диагноз. Эластометрия проводится с помощью фиброскана. Данный прибор вычисляет патологические изменения в тканях печени на клеточном уровне. Иногда данные эластометрии более информативны, чем результаты биопсии.
Часто у пациентов присутствуют сразу несколько типов вирусного гепатита. В связи с этим логично проводить комплексную поэтапную диагностику. Сначала врач опрашивает пациента и пальпирует органы брюшной полости. Затем назначаются анализы и инструментальные исследования. В сложных случаях доктор направляет пациента на биопсию. Терапия назначается с учетом результатов диагностики.
источник
В основе лабораторной диагностики вирусных инфекций лежат 3 группы методов:
1 группа — Обнаружение возбудителя или его компонентов непосредственно в клиническом материале, взятом от больного, и получение ответа через несколько часов (быстрая; экспресс-диагностика). Методы экспресс-диагностики наиболее распространённых вирусных инфекций приведены в табл. 2.
Материал для исследования
Отделяемое носоглотки, конъюнктивы, кровь, кал, моча
ИФ, молекулярная гибридизация (МГ), ЭМ, ИФА, РИА
В течение первых 12 дней после появления сыпи
Ветряной оспы и опоясывающего герпеса
Ветряная оспа, опоясывающий герпес
В течение первых 7 дней после появления сыпи
В течение всего периода заболевания
ЭМ, микроскопия окрашенных мазков-отпечатков, МГ, ИФ, выявление IgM
ЭМ, ИЭМ, ИФА, РИА, МГ, электрофорез РНК в ПААГ
ИЭМ, ИФА, РИА, выявление IgM
ИФА, РИА, РОПГА, МГ, ПЦР, ВИЭФ
2 группа методов — Выделение вируса из клинического материала, его индикация и идентификация (вирусологическая диагностика).
В большинстве случаев концентрация вируса в клиническом материале недостаточна для быстрого обнаружения вируса или его антигенов. В этих случаях используют вирусологическую диагностику. Эта группа методов требует продолжительного времени, трудоёмка, часто является ретроспективной. Однако вирусологическая диагностика является необходимой для инфекций, вызванных новыми типами вируса, или когда невозможно провести диагностику другими методами.
Для вирусологической диагностики врач должен обеспечить взятие необходимых проб материала в соответствующую фазу заболевания, доставку их в лабораторию, снаодив диагностические лаборатории необходимой клинической информацией.
Материалом для вирусологического исследования при заболеваниях, сопровождающихся диареей или другими желудочно-кишечными расстройствами, предполагающими вирусную этиологию, являются свежие порции фекалий. При заболеваниях дыхательной системы материал для исследования лучше всего получать путём аспирации слизи, смывов. Мазки из носоглотки мене информативны. При наличии везикулярной сыпи материалом для исследования является жидкость, аспирированная иглой из везикул. При петехиальной и макуло-папулёзной сыпи материалом для исследования являются как пробы слизи из носоглотки, так и фекалии. При подозрении на нейровирусные инфекции для вирусологического исследования следует забирать слизь из носоглотки, фекалии и спинномозговую жидкость. Для диагностики эпидемического паротита и бешенства материалом является слюна. При подозрении на цитомегало- и пaпoвирусные инфекции материалом может быть моча. Попытку выделить вирус из крови можно предпринять при подозрении на инфекции, вызванные некоторыми арбовирусами, вирусами герпеса. Биопсия мозга может быть проведена при диагностике герпетического энцефалита, ПСПЭ, прогрессирующего краснушного панэнцефалита, болезни Крептцфельдта-Якоба, лейкоспонгиоза и др.
Препараты слизи из носоглотки или фекалии помещаются в среду для транспортировки, состоящую из физиологического раствора с добавлением антибиотиков и небольшого количества белка или сыворотки животных. Материалы могут храниться при температуре 4°С не боле 48 часов. Более длительное хранение требует температуры -70°С.
Выделение вируса из клинического материала осуществляется путём его инокуляции в культуру клеток, куршше эмбрионы или заражения им лабораторных животных (см. Культивирование вирусов).
Вирус гриппа следует выделять путём инокуляции вируссодержащего материала в ампиотическую или аллантоисную полость куриного эмбриона. Для выделения вируса Коксаки А, вируса бешенства, многих арбовнрусов, ареиави-русов рекомендуется иптраперитонеальпая и иитрацереОратьпая инокуляция материала новорождённым мышам.
После заражения клеточной культуры, последнюю исследуют на наличие ЦП Д. Многие энтеровнрусы вызывают раннее ЦДД (через несколько часов). Цигомегаловирусы, аденовирусы, вирус краснухи вызывают ЦПД через несколько педель, а иногда необходимо прибегать к получению субкультуры. Присутствие сншштия свидетельствует о наличии таких вирусов, как PC, кори, эпидемического паротита, герпесвируеов.
Идентификация вирусов, выделенных в этих системах, проводится с по-мошыо серологических методов. Такие серологические реакции, как РТГЛ, РН, PIT Аде, используются только при вирусных инфекциях. РСК, РПГА, ИФА, РИА, ИФ, РП и др. используются для диагностики как вирусных инфекций, так и инфекций, вызванных другими возбудителями.
На схемах 2 и 3 представлена дигностика ОРВИ и кишечных инфекций.
источник
Составитель:
заведующая клинико-диагностической лабораторией У «Гомельская областная туберкулёзная клиническая больница» Т.Д. Борисенко
главный специалист по клинической лабораторной диагностике УЗ Гомельского областного исполнительного комитета А.А. Кудря
заведующая лабораторией диагностики вирусных и особо опасных инфекций ГУ «Гомельский областной центр гигиены, эпидемиологии и общественного здоровья» С.А. Думова
Характеристика вируса типа А (H1,N1)
Высокопатогенный вирус гриппа А (H1,N1) (ВПВГА) относится к семейству Orthomyxoviridae. Геном вируса представлен восемью фрагментами РНК. По данным генетического анализа, вирус гриппа, вызвавший вспышку заболевания среди людей в Мексике и США весной 2009 года, является реассортантом вирусов гриппа свиней.
Вирус передаётся от человека к человеку воздушно-капельным путём. Не исключён также и контактно-бытовой путь передачи. Инкубационный период при гриппе ВПВГА составляет обычно 2-3 дня, и вирус может выделяться в окружающую среду заболевшим 7 дней и более. Клиническая картина заболевания разнообразна – от бессимптомных форм до тяжелых пневмоний. Вирус чувствителен к озелтамивиру и занамивиру.
Вирус чувствителен к повышенным температурам и погибает при нагревании до 70 0 С в течении 30 минут. Вирус также чувствителен к различным дезинфектантам, обладающим вирулицидным действием.
ВПВГА характеризуется высокой антигенной изменчивостью. Опасения Всемирной организации здравоохранения (ВОЗ) связаны с генетической новизной вируса и его потенциальной способностью к дальнейшей реассортации, вследствие чего возможно возникновение более агрессивных вариантов инфекции.
Наиболее известные эпидемии вызванный вирусом гриппа А (H1,N1): «испанка» — пандемия 1918-1920 годов, «русский грипп» — пандемия 1977-1978 годов, «мексиканский» или «свиной» грипп – пандемия, начавшаяся в марте-апреле 2009 года. У переболевших остаётся частичный иммунитет.
ВОЗ присвоила вирусу гриппа А (H1,N1) шестую степень угрозы (из шести). Степень угрозы по ВОЗ не характеризует патогенность вируса (то есть опасность заболевания для жизни людей), а указывает на его способность к распространению.
Определение случаев заболевания
Подтверждённый случай – заболевание, при котором имеются симптомы острого респираторного заболевания (ОРЗ) с лабораторно подтверждённой инфекцией, вызванной ВПВГА одним из следующих методов:
l полимеразная цепная реакция (ПЦР) в режиме реального времени
l выделение вируса в культуре клеток.
Вероятный случай – у человека имеет место ОРЗ, при этом результат ПЦР положительный на грипп типа А, но отрицательный на подтип Н1 или Н3.
Подозрительный случай – случай, при котором:
l У человека имеется ОРЗ, и этот человек тесно контактировал с лицом с подтверждённой инфекцией, вызванной ВПВГА, в то время, когда это лицо находилось в состоянии болезни, или
l У человека имеет место ОРЗ, и известно, что этот человек недавно контактировал с животным с подтверждённой или подозреваемой инфекцией, вызванной ВПВГА, или
l У человека имеет место ОРЗ, и этот человек совершил поездку в район, где имеют место подтверждённые случаи ВПГА.
При поступлении из организации здравоохранения информации о подтверждённом, вероятном или подозрительном случае заболевания людей ВПГА, специалистами регионального центра гигиены и эпидемиологии проводится эпидемиологическое расследование.
Организация лабораторной диагностики
Сбор, хранение и транспортировка образцов для лабораторной диагностики
Сбор клинического материала осуществляет обученный медицинский работник лечебно-профилактического учреждения в средствах индивидуальной защиты органов дыхания (респиратор), защитных очках или щитках для защиты лица, бахилах, двойных резиновых перчатках в стерильные флаконы, пробирки, контейнеры, стерильными инструментами.
Для диагностики заболевания могут быть использованы следующие образцы:
l смыв из носовой полости
l содержимое эндотрахеальных трубок
По клиническим показаниям к ним могут быть добавлены:
l бронхоальвеолярный лаваж
l ткань легкого или трахеи, взятая post mortem.
Обследованию на высокопатогенный вирус гриппа подлежат все больные с тяжелым течением ОРЗ. Забор материала от пациентов (умерших) с подозрением на инфекцию ВПВГА проводят в лечебно-профилактическом учреждении (ЛПУ) после изоляции больного. Первичное исследование материала от больного осуществляется методами ПЦР в режиме реального времени на базе лаборатории диагностики вирусных и особо опасных инфекций ГУ «Гомельский областной Центр гигиены, эпидемиологии и общественного здоровья» (ОблЦГЭ и ОЗ).
Курьер получает в лаборатории диагностики вирусных и особо опасных инфекций ОблЦГЭ и ОЗ стерильные пробирки с физраствором и стерильные тампоны, упакованные по 10 штук. Пробирки и тампоны хранятся в приемном покое УГОТКБ, годны для использования 7 дней. В приёмном покое хранятся также одноразовые стерильные пластиковые сухие пробирки объёмом 50 мл для сбора биологического материала (мокрота, содержимое эндотрахеальных трубок, ткань лёгкого и др.).
l до начала этиотропной терапии
l мазок из носовой полости, зева — не позднее 5 дня от начала заболевания (лучше первые 3 дня)
l парные сыворотки крови 1-я сыворотка не позднее 3-5 дня заболевания.
2-я сыворотка через 14 дней
l секционный материал — в день смерти больного
Техника забора клинического материала
Венозная кровь
Для серологического исследования забираются парные сыворотки крови. Первую пробу крови берут в первые 3-4 дня заболевания (или в первый день обращения за медицинской помощью). Кровь забирается в чистую сухую пробирку шприцем из вены в количестве 3-5 мл у взрослых.
Первичная обработка крови проводится в клинико-диагностической лаборатории УГОТКБ. Венозная кровь, отстаивается 30 минут при комнатной температуре. При помощи стеклянной палочки отделяют столбик сгустка от стенок пробирки. Пробирку центрифугируют при 1500 об/мин 10 минут. Полученную сыворотку отсасывают автоматическим дозатором с одноразовым наконечником. На каждую сыворотку используется отдельный наконечник. Сыворотка не должна быть гемолизированная, хилезная, с признаками бактериального пророста.
Первую пробу сыворотки хранят при температуре минус 20 0 С до получения второй сыворотки крови. Повторное оттаивание – замораживание не допускается.
Вторую пробу берут через 14 дней после начала заболевания. Обе пробы одновременно отправляют для исследования в лабораторию диагностики вирусных и особо опасных инфекций в течение 24 часов после забора второй сыворотки.
Одиночные сыворотки лаборатория диагностики вирусных и особо опасных инфекций не принимает, т.к. диагностика осуществляется на основании 4-х кратного увеличения титра антител во второй сыворотке по сравнению с первой.
Мазок из полости носа
Мазок из полости носа забирают сухими стерильными ватными тампонами. Перед взятием материала полость носа необходимо очистить от слизи, лейкоцитов, слущенных клеток эпителия.
Тампон ввести легким движением по наружной стенке носа на глубину 2-3 см до нижней раковины. Затем тампон слегка опустить книзу, ввести в нижний носовой ход под нижнюю носовую раковину, сделать вращательное движение и удалить вдоль наружной стенки носа. Мазок берётся из обеих полостей носа. Тампоны погрузить в стерильную пробирку с 3 мл транспортной среды (фосфатно-солевой буфер или физраствор), отломать концы палочек и плотно закрыть пробкой.
Материал в течение 1 — 4 часов доставляется в лабораторию.
Мазки должны быть забраны таким образом, чтобы в них содержались клетки, имеющие диагностическое значение — цилиндрический эпителий из глубоких отделов носа, в котором размножаются вирусы. Мазки, содержащие клетки плоского и переходного эпителия из наружных отделов носа не информативны и исследованию не подлежат.
Мазок из ротоглотки
Мазки берут сухими стерильными ватными тампонами вращательными движениями с поверхности миндалин, нёбных дужек и задней стенки ротоглотки. Тампоны погрузить в стерильную пробирку с 3 мл транспортной среды (фосфатно-солевой буфер или физраствор), отломать концы палочек и закрыть пробкой.
Секционный материал
Кусочки ткани легких берут асептически. Объем проб – около 1-2 см?. Секционный материал помещают в стерильную посуду и транспортируют в термоконтейнере в течение 24 часов.
l Все виды собранного биологического материала должны храниться в больнице не более суток при температуре 2-8°С
l Сыворотка хранится в замороженном состоянии
Каждая проба представляется с сопроводительным документом. Направление на исследование материала на ВПГВА методом ПЦР представлено в Приложении 1. Материал взятый post mortem представляется с направлением по форме Приложения 2. Для исследования на грипп и другие ОРВИ (парагрипп, аденовирусная инфекция, РС-инфекция) методом РИФ с направлением на обычном бланке для исследования биологического материала.
Материал доставляется в лабораторию в специальном термоконтейнере с охлаждающими элементами. При необходимости используются специальные среды для транспортировки вирусосодержащего материала (выдает лаборатория диагностики вирусных и особо опасных инфекций ОблЦГЭ и ОЗ).
Все транспортируемые образцы должны быть упакованы в тройную упаковку, содержащую три упаковочных слоя. Упаковка должна быть выполнена с учётом предотвращения любой утечки содержимого, выдерживать удары и нагрузки, имеющие место при транспортировке. Между первичной ёмкостью и вторичной упаковкой должен находиться мягкий абсорбирующий материал, в количестве достаточном для впитывания всего содержимого первичных ёмкостей. При транспортировке нескольких клинических образцов – каждый упаковывается в первичную упаковку, исключается любой контакт между ними.
Методы лабораторной диагностики
Позволяет обнаружить антиген вируса гриппа в клетках цилиндрического эпителия дыхательного тракта больного за счёт взаимодействия антигенов со специфическими противовирусными антителами. Вирус и инфицированная клетка очень неустойчивы, забор материала нужно проводить как можно быстрее после появления клинических симптомов, т.к. число инфицированных клеток уменьшается по ходу болезни. Вследствие мутаций вновь появившиеся высокопатогенные штаммы вируса гриппа свиней изменили свои антигенные свойства, вследствие чего иммунофлюоресценция может быть ложноотрицательна. Поэтому метод не применяется для диагностики ВПВГА, а используется для диагностики гриппа А (кроме свиного), гриппа В, парагриппа, аденовирусной и респираторно-синтициальной инфекции.
Это методы определения специфических антител в парных сыворотках крови с целью ретроспективного подтверждения диагноза. Серологический анализ позволяет определить заболевание, вызванное одним из 6 подтипов гриппа А, включая свиной и птичий, гриппом В.
Полимеразная цепная реакция
Определяют РНК вируса в диагностическом материале. Результаты получают через 24 часа. При исследовании методом ПЦР анализ проводится в два этапа: I этап – обнаружение вирусов гриппа А, II этап – идентификация субтипов H1N1 и H3N2.
Выделение вируса в культуре клеток или куриных эмбрионах
Метод позволяет не только идентифицировать возбудителя, но и изучить его антигенные, фенотипические, генетические свойства, определить чувствительность к лекарственным препаратам. Это самый длительный метод — результаты через 2-10 дней. Материал для исследования является отделяемое из глубоких отделов носовой полости, зева, секционные ткани. Для транспортировки используют специальные среды. Исследование проводится в г. Минске в лабораториях Национального Центра Гриппа.
Лаборатория диагностики вирусных и особо опасных инфекций ГУ «Гомельский областной центр гигиены, эпидемиологии и общественного здоровья» осуществляет диагностику широкого спектра вирусных, бактериальных, протозойных инфекций, гельминтозов. Правила забора и доставки биологического материала представлены в Приложении 3.
- Постановление МЗ РБ № 48 от 01.10.2000 г. «О мероприятиях по профилактике гриппа и других острых респираторных вирусных инфекций»
- Инструкция по применению «Лабораторная диагностика заболевания людей высокопатогенным гриппом» от 08.05.2009 г. № 049-05
- Руководство «Порядок учёта, хранения, передачи и транспортировки микроорганизмов 1-4 групп патогенности» от 30.12.2002 г. №11-7-13-2002
- СП 1.2.011-94 «Безопасность работы с микроорганизмами 1, 2 группы патогенности»
- Инструктивно-методическое письмо «Правила забора и доставки биологического материала в лабораторию диагностики вирусных и особо опасных инфекций ГУ «Гомельский областной центр гигиены, эпидемиологии и общественного здоровья» № 8.7.2./40 от 29.05.2009 г.
Приложение 1
для лабораторного исследования биологического образца от больного ОРИ.
источник
Чаще всего на ПЦР отправляют соскобы со слизистой половых путей, и этот анализ является самым точным из всех имеющихся на сегодняшний день средств диагностики ЗППП. Редко приходится делать ПЦР крови, мочи, слюны и других биологических жидкостей.
Под действием определенных реактивов ДНК бактерий в материале, отправленном на анализ, увеличивается во много раз и становится различимой и идентифицируемой для приборов.
ПЦР всегда качественный анализ, то есть ответом может быть только “обнаружено” или “не обнаружено”. Расшифруем, что кроется за этими значениями. “Обнаружено”, или “положительно”, или просто “+” – из исследуемого материла выделена ДНК соответствующей бактерии, и с вероятностью 97% можно сказать, что человек заражен этой инфекцией. “Не обнаружено”, “отрицательно”, “-” – из исследуемого материала ДНК соответствующей бактерии не выделено, с вероятностью 97% можно утверждать, что большого количества этих бактерий в организме пациента нет, с вероятностью 60% – что пациент не заражен этой инфекцией.
Для того, чтобы бактерия попала в пробирку с материалом, отправляемым на анализ, необходимо, чтобы она содержалась в организме человека в определенном количестве. Если количество бактерий в организме человека минимально, они почти наверняка в пробирку не попадут, и результат анализа придет отрицательный. Однако человек при этом все равно инфицирован и болен. Поэтому для максимального увеличения точности результата перед проведением ПЦР-диагностики требуется специальная подготовка.
ПЦР – метод молекулярной диагностики, ставший для ряда инфекций “золотым стандартом”, проверен временем и тщательно апробирован клинически.
Необычайная чувствительность метода позволяет нашим специалистам гарантированно обнаруживать единичные возбудители в биологическом материале на основе их генетической информации. Аналитическая чувствительность АмплиСенс ПЦР-тест-систем для большинства вирусов и бактерий – воспроизводимое выявление 100 микроорганизмов в исследуемой биологической пробе (1000 МИКРООРГАНИЗМОВ В 1 МЛ)
Специфичность ПЦР при использовании технологии АмплиСенс даже для всех вирусных, хламидийных, микоплазменных, уреаплазменных и большинства других бактериальных инфекций достигает 100%.
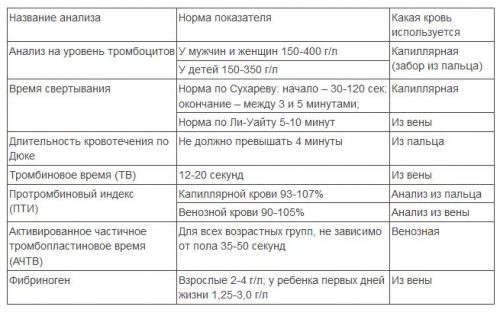
Забор биологического материала для лабораторных исследований методом ПЦР
Забор крови производится натощак из локтевой вены одноразовой иглой (диаметр 0,8-1,1 мм) в одноразовый шприц объемом 5 мл или специальную вакуумную систему типа “Venoject” (с ЭДТА). При заборе в шприц кровь из него аккуратно (без образования пены) переносится в одноразовую пробирку с антикоагулянтом (6% раствор ЭДТА в соотношении 1:19 или 3,8% раствор цитрата Na в соотношении 1:9. Гепарин в качестве антикоагулянта использовать нельзя), пробирка закрывается пробкой и переворачивается несколько раз (для перемешивания с антикоагулянтом). Пробирка с кровью до исследования хранят в холодильнике при +4°С – +8°С.
Максимальный срок хранения:
При исследовании на вирусные гепатиты – 2 суток
При исследовании на другие инфекции – 5 часов
Для анализа отбирается первая порция утренней мочи в количестве 10 мл в специальный флакон или пробирку без консервирующего раствора.
Максимальный срок хранения отобранного материала 1 сутки в холодильнике при температуре +4°С.
Перед забором слюна производится трехкратное полоскание полости рта физиологическим раствором. Забор слюны производится в одноразовые пробирки в количестве 3-5 мл.
Материал необходимо отбирать непосредственно перед исследованием или немедленно доставлять в лабораторию. При невозможности быстрой доставки материал замораживают при –20 °С. Последующая транспортировка осуществляется в замороженном состоянии (в термосе со льдом).
Забор материала производится рабочей частью стерильного одноразового аппликатора с задней стенки глотки и крипт миндалин. После забора материала аппикатор помещают в стерильную одноразовую пробирку.
Максимальный срок хранения материала 1 сутки в холодильнике при температуре +4°С – +8°С.
Мокрота и плевральный выпот
Материал отбирают в специальные флаконы в количестве 5-10 мл.
Максимальный срок хранения материала 1 сутки в холодильнике при температуре +4°С – +8°С.
Биопсийный материал помещают сухую одноразовую пробирку типа “Эппендорф”.
Максимальный срок хранения материала 1 сутки в холодильнике при температуре +4°С – +8°С.
Забор материала производится одноразовым шприцом в количестве 1 мл. Отобранный материал помещают в сухую одноразовую пробирку типа “Эппендорф”.
Максимальный срок хранения материала 1 сутки в холодильнике при температуре +4°С – +8°С.
Забор материала для анализа на урогенитальные инфекции
Соскоб производится из трех различных точек:
При необходимости материал для исследования берется из генитальных язв (исследование на HSV-II, Haemophilus ducrei).
Забор производится универсальным зондом или ложкой Фолькмана. Если соскоб взят универсальным зондом, рабочая часть зонда, содержащая исследуемый материал, отрезается или обламывается и помещается в одноразовую пробирку типа “Эппендорф” с консервирующим раствором. Если забор производится ложкой Фолькмана, рабочая часть инструмента споласкивается в консервирующем растворе, содержащемся в одноразовой пробирке типа “Эппендорф”.
Максимальный срок хранения материала 1 сутки в холодильнике при температуре +4°С – +8°С.
Забор материала производится универсальным зондом из уретры. При необходимости материал для исследования берется из генитальных язв (исследование на HSV-II, Haemophilus ducrei).
Рабочая часть зонда, содержащая исследуемый материал, отрезается или обламывается и помещается в одноразовую пробирку типа “Эппендорф” с консервирующим раствором.
Максимальный срок хранения материала 1 сутки в холодильнике при температуре +4°С – +8°С.
После окончания массажа предстательной железы сок в количестве 0,5-1 мл собирают в одноразовую сухую пробирку типа “Эппендорф”. При невозможности получить сок, сразу после массажа собирают первую порцию мочи (в которой содержится сок предстательной железы) в количестве 10 мл (правила забора мочи смотрите выше).
Максимальный срок хранения 1 сутки в холодильнике при температуре +4°С – +8°С.
Забор и хранение биологического материала (кровь) для исследований методом ИФА (инфекции)
Забор крови производится натощак из локтевой вены одноразовой иглой (диаметр 0,8-1,1 мм) в одноразовый шприц объемом 5 мл или специальную вакуумную систему типа “Venoject” (с ЭДТА или без). При заборе в шприц кровь из него аккуратно (без образования пены) переносится в одноразовую “сухую” пробирку или в пробирку с антикоагулянтом (6% раствор ЭДТА в соотношении 1:19 или 3,8% раствор цитрата Na в соотношении 1:9).
Кровь должна быть доставлена в лабораторию в день забора. Пробирку с кровью до исследования хранят в холодильнике при +4°С – +8°С.
Максимальный срок хранения сыворотки при температуре +4°С – +8°С – 48 часов
Максимальный срок хранения сыворотки при температуре -20°С – длительное хранение.
Забор и хранение биологического материала (кровь) для исследований на сифилис (Syphilis RPR, Syphilis TPHA, Syphilis TPHA (полуколичественный анализ), определения в сыворотке концетрации гормонов, онкомаркёров, аутоантител методом ИФА и для биохимических исследований
Утром натощак (при динамическом наблюдении – всегда в одни и те же часы);
Только в “сухую” пробирку или специальную коммерческую вакуумную систему без антикоагулянта.
Забор крови производится натощак из локтевой вены одноразовой иглой (диаметр 0,8-1,1 мм) в сухую пробирку объемом 5 мл или специальную вакуумную систему типа “Venoject” (без антикоагулянта). Забор шприцом нежелателен в связи с опасностью возникновения гемолиза.
Кровь должна быть доставлена в лабораторию в день забора. Пробирку с кровью до исследования хранят в холодильнике при +4°С – +8°С.
Максимальный срок хранения сыворотки при температуре +4°С – +8°С – 48 часов.
Максимальный срок хранения сыворотки при температуре -20 °С – длительное хранение.
Допускается только однократная разморозка сыворотки.
Забор крови для определения субпопуляций и функциональной активности лимфоцитов и нейтрофилов
Для предотвращения свёртывания в кровь при взятии добавляют антикоагулянт: 20 единиц гепарина на 1 мл крови. Лучше использовать стандартные пробирки с гепарином (ВАКУТАЙНЕР на-гепарин или ли-гепарин на 5-7 мл с зелёными крышками фирмы Becton Dickinson).
Перед взятием крови равномерно распределить гепарин по стенкам пробирки.
При взятии шприцем, во избежании гемолиза, кровь в пробирку спускать плавно, без напора.
После взятия пробирку с образцом несколько раз перевернуть. Не встряхивать и не крутить на шейкере.
Кровь должна храниться не более 48 часов при комнатной температуре
При перевозке температура крови должна быть +18 °С – +24 °С
Для определения иммуноглобулинов и ЦИК в сыворотке крови,
забор крови производится только в сухую пробирку.
Условия забора и перевозки те же.
Забор и хранение биологического материала (кровь) для определения группы крови по системе AB0 и Резус-фактора
Забор крови производится натощак из локтевой вены одноразовой иглой (диаметр 0,8-1,1 мм) в одноразовый шприц объемом 5 мл или специальную вакуумную систему типа “Venoject” (с ЭДТА). При заборе в шприц кровь из него аккуратно (без образования пены) переносится в одноразовую пробирку с антикоагулянтом (6% раствор ЭДТА в соотношении 1:19 или 3,8% раствор цитрата Na в соотношении 1:9).
Кровь должна быть доставлена в лабораторию в день забора. Пробирку с кровью до исследования хранят в холодильнике при +4°С – +8°С.
Забор и хранение биологического материала (моча) для определения суточной экскреции 17-КС
Утренняя моча сбрасывается, следующие порции мочи, включая утреннюю порцию следующего дня, собираются в отдельную посуду. Объём собранной мочи перемешивается, измеряется(!). В баночку отливается 50 мл мочи.
Доставка образца с указанием диуреза – в те же сутки.
При более длительном хранении (более суток) требуется заморозка.
Забор исследуемого материала для бактериологических исследований
Правила подготовки больного к исследованию и забора материала:
Материал для исследования у женщин следует брать перед менструацией или через 1-2 дня после ее окончания. Рекомендуется воздержаться от мочеиспускания в течение 3-4 часов и половых сношений перед взятием материала.
Женщины в день явки на обследование не должны спринцеваться и проводить туалет наружных половых органов.
Исследуемый материал берут специальными одноразовыми зондами, ложкой Фолькмана, бактериологической петлей либо ушным зондом с затупленным концом.
За 5-7 дней до забора материала необходимо прекратить прием химиопрепаратов и лечебные процедуры.
Исследуемый материал должен быть без примесей крови.
При вялотекущих и хронических инфекциях урогенитального тракта рекомендуется применять один из следующих методов провокации:
биологическая: введение гоновакцины (500 млн. микробных тел) взрослым однократно, внутримышечно, детям старше 3-х лет- 100-200 млн. микробных тел. Детям до 3 лет не рекомендуется введение гоновакцины;
термическая: применение в течение 3-х дней диатермии с абдоминально-вагинально-сакральным расположением электродов по 30,40,50 мин или индуктотермии по 10,15,20 мин. Следует производить забор отделяемого из уретры, цервикального канала и прямой кишки через один час после каждого прогревания;
механическая: наложение металлического колпачка на шейку матки женщин на 4 часа, проведение массажа уретры мужчин на буже в течение 10 мин;
алиментарная: употребление соленой, острой пищи и алкоголя за 24 часа до исследования.
Не следует проводить химические провокации, так как они губительно действуют на некоторых возбудителей.
Забор материала производят после провокации и через 24-48-72 ч.
Взятие материала проводит врач акушер-гинеколог при подозрении на инфекционную природу патологического процесса.
Содержимое цервикального канала, полости и придатков матки в норме стерильно.
Рекомендуется воздержаться от мочеиспускания в течение 1,5-2 часов и более перед взятием материала.
Перед взятием материала наружное отверстие уретры необходимо обработать тампоном, смоченным стерильным физиологическим раствором.
При наличии гнойных выделений соскоб надо брать либо сразу, либо через 15-20 мин после мочеиспускания, при отсутствии выделений следует провести массаж уретры с помощью зонда для взятия материала.
У женщин перед введением зонда в уретру необходимо провести ее массаж о лобковое сочленение.
В уретру женщин зонд ввести на глубину 1-1,5см, мужчин – на 3-4см и сделать несколько вращательных движений. У детей материал берут только с наружного отверстия уретры.
ВУЛЬВА, ПРЕДДВЕРИЕ ВЛАГАЛИЩА. Отделяемое берут стерильным ватным тампоном. При воспалении бартолиниевых желез производят их пункцию, при вскрытии абсцесса железы содержимое берут стерильным ватным тампоном.
ВЛАГАЛИЩЕ. Материал для исследования берут стерильным тампоном из заднего свода или с патологически измененных участков слизистой. Материал для посева должен быть взят до проведения мануального исследования.
Перед взятием материала необходимо удаление ватным тампоном слизи и обработка шейки матки стерильным физиологическим раствором
Необходимо пользоваться кольпоскопом.
Зонд ввести в цервикальный канал на глубину 0,5-1,5 см.
При наличии эрозий цервикального канала необходимо их обработать стерильным физиологическим раствором, и материал следует брать с границы здоровой и измененной ткани.
При извлечении зонда необходимо полностью исключить его касание стенок влагалища.
Для посева может быть использован соскоб слизистой, полученный при диагностическом выскабливании стенок цервикального канала.
МАТКА Материал берется с помощью специальных инструментов типа шприца-аспиратора, имеющего на зонде покрытие.
При воспалительном процессе в придатках матки материал из очага инфекции (гной, экссудат, кусочки органов) берется либо при оперативном вмешательстве, либо при проведении диагностической пункции в малом тазу, проводимой через влагалищные своды.
Взятый для исследования материал в транспортной среде может сохраняться до 24 часов при +4° С. Не допускается замораживание пробы.
Микробиологическое исследование мочи нужно проводить до начала антибактериальной терапии. Моча здорового человека стерильна.
Утром после тщательного туалета наружных половых органов в стерильную посуду собирают среднюю порцию свободно выпущенной мочи в количестве 3-5 мл. При подозрении на простатит получают 4 пробы: 3 порции мочи (первая и средняя порции при самопроизвольном мочеиспускании и последнюю через 5-10 минут после массажа предстательной железы) и секрет предстательной железы при массаже.
Взятие мочи с помощью катетера связано с риском инфицирования мочевыводящих путей, поэтому его желательно избегать. Катетеризацию производят в случаях, когда больной не способен мочиться или для разграничения воспалительного процесса в почках и мочевом пузыре. С этой целью мочевой пузырь опорожняют и вводят в него 50мл раствора, содержащего 40 мг неомицина и 20 мг полимиксина. Через 10 минут берут пробы мочи для исследования. При локализации процесса в мочевом пузыре моча остается стерильной. При инфицировании почек отмечается бактериурия.
Мочу больного можно получить путем надлобковой пункции мочевого пузыря. Этот метод взятия мочи дает наиболее достоверные результаты.
Микробиологическое исследование мочи надо проводить как можно быстрее после ее получения от больного, т.к. микробы, содержащие в моче, быстро размножаются при комнатной температуре, что может дать ложные результаты при определении степени бактериальной обсемененности. В связи с этим при исследовании мочи на степень бактериурии, от момента взятия пробы мочи до начала исследования в лаборатории должно проходить не более 1-2 часов.
При исследовании мочи на наличие возбудителей урогенитальных инфекций проба может сохраняться до 18 часов при +4° С.
При транспортировке проб мочи необходимо учитывать температуру внешней среды.
Материал (испражнение) на кишечный дисбактериоз забирается до начала лечения антибактериальными и химиотерапевтическими препаратами.
Пациенту рекомендуется помочиться в унитаз, далее путем естественной дефекации в подкладное судно или ночной горшок собираются испражнения (следить, чтобы не попала моча). Перед сбором материала подкладное судно (ночной горшок) предварительно промываются проточный водой несколько раз, ополаскиваются кипятком.
Испражнения в количестве 1 грамма (из разных мест средней части) из судна (горшка) забирается в стерильный флакон и в течение первых 2 часов доставляется в бактериологическую лабораторию с оформленным направлением. При невозможности быстрой доставки материала в лабораторию, допускается его хранение при +4° С до 6 часов. Не допускается замораживание пробы.
источник

 Обеззараживание кожи. Для этого используется антисептическая салфетка из набора.
Обеззараживание кожи. Для этого используется антисептическая салфетка из набора.