Гепатит В – инфекционное заболевание человека, характеризуется избирательным поражением печени и вызывается гепадновирусом (семейство Hepadnaviridae, род Orthohepadnavirus).
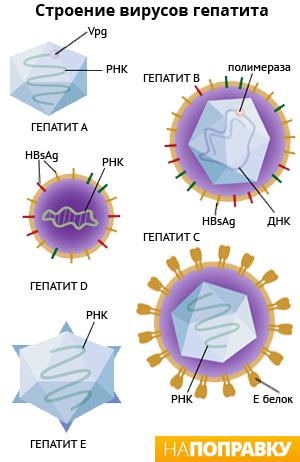
Морфология и структура. Вирионы гепатита В человека имеют сферическую форму, диаметр 42 нм, кубический тип симметрии, состоят из 180 капсомеров. Геном образует кольцевая двухнитевая молекула ДНК, состоящая из 3200 нуклеотидов, но ее «плюс»-нить на 20-50% короче «минус»-нити. Полный вирион состоит из внешней липид-гликопротеидной оболочки (суперкапсид), включающей белковые молекулы, несущие поверхностный АГ – HBs АГ (рис.32).
Суперкапсид HВV состоит из главного или основного S-белка, среднего М-белка и большого или длинного L-белка; имеется внутренний нуклеокапсид (ядро) диаметром 25-27 нм, фермент ДНК-полимераза и HBc АГ, который содержится в сердцевине вирионов. При протеолитическом гидролизе белка капсида образуется полипептид – НВе АГ – который отщепляется от НВс АГ при прохождении его через мембрану гепатоцитов и обнаруживается в крови.
В составе поверхностного HBs АГ имеется один общий АГ а и две пары взаимоисключающих детерминант d/у и w/r. Известны геномы HВV четырех основных субтипов, названные по сочетанию АГных эпитопов HBs Аg: adw, ayw, adr, ayr. АГы обеспечивают формирование общего перекрестного иммунитета ко всем субтипам вируса. Субтипы вируса имеют различное распространение в регионах мира. HBs АГ, его полипептидный фрагмент preS2, играет важную роль в прикреплении вируса к гепатоцитам за счет связывания их с альбуминовым рецептором. Полипептид preS1 обладает иммуногенными свойствами и используется для приготовления вакцины. В зараженной клетке HBs АГ синтезируется в цитоплазме и участвует в сборке вирионов. Наряду с полными вирионами (частицами Дейна) в сыворотке инфицированных лиц присутствует свободный HBs Аg в виде сферических частиц диаметром 20-22 нм или волокнистых образований до 200 нм. Эти частицы не содержат вирусной ДНК и являются неинфекционными. Ядерный АГ HBс АГ в свободной форме локализован в ядре гепатоцитов и экспрессируется на поверхности зараженных гепатоцитов, на которых и может быть обнаружен, но не выявляется в сыворотке крови больного.
При попадании HBс АГ в кровь он трансформируется в HBе АГ, что свидетельствует о высокой инфекционной опасности больного.
HBх АГ менее изучен. Считают, что он имеет отношение к раковой трансформации гепатоцитов.
Резистентность. Вирус гепатита В обладает высокой устойчивостью к температуре, выдерживает кипячение в течение 15-20 минут, 60 0 С – несколько часов, в комнатной температуре сохраняет жизнеспособность в течение 3 месяцев, в замороженном виде – несколько лет. Вирус погибает при обработке 3% Н2О2, 5% хлорамином, при УФ-облучении, при обработке сухим жаром при 180°С в течение 60 минут.
Эпидемиология. Источником заражения является больной человек и вирусоноситель. Заражение может происходит при медицинских манипуляциях, при переливании крови; при половом контакте, плод может заражаться трансплацентарно или через инфицированные пути матери. Инфицирование возможно через зубные щетки.
Репродукция. Вирус гепатита В не репродуцируется в культурах клеток и куриных эмбрионах. Репликация происходит в ядрах гепатоцитов. Она является весьма сложной и состоит из нескольких этапов. Первоначально ДНК-полимераза достраивает короткую (+)цепь ДНК до полной молекулы. Эта ДНК проникает в ядро клетки, где с нее синтезируется РНК-копия, получившая название прегенома. После этого вирусная ДНК-полимераза начинает строить на матрице РНК прегенома его ДНК-копию (обратная транскрипция). Прегеном одновременно разрушается. Эта ДНК может встраиваться в геном гепатоцита (интегративная инфекция). С вирусного генома транслируется информация для синтеза на рибосомах гепатоцитов HBs АГ, HBе АГ, капсидных белков, вирусспецифических ферментов. Новая вирусная частица выходит из гепатоцита (рис. 33). Наряду с вновь образованными вирусными частицами из инфицированной клетки высвобождаются также «пустые» вирусные частицы, содержащие HBs АГ и HBе АГ. При типичной острой форме гепатита В в крови появляются HBs АГ, HBе АГ, и АТ IgM, IgG анти-HBс АГ, анти-HBе АГ и анти-HBs АГ.
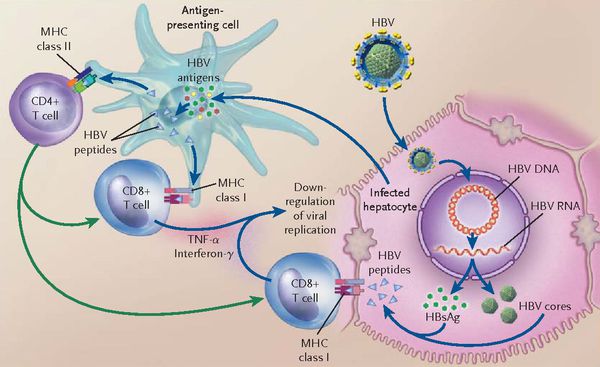
Патогенез и клиника. Входными путями служат кровеносные сосуды слизистых оболочек. Вирус попадает в кровь, заносится в печень и фиксируется на гепатоцитах. Вирус не обладает цитопатогенным действием, поэтому патологический процесс в печени возникает не с момента внедрения возбудителя в гепатоциты, а только после распознования иммуноцитами его АГов на клеточной мембране, которые индуцируют появление аутоантител и Т-киллеров к клеткам печени. Поэтому развивающийся хронический гепатит и цирроз печени можно рассматривать как аутоиммунное заболевание.
При развитии иммунного ответа, представленные на мембране макрофагов вирусные АГы индуцируют гуморальный ответ, при котором образуются АТ IgM и IgG-классов к HBs АГ, HBс АГ, HBе АГ. Одновременно появляются АГспецифические Т-киллеры, разрушающие гепатоциты, на месте которых развивается соединительная ткань, печень подвергается склерозу, функция ее нарушается.
Инкубационный период длится от 30 дней до 6 месяцев. Болезнь может протекать в латентной форме, выявляемой только лабораторными методами, в типичной желтушной форме и тяжелой («фульминантной») форме, заканчивающейся летально от печеночной недостаточности. На фоне увеличения сывороточных аланиновой и аспарагиновой аминотрансфераз у 30% взрослых больных развивается желтуха, которая сохраняется несколько недель, реже несколько месяцев. В разгар заболевания и до 8 недель после него определяются HBs АГ и HBе АГ. Почти одновременно начинается продукция АТ к HBс.
Опасность представляет переход болезни в хроническую форму, который возможен у 15% взрослых больных и до 90% новорожденных от больных матерей. В свою очередь, хронический В-гепатит является фактором риска развития цирроза и гепатоцеллюлярной карциномы.
Для диагностики применяют определение АГ и АТ в ИФА, РИА, ПЦР:
— НВs АГ – основной маркер острой или хронической формы инфекции, а также вирусоносительства;
— ДНК НВV – непосредственный показатель инфицирования НВV, свидетельствует о репликации вируса;
— Нbе АГ – маркер острой формы гепатита, кратковременно выявляемый в крови; его сохранение более 2 месяцев служит признаком развития хронического гепатита;
— IgМ АТ анти-НВс – главный маркер острой формы заболевания;
— АТ анти-НВs, анти-НВс, анти-НВе – маркеры завершения острой формы инфекции, указывающие на формирование иммунитета к НВV; наличие только IgG анти-НВs АГ может быть результатом предшествующей вакцинации или ранее перенесенной инфекции.
Cпецифическая профилактика. Вакцины получены геноинженерным путем, содержат НВs АГ. По рекомендации ВОЗ прививки против гепатита В являются обязательными и должны проводиться детям на первом году жизни. Используют генноинженерную вакцину (например, «Engerix B»), в которой использован рекомбинантный клон дрожжей, содержащий ген НВs + и вырабатывающий HBs АГ. Полный курс прививки состоит из 3 инъекций: 1 доза – сразу после рождения, 2 доза – через 1-2 месяца, 3 доза – до конца 1-го года жизни.
Вакцинировать необходимо также лиц, которые имеют повышенный риск инфекции: персонал медицинских учреждений, больных, которым проводилось переливание крови и др. Для экстренной пассивной иммунопрофилактики используют гамма-глобулин.
Для леченияинтерферон, ингибитор обратной транскрипции ламивудин, а также глюкокортикостероиды.
источник
Что такое гепатит Б? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александров П. А., инфекциониста со стажем в 11 лет.
Вирусный гепатит В (Б) — острое и хроническое инфекционное заболевание, вызываемое вирусом гепатита В, с гемоконтактным механизмом передачи (через кровь), протекающее в различных клинико-морфологических вариантах, и возможным развитием цирроза печени и гепатоцеллюлярной карциномы. Всего в мире, по самым скромных оценкам, инфицировано более 250 млн человек.
вид — вирус гепатита В (частица Дейна)
Развитие вируса происходит в гепатоцитах (железистых клетках печени). Он способен к интеграции в ДНК человека. Имеются 9 генотипов вируса с различными подтипами — генетическая изменчивость позволяет вирусу образовывать мутантные формы и ускользать от действия лекарств.
Имеет ряд собственных антигенов:
- поверхностный HbsAg (австралийский). Появляется за 15-30 дней до развития болезни, свидетельствует об инфицировании (не всегда). Антитела к HbsAg выявляются через 2-5 месяцев от начала заболевания, а сам HbsAg исчезает из крови (при благоприятном течении процесса);
- сердцевинный HbcorAg (ядерный, коровский). Появляется в инкубационном периоде и совместно с ним появляются антитела (HbcorAb). Длительное присутствие HbcorAg в крови свидетельствует о вероятной хронизации процесса (неадекватный иммунный ответ);
- антиген инфекциозности и активного размножения вируса (HbeAg). Появляется совместно с HbsAg и отражает степень инфицированности. Его продолжительная циркуляция в крови является свидетельством развития хронизации процесса, а антитела к нему являются благоприятным прогностическим признаком (не всегда, но по меньшей мере указывают на возможность более благоприятного процесса, срок их циркуляции после выздоровления окончательно не определён, но не более пяти лет после благоприятного разрешения процесса);
- HbxAg — регулятор транскрипции, способствует развитию гепатокарциномы.
Вирус гепатита В чрезвычайно устойчив к действию всевозможных естественных факторов окружающей среды, инактивируется при 60 °C за 10 часов, при 100 °C за 10 минут, при оптимальной температуре сохраняется до 6 месяцев, при автоклавировании погибает за 5 минут, в сухожаровом шкафу — через 2 часа, 2% раствор хлорамина убивает вирус за 2 часа. [1] [3]
Источник инфекции — только человек, больной острой или хронической формой инфекции.
Механизм передачи: гемоконтактный и вертикальный (от матери к ребёнку), не исключается трансмиссивный механизм передачи (например, при укусах комаров в результате раздавливания и втирания инфицированного тела комара в поврежденную ткань человека).
Пути передачи: половой, контактно-бытовой, гемотрансфузионный (например, при переливании крови или медицинских манипуляциях). Восприимчивость всеобщая. Заболеваемость — 30-100 человек на 100 тысяч населения (зависит от страны). Летальность от острых форм — до 2%. После перенесённого острого заболевания при условии выздоровления иммунитет стойкий, пожизненный.
Для заражения характерна малая заражающая доза (невидимые следы крови). [1] [2]
Инкубационный период — от 42 до 180 дней (следует иметь в виду, что наличие клинической симптоматики характеризует лишь незначительную долю всех случаев заболевания).
Начало постепенное. Характерные синдромы:
- общей инфекционной интоксикации (проявляется как астеноневротический синдром);
- холестатический (нарушение секреции желчи);
- артрита;
- нарушения пигментного обмена (появление желтухи при уровне общего билирубина свыше 40 ммоль/л);
- геморрагический (кровоточивость кровеносных сосудов);
- экзантемы;
- отёчно-асцитический (скопление жидкости в брюшной полости);
- гепатолиенальный (увеличение печени и селезёнки).
Начальный (преджелтушный) период продолжается 7-14 дней. Чаще протекает по многообразному типу с болевыми ощущениями в различных суставах по ночам и утром, уртикарными высыпаниями, астеновегетативными проявлениями (снижение аппетита, апатия, нервозность, слабость, разбитость, повышенная утомляемость). Изредка развивается синдром Джанотти-Крости — симметричная, яркая пятнисто-папулёзная сыпь. Не исключены умеренные диспептические явления (расстройства пищеварения). К концу периода происходит потемнение мочи, обесцвечивание кала.
Желтушный период продолжительностью около одного месяца характеризуется возникновением желтушного окрашивания кожи (различных оттенков) на фоне продолжающегося или ухудшающегося общего состояния. Характерна длительность и стойкость симптоматики. Появляется тяжесть и болезненность в правом подреберье, горечь во рту, тошнота, выражённый зуд кожи (практически не снимаемый никакими средствами). На фоне усиления астеноневротического компонента появляются геморрагические проявления, урежение пульса, гипотензия, отёки (отражает степень интоксикации и нарушения функций печени).
Следующим этапом в развитии болезни является нормализации общего состояния, спадение желтухи и реконвалесценция, которая в зависимости от конкретной ситуации и состояния иммунной системы может закончиться как выздоровлением, так и движением развития заболевания в хроническое течение, характеризующееся маловыраженой неусточивой симптоматикой, преимущественно в виде слабости, периодического дискомфорта в правом подреберье, бурно сигнализирующим лишь на стадии цирроза и полиорганных осложнений.
- гепатиты другой этиологии;
- желтухи другой этиологии (например, гемолитическая болезнь, токсическое поражение, опухоли);
- малярия;
- инфекционный мононуклеоз;
- лептоспироз;
- ревматоидный артрит.
В первое десятилетие 21 века произошло возникновение концепции «оккультной» (стёртой) ВГВ-инфекции (далее ОкВГВ), характеризующейся наличием вируса при недетектируемом уровне HbsAg. Механизм данного состояния связывают с мутацией в регионе домена полимеразы, что ведёт к уменьшению вирусной репликации и отсутствию экспрессии HbsАg, также вероятны дефекты гена Pol, что является следствием противовирусной терапии (Рахманова А.Г. и соавторы, 2015). При этом единственными серологическими маркером ВГВ могут быть HBcor антитела (чаще в сочетании с HbeAb), в особенности тогда, когда недоступны высокочувствительные и затратные методы определения HBV ДНК (Цинзерлинг В.А., Лобзин Ю.В., Карев В.Е., 2012). Это обуславливает сохраняющийся риск инфицирования пулов плазмы ВГВ при донорстве крови и трансплантации органов, внутрибольничного инфицирования в роддомах, хирургических стационарах, стоматологии.
Острый гепатит характеризуется более тяжёлым течением у беременной, возникновении повышенного риска преждевременных родов, аномалий развития плода на ранних сроках и кровотечений. Вероятность передачи при острой форме зависит от сроков беременности: в первом триместре риск 10% (но более тяжёлые проявления), в третьем триместре — до 75% (чаще бессимптомное течение после родов). У большинства детей при заражении во внутриутробном и постнатальном периодах происходит хронизация инфекции. [1] [3] [6]
Входные ворота — мельчайшие повреждения кожи и слизистых оболочек.
С движением кровяной массы вирус попадает в печеночную ткань, где локализуется в гепатоцитах и теряет свою протеиновую сферу в лизосомах. Происходит выход вирусной ДНК с последующим ресинтезом аномальных протеинов LSP, а параллельно образование новых частиц Дейна.
В процессе эволюции вирусчеловеческого взаимодействия возможно развитие двух вариантов:
При репликативном пути происходит следующее: белки LSP совместно с HbcorAg вызывают увеличение продукции гамма-интерферона, что приводит к активации главного комплекса гисотсовместимости (HLA), проистекает преобразование молекул гистосовместимости 1 и 2 классов, в результате чего клетка становиться для организма враждебной в антигенном формате.
Антигенпрезентирующие макрофаги содействуют изменению В-лимфоцитов в плазматические клетки и экспрессии ими агрессивных белков-антител к посторонним антигенам. В итоге на поверхности печёночных клеток формируются вирусспецифические иммунные комплексы (антиген + антитело + фракция комплемента С3в).
В динамике может реализоваться два сценария:
- в первом варианте запуск каскада комплимента ведёт к появлению в составе иммунных комплексов агрессивной фракции С9 (мембранатакующий комплекс) — наблюдается значительный некроз гепатоцитов без участия лимфоцитов (молниеносная форма гепатита В);
- при альтернативной варианте (наблюдающимся в большинстве случаев) каскад комплемента в силу иммуноиндивидуалистических свойств не активируется — тогда идёт умеренное разрушение Т-киллерами меченых антителами заражённых вирусом гепатоцитов. Образуются ступенчатые некрозы с образованием на месте гибели гепатоцитов соединительной ткани — рубцов (то есть острый гепатит В при плохом иммунном ответе постепенно переходит в хронический).
Непременным атрибутом патогенеза является формирование иммунопатологического процесса. Гибель гепатоцитов, инфицированных вирусом гепатита В, следует за счёт иммунокомпетентных частиц, Т-киллеров и макрофагальных элементов.
Серьёзным значением является нарушение свойств мембраны клеток печени, что сопровождается экскрецией (выделением) лизосомальных ферментов, разрушающих гепатоциты. Сообразно этому, гибель гепатоцитов происходит за счёт иммунокомпетентных клеток, лизосомальных ферментов и противопечёночных гуморальных аутоантител, то есть острая болезнь наступает (и благоприятно заканчивается) только при хорошем иммунитете, а при плохом идёт хронизация.
При тяжёлом цитолитическом синдроме (массивные некрозы гепатоцитов) возникает гипокалиемический алкалоз, острая печёночная недостаточность, печёночная энцефалопатия (ПЭП), церебротоксическое действие, нарушение функции обмена нервной ткани. [2] [3] [6]
По клиническим проявлениям:
- субклинический (инаппарантный);
- клинически выраженный (желтушный, безжелтушный, холестатический, фульминантный).
По фазам хронического процесса:
- HBeAg-положительная хроническая инфекция HBV (фаза «иммунной толерантности»);
- HBeAg-положительный хронический гепатит B;
- HBeAg-негативная хроническая инфекция HBV;
- HBeAg-отрицательный хронический гепатит B;
- отрицательная HBsAg фаза HBV-инфекции («оккультная фаза»). [1][2]
Острая печеночная недостаточность (синдром острой печеночной энцефалопатии):
- Первая стадия (ОПЭ-1). Предвестники — астения (слабость) и адинамия, инверсивное настроение, эйфория, нарушение сна, «тряска» конечностей, агрессивность, печёночный запах изо-рта, рвота, сонливость, нарастание желтухи, сжатие размеров печени, ухудшение лабораторных данных.
- Вторая стадия (ОПЭ-2). Прекома — моторное возбуждение перетекает в сопор (субкома), появляются судороги, сознание спутано, дезориентация во времени и месте, хлопающая дрожь кистей, тахикардия, повышение кровоточивости, рвота «кофейной гущей», дёгтеобразный стул, уменьшение диуреза (объёма мочи).
- Третья стадия (ОПЭ-3). Кома I — исчезновение словесной связи и адекватной реакции на болевые раздражители, выявление патологических рефлексов (Бабинского). Наблюдается спазм подбородочной мышцы со смещением кожи подбородка кверху при раздражении кожи в области возвышения одного пальца кисти на той же стороне тела. Появляются симптомы орального автоматизма — хоботковый. Дефекация и акт мочеиспускания не контролируются. Глотание сохранено, зрачки узкие со слабой реакцией на яркий свет, усиление желтухи, геморрагических проявлений, размеров печени, кисло-сладкий печёночный запах изо-рта, олиго или анурия.
- Четвёртая стадия (ОПЭ-4). Кома II — абсолютная потеря реакции на все раздражители, арефлексия, симптом плавающих глазных яблок, зрачки расширены и без реакции на свет, нет корнеального рефлекса, исчезает хлопающий тремор, нарушается глотание, дыхание типа Куссмауля или Чейн-Стокса, пульс нитевидный, недержание мочи и кала, резкое увеличение уровня билирубина в крови. [1][5]
Многообразие форм, тесная взаимосвязь с иммунной системой человека и зачастую достаточно высокая стоимость исследований часто затрудняют принятие конкретного решения и диагноза в стационарный отрезок времени, поэтому во избежание роковых (для больного) ошибок следует подходить к диагностике с учётом всех получаемых данных в динамическом наблюдении:
- общеклинический анализ крови с лейкоцитарной формулой (лейкопения, лимфо- и моноцитоз, уменьшение СОЭ, тромбоцитопения);
- общий анализ мочи (появление уробилина);
- биохимический анализ крови (гипербилирубинемия в основном за счёт связанной фракции, повышение уровня АЛТ и АСТ, ГГТП, холестерина, щелочной фосфатазы, снижение протромбинового индекса, фибриногена, положительная тимоловая проба);
- специфические серологические тесты достаточно многообразны и зависят от стадии и формы гепатита В (HbsAg, HbeAg, HbcorAg, HbcorAb IgM и суммарные, HbeAb, anti-Hbs, ПЦР гепатита В в качественном и количественном измерении);
- УЗИ органов брюшной полости, КТ и МРТ диагностика;
- фиброскан (применяется для оценки степени фиброза). [3][4]
Лечение острых форм гепатита В должно осуществляться в стационаре (учитывая возможность быстрых и тяжёлых форм болезни), хронических — с учётом проявлений. В острый период показан постельный режим, печёночная диета (№ 5 по Певзнеру): достаточное количество жидкости, исключение алкоголя, жирной, жареной, острой пищи, всё в мягком и жидком виде.
При лёгкой и средней тяжести острого гепатита этиотропная противовирусная терапия (ПВТ) не показана. При тяжёлой степени и риске развития осложнений назначается специфическая противовирусная терапия на весь период лечения и возможно более длительное время.
В лечении хронических форм гепатита показаниями к назначению ПВТ является наличие уровня DNA HBV более 2000 МЕ/мл (при циррозе печении независимо от уровня), умеренное и высокое повышение АЛТ/АСТ и степени фиброза печёночной ткани не менее F2 по шкале METAVIR, высокая вирусная нагрузка у беременных женщин. В каждом конкретном случае показания определяются индивидуально, в зависимости от выраженности процесса, временной тенденции, пола, планирования беременности и другого.
Существует два пути противовирусного лечения:
- терапия пегилированными интерферонами (имеет ряд существенных противопоказаний и серьёзных побочных эффектов — не менее 12 месяцев);
- нуклеозидно-аналоговой терапии NA (используются препараты с высоким порогом резистентности вируса, длительно — не менее пяти лет, удобство применения, хорошая переносимость).
В отдельных случаях может рассматриваться применение комбинированной терапии.
Из средств патогенетической терапии в острый период используются внутривенно вводимые растворы 5% глюкозы, дезинтоксикантов, антиоксидантов и витамины. Показан приём энтеросорбентов, ферментных препаратов, при выраженном холестазе применяются препараты Урсодезоксихолевой кислоты, при тяжёлом течении — глюкокортикостероиды, методы аппаратного плазмофереза.
В хронической стадии заболевания при наличии соответствующей активности процесса и невозможности назначения ПВТ может быть показан приём групп гепатопротекторов и антиоксидантов. [1] [3]
Основное направление профилактики на сегодняшний день — это проведение профилактической вакцинации в младенческом возрасте (в том числе усиленная вакцинация детей, рождённых от матерей с гепатитом В) и далее периодические ревакцинации раз в 10 лет (или индивидуально по результатам обследования). Достоверно показано, что в странах, где была введена вакцинация, резко сократилось количество вновь выявленных случаев острого гепатита В.
Вызывает некоторые вопросы эффективность вакцинации при заражении «оккультными» формами гепатита В, так как действие вакцины направлено на нейтрализацию HbsAg, которого в данном случае нет, или он видоизменён — окончательного решения пока не определено, ведутся поиски.
Вторая составляющая стратегии профилактики включает обеспечение безопасности крови и её компонентов, использование одноразового или стерилизованного инструментария, ограничение числа половых партнёров и использование барьерной контрацепции. [1] [2]
источник
Гепатит В (сывороточный гепатит) – это вирусное заболевание печени, при котором происходит гибель гепатоцитов, обусловленная аутоиммунными механизмами. В результате нарушаются детоксикационная и синтетическая функции печени.
По оценкам ВОЗ, в мире свыше 2 млрд человек инфицированы вирусом гепатита В, 75% населения земного шара проживает в регионах с высоким уровнем заболеваемости. Ежегодно острая форма инфекции диагностируется у 4 млн человек. В последние годы отмечается снижение заболеваемости гепатитом В, что обусловлено проведением вакцинации.
Вирус гепатита В относится к семейству гепаднавирусов. Он очень устойчив к физическому и химическому воздействию, обладает высокой степенью вирулентности. После перенесенного заболевания у человека формируется стойкий пожизненный иммунитет.
У больных и вирусоносителей возбудитель содержится в биологических жидкостях (крови, моче, сперме, слюне, влагалищном секрете), передается от человека человеку парентеральным путем, то есть минуя желудочно-кишечный тракт.
Ранее заражение часто происходило в результате лечебно-диагностических манипуляций, переливания крови и ее препаратов, выполнения маникюра, нанесения татуировок. В последние десятилетия стал преобладать половой путь передачи инфекции, что объясняется следующими факторами:
- широкое использование одноразового инструментария для инвазивных процедур;
- применение современных методов стерилизации и дезинфекции;
- тщательное обследование доноров крови, спермы;
- сексуальная революция;
- распространенность инъекционных наркотиков.
При незащищенном половом контакте с больным или вирусоносителем риск заражения гепатитом В, по разным данным, составляет от 15 до 45%. Немаловажную роль в распространении заболевания играют потребители инъекционных наркотиков – около 80% наркоманов инфицированы вирусом гепатита В.
Существует бытовой путь заражения: передача вируса происходит в результате использования общих зубных щеток, маникюрных инструментов, лезвий и бритв, банных принадлежностей и полотенец. Любые (даже незначительные) травмы кожи и слизистых оболочек в этом случае становятся входными воротами инфекции. При несоблюдении правил личной гигиены в течение нескольких лет происходит заражение всех членов семьи вирусоносителя.
Лицам, входящим в группу повышенного риска инфицирования гепатитом В, рекомендуется вакцинация. Иммунитет после прививки сохраняется около 15 лет.
Вертикальный путь передачи инфекции, то есть заражение ребенка от матери, чаще наблюдается в регионах с высокой заболеваемостью. При нормально протекающей беременности вирус не преодолевает плацентарный барьер, инфицирование ребенка может произойти во время родов. Однако при некоторых патологиях развития плаценты, ее преждевременной отслойке не исключено внутриутробное инфицирование плода. При обнаружении у беременной женщины в крови HBe-антигена риск заражения новорожденного оценивается в 90%. Если обнаруживается только HBs-антиген, риск инфицирования составляет менее 20%.
Вирусный гепатит В также передается в результате переливания реципиенту инфицированной крови или ее компонентов. Все доноры проходят обязательную диагностику, однако существует серологическое окно, то есть период, когда человек уже инфицирован и представляет эпидемиологическую опасность для окружающих, но лабораторные тесты не выявляют инфекции. Это связано с тем, что от момента инфицирования и до момента выработки антител, которые являются маркерами заболевания, проходит от 3 до 6 месяцев.
В группу риска по гепатиту В входят:
- потребители инъекционных наркотиков;
- лица, получающие гемотрансфузии;
- лица, ведущие беспорядочную половую жизнь;
- медицинские работники, в ходе профессиональной деятельности контактирующие с кровью пациентов (хирурги, медсестры, лаборанты, гинекологи).
Передача вируса гепатита В воздушно-капельным путем невозможна.
По длительности течения заболевания выделяют острую и хроническую форму. По особенностям клинической картины гепатит В бывает:
Основное осложнение хронической формы вирусного гепатита В – формирование цирроза печени.
Существуют следующие стадии гепатита В:
- Инкубационный период. Продолжительность – от 2 до 6 месяцев, чаще – 12–15 недель, в течение которых в клетках печени происходит активная репликация вируса. После того, как количество вирусных частиц достигнет критического значения, появляются первые симптомы – заболевание переходит в следующую стадию.
- Продромальный период. Возникновение неспецифических признаков инфекционного заболевания (слабости, вялости, болей в мышах и суставах, отсутствия аппетита).
- Разгар. Появление специфических признаков (печень увеличивается в размерах, появляется желтушное окрашивание склер и кожных покровов, развивается интоксикационный синдром).
- Выздоровление (реконвалесценция) или переход заболевания в хроническую форму.
Клиническая картина гепатита В обусловлена нарушением оттока желчи (холестазом) и нарушением детоксикационной функции печени. У части пациентов заболевание сопровождается эндогенной интоксикацией, то есть отравлением организма продуктами нарушенного метаболизма, вызванного некрозом гепатоцитов. У других пациентов превалирует экзогенная интоксикация, возникающая в результате всасывания в кровоток токсинов, образующихся в кишечнике в процессе пищеварения.
При любом виде интоксикации в первую очередь страдает центральная нервная система. Клинически это проявляется появлением следующих церебротоксических симптомов:
- нарушение сна;
- повышенная утомляемость, слабость;
- апатия;
- нарушения сознания.
При тяжелых формах заболевания может развиться геморрагический синдром – периодически возникающие носовые кровотечения, повышенная кровоточивость десен.
Нарушение нормального оттока желчи становится причиной возникновения желтухи. При ее появлении происходит ухудшение общего состояния: усиливаются проявления астении, диспепсии, геморрагического синдрома, возникает мучительный кожный зуд. Кал осветляется, а моча, наоборот, темнеет и по цвету напоминает темное пиво.
На фоне нарастания желтухи происходит увеличение печени (гепатомегалия). Примерно в 50% случаев, помимо печени, увеличивается селезенка. Неблагоприятным прогностическим признаком считаются нормальные размеры печени при выраженной желтухе.
Продолжается желтушный период достаточно длительно, до нескольких месяцев. Постепенно состояние больных улучшается: исчезают явления диспепсии, регрессирует желтушная симптоматика, печень возвращается к нормальным размерам.
Примерно в 5–10% случаев вирусный гепатит В приобретает хроническое течение. Его признаки:
- слабовыраженная интоксикация;
- субфебрильная температура;
- стойкое увеличение печени;
- стойкое повышение активности печеночных трансаминаз и повышенный уровень билирубина.
Диагностика вирусного гепатита В проводится на основании выявления в сыворотке крови специфических антигенов вируса (HbeAg, HbsAg), а также обнаружения антител к ним (anti-Hbs, anti-Hbe, anti-Hbc IgM).
Оценить степень активности инфекционного процесса можно на основании результата количественной полимеразной цепной реакции (ПЦР). Этот анализ позволяет обнаружить ДНК вируса, а также произвести подсчет количества вирусных копий в единице объема крови.
По оценкам ВОЗ, в мире свыше 2 млрд человек инфицированы вирусом гепатита В, 75% населения земного шара проживает в регионах с высоким уровнем заболеваемости.
Для оценки функционального состояния печени, а также контроля динамики заболевания регулярно проводят следующие лабораторные тесты:
- биохимический анализ крови;
- коагулограмма;
- общий анализ крови и мочи.
Обязательно выполняют УЗИ печени в динамике.
При наличии показаний проводят пункционную биопсию печени с последующим гистологическим и цитологическим исследованием пунктата.
Острая форма заболевания является основанием для госпитализации пациента. Больному рекомендуют строгий постельный режим, обильное питье и соблюдение щадящей диеты (стол №5 по Певзнеру).
Проводится противовирусная терапия сочетанием интерферонов и рибавирином. Дозировки и длительность курса лечения определяются врачом индивидуально в каждом конкретном случае.
Для уменьшения выраженности интоксикационного синдрома осуществляют внутривенную инфузию растворов глюкозы, кристаллоидов, препаратов калия. Показано проведение витаминотерапии.
С целью устранения спазма желчевыводящих путей назначают спазмолитики. При появлении симптомов холестаза в схему терапии обязательно включают препараты урсодезоксихолевой кислоты (УДХК).
Терапия хронической формы гепатита В проводится противовирусными препаратами и преследует следующие цели:
- замедление или полное прекращение прогрессирования болезни;
- подавление репликации вируса;
- устранение фибротических и воспалительных изменений в ткани печени;
- предотвращение развития первичного рака печени и цирроза.
В настоящее время не существует единого общепринятого стандарта лечения вирусного гепатита B. Подбирая терапию, врач учитывает все факторы, оказывающие влияние как на течение заболевания, так и на общее состояние пациента.
Наиболее опасным осложнением гепатита В является печеночная кома (гепатаргия, острая печеночная недостаточность). Она возникает вследствие массированной гибели гепатоцитов, приводящей к значительным нарушениям функций печени, и сопровождается высоким показателем летальности.
На фоне печеночной комы нередко наблюдается присоединение вторичной инфекции с развитием сепсиса. Кроме того, гепатаргия часто влечет развитие острого нефротического синдрома.
Немаловажную роль в распространении заболевания играют потребители инъекционных наркотиков – около 80% наркоманов инфицированы вирусом гепатита В.
Геморрагический синдром может стать причиной внутренних кровотечений, иногда сильных, угрожающих жизни пациента.
Основное осложнение хронической формы вирусного гепатита В – формирование цирроза печени.
К летальному исходу острый вирусный гепатит В приводит редко. Прогноз ухудшается при микст-инфекции с вирусами гепатитов С, D, наличии сопутствующих хронических заболеваний гепатобилиарной системы, молниеносном течении заболевания.
При хронической форме гепатита В больные погибают через несколько десятков лет от момента начала заболевания в результате развития у них первичного рака или цирроза печени.
Общие меры профилактики заражения вирусным гепатитом В включают:
- использование одноразового медицинского инструментария;
- тщательный контроль стерильности многоразового инструментария;
- выполнение гемотрансфузий исключительно при наличии строгих показаний;
- отстранение от донорства людей, переболевших любой формой гепатита;
- использование только индивидуальных предметов личной гигиены (зубных щеток, бритв, маникюрных инструментов);
- отказ от употребления наркотиков;
- безопасный секс.
Лицам, входящим в группу повышенного риска инфицирования гепатитом В, рекомендуется вакцинация. Иммунитет после прививки сохраняется около 15 лет, затем для его поддержания необходима ревакцинация.
Видео с YouTube по теме статьи:
источник
Инфекция HBV – одна из самых распространённых вирусных инфекций человека. По данным ВОЗ, более 25% населения уже были инфицированы HBV (обнаружение антител к НВsAg) и от 5 до 10% являются его носителями (по HBsAg). HBV высокоустойчив к внешним воздействиям и сохраняет инфекциозность при: комнатной температуре – 3 месяца, в холодильнике – 6 месяцев, в замороженном виде и в высушенной плазме – 15-25 лет, при автоклавировании – в течение 30 мин и при стерилизации сухим паром – 60 минут.
Основным резервуаром вируса в природе являются здоровые вирусоносители (5% населения) и больные хроническим гепатитом (5%), у которых показатель инфицированности окружающих составляет 25-50% в зависимости от активности процесса. Вирус часто проникает через неповреждённые слизистые и небольшие повреждения кожи и момент заражения остаётся неизвестным.
1. Ведущее значение в распространении HBV имеют парентеральные пути заражения:
А) оперативные вмешательства, чаще малые (стоматологические), инъекционная терапия, наркоманы, акупунктуры, экстракорпоральные методы очищения крови;
Б) эндоскопические исследования;
В) медицинские работники хирургического профиля, имеющие контакт с кровью и её компонентами;
Г) переливание крови и её компонентов (реже эритромассы), препаратов факторов свёртывания;
Д) бытовые процедуры – татуировки, проколы ушных мочек, пирсинг, маникюр, бритьё.
2. Большое значение имеют естественные пути передачи инфекции:
А) передача вируса половым путём является основной причиной инфицирования, наиболее частой в возрасте 16-25 лет, когда вероятна смена сексуальных партнёров;
Б) вертикальная передача вируса матерью-вирусоносительницей своему плоду во время родов (интранатальный период), редко трансплацентарное инфицирование, что диктует необходимость пассивно-активной иммунизации новорожденных от матерей с метками репликации вируса;
В) возможно инфицирование в постнатальный период с молоком и слюной, поэтому для диагностики вирусных заболеваний печени необходимо выявление меток инфицирования вирусом и заболеваний печени у родителей.
Выше перечисленное делает целесообразным вакцинацию всех новорожденных в постнатальный период вне зависимости от инфицирования матери.
Вирус гепатита В относится к группе гепаднвирусов, то есть гепатотропных ДНК содержащих вирусов. HBV состоит из поверхностного (HBs), ядерного (HBc) антигенов и.
Ядерный антиген (HBcAg) представляет собой главный белок нуклеокапсида и содержит две циркулярные нити ДНК, одна из которых неполная, поэтому HBV не способен к прямой репликации ДНК. При попадании в цитоплазму клетки вирусная ДНК достраивается вирусной ДНК-полимеразой (становится полной — двухцепочечной) и проникает в ядро, где транслируется под действием клеточной РНК-полимеразы с образованием полных РНК-копий генома. Они в свою очередь кодируют синтез ДНК и белка капсида в ядре, а гликопротеидов оболочки – в цитоплазме, то есть происходит репликация вирусов, которые покидают клетку.
Полная ДНК вируса содержит ген С, который кодирует синтез нуклеокапсида. Ген С имеет два локуса (промотора): собственно ген с, запускающий транскрипцию HBcAg и ген пре-с, кодирующий транскрипцию белка, превращающегося в HBeAg – сигнальный пептид. HBcAg, содержащий ДНК и ДНК-полимеразу, остаётся в основном в ядрах гепатоцитов вне хромосом (экстрахромосомно), где его можно обнаружить в поражённых клетках (биоптаты, лейкоциты) и покидает гепатоциты только в виде частиц Дейна – вирус HBV, поэтому в свободном состоянии он в крови не обнаруживается. HBeAg – сигнальный пептид – растворим, поступает в кровь и является количественным показателем репликации вируса. Помимо крови, HBeAg и HBV-ДНК выявляются в слюне, моче и семенной жидкости у мужчин. Однако, нередко обнаруживается мутация генома вируса с исчезновением гена пре-с, в связи с чем репликация вируса может продолжаться при прекращении продукции HBeAg, снижая информативность его отсутствия. Существует мнение, что HBe-отрицательные мутанты вызывают более агрессивное течение острого и хронического гепатитов и плохо поддаются лечению интерфероном.
Антитела к HBсAg (НВcAb) обнаруживаются приблизительно одновременно с цитолизом (его вызывают). НВcAb из класса иммуноглобулинов М свидетельствуют о репликации вирусов и длительное их сохранение (свыше 6 месяцев) предполагает хронизацию. НВcAb из класса иммуноглобулинов G могут сохраняться в течение многих лет после острого гепатита и у всех носителей, не свидетельствуя об активности процесса. HBeAb определяются в свободном состоянии после исчезновения НВeAg, что свидетельствует о прекращении репликации вируса и рассматривается как благоприятная иммунологическая динамика — обычно развивается длительная ремиссия хронического гепатита. HBeAb в составе иммунных комплексов играют большую роль в развитии васкулитов (гломерулонефрит, узелковый периартериит).
Внешняя оболочка вируса обозначается как НВsAg. Синтез белков оболочки вируса кодируется геном S, в котором выделяют 3 локуса: собственно ген S, при трансляции которого образуется главный белок оболочки и гены пре-S 1 и 2, кодирующих синтез прикрепительных белков. Прикрепительные белки (S1 и S2) участвуют в распознавании вируса рецепторами гепатоцитов и адгезии его на их поверхности. Они стимулируют образование вирусонейтрализующих антител (НВsAb), что используется при вакцинации. НВsAg определяется в плазме гепатоцитов, а также практически во всех биологических жидкостях: крови, сперме, вагинальной секрете, моче, слюне, желчи, грудном молоке, асцитической, синовиальной и спинномозговой жидкости. Он выявляется при остром гепатите и исчезает при реконвалесценции (через 3-6 месяцев). Сохранение его свыше 6 месяцев предполагает хронизацию процесса. У небольшой части он остаётся на долгие годы (фаза интеграции).
Антитела к HBsAg (HBsAb) обнаруживаются после исчезновения HBsAg, обычно сохраняются до конца жизни и имеют протективное действие, блокируя прикрепительный белок и проникновение вируса в клетку при реинфекции. HBsAb выявляются у 20-25% населения, свидетельствуя о перенесённом контакте с вирусом, реконвалесценции и стойком иммунитете, что не требует вакцинации. В настоящее время HBsAb появляются после вакцинации (рекомбинантный НВsAg), обеспечивая посредством блокады прикрепительного белка оболочки вируса поствакционный иммунитет, более стойкий у детей и менее – у взрослых (5-10 лет). Уровень HBsAb в этом случае определяет сроки ревакцинации. При изолированном НВsAg-носительстве (стадия интеграции) сферические и нитевидные частицы, состоящие только из белков внешней оболочки, содержат значительно меньше прикрепительных белков, чем в полных вирионах, поэтому в этом случае возможно выявление низкоаффинных антител к НВsAg в небольшом титре, не обладающих протективным действием и не препятствующих реинфекции и рецидиву.
При заражении НВV выделяют два типа процесса – репликация (размножение) и интеграция (встраивание) фрагментов ДНК вируса в геном клетки.
1. Репликация. При попадании HBV в кровь он прикрепляется к оболочке гепатоцита посредством прикрепительного белка (пре-S), что обуславливает его проникновение в клетку. Происходит трансляция с локусов ДНК вируса генов C и S на транскрипционную РНК с последующими репликацией вирусного генома и синтезом вирусных белков посредством клеточных ферментов. В ядрах гепатоцитов происходит репликация ДНК вируса, синтез HBcAg, а в цитоплазме – НВsAg. Установлен факт репликации вируса и вне печени: в клетках крови (лимфоциты, макрофаги), костном мозге, лимфоузлах, селезёнке, эндотелии, экзокринных (слюнные, молочные, поджелудочная) и эндокринных железах, почках, коже, сперматозоидах. Следовательно, доказательством репликации вируса, обуславливающей цитолиз, является обнаружение в крови HBV-ДНК (количественный метод), НВeAg (качественный метод), НВcAb из иммуноглобулинов М или НВcAg и HBV-ДНК в биоптатах и лейкоцитах.
2. Интегративный процесс лежит в основе антигеноносительства и персистенции вирусной инфекции при ХГ. Интеграции вируса всегда предшествует репликация. Судить о наличии интеграции при репликации с присутствием всех антигенных детерминант не представляется возможным. Она устанавливается лишь при прекращении репликации вируса и связанного с ней цитолиза. Интеграция обнаруживается чаще при длительной виремии, в связи с чем её вероятность увеличивается при затяжном течении (10% ежегодно). При интеграции происходит встраивание фрагментов ДНК вируса в ДНК клетки — такое состояние обозначается как хромосомное или интегральное. Фрагменты ДНК вируса (гены C и S) встраиваются в различные участки ДНК клетки дискретно. В этом случае полных форм вируса, способных к размножению (цитолизу) нет, но клеточная ДНК включает в себя информацию о репродукции структур вируса. То есть в стадии интеграции сохраняется риск инфицирования, когда интегрированная ДНК, попав вместе с клетками (лейкоциты, трансплантат) в организм реципиента, служит программой его репродукции.
Интеграция может быть представлена в двух вариантах:
А) трансляционный тип – происходит растормаживание (экспрессия) лишь встроенного гена S с его считкой (трансляций) на транскрипционную РНК и изолированным синтезом в цитоплазме клетки НВsAg с последующим поступлением его в кровь – НВs-антигенемия в виде сферических и нитевидных частиц. Возможно выявление в малом титре низкоаффинных антител к НВsAg, не обладающих протективным действием.
Б) нетрансляционный тип, когда в ДНК гепатоцитов не происходит экспрессии, а следовательно и трансляции интегрированных вирусных генов и в крови отсутствуют маркёры вируса, но в клеточном геноме обнаруживается интегрированная вирусная ДНК. Это определяет возможность инфицирования при переливании крови, её производных и при пересадке органов с отсутствием НВsAg.
Частотная характеристика перехода острого HBV–гепатита в хронический зависит от возраста. У новорожденных инфицирование чаще протекает бессимптомно, но и часто переходит в вирусоносительство (HBs-антигенемия) или в хроническую форму. У молодых, как правило, наблюдается развёрнутая клиническая картина (защитный цитолиз при нормальном иммунитете) с редким переходом в хронический. У взрослых и пожилых хронизация чаще. Особенно ухудшают прогноз сопутствующие заболевания и интоксикации (этанол, наркотики). Таким образом, хронический HBV–гепатит чаще развивается без указаний на острый. Реже – после острого.
Полная элиминация вируса (выздоровление) с исчезновением НВsAg и последующим иммунитетом (HBsAb) происходит у 85-90% инфицированных. HBs-антигенемия сохраняется в течение нескольких лет у 5%, а у 5-10% инфицированных – пожизненно. Дефекты гуморального (снижение продукции интерферона) и клеточного (ингибиция ответа лимфоцитов на интерферон) иммунитета ответственны на неспособность организма быстро элиминировать вирус, что способствует его интеграции и переходу острого гепатита в вирусоносительство или хронический. Существенную роль в хронизации гепатита B и его обострениях играют мутантные формы HBV, которые позволяют избегать иммунного надзора организма. Так появление HBe-отрицательных мутантов в течение 2 лет отмечено у 40% больных ХГ.
Антигеноносительство чаще наблюдается при бессимптомных и субклинических формах острого HBV–гепатита, так как меньшая выраженность иммунной защиты определяет и меньший защитный цитолиз: грудные дети, перенесшие HBV-инфекцию становятся HBs-носителями в 90% случаев, дети — в 20-30% и взрослые – в 5-10% случаев.
Большая частота бессимптомного HBs-носительства (более 1-2% населения Европы, США, 5% — в России и до 20% в Азии, Африке, Латинской Америке) требует разграничения так называемого здорового носительства от персистирующей HBV-инфекции – хронического гепатита в стадии ремиссии. К здоровым HBs-носителям ошибочно относят до 40% больных с хроническим гепатитом, поэтому все HBs-положительные, а также лица с цитолитическим и иммунновоспалительным синдромами должны подвергаться детальному обследованию, включая пункционную биопсию печени. Выявление иммунных (лимфо-макрофагальных) портальных и перипортальных инфильтратов свидетельствует о хронизации гепатита. У «здоровых» HBs-носителей в биоптатах печени могут выявляться изменения от минимальных до цирроза печени. Так у доноров с HBs-антигенемией в 2% случаев обнаружены морфологические признаки хронического гепатита.
Предполагается периодическая сменяемость фаз интеграции (ремиссии) и репликации (рецидива). В ряде случаев можно всё-таки выявить репликацию вируса в клетке современными высокочувствительными методами. Кроме того, понятие здорового вирусоносительства условно. Переход фазы интеграции в репликацию происходит вследствие активации (экспрессии) генома клетки при регенераторных процессах, сопровождающих повреждения печени при экзогенных (этанол) и эндогенных интоксикациях, а также при приёме гепатопротекторов. В этом случае дополнительно к экспрессии гена S происходит растормаживание всех локусов ДНК вируса, включая ген С, их трансляция на РНК с внутриклеточной репродукцией вирусных частиц и переходом в стадию репликации – рецидива. Возможна спонтанная сменяемость фаз. Аналогичной программой репродукции вируса в организме реципиента служит его ДНК, интегрированная в клетки крови или трансплантата донора. Переход интеграции в репликацию сопровождается цитолизом (как при остром HBV-гепатите).
Внепечёночные проявления HBV-инфекции, по-видимому, имеют иммуннокомплексную природу. Отложения ЦИК, состоящие из вирусных антигенов, антител к ним и комплемента выявляются в клубочках (гломерулонефрит), в мелких и средних артериях (узелковый периартериит). Кроме того, распространённое вирусное инфицирование ведёт к перемещению в поражённые органы лимфо-макрофагальных элементов с формированием лимфо-, плазмо-, моно-, гистиоцитарных инфильтратов, отражающих генерализацию иммунно-воспалительного синдрома. Реже встречается доказанное индуцирование вирусами гепатита B аутоагрессивных реакций вследствие инфицирования ими лимфо-макрофагальной системы (в частности Т-супрессоров) с приобретённым снижением толерантности к аутоантигенам.
Существенную роль в хронизации гепатита В и его обострениях играют мутантные формы HBV, которые позволяют избегать иммунного надзора организма. Так появление HBe-отрицательных мутантов в течение 2 лет обнаружено у 40% больных хроническим гепатитом.
Наличие вирусоносительства, даже в стадии интеграции, повышает риск развития гепатоцеллюлярной карциномы (первичного рака печени) в 5-10 раз.
Не нашли то, что искали? Воспользуйтесь поиском:
источник
В патогенезе гепатита В можно выделить несколько ведущих звеньев патогенетической цепи:
- внедрение возбудителя — заражение;
- фиксация на гепатоците и проникновение внутрь клетки;
- размножение вируса и «выталкивание» его на поверхность гепатоцита, а также в кровь;
- включение иммунологических реакции, направленных на элиминацию возбудителя;
- иммунокомплексное поражение органов и систем;
- формирование иммунитета, освобождение от возбудителя, выздоровление.
Поскольку заражение при гепатите В всегда происходит парентеральным путем, можно считать, что момент инфицирования практически равнозначен проникновению вируса в кровь. Попытки некоторых исследователей выделять при гепатите В энтеральную и региональную фазу малообоснованы. Больше оснований считать, что с током крови вирус сразу попадает в печень.
Тропизм вируса гепатита В к ткани печени предопределен наличием в составе НВsАg специального рецептора — полипептида с молекулярной массой 31 000 Да (РЗ1), обладающего альбумин связывающей активностью. Аналогичная зона альбумина находится и на мембране гепатоцитов печени человека и шимпанзе, чем по существу и определяется тропизм НВV к печени человека и шимпанзе.
При проникновении вируса внутрь гепатоцита происходит высвобождение вирусной ДНК, которая, попадая в ядро гепатоцита и исполняя роль матрицы для синтеза нуклеиновых кислот, запускает ряд последовательных биологических реакций, чьим итогом становится сборка нуклеокапсида вируса. Нуклеокапсид мигрирует через ядерную мембрану в цитоплазму где и происходит окончательная сборка частиц Дейна — полного вируса гепатита В.
Следует, однако, отметить, что при заражении гепатоцита процесс может пойти двумя путями — репликативным и интегративным. В первом случае развивается картина острого или хронического гепатита, а во втором — вирусоносительство.
Причины, предопределяющие два вида взаимодействия вирусной ДНК и гепатоцита, точно не установлены. Вероятнее всего, тип реагирования генетически детерминирован.
Итогом репликативного взаимодействия становятся сборка структур коровского антигена (в ядре) и сборка полного вируса (в цитоплазме) с последующей презентацией полного вируса или его антигенов на мембране или в структуре мембраны гепатоцитов.
Принято считать, что репликация вируса не приводит к поражению клетки на уровне гепатоцита, поскольку вирус гепатита В не обладает цитопатическим действием. Это положение нельзя считать бесспорным, так как оно основывается на экспериментальных данных, которые, хотя и свидетельствуют об отсутствии цитопатического действия вируса гепатита В, но получены на культурах тканей и поэтому не могут быть полностью экстраполированы на вирусный гепатит В у человека. Во всяком случае, вопрос об отсутствии поражения гепатоцитов в ходе репликативной фазы нуждается в дополнительном изучении.
Однако, независимо от характера взаимодействия вируса с клеткой, в дальнейшем печень обязательно включается в иммунопатологический процесс. При этом поражение гепатоцитов связано с тем, что в результате экспрессии вирусных антигенов на мембране гепатоцитов и выхода вирусных антигенов в свободную циркуляцию происходит включение цепи последовательных клеточных и гуморальных иммунных реакций, направленных в конечном итоге на удаление вируса ил организма. Этот процесс осуществляется в полном соответствии с общими закономерностями иммунного ответа при вирусных инфекциях. Для элиминации возбудителя включаются клеточные цитотоксические реакции, опосредованные различными классами клеток-эффекторов: К-клеток, Т-клеток, естественных киллеров, макрофагов. В ходе этих реакций происходит разрушение инфицированных гепатоцитов, что сопровождается высвобождением вирусных антигенов (НВсАg, НВeАg, НВsАg), запускающих систему антителогенеза, вследствие чего в крови накапливаются специфические антитела, прежде всего к коровому — анти-НВс и е-антигену — анти-НВЕ. Следовательно, освобождение печеночной клетки от вируса происходит в процессе ее гибели за счет реакций клеточного цитолиза.
Одновременно с этим накапливающиеся в крови специфические антитела связывают антигены вируса, образуя иммунные комплексы, фагоцитируемые макрофагами и выделяющиеся почками. При этом могут возникать различные иммунокомплексные поражения в виде гломерулонефрита, артериита, артралгий, кожных высыпаний и др. С участием специфических антител происходит очищение организма от возбудителя и наступает полное выздоровление.
В соответствии с изложенной концепцией патогенеза гепатита В все многообразие клинических вариантов течения болезни принято объяснять особенностями взаимодействия вируса и кооперацией иммунокомпетентных клеток, иначе говоря, силой иммунного ответа на присутствие вирусных антигенов. По современным представлениям, сила иммунного ответа генетически детерминирована и сцеплена с антигенами гистосовместимости локуса НLA первого класса.
Принято считать, что в условиях адекватного иммунного ответа на антигены вируса клинически развивается острый гепатит с циклическим течением и полным выздоровлением. На фоне снижения иммунного ответа к антигенам вируса иммуноопосредованный цитолиз выражен незначительно, поэтому не происходит эффективной элиминации инфицированных клеток печени, что приводит к слабовыраженным клиническим проявлениям с длительной персистенцией вируса и, возможно, развитию хронического гепатита. При этом, наоборот, в случае генетически детерминированною сильного иммунного ответа и массивности инфицирования (гемотрансфузии) возникают обширные зоны поражения печеночных клеток, чему клинически соответствуют тяжелые и злокачественные формы болезни.
Представленная схема патогенеза гепатита В отличается стройностью, тем не менее в ней имеется ряд спорных и малоисследованных моментов.
Если следовать концепции гепатита В как иммунопатологического заболевания, можно было бы ожидать усиления реакций клеточной цитотоксичности с нарастанием тяжести заболевания. Однако, при тяжелых формах показатели клеточного звена иммунитета резко снижены, в том числе отмечается многократное падение, по сравнению с таковыми у здоровых детей, и показателя К-клеточной цитотоксичности. При злокачественной форме в периоде развития массивного некроза печени и особенно печеночной комы отмечается полная неспособность лимфоцитов к бластной трансформации под влиянием фитогематтлютинина, стафилококкового эндотоксина и НВsAg. Кроме того, отсутствует способность лейкоцитов к миграции по данным реакции торможения миграции лейкоцитов (РТМЛ), и выявляется резкое увеличение проницаемости мембран лимфоцитов по результатам исследований их с помощью флюоресцентного зонда тетрациклина.
Так, если показатели флюоресценции лимфоцитов здоровых людей составляют 9,9±2%, а при типичном гепатите В с доброкачественным течением они повышаются до 22,3±2,7%, то при злокачественных формах число флюоресцирующих лимфоцитов достигает в среднем 63,5±5,8%. Поскольку повышение проницаемости клеточных мембран однозначно оценивается в литературе как достоверный показатель их функциональной неполноценности, можно заключить, что при гепатите В, особенно при злокачественной форме, возникает грубое повреждение лимфоцитов. Об этом же свидетельствуют и показатели К-клеточной цитотоксичносги. При тяжелой форме на 1-2-й неделе заболевания цитотоксичность составляет 15,5±8,8%, а при злокачественной форме на 1-й неделе — 6.0±2,6, на 2-й — 22.0±6,3% при норме 44,8±2,6%.
Представленные данные однозначно свидетельствуют о выраженных нарушениях в клеточном звене иммунитета у больных с тяжелыми формами гепатита В. Очевидно также, что эти изменения возникают вторично, в результате поражения иммунокомпетентных клеток токсическими метаболитами и, возможно, циркулирующими иммунными комплексами.
Как показали исследования, у больных с тяжелыми формами гепатита В, особенно в случае развития массивного некроза печени, в сыворотке крови происходит падение титра HВsАg и НВeАg и одновременно начинают обнаруживаться в высоких титрах антитела к поверхностному антигену, что совершенно нехарактерно для доброкачественных форм болезни, при которых анти-НВV появляются лишь на 3-5-м месяцев болезни.
Быстрое исчезновение антигенов вируса гепатита В при одновременном появлении высоких титров противовирусных антител позволяет предполагать интенсивное образование иммунных комплексов и возможное их участие в патогенезе развития массивного некроза печени.
Таким образом, фактические материалы не позволяют однозначно трактовать гепатит В только с позиций иммунопатологической агрессии. И дело не только в том, что при этом не обнаруживается связи между глубиной и распространенностью морфологических изменений в печени, с одной стороны, и выраженностью клеточных факторов иммунитета — с другой. Теоретически это обстоятельство можно было бы объяснить поздними сроками исследования показателей клеточного иммунитета, когда иммунокомпетентные клетки подверглись мощному токсическому воздействию в связи с нарастающей функциональной недостаточностью печени. Можно, конечно, допустить, что иммунный цитолиз гепатоцитов происходит на самых ранних этапах инфекционного процесса, возможно, еще до появления клинических симптомов тяжелого поражения печени. Однако такое предположение маловероятно, поскольку у больных с острейшим (молниеносным) течением болезни выявлялись аналогичные показатели клеточного иммунитета и, кроме того, при морфологическом исследовании ткани печени не обнаруживалось массивной лимфоцитарной инфильтрации, в то же время выявлялись сплошные поля некротизированного эпителия без явлений резорбции и лимфоцитарной агрессии.
Объяснить морфологическую картину при остром гепатите только с позиций иммунного клеточного цитолиза весьма сложно, поэтому в ранних работах не исключали цитотоксическое действие вируса гепатита В.
В настоящее время это предположение нашло частичное подтверждение благодаря открытию вируса гепатита В. Как показали исследования, частота обнаружения маркеров гепатита D находится в прямой зависимости от тяжести заболевания: при легкой форме они обнаруживаются у 14%, среднетяжелой — у 18, тяжелой — 30, злокачественной — у 52% больных. Учитывая, что вирус гепатита D обладает некрозогенным цитопатическим эффектом, можно считать установленным, что в развитии фульминантных форм гепатита В большое значение имеет коинфекция вирусами гепатита В и D.
Патогенез гепатита В можно представить следующим образом. После проникновения вируса гепатита В в гепатоциты индуцируется иммунологическая атака на инфицированные гепатоциты Т-киллеров, выделяющих лимфотоксины в направлении печеночных клеток.
Интимные механизмы поражения гепатоцигов при гепатите В до настоящего времени не установлены. Ведущую роль играют активированные процессы перекисного окисления липидов и лизосомальные гидролазы. Пусковым моментом могут быть лимфотоксины, высвобождающиеся из эффекторных клеток при их контакте с гепатоцитами, но не исключено, что инициатором процессов переоксидации может выступать и сам вирус. В дальнейшем патологический процесс вероятнее всего развивается в следующей последовательности.
- Взаимодействие фактора агрессии (лимфотоксины или вирус) с биологическими макромолекулами (возможно, с компонентами мембран эндоплазматической сети, способными принимать участие в процессах детоксикации, по аналогии с другими повреждающими агентами, как это было показано по отношению к четыреххлористому углероду).
- Образование свободных радикалов, активация процессов перекисного окисления липидов и повышение проницаемости всех гепатоцеллюлярных мембран (синдром цитолиза).
- Движение биологически активных веществ по градиенту концентрации — потеря ферментов различной внутриклеточной локализации, донаторов энергии, калия и др. Накопление в клетках натрия, кальция, сдвиг pH в сторону внутриклеточного ацидоза.
- Активация и выход лизосомальных гидролаз (РНК-аза, ДНК-аза, катепсины и др.) с распадом печеночной клетки и высвобождением аутоантигенов.
- Стимуляция Т- и В-систем иммунитета с формированием специфической сенсибилизации Т-лимфоцитов к печеночному липопротеину, а также образование противопеченочных гуморальных аутоантител.
В предложенной схеме патогенеза гепатита В в качестве пускового фактора выступают вирусные антигены, чья интенсивная продукция наблюдается на самых ранних этапах заболевания и весь острый период, за исключением злокачественных форм, при которых продукция вирусных антигенов практически прекращается в момент развития массивного некроза печени, что и предопределяет быстрое снижение репликации вируса.
Очевидно также, что вирусные антигены активируют Т- и В-системы иммунитета. В ходе этого процесса возникает характерное перераспределение субпопуляций Т-лимфоцитов, направленное на организацию адекватного иммунного ответа, элиминацию инфицированных гепатоцитов, нейтрализацию вирусных антигенов, саногенез и выздоровление
При взаимодействии иммунокомпетентных клеток с вирусными антигенами на мембранах гепатоцитов или в ходе репродукции вируса внутри гепатоцита, возникают условия для активации процессов перекисного окисления липидов, управляющий как известно, проницаемостью всех клеточных и субклеточных мембран,
С этих позиций становится понятным столь закономерное и в высшей степени характерное для вирусных гепатитов возникновение синдрома цитолиза — повышенной проницаемости клеточных мембран
Конечным исходом синдрома цитолиза может быть полное разобщение окислительного фосфорилирования, истечение материала клетки, гибель печеночной паренхимы.
Однако в подавляющем большинстве случаев эти процессы не приобретают столь фатального развития. Только при злокачественных формах болезни патологический процесс протекает лавинообразно и необратимо, поскольку возникают массивное заражение, выраженный иммунный процесс, чрезмерная активация процессов переоксидации и лизосомальных гидродаз, явления аутоиммунной агрессии.
Эти же механизмы наблюдаются и при благоприятном течении гепатита В, с той лишь особенностью, что все они реализуются на качественно ином уровне. В отличие от случаев массивного некроза печени, при благоприятном течении болезни количество инфицированных гепатоцитов, а следовательно, зона иммунопатологического цитолиза меньше, процессы перекисного окисления липидов усиливаются не столь значительно, активация же кислых гидролаз приводит лишь к ограниченному аутолизу с несущественным высвобождением аутоантигенов, а следовательно, без массивной аутоагрессии, то есть все этапы патогенеза при благоприятном течении осуществляются в рамках сохраняющейся структурной организации паренхимы печени и сдерживаются защитными системами (антиоксиданты, ингибиторы и др.) и поэтому не имеют столь разрушительного действия.
Причины возникновения симптомов интоксикации при вирусных гепатитах исследованы не до конца. Предложение различать так называемую первичную, или вирусную, интоксикацию и вторичную (обменную, или метаболическую) можно считать позитивным, хотя это не раскрывает интимного механизма возникновения общетоксического синдрома. Во-первых, вирусы гепатитов не обладают токсическими свойствами, а, во-вторых, концентрация многих метаболитов далеко не всегда коррелирует с тяжестью заболевания и степенью выраженности симптомов токсикоза. Известно также, что и концентрация вирусных антигенов строго не коррелирует с тяжестью интоксикации. наоборот, с увеличением тяжести заболевания, а следовательно, нарастания степени токсикоза, концентрация НВsАg снижается и бывает самой низкой при злокачественных формах в момент возникновения глубокой печеночной комы. Вместе с тем частота обнаружения и титры специфических противовирусных антител прямо зависят от тяжести заболевания.
Интоксикация появляется не в момент регистрации вирусных антигенов, а в периоде циркуляции в крови противовирусных антител класса IgМ к коровскому антигену и антигену системы E. Более того, при тяжелых и особенно злокачественных формах у значительной части больных в крови появляются даже анти-НВs, чего обычно никогда не наблюдается при легких и среднетяжелых формах болезни.
Представленные данные дозволяют заключить, что синдром токсикоза при вирусных гепатитах, и гепатите В в частности, не возникает в результате появления в крови вирусных антигенов, а становится следствием взаимодействия вирусных антигенов с противовирусными антителами класса IgМ. Результат такого взаимодействия, как известно, — образование иммунных комплексов и, возможно, активных токсичных веществ.
Симптомы интоксикации возникают в момент появления в свободной циркуляции иммунных комплексов, но в дальнейшем такой корреляции не прослеживается.
Частичное объяснение этому можно найти при исследовании состава иммунных комплексов. У больных с тяжелыми формами в крови циркулируют преимущественно комплексы среднего размера, а в их составе на высоте токсического синдрома преобладают антитела класса тогда как в периоде спада клинических проявлений и реконвалесценции комплексы становятся более крупными, а в их составе начинают преобладать антитела класса IgG.
Представленные данные касаются механизмов развития токсического синдрома в начальном периоде заболевания, но при токсикозе, возникающем на высоте клинических проявлений, они имеют лишь частичное значение и особенно — при развитии печеночной комы.
Методом гемокультур удалось показать, что при гепатите В в крови постоянно накапливаются токсины, высвобождающиеся из пораженной распадающейся печеночной ткани. Концентрация этих токсинов пропорциональна тяжести заболевания,они имеют белковую природу.
В периоде реконвалесценции в крови появляются антитела к этому токсину; но в случае возникновения печеночной комы концентрация токсина в крови резко возрастает, а антитела в крови не обнаруживаются.
источник