Важную часть обследования ребенка с лихорадкой неустановленного происхождения составляют правильно проведенные лабораторные исследования.
Если не назначить вовремя необходимые лабораторные исследования, можно опоздать с постановкой правильного диагноза. В то же время ненужные лабораторные тесты связаны с лишними материальными затратами, дискомфортом больного, а иногда и с определенным риском для него. По данным Lohr, лабораторные методы, включая рентгенографию, помогли в постановке правильного диагноза у 31 из 54 детей с лихорадкой неустановленного происхождения.
Лабораторные исследования должны назначаться обоснованно и логично. В первую очередь следует проводить те пробы, которые вероятнее всего дадут положительные результаты. Диагностические процедуры, сопровождающиеся значительным риском для ребенка, следует отложить до тех пор, пока не будет проведено предварительное наблюдение и другие лабораторные методы не окажутся бесполезными.
Необходимо учитывать стоимость каждого исследования, но при этом следует помнить, что каждый дополнительный день госпитализации может стоить больше, чем несколько лабораторных тестов.
Диагностические тесты по возможности следует назначать с учетом анамнестических данных, результатов физикального обследования или показателей предварительных лабораторных исследований. Однако при недостатке клинических данных для точного определения объема лабораторного обследования разумно провести серию доступных тестов, разделенных на этапы, или стадии, причем каждый последующий этап следует осуществлять после получения результатов предыдущего.
Предлагаемую ниже схему нужно рассматривать лишь как общее руководство для таких ситуаций и не обязательно жестко придерживаться ее при диагностике всех случаев лихорадки неустановленного происхождения.
Первый этап анализов при лихорадке неустановленного происхождения:
— Общий анализ крови (ОАК)
— Скорость оседания эритроцитов (СОЭ)
— Общий анализ и посев мочи
— Туберкулиновая кожная проба
— Рентгенография органов грудной клетки
— Противоточный иммуноэлектрофорез (ПИЭФ)
— Посев крови
Спинномозговая пункция (проводится в зависимости от таких факторов, как возраст ребенка, длительность и величина лихорадки, клиническая картина заболевания).
Как только поставлен рабочий диагноз лихорадки неустановленного происхождения, эту начальную группу лабораторных тестов необходимо выполнить как можно быстрее либо в поликлинических условиях, либо сразу же при поступлении больного в стационар. Если вероятность наличия гнойной инфекции очень мала, то можно обойтись без ПИЭФ.
Повышенная СОЭ хотя и не имеет большого дифференциально-диагностического значения, тем не менее является важным показателем развития воспалительного процесса. Кроме того, если у ребенка СОЭ повышена, то маловероятно, что причиной этого являются тепловые заболевания (гипертиреоз и т. д.) или ложная лихорадка. Повышение СОЭ отмечается более чем у 75% детей при лихорадке неустановленного происхождения, вызванной новообразованиями или заболеваниями соединительной ткани.
Спинномозговая пункция необходима у детей грудного возраста с лихорадкой неустановленного происхождения, особенно если лихорадка сохраняется в течение нескольких недель. Feigin показал, что в 20 из 63 случаев у детей при лихорадке неустановленного происхождения были выявлены изменения в ликворе, характерные для инфекционного процесса, при полном отсутствии каких-либо аменингеальных симптомов. Но автор не привел ни возраст своих больных, ни длительность лихорадки.
Необходимо произвести посев крови на стерильность для выявления как аэробной, так и анаэробной флоры. При этом особое внимание следует уделить тщательному соблюдению стерильности. Если больной получает антибиотики, то в культуру крови нужно ввести вещества, разрушающие эти антибиотики.
Второй этап анализов при лихорадке неустановленного происхождения:
— Посевы крови (повторные, множественные и включающие специальные среды)
— Исследование мазка крови на наличие микроорганизмов
— Посев кала
— Спинномозговая пункция (если не была выполнена ранее)
— Рентгенография органов грудной клетки (повторить, если предыдущие результаты были отрицательными)
— ПИЭФ (если не был выполнен ранее)
— OAK (повторно)
— СОЭ (повторно)
— Белки сыворотки крови
— Биохимическое исследование печени
— Антинуклеарные антитела
— Офтальмологическое обследование с помощью щелевой лампы и непрямой ретиноскопии
— Титр сывороточных антител против возбудителей сальмонеллеза, туляремии, орнитоза, трихиноза, бруцеллеза, токсоплазмоза, лихорадки Ку, гистоплазмоза, кокцидиоидомикоза
— Антигены сывороточного гепатита — Сканирование печени и селезенки — Галлиевая сцинтиграфия
— Ультразвуковое обследование брюшной полости (не обязательно)
Некоторые тесты необходимо провести повторно. ОАУ и СОЭ следует повторять каждые 5—7 дней, даже при ранее нормальных показателях.
Туберкулиновую пробу следует повторно провести через 10—14 дней после первого отрицательного результата; если он снова окажется отрицательным, то необходимо взять большее по концентрации разведение очищенного туберкулина. Следует провести многократные посевы достаточно большого количества крови для выявления как аэробных, так и анаэробных возбудителей.
При необходимости нужно использовать специальные среды для микроорганизмов, таких, как лептоспиры и спириллиум. Необходимо повторить рентгенографию органов грудной клетки, если последний снимок сделан более 5 дней назад. По данным Feigin, у 5 больных с ранее нормальной рентгенограммой органов грудной клетки при повторном исследовании были обнаружены выраженные рентгенологические изменения.
Такие методы исследования, как сканирование печени и селезенки, ультразвуковое исследование брюшной полости, галлиевая сцинтиграфия всего тела, чаще дают дополнительные сведения и редко имеют решающее значение в диагностике. Один такой метод может помочь обнаружить патологические изменения, не выявленные другим.
Указанные выше тесты позволяют обнаружить внутрибрюшные, забрюшинные, внутрипеченочные и внутригрудные образования, такие, как опухоли, лимфоузлы или абсцессы. Они могут выявить скрытый остеомиелит. Область применения этих современных методов исследования у детей с лихорадкой неустановленного происхождения пока не определена. При отсутствии специфических симптомов их ценность довольно низка, но все же они позволяют получить информацию, которую трудно добыть любыми другими неинвазивными методами.
Habibian показал, что галлиевая сцинтиграфия всего тела у взрослых — чувствительный метод при лихорадке неустановленного происхождения, поскольку он получил с его помощью положительные результаты у 17 из 22 больных. По данным Quinn, компьютерная томография (КТ) брюшной полости позволила обнаружить специфические патологические процессы (абсцесс, опухоль, гематома и пр.) у 23 из 78 взрослых больных с лихорадкой неустановленного происхождения, а неспецифические изменения (ге-патомегалия или спленомегалия) еще у 8 больных.
Хотя обе эти работы показывают, что сканирование дает полезную, а подчас и определяющую информацию, они не содержат материалов о том, как часто эти методы исследования дают положительные результаты при отсутствии клинических признаков или симптомов заболевания.
Третий этап анализов при лихорадке неустановленного происхождения:
— Обзорная рентгенография костей
— Сканирование костей с помощью технеция
— Рентгенография придаточных пазух носа
— Клизма с барием
— Рентгенография верхних отделов желудочно-кишечного тракта и тонкого кишечника
— Пункция костного мозга
— КТ брюшной полости
— Внутривенная пиелография
— Эхокардиография
— Биопсия печени
Данные методы объединены в эту группу либо из-за их малой эффективности при обследовании больных без специфических симптомов, либо ввиду их инвазивности (в том числе и. значительной лучевой нагрузки).
Если сканирование с галлием ранее дало отрицательные результаты, то маловероятно, что сканирование костей с использованием технеция или обычная рентгенография окажутся полезными. Рентгенография придаточных пазух носа и внутривенная пиелография имеют низкую диагностическую ценность при обследовании больных без соответствующих клинических проявлений, а рентгенологическое исследование тонкого и толстого кишечника связано со значительным радиационным воздействием.
Диагностическое значение чрескожной биопсии печени у детей при лихорадке неустановленного происхождения без признаков гепатомегалии не определено, но, вероятно, очень мало. Даже у взрослых число положительных результатов незначительно. По материалам Mitchell, чрескожная биопсия оказала помощь при постановке диагноза у 6 из 43 взрослых с лихорадкой неустановленного происхождения, но у всех 6 больных имелись некоторые нарушения функции печени, а у 4 из них была гепатомегалия.
Аспирированный костный мозг необходимо не только подвергнуть микроскопическому исследованию, но и произвести его посев на наличие пиогенных бактерий, микобактерий, грибов и вирусов.
Эхокардиография позволяет диагностировать эндокардит, миокардит, миксому предсердия.
Роль таких методов исследования, как биопсия лимфатических узлов, лимфоангиография и диагностическая лапаротомия, настолько мала, а сами исследования столь инвазивны, что при обследовании детей с лихорадкой неустановленного происхождения эти тесты не используются. Исключение составляют те ситуации, когда имеются четкие клинические или лабораторные показания к их проведению.
В настоящее время на смену этим инвазивным методам приходят радиологические тесты и методы сканирования, упомянутые в первой и второй группе лабораторных исследований.
источник
Посев крови – метод бактериологического исследования, использующийся для достоверного определения наличия бактерий в крови.
Посев используют для выявления в ней различных микроорганизмов приходится делать при многих заболеваниях. Посев крови осуществляют для обособленности, чтобы идентифицировать болезнетворных бактерий при бактериемии.
Бактериемия — это проникновение бактерий в кровь при генерализации инфекции в организме человека, заражении крови (сепсис). Данный вид анализа проводится в лабораториях медицинских учреждений.
Делают посев крови на жидкие питательные среды:
- желчный бульон,
- сахарный бульон,
- жидкие и полужидкие среды для выращивания микробов анаэробов.
Для обнаружения микроорганизмов требуется несколько анализов не менее 3, так как количество бактерий в крови может колеблется.
Определенные виды бактерий можно выделить только специальными бактериологическими посевами (бак посев) крови.
Бак посев крови показывает чувствительность к антибиотикам той или иной группы бактерий. Определив вид выращенной колоний бактерий после посева, (микробиологического исследования) можно подобрать эффективные антибиотики против именно этой группы микроорганизмов (так называемый посев крови на стерильность).
Обнаружить бактерии будет трудно или вообще невозможно, если человек перед анализом посева крови принимал антибиотики, при продолжающемся инфицировании болезнетворными микроорганизмами.
Для наиболее точного диагностирования заболеваний недостаточно самого современного лабораторного оборудования.
Точность результатов зависит не только от используемых реактивов и аппаратуры, но и от времени и правильности сбора исследуемого материала. При несоблюдении основных правил подготовки к анализам их результаты могут быть значительно искажены.
Для исследования крови более всего подходят утренние часы
Для большинства исследований кровь берется строго натощак.
Кофе, чай и сок – это тоже еда.
Рекомендуются следующие промежутки времени после последнего приема пищи:
- для общего анализа крови не менее 3-х часов;
- для биохимического анализа крови желательно не есть 12-14 часов (но не менее 8 часов).
За 2 дня до обследования необходимо отказаться от алкоголя, жирной и жареной пищи.
За 1-2 часа до забора крови не курить.
Перед исследованием крови следует максимально снизить физические нагрузки.
- Исключить бег, подъем по лестнице.
- Избегать эмоционального возбуждения.
- Минут10-15 нужно отдохнуть, расслабиться и успокоиться.
Нельзя сдавать кровь сразу после физиотерапевтических процедур, ультразвукового и рентгенологического исследования, массажа и рефлексотерапии.
Перед сдачей крови нужно исключить перепады температур, то есть баню и сауну.
Перед гормональным исследованием крови у женщин репродуктивного возраста следует придерживаться рекомендаций лечащего врача о дне менструального цикла, в который необходимо сдать кровь, так как на результат анализа влияют физиологические факторы фазы менструального цикла.
Перед сдачей крови необходимо успокоиться, чтобы избежать немотивированного выброса в кровь гормонов и увеличение их показателя.
Для сдачи крови на вирусные гепатиты желательно за 2 дня до исследования исключить из рациона цитрусовые, оранжевые фрукты и овощи.
Для правильной оценки и сравнения результатов ваших лабораторных исследований рекомендуется проводить их в одной и той же лаборатории
В разных лабораториях могут применяться разные методы исследования и единицы измерения показателей.
Бак посев можно назвать древним анализом, однако его популярность от этого отнюдь не падает, хотя современная бактериология имеет возможности найти и выделеть не только штаммы, но и отдельной клетки из него, которая называется клоном.
Однако для получения клона необходим специальный прибор – микроманипулятор, который в обычных лабораториях отсутствует, поскольку применяется, в основном, в научно-исследовательских целях (генетические исследования).
Результат оценивается после трехкратного посева. На посев берутся выделения из влагалища, менструальную кровь, соскоб или смыв эндометрия, содержимое очагов воспаления (например, из язв на шейке матки).
Даже проведение трехкратного посева дает низкий процент высеваемости палочек Коха. В дополнение используют ПЦР полученного биологического материала.
Количественную оценку грибковой инфекции можно дать с помощью посева грибков (культуральный метод).
Для таких целей материал с кожи, ногтей или волос собирают, как и в случае микроскопического исследования, далее:
- Биологический материал переносят в специальную питательную среду.
- Если во взятых образцах были грибки, то через некоторое время вырастают колонии.
- Затем колонии изучаются под микроскопом, что позволяет определить род и вид грибка, а также его концентрацию.
Кроме того, возможно и проведение тестов на чувствительность грибков к определенным противогрибковым препаратам, что позволяет подобрать больному оптимальную схему лечения.
Посев крови необходим для определения возбудителя инфекционного процесса. В норме кровь является стерильной и только при определенной части заболеваний, в нее могут проникать микроорганизмы.
Такой тип инфицирования называется бактериемией.
Наиболее тяжелый вариант бактериемии – сепсис (септицемия, септикопиемия), но данное состояние проявляется яркой клинической картиной и в основном является уделом стационаров (в том числе отделения реанимации).
Не всегда наличие возбудителя в крови приводит к сепсису. Возможна даже физиологическая бактериемия (она кратковременная и может возникать, например, при чистке зубов и неосторожном травмировании десен).
И все же, если микроорганизм попал в кровь, необходимо его выделить, определить и выяснить, к каким антимикробным препаратам он может быть чувствителен.
В этом случае применяется посев на аробные и анаэробные бактерии.
Аэробные бактерии имеют зависимость от кислорода (то есть их размножение без кислорода невозможно или возможно, но очень кратковременно).
Анаэробные бактерии в свою очередь имеют способность размножаться и без присутствия вокруг них источников кислорода.
Другое название для посева на аэробные и анаэробные бактерии является посев крови на стерильность.
Как и в любом другом исследовании, посев может быть ложноотрицательным, это связано со спецификой забора крови при данном исследовании (очень часто, забор крови нужно проводить на высоте лихорадки – повышения температуры тела).
Ложноположительный результат – при несоблюдении правил стерильности лабораторного инструментария, что в современных лабораториях крайне недопустимо и обычно такого не происходит.
В некоторых случаях для подтверждения диагноза необходимо использовать трехкратный посев на стерильность, то есть кровь забирается три раза с небольшим промежутком во времени.
После успешного забора крови для посева на аэробные и анаэробные бактерии, данный материал помещают на питательную среду. В течение определенного времени начинается рост колоний бактерий, присутствующих в кровотоке пациента.
При помощи различных лабораторных тестов исследователь проводит идентификацию бактерии, а также выполняет тест на чувствительность к антибактериальным препаратам, что в дальнейшем поможет лечащему врачу назначить наиболее эффективное лечение болезни.
Если возникает подозрение, что в теле развивается стафилококк, в первую очередь, не надо паниковать.
Обнаружение стафилококка клиническом посеве в концентрации 10 в 3 степени при бессимптомном носительстве не угрожает человеку. Вам необходимо обратить внитание на укрепление иммунитета.
Для точного определения, стафилококк ли является возбудителем заболевания, у больного берут на исследование биоматериалы. Это может быть кровь, содержимое гнойничков, отходящая мокрота, а в некоторых ситуациях и спинномозговая жидкость.
Значимые показатели анализа – выявление в сыворотке крови антител к антигенам стафилококка. Для этого используют реакцию торможения гемолиза, реакцию пассивной гемагглютинации. Одновременно проверяется чувствительность бактерии к различным противомикробным препаратам, чтобы в последующем сделать правильный выбор лекарства для борьбы с ним.
В случае если человек относится к группе пациентов с повышенным риском стафилококковой инфекции (из-за перенесенных заболеваний, других причин, вызвавших ослабление иммунной системы), врач может рекомендовать прохождение быстрого теста на коагулазу.
Такое тестирование – надежный способ определения кокков в крови. Если он покажет положительный результат – значит возбудителем стал золотистый стафилококк, если отрицательный – эпидермальный или сапрофитный.
Итак, материалом для бактериологического посева является кровь в количестве 5 – 10 мл, полученная из локтевой вены.
Участок кожи обрабатывается сначала ватным шариком, смоченным в 70 % — ном этиловом спирте, а затем другим ватным шариком, смоченным в 1 – 2 % — ном растворе йода, до полного высыхания кожи.
Алгоритм здесь может быть такой же, как и при заборе крови вакуумными шприцами с той разницей, что вместо пробирки в переходник вставляется гемокультурный флакон.
В месте венепункции йод вытирают спиртом и заклеивают этот участок пластырем. Пластиковую крышку данного флакона отламывают, обеззараживают внутреннюю поверхность крышки 70 % этиловым спиртом.
При температуре 37°С кровь нужно хранить не более 2–х часов!
Лучше всего произвести посев крови на питательную среду сразу после её забора.
Соотношение крови и питательной среды – 1: 10,осторожно перемешать.
Для получения наиболее достоверного результата проведение анализа должно быть как минимум двоекратным из разных рук с интервалом времени в 30 минут.
Вышеописанного метода в том, что имеет он адекватную стоимость, высокую информативность, простоту в выполнении, а главное – доступность!
В настоящее время существуют два способа посева крови на питательную среду и определение чувствительности к антибиотикам:
- посев на флору с выявлением чувствительности к широкому спектру антибиотиков;
- посев на флору с выявлением чувствительности к основному спектру антибиотиков.
источник
Опубликовано в журнале:
«Практика педиатра», октябрь 2008, с. 5-11
В.К. Таточенко, М.Д. Бакрадзе, ГУ Научный центр здоровья детей РАМН
Практически каждый ребенок раннего возраста обращается к педиатру по поводу острого заболевания, сопровождающегося высокой температурой. При этом у каждого пятого из них при осмотре не выявляются другие симптомы или признаки, позволяющие диагностировать конкретное заболевание [1].
Такая ситуация требует от педиатра принятия решения в отношении тактики ведения больного: высокая температура может указывать на начало тяжелого заболевания, требующего энергичного лечения и госпитализации, или же повышение температуры – это начало нетяжелой вирусной инфекции, не требующей серьезного вмешательства.
ТЕРМИНОЛОГИЯ
В современной педиатрии лихорадка без других симптомов рассматривается в качестве отдельной диагностической категории. При этом имеется в виду именно острое заболевание с фебрильной температурой, в начале которого отсутствуют катаральные явления и другие симптомы, которые указывали бы на поражение того или иного органа или на очаг инфекции. Подразумевается также, что у ребенка отсутствуют общие признаки неотложного токсического или септического заболевания: резкое нарушение общего состояния, нарушение сознания, сонливость (сон длиннее обычного или в необычное время), раздражительность (крик даже при прикосновении), периферический цианоз, гипо- или гипервентиляция, диспноэ, отказ от питья.
Международными критериями лихорадки без видимого очага инфекции (ЛБОИ) являются: температура выше 39,0 °С у ребенка в возрасте от 3 месяцев до 3 лет (и температура выше 38,0 °С у ребенка 0–2 месяцев) при отсутствии в момент осмотра токсических или септических симптомов очень тяжелого заболевания.
Смысл выделения детей группы ЛБОИ заключается в том, что в нее наряду с неопасными для жизни инфекциями входят случаи скрытой (оккультной) бактериемии. В начальной фазе бактериемия проявляет себя лишь высокой температурой; без лечения она часто ведет к развитию тяжелой бактериальной инфекции (ТБИ) – пневмонии, менингита, остеомиелита, сепсиса, не дающих вначале типичной клинической симптоматики; при этом есть реальная возможность назначить антибиотик, предотвратив ее прогрессирование.
Возбудителем оккультной бактериемии в 80% случаев является пневмококк, реже – H. influenzae типа b, менингококки, сальмонеллы. У детей 0–2 месяцев преобладает кишечная палочка, клебсиеллы, стрептококки группы В, энтеробактерии, энтерококки. Частота оккультной бактериемии у детей 3–36 месяцев с ЛБОИ составляет 3–8%, при температуре выше 40,0 °С – 11,6% [2, 3]. У детей 0–3 месяцев с ЛБОИ вероятность бактериемии или тяжелой бактериальной инфекции составляет 5,4–22% [4, 5].
ТБИ развивается не во всех случаях оккультной бактериемии, ее частота варьирует в зависимости от возбудителя. Менингит встречается в 3–6% случаев пневмококковой бактериемии, с менингококковой – в 25%, с гемофилюсной – в 7–60% случаев [6, 7]. Инфекция мочевых путей выявляется у 6–8% детей с бактериемией, у девочек – до 16% [8]. Сальмонеллезная бактериемия (при адекватном лечении) крайне редко дает локальные очаги [9].
Целью лечения детей с ЛБОИ является предотвращение развития ТБИ, что может быть достигнуто, например, введением цефтриаксона (50 мг/кг в/м) [10]. Оральные антибиотики снижают частоту развития пневмонии, но не менингита [11].
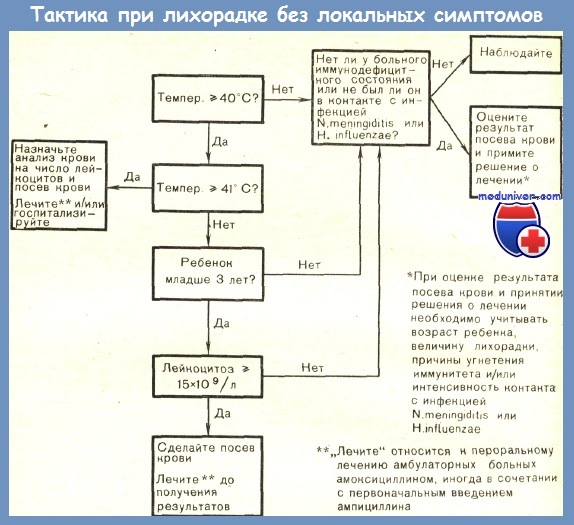
ДИАГНОСТИКА
Квалификация больного ребенка, как имеющего ЛБОИ, зависит от диагностических возможностей медицинского учреждения, куда он обратился. При отсутствии возможностей лабораторного и инструментального обследования – например, на вызове – в эту группу попадут дети с острым средним отитом, не проявляющим себя болями в ухе, «немая» бактериальная пневмония без признаков ОРВИ, а также инфекция мочевых путей, протекающая без дизурических симптомов. Поэтому, прежде чем ставить диагноз ЛБОИ, важно провести отоскопию, сделать рентгенограмму грудной клетки и провести анализ мочи. При отрицательных данных этих исследований диагноз ЛБОИ вполне оправдан, он требует, как правило, дальнейшей расшифровки. Наши данные показывают, что из числа детей с лихорадкой без другой симптоматики, направленных в диагностическое отделение НИИ педиатрии ГУ НЦЗД РАМН, при первом осмотре отит выявлялся в 17% случаев, пневмония – в 6%, инфекция мочевых путей – в 18% случаев, тогда как почти у 60% больных эти исследования результатов не дали.
Дальнейшее наблюдение за больными с ЛБОИ показало, что она состоит из двух подгрупп: подгруппы больных с вирусными инфекциями (герпетической 6-го типа, парвовирусной В19 и энтеровирусных инфекций), начальными признаками которых является высокая температура с появлением сыпи на 3–5-й дни болезни (применение антибиотиков в этой подгруппе не влияет на течение болезни); во вторую подгруппу входят дети с оккультной бактериемией, своевременное выявление которых позволяет провести антибактериальное лечение, дающее быстрое (в 1–2 дня) снижение температуры.
Клинические проявления скрытой бактериемии мало отличаются от проявлений вирусных инфекций: ни степень нарушения общего состояния, ни высота температуры больших различий не имеет, хотя температура выше 40,0 °С повышает риск бактериемии. Такой симптом, как отсутствие реакции температуры на антипиретики, также не позволяет надежно предсказать бактериемию, хотя и может указывать на ее повышенную вероятность.
Тем не менее дети с бактериемией чаще производят «токсическое впечатление»: у них чаще наблюдается полный отказ от еды, более выражены вялость, бледность или гиперемия кожи, с ними трудно установить визуальный контакт при осмотре. Характерно, что у детей, производящих более «здоровое» впечатление (при отсутствии четких лабораторных данных за бактериальную инфекцию), даже в возрасте до 2 месяцев, бактериемия встречается менее чем в 1% случаев [12].
Лабораторные показатели. Отсутствие четких клинических признаков скрытой бактериемии заставляет полагаться на лабораторные показатели. Наиболее чувствительным тестом является нейтрофильный лейкоцитоз > 15•10 9 /л или, при меньшем числе лейкоцитов, – абсолютное число нейтрофилов > 10•10 9 /л, или палочкоядерных форм > 1,5•10 9 /л. У детей с лихорадкой более 3–4 дней следует учитывать цифры СОЭ выше 30–40 мм/ч. У детей с такими показателями риск бактериемии достигает 15–20%, что оправдывает назначение антибактериального лечения. Менее пригоден признак повышения доли нейтрофилов выше 60% [13–15]. Следует помнить, однако, что отсутствие лейкоцитоза не исключает бактериемию, поскольку каждый пятый ребенок с бактериемией имеет лейкоцитоз ниже 15•10 9 /л [16].
Посев крови для выявления бактериемии доступен лишь в стационаре, но для получения результатов требуется не менее суток, так что его влияние на выбор лечебной тактики невелико.
Напротив, с учетом высокой частоты инфекции мочевых путей посевы мочи крайне желательны, тем более что результаты клинического анализа мочи нередко бывают отрицательными.
Более информативен уровень С-реактивного белка (СРБ) – 79% детей с бактериемией имеют цифры выше 70 мг/л, тогда как при вирусных инфекциях только 9% [17]. И этот показатель имеет ограничения, поскольку в 1–2-й день инфекции СРБ может еще оставаться ниже этого уровня. Надо сказать, что повышение уровня СРБ обычно сопровождает нейтрофильный лейкоцитоз и лишь у немногих детей СРБ бывает повышенным при отсутствии лейкоцитоза.
Еще более надежный показатель – прокальцитонин, его уровень повышается в ранние сроки бактериальной инфекции, так что цифры выше 2 нг/мл, как правило, говорят в пользу бактериального процесса. В отличие от СРБ, уровень прокальцитонина редко повышается при вирусных инфекциях даже в случаях, сопровождающихся лейкоцитозом 15–20•10 9 /л, что нередко наблюдается, например, при аденовирусной инфекции.
Оценку информативности этих маркеров мы провели в группе из 108 детей с ЛБОИ, у которых были исключены отит, пневмония и инфекция мочевых путей. Ретроспективно у 68 детей была диагностирована вирусная инфекция, которая проявила себя позже развитием стоматита у 16 детей с первичной инфекцией вирусом простого герпеса, папулезной сыпью (на 4–5-й день болезни) у 20 детей с внезапной экзантемой, сыпью на 3–4-й день у 26 детей с ЕСНО-экзантемой и характерной сыпью на 3–4-й дни у 6 детей с парвовирусной B19 инфекцией. В этой группе все три маркера бактериальной инфекции были отрицательными у 56 детей (уровень лейкоцитоза менее 15•10 9 /л, СРБ – ниже 30 мг/л и прокальцитонина – ниже 0,5 нг/мл), что позволило не назначать антибиотик, несмотря на продолжающуюся лихорадку. У всех 56 больных наблюдалось гладкое течение болезни, так что они обошлись без единой смены назначения.
У 12 детей из этой подгруппы маркеры бактериального воспаления были положительными (лейкоцитоз 15–19•10 9 /л у 4 детей, у 2 – нейтрофилез выше 10•10 9 /л, у 2 пациентов число палочкоядерных нейтрофилов > 1,5•10 9 /л, у 8-ми – СРБ 60–80 мг/л), и им была начата антибактериальная терапия (у части этих детей тест с прокальцитонином был отрицательным, но это не было принято во внимание, так как оценка этого теста нами еще не была завершена). Лечение, как правило, не влияло на уровень температуры, и оно было отменено через 1–2 дня по получении данных о наличии вирусной инфекции (появление стоматита, сыпи, лабораторных данных о наличии вирусов).
У 40 детей маркеры бактериального воспаления были положительными: у 28 детей лейкоцитоз превышал 15–19•10 9 /л, у 8 – имел место нейтрофилез выше 10•10 9 /л, у 3 – СОЭ превышала 45 мм/ч. Уровень СРБ превышал 70 мг/л у всех обследованных, в том числе у 4 с отсутствием лейкоцитоза и нейтрофилеза. У 24 детей был определен уровень прокальцитонина, оказавшийся у 8 ребят выше 10 нг/мл и у 14 детей – в пределах 2–5 мг. Введение антибиотика (цефтриаксон – 29 детям, амоксициллин/клавуланат – 11) дало быстрый эффект с падением температуры в течение 24–36 часов у 36 детей и через 36–72 часа – у 4 (у 3 – после добавления аминогликозида), что подтвердило бактериемический характер инфекции.
Таким образом, используя только отрицательные данные гематологических признаков и уровня СРБ, правильный диагноз вирусной инфекции мы смогли поставить 56 из 68 детей, что дает показатель их специфичности порядка 82%. Добавление теста на прокальцитонин повышает этот показатель.
Существуют две диаметральные точки зрения на лечение детей с ЛБОИ: «назначать антибиотики всем детям с ЛБОИ» и «наблюдать и лечить лишь при появлении симптомов бактериального заболевания» [18]. Последняя точка зрения становится популярной в странах, где проводится массовая вакцинация против пневмококковой и гемофилюсной инфекции типа b.
Ни та, ни другая концепции не представляются приемлемыми. Действительно, первая из них приведет к тому, что антибиотики получат все лихорадящие дети, хотя доля бактериальных лихорадок существенно ниже половины. С другой стороны, оставлять без лечения всех детей до появления симптомов менингита или пневмонии значит заведомо увеличить риск неблагоприятных исходов этих заболеваний.
На основании собственных и литературных данных мы придерживаемся следующих рекомендаций по ведению детей с ЛБОИ:
- при лейкоцитозе > 15•10 9 /л, абсолютном числе нейтрофилов > 10•10 9 /л или палочко-ядерных форм > 1,5•10 9 /л вероятна бактериемия и показаны антибиотики; выжидательная тактика может быть оправданна у «нетоксично выглядящих» детей с нормальным уровнем прокальцитонина;
- при лейкоцитозе 9/л, абсолютном числе нейтрофилов 9/л показанием к антибактериальной терапии является повышение уровня СРБ (выше 70 мг/л) и/или прокальцитони-на (выше 2 нг/мл);
- детям с температурой > 40,0 °С (0–2 месяцев > 39,0 °С) при числе лейкоцитов 10–15•10 9 /л и СРБ 30–70 мг/л, а также детям, чье наблюдение трудно обеспечить, допустимо однократное введение антибиотика с последующей оценкой состояния;
- при отсутствии маркеров бактериального воспаления – симптоматическая терапия.
Препарат выбора у детей с подозрением на бактериемию – цефтриаксон (50 мг/кг/сут внутримышечно или внутривенно), применение оральных препаратов ненадежно. Эффективен и амоксициллин/клавуланат внутривенно – 80 мг/кг/сут. У детей в возрасте 0–2 месяца цефалоспорин комбинируют с ампициллином (200 мг/кг/сут) с учетом возможности инфекции листериями и энтерококком, устойчивыми к цефалоспоринам. При получении данных посева крови или мочи следует проверить адекватность выбранного стартового антибиотика.
Эффект лечения детей с бактериемией обычно яркий – падение температуры ниже 38,0 °С в течение 12 часов и ее нормализация через 24–36 часов; такой эффект имеет диагностическое значение при отсутствии данных посева крови.
ПРОФИЛАКТИКА
Вакцинация против гриппа, сокращая заболеваемость, сокращает и частоту ЛБОИ. Массовая вакцинация против H. influenzae типа b в тех странах, где она проводится, снизила частоту бактериемии среди лихорадящих детей до уровня менее 2% [15], а пневмококковая вакцинация в США снизила частоту пневмококковой бактериемии на 84% и всех случаев бактериемии у детей 0–4 лет – на 69% [19]. Вакцинация сделала бактериемию настолько редкой, что целесообразность проведения посевов крови у детей с ЛБОИ ставится под сомнение, так как положительные результаты они дают лишь в десятых процента случаев.
Приводим ряд клинических наблюдений, иллюстрирующих статью.
Наблюдение 1
Больная Н., 1 год, поступила в отделение диагностики и восстановительного лечения ГУ НЦЗД РАМН с жалобами на лихорадку без катаральных явлений. Больна вторые сутки, температура 39,5 °С. Анамнез жизни без особенностей, прививки по возрасту.
При поступлении: состояние ребенка средней тяжести, выражены симптомы интоксикации, вялая, капризная, пьет мало, резко снижен аппетит, в контакт не входит. При осмотре катаральных явлений нет, зев не гиперемирован, носовое дыхание свободное, одышки нет, в легких дыхание проводится с двух сторон. Со стороны ЦНС – очаговой и менингиальной симптоматики нет. Анализ мочи нормальный, рентгенография грудной клетки, отоскопия патологии не выявили. Люмбальная пункция не проведена ввиду отсутствия менингиальных явлений.
Дальнейшую тактику решили данные анализа крови и острофазных белков; нейтрофильный (с/я – 70%, п/я – 4%) лейкоцитоз – 25,1•10 9 /л при СОЭ – 15 мм/ч, СРБ – 174 мг/л (при норме – до 20 мг/л), уровень прокальцитонина – 5 нг/мл (при норме менее 0,5 нг/мл) позволили заподозрить бактериемию без видимого очага бактериальной инфекции и назначить антибактериальное лечение – внутривенно цефтриаксон из расчета 60 мг/кг/сут. После первого введения цефтриаксона температура снизилась ниже 38,0 °С к концу первых суток и нормализовалась на следующий день, одновременно с нормализацией числа лейкоцитов. Всего было проведено 5 введений цефтриаксона. Девочка была выписана домой в удовлетворительном состоянии.
В данном случае, несмотря на отрицательный посев крови и мочи, диагноз бактериемии подтвердился быстрой реакцией на антибактериальное лечение.
Наблюдение 2
Больная Л., 2 года 4 месяца, поступила в клинику в первые сутки заболевания с жалобами на повышение температуры до 40,0 °С, без катаральных явлений, резкое снижение аппетита, за сутки выпила всего 250 мл жидкости. Ранний анамнез не отягощен. При осмотре обнаружилось состояние средней тяжести за счет лихорадки, интоксикации (мало пьет, не ест), девочка капризная, но активная. Кожные покровы чистые, зев умеренно гиперемирован, носовое дыхание свободное, ЧД – 38, в легких дыхание проводится с двух сторон, хрипов нет, живот мягкий, безболезненный, печень, селезенка не увеличены. Очаговой и менингиальной симптоматики нет. Физиологические отправления в норме, ото- и риноскопия без патологии, рентгенография грудной клетки без инфильтративных изменений.
И у этого ребенка тактика лечения определялась выраженными изменениями лабораторных показателей: лейкоцитоз – 40,5•10 9 /л при 89% нейтрофилов, СРБ – 80 мг/л, прокальцитонин – более 10 нг/мл. Был введен внутримышечно цефтриаксон (80 мг/кг/сут), после чего температура снизилась ниже 38,0 °С, однако на следующее утро появились отек левой глазной щели, отек левой щеки, указывающие на наличие острого гнойного синусита (диагноз был подтвержден компьютерной томографией придаточных пазух носа). К терапии был добавлен нетилмицин 7 мг/кг/сут. В течение следующих суток температура снизилась до нормальных цифр, отек лица исчез, появился аппетит, число лейкоцитов упало до 12•10 9 /л. Девочка выписана домой в удовлетворительном состоянии на 6-й день болезни.
У этой пациентки в отсутствие видимого бактериального очага диагноз бактериального процесса был поставлен также по данным лабораторных анализов, и он подтвердился в дальнейшем, несмотря на отрицательные результаты микробиологических исследований крови. И хотя начатое лечение не полностью подавило развитие воспалительных изменений в пазухах носа, оно оказало четкий положительный эффект, выразившийся в снижении температуры и улучшении состояния ребенка.
Наблюдение 3
Ребенок С., 1 год, поступил с жалобами на гектическую лихорадку до 40,0 °С, без катаральных явлений в течение последних 10 дней. Получал симптоматическую терапию и жаропонижающие. За неделю до болезни выписан из больницы, где перенес ОКИ. Анамнез жизни без особенностей, прививки сделаны по возрасту. В клинике при осмотре: кожные покровы и слизистые чистые, дыхание через нос свободное, в легких хрипов нет, одышки нет. Тоны сердца не изменены, ритмичные, ЧСС – 120 в минуту. Живот мягкий, безболезненный, печень, селезенка не увеличены. Менингиальной и очаговой симптоматики нет. Отоскопия, рентгенограмма грудной клетки, УЗИ органов брюшной полости и сердца – без патологии.
В связи с отсутствием очага инфекции и длительностью лихорадки («лихорадка неясного происхождения») помимо стандартных исследований были взяты биохимические, ревматологические и вирусологические (включая серологию на вирус Эпштейна-Барра) пробы. Однако нарастание лейкоцитоза с 16•10 9 /л на 7-й день лихорадки до 26,1•10 9 /л при 4% п/я и 64% с/я нейтрофилов и СОЭ – 22 мм/ч на 10-й день, при уровне СРБ – 107 мг/л, поставили вопрос о возможности скрытой бактериемии, несмотря на нормальный уровень прокальцитонина (0,5 нг/мл).
С учетом этого (в ожидании результатов остальных анализов) ребенку внутривенно был введен амоксициллин/клавуланат в дозе 250 мг/кг. Пациент был отпущен домой с периферическим венозным катетером с рекомендацией продолжить лечение в течение 48 часов. Уже через 6 часов после первой инфузии отмечалась нормализация температуры. Поскольку продолжить внутривенное введение препарата не удалось по техническим причинам, введение амоксициллина/клавуланата продолжили внутрь в дозе 600 мг/кг/сут; на его фоне температура оставалась стойко нормальной. Мальчик стал есть, анализ крови нормализовался на 3-й день. Антибактериальную терапию продолжили до 10 суток. Быстрый эффект лечения позволил подтвердить предполагавшийся диагноз скрытой (оккультной) бактериемии.
Взятые на высоте заболевания анализы не давали основания для альтернативного диагноза; напротив, в пользу диагноза бактериемии говорили высокий уровень фибриногена – 8,08 г/л (при норме 1,72–4,00 г/л), РФМК – 280 мкг/мл (30–40 мкг/мл) и D-димера – 399 нг/мл (255 нг/мл).
Наблюдение 4
Ребенок С., 3 года 10 месяцев, поступил в клинику с жалобами на повышенную температуру (до 39,9 °С) в течение 5 суток без признаков катара или других проявлений. Ранний анамнез без особенностей. Рос и развивался соответственно возрасту.
При поступлении состояние расценено как среднетяжелое за счет лихорадки, ребенок отказывался от еды. Объективно кроме лихорадки и незначительного покраснения в горле других признаков, указывающих на очаг инфекции, не было. В общем анализе мочи – без изменений, рентгенография грудной клетки – без инфильтративных изменений, отоскопия в норме.
Общий анализ крови: лейкоциты – 12,6•10 9 /л, п/я – 4%, с/я – 63,7%, лимф. – 30%, мон. – 6%; гемоглобин – 117 г/л; эритроциты – 4,3•10 9 ; тромбоциты – 376 000; СОЭ – 4 мм/ч, также не давал оснований говорить о бактериальном процессе, однако высокий уровень С-реактивного белка – 68,4 мг/л – послужил основанием для введения внутримышечно дозы цефтриаксона (60 мг/кг). Однако на фоне этой терапии лихорадка сохранялась, а через сутки на нижней губе появилась герпетическая везикула, диагноз первичной герпесвирусной инфекции был подтвержден в РНИФ на ВПГ. Антибиотик больше не вводили, ребенку был назначен ацикловир и местная противовирусная терапия. При выписке – состояние удовлетворительное.
В данном случае в решении вопроса об антибактериальной терапии не были учтены рекомендации по оценке уровня лейкоцитоза, а также не был принят во внимание низкий уровень прокальцитонина – менее 0,5 нг/л (исследование этого индикатора только начиналось). Как указано выше, уровень СРБ – 70 мг/л встречается и у 10% детей с вирусной инфекцией, что и имело место в данном наблюдении.
Наблюдение 5
Ребенок А., 3 месяца, поступил в клинику с жалобами на повышенную температуру (39,0 °С) в течение суток. Ранний анамнез без особенностей.
При осмотре состояние расценивалось как среднетяжелое за счет лихорадки и незначительной интоксикации (капризен, аппетит снижен, но пьет охотно). Объективно: катаральных явлений нет, зев не гиперемирован, дыхание через нос свободное, в легких хрипов нет, кровообращение удовлетворительное, гепатоспленомегалии нет. Менингиальной и очаговой симптоматики нет. Физиологические отправления в норме. Общий анализ мочи, отоскопия – без патологии.
У ребенка был выявлен нейтрофильный (п/я – 3%, с/я – 78 %) лейкоцитоз – 15•10 9 /л, СОЭ – 2 мм/ч, в связи с чем, несмотря на низкий уровень С-реактивного белка – 6 мг/л, ему была введена внутривенно доза амоксициллина/клавуланата (45 мг/кг/сут) до получения микробиологических анализов.
В мазке из зева патогенная флора выявлена не была, посев мочи – отрицательный, но в РНИФ были обнаружены антигены вируса Коксаки А, что, вместе с нетяжелым состоянием ребенка, несмотря на сохранение фебрильной лихорадки, позволило прекратить введение антибиотика со второго дня. Через четверо суток от начала болезни у ребенка на коже лица и туловища появилась мелкая пятнисто-папулезная сыпь с одновременным снижением температуры тела, что подтвердило диагноз энтеровирусной инфекции.
В данном наблюдении лейкоцитоз и нейтрофилез явились основанием для введения антибиотика; низкий уровень СРБ во внимание принят не был, так как этот показатель повышается позже. Правильный диагноз позволили поставить нетяжелое состояние ребенка и анализ на энтеровирусы.
Наблюдение 6
Ребенок Ж., 1 год 7 месяцев, поступил в клинику на вторые сутки заболевания с жалобами на повышенную температуру (39,5 °С). Ранний анамнез не отягощен, развитие — соответственно возрасту.
При поступлении — состояние средней тяжести за счет лихорадки, самочувствие ребенка сильно не страдало, аппетит умеренно снижен. Катаральных явлений нет. В соматическом статусе — без патологии. Со стороны ЦНС -менингиальной и очаговой симптоматики нет. Физиологические отправления в норме. Отоскопия, рентгенография грудной клетки — без патологии.
В общем анализе крови без воспалительных изменений: гемоглобин — 120 г/л; эритроциты — 4,73; лейкоциты — 11•10 9 /л, п/я — 4%, с/я- 59%, лимф. — 33%, мон. — 9%; СОЭ -14 мм/ч, С-реактивный белок — 12 мг/л; прокальцитонин — отрицательный.
В связи с нетяжелым состоянием, несмотря на сохраняющуюся лихорадку (до 39,5 °С) и отсутствие видимого очага бактериальной инфекции при отрицательных маркерах бактериального воспаления от антибактериальной терапии было решено воздержаться. Через 3 суток температура тела нормализовалась и появилась мелкая пятнисто-папулезная сыпь на лице, на шее и туловище — по типу внезапной экзантемы. Этот диагноз был подтвержден положительными данными ПЦР на герпес 6-го типа.
Список использованной литературы находится в редакции.
Сведения об авторах:
Владимир Кириллович Таточенко, главный научный сотрудник НИИ педиатрии ГУ НЦЗД РАМН, заслуженный деятель науки РФ, профессор, д-р мед. наук
Майя Джамаловна Бакрадзе, руководитель отделения диагностики и восстановительного лечения НИИ педиатрии ГУ НЦЗД РАМН, канд. мед. наук
источник
2. Появление шума регургитации.
1. Положительная гемокультура.
2. Вегетации и клапанная деструкция, формирование регургитации, абсцессы клапа-нов по данным ЭхоКС.
3. повышение СОЭ более 30 мм/час.
Сочетание 2 основных критериев, одним из которых является шум регуртации с одним дополнительным, делает диагноз эндокардита вероятным даже при отсутствии параклинического подтверждения. Сочетание двух основных клинических критериев с одним дополнительным и не менее, чем с двумя параклиническими позволяет считать диагноз инфекционного эндокардита достоверным. Сочетание основных и дополнительных клинических и параклинических критериев, но без регуртации и положительных данных ЭхоКС, может говорить о возможном диагнозе инфекционного эндокардита, но не исключает и другие направления диагностического поиска.
наличие очага инфекции или ситуации (в том числе и ятрогенной), которая могла привести к бактериемии.
бледность кожных покровов;
неуклонное нарастание тяжести общего состояния и появление новых симптомов и синдромов в процессе развития болезни.
выраженные островоспалительные изменения;
НСТ-тест (однако, сложность интерпретации показателей иммуногомеостаза и их изменений при сепсисе заключается в отсутствии преморбидных характеристик состояния иммунитета, а также нарастающим угнетением его по мере нарастания тяжести септического состояния).
Исследование системы свертывания крови:
потребление факторов свертывания;
Бактериологическое исследование крови:
Поскольку информация, полученная в результате посева крови, имеет важное прогностическое и тактическое значение, то у пациентов с впервые выявленной лихорадкой посевы крови всегда выполняются в тех случаях, когда у больного нет указаний на неинфекционные причины лихорадки.
Один посев крови – это образец, полученный в одно время и из одного места. Каждый посев осуществляется путем пункции отдельной вены. Высеваемость возбудителей в крови, полученной из артерии, такая же как и из вены, за исключением особого случая – инфекции артериального катетера. Получение двух посевов из двух разных вен с интервалом в 10 минут – наилучший способ определить, истинный это патоген (обычно оба посева положительны) или же контаминирующий организм (один положительный, второй отрицательный), к сожалению, нельзя назвать результаты этого метода абсолютно достоверными: как известно, бактериемия бывает интермиттирующей.
Сроки взятия проб крови: целесообразно во время лихорадочного периода (1) за 1 час предполагаемого подъема температуры, ориентируясь на температурную кривую предыдущих суток, (2) на высоте лихорадки и (3) через час после снижения температуры (как минимум 3 посева в сутки).
взятие крови проводят с соблюдением правил асептики стерильными одноразовыми шприцами;
запрещается проверять проходимость иглы, присасывая через нее воздух шприцем;
кровь берут у постели больного или в перевязочной и тут же засевают на питательные среды. Засеянные флаконы сразу должны быть доставлены в лабораторию или поставлены в термостат (t=37º). Забор крови из внутрисосудистых катетеров допускается в исключительных случаях и только с соблюдением правил 10 минутных интервалов.
для исследования необходимо взять кровь в соотношении 1:10 к объему питательной среды;
кожу над пунктируемой веной обрабатывают 70% спиртом, затем 5% настойкой йода и опять спиртом. Венопункцию проводят после полного высыхания дезинфектанта;
нельзя пальпировать вену в месте пункци;
-если флакон со средой закрыт ватно-марлевой пробкой, то процедуру рекомендуется осуществлять вдвоем: один мед.работник обрабатывает кожу больного, делает венопункцию и взятие крови, а второй в это время открывает над пламенем спиртовки пробки флаконов, подставляет их под струю крови из шприца (иглу со шприца надо снять и надеть стерильную), обжигает горлышки флаконов и закрывает их пробками;
-если флакон со средой закрыт герметично резиновый пробкой, то после ее обработки 70% спиртом в течение 1 мин. вносят кровь из шприца путем прокаливания пробки иглой (иглу сменить на стерильную).
наличие вегетаций, потоков регургитации;
исследование проводится в динамике и особенно показано при отмене антибиотика.
Прокальцитонин – это предшественник гормона кальцитонин. Совершенно случайно было открыто, что при бактериальной инфекции повышается концентрация прокальцитонина в крови. Этот факт способствовал тому, что прокальцитонин стали использовать в качестве маркера бактериальных инфекций. Установлено, что после стимуляции ФНО или ИЛ-6 печеночная ткань человека продуцирует прокальцитонин в большом количестве.
Концентрация циркулирующего в крови прокальцитонина чрезвычайно низкая. У здоровых и доноров она определяется на уровне 0,01 нг/мл. При тяжелых бактериальных инфекциях он может возрастать от 20 до 200 нг/мг. Концентрация прокальцитонина в 1,6 нг/мл является пороговой для разделения лихорадок бактериальной и не бактериальной природы. Для больных с нейтропениями этот порог ниже: между 0,5 и 1 нг/мл. При тяжелых инфекциях высокие уровни, а особенно отсутствие снижения показателей прокальцитонина на фоне лечения антибиотиками, имеет серьезное прогностическое значение. С другой стороны, клиническому улучшению предшествует снижение показателей прокальцитонина.
УЗИ органов брюшной полости, КТ (МРТ) структур черепа:
источник
Сепсисом называется тяжелая инфекционная болезнь, протекающая с размножением ее возбудителя в крови или в тканях. В последнем случае наблюдается периодическое образование метастазов инфекции в другие органы и ткани. В клинической картине сепсиса доминирует интоксикация и высокая лихорадка. Повторные ознобы с профузным потоотделением возникают иногда по несколько раз в сутки. Одновременно с лихорадкой отмечается высокий лейкоцитоз со сдвигом влево и повышение СОЭ. Эта грозная клиническая картина в большинстве случаев развивается в связи с фурункулом, карбункулом, после родов, уколов, порезов пальца, экстракции зуба и других манипуляций, нарушающих целостность кожи или слизистых оболочек. Предположение о сепсисе в подобных случаях может быть высказано в первые же дни болезни.
Когда размножение бактерий происходит в крови, принято говорить о септицемии. Форма сепсиса, протекающая с образованием метастатических абсцессов, называется пиемией.
Метастатические абсцессы чаще всего образуются в подкожной клетчатке и в легких. Пиемия начинается, как правило, внезапно. Клиническая картина ее складывается из гектической лихорадки с повторными ознобами, лейкоцитоза и эмболических абсцессов. Множественные эмболпи в легкие приводят к развитию инфарктной пневмонии, которая часто осложняется абсцессом или гнойным плевритом. Абсцессы в мягких тканях и в суставах проявляются классическими признаками воспаления: местной болезненностью, припухлостью, краснотой, повышением местной температуры и нарушением функции.
Терапевту чаще приходится иметь дело с септицемией, при которой даже самое тщательное обследование больного и самый подробный расспрос не позволяют установить входные ворота инфекции. Поэтому нередко первоначально больному ставят диагноз какого-либо острого инфекционного заболевания и только позднее, с появлением характерных ознобов и выраженной интоксикации, возникает предположение о сепсисе и назначаются посевы крови. Их производят как для установления диагноза, так и для определения чувствительности возбудителя болезни к антибиотикам. Кровь для посева лучше всего брать за полчаса — час до ожидаемого пика температурной кривой или во время лихорадки. Бактериемия часто бывает кратковременной, поэтому рекомендуется брать в течение дня от 3 до 5 проб крови, каждую объемом по 20 — 25 мл. Некоторые авторы рекомендуют брать 3 пробы крови каждый день в течение 3—4 дней.
Кратковременная бактериемия часто появляется и у здорового человека. Ее постоянно обнаруживают после- экстракции зуба, тонзиллэктомии, родов. Она нередко обнаруживается после цистоскопии, ректоскопии, во время острых воспалительных заболеваний верхних дыхательных путей, тонкой и толстой кишки. Бактериемия у здорового человека в подобных случаях оказывается кратковременной. У больных врожденными и приобретенными пороками сердца и сосудов бактерии оседают на пораженном клапане или на месте дефекта пристеночного эндотелия, создавая колонию. Бактериальным эндокардитом называется болезнь, возникающая вследствие колонизации клапанов сердца, пристеночного эндокарда сердца или эндотелия сосудов бактериями, грибами или другими патогенными организмами.
Развивается острый или подострый бактериальный эндокардит. Последний чаще называется затяжным септическим эндокардитом. Клиническая картина острого бактериального эндокардита подобна клинической картине септицемии. Появление систолического даума при септицемии считается достаточно убедительным свидетельством в пользу колонизации возбудителями сепсиса клапанов сердца. Острый бактериальный эндокардит чаще всего развивается у больных без признаков органического заболевапия сердца. Подострый бактериальный эндокардит чаще наблюдается у больных с врожденными и приобретенными пороками сердца.
Особенно часто осложняются подострым бактериальным эндокардитом митральный порок сердца с преобладанием недостаточности, аортальные пороки сердца: аортальная недостаточность и бикуспидальный аортальный клапан, имеющий обычно клиническую картину аортального стеноза. Подострый бактериальный эндокардит нередко развивается в аортальном клапане, деформированном сифилитическим процессом, он почти не встречается при дефекте межпредсердной перегородки и является частым осложнением дефекта межжелудочковой перегородки, открытого артериального протока, коарктации аорты, артериовенозной аневризмы. В последних трех случаях точнее было бы говорить о бактериальном эндартериите. Термин «бактериальный эндокардит» при этих болезнях применяется условно.
Подострый бактериальный эндокардит начинается в большинстве случаев незаметно, с лихорадки, к которой вскоре присоединяются признаки, указывающие на поражение сердца. В более поздних стадиях болезни появляются эмболии в сосуды большого или малого круга кровообращения, которые иногда становятся доминирующими в картине болезни.
Лихорадка является наиболее постоянным признаком бактериального эндокардита. Ознобы с повышением температуры до 40— 41С и с последующим профузным потоотделением указывают на более острое и более тяжелое течение болезни. Во время повышения температуры нередко появляются головные боли, иногда они оказываются единственной жалобой больных. В более легких случаях периоды лихорадки — постоянной, ремиттирующего или неправильного типа — периодически сменяются периодами субфебрилитета, длительность которых редко превышает 1—2 нед. Лихорадочная реакция не наблюдается у больных с признаками хронической почечной недостаточности и только в очень редких случаях у больных с нормальной функцией почек. К числу ранних синдромов бактериального эндокардита относится и анемия. Лихорадка и анемия являются, по-видимому, главными причинами общей слабости и быстрой утомляемости больных. Как правило наблюдается анорексия и быстро прогрессирующее похудание больного.
Клиническая картина бактериального эндокардита до тех пор не отличается от картины септицемии, пока не разовьется поражение сердца, которое в типичных случаях проявляется развитием митральной или аортальной недостаточности. У больного с ранее существовавшим пороком сердца бактериальный эндокардит приводит к появлению новых шумов, к изменению характера, силы и тембра старых шумов, к появлению периферических признаков аортальной недостаточности. Колонизация трехстворчатого клапана длительное время не вызывает изменения аускультативной картины сердца. Систолический шум при этой локализации бактериального эндокардита появляется обычно одновременно с признаками сердечной недостаточности: увеличением печени, расширением подкожных вен шеи, отеками подкожной клетчатки.
К числу поздних признаков бактериального эндокардита относятся: характерный цвет кожных покровов («кофе с молоком»), барабанные пальцы и множественные эмболии, которые чаще всего наблюдаются в сосудах кожи и слизистых оболочках глазного дна, в почках, селезенке, головном мозгу.
Септические эмболы в коже и слизистых оболочках (симптом Лукина — Либмана) выглядят в виде петехий с белым центром, которые чаще всего обнаруживаются к конъюнктиве нижнего века, на слизистой оболочке ротовой полости. Петехий с белым центром обнаруживаются и в сетчатке. Наибольшее диагностическое значение имеет петехия в конъюнктиве нижнего века. Они бывают единственными или появляются друг за другом обычно в виде небольшой серии.
По мнению Либмана, септические эмболии в кожу (узелки Ослера) являются патогномоничными признаками подострого бактериального эндокардита. Чаще всего они наблюдаются в подушечках пальцев верхних и нижних конечностей, в коже тенара и гипотенара и на подошвах нижних конечностей.
Поражение почек при бактериальном эндокардите проявляется в виде инфарктов, очагового или диффузного гломерулонефрита. Поражение почек удается обнаружить значительно раньше, чем поражение других органов. Протеинурия появляется в каждом, а гематурия — почти в каждом случае бактериального эндокардита. В поздних стадиях болезни возникает нефротический синдром и хроническая почечная недостаточность.
Увеличение селезенки обнаруживается приблизительно в 2/3 случаев бактериального эндокардита. Это поздний признак болезни, возникновение которого объясняется инфарктами органа. Нам приходилось наблюдать также и абсцессы селезенки.
Поражение центральной нервной системы относится к числу частых осложнений бактериального эндокардита. Эмболизация сосудов мозга сопровождается возникновением инсультов, в основе которых лежит чаще закупорка крупных артерий и реже — разрыв микотических аневризм. Клиническая картина болезни в подобных случаях складывается из лихорадки с признаками менингита и энцефалита.
При бактериальном эндокардите трехстворчатого клапана и открытого артериального протока наблюдаются эмболии легочных сосудов с образованием инфарктов обычно одновременно в обоих легких, которые склонны осложняться пневмониями, абсцессами и в редких случаях плевритами. Более чем в половине случаев число лейкоцитов в крови остается нормальным. Лейкоцитоз появляется только в случаях множественных эмболии или в связи с развитием инфарктов легких. Характерны повышение содержания гамма-глобулинов в крови и высокая СОЭ.
Ошибки в диагностике бактериального эндокардита происходят главным образом вследствие того, что постоянные синдромы этой болезни (эмболии в различные сосудистые области большого или малого круга кровообращения) отличаются большим разнообразием. По клиническим признакам они неотличимы от пневмонии, инсульта, энцефалита, сердечной недостаточности, хронической почечной недостаточности и других более знакомых врачу синдромов. Длительная лихорадка считается самым частым и самым ранним признаком бактериального эндокардита, но во многих случаях эта болезнь может начинаться незаметно, протекать только с субфебрильными повышениями температуры тела. Изредка встречаются случаи бактериального эндокардита, которые протекают без лихорадки. Посев крови примерно в 20% случаев оказывается стерильным. Причина этого — в большом разнообразии возбудителей болезни, каждый из которых растет только на строго определенных средах.
Систолический шум также не является обязательным признаком бактериального эндокардита, так как колония возбудителя болезни может локализоваться на пристеночном эндокардите либо на эндотелии артерий или артериовенозных анастомозов.
Диагноз подострого бактериального эндокардита в более легких случаях основывается на выявлении у больного, обычно страдающего каким-либо врожденным или приобретенным пороком сердца, длительной лихорадки, септических эмболии в кожу, почки, мозг и бактериемии. В более трудных случаях диагноз приходится обосновывать результатами наблюдений за клиническим течением болезни. Правильный диагноз в подобных случаях нередко ставят с запозданием, так как более или менее типичный комплекс синдромов (анемия, спленомегалия, барабанные пальцы, нефрит) развивается только в поздних стадиях болезни.
В подавляющем большинстве случаев бактериальный эндокардит начинается с лихорадки, поэтому его своевременный диагноз может быть поставлен только в том случае, если поиски возбудителя начнутся и закончатся задолго до развития необратимых осложнений (сердечная недостаточность, хроническая почечная недостаточность или нарушения мозгового кровообращения). Этого можно достигнуть, если возможность подострого бактериального эндокардита будет обсуждаться в каждом случае лихорадки неясного происхождения и если в каждом ее случае будут производиться посевы крови. Возможность подострого бактериального эндокардита должна считаться весьма вероятной, если лихорадка наблюдается у больного с органическими пороками сердца.
Поскольку подострый бактериальный эндокардит чаще развивается у больных с врожденным или приобретенным пороками сердца, постольку его чаще приходится отличать от рецидивирующего ревмокардита с сердечной недостаточностью, осложнившейся инфарктом легких с перифокальной пневмонией. Нередко нам приходилось отличать его от нарушения мозгового кровообращения и от хронического гломерулонефрита.
Friedberg (1966), Bauer (1967), Hart (1973) указывают, что им часто приходилось дифференцировать подострый бактериальный эндокардит от системной красной волчанки. С подобного рода трудностями нам сталкиваться не приходилось, вероятно, из-за значительной разницы в контингентах наблюдаемых больных.
Лихорадка у больного ревматическим пороком сердца первоначально принимается обычно за грипп или другую острую респираторную инфекцию. Если в последующее время спонтанно или под влиянием обычной в подобных случаях терапии антибиотиками температура тела понижается и становится субфебрильной, у больного предполагается обострение ревматизма. Энергичная противоревматическая терапия оказывается неэффективной, и у больных развивается сердечная недостаточность, которая также оказывается рефрактерной к обычным лечебным мероприятиям. Описанная ситуация возникает довольно часто, особенно у больных, получавших стероидные гормоны. Сердечная недостаточность постепенно начинает доминировать в картине болезни. К одышке присоединяются увеличение печени, отеки, в застойных легких возникают инфаркты, которые осложняются перифокальной пневмонией.
Выяснение истинной причины болезни в подобных случаях нередко оказывается весьма трудным. Более надежные результаты удается установить, оценивая на ранних этапах болезни выраженность нарушений проводимости и возбудимости миокарда, а на поздних ее этапах — последовательность появления лихорадки и сердечной недостаточности. Значительную помощь могут оказать и другие признаки, но в отличие от указанных они непостоянны.
В большинстве случаев ревмокардита диффузное поражение миокарда приводит к нарушению функции автоматизма и проводимости сердца. Особенно характерным считается замедление предсердно-желудочковой проводимости. Нарушения внутрижелудочковой проводимости встречаются значительно реже. Чем тяжелее ревмокардит, тем чаще наблюдаются желудочковая и предсердная вкстрасистолия и другие нарушения сердечного ритма. Мерцательная аритмия относится к числу частых нарушений сердечного ритма при пороках митрального клапана с признаками сердечной недостаточности. Указанные нарушения ритма при обострениях ревмокардита всегда предшествуют развитию сердечной недостаточности.
Подострый бактериальный эндокардит протекает обычно без нарушения сердечного ритма. Замедление предсердно-желудочковой проводимости при этом заболевании, по нашим наблюдениям, встречается редко, а нарушение внутрижелудочковой проводимости — чрезвычайно редко. Отсутствие нарушения возбудимости и проводимости сердца в сомнительных случаях следует оценивать как признак, свидетельствующий в пользу бактериального эндокардита.
Большое дифференциально-диагностическое значение следует придавать также и порядку появления перечисленных признаков. Нарушения проводимости и возбудимости сердца при обострении ревмокардита появляются в начале обострения и, как правило, задолго до развития сердечной недостаточности. При просмотре серии электрокардиограмм всегда удается заметить сочетание указанных нарушений с динамическим изменением формы и направления зубца Т. Нарушение возбудимости и проводимости миокарда при подостром бактериальном эндокардите развивается не в начале, а на высоте болезни обычно одновременно с сердечной недостаточностью или после ее появления.
Причины лихорадки при сердечной недостаточности часто остаются неясными. Такая как будто беспричинная лихорадка возникает как у больных подострым бактериальным эндокардитом, так и у больных ревматическими пороками сердца и атеросклеротическим кардиосклерозом. Различие заключается в том, что лихорадка при ревматическом пороке сердца и кардиосклерозе вызывается пневмонией, которая возникает как осложнение тяжелой сердечной недостаточности, а лихорадка при подостром бактериальном эндокардите обусловлена сепсисом.
Если лихорадка неясного происхождения развилась у больного с давно существующими признаками сердечной недостаточности, в основе ее всегда лежит не бактериальный эндокардит, а очаговая пневмония или тромбоэмболии легких с перифокальной пневмонией (Виноградов А. В., 1973). Это правило остается в силе даже в случаях абсцедирования очаговой пневмонии и при осложнении ее экссудативным плевритом. Диагноз бактериального эндокардита можно уверенно исключить, если признаки правожелудочковой недостаточности наблюдались у больного в течение примерно 6 мес до начала лихорадки.
Выясняя причину лихорадки при пороке сердца с недавно появившейся сердечной недостаточностью, всегда следует иметь ввиду ее возможную связь с бактериальным эндокардитом. Поэтому во всех подобного рода случаях необходимо повторно искать петехии на слизистых оболочках, определять размеры селезенки,
исследовать мочу для выявления признаков нефрита и производить повторные посевы крови для выделения возбудителя. Этим же принципом руководствуются при дифференциальном диагнозе между бактериальным эндокардитом, осложнившимся диффузным гломерулонефритом, и банальным хроническим гломерулонефритом с явлениями почечной недостаточности.
Возбудитель бактериального эндокардита расположен в русле крови обычно в левом сердце. Бактериальные эмболы попадают отсюда в артерии большого круга кровообращения и могут вызывать инфаркты любого органа. Клинические синдромы менингита, гемиплегии, субарахноидального кровоизлияния, развивающиеся на фоне лихорадки у больных молодого возраста с врожденным, или приобретенным пороком сердца, нередко оказываются осложнением бактериального эндокардита. Диагноз его может быть уверенно исключен только у больных митральным стенозом, осложнившимся мерцательной аритмией. Пневмококковая пневмония с явлениями менингита приблизительно в 1/3 случаев сочетается сэндокардитом аортального клапана (Hurst, 1974).
Многие инфекционные болезни протекают с длительной лихорадкой. Клиническая картина их в большинстве случаев настолько специфична, что распознавание их на высоте развития болезни не представляет значительных трудностей. В атипично протекающих случаях, например при пневмонической форме брюшного тифа или при менингококковой бактериемии без менингита, болезнь часто диагностируется с запозданием, а иногда остается нераспознанной. Для выяснения причины лихорадки в терапевтические отделения иногда госпитализируются больные туберкулезом, бруцеллезом, брюшным тифом, инфекционным мононуклеозом. В прошлые времена к этим болезням прибавлялись малярия, сыпной и возвратный тифы, которые в настоящее время в России ликвидированы.
источник