Микробиологическое исследование, позволяющее выявить возбудителя дифтерии (C. diphtheriae) в исследуемом биоматериале.
Посев на бациллы Леффлера, посев на BL, посев на дифтерийную палочку.
Corynebacterium diphtheriae сulture, Diphtheria сulture.
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
- За 3-4 часа до взятия мазков из ротоглотки (зева) не употреблять пищу, не пить, не чистить зубы, не полоскать рот/горло, не жевать жевательную резинку, не курить. За 3-4 часа до взятия мазков из носа не закапывать капли/спреи и не промывать нос. Взятие мазков оптимально выполнять утром, сразу после ночного сна.
Общая информация об исследовании
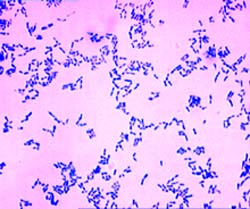
Corynebacterium diphtheriae (бациллы Леффлера) – это грамположительные бактерии рода Corynebacterium, являющиеся возбудителями дифтерии и способные к выработке дифтерийного токсина. Заболевание передается воздушно-капельным путем, источником инфекции являются больные люди или бактерионосители.
Инкубационный период составляет в среднем 2-5 дней. Происходит фибринозное воспаление слизистых оболочек ротоглотки и дыхательных путей с формированием псевдомембран и с симптомами общей интоксикации.
При токсической форме дифтерии также может поражаться сердце и нервная система. В некоторых случаях возможно бессимптомное носительство.
Диагноз «дифтерия» основывается на клинических данных, посев на дифтерию проводится для подтверждения.
Для чего используется исследование?
- Для подтверждения диагноза «дифтерия».
- Для дифференциальной диагностики заболеваний, протекающих со сходными симптомами, таких как ангины различного происхождения, паратонзиллярный абсцесс, инфекционный мононуклеоз, острый ларинготрахеит, эпиглоттит, бронхиальная астма.
- Чтобы оценить эффективность проводимой антибактерильной терапии.
Когда назначается исследование?
- При подозрении на дифтерию.
- Когда известно, что пациент контактировал с больными дифтерией.
- После проведения антибактериальной терапии – не менее чем через 2 недели после окончания курса антибиотиков.
- В некоторых случаях перед госпитализацией в стационар (с профилактической целью).
Референсные значения: нет роста.
Выявление возбудителя дифтерии подтверждает диагноз «дифтерия» или, если симптомы заболевания отсутствуют, свидетельствует о бактерионосительстве. При отрицательном результате посева у больного с подозрением на дифтерию диагноз может быть подтвержден в том случае, когда у контактных лиц результат посева положительный, то есть выделяется возбудитель дифтерии.
Причины положительного результата
- Дифтерия или бессимптомное носительство C. diphtheriae.
Причины отрицательного результата
- Отсутствие дифтерии. Исключение составляют случаи, когда на момент исследования проводилось лечение антибиотиками.
Что может влиять на результат?
- Предшествующая антибактериальная терапия.
Диагноз «дифтерия» основывается на клинической картине заболевания, поэтому лечение должно быть начато до получения лабораторного подтверждения заболевания. При положительном результате посева необходимо исследовать выделенный штамм С. diphtheriae на токсигенность.
Кто назначает исследование?
Инфекционист, терапевт, врач общей практики, педиатр, ЛОР.
источник
C. diphtheriae — палочковидные бактерии; вызывают дифтерию (греч. diphtheria — кожа, пленка) — острую инфекцию, характеризующуюся фибринозным воспалением в зеве, гортани, реже в других органах, и явлениями интоксикации.
Морфологические и культуральные свойства.
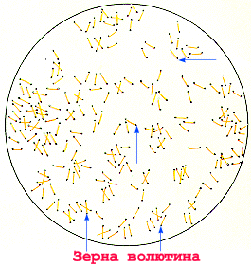
Corinebacterium diphteriae – тонкие, слегка изогнутые или прямые грамположительные палочки, расположенные под углом друг к другу в виде римских пятерок. Они утолщены на концах за счет наличия зерен валютина на одном или обоих полюсах клетки. Зерна валютина состоят из полифосфатов, они воспринимают анилиновые красители более интенсивно, чем цитоплазма клетки и легко выявляются при окраске по Нейссеру в виде гранул сине-черного цвета, тогда как тела бактерий – окрашивается в желто-зеленый. При окраске по Граму зерна валютина не выявляются.
Рисунок мазка из чистой культуры. Окраска по Нейссеру Мазок из чистой культуры.
Окраска щелочной синькой Леффлера
Дифтерийная палочка не обладает кислотоустойчивостью, неподвижна, спор не образует, имеет микрокапсулу с входящим в ее состав корд-фактором. В состав клеточной стенки входят галактоза, манноза, арабиноза, а также большое количество липидов, в том числе некислотоустойчивые миколовые кислоты.
Возбудитель дифтерии – факультативный анаэроб, гетеротроф, растет при 37 о С на сложных питательных средах: свернутая кровяная сыворотка, кровяной теллуритовый агар.
На элективных средах через 8-14 часов образует точечные, выпуклые желтовато-кремовые колонии с гладкой или слегка зернистой поверхностью. Колонии не сливаются и имеют вид шагреневой кожи.
На теллуритовых средах возбудитель дифтерии через 24-48 час образует черные или черно-серые колонии в результате восстановления теллурита до металлического теллура.
Возбудитель дифтерии обладает высокой ферментативной активностью. Дифференциально-диагностическими признаками C. diphteriae являются:
отсутствие способности ферментировать сахарозу и разлагать мочевину,
способность продуцировать фермент цистиназу.
Возбудитель дифтерии не однороден по культуральным и биохимическим свойствам. В соответствии с рекомендациями Европейского регионального бюро ВОЗ вид C. diphteriae подразделяют на 4 биовара: gravis, mitis, intermedius, belfanti.
На теллуритовой среде биовар gravis образует сухие, матовые, крупные, плоские, серовато-черные колонии, приподнятые в центре. Периферия колонии светлая с радиальной исчерченностью и неровным краем. Такие колонии напоминают цветок маргаритку. Биовар mitis образует мелкие, гладкие, блестящие, черные, выпуклые колонии с ровным краем, окруженные зоной гемолиза. Биовары intermedius и belfanti фактически относятся к биовару mitis, так как не разлагают крахмал, а этот признак у C. diphteriae является наиболее стабильным.
Антигенная структура. C. diphteriae имеют О-антиген (липидные и полисахаридные фракции, расположенные в глубине клеточной стенки) и К-антиген (поверхностный термолабильный белок). О-антиген является межвидовым. На основании К-антигена различают около 58 сероваров.
Факторы патогенности. Основными факторами патогенности C. diphteriae являются поверхностные структуры, ферменты и токсины.
Поверхностные структуры (пили, компоненты микрокапсулы: корд-фактор, К-антиген, миколовые кислоты) имеют белковую и липидную природу, способствуют адгезии микробов в месте входных ворот, препятствуют фагоцитозу бактерий, оказывают токсическое воздействие на клетки макроорганизма, разрушают митохондрии.
Ферменты патогенности: нейраминидаза, гиалуронидаза, гемолизин, дермонекротоксин. Нейраминидаза отщепляет N-ацетилнейраминовую кислоту от гликопротеидов слизи и поверхности клеток, лиаза расщепляет ее на пируват и N-ацетилманнозамин, а пируват стимулирует рост бактерий. В результате действия гиалуронидазы повышается проницаемость кровеносных сосудов и выход плазмы за их пределы, что ведет к отеку окружающих тканей. Дермонекротоксин вызывает некроз клеток в месте локализации возбудителя. Вышедший за пределы сосудов фибриноген плазмы контактирует с тромбокиназой некротизированных клеток организма и превращается в фибрин, что и является сущностью дифтерийного воспаления. Внутри дифтерийной пленки C. diphteriae находят защиту от эффекторов иммунной системы и антибиотиков, размножаясь, они образуют в большом количестве основной фактор патогенности — дифтерийный гистотоксин.
Дифтерийный гистотоксин оказывает блокирующее действие на синтез белка в органах, наиболее интенсивно снабженных кровью: сердечно-сосудистая система, миокард, нервная система, почки и надпочечники.
Эпидемиология. В естественных условиях дифтерией болеет только человек, не обладающий устойчивостью к возбудителю и антитоксическим иммунитетом. Заболевание распространено повсеместно. Наибольшее количество больных наблюдается во второй половине сентября, октябре и ноябре. Наиболее восприимчивы дети дошкольного и младшего школьного возраста. Среди взрослых к группе повышенного риска относятся работники общественного питания и торговли, школ, детских дошкольных и медицинских учреждений.
C. diphteriae обладает устойчивостью к факторам окружающей среды: в капельках слюны, прилипших к посуде или игрушкам, на ручках дверей они могут сохраняться до 15 дней, на предметах окружающей среды – 5,5 мес., могут размножаться в молоке. При кипячении C. diphteriae погибают в течение 1 мин, в 10% растворе перекиси водорода – через 3 мин, в 5% растворе карболовой кислоты и 50-60% спирте – через 1 мин.
Дифтерийный гистотоксин очень неустойчив и быстро разрушается при действии света, нагревании, окислении.
Источником инфекции являются:
1.носители токсигенных штаммов — особенно опасны те носители, у которых нет клинических проявлений заболевания, так как они обладают антитоксическим иммунитетом.
2.больные: Среди больных наибольшее значение имеют лица с локализацией процесса в верхних дыхательных путях. Больной эпидемиологически опасен в течение всего периода болезни, даже в период выздоровления он выделяет токсигенные штаммы в окружающую среду.
Основным механизмом заражения является аэрозольный. Пути передачи:
ведущая роль принадлежит воздушно-капельному,
иногда могут осуществляться воздушно-пылевой, контактно-бытовой, а также алиментарный (через молоко) пути передачи.
Входными воротами инфекции служат слизистые оболочки ротоглотки (небные миндалины и окружающие их ткани), носа, гортани, трахеи, а также слизистые оболочки глаз и половых органов, поврежденные кожные покровы, раневая или ожоговая поверхность, незажившая пупочная ранка.
Наиболее часто встречается дифтерия зева (90-95%). Инкубационный период длится от 2 до 10 дней. По патогенезу дифтерия относится к токсинемическим инфекциям, когда микроб остается в месте входных ворот инфекции, а все клинические проявления связаны с действием экзотоксина.
Начальным этапом инфекционного процесса является адгезия микроба в месте входных ворот. Размножаясь там, микроб выделяет гистотоксин, который оказывает местное действие на клетки тканей, а также поступает в кровь, что ведет к возникновению токсинемии.
В области входных ворот развивается воспалительная реакция, которая сопровождается некрозом эпителиальных клеток и отеком, образуется налет белого цвета с сероватым или желтоватым оттенком, содержащим большое количество микробов, продуцирующих токсин.
Характерным признаком дифтерии является фибринозная пленка:
Если слизистая оболочка образована однослойным эпителием (гортань, трахея, бронхи), возникает крупозное воспаление, здесь пленка располагается поверхностно и легко отделяется от подлежащих тканей.
Если слизистая оболочка образована многослойным эпителием (ротоглотка, надгортанник, голосовые связки), возникает дифтерическое воспаление, когда все клетки прочно связаны между собой и с подлежащей соединительнотканной основой. Фибринозная пленка в этом случае плотно спаяна с подлежащими тканями и не снимается тампоном. При попытке сделать это слизистая оболочка кровоточит.
Иммунитет. После перенесенного заболевания формируется стойкий и напряженный гуморальный антитоксический иммунитет. Продолжительность поствакцинального иммунитета – 3-5 лет.
Материалом для исследования является фибринозная пленка, слизь из зева или носа.
Сбор материала необходимо проводить в течение 3-4 ч (не позднее 12 ч) с момента обращения больного. Для взятия материала используют сухие ватные тампоны, если посев будет произведен в течение 2-3 ч, при транспортировке материала тампоны смачивают 5% раствором глицерина.
Основным методом диагностики является бактериологический. Бактериологическая лаборатория через 48 ч должна дать ответ о наличии или отсутствии C. diphteriae в анализах.
Материал засевают на питательную среду. Отбирают подозрительные колонии и выделенную культуру идентифицируют:
По наличию цистиназы (проба Пизу): в столбик питательного агара с цистином уколом засевают исследуемую культуру. Посевы инкубируют при 37 о С 24 ч. C. diphteriae вызывает почернение среды по ходу укола в результате образования сульфида свинца.
По наличию уреазы (проба Закса): готовят спиртовый раствор мочевины и раствор индикатора – фенолового красного, которые перед употреблением смешивают в соотношении 1:9 и разливают в агглютинационные пробирки. Исследуемые бактерии вносят петлей и растирают по стенке прибирки. В положительном случае через 20-30 мин инкубации при 37 о С среда приобретает красный цвет в результате расщепления мочевины уреазой.
Способности C. diphteriae продуцировать токсин (устанавливается в реакции преципитации в агаре). Для этого в чашку Петри с питательным агаром, содержащим 15-20% лошадиной сыворотки, 0,3% мальтозы и 0,03% цистина помещают полоску фильтровальной бумаги, пропитанную антитоксической противодифтерийной сывороткой, содержащей 5000 АЕ/мл. Чашку подсушивают при 37 0 С 30 мин и бляшками засевают испытуемые штаммы на расстоянии 0,6-0,8 см от края бумаги. Посевы инкубируют при 37 0 С 24 ч. В положительном случае в месте соединения токсина с антитоксином в среде образуется преципитат в виде белых линий – «усиков».
Для определения токсигенности возбудителя дифтерии может быть использована биопроба. Морской свинке внутрикожно или подкожно вводят испытуемую культуру. Токсигенные культуры убивают животных в течение 3-5 суток, при вскрытии обнаруживаются гиперемированные надпочечники, а при внутрикожном заражении – некроз кожи.
Для бактериоскопического исследования (как самостоятельный диагностический метод применяется редко ввиду полиморфизма возбудителя, но может быть проведен по просьбе врача) из материала готовят мазки на нескольких стеклах, один мазок окрашивают по Граму, другой по Нейссеру, третий – обрабатывают флюорохромом – корифосфином для люминесцентной микроскопии.
О наличии антитоксического иммунитета судят по реакции Шика – реакции нейтрализации токсина антитоксином. В кожу предплечья вводят 1/40 DLM дифтерийного токсина. Покраснение и припухлость в месте введения свидетельствует об отсутствии антитоксинов в крови. Отрицательная реакция Шика говорит о наличии антитоксинов.
Для ускоренного обнаружения дифтерийного токсина, как в бактериальных культурах, так и в сыворотке крови, применяют: РНГА с антительным эритроцитарным диагностикумом, РИА и ИФА. Из молекулярно-генетических методов исследования применяют ПЦР.
Препараты для специфического лечения дифтерии.
В целях нейтрализации дифтерийного гистотоксина применяют специфическую противодифтерийную лошадиную очищенную концентрированную сыворотку, которую получают путем гипериммунизации лошадей дифтерийным антитоксином.
Специфическое лечение противодифтерийной сывороткой начинают немедленно при клиническом подозрении на дифтерию. Необходимо выбрать оптимальный режим введения сыворотки, так как антитоксин может нейтрализовать только не связанный с тканями токсин. Для профилактики развития анафилактического шока сыворотку вводят дробно по А.М. Безредке. Введение сыворотки позднее 3-го дня болезни нецелесообразно.
Разработан противодифтерийный иммуноглобулин человека для внутривенного введения. Его применение дает меньше побочных реакций.
Для подавления размножения C. diphteriae в месте входных ворот обязательно назначают антибиотики. Препаратами выбора являются пенициллин или эритромицин, либо другие β-лактамы и макролиды.
Препараты для специфической профилактики дифтерии.
Для создания искусственного активного антитоксического иммунитета применяют дифтерийный анатоксин. Очищенный и концентрированный препарат входит в состав ассоциированных вакцин:
1. адсорбированной коклюшно-дифтерийно-столбнячной вакцины (АКДС-вакцина),
2. адсорбированного дифтерийно-столбнячного анатоксина (АДС-анатоксин),
3. адсорбированного дифтерийно-столбнячного анатоксина с уменьшенным содержанием антигенов (АДС-М),
4. адсорбированного дифтерийного анатоксина с уменьшенным содержанием антигена (АД-М).
Базисный иммунитет создается у детей согласно календарю прививок. Только 95% охват населения прививками гарантирует эффективность вакцинации.
источник
Мазок из ротоглотки берется натощак или не ранее, чем через 2 часа после еды.
Приготовить шпатель, стерильные ватные тампоны в пробирках с ватными пробками. Для приготовления тампонов используют алюминиевую проволоку или деревянные палочки, на один конец которых накручивают слой ваты (120 мг на тампон), тампоны монтируют в пробирки с ватными пробками. Если посев материала производится быстро, то слизь забирают сухими тампонами. При транспортировке на дальние расстояния (свыше 3 часов) применяют тампоны, опущенные в пробирки со средой обогащения, или тампоны, смоченные 5% раствором глицерина.
Больного усадить лицом к свету, попросить открыть рот. Вынуть из пробирки палочку с тампоном, взять ее в правую руку. Шпателем, находящимся в левой руке, прижать корень языка.
Тампоном, не касаясь языка, слизистой щек и зубов (чтобы на тампон не попала слюна), слегка нажимая, провести по миндалинам на границе наложений и здоровой ткани (при обследовании на коринебактерии) и по лакунам (при обследовании на флору), затем тампон опустить в стерильную пробирку и закрыть пробкой.
При обследовании на коринебактерии дифтерии, помимо мазка из ротоглотки, берется мазок из носа (стерильный тампон поочередно вводят в оба носовых хода, вращательными движениями забирая слизь со средней и задней трети слизистой носа). При подозрении на дифтерию другой локализации (глаза, уха, кожи, влагалища) отдельным тампоном берут мазок с пораженных участков на границе здоровой и поврежденной ткани.
При взятии слизи сухими тампонами пробирки с тампонами немедленно отправляют в бактериологическую лабораторию.
При длительной транспортировке (свыше 3 часов) тампон немедленно погружают в пробирку со средой обогащения и в таком виде доставляют в лабораторию.
При транспортировке тампонов в зимнее время следует избегать их переохлаждения, поэтому пробирку закутывают в слои ваты или помещают в сумку – термостат.
На каждой пробирке четко пишется порядковый номер, указывается место взятия материала («зев», «нос» и т.д.). К пробиркам прилагается список, где отмечается номер пробирки, фамилия, имя, возраст ребенка, домашний адрес (или название учреждения), цель обследования (диагностическая, по эпидпоказаниям, профилактическое обследование), дата и время взятия материала.
По требованию врача может быть сделана предварительная бактериоскопия мазка с тампона, при этом немедленно выдается результат. Например: «При прямой бактериоскопии мазка обнаружены палочки, подозрительные на дифтерийные».
При обследовании на коринебактерии дифтерии посев материала производится на чашку Петри с кровяным теллуритовым агаром, среда должна быть комнатной температуры. Площадь чашки разделяется на две равные части (площадки для посева материала из зева и носа). На нижней наружной части чашки карандашом подписывают: зев, нос, номер анализа, дата посева.
При обследовании мазка на флору посев делают на всю площадь чашки, содержащей кровяной агар.
При посеве сухим тампоном материал втирается в среду со всех сторон тампона на участке площадью 2 × 3 см 2 , затем этим же тампоном материал растирается штрихами. При обследовании на коринебактерии дифтерии половина чашки Петри засевается слизью из ротоглотки, а другая половина – слизью из носа.
После посева чашки незамедлительно ставят в термостат (при температуре 37 0 ) на 24 часа при обследовании на коринебактерии дифтерии, и на 48 часов — при обследовании на флору.
Предварительный ответ бактериологического обследования на коринебактерии дифтерии выдается через 48 – 72 часа. Он формулируется так: «В посевах материала из ротоглотки обнаружены бактерии (колонии), подозрительные на дифтерийные, исследование продолжается». При отсутствии подозрительных колоний выдается отрицательный окончательный результат.
При обнаружении дифтерийных колоний через 24 часа окончательный ответ выдается через 72 – 96 часов от момента забора материала. При использовании среды обогащения срок выдачи ответа отодвигается на 24 часа. Формулировка окончательного ответа: «Выделена токсигенная коринебактерия гравис ( митис или интермедиус)».
Во всех случаях обнаружения дифтерийных микроорганизмов лаборатория извещает учреждение, из которого направлен анализ, а также районного эпидемиолога.
Окончательный результат исследования мазка на флору выдается через 5 дней.
источник
Коринебактерии — грамположительные палочковидные микроорганизмы, широко распространенные в природе и обитающие в человеческом организме. Большинство представителей данного рода не патогенны для человека. Некоторые виды вызывают тяжелые инфекционные заболевания, например, дифтерию.
- Инфекции мочевыводящих путей — уретрита, простатита, поражения почек;
- Заболеваний органов дыхания — пневмонии, тонзиллита, фарингита;
- Гнойно-септических процессов — бактериемии, септицемии, абсцесса мозга, остеомиелита, эндокардита, септического артрита,
- Кожных заболеваний — псевдомикоза;
- Катетер-ассоциированных и раневых инфекций.
Некоторые коринебактерии являются представителями различных нормоцинозов человеческого организма. Они обитают на коже, в верхних отделах респираторного тракта, зрительном анализаторе, урогенитальном тракте. Так, С. striatum обладает тропностью к кожным покровам, С. durum – к респираторному эпителию органов дыхания, С. glucuronoliticam — к эпителиоцитам мочеполового тракта у мужчин. Многие виды выделяются из объектов окружающей среды.
Атоксигенные С. diphtheriae в норме колонизируют кожу и зев, не вызывая развития болезни. Непатогенные виды коринебактерий в допустимом количестве входят в состав нормоценоза толстого кишечника. Но иногда эти микробы приводят к развитию инфекции и даже эпидемических вспышек. Такая особенность обусловлена наличием иных факторов вирулентности у данных микроорганизмов.
Все коринебактерии условно делятся на группы:
- Микроорганизмы, опасные для теплокровных,
- Микробы, поражающие растения,
- Условно-патогенные бактерии, не причиняющие вреда здоровью.
В наибольшей степени развитию инфекции подвержены дети, пожилые люди и лица с иммунодефицитом и полиорганной патологией. В большинстве случаев видовая идентификация corynebacterium spp вызывает значительные трудности, обусловленные их морфобиологическими особенностями.
Морфология. Коринебактерии — полиморфные, тонкие и длинные палочки, имеющие характерные утолщения на концах, в которых содержатся зерна волютина. Это своеобразный запас питательных веществ – жировых включений, необходимый клеткам для нормальной жизнедеятельности. Микроорганизмы не образуют спор и не имеют жгутиков. Бактериальная клетка содержит нуклеоид с ДНК, имеющей замкнутую кольцевую форму и содержащей гуанин и цитозин в различных соотношениях. Зерна волютина, хорошо заметные в цитоплазме покоящейся клетки, исчезают при ее интенсивном делении. Клеточная стенка многослойна. Она состоит из пептидогликана, липидного слоя и микрокапсулы.
Corynebacterium diphtheriae является возбудителем опасного для человека заболевания — дифтерии. В настоящее время патология регистрируется крайне редко и лишь у отдельных лиц, которые, скорее всего, не были своевременно вакцинированы.
Распространение инфекции происходит воздушно-капельным или контактным путем во время общения с больными людьми или через инфицированные предметы. В случае заражения пищевых продуктов становится актуальным алиментарный путь. В эпидемиологическом отношении наибольшую опасность представляют здоровые бактерионосители.
В зависимости от расположения первичного очага инфекции выделяют различные формы заболевания. Спустя 7-10 дней инкубации появляются первые клинические признаки. Фибринозное воспаление развивается в месте локализации патологического очага. Оно приводит к разрушению эпителиоцитов и кровеносных сосудов. В постепенно образующемся экссудате содержится много фибриногена, который сворачивается и образует налет на слизистой серо-белого цвета. Он плотно спаивается с подслизистым слоем и не поддается снятию. При попытке удалить налет начинается кровотечение. Кроме местных признаков воспаления, обусловленных локализацией входных ворот инфекции, возникает тяжелая интоксикация с лихорадкой, ознобом, гипергидрозом, ломотой в теле, вялостью, бледностью кожи, адинамией, гипотонией и прочими признаками.
Дифтерия зева — самая опасная форма инфекции, способная привести к развитию крупа, который является причиной смертельного исхода. Он обусловлен отеком слизистой гортани и выраженной асфиксией.
Основным диагностическим методом дифтерии является микробиологический. При появлении плотных фибриновых пленок и отека глотки или других частей тела необходимо взять у больного мазок на дифтерию и начать данное исследование. Отделяемое зева, слизь из носа, налет с миндалин – биоматериал, который доставляют в бактериологическую лабораторию для проведения анализа. Его засевают на среды, содержащие сыворотку или кровь с теллуритом калия, который угнетает рост вторичной микрофлоры. После инкубации выросшие колонии микроскопируют, накапливают чистую культуру и проводят окончательную идентификацию до вида. Для клиницистов важны результаты серо- и фаготипирования. Определение токсигенности выделенной культуры имеет важное диагностическое значение.
Этиотропная терапия дифтерии заключается во введении больным антитоксической сыворотки, антибиотиков и сульфаниламидов. Симптоматическая и патогенетическая терапия улучшают общее состояние больных, избавляя их от симптомов. После снятия острых явлений патологии показаны санирующие физиопроцедуры – ультразвук и лазеротерапия непосредственно на очаг.
Чтобы предупредить развитие такого серьезного заболевания, как дифтерия, проводят всеобщую иммунизацию населения вакциной АКДС в соответствии с Национальным календарем прививок. Массовая вакцинация в настоящее время значительно снизила показатели заболеваемости дифтерией и смертности от нее.
Corynebacterium non diphtheriae являются обитателями внешней среды. Они обнаруживаются на коже и слизистой внутренних органов, являясь представителями нормоценозов. У ослабленных лиц из группы риска эти микробы способны вызывать воспалительные процессы, которые протекают также тяжело, как заболевания, вызванные безусловными патогенами. Чтобы правильно подобрать этиотропную терапию и вылечить больного, необходимо точно и быстро идентифицировать микроб.
Corynebacterium glucuronolyticum — микроорганизмы, выделенные от людей с заболеваниями мочеполовой системы. Они являются возбудителями простатита и уретрита у мужчин, но могут в оптимальном количестве обитать в организме здоровых людей, являясь представителями данного биоциноза.
Под воздействием негативных факторов происходит активный рост и размножение Corynebacterium glucuronolyticum. Бактерии начинают приобретать болезнетворные свойства, вызывая местное воспаление. Паренхима предстательной железы отекает, увеличивается в размере, инфильтрируется лимфоцитами. Воспаление распространяется на околожелезистую ткань, изменяется структура органа, разрушаются эпителиоциты, утрачивается секреторная функция железы.
Дифтероиды входят в состав нормоциноза урогенитального тракта мужчин наряду со стафилококками, энтерококками, единичными микоплазмами и уреаплазмами. В процессе сексуальной активности уретра заселяется потенциальными уропатогенными бактериями. При переохлаждении, нервном перенапряжении, длительном приеме антибиотиков возникает воспаление в простате, обусловленное условно-патогенными бактериями. При этом нарушаются функции местных факторов защиты организма.
Больные с простатитом или уретритом, вызванном Corynebacterium glucuronolyticum, жалуются на боли в промежности, мошонке, половом члене, усиливающиеся в конце акта мочеиспускания; дизурические расстройства: полиурию, никтурию, неполное опорожнение мочевого пузыря, слабую струю; половую слабость – расстройства эрекции и эякуляции.
- Пальпация предстательной железы per rectum — изменение размеров железы, гетерогенная консистенции, чередование плотных и мягких участков, болезненные ощущения.В гемограмме — признаки воспаления.
- Бактериологическое исследование мочи и секрета простаты проводится в микробиологической лаборатории. Биоматериал засевают на стандартные среды для первичной идентификации, микроскопируют выросшие колонии, а затем изучают структуру, физиологию, ферментативную и биохимическую активность выделенного возбудителя. Corynebacterium glucuronolyticum хорошо растут на кровяном агаре. Через 24 часа на нем появляются выпуклые колонии беловато-желтоватого оттенка без зон гемолиза.
- ПЦР-диагностика — определение генетического материала коринебактерий в исследуемом образце.
Лечение простатита и уретрита противомикробное. Больным назначают фторхинолоны, макролиды и тетрациклины.
Corynebacterium glucuronolyticum — возбудитель заболеваний урогенитального тракта у мужчин. На сегодня инфекционный простатит и уретрит являются довольно распространенными недугами и серьезной медицинской проблемой. Специфические диагностические методы и терапевтические принципы остаются до конца не изученными. Больные, «заработав» подобный недуг, мучаются всю жизнь. Только эффективное антимикробное лечение поможет им справиться с патологией.
Дифтероиды — микроорганизмы из рода Corynebacterium, которые в настоящее время плохо изучены. К ним и относится данный микроб, имеющий еще одно название — палочка Хофмана. Его коринебактерия получила в честь своего первооткрывателя.
Дифтероиды распространены повсеместно: они обнаруживаются в воздухе, почве, воде, на продуктах. Микробы обладают устойчивостью к факторам внешней среды — температуре, солнечному свету, влажности. Хлорамин и прочие хлорсодержащие дезинфектанты уничтожают их за пару минут. Дифтероиды обитают в различных биоценозах здорового человеческого организма — в носоглотке, на коже, в уретре, половых органах, сперме.
Признаки, отличающие данный вид от патогенных коринебактерий:
- Отсутствие волютина,
- Хаотичное расположение в мазке,
- Массивный рост на простых питательных средах при 37 градусах.
Corynebacterium pseudodiphtheriticum вызывает гнойно-воспалительные процессы при ослаблении макроорганизма вирусными инфекциями, стрессами, онкопатологиями, вторичным иммунодефицитом. При этом заболевание не развивается в местах обычного обитания бактерий. Они не способны к токсинообразованию. Проникая в кровь, коринебактерии способствуют развитию бактериемии. Известны случаи тяжелых бронхитов и пневмоний на фоне длительной иммуносупрессии. Эти микробы могут вызывать эндокардит, лимфаденит, дерматологические заболевания, инфекцию мочевыводящих путей.
Дисбиотические изменения развиваются в организме при увеличении количества дифтероидов до 10 в 5 или 6 степени микробных клеток. При этом возникают характерные клинические проявления.
-
При поражении носоглотки развивается ринит или ринофарингит. У больных возникает заложенность носа по ночам, ринорея, утренний кашель с выделением слегка зеленоватой мокроты. Обычно местные симптомы не сопровождаются общей интоксикацией и астенизацией организма. Состояние больных остается удовлетворительным. Лечение corynebacterium pseudodiphtheriticum в данном случае заключается в промывании носа «Аквалором» или «Аквамарисом», местном использовании «Полидексы» и рассасывании «Имудона». При отсутствии эффекта от подобных манипуляций назначают пероральный прием «Ципрофлоксацина».
- Воспаление слизистой зева проявляется першением и болью в горле, гиперемией и отечностью миндалин и небных дужек, покашливанием, ухудшением общего самочувствия – вялостью, слабостью, ломотой. Специалисты рекомендуют орошать слизистую горла «Мирамистином», «Хлорофиллиптом», «Гексоралом», рассасывать антисептические леденцы и пастилки. В более тяжелых случаях назначают антибиотикотерапию.
- Поражение бронхолегочных структур приводит к развитию бронхита или пневмонии. Заболевания характеризуются относительно легким течением и хорошо поддаются терапии. Больные жалуются на влажный кашель, одышку, боль за грудиной, периодический субфебрилитет, регионарный лимфаденит. Показано внутримышечное введение антибиотиков, к которым чувствителен микроб, а также патогенетическая и симптоматическая терапия, устраняющая клинические проявления и улучшающая общее самочувствие больных.
- Уретрит и простатит у мужчин, а также цистит, цервицит и вагинит у женщин проявляются стандартными признаками дизурии, болью и резью при мочеиспускании, жжением и зудом во влагалище, вагинальными выделениями с запахом, неприятными ощущениями при половой близости, снижением либидо и потенции. Больным показана общая и местная антибактериальная терапия. При цистите и уретрите проводят инстилляции антибиотиков в мочевой пузырь, при вагините и цервиците суппозитории с противомикробным и антисептическим компонентами вводят во влагалище.
Лечение заболеваний, вызванных Corynebacterium pseudodiphtheriticum, заключается в применении бактериофагов, антибиотиков, проведении плазмафереза и других способов очищения крови.
Если дифтероиды были выделены из крови, ликвора, мочи и других стерильных субстратов, их необходимо рассматривать как потенциальных возбудителей и проводить соответствующее лечение. В микробиологической лаборатории для этого ставят тест на чувствительность выделенного микроба к антибиотикам.
источник
Взятие материала проводится до начала антибактериальной терапии или не ранее, чем через 2 недели после ее окончания.
- Ротоглотка. Взятие материала проводят до еды, питья и чистки зубов.
- Мокрота. Перед сбором мокроты почистить зубы и прополоскать рот и горло водой Сбор материала производить после глубокого откашливания сначала в стерильный контейнер с крышкой. Далее, необходимо, пропитать содержимым зонд-тампон в течение 5 секунд, стараясь захватить плотные комочки, и погрузить зонд-тампон в пробирку, обломить по метке и плотно закрыть крышкой
- Пазухи носа, Бронхоальвеолярный лаваж, трахеобронхиальные смывы: Взятие биоматериала производит врач!
В лабораторию необходимо доставить пробирку с крышкой фиолетового цвета, с жидкой средой AMIES, с зонд-тампоном, пропитанным биоматериалом (пробирку можно получить в регистратуре CMD). Доставка в лабораторию в день взятия биоматериала.
Метод исследования: Микробиологический
Corynebacterium diphtheriae (палочки Леффлера) – возбудители дифтерии, характеризующейся фибринозным воспалением в месте входных ворот инфекции и токсическим поражением преимущественно сердечно-сосудистой и нервной систем. Наиболее частая форма – дифтерия ротоглотки (дифтерийная ангина), а при локализации воспаления на гортани или трахее может развиться дифтерийный круп. Основной путь передачи воздушно-капельный. Заражение происходит от больных или бактерионосителей.
Идентификация микроорганизма производится на высокоточном масс-спектрометре Microflex (Bruker).
- Обследование лиц с подозрением на дифтерию;
- Обследование контактных лиц;
- Оценка эффективности антибактериальной терапии.
Результат бактериологического исследования , в случае обнаружения возбудителя дифтерии (Corynebacterium diphtheriae) предоставляется в качественном формате.
Референсные значения (вариант нормы): не обнаружено.
Интерпретация проводится врачом с учетом клинических проявлений.
Обращаем Ваше внимание на то, что интерпретация результатов исследований, установление диагноза, а также назначение лечения, в соответствии с Федеральным законом № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации» от 21 ноября 2011 года, должны производиться врачом соответствующей специализации.
» [«serv_cost»]=> string(3) «820» [«cito_price»]=> NULL [«parent»]=> string(3) «542» [10]=> string(1) «1» [«limit»]=> NULL [«bmats»]=> array(8) array(3) string(1) «N» [«own_bmat»]=> string(2) «12» [«name»]=> string(14) «Мокрота» > [1]=> array(3) string(1) «N» [«own_bmat»]=> string(2) «12» [«name»]=> string(47) «Бронхоальвеолярный лаваж» > [2]=> array(3) string(1) «N» [«own_bmat»]=> string(2) «12» [«name»]=> string(12) «Другой» > [3]=> array(3) string(1) «N» [«own_bmat»]=> string(2) «12» [«name»]=> string(52) «Мазок/отделяемое ротоглотки» > [4]=> array(3) string(1) «N» [«own_bmat»]=> string(2) «12» [«name»]=> string(52) «Мазок/отделяемое носоглотки» > [5]=> array(3) string(1) «N» [«own_bmat»]=> string(2) «12» [«name»]=> string(57) «Мазок/отделяемое носовых ходов» > [6]=> array(3) string(1) «N» [«own_bmat»]=> string(2) «12» [«name»]=> string(34) «Пунктат пазух носа» > [7]=> array(3) string(1) «N» [«own_bmat»]=> string(2) «12» [«name»]=> string(47) «Трахеобронхиальные смывы» > > >
| Тип | В офисе |
|---|---|
| Мокрота | |
| Бронхоальвеолярный лаваж | |
| Другой | |
| Мазок/отделяемое ротоглотки | |
| Мазок/отделяемое носоглотки | |
| Мазок/отделяемое носовых ходов | |
| Пунктат пазух носа | |
| Трахеобронхиальные смывы |
Взятие материала проводится до начала антибактериальной терапии или не ранее, чем через 2 недели после ее окончания.
- Ротоглотка. Взятие материала проводят до еды, питья и чистки зубов.
- Мокрота. Перед сбором мокроты почистить зубы и прополоскать рот и горло водой Сбор материала производить после глубокого откашливания сначала в стерильный контейнер с крышкой. Далее, необходимо, пропитать содержимым зонд-тампон в течение 5 секунд, стараясь захватить плотные комочки, и погрузить зонд-тампон в пробирку, обломить по метке и плотно закрыть крышкой
- Пазухи носа, Бронхоальвеолярный лаваж, трахеобронхиальные смывы: Взятие биоматериала производит врач!
В лабораторию необходимо доставить пробирку с крышкой фиолетового цвета, с жидкой средой AMIES, с зонд-тампоном, пропитанным биоматериалом (пробирку можно получить в регистратуре CMD). Доставка в лабораторию в день взятия биоматериала.
Метод исследования: Микробиологический
Corynebacterium diphtheriae (палочки Леффлера) – возбудители дифтерии, характеризующейся фибринозным воспалением в месте входных ворот инфекции и токсическим поражением преимущественно сердечно-сосудистой и нервной систем. Наиболее частая форма – дифтерия ротоглотки (дифтерийная ангина), а при локализации воспаления на гортани или трахее может развиться дифтерийный круп. Основной путь передачи воздушно-капельный. Заражение происходит от больных или бактерионосителей.
Идентификация микроорганизма производится на высокоточном масс-спектрометре Microflex (Bruker).
- Обследование лиц с подозрением на дифтерию;
- Обследование контактных лиц;
- Оценка эффективности антибактериальной терапии.
Результат бактериологического исследования , в случае обнаружения возбудителя дифтерии (Corynebacterium diphtheriae) предоставляется в качественном формате.
Референсные значения (вариант нормы): не обнаружено.
Интерпретация проводится врачом с учетом клинических проявлений.
Обращаем Ваше внимание на то, что интерпретация результатов исследований, установление диагноза, а также назначение лечения, в соответствии с Федеральным законом № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации» от 21 ноября 2011 года, должны производиться врачом соответствующей специализации.
Продолжая использовать наш сайт, вы даете согласие на обработку файлов cookie, пользовательских данных (сведения о местоположении; тип и версия ОС; тип и версия Браузера; тип устройства и разрешение его экрана; источник откуда пришел на сайт пользователь; с какого сайта или по какой рекламе; язык ОС и Браузера; какие страницы открывает и на какие кнопки нажимает пользователь; ip-адрес) в целях функционирования сайта, проведения ретаргетинга и проведения статистических исследований и обзоров. Если вы не хотите, чтобы ваши данные обрабатывались, покиньте сайт.
Copyright ФБУН Центральный НИИ Эпидемиологии Роспотребнадзора, 1998 — 2019
Центральный офис: 111123, Россия, Москва, ул. Новогиреевская, д.3а, метро «Шоссе Энтузиастов», «Перово»
+7 (495) 788-000-1, info@cmd-online.ru
! Продолжая использовать наш сайт, вы даете согласие на обработку файлов cookie, пользовательских данных (сведения о местоположении; тип и версия ОС; тип и версия Браузера; тип устройства и разрешение его экрана; источник откуда пришел на сайт пользователь; с какого сайта или по какой рекламе; язык ОС и Браузера; какие страницы открывает и на какие кнопки нажимает пользователь; ip-адрес) в целях функционирования сайта, проведения ретаргетинга и проведения статистических исследований и обзоров. Если вы не хотите, чтобы ваши данные обрабатывались, покиньте сайт.
источник
Сдача мазка на дифтерию производится натощак либо через 1,5-2 часа после еды с помощью шпателя. Дифтерия вызывается неподвижной аэробной бактерией.
При развитии данного недуга у пациента проявляются следующие симптомы:
- интоксикация организма;
- воспаление горла;
- нарушенное дыхание;
- поражение почек и сердца.
В некоторых случаях заболевание заканчивается летальным исходом. Поэтому специалисты рекомендуют своевременно сдавать анализ на дифтерию. Детям до 11 лет, которые нуждаются в ревакцинации, делают прививки. Маленькие пациенты, контактировавшие с больным дифтерией и не получившие законченную вакцинацию (первичную ревакцинацию), получают реакцию Шика (при ее отсутствии в течение последнего года).
Ребенок, заболевший дифтерией, изолируется от остальных членов семьи, то есть госпитализируется. Место, где находился заболевший, дезинфицируется. Предварительно о результатах анализа мазка из носовых путей сообщается работникам детского учреждения. После госпитализации больного в доме проводится влажная уборка.
Дифтерия относится к острым инфекционным заболеваниям. Для нее характерно образование фиброзной пленки. Недуг вызывается Corynebacterium diphtheriae, который повреждает различные органы и ткани человеческого организма. Corynebacterium diphtheriae — это грамположительная палочка, которую исследовал Фридрих Леффлер в 1984 г. Источником инфекции считается больной человек либо здоровый бактерионоситель.
Рассматриваемое заболевание передается воздушно-капельным или контактно-бытовым путем. Специалисты выделяют следующую классификацию грамположительной палочки:
Классификация бактерий зависит от морфологических, культуральных и ферментативных свойств Corynebacterium diphtheriae. Бактерии токсигенного типа вырабатывают один токсин. Нетоксигенные аналоги не продуцируют и не вызывают дифтерию. Поэтому при подозрении на рассматриваемый недуг рекомендуется определить принадлежность штаммов Сorynebacterium diphtheriae. Для этого больной сдает мазок из зева и носа.
Врач ставит диагноз с учетом клинической картины недуга и результатов эпидемиологического обследования. Чтобы подтвердить диагноз, медики применяют бактериологический способ лабораторной диагностики. Этот способ позволяет выявить этиологический фактор — палочку Леффлера.
Чтобы выявить возбудителей недуга, потребуется 8-12 часов (если пациент не принимал медикаменты). В противном случае исследование не будет эффективным, так как замедляется рост бактерий. В таком случае применяют серологические способы диагностики.
Реакция пассивной гемагглютинации проводится в первые 3 дня и через 7-10 суток после постановки диагноза. Подобная методика позволяет определить антитела к дифтерийному токсину. Если антитела нарастают больше, чем в 4 раза, тогда анализ можно назвать положительным. Рассматриваемая методика считается высокочувствительной и специфической диагностикой. Чтобы выявить лица, у которых отсутствует иммунитет к дифтерии, определяют уровень антител к соответствующему анатоксину. Если антитела отсутствуют либо их количество незначительно, тогда пациент нуждается в вакцинации АКДС.
Эффективность вакцинации определяется по нарастанию титра антител.
Чтобы обеспечить активную выработку специфического иммунитета, проводится соответствующая иммунизация. В задачи анатоксина входит защита организма от интоксикации.
Медики выделяют следующие показания к сбору посева из носа:
На результаты анализа прямое влияние оказывают такие факторы, как хилез и гемолиз пробы. Назначить посев может лечащий врач-терапевт. Предварительно больному потребуется сдать натощак кровь. Пациент может пить только воду. Кровь исследуют до начала приема медикаментов либо не ранее чем через 7-14 дней после их отмены. В противном случае потребуется указать, какие препараты (включая дозировку) принимает больной.
За 1 день до сдачи крови из рациона пациента исключают жареную и жирную пищу. Больному противопоказаны спиртные напитки и тяжелые физические нагрузки. Отрицательным результатом исследования считается титр менее 1/200. Если результат равен либо выше этого значения, тогда он положительный (пациент болел или болеет дифтерией либо вакцинация эффективна).
Отрицательный результат свидетельствует об отсутствии или ранних сроках инфекции, а также об отсутствии или неэффективной вакцинации. В любом случае нельзя определить чувствительность к медикаментам, так как нет стандартизированного метода.
Чтобы вылечить токсическую форму, применяют противодифтерийную антитоксическую сыворотку и «Пенициллин G». Санация носителей предусматривает применение «Эритромицина». Курс лечения назначает врач. Нельзя заниматься самолечением.
источник
Возбудитель дифтерии относится к роду Corynebacterium (от лат. coryna — булава, diphthera — пленка). Бактерии имеют булавовидные утолщения на концах. К этому роду относятся патогенные для человека дифтерийные палочки и непатогенные виды — ложнодифтерийные палочки и дифтероиды, обнаруживаемые на слизистых оболочках и кожных покровах.
Возбудители дифтерии — Corynebacterium diphtheriae — были обнаружены Т. Клебсом (1883) и выделены в чистом виде Ф. Леффлером (1884).
Морфология. Возбудители дифтерии слегка изогнутые, тонкие палочки, размером 3-6 × 0,3-0,5 мкм, на концах которых имеются утолщения. В этих утолщениях имеются зерна волютина (зерна Бабеша — Эрнста). Бактерии дифтерии неподвижны, не имеют спор и капсул. Грамположительны. Они хорошо окрашиваются основными анилиновыми красителями, при этом волютиновые зерна окрашиваются интенсивнее. Для окраски обычно применяют щелочной метиленовый синий или кристаллический фиолетовый. Особенностью коринебактерий дифтерии является их полиморфность; в одной кулатуре встречаются различные по форме и размерам палочки: изогнутые, прямые, длинные, короткие, толстые, иногда коккобактерии. Характерно расположение бактерий в мазках — они обычно располагаются попарно под острым или тупым углом, в виде растопыренных пальцев и т. д. Расположение в мазках и наличие зерен волютина является дифференциально-диагностическим признаком при микроскопическом исследовании. Непатогенные представители рода коринебактерий — ложнодифтерийные палочки и дифтериоды чаще располагаются в виде частокола, зерна волютина у них могут отсутствовать либо быть на одном конце (см. рис. 4).
Культивирование. Коринебактерий дифтерии — факультативные анаэробы. Растут при температуре 35-37° С, рН среды 7,4-7,8. Они не размножаются на обычных питательных средах. Культивируют их на средах, содержащих кровь или сыворотку.
В конце XIX века французский ученый Э. Ру для культивирования бактерий дифтерии предложил использовать свернутую бычью или лошадиную сыворотку, а Ф. Леффлер рекомендовал добавлять к ней бульон (25%) и 1% глюкозу. На этих средах коринебактерий растут быстро, в течение 14-18 ч образуют несливающиеся выпуклые колонии кремового цвета (рост на скошенной среде напоминает шагреневую кожу). Однако отдифференцировать на этих средах дифтерийные палочки от ложнодифтерийных невозможно.
В настоящее время основными средами для выращивания являются среда Клауберга (содержащая сыворотку крови и теллурит калия), хинозольная среда Бунина, среда Тинсдаля и др. На основании культуральных и ферментативных свойств коринебактерий дифтерии делят на три биовара: гравис (gravis), ми тис (mitis), интермедиус (intermedins). Биовар гравис обычно находится в R-форме. На среде Клауберга бактерии этого биовара растут в виде крупных колоний 2-3 мм, серовато-черного цвета (так как восстанавливают теллурит в теллур), имеют изрезанные края, что придает им вид розетки. При прикосновении к колонии петлей она как бы рассыпается. На бульоне бактерии этого биовара образуют крошащуюся пленку и зернистый осадок.
Коринебактерии биовара митис (mitis) на среде Клауберга растут в виде небольших, гладких колоний (S-форма) черного цвета. На бульоне они дают равномерное помутнение.
Коринебактерии биовара интермедиус (intermedins) являются промежуточными. На среде Клауберга бактерии этого биовара чаще растут в виде блестящих, мелких, черных колоний (этот биовар встречается редко).
Ферментативные свойства. Все три биовара дифтерийных бактерий обладают ферментом цистиназой, расщепляющим цистин с образованием сероводорода. Эти свойства используются для дифференциации возбудителей дифтерии от непатогенных представителей этого рода (табл. 49).
Таблица 49. Свойства возбудителей дифтерии и близких к ним коринебактерий
Примечание. + положительная реакция (расщепляет); — отрицательная реакция (не расщепляет).
Возбудители всех трех биоваров расщепляют глюкозу и мальтозу до образования кислоты. С. gravis расщепляют крахмал. Это свойство отличает его от двух других биоваров. Коринебактерий дифтерии восстанавливают нитраты в нитриты, не образуют индол, не разлагают мочевину.
Коринебактерии дифтерии образуют нейраминидазу, гиалуронидазу и другие ферменты патогенности.
Токсинообразование. Вирулентные штаммы возбудителей дифтерии продуцируют экзотоксин. Химически он представляет собой термолабильный белок, состоящий из Двух фракций. Фракция В фиксирует токсин на чувствительных к нему тканях организма. Фракция А ответственна за токсическое действие. Силу токсина дифтерийных культур можно устанавливать «in vivo» на чувствительных к этому токсину морских свинках. Dim дифтерийного экзотоксина — минимальная смертельная доза, это минимальное количество яда, убивающее морскую свинку массой 250 г на 4-й день.
Наличие экзотоксина можно обнаружить также «in vitro» — на плотной питательной среде. Этот метод широко используется в практической работе. Дифтерийный экзотоксин малоустойчив. Он быстро разрушается под влиянием температуры, света и кислорода воздуха. После добавления к токсину формалина (0,3-0,4%) и выдерживания его при температуре 37-38° С в течение нескольких недель он переходит в анатоксин, который теряет ядовитость, но сохраняет антигенные свойства токсина. Токсины, образуемые различными штаммами, не различаются между собой и могут быть нейтрализованы дифтерийным антитоксином * .
* ( В настоящее время установлено, что все биовары коринебактерий могут быть токсигенными и нетоксигенными.)
Антигенная структура. У бактерий дифтерии имеется поверхностный термолабильный белковый антиген и типоспецифический полисахаридный О-антиген. Кроме этого, среди коринебактерий различают 19 фаговаров, которые учитываются при идентификации культур. С помощью фаговаров выявляют источник заболевания.
Устойчивость к факторам окружающей среды. Возбудители дифтериии сравнительно устойчивы. Температура 60° С убивает их через 10-15 мин, 100° С — через минуту. В пленке они выдерживают нагревание до 90° С. На свернутой сыворотке при комнатной температуре сохраняются до 2 мес, на детских игрушках — несколько суток. Низкие температуры коринебактерий переносят хорошо. К высушиванию возбудители дифтерии довольно устойчивы. Дезинфицирующие вещества (3% раствор фенола, 1% раствор сулемы, 10% раствор перекиси водорода) убивают эти бактерии в течение нескольких минут.
Восприимчивость животных. В естественных условиях животные дифтерией не болеют. Из экспериментальных животных наиболее восприимчивы морские свинки и кролики. При внутрикожном или подкожном заражении у них развивается картина токсикоинфекции с образованием на месте введения воспаления, отека, некроза. В надпочечниках наблюдаются кровоизлияния.
Источники заболевания. Больные люди и бактерионосители.
Пути передачи. Воздушно-капельный путь, контактно-бытовой (через посуду, игрушки, книги, полотенца и т. д.).
Заболевание у человека: 1) дифтерия зева; 2) дифтерия носа.
Реже возникает дифтерия трахеи, бронхов, глаз, уха, влагалища и дифтерия поврежденной кожи.
Патогенез. Входными воротами являются слизистые оболочки дыхательных путей и поврежденная кожа. Попав на слизистую оболочку, возбудители дифтерии размножаются в месте внедрения и вызывают некроз ткани. Образуется пленка, тесно связанная с подлежащими тканями. На поверхности слизистой появляются грязно-серые или желтоватые налеты, состоящие из разрушенного эпителия, фибрина, лейкоцитов и коринебактерий дифтерии. При снятии пленки ватным тампоном или шпателем поверхность слизистой может кровоточить.
В процессе размножения коринебактерий дифтерии в некротических участках накапливается экзотоксин, который может привести к отеку слизистой оболочки и клетчатки. Со слизистой оболочки отек может распространяться на гортань, бронхи и вызвать явления асфиксии. Токсин, циркулирующий в крови, избирательно поражает сердечную мышцу, надпочечники и клетки нервной ткани.
Дифтерия — это токсикоинфекция. Тяжесть процесса зависит от степени токсигенности штамма и от защитных сил организма.
Иммунитет. Невосприимчивость обусловливается антитоксическим и антибактериальным иммунитетом. Грудные дети не болеют, так как у них имеется пассивный иммунитет, переданный от матери.
О наличии антитоксического иммунитета судят по реакции Шика. Для постановки реакции 1 /40 Dlm (летальной дозы токсина для морской свинки), содержащегося в 0,2 мл изотонического раствора натрия хлорида, вводят внутрикожно в области предплечья. При отсутствии в крови антитоксина в месте введения через 24-48 ч появляется краснота и припухлость (до 2 см в диаметре). При наличии антитоксина припухлости и красноты нет (имеющийся в крови антитоксин нейтрализовал введенный токсин).
Перенесенное заболевание оставляет иммунитет. Однако в 6-7% случаев наблюдаются повторные заболевания.
Профилактика. Ранняя диагностика. Изоляция. Дезинфекция. Выявление носителей токсигенной дифтерийной палочки.
Специфическая профилактика осуществляется введением анатоксина. В СССР проводят обязательную вакцинацию детей вакциной АКДС — это комплексная вакцина, в которую входят дифтерийный и столбнячный анатоксин и взвесь убитых коклюшных палочек. Вакцинируют детей с 5-6 месяцев с последующей ревакцинацией. Для ревакцинации вводят вакцину без коклюшных палочек.
Специфическое лечение. Применяют противодифтерийную антитоксическую сыворотку. Доза и кратность определяется лечащим врачом, вводят также антимикробные препараты.
1. Какова морфология коринебактерий дифтерии и какие имеются биовары?
2. На каких средах выращивают бактерии дифтерии и каков характер роста?
3. Отношение к какому углеводу позволяет отличить биовар gravis от других биоваров дифтерии?
4. Каков путь передачи и где чаще локализуется возбудитель дифтерии у больного?
5. Каковы специфическая профилактика и специфическое лечение дифтерии?
Цель исследования: выделение возбудителя для постановки диагноза. Выявление бактерионосителей дифтерии по эпидемиологическим показаниям. Выявление экзотоксина у выделенной культуры.
1. Отделяемое слизистой оболочки зева.
2. Отделяемое слизистой оболочки носа.
3. Отделяемое слизистой оболочки глаза.
5. Отделяемое слизистой оболочки влагалища.
Материал для исследования зависит от локализации процесса.
Способы сбора материала
При любой локализации процесса обязательно исследует слизистую зева и носа. Материал собирают ватным тампоном, для чего используют металлическую проволоку, желательно алюминиевую, на один конец которой плотно накручивают вату, затем тампон монтируют в корковую пробку, помещают в пробирку и стерилизуют в печи Пастера при температуре 160° С 1 тампон течение часа или в автоклаве при температуре 112° С.
Примечания. 1. Материал собирают натощак либо не раньше чем через 2 ч после еды и не ранее чем через 4 дня после лечения антибиотиками или другими антибактериальными средствами. 2. Если материал берут из зева и носа, то пробирки с обоими тампонами надписывают и связывают вместе. Посевы делают раздельно и исследование материала из каждого тампона ведут как самостоятельную работу. 3 Материал, собранный сухим тампоном, должен быть посеян не позднее чем через 2-3 ч после забора. При необходимости транспортировки собранного материала тампон предварительно смачивают 5% раствором глицерина в изотоническом растворе натрия хлорида.
Первый день исследования
Чашки вынимают из термостата и просматривают. Рост бактерий на среде Клауберга может быть замедлен из-за наличия ингибиторов в среде. В этом случае чашки ставят в термостат еще на 24 ч.
Чашки вынимают из термостата, просматривают их с помощью лупы или стереоскопического микроскопа. При наличии подозрительных колоний часть их под контролем стереоскопического микроскопа выделяют на агар с 25% сывороткой и на столбик со средой Пизу для определения фермента цистиназы. Из другой части колоний ставят пробу на токсигенность.
При микроскопическом исследовании колоний, снятых со среды Клауберга, коринебактерии дифтерии теряют свою специфичность: отсутствует зернистость, изменяется величина, расположение сохраняется. При посеве их на среды с сывороткой морфологическая специфичность возбудителей дифтерии восстанавливается.
Проба на наличие фермента цистиназы и определение токсигенности являются обязательными при идентификации возбудителей дифтерии. Если результат этих опытов, проведенных с частью колоний со среды Клауберга, недостаточно четкий или отрицательный, то опыт повторяют, используя выделенную чистую культуру.
Проба на цистиназу. Проводят посев исследуемой культуры уколом в центр столбика среды Пизу. При положительной реакции через 18-24 ч по ходу укола наблюдается почернение, а вокруг черного стержня образуется темное облачко; почернение происходит в результате того, что фермент цистиназа расщепляет цистин, входящий в состав среды Пизу, и освободившаяся сера вступает в реакцию с ацетатом свинца — образуется сульфит свинца черного цвета. Дифтероиды и ложнодифтерийные палочки не содержат фермент цистиназу, поэтому при росте их на среде Пизу цвет среды не изменяется.
Определение экзотоксина. Проводят методом диффузной преципитации в геле. Метод основан на взаимодействии токсина с антитоксином. В тех участках агара, где эти компоненты взаимодействуют, образуется преципитат в виде закругленных линий.
Методика определения: в чашки Петри разливают растопленный и охлажденный до 50° С агар Мартена рН 7,8 (на агаре Мартена лучше продуцируется экзотоксин). Количество агара в чашке должно быть не более 12-15 мл, чтобы сохранить прозрачность, — в толстом слое линии преципитации плохо видны. После застывания агара накладывают полоску стерильной фильтровальной бумаги, смоченной противодифтерийной антитоксической сывороткой.
Испытуемую культуру засевают «бляшками». Посев производят петлей. Диаметр бляшек 0,8-1,0 см. Расстояние бляшек от края полосок бумаги 0,5-0,7 см, между двумя бляшками испытуемой культуры засевают бляшки заведомо токсигенного штамма. Испытуемую культуру считают токсигенной, если линии преципитации четки и сливаются с линиями преципитации контрольного (токсигенного) штамма. Если линии преципитации перекрещиваются с линиями контрольного штамма или отсутствуют, выделенную культуру считают нетоксигенной (рис. 50).
Рис. 50. Выявление экзотоксина C.Diphtheriae методом диффузной преципитации в агаре. 1 — бляшки нетоксигенного штамма (линии преципитации перекрещиваются); 2 — бляшки токсигенного штамма (линии преципитации соединяются)
Приготовление полосок бумаги. Из фильтровальной бумаги нарезают полоски размером 1,5×8 см, заворачивают по несколько штук в бумагу и стерилизуют в автоклаве при температуре 120° С в течение 30 мин. Перед постановкой опыта стерильным пинцетом вынимают одну полоску, укладывают ее в стерильную чашку Петри и смачивают противодифтерийной антитоксической сывороткой. Предварительно сыворотку разводят так, чтобы в 1 мл содержалось 500 АЕ (антитоксических единиц). Бумажку смачивают 0,25 мл сыворотки (125 АЕ) и помещают на поверхность среды. Затем делают посевы указанным выше способом. Все посевы ставят в термостат. Учет результатов производят через 18-24 и 48 ч.
Вынимают посевы из термостата, учитывают результат. Делают мазки из культуры, выросшей на среде с сывороткой, и окрашивают их синим Леффлера.
Наличие в мазках характерных по морфологии палочек, черного с облачком стержня в среде Пизу и линий преципитации в агаре позволяет дать предварительный ответ: «Обнаружены коринебактерии дифтерии». Исследование продолжают. При отсутствии линий преципитации в агаре или их недостаточной четкости исследование на токсигенность обязательно повторяют с выделенной чистой культурой.
Для окончательной идентификации выделенной культуры и определения биовара возбудителя производят посев на глюкозу, сахарозу, крахмал и бульон с мочевиной (для выявления фермента уреазы). Посев на среды делают обычным способом.
Проба на уреазу. Выделенную культуру засевают на бульон с мочевиной и индикатором (крезоловый красный) и ставят в термостат. Уже через 30-40 мин можно учитывать результат: при посеве истинных возбудителей дифтерии цвет среды не изменяется, так как они не содержат уреазу. Псевдодифтерийные палочки расщепляют мочевину и изменяют индикатор — среда приобретает малиново-красный цвет.
Производят учет результатов (табл. 50).
Таблица 50. Ферментативные свойства выделенных возбудителей
1. Какой материал исследуют для выявления возбудителя дифтерии?
2. Как собирают материал для исследования на дифтерию из зева и носа?
3. Что нужно сделать с тампоном, если собранный материал необходимо транспортировать?
4. При помощи какого прибора изучают колонии на среде Клауберга?
5. Какие исследования проводят для окончательной идентификации выделенной культуры?
6. Какими методами определяют токсигенность коринебактерий дифтерии?
1. Возьмите у преподавателя проволоку и вату и приготовьте 10 тампонов, вмонтируйте их в корковую пробку, вставьте в пробирку и простерилизуйте.
Внимание! Перед стерилизацией проверьте, достаточно ли плотно накручен тампон.
2. Возьмите у преподавателя стерильные тампоны и произведите забор материала друг у друга из зева и носа (разными тампонами).
3. Изучите по табл. 49 свойства возбудителей дифтерии и близких к ним коринебактерий.
4. Поставьте пробу на токсигенность. Бляшки сделайте петлей без культуры.
5. Зарисуйте ход исследования и положительный и отрицательный результат пробы на токсигенность.
Теллуровая среда Клауберга: первая смесь — предварительно за 1,5 мес готовят смесь из 20 мл бараньей или лошадиной крови и 10 мл глицерина. В день приготовления среды готовят две другие смеси; вторая смесь — 50 мл МПА рН 7,5 растапливают и охлаждают до температуры 50° С, после чего прибавляют 2,5 мл первой смеси; третья смесь — смешивают 17 мл бараньей крови и 33 мл дистиллированной воды (смесь приготавливают стерильно), подогревают на водяной бане до температуры 50° С. Соединяют вторую и третью смеси, прибавляют 4 мл 1% раствора теллурита калия К2ТеО3, быстро все перемешивают и разливают в чашки. Среда прозрачная, имеет цвет красного вина.
Среда Пизу. К 90 мл расплавленного 2% МПА (рН 7,6) добавляют 2 мл раствора цистина (1% раствор цистина в 0,1 н. растворе гидроксида натрия), тщательно перемешивают и добавляют такой же объем 0,1 н. раствора серной кислоты. Среду стерилизуют 30 мин при температуре 112° С. К расплавленной и охлажденной до 50° С среде добавляют 1 мл 10% раствора ацетата свинца, стерилизованного двукратно текучим паром, перемешивают и добавляют 9 мл нормальной лошадиной сыворотки. Среду стерильно разливают в маленькие пробирки по 2 мл. Посев производят уколом.
Среда Бунина. Сухую хинозольную среду добавляют к 100 мл холодной воды (рН 7,6-7,8), размешивают и нагревают на слабом огне до расплавления агара (по прописи на этикетке). Затем среду кипятят 2-3 мин до образования пены, после чего среду остужают до 50° С и добавляют 5-10 мл стерильной дефибринированной крови. Среду перемешивают и разливают в чашки Петри. Готовую среду можно сохранять 3-4 дня при температуре 4-10°.
Среда Тинсдаля. К 100 мл 2% питательного агара, расплавленного и охлажденного до 50° С, добавляют: 1) 12 мл 1% раствора цистина на 0,1 н. растворе серной кислоты; 2) 12 мл 1% раствора гидроксида натрия; 3) 1,8 мл 2% раствора теллурита калия; 4) 1,8 мл 2,5% раствора гипосульфита натрия, 20 мл нормальной лошадиной или бычьей сыворотки. После добавления каждого ингредиента среду тщательно перемешивают. Чашки со средой хранят 3-4 дня при 10° С.
источник
 При поражении носоглотки развивается ринит или ринофарингит. У больных возникает заложенность носа по ночам, ринорея, утренний кашель с выделением слегка зеленоватой мокроты. Обычно местные симптомы не сопровождаются общей интоксикацией и астенизацией организма. Состояние больных остается удовлетворительным. Лечение corynebacterium pseudodiphtheriticum в данном случае заключается в промывании носа «Аквалором» или «Аквамарисом», местном использовании «Полидексы» и рассасывании «Имудона». При отсутствии эффекта от подобных манипуляций назначают пероральный прием «Ципрофлоксацина».
При поражении носоглотки развивается ринит или ринофарингит. У больных возникает заложенность носа по ночам, ринорея, утренний кашель с выделением слегка зеленоватой мокроты. Обычно местные симптомы не сопровождаются общей интоксикацией и астенизацией организма. Состояние больных остается удовлетворительным. Лечение corynebacterium pseudodiphtheriticum в данном случае заключается в промывании носа «Аквалором» или «Аквамарисом», местном использовании «Полидексы» и рассасывании «Имудона». При отсутствии эффекта от подобных манипуляций назначают пероральный прием «Ципрофлоксацина».