К роду Corynebacterium относятся бактерии, имеющие булавовидные утолщения на концах: коринебактерии, патогенные для человека и животных, и дифтероиды (непатогенные и условно-патогенные коринебактерии).
Открытию возбудителя дифтерии предшествовали обширные клинические, патологоанатомические, эпидемиологические и экспериментальные исследования, которые в значительной степени подготовили почву для его обнаружения (Клебс Э., 1883), выделения в чистой культуре (Леффлер Ф. , 1884), получения токсина (Ру Э. и Иерсен А., 1888), антитоксической сыворотки (Беринг Э., Китазато, 1890, Ру Э., 1894) и дифтерийного анатоксина (Рамон Г. , 1923).
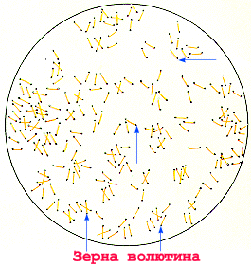
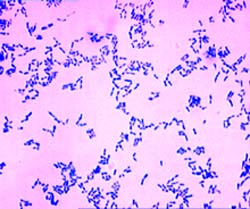
Морфология.Дифтерийные коринебактерии – Corynebacterium diphtheriae (лат. согуnа булава, diphthera – пленка, кожа) прямые или слегка изогнутые палочки длиной 1 8 мкм и шириной 03 0,8 мкм, полиморфные, лучше окрашиваются по полюсам, на которых расположены метахроматические гранулы волютина (зерна Бабеша Эрнста, полиметафосфаты) У дифтерийных коринебактерий наблюдаются булавовидные утолщения по концам, содержащие зерна волютина, иногда появляются ветвистые и нитевидные формы, а также короткие образования, почти кокковидные и дрожжеподобные. В мазках они располагаются V-образно (под углом), принимая вид растопыренных пальцев. Они не образуют спор, капсул и жгутиков, грамположительны.
Культивирование. Возбудитель дифтерии аэроб или факультативный анаэроб, хорошо культивируется на средах, содержащих белок (свернутой сыворотке, кровяном агаре, сывороточным aгapе), а также на сахарном бульоне. На среде Ру (свернутая лошадиная сыворотка) и среде Леффлера (3 части бычьей сыворотки + 1 часть сахарного бульона) дифтерийные коринебактерии развиваются в течение 16 18 ч, рост их напоминает шагреневую кожу, колонии между собой не сливаются.
По культуральным и биологическим свойствам коринебактерии дифтерии подразделяются на три биовара gravis, mitis и intermedius, которые отличаются друг от друга по ряду признаков.
Коринебактерии биовара gravis на теллуритовом агаре, содержащем дефибринированную кровь и теллурит калия, образуют крупные шероховатые (R-формы) розеткообразные колонии черного или серого цвета. Они ферментируют декстрин, крахмал и гликоген, в бульоне образуют поверхностную пленку и зернистый осадок, обычно высокотоксичны и обладают более выраженными инвазионными свойствами.
Коринебактерии биовара mitis на теллуровом агаре растут с образованием темных гладких (S-формы) блестящих колоний. Они не ферментируют крахмал и гликоген, декстрин ферментируют непостоянно, вызывают гемолиз эритроцитов всех видов животных, в бульоне отмечается диффузное помутнение. Культуры этого типа, как правило, менее токсигенны и инвазионны, чем коринебактерии биовара gravis.
Коринебактерии биовара intermedius занимают промежуточное положение. Колонии у них на теллуритовом агаре мелкие (RS-формы), черного цвета, не ферментируют крахмал и гликоген, в бульоне растут с появлением мути и зернистого осадка.
Ферментативные свойства. Дифтерийные коринебактерии (все три биовара) не свертывают молоко, не разлагают мочевину, не выделяют индол, слабо образуют сероводород, восстанавливают нитраты в нитриты, а также теллурит калия в сульфид теллурита, вследствие чего колонии дифтерийных коринебактерии на теллуритовом агаре становятся черными или серыми.
Дифтерийные коринебактерии ферментируют глюкозу и мальтозу, непостоянно галактозу, крахмал, декстрин, глицерин.
Дифтерийные бактерии ферментируют цистеин с образованием сероводорода и не разлагают мочевину, в то время как дифтероида расщепляют мочевину, но не ферментируют цистеин.
Дифтерийные коринебактерии продуцируют бактериоцины (коринецины), наделяющие их некоторыми селективными преимуществами.
Токсинообразование. Дифтерийные коринебактерии продуцируют в бульонных культурах сильные экзотоксины (гистотоксин, дермонекротоксин, гемолизин). Токсигенность коринебактерии дифтерии связана с лизогенностью (наличие в токсигенных штаммах умеренных фагов профагов). Классический международный эталонный штамм Парк-Вильямс 8 продуцент экзотоксина также является лизогенным и более 85 лет сохраняет способность к токсинообразованию. Генетические детерминанты токсигенности (tox + -гены) локализованы в геноме профага, интегрированного с нуклеоидом коринебактерии дифтерии.
В результате лизогенизации нетоксигенные штаммы C. diphtheriae (биовара mitis) превращаются в токсигенные (токсигенная конверсия).
Дифтерийный токсин – термостабильный полипептид, состоящий из двух фрагментов, названных А и В. Фрагмент B требуется для транспортировки фрагмента А в клетку, где он подавляет элонгацию полипептидной цепи на рибосоме. Подавление синтеза белка, вероятно, обеспечивает оба токсических эффекта дифтерийного токсина некротический и нейтротоксический.
Дифтерийный токсин неустойчив. Он легко разрушается под влиянием температуры, света и кислорода воздуха, но сравнительно резистентен к действию ультразвука.
После добавления к токсину 0,3 0,4 % формалина и последующего выдерживания при 38 – 40 °С в течение 3 4 недель происходит превращение его в дифтерийный анатоксин, который обладает большей устойчивостью по отношению к физическим и химическим воздействиям, чем исходный токсин.
Токсигенные штаммы дифтерийных коринебактерий наряду с лизогенностью характеризуются выраженной дегидрогеназной и нейраминидазной активностью, в то время как нетоксигенные штаммы такой активностью не обладают.
Антигенная структура. Путем реакции агглютинации у возбудителя дифтерии установлено 11 сероваров.
Токсины, образуемые различными штаммами биоваров gravis и mitis, не различаются между собой и полностью нейтрализуются стандартным дифтерийным антитоксином. Рядом авторов установлено наличие у коринебактерии дифтерии вариантоспецифических термолабильных поверхностных белковых антигенов (К-антигенов) и группоспецифических термостабильных соматических полисахаридных антигенов.
Среди коринебактерии дифтерии имеется 19 фаготипов, с помощью которых выявляют источники инфекции; фаготипы учитываются также при идентификации выделенных культур.
Резистентность. Дифтерийные коринебактерии сравнительно устойчивы к вредному влиянию факторов внешней среды. На свернутой сыворотке остаются живыми до 1 года, при комнатной температуре до 2 месяцев, на детских игрушках до нескольких суток. Коринебактерии довольно долго сохраняются в пленках больных дифтерией, особенно если пленки не подвергаются действию света. От действия температуры 60 °С и 1 % раствора фенола коринебактерии погибают в течение 10 мин.
Патогенность для животных. В естественных условиях вирулентные дифтерийные коринебактерии обнаружены у лошадей, коров, собак, инфицированных, вероятно, от людей больных и носителей. Однако домашние животные в качестве источников заражения человека роли не играют
Из лабораторных животных наиболее восприимчивы морские свинки и кролики. При заражении их культурой или токсином у них развивается типичная картина токсикоинфекции с образованием на месте введения воспаления, отека, некроза. Внутренние органы гиперемированы, в надпочечниках наблюдаются кровоизлияния. Доза 0,06 мкг токсина убивает морскую свинку массой в 250 г.
Патогенез заболевания у человека. Источником инфекции являются больные дифтерией и носители. Болезнь передается воздушно-капельным путем, иногда с частицами пыли; передача возможна также через различные предметы (игрушки, посуда, книги, полотенца, платки и т. д.), пищевые продукты (молоко, различные холодные блюда и др.), инфицированные дифтерийными коринебактериями.
В эпидемиологии дифтерии большую роль играют носители. В среднем число носителей из реконвалесцентов и здоровых лиц колеблется в пределах 3 5%.
Наибольшую заболеваемость дифтерией отмечают осенью, что объясняется увеличением скученности детей в это время года и снижением сопротивляемости организма под влиянием охлаждения.
Дифтерийные коринебактерии благодаря наличию у них диффузионного фактора обладают способностью проникать в кровь и ткани больных людей и зараженных животных. Диффузионный фактор представляет собой фермент гиалуронидазу, обладающую способностью расщеплять гиалуроновую кислоту. К факторам инвазионности относятся нейраминидаза, некротический фактор, фибринолизин.
В патогенезе дифтерии ведущую роль играет гистотоксин, который блокирует синтез белка в клетках млекопитающих, инактивирует фермент трансферазу, ответственную за образование полипептидной цепи.
В клинике и эксперименте на животных доказано влияние на развитие болезни патогенных стафилококков и стрептококков, которые в значительной степени усиливают тяжесть инфекции.
У человека на месте внедрения возбудителя дифтерии (зев, нос, трахея, конъюнктива глаз, кожа, вульва влагалища, раневая поверхность) образуются пленки с большим количеством дифтерийных коринебактерии и других микробов. Продуцируемый экзотоксин вызывает некроз и дифтеритическое воспаление слизистых оболочек или кожи, всасываясь, он поражает нервные клетки, сердечную мышцу и паренхиматозные органы, обусловливает явления общей тяжелой интоксикации.
Глубокие изменения происходят в сердечной мышце, сосудах, надпочечниках, а также в центральной и периферической нервной системе. Поэтому выделяют три точки приложения дифтерийного токсина в организме: миокард (развитие токсического дифтерийного миокардита), надпочечники(падение тонуса сосудов и артериального давления из-за снижения выработки адреналина), нервная система (развитие параличей и парезов).
По локализации процесса наиболее часто наблюдаются дифтерия зева и дифтерийный круп (дифтерия гортани), затем дифтерия носа. Сравнительно редко встречается дифтерия глаз, ушей, половых органов, кожи и раны. На дифтерию зева приходится более 90 % всех заболеваний, второе место занимает дифтерия носа.
Смерть от дифтерии гортани может быть из-за асфиксии, удушья, потому что даже небольшая дифтеритическая пленка может полностью перекрыть голосовую щель. При дифтерии зева большинство смертных случаев связано с поражением сердца вследствие интоксикации.
Иммунитет. При дифтерии невосприимчивость зависит главным образом от содержания антитоксина в крови. Нельзя, однако, исключить определенной роли и антибактериального комплекса, связанного с фагоцитозом и наличием опсонинов, агглютининов, преципитинов и комплементсвязывающих веществ. Иммунитет при дифтерии носит антиинфекционный (антитоксический и антибактериальный) характер.
Проба Шика. Наличие противодифтерийного антитоксического иммунитета можно выявить с помощью реакции Шика. 1/40 Dlm токсина для морской свинки в объеме 0,2 мл вводят детям в предплечье внутрикожно. При положительной реакции, свидетельствующей об отсутствии антитоксического иммунитета, на месте введения через 24 48 ч появляются краснота и припухлость диаметром до 2 см. Положительная реакция Шика наступает при отсутствии антитоксина или незначительном количестве его в сыворотке крови. Отрицательная реакция Шика является в известной степени показателем невосприимчивости к дифтерии.
В связи с тем что дифтерийный экзотоксин вызывает состояние сенсибилизации и обусловливает у многих детей развитие тяжелых осложнений, ранее широко применявшаяся реакция Шика используется ограниченно.
Для определения количества антитоксинов в крови рекомендована реакция непрямой гемагглютинации с эритроцитами, сенсибилизированными дифтерийным анатоксином.
Наиболее восприимчивыми к дифтерии являются дети в возрасте 1 4 лет. В последние годы отмечено относительное увеличение заболеваемости среди лиц 15 лет и старше.
Перенесение дифтерии оставляет менее прочный иммунитет, чем при других заболеваниях детского возраста (корь, коклюш). Повторные заболевания дифтерией наблюдаются в 6 — 7% случаев.
Лечение. Терапия дифтерии включает изоляцию больного, строгий постельный режим, раннее назначение антитоксина и соответствующую антибиотикотерпию. Может потребоваться поддерживающая терапия типа зондирования и вентиляции при обструкции дыхательных путей.
Больным дифтерией вводят антитоксическую сыворотку в дозах 5000 — 15000 ME при средней тяжести заболевания и 30 000 50 000 ME при тяжелых формах.
C. diphtheriae чувствительна к пенициллину, тетрациклину, рифампицину и клиндамицину. Эритромицин предпочтительнее пенициллина для лечения дифтерии горла, особенно при лечении носителей. Описаны эритромицин- и тетрциклин-устойчивые штаммы.
Антибиотикотерпия не оказывает никакого влияния на преформированный (ранее образованный) токсин, который быстро распространяется от места повреждения и, если не будет нейтрализован антитоксином, быстро связывается с клетками тканей необратимо.
Лечение) не должна ждать лабораторное подтверждение, если имеется сильное клиническое подозрение, поскольку коэффициент смертности непосредственно связан с периодом задержки перед предоставлением антитоксина, повышение от ноля до 20 % между началом болезни и дня 5 из инфекции, средний случай заболевания — коэффициент смертности — 5-7 %.
Применяют также пенициллин, тетрациклины, рифампицин, клиндамицин, сульфаниламидные препараты и сердечные средства.
Для лечения носителей назначают антибиотики. Хороший результат дает применение тетрациклина, эритромицина в сочетании с витамином С.
Профилактика. Заключается в ранней диагностике, немедленной госпитализации, полноценной дезинфекции помещения и предметов, выявлении носителей.
Специфическую профилактику проводят путем активной иммунизации. Существует несколько вакцин, используемых для специфической профилактики дифтерии: 1) адсорбированный дифтерийный анатоксин (АД-анатоксин); 2) адсорбированный дифтерийно-столбнячный анатоксин (АДС-анатоксин); 3) адсорбированная коклюшно-дифтерийно-столбнячная вакцина (АКДС-вакцина). Все эти препараты применяют согласно инструкциям или наставлениям.
Нужно отметить, что не все иммунизируемые дети приобретают резистентность к дифтерии. В среднем 5-10 % из них остается восприимчивыми, или рефрактерными, т.е. неспособными к образованию антител после иммунизации. Такое состояние является результатом иммунологической толерантности, агаммаглобулинемии или гипогаммаглобулинемии.
Ранее дифтерия была грозным заболеванием детей. В России в 1886 — 1912 гг. ежегодно заболевало более 250000 человек. Летальность была очень высокой 12 -30%.
Благодаря введению обязательной иммунизации против дифтерии достигнуты большие успехи в борьбе с этой инфекцией. Заболеваемость дифтерией в 1975 г. по сравнению с 1913 г. снизилась до единичных случаев, смертность от дифтерии уменьшилась более чем в 100 раз.
Однако, в настоящее время дифтерия вновь стала актуальной инфекцией для стран бывшего СССР, в том числе и для Украины.
Дата добавления: 2014-01-11 ; Просмотров: 1062 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
источник
Дифтерия — острое инфекционное заболевание преимущественно детского возраста, которое проявляется глубокой интоксикацией организма дифтерийным токсином и характерным фибринозным воспалением в месте локализации возбудителя. Название болезни происходит от греческого слова diphthera — кожа, пленка, так как в месте размножения возбудителя образуется плотная, серовато-белого цвета пленка.
Возбудитель дифтерии — Corynebacterium diphtheriae — был обнаружен впервые в 1883 г. Э. Клебсом в срезах из пленки, получен в чистой культуре в 1884 г. Ф. Леффлером. В 1888 г. Э. Ру и А. Иерсен обнаружили его способность продуцировать экзотоксин, играющий главную роль в этиологии и патогенезе дифтерии. Получение в 1892 г. антитоксической сыворотки Э. Берингом и использование ее с 1894 г. для лечения дифтерии позволило значительно снизить летальность. Успешное наступление на эту болезнь началось после 1923 г. в связи с разработкой Г. Районом метода получения дифтерийного анатоксина.
Возбудитель дифтерии относится к роду Corynebacterium (класс Actinobacteria). В морфологическом отношении характеризуется тем, что клетки булавовидно утолщены на концах (греч. согупе — булава), образуют ветвление, особенно в старых культурах, и содержат зернистые включения.
В состав рода Corynebacterium входит большое число видов, которые делят на три группы.
- Коринебактерии — паразиты человека и животных и патогенные для них.
- Коринебактерии, патогенные для растений.
- Непатогенные коринебактерии. Многие виды коринебактерии являются нормальными обитателями кожи, слизистых зева, носоглотки, глаз, дыхательных путей, уретры и половых органов.

С. diphtheriae — прямые или слегка изогнутые неподвижные палочки длиной 1,0-8,0 мкм и диаметром 0,3-0,8 мкм, спор и капсул не образуют. Очень часто они имеют вздутия на одном или обоих концах, часто содержат метахроматические гранулы — зерна волютина (полиметафосфаты), которые при окрашивании метиленовым синим приобретают голубовато-пурпурный цвет. Для их обнаружения предложен особый метод окрашивания по Нейссеру. При этом палочки окрашиваются в соломенно-желтый, а зерна волютина — в темно-коричневый цвет, и располагаются обычно по полюсам. Corynebacterium diphtheriae хорошо окрашивается анилиновыми красителями, грамположительна, но в старых культурах нередко обесцвечивается и имеет отрицательную окраску по Граму. Для нее характерен выраженный полиморфизм, особенно в старых культурах и под влиянием антибиотиков. Содержание Г + Ц в ДНК около 60 мол %.
Дифтерийная палочка является аэробом или факультативным анаэробом, температурный оптимум для роста 35-37 °С (границы роста 15-40 °С), оптимальная рН 7,6-7,8. К питательным средам не очень требовательна, но лучше растет на средах, содержащих сыворотку или кровь. Избирательными для дифтерийных бактерий являются свернутые сывороточные среды Ру или Леффлера, рост на них появляется через 8-12 ч в виде выпуклых, величиной с булавочную головку колоний серовато-белого или желтовато-кремового цвета. Поверхность их гладкая или слегка зернистая, на периферии колонии несколько более прозрачные, чем в центре. Колонии не сливаются, вследствие чего культура приобретает вид шагреневой кожи. На бульоне рост проявляется в виде равномерного помутнения, либо бульон остается прозрачным, а на его поверхности образуется нежная пленка, которая постепенно утолщается, крошится и хлопьями оседает на дно.
Особенностью дифтерийных бактерий является их хороший рост на кровяных и сывороточных средах, содержащих такие концентрации теллурита калия, которые подавляют рост других видов бактерий. Это связано с тем, что С. diphtheriae восстанавливают теллурит калия до металлического теллура, который, откладываясь в микробных клетках, придает колониям характерный темно-серый или черный цвет. Применение таких сред повышает процент высеваемости дифтерийных бактерий.
Corynebacterium diphtheriae ферментируют глюкозу, мальтозу, галактозу с образованием кислоты без газа, но не ферментируют (как правило) сахарозу, имеют цистиназу, не имеют уреазы и не образуют индола. По этим признакам они отличаются от тех коринеформных бактерий (дифтероидов), которые чаще других встречаются на слизистой оболочке глаза (Corynebacterium xerosus) и носоглотки (Corynebacterium pseiidodiphtheriticum) и от других дифтероидов.
В природе существуют три основных варианта (биотипа) дифтерийной палочки: gravis, intermedins и mitis. Они различаются по морфологическим, культуральным, биохимическим и другим свойствам.
Деление дифтерийных бактерий на биотипы было произведено с учетом того, при каких формах течения дифтерии у больных они выделяются с наибольшей частотой. Тип gravis чаще выделяется от больных с тяжелой формой дифтерии и вызывает групповые вспышки. Тип mitis вызывает более легкие и спорадические случаи заболеваний, а тип intermedius занимает промежуточное положение между ними. Corynebacterium belfanti, ранее относимый к биотипу mitis, выделен в самостоятельный, четвертый, биотип. Его главное отличие от биотипов gravis и mitis — способность восстанавливать нитраты в нитриты. Штаммы Corynebacterium belfanti обладают выраженными адгезивными свойствами, и среди них обнаруживаются как токсигенные, так и нетоксигенные варианты.

Коринебактерии очень гетерогенна и мозаична. У возбудителей дифтерии всех трех типов обнаружено несколько десятков соматических антигенов, по которым их делят на серотипы. В России принята серологическая классификация, по которой различают 11 серотипов дифтерийных бактерий, из них 7 основных (1-7) и 4 дополнительных, редко встречающихся серотипов (8-11). Шесть серотипов (1, 2, 3, 4, 5, 7) относятся к типу gravis, а пять (6,8,9,10,11) — к типу mitis. Недостатком метода серотипирования является то, что многие штаммы, особенно нетоксигенные, обладают спонтанной агглютинацией или полиагглютинабельностью.

Для дифференциации дифтерийных бактерий предложены различные схемы фаготипирования. По схеме М. Д. Крыловой с помощью набора из 9 фагов (А, В, С, D, F, G, Н, I, К) удается типировать большинство токсигенных и нетоксигенных штаммов типа gravis. С учетом чувствительности к указанным фагам, а также культуральных, антигенных свойств и способности синтезировать корицины (бактерицидные белки) М. Д. Крылова выделила 3 самостоятельные группы коринебактерий типа gravis (I-III). В каждой из них имеются подгруппы токсигенных и их нетоксигенных аналогов возбудителей дифтерии.
Corynebacterium diphtheriae проявляет большую устойчивость к низким температурам, но быстро погибает при высокой температуре: при 60 °С — в течение 15-20 мин, при кипячении — через 2-3 мин. Все дезинфицирующие вещества (лизол, фенол, хлорамин и др.) в обычно применяемой концентрации уничтожают ее за 5-10 мин. Однако возбудитель дифтерии хорошо переносит высушивание и может долго сохранять жизнеспособность в высохшей слизи, слюне, в частичках пыли. В мелкодисперсном аэрозоле дифтерийные бактерии сохраняют жизнеспособность в течение 24-48 ч.
Патогенность Corynebacterium diphtheriae определяется наличием ряда факторов.
Структуры, ответственные за адгезию, не идентифицированы, однако без них дифтерийная палочка не смогла бы колонизировать клетки. Их роль выполняют какие-то компоненты клеточной стенки возбудителя. Инвазивные свойства возбудителя связаны с гиалуронидазой, нейраминидазой и протеазой.
Токсического гликолипида, содержащегося в клеточной стенке возбудителя. Он представляет собой 6,6′-диэфир трегалозы, содержащий коринемиколовую кислоту (С32Н6403) и коринемиколиновую кислоту (Сз2Н62Оз) в эквимолярных отношениях (трегалозо-6,6′-дикоринемиколат). Гликолипид оказывает разрушающее действие на клетки ткани в месте размножения возбудителя.
Экзотоксина, обусловливающего патогенность возбудителя и характер патогенеза заболевания. Нетоксигенные варианты С. diphtheriae дифтерии не вызывают.
Экзотоксин синтезируется в виде неактивного предшественника — единой полипептидной цепи с м.м. 61 кД. Его активация осуществляется собственной бактериальной протеазой, которая разрезает полипептид на два связанные между собой дисульфидными связями пептида: А (м.м. 21 кД) и В (м.м. 39 кД). Пептид В выполняет акцепторную функцию — он распознает рецептор, связывается с ним и формирует внутримембранный канал, через который проникает в клетку пептид А и реализует биологическую активность токсина. Пептид А представляет собой фермент АДФ-рибозилтрансферазу, который обеспечивает перенос аденозиндифосфатрибозы из НАД на один из аминокислотных остатков (гистидина) белкового фактора элонгации EF-2. В результате модификации EF-2 утрачивает свою активность, и это приводит к подавлению синтеза белка рибосомами на стадии транслокации. Токсин синтезируют только такие С. diphtheriae, которые несут в своей хромосоме гены умеренного конвертирующего профага. Оперон, кодирующий синтез токсина, является моноцистронным, он состоит из 1,9 тыс. пар нуклеотидов и имеет промотор toxP и 3 участка: toxS, toxA и toxB. Участок toxS кодирует 25 аминокислотных остатков сигнального пептида (он обеспечивает выход токсина через мембрану в периплазматическое пространство бактериальной клетки), toxA — 193 аминокислотных остатка пептида А, и toxB — 342 аминокислотных остатка пептида В токсина. Утрата клеткой профага или мутации в tox-опероне делают клетку малотоксигенной. Напротив, лизогенизация нетоксигенных С. diphtheriae конвертирующим фагом превращает их в токсигенные бактерии. Это доказано однозначно: токсигенность дифтерийных бактерий зависит от лизогенизации их конвертирующими tox-коринефагами. Коринефаги интегрируются в хромосому коринебактерий с помощью механизма сайт-специфической рекомбинации, причем штаммы дифтерийных бактерий могут содержать в своих хромосомах по 2 сайта рекомбинации (attB), и коринефаги интегрируются в каждый из них с одинаковой частотой.
Генетический анализ ряда нетоксигенных штаммов дифтерийных бактерий, проведенный с помощью меченых ДНК-зондов, несущих фрагменты tox-оперона коринефага, показал, что в их хромосомах имеются последовательности ДНК, гомологичные tox-оперону коринефага, но они либо кодируют неактивные полипептиды, либо находятся в «молчащем» состоянии, т. е. неактивны. В связи с этим возникает очень важный в эпидемиологическом отношении вопрос: могут ли нетоксигенные дифтерийные бактерии превращаться в токсигенные в естественных условиях (в организме человека), подобно тому, как это происходит in vitro? Возможность подобного превращения нетоксигенных культур коринебактерий в токсигенные с помощью фаговой конверсии была показана в опытах на морских свинках, куриных эмбрионах и белых мышах. Однако происходит ли это в ходе естественного эпидемического процесса (и если происходит, то как часто), пока установить не удалось.
В связи с тем, что дифтерийный токсин в организме больных оказывает избирательное и специфическое воздействие на определенные системы (поражаются в основном симпатико-адреналовая система, сердце, сосуды и периферические нервы), то очевидно, он не только угнетает биосинтез белка в клетках, но и вызывает другие нарушения их метаболизма.
Для обнаружения токсигенности дифтерийных бактерий можно использовать следующие способы:
- Биологические пробы на животных. Внутрикожное заражение морских свинок фильтратом бульонной культуры дифтерийных бактерий вызывает у них некроз в месте введения. Одна минимальная смертельная доза токсина (20-30 нг) убивает морскую свинку весом 250 г при подкожном введении на 4-5-й день. Наиболее характерным проявлением действия токсина является поражение надпочечников, они увеличены и резко гиперемированы.
- Заражение куриных эмбрионов. Дифтерийный токсин вызывает их гибель.
- Заражение культур клеток. Дифтерийный токсин вызывает отчетливый цитопатический эффект.
- Метод твердофазного иммуноферментного анализа с использованием меченных пероксидазой антитоксинов.
- Использование ДНК-зонда для непосредственного обнаружения tox-оперона в хромосоме дифтерийных бактерий.
Однако наиболее простым и распространенным способом определения токсигенности дифтерийных бактерий является серологический — метод преципитации в геле. Суть его состоит в следующем. Полоску стерильной фильтровальной бумаги размером 1,5 х 8 см смачивают антитоксической противодифтерийной сывороткой, содержащей 500 АЕ в 1 мл, и наносят на поверхность питательной среды в чашке Петри. Чашку подсушивают в термостате 15-20 мин. Испытуемые культуры засевают бляшками по обе стороны от бумажки. На одну чашку засевают несколько штаммов, один из которых, заведомо токсигенный, служит контролем. Чашки с посевами инкубируют при 37 °С, результаты учитывают через 24-48 ч. Вследствие встречной диффузии в геле антитоксина и токсина в месте их взаимодействия образуется четкая линия преципитации, которая сливается с линией преципитации контрольного токсигенного штамма. Полоски неспецифической преципитации (они образуются, если в сыворотке кроме антитоксина присутствуют в небольшом количестве другие антимикробные антитела) появляются поздно, выражены слабо и никогда не сливаются с полоской преципитации контрольного штамма.
Прочный, стойкий, фактически пожизненный, повторные случаи заболевания наблюдаются редко — у 5-7 % переболевших. Иммунитет носит главным образом антитоксический характер, меньшее значение имеют антимикробные антитела.
Для оценки уровня противодифтерийного иммунитета ранее широко применялась проба Шика. С этой целью внутрикожно детям вводилась 1/40 Dim токсина для морской свинки в объеме 0,2 мл. При отсутствии антитоксического иммунитета через 24-48 ч на месте введения появляется краснота и припухлость диаметром более 1 см. Такая положительная реакция Шика свидетельствует либо о полном отсутствии антитоксина, либо о том, что его содержание составляет менее 0,001 АЕ/мл крови. Отрицательная реакция Шика наблюдается, когда содержание антитоксина в крови выше 0,03 АЕ/мл. При содержании антитоксина ниже 0,03 АЕ/мл, но выше 0,001 АЕ/мл реакция Шика может быть или положительной, или, иногда, отрицательной. Кроме того, сам токсин обладает выраженным аллергенным свойством. Поэтому для определения уровня противодифтерийного иммунитета (количественное содержание антитоксина) лучше пользоваться РПГА с эритроцитарным диагностикумом, сенсибилизированным дифтерийным анатоксином.
Единственным источником заражения является человек — больной, выздоравливающий или здоровый бактерионоситель. Заражение происходит воздушно-капельным, воздушно-пылевым путем, а также через различные предметы, бывшие в употреблении у больных или здоровых бактерионосителей: посуда, книги, белье, игрушки и т. п. В случае инфицирования пищевых продуктов (молоко, кремы и т. п.) возможно заражение алиментарным путем. Наиболее массивное выделение возбудителя имеет место при острой форме заболевания. Однако наибольшее эпидемиологическое значение имеют лица со стертыми, нетипичными формами заболевания, так как они часто не госпитализируются и выявляются далеко не сразу. Больной дифтерией заразен в течение всего периода болезни и части периода выздоровления. Средний срок бактерионосительства у выздоравливающих варьирует от 2 до 7 нед., но может продолжаться и до 3 мес.
Особую роль в эпидемиологии дифтерии играют здоровые бактерионосители. В условиях спорадической заболеваемости именно они являются основными распространителями дифтерии, способствуя и сохранению возбудителя в природе. Средняя продолжительность носительства токсигенных штаммов несколько меньше (около 2 мес), чем нетоксигенных (около 2-3 мес).
Причина формирования здорового носительства токсигенных и нетоксигенных дифтерийных бактерий раскрыта не до конца, так как даже высокий уровень антитоксического иммунитета не всегда обеспечивает полное освобождение организма от возбудителя. Возможно, определенное значение имеет уровень антибактериального иммунитета. Первостепенное эпидемиологическое значение имеет носительство токсигенных штаммов дифтерийных бактерий.

К дифтерии восприимчивы люди любого возраста. Возбудитель может проникнуть в организм человека через слизистые оболочки различных органов или через поврежденную кожу. В зависимости от локализации процесса различают дифтерию зева, носа, гортани, уха, глаза, половых органов и кожи. Возможны смешанные формы, например дифтерия зева и кожи и т. п. Инкубационный период — 2-10 дней. При клинически выраженной форме дифтерии в месте локализации возбудителя развивается характерное фибринозное воспаление слизистой оболочки. Токсин, вырабатываемый возбудителем, сначала поражает эпителиальные клетки, а затем близлежащие кровеносные сосуды, повышая их проницаемость. В выходящем экссудате содержится фибриноген, свертывание которого приводит к образованию на поверхности слизистой оболочки серовато-белого Цвета пленчатых налетов, которые плотно спаяны с подлежащей тканью и при отрыве от нее вызывают кровотечение. Следствием поражения кровеносных сосудов может быть развитие местного отека. Особенно опасной является дифтерия зева, так как она может стать причиной дифтерийного крупа вследствие отека слизистой оболочки гортани и голосовых связок, от которого раньше погибало в результате асфиксии 50-60 % больных дифтерией детей. Дифтерийный токсин, поступая в кровь, вызывает общую глубокую интоксикацию. Он поражает преимущественно сердечно-сосудистую, симпатико-адреналовую системы и периферические нервы. Таким образом, симптомы дифтерии складываются из сочетания местных признаков, зависящих от локализации входных ворот, и общих симптомов, обусловленных отравлением токсином и проявляющихся в виде адинамии, вялости, бледности кожных покровов, понижения кровяного давления, миокардита, паралича периферических нервов и других нарушений. Дифтерия у привитых детей, если и наблюдается, протекает, как правило, в легкой форме и без осложнений. Летальность в период до применения серотерапии и антибиотиков составляла 50-60 %, ныне — 3-6 %.
Единственным методом микробиологической диагностики дифтерии является бактериологический, с обязательной проверкой выделенной культуры коринебактерий на токсигенность. Бактериологические исследования на дифтерию проводят в трех случаях:
- для диагностики дифтерии у детей и взрослых с острыми воспалительными процессами в области зева, носа, носоглотки;
- по эпидемическим показаниям лиц, находившихся в контакте с источником возбудителя дифтерии;
- лиц, вновь поступающих в детские дома, ясли, школы-интернаты, другие специальные учреждения для детей и взрослых, с целью выявления среди них возможных бактерионосителей дифтерийной палочки.
Материалом для исследования служат слизь из зева и носа, пленка с миндалин или других слизистых оболочек, являющихся местом входных ворот возбудителя. Посевы производят на теллуритовые сывороточные или кровяные среды и одновременно на свернутые сывороточные среды Ру (свернутая лошадиная сыворотка) или Леффлера (3 части бычьей сыворотки + 1 часть сахарного бульона), на которых рост коринебактерий появляется уже через 8-12 ч. Выделенную культуру идентифицируют по совокупности морфологических, культуральных и биохимических свойств, по возможности используют методы серо- и фаготипирования. Во всех случаях обязательна проверка на токсигенность одним из указанных выше методов. Морфологические особенности коринебактерий лучше изучать, используя три метода окрашивания препарата-мазка: по Граму, Нейссеру и метиленовым синим (или толуидиновым синим).
Специфическим средством лечения дифтерии является применение противодифтерийной антитоксической сыворотки, содержащей не менее 2000 ME в 1 мл. Сыворотку вводят внутримышечно в дозах от 10 000 до 400 000 ME в зависимости от тяжести течения болезни. Эффективным методом лечения является применение антибиотиков (пенициллины, тетрациклины, эритромицин и др.) и сульфаниламидных препаратов. С целью стимулирования выработки собственных антитоксинов можно использовать анатоксин. Для освобождения от бактерионосительства следует использовать те антибиотики, к которым данный штамм коринебактерий высокочувствителен.
Основным методом борьбы с дифтерией является массовая плановая вакцинация населения. С этой целью используют различные варианты вакцин, в том числе комбинированные, т. е. направленные на одновременное создание иммунитета против нескольких возбудителей. Наибольшее распространение в России получила вакцина АКДС. Она представляет собой адсорбированную на гидроокиси алюминия взвесь коклюшных бактерий, убитых формалином или мертиолятом (20 млрд в 1 мл), и содержит дифтерийный анатоксин в дозе 30 флоккулирующих единиц и 10 единиц связывания столбнячного анатоксина в 1 мл. Вакцинируют детей с 3-месячного возраста, а затем проводят ревакцинации: первую через 1,5-2 года, последующие в возрасте 9 и 16 лет, а далее через каждые 10 лет.
Благодаря массовой вакцинации, начатой в СССР в 1959 г., заболеваемость дифтерией в стране к 1966 г. по сравнению с 1958 г. была снижена в 45 раз, а ее показатель в 1969 г. составил 0,7 на 100 000 населения. Последовавшее в 80-х гг. XX в. снижение объема прививок привело к тяжелым последствиям. В 1993-1996 гг. Россию охватила эпидемия дифтерии. Болели взрослые, в основном не получившие прививок, и дети. В 1994 г. было зарегистрировано почти 40 тыс. больных. В связи с этим была возобновлена массовая вакцинация. В этот период были привиты 132 млн человек, в том числе 92 млн взрослых. В 2000-2001 гг. охват детей прививками в установленный срок составил 96 %, а ревакцинацией — 94 %. Благодаря этому уровень заболеваемости дифтерией в 2001 г. снизился по сравнению с 1996 г. в 15 раз. Однако для того чтобы довести уровень заболеваемости до единичных случаев, необходимо охватить вакцинацией не менее 97-98 % детей первого года жизни и обеспечить в последующие годы массовую ревакцинацию. Добиться полной ликвидации дифтерии в ближайшие годы вряд ли возможно из-за распространенного носительства токсигенных и нетоксигенных дифтерийных бактерий. Для решения этой проблемы также потребуется определенное время.
источник
C. diphtheriae — палочковидные бактерии; вызывают дифтерию (греч. diphtheria — кожа, пленка) — острую инфекцию, характеризующуюся фибринозным воспалением в зеве, гортани, реже в других органах, и явлениями интоксикации.
Морфологические и культуральные свойства.
Corinebacterium diphteriae – тонкие, слегка изогнутые или прямые грамположительные палочки, расположенные под углом друг к другу в виде римских пятерок. Они утолщены на концах за счет наличия зерен валютина на одном или обоих полюсах клетки. Зерна валютина состоят из полифосфатов, они воспринимают анилиновые красители более интенсивно, чем цитоплазма клетки и легко выявляются при окраске по Нейссеру в виде гранул сине-черного цвета, тогда как тела бактерий – окрашивается в желто-зеленый. При окраске по Граму зерна валютина не выявляются.
Рисунок мазка из чистой культуры. Окраска по Нейссеру Мазок из чистой культуры.
Окраска щелочной синькой Леффлера
Дифтерийная палочка не обладает кислотоустойчивостью, неподвижна, спор не образует, имеет микрокапсулу с входящим в ее состав корд-фактором. В состав клеточной стенки входят галактоза, манноза, арабиноза, а также большое количество липидов, в том числе некислотоустойчивые миколовые кислоты.
Возбудитель дифтерии – факультативный анаэроб, гетеротроф, растет при 37 о С на сложных питательных средах: свернутая кровяная сыворотка, кровяной теллуритовый агар.
На элективных средах через 8-14 часов образует точечные, выпуклые желтовато-кремовые колонии с гладкой или слегка зернистой поверхностью. Колонии не сливаются и имеют вид шагреневой кожи.
На теллуритовых средах возбудитель дифтерии через 24-48 час образует черные или черно-серые колонии в результате восстановления теллурита до металлического теллура.
Возбудитель дифтерии обладает высокой ферментативной активностью. Дифференциально-диагностическими признаками C. diphteriae являются:
отсутствие способности ферментировать сахарозу и разлагать мочевину,
способность продуцировать фермент цистиназу.
Возбудитель дифтерии не однороден по культуральным и биохимическим свойствам. В соответствии с рекомендациями Европейского регионального бюро ВОЗ вид C. diphteriae подразделяют на 4 биовара: gravis, mitis, intermedius, belfanti.
На теллуритовой среде биовар gravis образует сухие, матовые, крупные, плоские, серовато-черные колонии, приподнятые в центре. Периферия колонии светлая с радиальной исчерченностью и неровным краем. Такие колонии напоминают цветок маргаритку. Биовар mitis образует мелкие, гладкие, блестящие, черные, выпуклые колонии с ровным краем, окруженные зоной гемолиза. Биовары intermedius и belfanti фактически относятся к биовару mitis, так как не разлагают крахмал, а этот признак у C. diphteriae является наиболее стабильным.
Антигенная структура. C. diphteriae имеют О-антиген (липидные и полисахаридные фракции, расположенные в глубине клеточной стенки) и К-антиген (поверхностный термолабильный белок). О-антиген является межвидовым. На основании К-антигена различают около 58 сероваров.
Факторы патогенности. Основными факторами патогенности C. diphteriae являются поверхностные структуры, ферменты и токсины.
Поверхностные структуры (пили, компоненты микрокапсулы: корд-фактор, К-антиген, миколовые кислоты) имеют белковую и липидную природу, способствуют адгезии микробов в месте входных ворот, препятствуют фагоцитозу бактерий, оказывают токсическое воздействие на клетки макроорганизма, разрушают митохондрии.
Ферменты патогенности: нейраминидаза, гиалуронидаза, гемолизин, дермонекротоксин. Нейраминидаза отщепляет N-ацетилнейраминовую кислоту от гликопротеидов слизи и поверхности клеток, лиаза расщепляет ее на пируват и N-ацетилманнозамин, а пируват стимулирует рост бактерий. В результате действия гиалуронидазы повышается проницаемость кровеносных сосудов и выход плазмы за их пределы, что ведет к отеку окружающих тканей. Дермонекротоксин вызывает некроз клеток в месте локализации возбудителя. Вышедший за пределы сосудов фибриноген плазмы контактирует с тромбокиназой некротизированных клеток организма и превращается в фибрин, что и является сущностью дифтерийного воспаления. Внутри дифтерийной пленки C. diphteriae находят защиту от эффекторов иммунной системы и антибиотиков, размножаясь, они образуют в большом количестве основной фактор патогенности — дифтерийный гистотоксин.
Дифтерийный гистотоксин оказывает блокирующее действие на синтез белка в органах, наиболее интенсивно снабженных кровью: сердечно-сосудистая система, миокард, нервная система, почки и надпочечники.
Эпидемиология. В естественных условиях дифтерией болеет только человек, не обладающий устойчивостью к возбудителю и антитоксическим иммунитетом. Заболевание распространено повсеместно. Наибольшее количество больных наблюдается во второй половине сентября, октябре и ноябре. Наиболее восприимчивы дети дошкольного и младшего школьного возраста. Среди взрослых к группе повышенного риска относятся работники общественного питания и торговли, школ, детских дошкольных и медицинских учреждений.
C. diphteriae обладает устойчивостью к факторам окружающей среды: в капельках слюны, прилипших к посуде или игрушкам, на ручках дверей они могут сохраняться до 15 дней, на предметах окружающей среды – 5,5 мес., могут размножаться в молоке. При кипячении C. diphteriae погибают в течение 1 мин, в 10% растворе перекиси водорода – через 3 мин, в 5% растворе карболовой кислоты и 50-60% спирте – через 1 мин.
Дифтерийный гистотоксин очень неустойчив и быстро разрушается при действии света, нагревании, окислении.
Источником инфекции являются:
1.носители токсигенных штаммов — особенно опасны те носители, у которых нет клинических проявлений заболевания, так как они обладают антитоксическим иммунитетом.
2.больные: Среди больных наибольшее значение имеют лица с локализацией процесса в верхних дыхательных путях. Больной эпидемиологически опасен в течение всего периода болезни, даже в период выздоровления он выделяет токсигенные штаммы в окружающую среду.
Основным механизмом заражения является аэрозольный. Пути передачи:
ведущая роль принадлежит воздушно-капельному,
иногда могут осуществляться воздушно-пылевой, контактно-бытовой, а также алиментарный (через молоко) пути передачи.
Входными воротами инфекции служат слизистые оболочки ротоглотки (небные миндалины и окружающие их ткани), носа, гортани, трахеи, а также слизистые оболочки глаз и половых органов, поврежденные кожные покровы, раневая или ожоговая поверхность, незажившая пупочная ранка.
Наиболее часто встречается дифтерия зева (90-95%). Инкубационный период длится от 2 до 10 дней. По патогенезу дифтерия относится к токсинемическим инфекциям, когда микроб остается в месте входных ворот инфекции, а все клинические проявления связаны с действием экзотоксина.
Начальным этапом инфекционного процесса является адгезия микроба в месте входных ворот. Размножаясь там, микроб выделяет гистотоксин, который оказывает местное действие на клетки тканей, а также поступает в кровь, что ведет к возникновению токсинемии.
В области входных ворот развивается воспалительная реакция, которая сопровождается некрозом эпителиальных клеток и отеком, образуется налет белого цвета с сероватым или желтоватым оттенком, содержащим большое количество микробов, продуцирующих токсин.
Характерным признаком дифтерии является фибринозная пленка:
Если слизистая оболочка образована однослойным эпителием (гортань, трахея, бронхи), возникает крупозное воспаление, здесь пленка располагается поверхностно и легко отделяется от подлежащих тканей.
Если слизистая оболочка образована многослойным эпителием (ротоглотка, надгортанник, голосовые связки), возникает дифтерическое воспаление, когда все клетки прочно связаны между собой и с подлежащей соединительнотканной основой. Фибринозная пленка в этом случае плотно спаяна с подлежащими тканями и не снимается тампоном. При попытке сделать это слизистая оболочка кровоточит.
Иммунитет. После перенесенного заболевания формируется стойкий и напряженный гуморальный антитоксический иммунитет. Продолжительность поствакцинального иммунитета – 3-5 лет.
Материалом для исследования является фибринозная пленка, слизь из зева или носа.
Сбор материала необходимо проводить в течение 3-4 ч (не позднее 12 ч) с момента обращения больного. Для взятия материала используют сухие ватные тампоны, если посев будет произведен в течение 2-3 ч, при транспортировке материала тампоны смачивают 5% раствором глицерина.
Основным методом диагностики является бактериологический. Бактериологическая лаборатория через 48 ч должна дать ответ о наличии или отсутствии C. diphteriae в анализах.
Материал засевают на питательную среду. Отбирают подозрительные колонии и выделенную культуру идентифицируют:
По наличию цистиназы (проба Пизу): в столбик питательного агара с цистином уколом засевают исследуемую культуру. Посевы инкубируют при 37 о С 24 ч. C. diphteriae вызывает почернение среды по ходу укола в результате образования сульфида свинца.
По наличию уреазы (проба Закса): готовят спиртовый раствор мочевины и раствор индикатора – фенолового красного, которые перед употреблением смешивают в соотношении 1:9 и разливают в агглютинационные пробирки. Исследуемые бактерии вносят петлей и растирают по стенке прибирки. В положительном случае через 20-30 мин инкубации при 37 о С среда приобретает красный цвет в результате расщепления мочевины уреазой.
Способности C. diphteriae продуцировать токсин (устанавливается в реакции преципитации в агаре). Для этого в чашку Петри с питательным агаром, содержащим 15-20% лошадиной сыворотки, 0,3% мальтозы и 0,03% цистина помещают полоску фильтровальной бумаги, пропитанную антитоксической противодифтерийной сывороткой, содержащей 5000 АЕ/мл. Чашку подсушивают при 37 0 С 30 мин и бляшками засевают испытуемые штаммы на расстоянии 0,6-0,8 см от края бумаги. Посевы инкубируют при 37 0 С 24 ч. В положительном случае в месте соединения токсина с антитоксином в среде образуется преципитат в виде белых линий – «усиков».
Для определения токсигенности возбудителя дифтерии может быть использована биопроба. Морской свинке внутрикожно или подкожно вводят испытуемую культуру. Токсигенные культуры убивают животных в течение 3-5 суток, при вскрытии обнаруживаются гиперемированные надпочечники, а при внутрикожном заражении – некроз кожи.
Для бактериоскопического исследования (как самостоятельный диагностический метод применяется редко ввиду полиморфизма возбудителя, но может быть проведен по просьбе врача) из материала готовят мазки на нескольких стеклах, один мазок окрашивают по Граму, другой по Нейссеру, третий – обрабатывают флюорохромом – корифосфином для люминесцентной микроскопии.
О наличии антитоксического иммунитета судят по реакции Шика – реакции нейтрализации токсина антитоксином. В кожу предплечья вводят 1/40 DLM дифтерийного токсина. Покраснение и припухлость в месте введения свидетельствует об отсутствии антитоксинов в крови. Отрицательная реакция Шика говорит о наличии антитоксинов.
Для ускоренного обнаружения дифтерийного токсина, как в бактериальных культурах, так и в сыворотке крови, применяют: РНГА с антительным эритроцитарным диагностикумом, РИА и ИФА. Из молекулярно-генетических методов исследования применяют ПЦР.
Препараты для специфического лечения дифтерии.
В целях нейтрализации дифтерийного гистотоксина применяют специфическую противодифтерийную лошадиную очищенную концентрированную сыворотку, которую получают путем гипериммунизации лошадей дифтерийным антитоксином.
Специфическое лечение противодифтерийной сывороткой начинают немедленно при клиническом подозрении на дифтерию. Необходимо выбрать оптимальный режим введения сыворотки, так как антитоксин может нейтрализовать только не связанный с тканями токсин. Для профилактики развития анафилактического шока сыворотку вводят дробно по А.М. Безредке. Введение сыворотки позднее 3-го дня болезни нецелесообразно.
Разработан противодифтерийный иммуноглобулин человека для внутривенного введения. Его применение дает меньше побочных реакций.
Для подавления размножения C. diphteriae в месте входных ворот обязательно назначают антибиотики. Препаратами выбора являются пенициллин или эритромицин, либо другие β-лактамы и макролиды.
Препараты для специфической профилактики дифтерии.
Для создания искусственного активного антитоксического иммунитета применяют дифтерийный анатоксин. Очищенный и концентрированный препарат входит в состав ассоциированных вакцин:
1. адсорбированной коклюшно-дифтерийно-столбнячной вакцины (АКДС-вакцина),
2. адсорбированного дифтерийно-столбнячного анатоксина (АДС-анатоксин),
3. адсорбированного дифтерийно-столбнячного анатоксина с уменьшенным содержанием антигенов (АДС-М),
4. адсорбированного дифтерийного анатоксина с уменьшенным содержанием антигена (АД-М).
Базисный иммунитет создается у детей согласно календарю прививок. Только 95% охват населения прививками гарантирует эффективность вакцинации.
источник
Коринебактерии — грамположительные палочковидные микроорганизмы, широко распространенные в природе и обитающие в человеческом организме. Большинство представителей данного рода не патогенны для человека. Некоторые виды вызывают тяжелые инфекционные заболевания, например, дифтерию.
- Инфекции мочевыводящих путей — уретрита, простатита, поражения почек;
- Заболеваний органов дыхания — пневмонии, тонзиллита, фарингита;
- Гнойно-септических процессов — бактериемии, септицемии, абсцесса мозга, остеомиелита, эндокардита, септического артрита,
- Кожных заболеваний — псевдомикоза;
- Катетер-ассоциированных и раневых инфекций.
Некоторые коринебактерии являются представителями различных нормоцинозов человеческого организма. Они обитают на коже, в верхних отделах респираторного тракта, зрительном анализаторе, урогенитальном тракте. Так, С. striatum обладает тропностью к кожным покровам, С. durum – к респираторному эпителию органов дыхания, С. glucuronoliticam — к эпителиоцитам мочеполового тракта у мужчин. Многие виды выделяются из объектов окружающей среды.
Атоксигенные С. diphtheriae в норме колонизируют кожу и зев, не вызывая развития болезни. Непатогенные виды коринебактерий в допустимом количестве входят в состав нормоценоза толстого кишечника. Но иногда эти микробы приводят к развитию инфекции и даже эпидемических вспышек. Такая особенность обусловлена наличием иных факторов вирулентности у данных микроорганизмов.
Все коринебактерии условно делятся на группы:
- Микроорганизмы, опасные для теплокровных,
- Микробы, поражающие растения,
- Условно-патогенные бактерии, не причиняющие вреда здоровью.
В наибольшей степени развитию инфекции подвержены дети, пожилые люди и лица с иммунодефицитом и полиорганной патологией. В большинстве случаев видовая идентификация corynebacterium spp вызывает значительные трудности, обусловленные их морфобиологическими особенностями.
Морфология. Коринебактерии — полиморфные, тонкие и длинные палочки, имеющие характерные утолщения на концах, в которых содержатся зерна волютина. Это своеобразный запас питательных веществ – жировых включений, необходимый клеткам для нормальной жизнедеятельности. Микроорганизмы не образуют спор и не имеют жгутиков. Бактериальная клетка содержит нуклеоид с ДНК, имеющей замкнутую кольцевую форму и содержащей гуанин и цитозин в различных соотношениях. Зерна волютина, хорошо заметные в цитоплазме покоящейся клетки, исчезают при ее интенсивном делении. Клеточная стенка многослойна. Она состоит из пептидогликана, липидного слоя и микрокапсулы.
Corynebacterium diphtheriae является возбудителем опасного для человека заболевания — дифтерии. В настоящее время патология регистрируется крайне редко и лишь у отдельных лиц, которые, скорее всего, не были своевременно вакцинированы.
Распространение инфекции происходит воздушно-капельным или контактным путем во время общения с больными людьми или через инфицированные предметы. В случае заражения пищевых продуктов становится актуальным алиментарный путь. В эпидемиологическом отношении наибольшую опасность представляют здоровые бактерионосители.
В зависимости от расположения первичного очага инфекции выделяют различные формы заболевания. Спустя 7-10 дней инкубации появляются первые клинические признаки. Фибринозное воспаление развивается в месте локализации патологического очага. Оно приводит к разрушению эпителиоцитов и кровеносных сосудов. В постепенно образующемся экссудате содержится много фибриногена, который сворачивается и образует налет на слизистой серо-белого цвета. Он плотно спаивается с подслизистым слоем и не поддается снятию. При попытке удалить налет начинается кровотечение. Кроме местных признаков воспаления, обусловленных локализацией входных ворот инфекции, возникает тяжелая интоксикация с лихорадкой, ознобом, гипергидрозом, ломотой в теле, вялостью, бледностью кожи, адинамией, гипотонией и прочими признаками.
Дифтерия зева — самая опасная форма инфекции, способная привести к развитию крупа, который является причиной смертельного исхода. Он обусловлен отеком слизистой гортани и выраженной асфиксией.
Основным диагностическим методом дифтерии является микробиологический. При появлении плотных фибриновых пленок и отека глотки или других частей тела необходимо взять у больного мазок на дифтерию и начать данное исследование. Отделяемое зева, слизь из носа, налет с миндалин – биоматериал, который доставляют в бактериологическую лабораторию для проведения анализа. Его засевают на среды, содержащие сыворотку или кровь с теллуритом калия, который угнетает рост вторичной микрофлоры. После инкубации выросшие колонии микроскопируют, накапливают чистую культуру и проводят окончательную идентификацию до вида. Для клиницистов важны результаты серо- и фаготипирования. Определение токсигенности выделенной культуры имеет важное диагностическое значение.
Этиотропная терапия дифтерии заключается во введении больным антитоксической сыворотки, антибиотиков и сульфаниламидов. Симптоматическая и патогенетическая терапия улучшают общее состояние больных, избавляя их от симптомов. После снятия острых явлений патологии показаны санирующие физиопроцедуры – ультразвук и лазеротерапия непосредственно на очаг.
Чтобы предупредить развитие такого серьезного заболевания, как дифтерия, проводят всеобщую иммунизацию населения вакциной АКДС в соответствии с Национальным календарем прививок. Массовая вакцинация в настоящее время значительно снизила показатели заболеваемости дифтерией и смертности от нее.
Corynebacterium non diphtheriae являются обитателями внешней среды. Они обнаруживаются на коже и слизистой внутренних органов, являясь представителями нормоценозов. У ослабленных лиц из группы риска эти микробы способны вызывать воспалительные процессы, которые протекают также тяжело, как заболевания, вызванные безусловными патогенами. Чтобы правильно подобрать этиотропную терапию и вылечить больного, необходимо точно и быстро идентифицировать микроб.
Corynebacterium glucuronolyticum — микроорганизмы, выделенные от людей с заболеваниями мочеполовой системы. Они являются возбудителями простатита и уретрита у мужчин, но могут в оптимальном количестве обитать в организме здоровых людей, являясь представителями данного биоциноза.
Под воздействием негативных факторов происходит активный рост и размножение Corynebacterium glucuronolyticum. Бактерии начинают приобретать болезнетворные свойства, вызывая местное воспаление. Паренхима предстательной железы отекает, увеличивается в размере, инфильтрируется лимфоцитами. Воспаление распространяется на околожелезистую ткань, изменяется структура органа, разрушаются эпителиоциты, утрачивается секреторная функция железы.
Дифтероиды входят в состав нормоциноза урогенитального тракта мужчин наряду со стафилококками, энтерококками, единичными микоплазмами и уреаплазмами. В процессе сексуальной активности уретра заселяется потенциальными уропатогенными бактериями. При переохлаждении, нервном перенапряжении, длительном приеме антибиотиков возникает воспаление в простате, обусловленное условно-патогенными бактериями. При этом нарушаются функции местных факторов защиты организма.
Больные с простатитом или уретритом, вызванном Corynebacterium glucuronolyticum, жалуются на боли в промежности, мошонке, половом члене, усиливающиеся в конце акта мочеиспускания; дизурические расстройства: полиурию, никтурию, неполное опорожнение мочевого пузыря, слабую струю; половую слабость – расстройства эрекции и эякуляции.
- Пальпация предстательной железы per rectum — изменение размеров железы, гетерогенная консистенции, чередование плотных и мягких участков, болезненные ощущения.В гемограмме — признаки воспаления.
- Бактериологическое исследование мочи и секрета простаты проводится в микробиологической лаборатории. Биоматериал засевают на стандартные среды для первичной идентификации, микроскопируют выросшие колонии, а затем изучают структуру, физиологию, ферментативную и биохимическую активность выделенного возбудителя. Corynebacterium glucuronolyticum хорошо растут на кровяном агаре. Через 24 часа на нем появляются выпуклые колонии беловато-желтоватого оттенка без зон гемолиза.
- ПЦР-диагностика — определение генетического материала коринебактерий в исследуемом образце.
Лечение простатита и уретрита противомикробное. Больным назначают фторхинолоны, макролиды и тетрациклины.
Corynebacterium glucuronolyticum — возбудитель заболеваний урогенитального тракта у мужчин. На сегодня инфекционный простатит и уретрит являются довольно распространенными недугами и серьезной медицинской проблемой. Специфические диагностические методы и терапевтические принципы остаются до конца не изученными. Больные, «заработав» подобный недуг, мучаются всю жизнь. Только эффективное антимикробное лечение поможет им справиться с патологией.
Дифтероиды — микроорганизмы из рода Corynebacterium, которые в настоящее время плохо изучены. К ним и относится данный микроб, имеющий еще одно название — палочка Хофмана. Его коринебактерия получила в честь своего первооткрывателя.
Дифтероиды распространены повсеместно: они обнаруживаются в воздухе, почве, воде, на продуктах. Микробы обладают устойчивостью к факторам внешней среды — температуре, солнечному свету, влажности. Хлорамин и прочие хлорсодержащие дезинфектанты уничтожают их за пару минут. Дифтероиды обитают в различных биоценозах здорового человеческого организма — в носоглотке, на коже, в уретре, половых органах, сперме.
Признаки, отличающие данный вид от патогенных коринебактерий:
- Отсутствие волютина,
- Хаотичное расположение в мазке,
- Массивный рост на простых питательных средах при 37 градусах.
Corynebacterium pseudodiphtheriticum вызывает гнойно-воспалительные процессы при ослаблении макроорганизма вирусными инфекциями, стрессами, онкопатологиями, вторичным иммунодефицитом. При этом заболевание не развивается в местах обычного обитания бактерий. Они не способны к токсинообразованию. Проникая в кровь, коринебактерии способствуют развитию бактериемии. Известны случаи тяжелых бронхитов и пневмоний на фоне длительной иммуносупрессии. Эти микробы могут вызывать эндокардит, лимфаденит, дерматологические заболевания, инфекцию мочевыводящих путей.
Дисбиотические изменения развиваются в организме при увеличении количества дифтероидов до 10 в 5 или 6 степени микробных клеток. При этом возникают характерные клинические проявления.
-
При поражении носоглотки развивается ринит или ринофарингит. У больных возникает заложенность носа по ночам, ринорея, утренний кашель с выделением слегка зеленоватой мокроты. Обычно местные симптомы не сопровождаются общей интоксикацией и астенизацией организма. Состояние больных остается удовлетворительным. Лечение corynebacterium pseudodiphtheriticum в данном случае заключается в промывании носа «Аквалором» или «Аквамарисом», местном использовании «Полидексы» и рассасывании «Имудона». При отсутствии эффекта от подобных манипуляций назначают пероральный прием «Ципрофлоксацина».
- Воспаление слизистой зева проявляется першением и болью в горле, гиперемией и отечностью миндалин и небных дужек, покашливанием, ухудшением общего самочувствия – вялостью, слабостью, ломотой. Специалисты рекомендуют орошать слизистую горла «Мирамистином», «Хлорофиллиптом», «Гексоралом», рассасывать антисептические леденцы и пастилки. В более тяжелых случаях назначают антибиотикотерапию.
- Поражение бронхолегочных структур приводит к развитию бронхита или пневмонии. Заболевания характеризуются относительно легким течением и хорошо поддаются терапии. Больные жалуются на влажный кашель, одышку, боль за грудиной, периодический субфебрилитет, регионарный лимфаденит. Показано внутримышечное введение антибиотиков, к которым чувствителен микроб, а также патогенетическая и симптоматическая терапия, устраняющая клинические проявления и улучшающая общее самочувствие больных.
- Уретрит и простатит у мужчин, а также цистит, цервицит и вагинит у женщин проявляются стандартными признаками дизурии, болью и резью при мочеиспускании, жжением и зудом во влагалище, вагинальными выделениями с запахом, неприятными ощущениями при половой близости, снижением либидо и потенции. Больным показана общая и местная антибактериальная терапия. При цистите и уретрите проводят инстилляции антибиотиков в мочевой пузырь, при вагините и цервиците суппозитории с противомикробным и антисептическим компонентами вводят во влагалище.
Лечение заболеваний, вызванных Corynebacterium pseudodiphtheriticum, заключается в применении бактериофагов, антибиотиков, проведении плазмафереза и других способов очищения крови.
Если дифтероиды были выделены из крови, ликвора, мочи и других стерильных субстратов, их необходимо рассматривать как потенциальных возбудителей и проводить соответствующее лечение. В микробиологической лаборатории для этого ставят тест на чувствительность выделенного микроба к антибиотикам.
источник

 При поражении носоглотки развивается ринит или ринофарингит. У больных возникает заложенность носа по ночам, ринорея, утренний кашель с выделением слегка зеленоватой мокроты. Обычно местные симптомы не сопровождаются общей интоксикацией и астенизацией организма. Состояние больных остается удовлетворительным. Лечение corynebacterium pseudodiphtheriticum в данном случае заключается в промывании носа «Аквалором» или «Аквамарисом», местном использовании «Полидексы» и рассасывании «Имудона». При отсутствии эффекта от подобных манипуляций назначают пероральный прием «Ципрофлоксацина».
При поражении носоглотки развивается ринит или ринофарингит. У больных возникает заложенность носа по ночам, ринорея, утренний кашель с выделением слегка зеленоватой мокроты. Обычно местные симптомы не сопровождаются общей интоксикацией и астенизацией организма. Состояние больных остается удовлетворительным. Лечение corynebacterium pseudodiphtheriticum в данном случае заключается в промывании носа «Аквалором» или «Аквамарисом», местном использовании «Полидексы» и рассасывании «Имудона». При отсутствии эффекта от подобных манипуляций назначают пероральный прием «Ципрофлоксацина».