Возбудитель дифтерии относится к роду Corynebacterium (от лат. coryna — булава, diphthera — пленка). Бактерии имеют булавовидные утолщения на концах. К этому роду относятся патогенные для человека дифтерийные палочки и непатогенные виды — ложнодифтерийные палочки и дифтероиды, обнаруживаемые на слизистых оболочках и кожных покровах.
Возбудители дифтерии — Corynebacterium diphtheriae — были обнаружены Т. Клебсом (1883) и выделены в чистом виде Ф. Леффлером (1884).
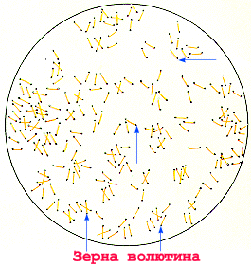
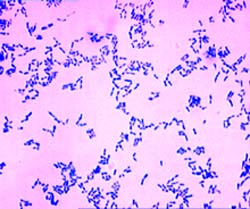
Морфология. Возбудители дифтерии слегка изогнутые, тонкие палочки, размером 3-6 × 0,3-0,5 мкм, на концах которых имеются утолщения. В этих утолщениях имеются зерна волютина (зерна Бабеша — Эрнста). Бактерии дифтерии неподвижны, не имеют спор и капсул. Грамположительны. Они хорошо окрашиваются основными анилиновыми красителями, при этом волютиновые зерна окрашиваются интенсивнее. Для окраски обычно применяют щелочной метиленовый синий или кристаллический фиолетовый. Особенностью коринебактерий дифтерии является их полиморфность; в одной кулатуре встречаются различные по форме и размерам палочки: изогнутые, прямые, длинные, короткие, толстые, иногда коккобактерии. Характерно расположение бактерий в мазках — они обычно располагаются попарно под острым или тупым углом, в виде растопыренных пальцев и т. д. Расположение в мазках и наличие зерен волютина является дифференциально-диагностическим признаком при микроскопическом исследовании. Непатогенные представители рода коринебактерий — ложнодифтерийные палочки и дифтериоды чаще располагаются в виде частокола, зерна волютина у них могут отсутствовать либо быть на одном конце (см. рис. 4).
Культивирование. Коринебактерий дифтерии — факультативные анаэробы. Растут при температуре 35-37° С, рН среды 7,4-7,8. Они не размножаются на обычных питательных средах. Культивируют их на средах, содержащих кровь или сыворотку.
В конце XIX века французский ученый Э. Ру для культивирования бактерий дифтерии предложил использовать свернутую бычью или лошадиную сыворотку, а Ф. Леффлер рекомендовал добавлять к ней бульон (25%) и 1% глюкозу. На этих средах коринебактерий растут быстро, в течение 14-18 ч образуют несливающиеся выпуклые колонии кремового цвета (рост на скошенной среде напоминает шагреневую кожу). Однако отдифференцировать на этих средах дифтерийные палочки от ложнодифтерийных невозможно.
В настоящее время основными средами для выращивания являются среда Клауберга (содержащая сыворотку крови и теллурит калия), хинозольная среда Бунина, среда Тинсдаля и др. На основании культуральных и ферментативных свойств коринебактерий дифтерии делят на три биовара: гравис (gravis), ми тис (mitis), интермедиус (intermedins). Биовар гравис обычно находится в R-форме. На среде Клауберга бактерии этого биовара растут в виде крупных колоний 2-3 мм, серовато-черного цвета (так как восстанавливают теллурит в теллур), имеют изрезанные края, что придает им вид розетки. При прикосновении к колонии петлей она как бы рассыпается. На бульоне бактерии этого биовара образуют крошащуюся пленку и зернистый осадок.
Коринебактерии биовара митис (mitis) на среде Клауберга растут в виде небольших, гладких колоний (S-форма) черного цвета. На бульоне они дают равномерное помутнение.
Коринебактерии биовара интермедиус (intermedins) являются промежуточными. На среде Клауберга бактерии этого биовара чаще растут в виде блестящих, мелких, черных колоний (этот биовар встречается редко).
Ферментативные свойства. Все три биовара дифтерийных бактерий обладают ферментом цистиназой, расщепляющим цистин с образованием сероводорода. Эти свойства используются для дифференциации возбудителей дифтерии от непатогенных представителей этого рода (табл. 49).
Таблица 49. Свойства возбудителей дифтерии и близких к ним коринебактерий
Примечание. + положительная реакция (расщепляет); — отрицательная реакция (не расщепляет).
Возбудители всех трех биоваров расщепляют глюкозу и мальтозу до образования кислоты. С. gravis расщепляют крахмал. Это свойство отличает его от двух других биоваров. Коринебактерий дифтерии восстанавливают нитраты в нитриты, не образуют индол, не разлагают мочевину.
Коринебактерии дифтерии образуют нейраминидазу, гиалуронидазу и другие ферменты патогенности.
Токсинообразование. Вирулентные штаммы возбудителей дифтерии продуцируют экзотоксин. Химически он представляет собой термолабильный белок, состоящий из Двух фракций. Фракция В фиксирует токсин на чувствительных к нему тканях организма. Фракция А ответственна за токсическое действие. Силу токсина дифтерийных культур можно устанавливать «in vivo» на чувствительных к этому токсину морских свинках. Dim дифтерийного экзотоксина — минимальная смертельная доза, это минимальное количество яда, убивающее морскую свинку массой 250 г на 4-й день.
Наличие экзотоксина можно обнаружить также «in vitro» — на плотной питательной среде. Этот метод широко используется в практической работе. Дифтерийный экзотоксин малоустойчив. Он быстро разрушается под влиянием температуры, света и кислорода воздуха. После добавления к токсину формалина (0,3-0,4%) и выдерживания его при температуре 37-38° С в течение нескольких недель он переходит в анатоксин, который теряет ядовитость, но сохраняет антигенные свойства токсина. Токсины, образуемые различными штаммами, не различаются между собой и могут быть нейтрализованы дифтерийным антитоксином * .
* ( В настоящее время установлено, что все биовары коринебактерий могут быть токсигенными и нетоксигенными.)
Антигенная структура. У бактерий дифтерии имеется поверхностный термолабильный белковый антиген и типоспецифический полисахаридный О-антиген. Кроме этого, среди коринебактерий различают 19 фаговаров, которые учитываются при идентификации культур. С помощью фаговаров выявляют источник заболевания.
Устойчивость к факторам окружающей среды. Возбудители дифтериии сравнительно устойчивы. Температура 60° С убивает их через 10-15 мин, 100° С — через минуту. В пленке они выдерживают нагревание до 90° С. На свернутой сыворотке при комнатной температуре сохраняются до 2 мес, на детских игрушках — несколько суток. Низкие температуры коринебактерий переносят хорошо. К высушиванию возбудители дифтерии довольно устойчивы. Дезинфицирующие вещества (3% раствор фенола, 1% раствор сулемы, 10% раствор перекиси водорода) убивают эти бактерии в течение нескольких минут.
Восприимчивость животных. В естественных условиях животные дифтерией не болеют. Из экспериментальных животных наиболее восприимчивы морские свинки и кролики. При внутрикожном или подкожном заражении у них развивается картина токсикоинфекции с образованием на месте введения воспаления, отека, некроза. В надпочечниках наблюдаются кровоизлияния.
Источники заболевания. Больные люди и бактерионосители.
Пути передачи. Воздушно-капельный путь, контактно-бытовой (через посуду, игрушки, книги, полотенца и т. д.).
Заболевание у человека: 1) дифтерия зева; 2) дифтерия носа.
Реже возникает дифтерия трахеи, бронхов, глаз, уха, влагалища и дифтерия поврежденной кожи.
Патогенез. Входными воротами являются слизистые оболочки дыхательных путей и поврежденная кожа. Попав на слизистую оболочку, возбудители дифтерии размножаются в месте внедрения и вызывают некроз ткани. Образуется пленка, тесно связанная с подлежащими тканями. На поверхности слизистой появляются грязно-серые или желтоватые налеты, состоящие из разрушенного эпителия, фибрина, лейкоцитов и коринебактерий дифтерии. При снятии пленки ватным тампоном или шпателем поверхность слизистой может кровоточить.
В процессе размножения коринебактерий дифтерии в некротических участках накапливается экзотоксин, который может привести к отеку слизистой оболочки и клетчатки. Со слизистой оболочки отек может распространяться на гортань, бронхи и вызвать явления асфиксии. Токсин, циркулирующий в крови, избирательно поражает сердечную мышцу, надпочечники и клетки нервной ткани.
Дифтерия — это токсикоинфекция. Тяжесть процесса зависит от степени токсигенности штамма и от защитных сил организма.
Иммунитет. Невосприимчивость обусловливается антитоксическим и антибактериальным иммунитетом. Грудные дети не болеют, так как у них имеется пассивный иммунитет, переданный от матери.
О наличии антитоксического иммунитета судят по реакции Шика. Для постановки реакции 1 /40 Dlm (летальной дозы токсина для морской свинки), содержащегося в 0,2 мл изотонического раствора натрия хлорида, вводят внутрикожно в области предплечья. При отсутствии в крови антитоксина в месте введения через 24-48 ч появляется краснота и припухлость (до 2 см в диаметре). При наличии антитоксина припухлости и красноты нет (имеющийся в крови антитоксин нейтрализовал введенный токсин).
Перенесенное заболевание оставляет иммунитет. Однако в 6-7% случаев наблюдаются повторные заболевания.
Профилактика. Ранняя диагностика. Изоляция. Дезинфекция. Выявление носителей токсигенной дифтерийной палочки.
Специфическая профилактика осуществляется введением анатоксина. В СССР проводят обязательную вакцинацию детей вакциной АКДС — это комплексная вакцина, в которую входят дифтерийный и столбнячный анатоксин и взвесь убитых коклюшных палочек. Вакцинируют детей с 5-6 месяцев с последующей ревакцинацией. Для ревакцинации вводят вакцину без коклюшных палочек.
Специфическое лечение. Применяют противодифтерийную антитоксическую сыворотку. Доза и кратность определяется лечащим врачом, вводят также антимикробные препараты.
1. Какова морфология коринебактерий дифтерии и какие имеются биовары?
2. На каких средах выращивают бактерии дифтерии и каков характер роста?
3. Отношение к какому углеводу позволяет отличить биовар gravis от других биоваров дифтерии?
4. Каков путь передачи и где чаще локализуется возбудитель дифтерии у больного?
5. Каковы специфическая профилактика и специфическое лечение дифтерии?
Цель исследования: выделение возбудителя для постановки диагноза. Выявление бактерионосителей дифтерии по эпидемиологическим показаниям. Выявление экзотоксина у выделенной культуры.
1. Отделяемое слизистой оболочки зева.
2. Отделяемое слизистой оболочки носа.
3. Отделяемое слизистой оболочки глаза.
5. Отделяемое слизистой оболочки влагалища.
Материал для исследования зависит от локализации процесса.
Способы сбора материала
При любой локализации процесса обязательно исследует слизистую зева и носа. Материал собирают ватным тампоном, для чего используют металлическую проволоку, желательно алюминиевую, на один конец которой плотно накручивают вату, затем тампон монтируют в корковую пробку, помещают в пробирку и стерилизуют в печи Пастера при температуре 160° С 1 тампон течение часа или в автоклаве при температуре 112° С.
Примечания. 1. Материал собирают натощак либо не раньше чем через 2 ч после еды и не ранее чем через 4 дня после лечения антибиотиками или другими антибактериальными средствами. 2. Если материал берут из зева и носа, то пробирки с обоими тампонами надписывают и связывают вместе. Посевы делают раздельно и исследование материала из каждого тампона ведут как самостоятельную работу. 3 Материал, собранный сухим тампоном, должен быть посеян не позднее чем через 2-3 ч после забора. При необходимости транспортировки собранного материала тампон предварительно смачивают 5% раствором глицерина в изотоническом растворе натрия хлорида.
Первый день исследования
Чашки вынимают из термостата и просматривают. Рост бактерий на среде Клауберга может быть замедлен из-за наличия ингибиторов в среде. В этом случае чашки ставят в термостат еще на 24 ч.
Чашки вынимают из термостата, просматривают их с помощью лупы или стереоскопического микроскопа. При наличии подозрительных колоний часть их под контролем стереоскопического микроскопа выделяют на агар с 25% сывороткой и на столбик со средой Пизу для определения фермента цистиназы. Из другой части колоний ставят пробу на токсигенность.
При микроскопическом исследовании колоний, снятых со среды Клауберга, коринебактерии дифтерии теряют свою специфичность: отсутствует зернистость, изменяется величина, расположение сохраняется. При посеве их на среды с сывороткой морфологическая специфичность возбудителей дифтерии восстанавливается.
Проба на наличие фермента цистиназы и определение токсигенности являются обязательными при идентификации возбудителей дифтерии. Если результат этих опытов, проведенных с частью колоний со среды Клауберга, недостаточно четкий или отрицательный, то опыт повторяют, используя выделенную чистую культуру.
Проба на цистиназу. Проводят посев исследуемой культуры уколом в центр столбика среды Пизу. При положительной реакции через 18-24 ч по ходу укола наблюдается почернение, а вокруг черного стержня образуется темное облачко; почернение происходит в результате того, что фермент цистиназа расщепляет цистин, входящий в состав среды Пизу, и освободившаяся сера вступает в реакцию с ацетатом свинца — образуется сульфит свинца черного цвета. Дифтероиды и ложнодифтерийные палочки не содержат фермент цистиназу, поэтому при росте их на среде Пизу цвет среды не изменяется.
Определение экзотоксина. Проводят методом диффузной преципитации в геле. Метод основан на взаимодействии токсина с антитоксином. В тех участках агара, где эти компоненты взаимодействуют, образуется преципитат в виде закругленных линий.
Методика определения: в чашки Петри разливают растопленный и охлажденный до 50° С агар Мартена рН 7,8 (на агаре Мартена лучше продуцируется экзотоксин). Количество агара в чашке должно быть не более 12-15 мл, чтобы сохранить прозрачность, — в толстом слое линии преципитации плохо видны. После застывания агара накладывают полоску стерильной фильтровальной бумаги, смоченной противодифтерийной антитоксической сывороткой.
Испытуемую культуру засевают «бляшками». Посев производят петлей. Диаметр бляшек 0,8-1,0 см. Расстояние бляшек от края полосок бумаги 0,5-0,7 см, между двумя бляшками испытуемой культуры засевают бляшки заведомо токсигенного штамма. Испытуемую культуру считают токсигенной, если линии преципитации четки и сливаются с линиями преципитации контрольного (токсигенного) штамма. Если линии преципитации перекрещиваются с линиями контрольного штамма или отсутствуют, выделенную культуру считают нетоксигенной (рис. 50).
Рис. 50. Выявление экзотоксина C.Diphtheriae методом диффузной преципитации в агаре. 1 — бляшки нетоксигенного штамма (линии преципитации перекрещиваются); 2 — бляшки токсигенного штамма (линии преципитации соединяются)
Приготовление полосок бумаги. Из фильтровальной бумаги нарезают полоски размером 1,5×8 см, заворачивают по несколько штук в бумагу и стерилизуют в автоклаве при температуре 120° С в течение 30 мин. Перед постановкой опыта стерильным пинцетом вынимают одну полоску, укладывают ее в стерильную чашку Петри и смачивают противодифтерийной антитоксической сывороткой. Предварительно сыворотку разводят так, чтобы в 1 мл содержалось 500 АЕ (антитоксических единиц). Бумажку смачивают 0,25 мл сыворотки (125 АЕ) и помещают на поверхность среды. Затем делают посевы указанным выше способом. Все посевы ставят в термостат. Учет результатов производят через 18-24 и 48 ч.
Вынимают посевы из термостата, учитывают результат. Делают мазки из культуры, выросшей на среде с сывороткой, и окрашивают их синим Леффлера.
Наличие в мазках характерных по морфологии палочек, черного с облачком стержня в среде Пизу и линий преципитации в агаре позволяет дать предварительный ответ: «Обнаружены коринебактерии дифтерии». Исследование продолжают. При отсутствии линий преципитации в агаре или их недостаточной четкости исследование на токсигенность обязательно повторяют с выделенной чистой культурой.
Для окончательной идентификации выделенной культуры и определения биовара возбудителя производят посев на глюкозу, сахарозу, крахмал и бульон с мочевиной (для выявления фермента уреазы). Посев на среды делают обычным способом.
Проба на уреазу. Выделенную культуру засевают на бульон с мочевиной и индикатором (крезоловый красный) и ставят в термостат. Уже через 30-40 мин можно учитывать результат: при посеве истинных возбудителей дифтерии цвет среды не изменяется, так как они не содержат уреазу. Псевдодифтерийные палочки расщепляют мочевину и изменяют индикатор — среда приобретает малиново-красный цвет.
Производят учет результатов (табл. 50).
Таблица 50. Ферментативные свойства выделенных возбудителей
1. Какой материал исследуют для выявления возбудителя дифтерии?
2. Как собирают материал для исследования на дифтерию из зева и носа?
3. Что нужно сделать с тампоном, если собранный материал необходимо транспортировать?
4. При помощи какого прибора изучают колонии на среде Клауберга?
5. Какие исследования проводят для окончательной идентификации выделенной культуры?
6. Какими методами определяют токсигенность коринебактерий дифтерии?
1. Возьмите у преподавателя проволоку и вату и приготовьте 10 тампонов, вмонтируйте их в корковую пробку, вставьте в пробирку и простерилизуйте.
Внимание! Перед стерилизацией проверьте, достаточно ли плотно накручен тампон.
2. Возьмите у преподавателя стерильные тампоны и произведите забор материала друг у друга из зева и носа (разными тампонами).
3. Изучите по табл. 49 свойства возбудителей дифтерии и близких к ним коринебактерий.
4. Поставьте пробу на токсигенность. Бляшки сделайте петлей без культуры.
5. Зарисуйте ход исследования и положительный и отрицательный результат пробы на токсигенность.
Теллуровая среда Клауберга: первая смесь — предварительно за 1,5 мес готовят смесь из 20 мл бараньей или лошадиной крови и 10 мл глицерина. В день приготовления среды готовят две другие смеси; вторая смесь — 50 мл МПА рН 7,5 растапливают и охлаждают до температуры 50° С, после чего прибавляют 2,5 мл первой смеси; третья смесь — смешивают 17 мл бараньей крови и 33 мл дистиллированной воды (смесь приготавливают стерильно), подогревают на водяной бане до температуры 50° С. Соединяют вторую и третью смеси, прибавляют 4 мл 1% раствора теллурита калия К2ТеО3, быстро все перемешивают и разливают в чашки. Среда прозрачная, имеет цвет красного вина.
Среда Пизу. К 90 мл расплавленного 2% МПА (рН 7,6) добавляют 2 мл раствора цистина (1% раствор цистина в 0,1 н. растворе гидроксида натрия), тщательно перемешивают и добавляют такой же объем 0,1 н. раствора серной кислоты. Среду стерилизуют 30 мин при температуре 112° С. К расплавленной и охлажденной до 50° С среде добавляют 1 мл 10% раствора ацетата свинца, стерилизованного двукратно текучим паром, перемешивают и добавляют 9 мл нормальной лошадиной сыворотки. Среду стерильно разливают в маленькие пробирки по 2 мл. Посев производят уколом.
Среда Бунина. Сухую хинозольную среду добавляют к 100 мл холодной воды (рН 7,6-7,8), размешивают и нагревают на слабом огне до расплавления агара (по прописи на этикетке). Затем среду кипятят 2-3 мин до образования пены, после чего среду остужают до 50° С и добавляют 5-10 мл стерильной дефибринированной крови. Среду перемешивают и разливают в чашки Петри. Готовую среду можно сохранять 3-4 дня при температуре 4-10°.
Среда Тинсдаля. К 100 мл 2% питательного агара, расплавленного и охлажденного до 50° С, добавляют: 1) 12 мл 1% раствора цистина на 0,1 н. растворе серной кислоты; 2) 12 мл 1% раствора гидроксида натрия; 3) 1,8 мл 2% раствора теллурита калия; 4) 1,8 мл 2,5% раствора гипосульфита натрия, 20 мл нормальной лошадиной или бычьей сыворотки. После добавления каждого ингредиента среду тщательно перемешивают. Чашки со средой хранят 3-4 дня при 10° С.
источник
Возбудитель дифтерии. Таксономия. Характеристика. Микробиологическая диагностика. Выявление антитоксического иммунитета. Специфическая профилактика и лечение
Дифтерия — острая инфекционная болезнь, характеризующаяся фибринозным воспалением в зеве, гортани, реже в других органах и явлениями интоксикации. Возбудителем ее является Corynebacterium diphtheriae.
Таксономия. Corynebacterium относится к отделу Firmicutes, роду Corynebacterium.
Морфологические и тинкториальные свойства. Возбудитель дифтерии характеризуется полиморфизмом: тонкие, слегка изогнутые палочки (наиб. распространенные) встречаются кокковидные и ветвящиеся формы. Бактерии нередко располагаются под углом друг к другу. Они не образуют спор, не имеют жгутиков, у многих штаммов выявляют микрокапсулу. Характерная особенность — наличие на концах палочки зерен волютина (обусловливает булавовидную форму). Возбудитель дифтерии по Граму окрашивается положительно.
Культуральные свойства. Факультативный анаэроб, оптим. температура. Микроб растет на специальных питательных средах, например на среде Клауберга (кровяно-теллуритовый агар), на которой дифтерийная палочка даёт колонии 3 типов: а) крупные, серые, с неровными краями, радиальной исчерченностью, напоминающие маргаритки; б) мелкие, черные, выпуклые, с ровными краями; в) похожие на первые и вторые.
В зависимости от культуральных и ферментативных свойств различают 3 биологических варианта C.diphtheriae: gravis, mitis и промежуточный intermedius.
Ферментативная активность. Высокая. Ферментируют глк и мальтозу в образованием кислоты, не разлагают сахарозу, лактозу и маннит. Не продуцируют уреазу и не образуют индол. Продуцирует фермент цистиназу, рпсщепляющую цистеин до H2S. Образует каталазу, сукцинатдегидрогеназу.
Антигенные свойства. О-антигены – термостабильные полисахаридные, расположены в глубине клеточной стенки. К-антигены – поверхностные, термолабильные, сероватоспецифические. С помошью сывороток к К-антигену С.diph. разделяют на серовары(58).
Факторы патогенности. Экзотоксин, нарушающий синтез белка и поражающий в связи с этим клетки миокарда, надпочечников, почек, нервных ганглиев. Способность вырабатывать экзотоксин обусловлена наличием в клетке профага, несущего tох-ген, ответственный за образование токсина. Ферменты агрессии — гиалуронидазу, нейраминидазу. К факторам патогенности относится также микрокапсула.
Резистентность. Устойчив к высушиванию, действию низких температур, поэтому в течение нескольких дней может сохраняться на предметах, в воде.
Эпидемиология. Источник дифтерии — больные люди Заражение происходит чаще через дыхательные пути. Основной путь передачи воздушно-капельный, возможен и контактный путь — через белье, посуду.
Патогенез. Входные ворота инфекции — слизистые оболочки зева, носа, дыхательных путей, глаз, половых органов, раневая поверхность. На месте входных ворот наблюдается фибринозное воспаление, образуется характерная пленка, которая с трудом отделяется от подлежащих тканей. Бактерии выделяют экзотоксин, попадающий в кровь, — развивается токсинемия. Токсин поражает миокард, почки, надпочечники, нервную систему.
Клиника. Существуют различные по локализации формы дифтерии: дифтерия зева, которая наблюдается в 85—90 % случаев, дифтерия носа, гортани, глаз, наружных половых органов, кожи, ран. Инкубационный период составляет от 2 до 10 дней. Заболевание начинается с повышения температуры тела, боли при глотании, появления пленки на миндалинах, увеличения лимфатических узлов. Отека гортани, развивается дифтерийный круп, который может привести к асфиксии и смерти. Другими тяжелыми осложнениями, которые также могут явиться причиной смерти, являются токсический миокардит, паралич дыхательных мышц.
Иммунитет. После заболевания — стойкий, напряженный антитоксичный иммунитет. Особое значение – образование АТ к фрагменту В. Они нейтрализуют дифтерийный гистотоксин, предупреждая прикрепление последнего к клетке. Антибактериальный иммунитет – ненажняженный, сероватоспецифичен
Микробиологическая диагностика. С помощью тампона у больного берут пленку и слизь из зева и носа. Для постановки предварительного диагноза возможно применение бактериоскопического метода. Основной метод диагностики — бактериологический: посев на среду Клаубера II (кровяно-теллуритовый агар), на плотную сывороточную среду для выявления продукции цистиназы, на среды Гисса, на среду для определения токсигенности возбудителя. Внутривидовая идентификация заключается в определении био- и серовара. Для ускоренного обнаружения дифтерийного токсина применяют: РНГА (реакция непрямой геммаглютинации) с антительным эритроцитарным диагностикумом, реакцию нейтрализации антител (о наличии токсина судят по эффекту предотвращения гемаггютинации); РИА (радиоиммунный) и ИФА(имунноферментный анализ).
Лечение. Основной метод терапии — немедленное введение специфической антитоксической противодифтерийной лошадиной жидкой сыворотки. Иммуноглобулин человека противодифтерийный для в/в введения.
Ассоциированные вакцины: АКДС (абсорбированная коклюшно – столбнячная вакцина), АДС (абсорбированный дифтерийно — столбнячный анатоксин).
Не нашли то, что искали? Воспользуйтесь поиском:
источник
C. diphtheriae — палочковидные бактерии; вызывают дифтерию (греч. diphtheria — кожа, пленка) — острую инфекцию, характеризующуюся фибринозным воспалением в зеве, гортани, реже в других органах, и явлениями интоксикации.
Морфологические и культуральные свойства.
Corinebacterium diphteriae – тонкие, слегка изогнутые или прямые грамположительные палочки, расположенные под углом друг к другу в виде римских пятерок. Они утолщены на концах за счет наличия зерен валютина на одном или обоих полюсах клетки. Зерна валютина состоят из полифосфатов, они воспринимают анилиновые красители более интенсивно, чем цитоплазма клетки и легко выявляются при окраске по Нейссеру в виде гранул сине-черного цвета, тогда как тела бактерий – окрашивается в желто-зеленый. При окраске по Граму зерна валютина не выявляются.
Рисунок мазка из чистой культуры. Окраска по Нейссеру Мазок из чистой культуры.
Окраска щелочной синькой Леффлера
Дифтерийная палочка не обладает кислотоустойчивостью, неподвижна, спор не образует, имеет микрокапсулу с входящим в ее состав корд-фактором. В состав клеточной стенки входят галактоза, манноза, арабиноза, а также большое количество липидов, в том числе некислотоустойчивые миколовые кислоты.
Возбудитель дифтерии – факультативный анаэроб, гетеротроф, растет при 37 о С на сложных питательных средах: свернутая кровяная сыворотка, кровяной теллуритовый агар.
На элективных средах через 8-14 часов образует точечные, выпуклые желтовато-кремовые колонии с гладкой или слегка зернистой поверхностью. Колонии не сливаются и имеют вид шагреневой кожи.
На теллуритовых средах возбудитель дифтерии через 24-48 час образует черные или черно-серые колонии в результате восстановления теллурита до металлического теллура.
Возбудитель дифтерии обладает высокой ферментативной активностью. Дифференциально-диагностическими признаками C. diphteriae являются:
отсутствие способности ферментировать сахарозу и разлагать мочевину,
способность продуцировать фермент цистиназу.
Возбудитель дифтерии не однороден по культуральным и биохимическим свойствам. В соответствии с рекомендациями Европейского регионального бюро ВОЗ вид C. diphteriae подразделяют на 4 биовара: gravis, mitis, intermedius, belfanti.
На теллуритовой среде биовар gravis образует сухие, матовые, крупные, плоские, серовато-черные колонии, приподнятые в центре. Периферия колонии светлая с радиальной исчерченностью и неровным краем. Такие колонии напоминают цветок маргаритку. Биовар mitis образует мелкие, гладкие, блестящие, черные, выпуклые колонии с ровным краем, окруженные зоной гемолиза. Биовары intermedius и belfanti фактически относятся к биовару mitis, так как не разлагают крахмал, а этот признак у C. diphteriae является наиболее стабильным.
Антигенная структура. C. diphteriae имеют О-антиген (липидные и полисахаридные фракции, расположенные в глубине клеточной стенки) и К-антиген (поверхностный термолабильный белок). О-антиген является межвидовым. На основании К-антигена различают около 58 сероваров.
Факторы патогенности. Основными факторами патогенности C. diphteriae являются поверхностные структуры, ферменты и токсины.
Поверхностные структуры (пили, компоненты микрокапсулы: корд-фактор, К-антиген, миколовые кислоты) имеют белковую и липидную природу, способствуют адгезии микробов в месте входных ворот, препятствуют фагоцитозу бактерий, оказывают токсическое воздействие на клетки макроорганизма, разрушают митохондрии.
Ферменты патогенности: нейраминидаза, гиалуронидаза, гемолизин, дермонекротоксин. Нейраминидаза отщепляет N-ацетилнейраминовую кислоту от гликопротеидов слизи и поверхности клеток, лиаза расщепляет ее на пируват и N-ацетилманнозамин, а пируват стимулирует рост бактерий. В результате действия гиалуронидазы повышается проницаемость кровеносных сосудов и выход плазмы за их пределы, что ведет к отеку окружающих тканей. Дермонекротоксин вызывает некроз клеток в месте локализации возбудителя. Вышедший за пределы сосудов фибриноген плазмы контактирует с тромбокиназой некротизированных клеток организма и превращается в фибрин, что и является сущностью дифтерийного воспаления. Внутри дифтерийной пленки C. diphteriae находят защиту от эффекторов иммунной системы и антибиотиков, размножаясь, они образуют в большом количестве основной фактор патогенности — дифтерийный гистотоксин.
Дифтерийный гистотоксин оказывает блокирующее действие на синтез белка в органах, наиболее интенсивно снабженных кровью: сердечно-сосудистая система, миокард, нервная система, почки и надпочечники.
Эпидемиология. В естественных условиях дифтерией болеет только человек, не обладающий устойчивостью к возбудителю и антитоксическим иммунитетом. Заболевание распространено повсеместно. Наибольшее количество больных наблюдается во второй половине сентября, октябре и ноябре. Наиболее восприимчивы дети дошкольного и младшего школьного возраста. Среди взрослых к группе повышенного риска относятся работники общественного питания и торговли, школ, детских дошкольных и медицинских учреждений.
C. diphteriae обладает устойчивостью к факторам окружающей среды: в капельках слюны, прилипших к посуде или игрушкам, на ручках дверей они могут сохраняться до 15 дней, на предметах окружающей среды – 5,5 мес., могут размножаться в молоке. При кипячении C. diphteriae погибают в течение 1 мин, в 10% растворе перекиси водорода – через 3 мин, в 5% растворе карболовой кислоты и 50-60% спирте – через 1 мин.
Дифтерийный гистотоксин очень неустойчив и быстро разрушается при действии света, нагревании, окислении.
Источником инфекции являются:
1.носители токсигенных штаммов — особенно опасны те носители, у которых нет клинических проявлений заболевания, так как они обладают антитоксическим иммунитетом.
2.больные: Среди больных наибольшее значение имеют лица с локализацией процесса в верхних дыхательных путях. Больной эпидемиологически опасен в течение всего периода болезни, даже в период выздоровления он выделяет токсигенные штаммы в окружающую среду.
Основным механизмом заражения является аэрозольный. Пути передачи:
ведущая роль принадлежит воздушно-капельному,
иногда могут осуществляться воздушно-пылевой, контактно-бытовой, а также алиментарный (через молоко) пути передачи.
Входными воротами инфекции служат слизистые оболочки ротоглотки (небные миндалины и окружающие их ткани), носа, гортани, трахеи, а также слизистые оболочки глаз и половых органов, поврежденные кожные покровы, раневая или ожоговая поверхность, незажившая пупочная ранка.
Наиболее часто встречается дифтерия зева (90-95%). Инкубационный период длится от 2 до 10 дней. По патогенезу дифтерия относится к токсинемическим инфекциям, когда микроб остается в месте входных ворот инфекции, а все клинические проявления связаны с действием экзотоксина.
Начальным этапом инфекционного процесса является адгезия микроба в месте входных ворот. Размножаясь там, микроб выделяет гистотоксин, который оказывает местное действие на клетки тканей, а также поступает в кровь, что ведет к возникновению токсинемии.
В области входных ворот развивается воспалительная реакция, которая сопровождается некрозом эпителиальных клеток и отеком, образуется налет белого цвета с сероватым или желтоватым оттенком, содержащим большое количество микробов, продуцирующих токсин.
Характерным признаком дифтерии является фибринозная пленка:
Если слизистая оболочка образована однослойным эпителием (гортань, трахея, бронхи), возникает крупозное воспаление, здесь пленка располагается поверхностно и легко отделяется от подлежащих тканей.
Если слизистая оболочка образована многослойным эпителием (ротоглотка, надгортанник, голосовые связки), возникает дифтерическое воспаление, когда все клетки прочно связаны между собой и с подлежащей соединительнотканной основой. Фибринозная пленка в этом случае плотно спаяна с подлежащими тканями и не снимается тампоном. При попытке сделать это слизистая оболочка кровоточит.
Иммунитет. После перенесенного заболевания формируется стойкий и напряженный гуморальный антитоксический иммунитет. Продолжительность поствакцинального иммунитета – 3-5 лет.
Материалом для исследования является фибринозная пленка, слизь из зева или носа.
Сбор материала необходимо проводить в течение 3-4 ч (не позднее 12 ч) с момента обращения больного. Для взятия материала используют сухие ватные тампоны, если посев будет произведен в течение 2-3 ч, при транспортировке материала тампоны смачивают 5% раствором глицерина.
Основным методом диагностики является бактериологический. Бактериологическая лаборатория через 48 ч должна дать ответ о наличии или отсутствии C. diphteriae в анализах.
Материал засевают на питательную среду. Отбирают подозрительные колонии и выделенную культуру идентифицируют:
По наличию цистиназы (проба Пизу): в столбик питательного агара с цистином уколом засевают исследуемую культуру. Посевы инкубируют при 37 о С 24 ч. C. diphteriae вызывает почернение среды по ходу укола в результате образования сульфида свинца.
По наличию уреазы (проба Закса): готовят спиртовый раствор мочевины и раствор индикатора – фенолового красного, которые перед употреблением смешивают в соотношении 1:9 и разливают в агглютинационные пробирки. Исследуемые бактерии вносят петлей и растирают по стенке прибирки. В положительном случае через 20-30 мин инкубации при 37 о С среда приобретает красный цвет в результате расщепления мочевины уреазой.
Способности C. diphteriae продуцировать токсин (устанавливается в реакции преципитации в агаре). Для этого в чашку Петри с питательным агаром, содержащим 15-20% лошадиной сыворотки, 0,3% мальтозы и 0,03% цистина помещают полоску фильтровальной бумаги, пропитанную антитоксической противодифтерийной сывороткой, содержащей 5000 АЕ/мл. Чашку подсушивают при 37 0 С 30 мин и бляшками засевают испытуемые штаммы на расстоянии 0,6-0,8 см от края бумаги. Посевы инкубируют при 37 0 С 24 ч. В положительном случае в месте соединения токсина с антитоксином в среде образуется преципитат в виде белых линий – «усиков».
Для определения токсигенности возбудителя дифтерии может быть использована биопроба. Морской свинке внутрикожно или подкожно вводят испытуемую культуру. Токсигенные культуры убивают животных в течение 3-5 суток, при вскрытии обнаруживаются гиперемированные надпочечники, а при внутрикожном заражении – некроз кожи.
Для бактериоскопического исследования (как самостоятельный диагностический метод применяется редко ввиду полиморфизма возбудителя, но может быть проведен по просьбе врача) из материала готовят мазки на нескольких стеклах, один мазок окрашивают по Граму, другой по Нейссеру, третий – обрабатывают флюорохромом – корифосфином для люминесцентной микроскопии.
О наличии антитоксического иммунитета судят по реакции Шика – реакции нейтрализации токсина антитоксином. В кожу предплечья вводят 1/40 DLM дифтерийного токсина. Покраснение и припухлость в месте введения свидетельствует об отсутствии антитоксинов в крови. Отрицательная реакция Шика говорит о наличии антитоксинов.
Для ускоренного обнаружения дифтерийного токсина, как в бактериальных культурах, так и в сыворотке крови, применяют: РНГА с антительным эритроцитарным диагностикумом, РИА и ИФА. Из молекулярно-генетических методов исследования применяют ПЦР.
Препараты для специфического лечения дифтерии.
В целях нейтрализации дифтерийного гистотоксина применяют специфическую противодифтерийную лошадиную очищенную концентрированную сыворотку, которую получают путем гипериммунизации лошадей дифтерийным антитоксином.
Специфическое лечение противодифтерийной сывороткой начинают немедленно при клиническом подозрении на дифтерию. Необходимо выбрать оптимальный режим введения сыворотки, так как антитоксин может нейтрализовать только не связанный с тканями токсин. Для профилактики развития анафилактического шока сыворотку вводят дробно по А.М. Безредке. Введение сыворотки позднее 3-го дня болезни нецелесообразно.
Разработан противодифтерийный иммуноглобулин человека для внутривенного введения. Его применение дает меньше побочных реакций.
Для подавления размножения C. diphteriae в месте входных ворот обязательно назначают антибиотики. Препаратами выбора являются пенициллин или эритромицин, либо другие β-лактамы и макролиды.
Препараты для специфической профилактики дифтерии.
Для создания искусственного активного антитоксического иммунитета применяют дифтерийный анатоксин. Очищенный и концентрированный препарат входит в состав ассоциированных вакцин:
1. адсорбированной коклюшно-дифтерийно-столбнячной вакцины (АКДС-вакцина),
2. адсорбированного дифтерийно-столбнячного анатоксина (АДС-анатоксин),
3. адсорбированного дифтерийно-столбнячного анатоксина с уменьшенным содержанием антигенов (АДС-М),
4. адсорбированного дифтерийного анатоксина с уменьшенным содержанием антигена (АД-М).
Базисный иммунитет создается у детей согласно календарю прививок. Только 95% охват населения прививками гарантирует эффективность вакцинации.
источник
Род Corynebacterium семейства Corynebacteriaceae относится котделу Firmicutes. В род коринебактерий входят десятки патогенныхи непатогенных бактерий, имеющих определенную роль в патологиичеловека, животных, растений.
C. diphtheriае – возбудители дифтерии; C. xerosis – cапрофиты;C.cistitidis вызывают образование камней в мочевыводящих путях,циститы, пиелонефриты;C.minutissimum вызывают септицемии, абсцессы мозга, остеомиелиты; C.ulcerans вызывает дифтериеподобныепоражения – фарингиты, реже поражения кожи; С.pseudodiphthericumмогут встречаться в носоглоточной слизи здоровых людей, не принося вреда, но, попадая в кровь, могут быть причиной сепсиса.
Общие свойства
Морфологические свойства – выражен полиморфизм, чаще имеют вид тонких палочек, расположенных под углом в виде римскихцифр Х или V, на концах расположены зерна волютина.Грамположительны. Выражена метахромазия, которая выявляется приокраске по Нейссеру (зерна сине-фиолетовые, а палочки желтые,напоминают россыпь спичек). Спор, жгутиков нет, иногда образуюткапсулу. При окраске корифосфином в люминесцентном микроскопезерна волютина дают красное свечение на фоне желто-зеленого телаклетки.
Культуральные свойства – факультативные анаэробы, метаболизм окислительно-ферментативный. На кровяном и сывороточном агарах через 18-20 часов образуются крошковидные колонии кремового цвета, напоминающие «булыжную мостовую».
Селективными средами являются среда Тинсдаля (цистин-теллурит-сывороточный агар), на которой коринебактерии растут ввиде коричневатых колоний; среда Клауберга II (МПА, гемолизированная кровь, теллуристый калий, глицерин), на ней образуются серые колонии, т.к. теллурит калия восстанавливается в металлический
теллур; среда Бучина (МПА, антисептик хинозол, глюкоза, цистин,рыбий гидролизат, кровь, индикатор водно-розоловый (ВР), колонииголубого цвета, т.к. возбудители разлагают глюкозу до кислоты).
На жидких средах коринебактерии дифтерии могут давать равномерное помутнение или поверхностную пленку, которая растет,крошится и хлопьями оседает на дно пробирки.
Биохимические свойства – разлагают глюкозу, крахмал, мальтозу, галактозу, декстрин до кислоты, не разлагают лактозу, сахарозу,маннит, выделяют фермент цистиназу, который выявляют на средеПизу (МПА, цистин, уксуснокислый свинец, гипосульфит натрия).Посев на эту среду производят уколом. Если есть фермент цистиназа,то среда по ходу укола чернеет, так как образуется сернистый свинец.
Не выделяют уреазу, следовательно, не разлагают мочевину. Восстанавливают нитраты, кроме C. diphtheriае, биотип belfanti; не разжжают желатин, не образуют индол. Способность разлагать крахмал игилкоген варьирует у различных штаммов, что используется длявнутривидовой дифференциации. Возбудитель дифтерии продуцируеткаталазу, гиалуронидазу, нейрамидазу, ДНК-азу.
Резистентность во внешней среде. Устойчивы к низким температурам, чувствительны к высоким температурам, к дезинфицирующимрастворам, (перекиси водорода, растворам сулемы, карболовой кислоты), антибиотикам. В дифтерийной пленке, капельках среды, прилипших к стенке стакана, на ручках дверей, детских игрушках онимогут сохраняться до 15 дней, в воде и молоке – 20 дней. При кипячении и в алкоголе дифтерийные бактерии погибают в течение 1 минуты, в 10% растворе перекиси водорода – через 3 минуты.
7. Факторы патогенности коринебактерий дифтерии, характеристика токсина, механизм его действия. Генетический контроль образования токсина. Способы определения токсигенности коринебактерий дифтерии.
Экзотоксин состоит из двух фракций (А и В), обладает ферментативной активностью, его выделение определяется tox-геном профага в лизогенной культуре.
Фракция А – собственно токсин (токсический полипептид), обладает некротическими свойствами, действует на фактор элонгации-2– трансферазу, ответственную за элонгацию (наращивание) полипептидных цепей на рибосоме. В результате блокируется белковый синтез в любых клетках, в том числе в миокарде и клетках нервной системы. Это приводит к демиелинизации нервных волокон, развиваются параличи и парезы, токсин повреждает эпителиоциты стенок сосудов, вызывает усиленную экссудацию.
Фракция В (транспортный полипептид) взаимодействует с клеточными рецепторами, обладает гиалуронидазной, нейраминидазной,протеазной активностью, т.е. способствует распространению фракцииА экзотоксина.
Особенность токсинообразования дифтерийной палочки определяется наличием ее в ДНК специфического профага, содержащего структурный ген токсичности, который обозначается как ТОХ+. Неинфицированная специфическим фагом дифтерийная палочка не способна к токсинообразованию. При ее инфицировании профагом происходит присоединение ТОХ+ к ДНК микробной клетки.
Гемолизирующий фактор приводит к развитию геморрагическогосиндрома.
Фимбрии и поверхностные структуры клеточной стенки обеспечивают адгезию и колонизацию клеток к эпителию слизистой оболочки.
Корд-фактор нарушает процессы фосфорилирования, в результате чего нарушаются процессы дыхания в различных клетках организма.
Корицины обеспечивают микробный антагонизм. Гены, кодирующие синтез корицинов передаются плазмидными генами.
Биологические типы. В 1931 г. Андерсен подразделил возбудителей дифтерии на 3 биовара: gravis – R-тип, mitis – S-тип и intermedius– R-S-тип. Он полагал, что I тип выделяется при тяжелых формах, II –при легких, а III занимает промежуточное положение. В основу дифференциации биоваров положены биохимические и культуральныесвойства.
В настоящее время доказано, что биовары имеют эпидемиологическое значение. При массовых вспышках чаще выделяются R-типы,при спорадических – S-типы.
Патогенез и клинические формы дифтерии. Иммунитет. Методы его выявления.
Иммунитет – антитоксический (антитела IgG), в меньшей степе-ни антимикробный. Естественный пассивный иммунитет от матери
сохраняется 3-5 месяцев. После перенесенного заболевания или вак-цинации развивается стойкий иммунитет. Он считается достаточным
при титре антител 1:40 в РПГА или 0,03 МЕ/мл в реакции флоккуля-ции.
При титре антител ниже 1:40 или 0,03 МЕ/мл необходимо прово-дить вакцинацию дифтерийным анатоксином или комплексным пре-
Характеристика заболевания
Источники инфекции: больной человек и бактерионоситель.Пути передачи: воздушно-капельный, контактно-бытовой (через
мягкие игрушки у детей), алиментарный (чаще молоко).Входные ворота – слизистые оболочки носоглотки, реже конъ-
юнктива глаза, раневая поверхность, слизистые половых органов, уш-ных раковин.
Патогенез. У входных ворот за счет выделения токсина подавля-ется фагоцитоз, повреждаются эндотелиоциты, увеличивается прони-
цаемость сосудистой стенки, усиливается экссудация. Развиваетсяфибринозное воспаление, образуется плотно спаянный с подлежащи-
ми тканями налет, возникают регионарные лимфадениты. Некроз мо-жет захватывать все слои слизистой оболочки, на ней появляются яз-
вы (дифтеритическое воспаление). Оно сопровождается значитель-ной интоксикацией, токсин распространяется лимфогенным и гемато-
генным путем, поражаются паренхиматозные органы, сердечно-сосудистая и центральная нервная системы. Увеличивается проница-
емость сосудов, появляются местные отеки. При дифтерии зева можетвозникнуть отек слизистых гортани и голосовых связок, что приводит
к асфиксии (удушью) и гибели больных без оказания срочной помо-щи. Летальность 3-6%.
Клинические формы: локализованная – характерен ограниченныйочаг поражения, фибринозный налет на относительно бледных мин-
далинах, зеве, температура – 37,2-37,50С, интоксикация слабо выра-жена.
Генерализованная форма – налеты выходят за пределы очага по-ражения, в процесс вовлекаются другие ткани и органы, температура
38-390С, интоксикация, головная боль, лимфоузлы болезненны, уве-личены.
Токсическая – начало бурное, температура 39-400С, интоксика-ция резко выражена, толстые, бугристые, гнойные налеты, плохо
снимаются, миндалины кровоточат при снятии налетов, отек тканей,регионарные лимфоузлы болезненны и увеличены. Поражаются сер-
дечно-сосудистая, нервная системы, паренхиматозные органы. Высо-кая летальность.
Гипертоксическая форма – поражаются миокард, почки, надпо-чечники, ЦНС, выражена интоксикация. Летальный исход может
наступить в течение суток.
Столбняк — тяжелая раневая инфекция, вызываемая Clostridium tetani, характеризуется поражением нервной системы, приступами тонических и клонических судорог.
Таксономия. С. tetani относится к отделу Firmicutes, роду Clostridium.
Морфологические свойства. Возбудитель — подвижная (перитрих) грамположительная палочка, образует споры, чаще круглые, реже овальные, споры расположены терминально.
В культуре старше 24 ч бактерии становятся грамотрицательными.
Культуральные свойства. Облигатный анаэроб. На жидких питательных средах бактерии растут придонно, продуцируя сильный экзотоксин. На плотных питательных средах образуют прозрачные или слегка сероватые колонии с шероховатой поверхностью. Не расщепляют углеводов, обладают слабым протеолитическим действием.
Антигенная структура и токсинообразование.
По жгутиковому Н-антигену делится на 10 сероваров; О-антиген является общим для всех представителей вида. Возбудитель продуцирует два патогенных растворимых антигена — тетанолизин и тетаноспазмин, составляющих две фракции столбнячного экзотоксина.
Основным фактором патогенности является экзотоксин. Тетанолизин и тетаноспазмин оказывают соответственно гемолитическое (вызывает лизис эритроцитов) и спастическое (вызывает непроизвольное сокращение мышц) действие.
Резистентность. Являясь нормальным обитателем кишечника животных, человека, клостридии попадают в окружающую среду, в почву с фекалиями, ще в виде спор могут сохраняться годами.
Споры столбнячной палочки отличаются термоустойчивостью: при кипячении погибают лишь через 50—60 мин..
Эпидемиология и патогенез. Заражение происходит при проникновении возбудителя в организм через дефекты кожи и слизистых оболочек при ранениях (боевых, производственных, бытовых), ожогах, обморожениях, через операционные раны, после инъекций.
При инфицировании пуповины возможно развитие столбняка у новорожденных («пупочный столбняк»).
Патогенез. Главным патогенетическим фактором является столбнячный токсин. Палочки столбняка остаются в раневой ткани, т.е. на месте внедрения, и не распространяются по организму. От места размножения возбудителя токсин распространяется по кровеносным и лимфатическим сосудам, по нервным стволам, достигает спинного и продолговатого мозга и поражает нервные окончания синапсов, секретирующих медиаторы (ацетилхолин), в результате чего нарушается проведение импульсов по нервным волокнам.
Клиника. Инкубационный период составляет в среднем 6— 14 дней.
У больных наблюдаются спазм жевательных мышц, затрудненное глотание, напряжение мышц затылка, спины (туловище принимает дугообразное положение — опистотонус), груди и живота.
Характерны постоянные мышечные боли, повышенная чувствительность к различным раздражителям, частые генерализованные судороги. Болезнь протекает при повышенной температуре тела и ясном сознании.
После перенесенной болезни иммунитет не вырабатывается. От матери, вакцинированной против столбняка, новорожденным передается непродолжительный пассивный антитоксический иммунитет.
Микробиологическая диагностика. Для бактериологического исследования берут материал из раны и очагов воспаления, а также кровь.
В культурах выявляют столбнячный токсин, проводя опыт на мышах, у которых развивается характерная клиническая картина. Обнаружение столбнячного токсина при наличии грамположительных палочек с круглыми терминальными спорами позволяет сделать заключение, что в исследуемом материале присутствует С.
Лечение.Адсорбированный столбнячный анатоксин.Получен путем обезвреживания формалином столбнячного токсина с последующей его очисткой, концентрацией и адсорбцией на гидрате оксида алюминия. Входит в состав ассоциированной коклюшно-дифтерийно-столбнячной вакцины и других препаратов. Применяется для активной иммунизации против столбняка.
Противостолбнячная сыворотка.Получена из крови лошадей, гинериммунизированных столбнячным анатоксином.
Применяется для профилактики и лечения столбняка..
Иммуноглобулин человеческий противостолбнячный.Получен из гамма-глобулиновой фракции крови людей-доноров, ревакцинированных очищенным столбнячным анатоксином. Применяется для пассивной экстренной профилактики столбняка в сочетании со столбнячным анатоксином при повреждениях кожных покровов, а также для лечения начавшегося заболевания.
Профилактика: При обширных травмах необходимо обратиться к врачу.
Проводится хирургическая обработка раны. Надежным способом защиты от столбняка является специфическая профилактика, которая состоит в проведении плановой и экстренной иммунизации. Экстренная пассивная иммунизация осуществляется у привитых детей и взрослых в случаях травм, ожогов и обморожений путем введения 0,5 мл сорбированного столбнячного анатоксина; непривитым вводят 1 мл столбнячного анатоксина и человеческий иммуноглобулин.
Для создания искусственного активного иммунитета применяют адсорбированный столбнячный анатоксин в составе вакцин АКДС и АДС или секстанатоксина. Вакцинацию начинают с 3—5-месячного возраста и затем периодически проводят ревакцинации.
Возбудитель дифтерии. Таксономия и характеристика. Условно – патогенные коринебактерии. Микробиологическая диагностика. Выявления анатоксического иммунитета. Специфическая профилактика и лечение.
Дифтерия — острая инфекционная болезнь, характеризующаяся фибринозным воспалением в зеве, гортани, реже в других органах и явлениями интоксикации.
Возбудителем ее является Corynebacterium diphtheriae.
Таксономия. Corynebacterium относится к отделу Firmicutes, роду Corynebacterium.
Морфологические и тинкториальные свойства. Возбудитель дифтерии характеризуется полиморфизмом: тонкие, слегка изогнутые палочки (наиб.
распространенные) встречаются кокковидные и ветвящиеся формы. Бактерии нередко располагаются под углом друг к другу. Они не образуют спор, не имеют жгутиков, у многих штаммов выявляют микрокапсулу. Характерная особенность — наличие на концах палочки зерен волютина (обусловливает булавовидную форму). Возбудитель дифтерии по Граму окрашивается положительно.
Культуральные свойства. Факультативный анаэроб, оптим.
температура. Микроб растет на специальных питательных средах, например на среде Клауберга (кровяно-теллуритовый агар), на которой дифтерийная палочка даёт колонии 3 типов: а) крупные, серые, с неровными краями, радиальной исчерченностью, напоминающие маргаритки; б) мелкие, черные, выпуклые, с ровными краями; в) похожие на первые и вторые.
В зависимости от культуральных и ферментативных свойств различают 3 биологических варианта C.diphtheriae: gravis, mitis и промежуточный intermedius.
Ферментативная активность. Высокая.
Ферментируют глк и мальтозу в образованием кислоты, не разлагают сахарозу, лактозу и маннит. Не продуцируют уреазу и не образуют индол. Продуцирует фермент цистиназу, рпсщепляющую цистеин до H2S. Образует каталазу, сукцинатдегидрогеназу.
Антигенные свойства. О-антигены – термостабильные полисахаридные, расположены в глубине клеточной стенки. К-антигены – поверхностные, термолабильные, сероватоспецифические.
С помошью сывороток к К-антигену С.diph. разделяют на серовары(58).
Факторы патогенности. Экзотоксин, нарушающий синтез белка и поражающий в связи с этим клетки миокарда, надпочечников, почек, нервных ганглиев. Способность вырабатывать экзотоксин обусловлена наличием в клетке профага, несущего tох-ген, ответственный за образование токсина.
Ферменты агрессии — гиалуронидазу, нейраминидазу. К факторам патогенности относится также микрокапсула.
Резистентность. Устойчив к высушиванию, действию низких температур, поэтому в течение нескольких дней может сохраняться на предметах, в воде.
Эпидемиология. Источник дифтерии — больные люди Заражение происходит чаще через дыхательные пути. Основной путь передачи воздушно-капельный, возможен и контактный путь — через белье, посуду.
Патогенез. Входные ворота инфекции — слизистые оболочки зева, носа, дыхательных путей, глаз, половых органов, раневая поверхность.
На месте входных ворот наблюдается фибринозное воспаление, образуется характерная пленка, которая с трудом отделяется от подлежащих тканей. Бактерии выделяют экзотоксин, попадающий в кровь, — развивается токсинемия.
Токсин поражает миокард, почки, надпочечники, нервную систему.
Клиника. Существуют различные по локализации формы дифтерии: дифтерия зева, которая наблюдается в 85—90 % случаев, дифтерия носа, гортани, глаз, наружных половых органов, кожи, ран. Инкубационный период составляет от 2 до 10 дней.
Заболевание начинается с повышения температуры тела, боли при глотании, появления пленки на миндалинах, увеличения лимфатических узлов. Отека гортани, развивается дифтерийный круп, который может привести к асфиксии и смерти. Другими тяжелыми осложнениями, которые также могут явиться причиной смерти, являются токсический миокардит, паралич дыхательных мышц.
Иммунитет. После заболевания — стойкий, напряженный антитоксичный иммунитет.
Особое значение – образование АТ к фрагменту В. Они нейтрализуют дифтерийный гистотоксин, предупреждая прикрепление последнего к клетке. Антибактериальный иммунитет – ненажняженный, сероватоспецифичен
Микробиологическая диагностика. С помощью тампона у больного берут пленку и слизь из зева и носа.
Для постановки предварительного диагноза возможно применение бактериоскопического метода. Основной метод диагностики — бактериологический: посев на среду Клаубера II (кровяно-теллуритовый агар), на плотную сывороточную среду для выявления продукции цистиназы, на среды Гисса, на среду для определения токсигенности возбудителя. Внутривидовая идентификация заключается в определении био- и серовара.
Для ускоренного обнаружения дифтерийного токсина применяют: РНГА(реакция непрямой геммаглютинации) с антительным эритроцитарным диагностикумом , реакцию нейтрализации антител (о наличии токсина судят по эффекту предотвращения гемаггютинации); РИА (радиоиммунный) и ИФА(имунноферментный анализ).
Лечение. Основной метод терапии — немедленное введение специфической антитоксической противодифтерийной лошадиной жидкой сыворотки. Иммуноглобулин человека противодифтерийный для в/в введения.
Ассоциированные вакцины: АКДС (абсорбированная коклюшно – столбнячная вакцина), АДС(абсорбированный дифтерийно — столбнячный анатоксин).
Дифтерия — острая инфекционная болезнь, характеризующаяся фибринозным воспалением в зеве, гортани, реже в других органах и явлениями интоксикации.
Возбудителем ее является Corynebacteriumdiphtheriae.
Corynebacterium относится к отделу Firmicutes, роду Corynebacterium.
Морфологические и тинкториальные свойства
Возбудитель дифтерии характеризуется полиморфизмом: тонкие, слегка изогнутые палочки (наиб. распространенные) встречаются кокковидные и ветвящиеся формы. Бактерии нередко располагаются под углом друг к другу.
Они не образуют спор, не имеют жгутиков, у многих штаммов выявляют микрокапсулу. Характерная особенность — наличие на концах палочки зерен волютина (обусловливает булавовидную форму). Возбудитель дифтерии по Граму окрашивается положительно.
Возбудитель дифтерии Corynebacterium diphtheriae выделен в чистой культуре Леффлером в 1884 г.
Размеры дифтерийной палочки: длина 1—6 мкм, толщина 0,3— 0,8 мкм. Отличительной особенностью возбудителя дифтерии является многообразие форм — наряду с длинными изогнутыми, изящными «типичными» палочками микробов встречаются короткие толстые с колбовидными вздутиями на концах, иногда коккообразные клетки, что придает микробу сходство с булавой.
В колбовидных вздутиях часто находят волютиновые зерна (тельца Бабеша-Эрнета).
Характерен общий вид препарата, особенно если мазок взят с большим количеством микробов. Микробы лежат большими скоплениями и напоминают пакет булавок. В окрашенных мазках могут быть расположены попарно, под острым или прямым углом друг к другу, напоминая римскую цифру V. Дифтерийные микробы неподвижны, спор не образуют, жгутиков не имеют, грамположительные, хорошо окрашиваются основными анилиновыми красками, причем особенно интенсивно окрашиваются волютиновые зерна.
При окрашивании по Кецссеру характерной особенностью является то, что зерна волютина окрашиваются в сине-черный цвет, контрастирующий со светло-коричневой окраской всей микробной клетки.
Факультативный анаэроб. Микроб растет на специальных питательных средах, например на среде Клауберга (кровяно-теллуритовый агар), на которой дифтерийная палочка даёт колонии 3 типов:
а) крупные, серые, с неровными краями, радиальной исчерченностью, напоминающие маргаритки;
б) мелкие, черные, выпуклые, с ровными краями;
в) похожие на первые и вторые.
В зависимости от культуральных и ферментативных свойств различают 3 биологических варианта C.diphtheriae: gravis, mitis и промежуточный intermedius.
дифтерийные микробы хорошо развиваются при свободном доступе кислорода; растут при температуре от 15 до 40 °С.
Могут расти на обычных питательных средах, но лучше и с характерной морфологией развиваются на средах, содержащих кровь или сыворотку любого вида животного.
На этих средах дифтерийные бактерии вырастают уже через 8—10—12 ч.
►свернутая лошадиная сыворотка (среда РУ);
►среда Леффлера (3 части сыворотки + 1 часть мясного бульона с 1% виноградного сахара, 1% пептона);
►теллуритовые среды.
Очень характерен общий вид роста дифтерийных микробов в пробирках на скошенных свернутых сывороточных средах: колонии не сливаются вместе, вся культура представляется усеянной зернышками, напоминая шагреневую кожу.
Колонии круглые, гладкие или слегка зернистые, непрозрачные с полупрозрачной периферией, края ровные, но впоследствии становятся извилистыми или даже зазубренными. На теллуритовых средах дифтерийные палочки образуют темно-серые или черные колонии вследствие восстановления теллурита до металлического теллура.
Восстановление происходит внутри бактериальной клетки.
Типы дифтерийных микробов. На основании культуральных свойств различают 3 типа дифтерийных микробов:
►gravis (тяжелый);
►mitis (средний);
►intermedius (промежуточный).
Тип гравис дает зернистый осадок и пленку на бульоне, на плотных средах образует плоские матовые колонии неправильных очертаний, напоминающие маргаритку.
Тип митис равномерно мутит бульон и образует выпуклые полупрозрачные колонии. Третий тип обладает некоторыми свойствами первого и второго типов.
Часто встречаются также атипичные формы. У дифтерийных бактерий, как и у других микроорганизмов, наблюдаются:
►гладкие (S) формы колоний;
►шероховатые (R) формы;
►промежуточные (RS).
У высокотоксичных штаммов обычно преобладают R-формы. Дифтерийная палочка вырабатывает кислоту без газообразования в средах с глюкозой, мальтозой и галактозой, но не с лактозой, сахарозой и маннитом.
Сбраживание крахмала и гликогена считают характерной особенностью типа гравис. Многие штаммы дают гемолиз на кровяном агаре и лизируют эритроциты, добавленные к культуре.
Дифтерийные бактерии чувствительны к дезинфицирующим средствам: 10%-ная перекись водорода убивает их в течение 3 мин; 1%-ная сулема, 5%-ная карболовая кислота, 50— 60%-ный алкоголь — в течение 1 мин. Низкие температуры (до -190 °С) не убивают дифтерийные бактерии длительное время. Высокая температура приводит к быстрой их гибели.
Под действием прямого солнечного света палочки дифтерии гибнут в течение нескольких дней. В пыли они сохраняют жизнедеятельность до 5 недель, в воде и молоке до 6—20 дней.
В трупах сохраняются до 2 недель.
Высокая. Ферментируют глк и мальтозу в образованием кислоты, не разлагают сахарозу, лактозу и маннит. Не продуцируют уреазу и не образуют индол. Продуцирует ферментцистиназу, расщепляющую цистеин до H2S.
Образует каталазу, сукцинатдегидрогеназу.
О-антигены – термостабильные полисахаридные, расположены в глубине клеточной стенки. К-антигены – поверхностные, термолабильные, серовароспецифические. С помощью сывороток к К-антигену С.diph. разделяют на серовары (58).
Экзотоксин, нарушающий синтез белка и поражающий в связи с этим клетки миокарда, надпочечников, почек, нервных ганглиев.
Способность вырабатывать экзотоксин обусловлена наличием в клетке профага, несущего tох-ген, ответственный за образование токсина. Ферменты агрессии — гиалуронидазу, нейраминидазу. К факторам патогенности относится также микрокапсула.
Устойчив к высушиванию, действию низких температур, поэтому в течение нескольких дней может сохраняться на предметах, в воде.
Источник дифтерии — больные люди Заражение происходит чаще через дыхательные пути.
Основной путь передачи воздушно-капельный, возможен и контактный путь — через белье, посуду.
Входные ворота инфекции — слизистые оболочки зева, носа, дыхательных путей, глаз, половых органов, раневая поверхность. На месте входных ворот наблюдается фибринозное воспаление, образуется характерная пленка, которая с трудом отделяется от подлежащих тканей.
Бактерии выделяют экзотоксин, попадающий в кровь, — развивается токсинемия. Токсин поражает миокард, почки, надпочечники, нервную систему.
Существуют различные по локализации формы дифтерии: дифтерия зева, которая наблюдается в 85—90 % случаев, дифтерия носа, гортани, глаз, наружных половых органов, кожи, ран.
Инкубационный период составляет от 2 до 10 дней. Заболевание начинается с повышения температуры тела, боли при глотании, появления пленки на миндалинах, увеличения лимфатических узлов. Отека гортани, развивается дифтерийный круп, который может привести к асфиксии и смерти.
Другими тяжелыми осложнениями, которые также могут явиться причиной смерти, являются токсический миокардит, паралич дыхательных мышц.
После заболевания — стойкий, напряженный антитоксичный иммунитет. Особое значение – образование АТ к фрагменту В. Они нейтрализуют дифтерийный гистотоксин, предупреждая прикрепление последнего к клетке.
Антибактериальный иммунитет – ненапряженный, серовароспецифичен
С помощью тампона у больного берут пленку и слизь из зева и носа.
Для постановки предварительного диагноза возможно применение бактериоскопического метода. Основной метод диагностики — бактериологический: посев на среду Клаубера II (кровяно-теллуритовый агар), на плотную сывороточную среду для выявления продукции цистиназы, на среды Гисса, на среду для определения токсигенности возбудителя.
Внутривидовая идентификация заключается в определении био- и серовара. Для ускоренного обнаружения дифтерийного токсина применяют: РНГА(реакция непрямой геммаглютинации) с антительным эритроцитарным диагностикумом, реакцию нейтрализации антител (о наличии токсина судят по эффекту предотвращения гемаггютинации); РИА (радиоиммунный) и ИФА(имунноферментный анализ).
Основной метод терапии — немедленное введение специфической антитоксической противодифтерийной лошадиной жидкой сыворотки.
Иммуноглобулин человека противодифтерийный для в/ввведения.
Ассоциированные вакцины: АКДС (абсорбированная коклюшно – столбнячная вакцина), АДС(абсорбированный дифтерийно — столбнячный анатоксин).
Методические указания
По теме 2.9. «Патогенные возбудители воздушно-капельных
бактериальных инфекций»
Тема 2.9.1: «Коринебактерии дифтерии».
Отделу Firmicutes, семейству Corynebacteriaceae,

патогенный для человека и животных вид – C.diphtheriae
коринебактерии, патогенные для растений;
б) псевдодифтерийные палочки (ложнодифтерийные палочки
Гоффмана) – C. рseudodiphtheriticum (hoffmani)
C.diphtheriaeвызывают у человека дифтерию – острую инфекцию дыхательных путей, которая характеризуется образованием в зеве и слизистой носа серовато-белых наложений (пленок), спаянных с подлежащей тканью. В зависимости от входных ворот и локализации возбудителя в организме различают следующие формы заболевания: дифтерия зева, носа, гортани, трахеи, бронхов, глаз, уха, кожи, наружных половых органов у девочек, раневой поверхности.
3. Материал для исследования: отделяемое слизистой оболочки зева, носа, глаза, влагалища, раны, уха, а также секционный материал и дифтерийные пленки (при наличии).
Элективные питательные среды и характер роста:
Среда Клауберга (КТА, кровяно-теллуритовый агар) является основной средой для выделения C.diphtheriae, на которой они образуют различные колонии в зависимости от биовара.
vargravis (грубый, шероховатый) – формирует плотные сухие шероховатые (R-формы), розеткообразные колонии диаметром 1,5-2 мм, с волнистым краем серого или темно-серого (черного), цвета.
Колонии – хрупкие – при раздавливании петлей они крошатся на мелкие кусочки. Их можно также «двигать» петлей по поверхности агара без нарушения целостности. Они не дают гемолиза.
var mitis (гладкий, тонкий) – образует серые матовые колонии диаметром 1,5-2 мм с ровным краем и гладкой поверхностью, блестящие (S-формы). Характерна вариабельность размеров колоний. Дают небольшую зону гемолиза.
var intermedius – образует колонии RS-формы: мелкие, серые, прозрачные колонии диаметром 0,5-1 мм.
На среде Тинсдаля-Садыковой («Т», сывороточный агар с теллуритом калия и циститом) – рост такой же, как на среде Клауберга, кроме того, вокруг колоний всех биоваров образуется темно-коричневый ободок.
5-10% кровяной агар – растут как на среде Клауберга, только mitis без гемолиза.
20% сывороточный агар – растут как на среде Клауберга, только без гемолиза.
Среда Бучина (хинозольная, дифференциально-диагностическая среда) – колонии C.diphtheriae фиолетового цвета, а колонии C.xerosis и C.
hoffmani – бесцветные или голубоватые на фиолетовом фоне среды.
На сывороточном и сахарном бульонах биовар gravisобразуетпленку и зернистый осадок;биовар mitis – диффузное помутнение;биовар intermedius – муть и зернистый осадок.
Чистую культуру коринебактерий выделяют на скошенных элективных средах Ру (свернутая лошадиная сыворотка) и Лёффлера (3 части бычьей сыворотки и 1 часть сахарного бульона), которые выглядят одинаково – косячки белого цвета.
Можно использовать и 20% сывороточный скошенный агар.
На средах Ру, Лёффлера –коринебактерии дифтерии через 8-14 часов вырастают в виде изолированных небольших (точечных) выпуклых желтовато-кремовых колоний с гладкой или слегка зернистой поверхностью, напоминающих «шагреневую кожу».
5. Методы лабораторной диагностики:
1. Бактериологический – основной
6. Тесты идентификации C.diphtheriae:
1. Учитывают результаты пробы на токсигенность (с колониями) и дают предварительный ответ.
2. Проверяют однородность чистой культуры, т.е. делают мазок со скошенной элективной среды, окрашивают по Леффлеру и микроскопируют.
3. Делают посев чистой культуры на короткий «пестрый» ряд Гисса (сахароза, глюкоза, крахмал, мочевина) → 37оС 24 часа.
Посев чистой культуры в столбик среду Пизу для определения цистиназной активности → 37оС 24 часа.
5. Проводят серологическую идентификацию культуры путем постановки РА на стекле с поливалентной агглютинирующей дифтерийной сывороткой.
6. Повторяют пробу на токсигенность с чистой культурой → 37оС 24 часа.
Делают пробу на чувствительность к антибиотикам методом диффузии в агар с применением бумажных дисков → 37оС 24 часа.
Дата добавления: 2016-11-18; просмотров: 109 | Нарушение авторских прав
Возбудитель относится к роду Carinobakterium , виду C. difteria .
Это тонкие палочки, прямые или слегка изогнутые, грамположительные. Для них характерен выраженный полиморфизм. На концах булавовидные утолщения.
В мазках бактерии располагаются под углом в виде V или X.
Спор и капсул не образуют. Неподвижны. Имеют фимбрии. Являются факультативными анаэробами или аэробами.
Выделяясь во внешнюю среду со слюной, пленками, дифтерийные палочки способны сохранять жизнеспособность на предметах в течение нескольких дней.
Хорошо переносят высушивание.
Каринобактерии требовательны к питательным средам, для их культивирования применяются сывороточные среды или среды с добавлением крови. Используется среда Ру (свернутая сыворотка).
Для выделения используются элективные питательные среды с добавлением толурита калия. Каринобактерии подразделяются на три биовара: gravis, mitisintermedius .
1) ворсинки, фимбрии или пили;
2) колонизация и инвазия (за счет ферментов);
3) корд-фактор (нарушает фосфорилирование процессов дыхания клеток макроорганизма);
4) ведущий фактор – экзотоксин.
Пути передачи – воздушно-капельный, контактно-бытовой.
Возбудитель проникает через слизистые оболочки ротоглотки, реже – глаз, половых органов, кожу, раневую поверхность.
Сам возбудитель остается на месте входных ворот инфекции, а патогенез и клиническая картина определены действием экзотоксина, который оказывает общее и местное действие.
Патоморфологическим проявлением взаимодействия макро– и микроорганизма при дифтерии является фибринозное воспаление.
В выходящем из сосудов экссудате обнаруживается фибриноген, при свертывании которого на поверхности слизистой оболочки образуются серовато-белого цвета пленчатые налеты, плотно спаянные с окружающей тканью. Они тяжело снимаются, при их отрыве обнажается эрозийная поверхность. Разрастание этих пленок приводят к развитию истинного крупа.
Затем в воспалительный процесс вовлекаются:
1) регионарные лимфатические узлы (лимфадениты);
3) сердце (параличу сердечной мышцы);
6) периферическая нервная система – полиневриты, парезы;
7) иммунная система (на 5—7-й дни антитела отсутствуют).
Сила токсина измеряется в DLM.
1 DLM – это минимальное количество токсина, которое при подкожном введении морской свинке весом 250 г вызывает ее гибель на 4—5-е сутки при характерной патолого-анатомической картине.
Дата добавления: 2015-05-30; просмотров: 218; Опубликованный материал нарушает авторские права? | Защита персональных данных |
Автор: Светлана Васильевна
Дифтерийная палочка является аэробом или факультативным анаэробом, температурный оптимум для роста 35—37 °С (границы роста 15—40 °С), оптимальная рН 7,6—7,8. К питательным средам не очень требовательна, но лучше растет на средах, содержащих сыворотку или кровь. Избирательными для дифтерийных бактерий являются свернутые сывороточные среды Ру или Леффлера, рост на них появляется через 8—12 часов в виде выпуклых, величиной с булавочную головку колоний серовато-белого или желтовато-кремового цвета.
Поверхность их гладкая или слегка зернистая, на периферии колонии несколько более прозрачные, чем в центре. Колонии не сливаются, вследствие чего культура приобретает вид шагреневой кожи. На бульоне рост проявляется в виде равномерного помутнения, либо бульон остается прозрачным, а на его поверхности образуется нежная пленка, которая постепенно утолщается, крошится и хлопьями оседает на дно.
Особенностью дифтерийных бактерий является их хороший рост на кровяных и сывороточных средах, содержащих такие концентрации теллурита калия, которые подавляют рост других видов бактерий.
Это связано с тем, что С. diphtheriae восстанавливают теллурит калия до металлического теллура, который, откладываясь в микробных клетках, придает колониям характерный темно-серый или черный цвет. Применение таких сред повышает процент высеваемости дифтерийных бактерий.
С. diphtheriae ферментируют глюкозу, мальтозу, галактозу с образованием кислоты без газа, но не ферментируют (как правило) сахарозу, имеют цистиназу, не имеют уреазы и не образуют индола. По этим признакам они отличаются от тех коринеформных бактерий (дифтероидов), которые чаще других встречаются на слизистой оболочке глаза (С.
xerosus) и носоглотки (С. pseudodiphtheriticum) и от других дифтероидов.
В природе существуют три основных варианта (биотипа) дифтерийной палочки: gravis, intermedins и mitis.
Они различаются по морфологическим, культуральным, биохимическим и другим свойствам. Деление дифтерийных бактерий на биотипы было произведено с учетом того, при каких формах течения дифтерии у больных они выделяются с наибольшей частотой. Тип gravis чаще выделяется от больных с тяжелой формой дифтерии и вызывает групповые вспышки.
Тип mitis вызывает более легкие и спорадические случаи заболеваний, а тип intermedins занимает промежуточное положение между ними.
С. belfanti. ранее относимый к биотипу mitis, выделен в самостоятельный, четвертый, биотип. Его главное отличие от биотипов gravis и mitis — способность восстанавливать нитраты в нитриты.
Штаммы С. belfanti обладают выраженными адгезивными свойствами, и среди них обнаруживаются как токсигенные, так и нетоксигенные варианты.
Как можно получить второе высшее образование по выходным?
Гуманитарно-экономический и Информационно-технологический Институт (geiti.ru) предоставляет такую прекрасную возможность дистанционного обучения и получения диплома гособразца.
Не нашли подходящую информацию? Не беда! Воспользуйтесь поиском на сайте в верхнем правом углу.
источник