Серологический тест, использующийся в диагностике брюшного тифа.
Брюшной тиф — острая циклически протекающая кишечная антропонозная инфекция, вызываемая бактериями Salmonella typhi (Salmonella enterica серотип typhi), с алиментарным путем передачи (фекально-оральный), характеризующаяся лихорадкой, явлениями общей интоксикации с развитием тифозного статуса, розеолезными высыпаниями на коже, гепато- и спленомегалией и специфическим поражением лимфатической системы нижнего отдела тонкой кишки.
Возбудитель — Salmonella enterica серовар Typhi из семейства Enterobacteriaceae рода Salmonella, подвижная грамотрицательная палочка с закругленными концами, хорошо окрашиваемая всеми анилиновыми красителями. Вырабатывает эндотоксин, патогенный только для человека. Не образует споры.
Резервуар и источники возбудителя: человек, больной или носитель (транзиторный, острый или хронический).
Механизм передачи возбудителя фекально-оральный. Путь передачи — преимущественно водный, но возможны пищевой и бытовой пути передачи.
Естественная восприимчивость людей высокая, хотя клинические проявления заболевания могут варьировать от стертых до тяжело протекающих форм. Перенесенное заболевание оставляет стойкий иммунитет.
Инкубационный период — от 7 дней до 23 дней, в среднем 2 нед. Возбудитель — рот — кишечник — пейеровы бляшки и солитарные фолликулы (лимфаденит и лимфангит) — кровяное русло — бактериемия — первые клинические проявления. Циркулирующие в крови микроорганизмы частично погибают — высвобождается эндотоксин, обусловливающий интоксикационный синдром, а при массивной эндотоксемии — инфекционно-токсический шок.
Начальный период (время от момента появления лихорадки до установления ее постоянного типа) — продолжается 4-7 дней и характеризуется нарастающими симптомами интоксикации. Бледность кожи, слабость, головная боль, снижение аппетита, брадикардия. Обложенность языка белым налетом, запоры, метеоризм, поносы.
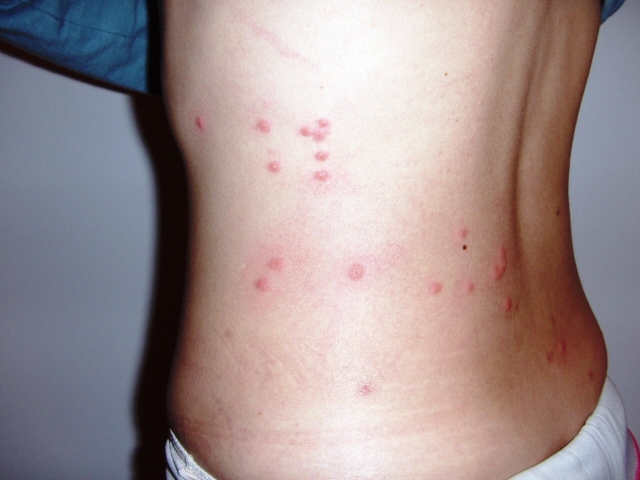
Период разгара — 9-10 дней. Температура тела держится постоянно на высоком уровне. Симптомы интоксикации резко выражены. Больные заторможены, негативны к окружающему. При осмотре на бледном фоне кожи можно обнаружить бледно-розовые единичные элементы сыпи — розеолы, слегка выступающие над поверхностью кожи, исчезающие при надавливании, располагающиеся на коже верхних отделов живота, нижних отделов грудной клетки, боковых поверхностях туловища, сгибательных поверхностях верхних конечностей. Отмечаются глухость тонов сердца, брадикардия, гипотония. Язык обложен коричневатым налетом, с отпечатками зубов по краям. Живот вздут, имеется склонность к запорам. Увеличивается печень и селезенка. Тифозный статус — резкая заторможенность, нарушение сознания, бред, галлюцинации. Другим проявлением тяжести болезни является инфекционно-токсический шок.
Период разрешения болезни. Температура падает критически или ускоренным лизисом, уменьшается интоксикация — появляется аппетит, нормализуется сон, постепенно исчезает слабость, улучшается самочувствие.
В период реконвалесценции у 3-10 % больных может наступить рецидив болезни. Предвестниками рецидива являются субфебрилитет, отсутствие нормализации размеров печени и селезенки, сниженный аппетит, продолжающаяся слабость, недомогание. Рецидив сопровождается теми же клиническими проявлениями, что и основная болезнь, но протекает менее продолжительно.
Брюшной тиф может протекать в легкой, среднетяжелой и тяжелой формах. Выделяют атипичные формы болезни — абортивные и стертые.
В настоящее время в клинической картине брюшного тифа произошли большие изменения. Это связано с повсеместным применением антибиотиков, а также с иммунопрофилактикой. Вследствие этого стали преобладать стертые и абортивные формы заболевания. Лихорадка может длиться до 5-7 дней (иногда 2-3 дня). Чаще встречается острое начало (без продромального периода — в 60-80% случаев). Что касается картины крови, то в 50% случаев сохраняется нормоцитоз, эозинофилы в норме. Серологические реакции на брюшной тиф могут быть отрицательными в течение всей болезни.
Лабораторная диагностика прежде всего заключается в бактериологическом исследовании крови, кала, мочи, желчи. Метод гемокультуры можно использовать с первых дней заболевания и до конца лихорадочного периода, желательно до начала лечения. Для этого 5-10 мл крови из локтевой вены у постели больного засевают на 20 % желчный бульон или среду Рапопорта, мясопептонный бульон с 1 % глюкозы, либо даже в стерильную дистиллированную воду. Объем среды — 50-100 мл. Соотношение материала и среды должно быть 1:10. Кал, мочу, дуоденальное содержимое исследуют со 2-й недели от начала заболевания, засевая на среды Плоскирева, Левина, Мюллера и др. Предварительный результат этих исследований получают через 2 дня, окончательный — через 4 дня.
Для выявления брюшной тифозной палочки в фекалиях, моче, дуоденальном содержимом используют РИФ с меченными сыворотками к О- и Vi-антигенам. Предварительный ответ может быть получен в течение 1 ч, окончательный — через 5-20 ч.
Из серологических методов используют РА (Видаля) и РПГА с цистеином. Реакцию Видаля ставят с Н- и О-антигенами с 7-9-го дня заболевания повторяют на 3-4-й неделе для определения нарастания титра (от 1:200 до 1:400-1:800-1:1600). Последнее имеет значение для исключения положительного результата реакции, который может быть обусловлен предшествовавшей иммунизации против брюшного тифа. Ответ может быть получен через 18-20 ч. При постановке РПГА учет результатов проводят после инкубирования пластин при 37° С в течение 1,5-2 ч и повторно — через 24 ч нахождения при комнатной температуре. Положительный считается реакция в титре 1:40 и выше.
- В комплексе с микробиологическими тестами в целях диагностики брюшного тифа (дифференциальная диагностика гастроэнтеритов у детей; лихорадка неясной этиологии с относительной брадикардией, болезненность живота, потеря аппетита, общее недомогание у взрослых).
- Диспансерное наблюдение пациентов, перенесших брюшной тиф.
- Выявление носителей инфекции, санитарно-эпидемиологические исследования.
Единицы измерения: тест полуколичественный, единицы измерения – титры. При отсутствии антител выдаётся ответ «отрицательно», при их обнаружении – «положительно» с приведением конечного титра.
Диагностические значения титров:
- возраст старше 1 года: с комплексным сальмонеллёзным диагностикумом – 1:200, Vi-диагностикумом – 1:40, О9-диагностикумом — 1:200;
- дети до 1 года: с комплексным сальмонеллёзным диагностикумом – 1:100, Vi-диагностикум – 1:20, О9-диагностикум — 1:100.
Положительно:
- острая инфекция;
- перенесённая в прошлом инфекция;
- хроническое носительство;
- редко – ложноположительные результаты вследствие перекрёстных реакций (в т. ч. другие виды сальмонелл).
Отрицательно:
- отсутствие инфекции;
- ранняя стадия заболевания;
- отдалённые сроки после выздоровления.
источник
«Методические рекомендации по постановке реакции пассивной гемагглютинации с цистеиновой пробой с целью диагностики брюшного тифа, паратифов, других сальмонеллезов и выявления бактерионосителей»
Документ по состоянию на август 2014 г.
Утверждаю
Начальник Главного управления
карантинных инфекций
Министерства здравоохранения СССР
В.П.СЕРГИЕВ
29 февраля 1980 года
Методические рекомендации разработаны в лаборатории брюшного тифа и прочих сальмонеллезов Центрального научно-исследовательского института эпидемиологии Министерства здравоохранения СССР (Ю.Я. Тендетник). Рекомендованы к утверждению Лабораторным советом при Главном санитарно-эпидемиологическом управлении Министерства здравоохранения СССР.
С целью улучшения диагностики брюшного тифа, паратифов и других сальмонеллезов, а также при проведении эпидемиологического анализа и выявлении источников инфекции наряду с бактериологическим методом (который является основным) следует применять серологические исследования и, в частности, выявлять в сыворотке крови антитела к соответствующим возбудителям.
В настоящее время недостаточно ограничиваться определением общего титра антител, поскольку последние неоднородны по своим свойствам и относятся к 5 классам иммуноглобулинов — IgM, IgG, IgA, IgD и IgE. Наибольшее диагностическое значение имеют IgM-антитела (с константой седиментации 19S) и IgG-антитела (с константой седиментации 7S). Нормальные (так называемые неспецифические), анамнестические и прививочные антитела к O-антигенам тифозных, паратифозных и др. сальмонеллезных бактерий принадлежат в основном к IgM-антителам. Эти же антитела появляются первыми на самой ранней стадии заболевания, но к концу первой недели болезни начинают заметно нарастать IgG-антитела. Такая же закономерность отмечается и в отношении образования H-антител, однако их титр достигает максимума позже, чем титр O-антител. При брюшном тифе, кроме O- и H-антител, образуются еще Ви-антитела, основная масса которых в разгар болезни относится к IgG и IgA. У переболевших, не ставших бактерионосителями, уровень как IgG, так и IgM-антител постепенно снижается, но сохраняются в относительно высоком титре в течение нескольких недель, а иногда и больше. При формировании острого и хронического бактерионосительства, как правило, в сыворотках преобладают IgG-антитела, тогда как у транзиторных бактерионосителей определяются практически только IgM-антитела.
Лабораторное оснащение методики. Аппаратура, диагностические препараты, стекло, химические реактивы и др.
1. Термостат любого типа (жидкостный или воздушный) для поддержания температуры 37 +/- 1,0 °C.
2. Баня водяная лабораторная любого типа для поддержания температуры 56 +/- 1 °C.
3. pH — метр любой системы со стеклянными или каломельными электродами для измерения pH раствора в пределах 1 — 10 +/- 0,1 pH.
4. Весы лабораторные с погрешностью взвешивания не более 0,001 г по ГОСТ 19491-74. Удобны весы торзионные типа ВТ-500.
5. Шприц типа «Рекорд» (объем 1 мл) непрерывного действия Ш-19, ТУ-64-1-884-72.
6. Иглы трубчатые инъекционные к шприцу типа «Рекорд» с коротким срезом N 1060, размер 1,0 x 60 мм, или N 1090, размер 1,0 x 90 мм. Допустимо использование игл с отверстием не менее 0,8 мм.
7. Диагностикумы сальмонеллезные «О» эритроцитарные жидкие и сухие, ТУ-42 КВС 14 119-77, Московского научно-исследовательского института эпидемиологии и микробиологии МЗ РСФСР. Допустимо использование аналогичных диагностикумов других институтов.
8. Эритроцитарный Ви-диагностикум, МРТУ 42 N 15-64, Московского научно-исследовательского института эпидемиологии и микробиологии МЗ РСФСР.
9. Н-диагностикумы сальмонеллезные эритроцитарные формализированные, ТУ 42 КВС 89-76, Московского научно-исследовательского института вакцин и сывороток им. Мечникова МЗ СССР или Московского научно-исследовательского института эпидемиологии и микробиологии МЗ РСФСР. В случае отсутствия эритроцитарных Н-диагностикумов допустимо использование сальмонеллезных Н-монодиагностикумов корпускулярных бактериальных, МРТУ 42 N 24-64, Ташкентского научно-исследовательского института вакцин и сывороток или других предприятий.
10. Сыворотки иммунные стандартные с известным титром антител. Приложены к каждой упаковке соответствующего диагностикума.
11. Сыворотка крови нормальная сухая от различных видов лабораторных животных (кролики, крысы, мыши и др.), ТУ 42 КВС 144-78, Московского научно-исследовательского института вакцин и сывороток им. Мечникова МЗ СССР. Допустимо использование любой нормальной сыворотки иного происхождения при условии отсутствия в ней антител к сальмонеллезным О-, Ви- и Н-антигенам в титре 1:100.
12. Планшеты пластмассовые с лунками (для иммунологических реакций) из метаметилкрилата Ленинградского завода «Медполимер», ТУ 64-2-278-79. Допустимо использование других планшетов подобного типа.
13. Пипетки стеклянные мерные на 1, 2, 5 и 10 мл по ГОСТ 20292-74.
14. Пробирки стеклянные биологические 15 x 150 мм по ГОСТ 10515-75. Допустимо использование других пробирок из водостойкого стекла подходящего размера.
15. Пробирки стеклянные, для лекарственных средств 9,5 x 30 мм и 9,5 x 40 мм, ТУ 64-2-182-77. Допустимо использование любых других пробирок или флаконов из водостойкого стекла на 2, 3, 4 и 5 мл.
16. Пробки резиновые конусные N 7, 8, 9, 10, 11, 12, 14 по ГОСТ 7852-76.
17. L-цистеин солянокислый или свободный (ч) ФС-42.1048-76 химико-фармацевтического объединения «Дарница», Киев, Мин. мед. пром. Допустимо использование венгерского L-цистеина. Требования к препарату: содержание золы в виде сульфатов не более 0,2%, аммиака — не более 0,05%.
18. Вода дистиллированная по ГОСТ 6709-72.
19. Натрий хлористый (хч) по ГОСТ 4233-77.
20. Натр едкий очищенный по ГОСТ 11078-78
21. Натрий фосфорнокислый двузамещенный (хч) по ГОСТ 11773-76.
22. Калий фосфорнокислый однозамещенный (хч) по ГОСТ 4198-75.
23. Методы приготовления буферных растворов по ГОСТ 4919.2-77.
24. Бумага индикаторная универсальная для определения pH в пределах 1 — 10, ТУ 61-09 1181-71. Допустимо использование индикаторной бумаги иного типа или измерение pH раствора цистеина с помощью потенциометра.
сывороток некоторыми редуцирующими веществами, и в частности цистеином, тогда как IgM и IgA-антитела инактивируются этими реагентами. Это позволяет с помощью цистеина определить удельное содержание в сыворотке IgG-антител. Рекомендуется использовать L-цистеин как солянокислый, так и «свободный» (ч). Для обработки сывороток готовят ex tempore раствор солянокислого или «свободного» цистеина (15 мг на 1 мл растворителя). При этом солянокислый цистеин растворяют в 0,1 N растворе едкого натра с таким расчетом, чтобы pH готового раствора был равен 7,0 — 7,2. «Свободный» цистеин сначала растворяют в половинном количестве 0,85% раствора хлористого натрия, затем доводят pH до 7,0 — 7,2 0,1 N раствором едкого натра и вновь доливают до нужного объема 0,85% раствором хлористого натрия, так как «свободный» цистеин значительно слабее, чем солянокислый сдвигает pH раствора в кислую сторону. Раствор цистеина может храниться не более 30 — 60 мин., поэтому сначала следует приготовить необходимые разведения сывороток.
Исследуемую сыворотку в разведении 1:5 смешивают с равным объемом раствора цистеина. Объем исследуемой сыворотки и раствора цистеина рассчитывают исходя из числа диагностикумов. Для титрования сыворотки могут использоваться коммерческие эритроцитарные сальмонеллезные О-диагностикумы основных серологических групп (A, B, C1, C2, D и E), комплексный (поливалентный) О-диагностикум, включающий рецепторы антигенов указанных групп (1, 2, 4, 5, 6, 7, 8, 9, 12, 3, 10), эритроцитарный Ви-диагностикум и сальмонеллезные эритроцитарные Н-диагностикумы. Применяются также бактериальные Н-диагностикумы в реакции агглютинации. При постановке реакции с одним диагностикумом требуется 0,2 мл цельной сыворотки (0,1 мл для обработки цистеином и еще 0,1 мл для титрования без цистеина). Если нужно протитровать IgG и суммарные антитела к 5 — 6 диагностикумам, достаточно 0,6 мл цельной сыворотки.
Смесь сыворотки с раствором цистеина помещают в пробирки объемом на 2 и 3 мл или такого же объема флакончики и плотно закрывают их резиновыми пробками (лейкопластырем). Объем пробирок (флаконов) должен быть таким, чтобы между содержимым и пробиркой оставалось минимальное (не более 0,2 мл) свободное пространство во избежание инактивации цистеина кислородом воздуха. Пробирки с сыворотками, обработанными цистеином, выдерживают в течение 18 — 20 часов в термостате при 37 °C. В таких же условиях выдерживается вторая часть исследуемой сыворотки без цистеина, разведенная 1:10 0,85% раствором хлористого натрия. На следующий день обе части сыворотки титруют, начиная с разведения 1:20, одними и теми же диагностикумами.
При титровании большого числа сывороток целесообразно использовать пластмассовые планшеты с лунками и шприц непрерывного действия типа «Рекорд», марки Ш-19, в комплект которого входит тройник с клапанами, резиновый шланг с оливой и пружина. Шприц типа «Рекорд» на 1 мл снабжают самодельным ограничителем (отрезок металлической или твердой пластмассовой трубки), надетым на стержень между поршнем и крышкой шприца. Длина ограничителя подбирается с таким расчетом, чтобы в шприц набирался нужный объем жидкости (0,5 мл или 0,25 мл и т.п.). Приложенную к комплекту Ш-19 пружину делят на 2 половины и одну часть надевают на стержень между крышкой шприца и головкой стержня. Один конец шланга с оливой помещается в сосуд с раствором для титрования, а другой подсоединяется к тройнику (марка А), надетому на шприц.
Каждое нажатие пальцем на головку поршня до упора позволяет внести 0,5 мл раствора в лунку, после чего пружина отводит поршень в исходное положение и шприц вновь заполняется 0,5 мл раствора. В первые лунки каждого ряда вносят по 0,5 мл исследуемых сывороток, обработанных и не обработанных цистеином (в разведении 1:10), и тем же шприцем (с ограничителем на 0,5 мл), на головку которого вместо тройника надета изогнутая игла с отверстием диаметром примерно 0,8 — 1,0 мм, перемешивают 3 раза содержимое первой лунки и переносят 0,5 мл во вторую лунку, а из второй после трехкратного перемешивания — в третью и т.д. Из последней лунки 0,5 мл содержимого выливают и тщательно (не менее 4 — 5 раз) промывают шприц чистым 0,85% раствором хлористого натрия. Таким образом последовательно разводят до предполагаемого титра исследуемые сыворотки и во все лунки вносят необходимое количество диагностикума (согласно соответствующему наставлению). При отсутствии указанного шприца и пластмассовых планшетов с лунками можно пользоваться мерными пипетками и биологическими пробирками.
В качестве основы для титрования сывороток, обработанных цистеином, необходимо использовать забуференный 0,85% раствор хлористого натрия (фосфатный буфер, pH 7,0 — 7,2), однако предпочтительнее готовить 0,85% раствор хлористого натрия на нормальной, прогретой при 56 °C в течение 30 минут сыворотке (кроличьей, лошадиной, крупного рогатого скота). Нормальную сыворотку добавляют из расчета 1 мл на 100 мл 0,85% раствора хлористого натрия (pH 7,0 — 7,2) при условии: в принятом разведении нормальной сыворотки отсутствуют антитела к применяемым диагостикумам, что проверяют предварительно для каждой новой серии нормальной сыворотки. Стабильность используемых диагностикумов периодически (1 раз в 2 — 3 месяца) проверяют титрованием одной серии иммунной сыворотки с известным титром. Такая сыворотка в лиофилизированном состоянии прилагается к диагностикуму и служит рабочим стандартом. Каждый опыт должен сопровождаться контролем диагностикума в растворе для титрования.
После внесения диагностикума пластинки или пробирки осторожно встряхивают для равномерного перемешивания содержимого и помещают либо в термостат при 37 °C на 3 часа, либо оставляют на 18 — 20 часов при комнатной температуре.
Реакция гемагглютинации считается положительной в том случае, если эритроциты полностью агглютинировались и расположены равномерно по дну лунки либо при почти полной агглютинации небольшая часть эритроцитов оседает в центре лунки в виде ровного колечка или пуговки. Иногда при положительной реакции края агглютината в лунках могут слегка сползать и он принимает вид «зонтика». При отрицательном результате агглютинанта нет, все эритроциты оседают на дне в центре в виде пуговки или ровного колечка.
В современных условиях при относительно частом контакте организма человека с сальмонеллами и некоторыми другими бактериями семейства кишечных, а также с их антигенами нарастание IgM и IgG-антител у многих заболевших происходит быстро — по типу вторичного иммунного ответа. Это особенно характерно для взрослых. Поэтому первое взятие сыворотки с целью диагностики заболевания необходимо проводить немедленно после поступления больного в стационар, а второй раз сыворотку можно брать в конце первой — начале второй недели болезни при подозрении на сальмонеллез и в конце второй недели — при подозрении на брюшной тиф и паратифы. Целесообразно исследовать сыворотку и в периоде реконвалесценции, если результаты бактериологического обследования больного оказались отрицательными. При таком подходе к серологическому исследованию, как правило, удается выявить достоверное нарастание титра суммарных антител, т.е. цистеиночувствительные + цистеиноустойчивые, и установить характерную для заболеваний путем обработки сывороток цистеином. Именно эти показатели должны быть основными при постановке серологического диагноза заболевания. Понимание «диагностического» титра антител (особенно суммарных) является весьма условным. Так называемый «диагностический» титр может быть обусловлен профилактической вакцинацией, перенесенным в прошлом (от нескольких месяцев до 3-х лет) заболеванием в стертой или субклинической форме или встречей с антигенами (которые могут попадать в организм с загрязненной пищей или водой), даже подвергшимися термической обработке, поскольку некоторые соматические антигены термоустойчивы. Следует учитывать также и то, что для разных районов страны (в связи с особенностями эпидемической ситуации и др.) величина «диагностического» титра будет различной. Она устанавливается эмпирически в результате титрования сывороток от 100 — 200 здоровых лиц. Большое значение имеет условно-диагностический титр IgG-антител, т.к. их наличие свидетельствует о значительном специфическом антигенном стимуле.
При подозрении на тиф и паратифы сыворотки следует титровать с помощью О-диагностикумов серогрупп А, В и Д, а также Н-диагностикумов 1 фазы a, b, d и Ви-диагностикума. Если выявляется четкое нарастание (в 4 раза и более) титра суммарных антител к определенным антигенам и особенно увеличение уровня IgG-антител, устойчивых к цистеину, то это дает веские основания для подтверждения клинического диагноза. Необходимо при этом учитывать, что при паратифе А титры О-антител на протяжении заболевания бывают более низкими, чем при брюшном тифе и паратифе В. В случае позднего поступления больного в стационар (в разгаре болезни) условно-диагностическим титром суммарных О-антител следует считать положительный результат в разведении не ниже 1:640. Минимальным условно-диагностическим титром IgG О- и Н-антител считается разведение 1:80, а для Ви-антител — 1:40 (при паратифе А «диагностические» титры могут быть в 2 раза ниже).
В такой ситуации при отсутствии бактериологического подтверждения рекомендуется исследовать сыворотку в периоде поздней реконвалесценции, чтобы уловить снижение общего титра антител и уменьшение удельного содержания цистеиноустойчивых IgG-антител, что также может служить определенным основанием для постановки диагноза.
При подозрении на сальмонеллез сыворотки вначале титруют с комплексным диагностикумом без цистеина. Если будет выявлено нарастание уровня антител или титр окажется достаточно высоким (не ниже 1:320), то следует перетитровать сыворотки в РПГА с цистеином со всеми групповыми О-диагностикумами (при отрицательном результате бактериологического обследования). Это необходимо не только для уточнения этиологии заболевания, но и потому что РПГА с комплексным диагностикумом недостаточно специфична. При сальмонеллезах и особенно пищевых токсикоинфекциях сальмонеллезной этиологии уже в конце первой недели в сыворотке обычно определяется довольно высокоудельное содержание IgG-антител. Поэтому при обработке такой сыворотки цистеином титр может снижаться не очень резко.
Реакция пассивной гемагглютинации с цистеином может оказаться полезной для постановки правильного диагноза в случаях смешанной инфекции или при выделении двух или нескольких видов возбудителей, этиологическая роль каждого из которых не ясна. При истинной микст-инфекции антитела и особенно цистеиноустойчивые будут нарастать к каждому возбудителю. Если же к какому-то микробу нарастание антител, и в том числе IgG, не будет выявлено, то можно предполагать, что выделение этого микроба носит случайный, транзиторный характер. Транзиторное носительство сальмонелл нередко имеет место у взрослых, т.к. они значительно более устойчивы к заражению, чем дети.
РПГА с цистеином можно использовать с целью установления ретроспективного диагноза, т.к. у переболевших даже субклинической формой заболевания в течение 1 — 2 месяцев в большинстве случаев сохраняется повышенный титр суммарных IgG-антител к соответствующему антигену.
В случае формирования острого и особенно хронического бактерионосительства происходит выраженное нарастание IgG-антител и при этом основное значение имеет не абсолютный титр антител, а удельное содержание в сыворотке цистеиноустойчивых антител. Если обработка цистеином не снижает титр либо снижает его только на одно, максимум два разведения, то это говорит о значительном содержании в сыворотке IgG-антител и у такого человека следует заподозрить острое или хроническое бактерионосительство. Необходимо отметить, что при длительном бактерионосительстве титр О-антител может быть низким (иногда 1:20 — 1:40), но эти антитела практически целиком определяются IgG-антителами. В то же время у хронических носителей тифозных бактерий определяется также сравнительно высокий уровень (в большинстве случаев выше 1:80) Ви-антител, который при обработке цистеином.
Отмеченная закономерность может нарушаться у хронических носителей тифозных бактерий, инвазированных онисторхами. В сыворотках у значительного процента таких лиц относительно невелико удельное содержание IgG О-антител, однако выявляются высокие титры IgG Ви-антител. Это необходимо принимать во внимание при обследовании на бактерионосительство различных контингентов населения, главным образом, на некоторых территориях Обь-Иртышского бассейна, где описторхоз встречается в качестве краевой патологии.
У транзиторных бактерионосителей при относительно невысоком титре антител все они, как правило, принадлежат к IgM и полностью инактивируются цистеином. Если этого не наблюдается и в сыворотке остаются антитела (выше 1:20) после обработки ее цистеином, то у такого лица можно предполагать наличие либо субклинической формы инфекции, либо продолжающееся бактерионосительство. Некоторое повышение уровня IgG-антител может происходить в результате многократной специфической вакцинации, поэтому при анализе результатов реакции следует учитывать прививочный анамнез.
Постановка РПГА с цистеиновой пробой может быть использована с целью контроля возможного прекращения бактерионосительства. Известно, что у бактерионосителей выделение возбудителей может происходить не постоянно, а с более или менее длительными перерывами. У такого лица серологические показатели будут характерными для длительного бактерионосителя. Если же на фоне прекратившегося бактериовыделения значительно снизится титр антител и особенно цистеиноустойчивых IgG, то можно предположить об освобождении организма от возбудителя. Освобождение от бактерионосительства чаще наблюдается при сальмонеллезах, реже — при брюшном тифе.
источник
Брюшной тиф диагностируют на основании длительной лихорадки, головной боли, нарастающей интоксикации с развитием тифозного статуса, типичных изменений языка, появления метеоризма, розеолёзной сыпи, гепатоспленомегалии и изменений периферической крови.
Лабораторная диагностика брюшного тифа основана на обнаружении возбудителя в биоматериале и специфических антител в крови больного. Решающее значение имеет обнаружение возбудителя в крови (гемокультура), моче (уринокультура), испражнениях (копрокультура), жёлчи (биликультура), а также в костном мозге, спинномозговой жидкости, розеолах, гное или экссудате.
В практической работе для ранней диагностики брюшного тифа наибольшее значение имеет гемокультура, которую следует проводить на протяжении всего лихорадочного периода. Кровь из вены в количестве 5-10 мл засевают во флакон с 50-100 мл 10-20% жёлчного бульона (лучшие результаты даёт посев в трипсин-соевый бульон). Положительные результаты гемокультуры чаще получают при посевах крови на первой неделе заболевания, когда бактериемия наиболее выражена. Со второй недели болезни брюшнотифозные палочки можно обнаружить в посевах кала, мочи и дуоденального содержимого. Наиболее высокий процент выделения палочек брюшного тифа получают при посевах костного мозга. В целом бактериологическое подтверждение диагноза брюшного тифа удаётся получить у 80-90% больных.
Серологические методы позволяют обнаружить специфические антитела в крови или антигены в биосубстрате. В практической работе чаще всего применяют реакцию Видаля и РНГА (реакция непрямой гемагглютинации) с использованием эритроцитарных О-, Н- и Vi-антигенов. Реакция Видаля основана на обнаружении специфических О- и Н-антител-агглютининов в крови больного с помощью соответствующих антигенов. Положительные результаты можно получить с 8-9 сут болезни. Реакция Видаля может быть положительной у привитых и перенёсших брюшной тиф, поэтому решающее значение имеет нарастание титра антител в динамике заболевания. Для более точного выявления специфических иммунных сдвигов в крови больного реакцию Видаля следует повторять с О- (IX и XII) и Н-монодиагностикумами для исключения перекрёстных реакций с сальмонеллами других групп.
Более специфичны и чувствительны РНГА с эритроцитарными О- и Vi-антигенами и реакция Vi-гемагглютинации. Эти реакции используют для ранней диагностики брюшного тифа. В РНГА концентрация О-антител нарастает в динамике заболевания, а титры Vi-антител существенно не меняются. Реакция Vi-гемагглютинации имеет наибольшее значение при обследовании лиц, подозрительных на брюшнотифозное носительство.
Серологические реакции на обнаружение специфических антител в крови больного следует ставить с 4-5-го дня болезни, а затем на 2-3-й нед и позднее. Диагноз брюшного тифа считают серологически подтверждённым при титре антител 1:200 и выше или при нарастании титра антител в 2-3 раза в динамике заболевания. При оценке серологических реакций важно учитывать, что нарастание титров специфических О-антител свидетельствует об остром инфекционном процессе, а наличие только Н- или Vi-антител — о перенесённом ранее брюшном тифе или бактерионосительстве.
Для серологической диагностики бактерионосительства и вакцинальных реакций предложено раздельное определение специфических антител, относящихся к IgM и IgG в ИФА. Выявление специфических брюшнотифозных IgM указывает на текущий инфекционный процесс, а изолированное обнаружение специфических антител, относящихся к классу IgG, — о вакцинальной природе антител или перенесённом ранее брюшном тифе.
Дифференциальная диагностика брюшного тифа
В практической работе брюшной тиф у детей чаще приходится дифференцировать с тифоподобной формой сальмонеллёза, паратифами, инфекционным мононуклеозом, лимфогранулематозом, иерсиниозом, малярией, а в начальном периоде — с гриппом, энтеровирусной инфекцией и острой кишечной инфекцией другой этиологии.

источник
Диагностический серологический анализ по выявлению в сыворотке крови антител к Vi-антигенам возбудителя брюшного тифа предназначен для подтверждения либо отрицания факта носительства.
| Сроки выполнения | 7-8 дней |
| Синонимы (rus) | Серологический анализ на Vi-антитела возбудителя брюшного тифа в сыворотке крови |
| Cинонимы (eng) | Indirect hemagglutination assay for Salmonella typhi Vi antibodies |
| Метод анализа | Реакция непрямой гемагглютинации (РНГА) |
| Подготовка к исследованию | Анализ проводится утром, натощак. С последнего приема пищи должно пройти не менее 8 часов. |
| Исключить прием алкоголя не менее чем за 24 часа до взятия биоматериала. | |
| Не рекомендуется сдавать кровь на серологию после флюорографии, рентгена, физиотерапевтических процедур. | |
| Биоматериал и способы его взятия | Венозная кровь |
Брюшной тиф относится к острым инфекционным кишечным заболеваниям. Для него характерны циклическое течение с системным поражением органов кишечника, ЦНС, печени, лимфатической системы; общая интоксикация организма, устойчивая бактериемия, при которой в крови обнаруживается присутствие бактерий. Источником инфекции являются больные, переболевшие бактерионосители.
Возбудитель брюшного тифа — сальмонелла Salmonella typhi, относится к кишечным бактериям.
Антигенная система возбудителя представлена антигенами O, H, Vi.
Антиген Vi является антигеном вирулентности, формирующим устойчивость возбудителя брюшнотифозной сальмонеллы к защитным реакциям организма. Наличие антител к Vi-антигенам Salmonella typhi при проведении серологического исследования образцов крови служит маркером бактерионосительства.
Выявление антител к эритроцитарным Vi-антигенам осуществляют с помощью серологической реакции непрямой гемагглютинации, РНГА , с применением специальных диагностикумов.
Метод РНГА:
- основан на способности взаимодействия антител сыворотки крови и антигенов, которые фиксированы на эритроцитах (эритроцитарный диагностикум); результатом реакции является агрегация эритроцитов с последующим осаждением, агглютинация;
- по характеру осадка эритроцитов судят о наличии антител (характерный «зонтик»), либо об их отсутствии (осадок в виде «точки»);
- является полуколичественным; для проведения реакции используют разведения сыворотки крови для выявления диагностического титра;
- минимальным диагностическим титром при проведении реакции является показатель 1:40;
- повышение диагностической ценности реакции наблюдается при использовании повторного анализа (метод парных сывороток);
- реакция высокочувствительна и специфична, может быть использована на пятый-седьмой дни заболевания.
Результаты анализа могут быть положительными или отрицательными.
Положительный ответ:
- выявление в крови антител к Vi-антигенам брюшнотифозного возбудителя (минимальное значение диагностического титра 1:40) рассматривается как указание на факт бактерионосительства и на необходимость повторного тестирования;
- в ответе фиксируется значение титра;
- может свидетельствовать о протекании острой инфекции, о перенесенном в прошлом заболевании, о проведенной вакцинации;
- в редких случаях может быть ложноположительным вследствие перекрестной реакции.
Отрицательный ответ выдается в случае, если антитела не выявлены. Подобная ситуация возможна как при отсутствии инфицирования брюшнотифозным возбудителем, так и на ранних сроках заболевания.
Проведение данного исследования имеет особую важность для предотвращения случаев распространения брюшного тифа бактерионосителями.
анализы Вопрос: Доктор назначила ребенку: 1. Анализ крови на органические и аминокислоты методом тандемной масспектрометрии 2. Анализ мочи на органические и аминокислоты методом газовой спектрометрии (разовая порция). Мы можем сделать такие анализы в вашей лаборатории в Адлере? стоимость и сроки, а так же как подготовиться к анализу написшите, пожалуйста.
Ответ: Здравствуйте! Да, Вы можете сдать кровь и мочу на исследование в Адлере. Комплексное определение концентрации ненасыщенных жирных кислот семейства Омега-6 в крови методом тандемной масс-спектрометрии — 8250 руб. Срок выполнения до 10 рабочих дней. Комплексное определение концентрации на аминокислоты в крови (32 показателя) — 8140 руб., 10 р.дней., Комплексное определение содержания органических кислот в моче — 5000 руб., 10 р. дней. Сдавать утром после 8 часового ночного голодания.
Какой анализ крови нужно сдать Вопрос: Добрый день,хотел бы у вас уточнить один вопрос.Был на приеме у невролога, т.к. в последнее время немеет лобная часть головы,он установил диагноз,прописал лекарства и сказал,что надо бы сделать общий анализ крови для проверки.Какой-то отдельный анализ крови надо еще делать или хватит только общего?
Ответ: Здравствуйте! Если доктор Вам назначил общий анализ крови, значит его следует выполнить. Общий клинический анализ крови является комплексным исследованием, который поможет врачу провести скрининг. Данный анализ отражает текущее состояние человека и дает такие показатели крови, как эритроциты, гемоглобин, лейкоциты, лейкоцитарная формула и еще до 18 показателей.
источник
Возбудитель — Salmonella typhi, грамотрицательная подвижная палочка рода Salmonella семейства Enterobacteriaceae. Бактерии неприхотливы и растут на обычных питательных средах. У S. typhi выделяют термостабильный соматический О-Аг, термолабильный жгутиковый Н-Аг, термолабильный соматический Vi-Aг и др. Бактерии экзотоксинов не образуют. При разрушении микроорганизмов высвобождается эндотоксин, играющий основную роль в патогенезе заболевания. В определённой степени патогенность брюшнотифозных бактерий также определяют «ферменты агрессии» — гиалуронидаза, фибринолизин, лецитиназа, гемолизин, каталаза и др. По чувствительности к типовым бактериофагам выделяют более 100 стабильных фаговаров. Определение фаговара возбудителя — удобный маркёр для выявления эпидемиологических связей между отдельными заболеваниями, выяснения источника и путей передачи возбудителя. В неблагоприятных условиях, например в иммунном организме, бактерии переходят в L-формы. Бактерии умеренно устойчивы во внешней среде — в почве и воде могут сохраняться до 1-5 мес, в испражнениях — до 25 дней, на белье — до 2 нед, на пищевых продуктах — от нескольких дней до недель. Несколько дольше сохраняются в молоке, мясном фарше, овощных салатах, где при температуре выше 18 «С способны размножаться. При нагревании возбудитель быстро погибает, дезинфицирующие растворы в обычных концентрациях действуют на него губительно.
Резервуар и источник инфекции — человек (больной или бактериовыделитель). Опасность больного для окружающих в разные периоды болезни неодинакова. В инкубационном периоде заражённый человек практически не опасен. Опасность больного для окружающих увеличивается по мере развития болезни и достигает максимума на 2-3-й неделе болезни — в период выделения бактерий с испражнениями, мочой и потом; также их можно обнаружить в грудном молоке и носоглотке. Большая часть переболевших освобождается от возбудителя в первые 1 2 нед или в ближайшие 2-3 мес реконвалесценции. Примерно 3-5% остаются носителями на длительный срок, а некоторые — на всю жизнь. Эпидемиологическая опасность хронического носителя определяется его профессией и зависит от соблюдения им правил личной гигиены. Особую опасность представляют носители, имеющие доступ к приготовлению, хранению и реализации пищевых продуктов.
Механизм передачи фекально-оральный, реализуется водным, пищевым и бытовым путями; в районах с повышенным уровнем заболеваемости распространение идёт преимущественно водным путём. Последнее происходит за счёт использования воды, взятой из загрязнённых открытых или технических водоёмов, а также из-за неудовлетворительного санитарно-технического состояния водопроводных и канализационных сооружений. В результате употребления заражённой воды возникают острые и хронические водные вспышки, способные длительно продолжаться и охватывать большие группы населения. К возникновению водных вспышек приводят аварии на водопроводных сетях и сооружениях, перепады давления и нерегулярность подачи воды, сопровождающиеся подсосом инфицированных грунтовых вод через негерметичные отрезки сетей. Из пищевых продуктов наиболее опасны молоко и молочные изделия, кремы, салаты и другие продукты, служащие благоприятной средой для размножения бактерий. Иногда заражение может произойти и через овощи, особенно при их поливе сточными водами или удобрении фекалиями. Бытовой путь передачи возможен при низкой культуре бактерионосителей или больных со стёртой формой болезни. При этом происходит заражение окружающих предметов, а в последующем — заражение пищи.
Дифференциальная диагностика
Брюшной тиф необходимо дифференцировать от заболеваний, сопровождающихся длительной лихорадкой и развитием признаков интоксикации, — сыпного тифа, малярии, бруцеллёза, пневмонии, сепсиса, туберкулёза, лимфогранулематоза и др. В клинической дифференциальной диагностике брюшного тифа следует опираться на такие симптомы, как высокая длительная лихорадка, бледность кожных покровов лица, болезненность и урчание при пальпации в правой подвздошной области, гепатолиенальныи синдром, брадикардию, увеличение в размерах языка, обложенного по центру, появление на 8-9-й день болезни скудной розеолёзной сыпи на животе и нижней части груди, при более тяжёлом течении — развитие тифозного статуса. Постановка правильного диагноза вызывает значительные трудности, особенно при атипичных формах брюшного тифа. Поэтому каждый случай неясной лихорадки длительностью более 3 дней требует проведения соответствующих лабораторных исследований, в том числе выделения возбудителя из крови и фекалий, определения антигенов возбудителя в сыворотке крови и испражнениях. Получение брюшнотифозной гемокультуры — абсолютное подтверждение диагноза брюшного тифа. Обнаружение брюшнотифозных палочек в каловых массах менее информативно.
Лабораторная диагностика
На высоте интоксикации у больных брюшным тифом изменения гемограммы характеризуются лейкопенией, анэозинофилией, относительным лимфоцитозом и умеренным повышением скорости оседания эритроцитов (СОЭ). На первых этапах болезни также можно наблюдать умеренный лейкоцитоз со сдвигом лейкоцитарной формулы влево. В анализе мочи можно обнаружить белок и увеличение количества эритроцитов, а также цилиндры.
Наиболее достоверный метод диагностики брюшного тифа — выделение возбудителя. Для этого проводят посев 10 мл крови на 100 мл среды, содержащей жёлчь (10-20% жёлчный бульон, среда Раппопорта). Выделение гемокультуры наиболее эффективно в первую неделю болезни, однако с диагностической целью исследование проводят во все периоды температурной реакции. Посевы испражнений (копрокультуру) и мочи (уринокультуру) также проводят во все периоды заболевания, особенно на 2-3-й неделе. Вместе с тем необходимо помнить, что брюшнотифозную палочку из кала и мочи можно выделить не только у больных брюшным тифом, но и от бактерионосителей при различных лихорадочных состояниях. Посевы испражнений и мочи выполняют на плотные питательные среды. Помимо бактериологических исследований уже с первых дней болезни можно выявить брюшнотифозный О-Аг в испражнениях или сыворотке крови в РКА, РЛА, а также методами иммунофлюоресцентной микроскопии и ИФА.
Серологическую диагностику (РНГА в парных сыворотках с эритроцитарным брюшнотифозным О-диагностикумом) проводят с конца первой недели заболевания, однако минимальный диагностический титр AT (1:200) впервые можно выявить и в более поздние сроки заболевания (на 3-й неделе болезни). РНГА с эритроцитарным брюшнотифозным Vi-диагностикумом у больных брюшным тифом имеет вспомогательное значение (минимальный диагностический титр 1:40). Чаще эту реакцию используют для отбора лиц, подозрительных на бактерионосительство. При титрах AT 1:80 и выше этим лицам проводят многократное бактериологическое исследование. В настоящее время наибольшее распространение получила РПГА, которая бывает положительной уже на 4-5-й день болезни.
источник
Используют бактериологический и серологические методы, которые проводят с учетом периода инфекционного процесса.
Материалом для выделения являются кровь (гемокультура), испражнения (копрокультура), моча (уринокультура), дуоденальное содержимое, желчь (биликультура), соскоб розеол, костный мозг.
В бактериологическом исследовании ранним методом является выделение возбудителя из крови (гемокультура) в период бактериемии (первая неделя заболевания).
Кровь засевают в желчный бульон или среду Рапопорт в соотношении 1:10 (чтобы уменьшить бактерицидные свойства белков крови). На 2-й день проводят пересев на среду Эндо или Левина, или висмут-сульфит агар. Подозрительные (прозрачные или черные в зависимости от сред) колонии пересевают на скошенный агар или одну из комбинированных сред (Олькеницкого, Ресселя, Клиглера). На этих средах для первичной идентификации определяют ферментацию глюкозы, способность к газообразованию, выделение сероводорода, отсутствие уреазы.
Одновременно изучают морфологию и тинкториальные свойства.
Определяют биохимические свойства. Бактерии тифо-паратифозной группы не разлагают сахарозу, лактозу, не образуют индол.
При выделении культур, имеющих характерные для сальмонелл ферментативные свойства, изучают их антигенную структуру в реакции агглютинации на стекле с О- и Н-диагностическими антисыворотками, определяют чувствительность к антибиотикам, проводят фаготипирование.
Для серологической диагностики брюшного тифа и паратифов с 5-7 дня заболевания в основном используется РПГА с О- и Н-эритроцитарными диагностикумами. Положительной считается реакция в титре 1:160 и выше. При исследовании в РПГА титр антител в динамике заболевания нарастает.
Возможно применение реакции агглютинации Видаля с О- и Н-монодиагностикумами к конкретным возбудителям (положительный титр реакции – 1:200 и выше). Серологический диагноз имеет ретроспективный характер.
Для выявления бактерионосителей используют РПГА с эритроцитарным Vi-диагностикумом (титр реакции – 1:40). Исследуют били- и копрокультуру. Проводят фаготипирование с Vi-1 антигеном.
При эпидемических вспышках брюшного тифа для экспресс-диагностики с целью выявления АГ в крови, костном мозге и другом материале применяют РИФ и ИФА.
Лечение брюшного тифа
Этиотропную терапию проводят сразу после установления клинического диагноза. Для лечения используют фторхинолоны. При устойчивости к ним применяют цефалоспорины III поколения, азитромицин.
Левомицетин и ко-тримоксазол в настоящее время используют реже из-за распространения полирезистентных штаммов. Патогенетическое лечение включает инфузионно-дезинтоксикационную терапию.
Профилактика
Проводятся санитарно-гигиенические и противоэпидемические мероприятия, направленные на обезвреживание источников инфекции, пресечение путей передачи, повышение невосприимчивости организма.
Для специфической иммунопрофилактики брюшного тифа разработано 3 типа вакцин. Применяют инактивированные вакцины (эффективность 50-70%), разработана живая аттенуированная вакцина из штамма Ту21а (оказывает большее протективное действие, находится на стадии клинических испытаний). Эффективной является полисахаридная вакцина из Vi-антигена S. typhi(например, Вианвак пр-ва Российской Федерации), применяется по эпидпоказаниям, протективный эффект сохраняется до 2-х лет.
Сальмонеллезы
Сальмонеллезы – группа полиэтиологичных острых инфекционных болезней человека, животных и птиц, характеризующаяся преимущественным поражением желудочно-кишечного тракта, диареей и бактериемией.
Наиболее частой клинической формой сальмонеллезной инфекции является сальмонеллезный гастроэнтерит. Основные возбудители гастроэнтерита: S. Enteritidis, S .Choleraesuis, S .Anatum, S .Derby, хотя заболевания могут вызываться и многими другими вариантами бактерий.
Значительно более тяжелой формой является генерализованная сальмонеллезная инфекция – септицемия. Ее ведущим возбудителем является S. Typhimurium.
Большинство возбудителей выделяют у различных животных (основной резервуар) и человека.
Источником заражения человека чаще всего являются домашние птицы (50%), особенно куры и утки, а также их яйца (сальмонеллы могут проникать через скорлупу внутрь). Носительство сальмонелл выявлено у домашнего скота, собак, кошек, грызунов, у многих диких животных и птиц. Инфицированные животные выделяют бактерии с мочой и калом, молоком, слюной, загрязняя окружающую среду.
Основной путь передачи сальмонелл – пищевой. Заболевания возникают у человека в связи с употреблением мясных продуктов (говядина, свинина – до 20% случаев, мясо птицы), яиц, реже – рыбы, овощей, фруктов, моллюсков, раков, крабов.
Мясо может инфицироваться эндогенно при жизни животного во время его болезни, а также экзогенно в процессе транспортировки, переработки, хранения. Иногда продукты питания инфицируются при неправильной их кулинарной обработке, приготовлении пищи.
При несоблюдении санитарно-гигиенических норм может возникнуть контактно-бытовой путь передачи, который характерен для внутрибольничных вспышек сальмонеллеза. Такие вспышки отмечены в родовспомогательных учреждениях, хирургических, детских и других стационарах. При госпитальных сальмонеллезах чаще выделяется S. typhimurium иS. Haifa. В Республике Беларусь сальмонеллезные инфекции составляют более 50% от всех случаев госпитальных инфекций
Возбудители госпитальных сальмонеллезов отличаются высокой полирезистентностью к химиотерапевтическим препаратам и антибиотикам.
Наиболее восприимчивы к сальмонеллезу дети в возрасте до 1 года и лица с различными иммунодефицитами.
Инкубационный период болезни – от 2-6 часов до 2-3 суток (в среднем составляет 7-24 часа).
Патогенез сальмонеллезов определяется факторами вирулентности возбудителей. Среди них наиболее важную роль играют инвазивные белки III типа секреции.
Некоторые из белков инвазии обеспечивают проникновение сальмонелл внутрь эпителиальных клеток кишечника, их выживание внутри вакуолей. Кроме того, они стимулируют выброс провоспалительных цитокинов и хемокинов из пораженных клеток, апоптоз макрофагов.
Внутри макрофагов бактерии не только размножаются, но и частично погибают с освобождением эндотоксина, поражающего нервно-сосудистый аппарат кишечника и повышающего проницаемость клеточных мембран.
В течение 1 часа от проникновения сальмонелл внутрь клеток развивается выраженная нейтрофильная инфильтрация стенки кишечника. Кишечное воспаление сопровождается выходом белка из пораженных энтероцитов, усилением секреции хлоридов с развитием профузной диареи.
Часть сальмонелл может продуцировать энтеротоксин, который через повышение содержания цАМФ в энтероцитах стимулирует экскрецию хлоридов, что усугубляет диарею.
В большинстве случаев на этой стадии инфекционный процесс может завершиться (гастроинтестинальная форма).
В тяжелых случаях возникает бактериемия и генерализация инфекции, что приводит к септицемии.
Эта форма сальмонеллеза наиболее характерна для S. Typhimurium и S. Enteritidis. Ее развитие обусловлено белками вирулентности, которые кодируются островом патогенности SPI-2. Данные белки подавляют фагоцитоз, что обеспечивает выживание и размножение бактерий внутри фагоцитов, их проникновение в кровь и паренхиматозные органы.
В результате сальмонеллы могут вызывать дистрофические изменения в пораженных органах (селезенка, печень) с формированием вторичных гнойных очагов.
Обычно болезнь заканчивается выздоровлением, однако септические формы инфекции могут приводить у летальным исходам.
Постинфекционный иммунитет непродолжительный, нестойкий, типоспецифический. В сыворотке больных и реконвалесцентов обнаруживаются агглютинины, преципитины, бактериолизины и другие антитела. Заболевание, вызванное одним сероваром, не создает иммунитета к другим, а перенесенная инфекция не исключает реинфекцию.
Дата добавления: 2015-11-05 ; просмотров: 3296 | Нарушение авторских прав
источник
Диагностика брюшного тифа основывается на характерных особенностях клинической картины (особенно начала болезни), данных анамнеза (особенно эпидемиологического – контакты с больными, посещение инфекционно опасных регионов, где много бактерионосителей), результатах, полученных в ходе лабораторных исследователей.
Конечно при диагностике брюшного тифа применяется микробиологическая диагностика, при которой из крови и естественных выделений человека выделяется возбудитель. Именно методы микробиологической диагностики позволяют выявить болезнь на раннем этапе.
Используется также серологическая диагностика. Однако ее методы могут показать заболевание только начиная с 5-го – 8-го дня с начала болезни. Причем максимум возможностей достигает на 2-ой – 3-ей неделях болезни. То есть очевидно запаздывание с выставлением диагноза.
Отметим, что в практике серологической диагностики брюшного тифа широко применяется реакция Видаля, а также РПГА (реакция пассивной гемагглютинации). Эти варианты диагностики используются также для дифференциальной диагностики с целью отстройки от болезней со схожими симптомами (паратифы, сальмонеллез).
Брюшной тиф относится к типичным антропонозным кишечным инфекциям. Источником заболевания может являться только больной человек или здоровый носитель бактерий. Инфицирование происходит фекально-оральным (при употреблении загрязненной воды, термически необработанного молока, мяса и т.д.) и контактно-бытовым путем (как правило, это более характерно для детей).
Инкубационный период болезни составляет 3-14 дней (иногда он может удлиняться до 21-го дня). При пищевом пути заражения период инкубации значительно короче, чем при водном или контактно-бытовом заражении. Чем короче период инкубации инфекции, тем тяжелее течение брюшного тифа и острее начало заболевания.
Комплексная диагностика брюшного тифа основывается на анализе клинической симптоматики, данных 
- контакта с больным брюшным тифом или лихорадящими пациентами;
- поездок в эндемичные по брюшному тифу районов;
- употребления сырого молока, термически необработанного мяса и фарша, немытых фруктов или овощей;
- употребления молочных или мясных продуктов, приготовленных частными лицами в антисанитарных условиях (шаурма, чебуреки и т.д., приобретенные на стихийных рынках и в ларьках);
- приема пищи в общепитах или кафе с низким уровнем санитарного контроля и т.д.
При обследовании больного, в первую очередь обращают на себя внимание:
- его заторможенность, сонливость и адинамичность;
- наличие лихорадки 39-40 градусов;
- снижение артериального давления;
- брадиаритмия, появление негрубого систолического шума;
- вздутый, болезненный при пальпации живот с увеличенными мезентериальными лимфоузлами. Отмечается симптом Падалки – при пальпации и перкуссии правой подвздошной области выявляется сильное урчание и укорочение перкуторного звука.
- жалобы на бессонницу, головные боли, сильную слабость, запоры;
- желтизна кожи на стопах и подошвах;
- трещины и язвы на губах, а также тифозный или «поджаренный» язык (сероватый налет в центре с ярко красным ободком по краям);
- увеличение печени и селезенки с четвертого дня;
- розеолезная сыпь с 8-х суток;
- появление у пациента бреда, маний, психоза и галлюцинаций.

Возможно развитие анэозинофилии, относительного лимфоцитоза, нейтропении (характерен палочкоядерный сдвиг). Также характерно снижение количества тромбоцитов (риск тяжелого кровотечения прямо пропорционален уровню тромбоцитопении).
Поражение почек проявляется развитием олигурии (уменьшение объема мочи) или анурии (отсутствие мочи). В анализах мочи отмечается появление:
- протеинурии (белок в моче);
- микрогематурии (эритроциты в моче);
- цилиндрурии (цилиндры в моче).
При развитии кишечного кровотечения отмечается сильная тахикардия, резкая бледность кожи, падение артериального давления, снижение температуры тела, появление мелены (дегтеобразного стула с резким запахом).
Выделение гемокультуры брюшнотифозных сальмонелл возможно на протяжении всего лихорадочного периода, однако наиболее информативным анализ является на первой неделе заболевания.
В качестве дополнительного метода диагностики с десятого дня болезни проводится микробиологическая диагностика брюшного тифа с исследованием естественных выделений.
Анализ испражнений и мочи проводят со второй недели заболевания. Однако данные исследования обладают малой чувствительностью и позволяют выделить возбудителя только у 30-40 процентов больных.
По показаниям могут проводиться посевы на возбудителя соскобов (скарификата) с розеолезных высыпаний, спинномозговой жидкости и мокроты.
Для определения специфических антител с четвертого-пятого дня болезни может проводиться реакция Видаля с О- и Н- антигенами. О положительном результате свидетельствует титр 1:200, а также увеличение титра в динамике, при проведении повторного исследования.
На данный момент, реакция непрямой (пассивной) гемагглютинации (РНГА) практически вытеснила классическую реакцию Видаля. Это объясняется тем, что РНГА с О-, Н- и Vi- антигенами отличается больше чувствительностью и специфичностью (реакция Видаля может дать неспецифическую реакцию с другими бактериями, входящими в семейство энтеробактерий).
Серологическая диагностика посредством РНГА проводится на четвертый-пятый день болезни и в динамике – через десять – четырнадцать дней, с момента первого анализа. При этом, для острой инфекции показательны положительные титры с О-антигенами. Высокие титры Н-антигенов характерны для пациентов с иммунитетом против брюшного тифа, сформировавшимся в результате перенесенного заболевания или после проведения вакцинации.
Vi-антигены обнаруживают у хронических носителей сальмонелл.
В качестве дополнительных методов диагностики (контроль состояния больного и раннее выявление осложнений) проводят:
- ультразвуковое исследование органов брюшной полости;
- ЭКГ и Эхо-КГ;
- рентгенографию ОГК (органы грудной клетки);
- анализ кала на скрытую кровь;
- контроль гематокрита;
- биохимическое исследование крови, коагулограмму, электролиты крови и т.д.
При подозрении на перфорацию кишечника и кровотечение показана консультация хирурга.

Назначается диета №4А и №4. Из рациона больного полностью исключаются все продукты с большим содержанием грубой клетчатки, а также способствующие усилению кишечной моторики и газообразованию. Из рациона исключают черный хлеб, квашеную капусту, жирные молочные продукты, картофель, бобовые, цитрусы и т.д.
С пятого-шестого дня стабилизации температуры возможно расширение диеты. При кишечных кровотечениях назначают голод на сутки (через 12-ть часов после кровотечения можно поить прохладным чаем).

Дополнительно проводится симптоматическое лечение, направленное на облегчение состояния больного, а также профилактику и лечение осложнений.
Противомикробная терапия назначается в виде длительного непрерывного курса. Антибиотики назначаются с учетом возраста, тяжести состояния больного и наличия осложнений.
Назначение азитромицина целесообразно при легком неосложненном течении болезни. При среднетяжелом и тяжелом брюшном тифе рекомендовано использовать:
- цефалоспорины (препараты цефиксима, цефтриаксона, цефотаксима);
- фторхинолоновые средства (препараты ципрофлоксацина, офлоксацина, пефлоксацина).
На фоне длительной антибактериальной терапии целесообразно применение флуконазола, с целью профилактики грибковых осложнений.
По показаниям может применяться брюшнотифозная вакцина. При наличии иммунодефицитных состояний, высокого риска осложнений, а также при тяжелом течении показана иммунотерапия. Рекомендовано использование пентоксила, тимогена, метацила.
Для нормализации температуры тела больного назначают нестероидные противовоспалительные средства (парацетамол, нимесулид).
Десенсибилизация пациента проводится препаратами хлоропирамина (Супрастин), мебгибролина (Диазолин) и т.д.
Дезинтоксикация проводится при помощи инфузии растворов натрия хлорида, глюкозы, реополиглюкина, Рингера и т.д.
При развитии судорожного синдрома назначают диазепам.
Дополнительно проводится антиоксидантнаяи витаминная терапия. Назначают рибоксин, аскорбиновую кислоту, витамины А и Е, витамины групп В, препараты цитохрома С, и т.д.
Из стационара больные выписываются не ранее двадцать первого дня от момента стабилизации температуры, а также при отрицательных бак.анализах кала и мочи (требуются 2-х кратные отрицательные тесты) и желчи (однократно).
Каждый месяц проводится исследование кала и мочи. В конце третьего месяца – желчи.
В дальнейшем они состоят на учете у санэпиднадзора еще два года. Хронические носители (положительная Vi- гемагглютинация) состоят на учете пожизненно.
источник
