Реакция Вассермана
Цель: Определить наличие антител в крови исследуемого человека к бледной трепонеме.
1. Сыворотки: исследуемого человека, больного сифилисом (+ контроль), здорового (- контроль).
2. Диагностические антигены: а)специфический антиген из инактивированной культуры бледной трепонемы, б) неспецифический антиген из кардиомицитов бычьего сердца.
3. Физ.раствор
4. Комплимент
5.Гемолитическая (индикаторная) система а) эритроциты барана б) гемолитическая сыворотка кролика против эритроцитов барана
Техника постановки:
1. Физ.раствор вносят по 1 мл в 2 ряда пробирок (по 3 пробирки в каждом ряду)
2. Сыворотку по 0,5 мл вносят в пробирки: в 1 ряд – исследуемого человека, 2 – здорового человека, 3 – больного сифилисом.
3. Внесение диагностических антигенов: в 1-ую пробирку каждого ряда специфический антиген, во 2-ую – неспецифический антиген
4. В каждую пробирку вносят по 0,1 мл комплимента
5. Инкубация в термостате 2 часа
6. Внесение гемолитической системы в каждую пробиркупо 1 мл взвеси эритроцитов барана и по 1 мл гемолитической сыворотки кролика
8. Учет результатов: если раствор прозрачный, эритроциты на дне- реакция +, если раствор окрашен в красный цвет «лаковая кровь»- реакция -.
Заключение: в сыворотке исследуемого человека обнаружены антитела к бледной трепонемы. RW у исследуемого человека положительная.
РСК по определению антител к риккетсиям Музера и Провачека.
Цель реакции: определить этиологию риккетсиоза у исследуемого человека: эпидемический (R.prowazekii) либо эндемический (R.typhi) сыпной тиф.
Компоненты реакции:
1. Сыворотка исследуемого человека
2. Диагностические антигены: антиген Провачека (R.prowazekii) и антиген Музера (R.typhi)
5. Гемолитическая (индикаторная) система а) эритроциты барана б) гемолитическая сыворотка кролика против эритроцитов барана
Техника постановки:
1. Физ.раствор вносят по 1 мл в 2 ряда пробирок (по 9 пробирок в каждом ряду: 7 для разведений, 2 — контрольные)
2. Сыворотку по 0,5 мл вносят в 1-ые пробирки каждого ряда и титруют:
3. Внесение диагностических антигенов: в пробирки 1-го ряда: антиген Музера, во 2=ой- антиген Провачека
4. В каждую пробирку вносят по 0,1 мл комплимента
5. Инкубация в термостате 2 часа
6. Внесение гемолитической системы в каждую пробиркупо 1 мл взвеси эритроцитов барана и по 1 мл гемолитической сыворотки кролика
7. Инкубация в термостате 1 час
8. Учет результатов: если раствор прозрачный, эритроциты на дне- реакция +, если раствор окрашен в красный цвет «лаковая кровь»- реакция -. Диагностический титр 1:40
Заключение: в сыворотке исследуемого человека обнаружены антитела к R.prowazekii в титре 1:80. Ds –эпидемический сыпной тиф.
Реакция Видаля
Механизм антителообразования:O-антитела (Ig M) появляются на первой неделе, накапливаются в разгар заболевания и исчезают к моменту выздоровления. Н- антитела (Ig G)являются в разгар заболевания и сохраняются у переболевших в течение 1-1,5 лет.
Цель реакции:определить антитела к сальмонеллам брюшного тифа, паратифа А или паратифа В в сыворотке исследуемого человека.
Компоненты реакции:
1. Сыворотка исследуемого человека
2. Диагностические антигены: а) О –антигенный диагностикум брюшного тифа, б) Н — антигенный диагностикум брюшного тифа, в) ОН — антигенный диагностикум паратифа А, г) ОН — антигенный диагностикум паратифа В.
Техника постановки:
1. Физ.раствор вносят по 1 мл в 4 ряда пробирок по 8 пробирок: 6 – для разведений, 2 – контрольные
2. Сыворотку исследуемого человека по 0,1 мл вносят в первые пробирки каждого ряда, затем титруют (100,200,400,600,800,1600)
4. Внесение диагностикумов: в 1 — О –антигенный диагностикум брюшного тифа, во 2 — Н — антигенный диагностикум брюшного тифа, в 3 — ОН — антигенный диагностикум паратифа А, в 4 — ОН — антигенный диагностикум паратифа В.
3. Инкубация в термостате 2 часа
4. Учет результатов: если выпадает осадок в виде хлопьев (агглютинация), то реакция +, если раствор прозрачный – реакция –.
Диагностический титр 1:200
А) если агглютинация в 1 ряду, то у исследуемого человека брюшной тиф (инфекционный иммунитет)
Б) если во 2 ряду, то человек переболел брюшным тифом или привит против брюшного тифа (постинфекционный или поствакцинальный иммунитет). Отличить их можно только по нарастанию титра при инфекционном Видале.
В) в 3 ряду – паратиф А (инфекционный иммунитет)
Г) в 4 ряду – паратиф В (инфекционный иммунитет)
Д) если агглютинация произошла во всех первых пробирках каждого ряда, то это групповой иммунитет за счет наличия одинаковых антигенов у S.typhi и S.paratyphi, но учитывается тот ряд, где в последующих разведениях произошла агглютинация.
РПГА при брюшном тифе с 1 и 2 сыворотками.
Цель реакции:определить антитела к сальмонеллам брюшного тифа и определить стадию заболевания по нарастанию титра антител.
Компоненты реакции:
1. Парные сыворотки исследуемого человека (взятые на 7 и 14 день заболевания).
2. Эритроцитарный антигенный диагностикум брюшного тифа,
Техника постановки:
1. В 2 ряда лунок вносят по 1 мл ф/р.
2. Титруют сыворотки: в 1 ряду первую сыворотку, во 2 – вторую.(10,20,40,80,160,320)
3. Внесение эритроцитарного антигенного диагностикума по 3 капли в каждую лунку.
4. Инкубация в термостате 2 часа
5. Учет результатов: если осадок в виде хлопьев геммаглютинации («зонтики»), то реакция +, если в виде осадка эритроцитов («пуговки»), то реакция -.
6. Диагностический титр:1:20
Заключение:Предварительный диагноз – брюшной тиф, т.к. титр антител увеличился в 4 раза с 1:20 с 1 сывороткой, а со 2 – 1:80.
источник
Брюшной тиф развивается при попадании в организм бактерии сальмонеллы. Ею можно занести в кишечник через немытые продукты питания, загрязненную воду, пренебрегая правилами гигиены (например, при одновременном использовании полотенец с лицом, которое является носителем бактерии).
Путь передачи инфекции фекально-оральный. Поскольку клиническая картина заболевания не имеет специфических симптомов, то для подтверждения диагноза необходимо провести анализ на брюшной тиф, который поможет определить присутствие в организме возбудителя.
Анализ крови на брюшной тиф может сдаваться в двух случаях:
- при проявлении клиники характерной для кишечной инфекции;
- для предотвращения эпидемий (является обязательным анализом при продлении санитарной книжки).
Если пациент обратился к доктору с жалобой на проблемы с пищеварением и гипертермией, то врач, основываясь на проявлениях болезни, сделает предположение о развитии кишечной инфекции. На присутствие брюшного тифа указывают следующие жалобы пациента:
- боль в животе;
- признаки отравления (тошнота, рвота, слабость, потеря аппетита, гипертермия);
- проблемы со стулом (запор, несколько реже диарея);
- обезвоживание (сильная жажда, язык покрыт белым налетом, шелушение кожи);
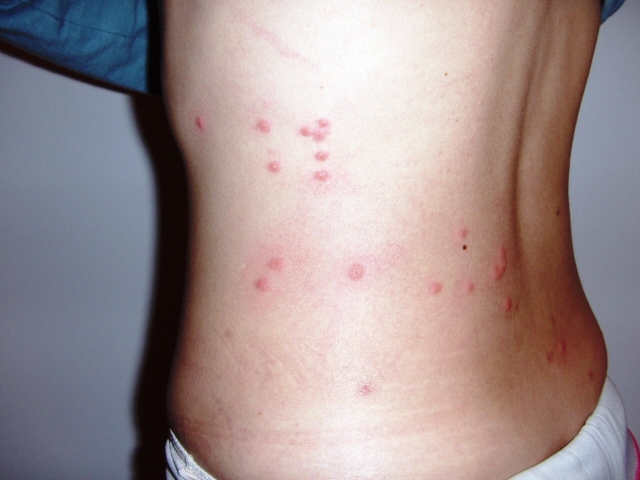
- возможно образование розеол (сыпь на коже появляется через неделю после инфицирования. При нажатии на нее исчезает, а затем вновь появляется. Количество высыпаний от 4 до 25 элементов).
Брюшной тиф, как правило, протекает следующим образом. Острое начало течения болезни в 30% случаев. Симптомы отравления, ухудшение сна, боль в голове, слабость усиливаются постепенно. Температура тела увеличивается на протяжении нескольких дней и достигает фебрильных значений. Появляется заторможенность реакций, живот вздут, появляется метеоризм, урчание.
Возбудитель тифа в пресном водоеме может оставаться жизнеспособным до месяца, а в сельскохозяйственной продукции до 10 дней, в молочных продуктах он размножается и накапливается. Комнатная муха также способна перенести бактерию на продукты питания.
Первые признаки заболевания проявляются на 7–23 сутки после заражения, поэтому установить точно источник крайне сложно. Брюшной тиф нужно дифференцировать от туберкулёза, бруцеллеза, сыпного тифа, холеры, чумы и прочих болезней, при которых у пациента возникает лихорадка и интоксикация.
Для подтверждения брюшного тифа назначаются лабораторные исследования, которые нужно провести еще до начала антибиотикотерапии (прием антибактериальных лекарств может сказаться на правильности диагностики).
Для обследования могут брать кровь, кал, мочу, желчь, спинномозговую жидкость (при подозрении на осложнение). В зависимости от стадии болезни и симптоматики могут назначать следующие анализы на брюшной тиф.
При нем изучается плазма крови. Необходимо для обнаружения специфических антител, вырабатываемых иммунитетом человека. Анализ может проводиться только спустя 4–5 суток после заражения брюшным тифом, поскольку ранее организм не синтезирует антитела.
Назначается для определения количественной характеристики всех клеток крови. При заражении брюшным тифом изменяются нормальные показатели крови.
Возникает лейкопения (количество лейкоцитов понижается), анэозинофилия (отсутствуют эозинофилы), повышается количество лимфоцитов, что указывает на присутствие в крови инфекции.
Также во время брюшного тифа увеличивается уровень нейтрофилов, лейкоцитов, синтезируемых организмом во время воспаления, понижается количество тромбоцитов, которые ответственны за свертываемость крови.
Развернутый анализ крови проводится обязательно при поступлении на стационарное лечение и во время терапии, чтоб проследить динамику. Для исследования берут анализ крови из вены или из пальца.
Обнаруживает белки острой фазы, проводить ее нужно еще до приема антибиотика. Для теста требуется 5–10 мл крови из вены, результаты исследования можно узнать в течение суток.
Во взятом образце крови мало бактерий, поэтому ее переносят в питательную среду (мясопептонный бульон) и ставят в термостатический аппарат. Микроорганизм в благоприятных условиях начнет образовывать многочисленную колонию, которая будет пригодна для исследования.
После используют химические реагенты и устанавливают вид бактерии. Подобный тест проводится всем пациентом с гипертермией, а также при проверке на брюшной тиф. Результаты можно получить на 4-5 день после проведения анализа, предварительный ответ будет дан через 2 суток. Бак посев наиболее точная лабораторная диагностика брюшного тифа.
Для обнаружения человека, который является переносчиком тифозной палочки, а также для контроля действия вакцинации против брюшного тифа применяется РНГА (реакции непрямой гемагглютинации) или пассивной гемагглютинации (РПГА). Этот метод помогает обнаружить антигены и антитела при помощи красных кровяных клеток, которые выпадают в осадок при контакте с антигеном.
Эритроциты, на которых адсорбированы антигены, склеиваются при контакте с антителом. При иммунологическом исследовании определяется уровень этих антител. У человека, болеющего брюшным тифом, он может быть на уровне 1:40, а у победившего инфекцию 1:2000, поэтому диагностика проводится с интервалом в 5 дней, чтоб следить за динамикой.
Данный анализ назначается редко, так как тифозная палочка выходит из организма только через 8–10 дней после заражения. Этот способ применяется для выявления людей, которые являются носителями инфекции, но сами не болеют.
Тифозная бактерия обнаруживается в урине только спустя 1–1,5 неделю после инфицирования. Анализ мочи может указать на такие косвенные доказательства брюшного тифа, как лейкоцитоз (на начальном этапе болезни количество белых кровяных клеток повышается, а в течение 7 дней резко падает), лейкопению, повышенное СОЭ, анэозинофилию, относительный лимфоцитоз.
Перед сбором мочи пациент должен провести гигиену наружных половых органов, затем собрать материал для анализа в стерильную баночку. Для диагностики будет достаточно 40–50 мл мочи. Для обследования на инфекцию используют осадок, который переносят на плотную питательную среду.
Возможность обнаружения возбудителя брюшного тифа микробиологическими методами напрямую связана с количеством бактерий в биологической жидкости и применением антибактериальной терапии. Через неделю после заражения сальмонеллой S. Typhi серологические агглютинационные тесты (РПГА на брюшной тиф) дают положительный ответ.
Серологические тесты менее специфичны, чем бактериологические методы, так как положительный ответ может свидетельствовать о перенесенной инфекции, вызванной другим видом сальмонелл. Дополнительное исследование через пять дней помогает следить за ростом титр, который характерен для острой инфекции.
Анализ крови на брюшной тиф должны сдавать не только пациенты с характерными признаками заболевания, но и те, кто при работе сталкивается с большим количеством людей или продуктами питания. Делается это с целью профилактики распространения брюшного тифа, поскольку заразившийся человек способен длительное время быть разносчиком инфекции.
Наибольшее количество бактерий больной выделяет с фекалиями в период с первой до пятой недели заболевания, а с мочой в течение 2–4 недель. Каждый десятый перенесший инфекцию выделяет тифозную палочку во внешнюю среду на протяжении 3 месяцев, а 3–5% от всего количества больных тифом являются хроническими носителями инфекции, распространяя палочку в течение нескольких лет.
При прохождении и продлении санкнижки анализ на брюшной тиф является обязательным. Многие не знают, откуда кровь берут для проверки. Для проведения диагностики у пациента осуществляется забор венозной крови из области сгиба локтя.
Исследование проводится инвитро, что в дословном переводе означает «в пробирке». Сколько времени делается тест зависит от загруженности лаборатории, как минимум результат будет готов через два дня. Как правильно сдавать анализ на брюшной тиф уточнит доктор, выписывающий направление.
Если уточнений нет, то следует придерживаться следующих рекомендаций:
- сдавать нужно кровь натощак;
- за день до проведения нельзя есть слишком острую, соленую, жирную или копченую пищу;
- необходимо исключить прием слабых и крепких алкогольных напитков, медикаментов как минимум за три дня до сдачи крови;
- питьевой режим менять не требуется, но от кофе все же лучше отказаться;
- за час до анализа не разрешается курить.
Если антитела к брюшному тифу не обнаружены, то это подтверждение того, что человек не является разносчиком инфекции. Если же присутствуют симптомы заболевания, а тест не показал наличие специфического белка, то, возможно, что иммунный ответ еще не сформирован, так как патология на ранней стадии.
Ложноположительный результат анализа возможен если в организме присутствует бактерия из рода сальмонелл, но вызывает другое заболевание, то есть микроорганизм есть и иммунитет реагирует выработкой антител. Какие анализы сдать при предполагаемом брюшном тифе или при проверке на бактерионосительство, а также где лучше сдать биологический материал, укажет врач.
Если брюшной тиф протекает в острой форме, то больной будет госпитализирован в инфекционную больницу. Пациенту назначаются антибиотики, диета и постельный режим. Избегать рекомендуется любого перенапряжения, даже при посещении уборной. Брюшной тиф, при отсутствии адекватного лечения, может привести к токсическому шоку, перфорации слизистой кишечника. Терапия длится от 2 до 4 недель.
источник
«Методические рекомендации по постановке реакции пассивной гемагглютинации с цистеиновой пробой с целью диагностики брюшного тифа, паратифов, других сальмонеллезов и выявления бактерионосителей»
Документ по состоянию на август 2014 г.
Утверждаю
Начальник Главного управления
карантинных инфекций
Министерства здравоохранения СССР
В.П.СЕРГИЕВ
29 февраля 1980 года
Методические рекомендации разработаны в лаборатории брюшного тифа и прочих сальмонеллезов Центрального научно-исследовательского института эпидемиологии Министерства здравоохранения СССР (Ю.Я. Тендетник). Рекомендованы к утверждению Лабораторным советом при Главном санитарно-эпидемиологическом управлении Министерства здравоохранения СССР.
С целью улучшения диагностики брюшного тифа, паратифов и других сальмонеллезов, а также при проведении эпидемиологического анализа и выявлении источников инфекции наряду с бактериологическим методом (который является основным) следует применять серологические исследования и, в частности, выявлять в сыворотке крови антитела к соответствующим возбудителям.
В настоящее время недостаточно ограничиваться определением общего титра антител, поскольку последние неоднородны по своим свойствам и относятся к 5 классам иммуноглобулинов — IgM, IgG, IgA, IgD и IgE. Наибольшее диагностическое значение имеют IgM-антитела (с константой седиментации 19S) и IgG-антитела (с константой седиментации 7S). Нормальные (так называемые неспецифические), анамнестические и прививочные антитела к O-антигенам тифозных, паратифозных и др. сальмонеллезных бактерий принадлежат в основном к IgM-антителам. Эти же антитела появляются первыми на самой ранней стадии заболевания, но к концу первой недели болезни начинают заметно нарастать IgG-антитела. Такая же закономерность отмечается и в отношении образования H-антител, однако их титр достигает максимума позже, чем титр O-антител. При брюшном тифе, кроме O- и H-антител, образуются еще Ви-антитела, основная масса которых в разгар болезни относится к IgG и IgA. У переболевших, не ставших бактерионосителями, уровень как IgG, так и IgM-антител постепенно снижается, но сохраняются в относительно высоком титре в течение нескольких недель, а иногда и больше. При формировании острого и хронического бактерионосительства, как правило, в сыворотках преобладают IgG-антитела, тогда как у транзиторных бактерионосителей определяются практически только IgM-антитела.
Лабораторное оснащение методики. Аппаратура, диагностические препараты, стекло, химические реактивы и др.
1. Термостат любого типа (жидкостный или воздушный) для поддержания температуры 37 +/- 1,0 °C.
2. Баня водяная лабораторная любого типа для поддержания температуры 56 +/- 1 °C.
3. pH — метр любой системы со стеклянными или каломельными электродами для измерения pH раствора в пределах 1 — 10 +/- 0,1 pH.
4. Весы лабораторные с погрешностью взвешивания не более 0,001 г по ГОСТ 19491-74. Удобны весы торзионные типа ВТ-500.
5. Шприц типа «Рекорд» (объем 1 мл) непрерывного действия Ш-19, ТУ-64-1-884-72.
6. Иглы трубчатые инъекционные к шприцу типа «Рекорд» с коротким срезом N 1060, размер 1,0 x 60 мм, или N 1090, размер 1,0 x 90 мм. Допустимо использование игл с отверстием не менее 0,8 мм.
7. Диагностикумы сальмонеллезные «О» эритроцитарные жидкие и сухие, ТУ-42 КВС 14 119-77, Московского научно-исследовательского института эпидемиологии и микробиологии МЗ РСФСР. Допустимо использование аналогичных диагностикумов других институтов.
8. Эритроцитарный Ви-диагностикум, МРТУ 42 N 15-64, Московского научно-исследовательского института эпидемиологии и микробиологии МЗ РСФСР.
9. Н-диагностикумы сальмонеллезные эритроцитарные формализированные, ТУ 42 КВС 89-76, Московского научно-исследовательского института вакцин и сывороток им. Мечникова МЗ СССР или Московского научно-исследовательского института эпидемиологии и микробиологии МЗ РСФСР. В случае отсутствия эритроцитарных Н-диагностикумов допустимо использование сальмонеллезных Н-монодиагностикумов корпускулярных бактериальных, МРТУ 42 N 24-64, Ташкентского научно-исследовательского института вакцин и сывороток или других предприятий.
10. Сыворотки иммунные стандартные с известным титром антител. Приложены к каждой упаковке соответствующего диагностикума.
11. Сыворотка крови нормальная сухая от различных видов лабораторных животных (кролики, крысы, мыши и др.), ТУ 42 КВС 144-78, Московского научно-исследовательского института вакцин и сывороток им. Мечникова МЗ СССР. Допустимо использование любой нормальной сыворотки иного происхождения при условии отсутствия в ней антител к сальмонеллезным О-, Ви- и Н-антигенам в титре 1:100.
12. Планшеты пластмассовые с лунками (для иммунологических реакций) из метаметилкрилата Ленинградского завода «Медполимер», ТУ 64-2-278-79. Допустимо использование других планшетов подобного типа.
13. Пипетки стеклянные мерные на 1, 2, 5 и 10 мл по ГОСТ 20292-74.
14. Пробирки стеклянные биологические 15 x 150 мм по ГОСТ 10515-75. Допустимо использование других пробирок из водостойкого стекла подходящего размера.
15. Пробирки стеклянные, для лекарственных средств 9,5 x 30 мм и 9,5 x 40 мм, ТУ 64-2-182-77. Допустимо использование любых других пробирок или флаконов из водостойкого стекла на 2, 3, 4 и 5 мл.
16. Пробки резиновые конусные N 7, 8, 9, 10, 11, 12, 14 по ГОСТ 7852-76.
17. L-цистеин солянокислый или свободный (ч) ФС-42.1048-76 химико-фармацевтического объединения «Дарница», Киев, Мин. мед. пром. Допустимо использование венгерского L-цистеина. Требования к препарату: содержание золы в виде сульфатов не более 0,2%, аммиака — не более 0,05%.
18. Вода дистиллированная по ГОСТ 6709-72.
19. Натрий хлористый (хч) по ГОСТ 4233-77.
20. Натр едкий очищенный по ГОСТ 11078-78
21. Натрий фосфорнокислый двузамещенный (хч) по ГОСТ 11773-76.
22. Калий фосфорнокислый однозамещенный (хч) по ГОСТ 4198-75.
23. Методы приготовления буферных растворов по ГОСТ 4919.2-77.
24. Бумага индикаторная универсальная для определения pH в пределах 1 — 10, ТУ 61-09 1181-71. Допустимо использование индикаторной бумаги иного типа или измерение pH раствора цистеина с помощью потенциометра.
сывороток некоторыми редуцирующими веществами, и в частности цистеином, тогда как IgM и IgA-антитела инактивируются этими реагентами. Это позволяет с помощью цистеина определить удельное содержание в сыворотке IgG-антител. Рекомендуется использовать L-цистеин как солянокислый, так и «свободный» (ч). Для обработки сывороток готовят ex tempore раствор солянокислого или «свободного» цистеина (15 мг на 1 мл растворителя). При этом солянокислый цистеин растворяют в 0,1 N растворе едкого натра с таким расчетом, чтобы pH готового раствора был равен 7,0 — 7,2. «Свободный» цистеин сначала растворяют в половинном количестве 0,85% раствора хлористого натрия, затем доводят pH до 7,0 — 7,2 0,1 N раствором едкого натра и вновь доливают до нужного объема 0,85% раствором хлористого натрия, так как «свободный» цистеин значительно слабее, чем солянокислый сдвигает pH раствора в кислую сторону. Раствор цистеина может храниться не более 30 — 60 мин., поэтому сначала следует приготовить необходимые разведения сывороток.
Исследуемую сыворотку в разведении 1:5 смешивают с равным объемом раствора цистеина. Объем исследуемой сыворотки и раствора цистеина рассчитывают исходя из числа диагностикумов. Для титрования сыворотки могут использоваться коммерческие эритроцитарные сальмонеллезные О-диагностикумы основных серологических групп (A, B, C1, C2, D и E), комплексный (поливалентный) О-диагностикум, включающий рецепторы антигенов указанных групп (1, 2, 4, 5, 6, 7, 8, 9, 12, 3, 10), эритроцитарный Ви-диагностикум и сальмонеллезные эритроцитарные Н-диагностикумы. Применяются также бактериальные Н-диагностикумы в реакции агглютинации. При постановке реакции с одним диагностикумом требуется 0,2 мл цельной сыворотки (0,1 мл для обработки цистеином и еще 0,1 мл для титрования без цистеина). Если нужно протитровать IgG и суммарные антитела к 5 — 6 диагностикумам, достаточно 0,6 мл цельной сыворотки.
Смесь сыворотки с раствором цистеина помещают в пробирки объемом на 2 и 3 мл или такого же объема флакончики и плотно закрывают их резиновыми пробками (лейкопластырем). Объем пробирок (флаконов) должен быть таким, чтобы между содержимым и пробиркой оставалось минимальное (не более 0,2 мл) свободное пространство во избежание инактивации цистеина кислородом воздуха. Пробирки с сыворотками, обработанными цистеином, выдерживают в течение 18 — 20 часов в термостате при 37 °C. В таких же условиях выдерживается вторая часть исследуемой сыворотки без цистеина, разведенная 1:10 0,85% раствором хлористого натрия. На следующий день обе части сыворотки титруют, начиная с разведения 1:20, одними и теми же диагностикумами.
При титровании большого числа сывороток целесообразно использовать пластмассовые планшеты с лунками и шприц непрерывного действия типа «Рекорд», марки Ш-19, в комплект которого входит тройник с клапанами, резиновый шланг с оливой и пружина. Шприц типа «Рекорд» на 1 мл снабжают самодельным ограничителем (отрезок металлической или твердой пластмассовой трубки), надетым на стержень между поршнем и крышкой шприца. Длина ограничителя подбирается с таким расчетом, чтобы в шприц набирался нужный объем жидкости (0,5 мл или 0,25 мл и т.п.). Приложенную к комплекту Ш-19 пружину делят на 2 половины и одну часть надевают на стержень между крышкой шприца и головкой стержня. Один конец шланга с оливой помещается в сосуд с раствором для титрования, а другой подсоединяется к тройнику (марка А), надетому на шприц.
Каждое нажатие пальцем на головку поршня до упора позволяет внести 0,5 мл раствора в лунку, после чего пружина отводит поршень в исходное положение и шприц вновь заполняется 0,5 мл раствора. В первые лунки каждого ряда вносят по 0,5 мл исследуемых сывороток, обработанных и не обработанных цистеином (в разведении 1:10), и тем же шприцем (с ограничителем на 0,5 мл), на головку которого вместо тройника надета изогнутая игла с отверстием диаметром примерно 0,8 — 1,0 мм, перемешивают 3 раза содержимое первой лунки и переносят 0,5 мл во вторую лунку, а из второй после трехкратного перемешивания — в третью и т.д. Из последней лунки 0,5 мл содержимого выливают и тщательно (не менее 4 — 5 раз) промывают шприц чистым 0,85% раствором хлористого натрия. Таким образом последовательно разводят до предполагаемого титра исследуемые сыворотки и во все лунки вносят необходимое количество диагностикума (согласно соответствующему наставлению). При отсутствии указанного шприца и пластмассовых планшетов с лунками можно пользоваться мерными пипетками и биологическими пробирками.
В качестве основы для титрования сывороток, обработанных цистеином, необходимо использовать забуференный 0,85% раствор хлористого натрия (фосфатный буфер, pH 7,0 — 7,2), однако предпочтительнее готовить 0,85% раствор хлористого натрия на нормальной, прогретой при 56 °C в течение 30 минут сыворотке (кроличьей, лошадиной, крупного рогатого скота). Нормальную сыворотку добавляют из расчета 1 мл на 100 мл 0,85% раствора хлористого натрия (pH 7,0 — 7,2) при условии: в принятом разведении нормальной сыворотки отсутствуют антитела к применяемым диагостикумам, что проверяют предварительно для каждой новой серии нормальной сыворотки. Стабильность используемых диагностикумов периодически (1 раз в 2 — 3 месяца) проверяют титрованием одной серии иммунной сыворотки с известным титром. Такая сыворотка в лиофилизированном состоянии прилагается к диагностикуму и служит рабочим стандартом. Каждый опыт должен сопровождаться контролем диагностикума в растворе для титрования.
После внесения диагностикума пластинки или пробирки осторожно встряхивают для равномерного перемешивания содержимого и помещают либо в термостат при 37 °C на 3 часа, либо оставляют на 18 — 20 часов при комнатной температуре.
Реакция гемагглютинации считается положительной в том случае, если эритроциты полностью агглютинировались и расположены равномерно по дну лунки либо при почти полной агглютинации небольшая часть эритроцитов оседает в центре лунки в виде ровного колечка или пуговки. Иногда при положительной реакции края агглютината в лунках могут слегка сползать и он принимает вид «зонтика». При отрицательном результате агглютинанта нет, все эритроциты оседают на дне в центре в виде пуговки или ровного колечка.
В современных условиях при относительно частом контакте организма человека с сальмонеллами и некоторыми другими бактериями семейства кишечных, а также с их антигенами нарастание IgM и IgG-антител у многих заболевших происходит быстро — по типу вторичного иммунного ответа. Это особенно характерно для взрослых. Поэтому первое взятие сыворотки с целью диагностики заболевания необходимо проводить немедленно после поступления больного в стационар, а второй раз сыворотку можно брать в конце первой — начале второй недели болезни при подозрении на сальмонеллез и в конце второй недели — при подозрении на брюшной тиф и паратифы. Целесообразно исследовать сыворотку и в периоде реконвалесценции, если результаты бактериологического обследования больного оказались отрицательными. При таком подходе к серологическому исследованию, как правило, удается выявить достоверное нарастание титра суммарных антител, т.е. цистеиночувствительные + цистеиноустойчивые, и установить характерную для заболеваний путем обработки сывороток цистеином. Именно эти показатели должны быть основными при постановке серологического диагноза заболевания. Понимание «диагностического» титра антител (особенно суммарных) является весьма условным. Так называемый «диагностический» титр может быть обусловлен профилактической вакцинацией, перенесенным в прошлом (от нескольких месяцев до 3-х лет) заболеванием в стертой или субклинической форме или встречей с антигенами (которые могут попадать в организм с загрязненной пищей или водой), даже подвергшимися термической обработке, поскольку некоторые соматические антигены термоустойчивы. Следует учитывать также и то, что для разных районов страны (в связи с особенностями эпидемической ситуации и др.) величина «диагностического» титра будет различной. Она устанавливается эмпирически в результате титрования сывороток от 100 — 200 здоровых лиц. Большое значение имеет условно-диагностический титр IgG-антител, т.к. их наличие свидетельствует о значительном специфическом антигенном стимуле.
При подозрении на тиф и паратифы сыворотки следует титровать с помощью О-диагностикумов серогрупп А, В и Д, а также Н-диагностикумов 1 фазы a, b, d и Ви-диагностикума. Если выявляется четкое нарастание (в 4 раза и более) титра суммарных антител к определенным антигенам и особенно увеличение уровня IgG-антител, устойчивых к цистеину, то это дает веские основания для подтверждения клинического диагноза. Необходимо при этом учитывать, что при паратифе А титры О-антител на протяжении заболевания бывают более низкими, чем при брюшном тифе и паратифе В. В случае позднего поступления больного в стационар (в разгаре болезни) условно-диагностическим титром суммарных О-антител следует считать положительный результат в разведении не ниже 1:640. Минимальным условно-диагностическим титром IgG О- и Н-антител считается разведение 1:80, а для Ви-антител — 1:40 (при паратифе А «диагностические» титры могут быть в 2 раза ниже).
В такой ситуации при отсутствии бактериологического подтверждения рекомендуется исследовать сыворотку в периоде поздней реконвалесценции, чтобы уловить снижение общего титра антител и уменьшение удельного содержания цистеиноустойчивых IgG-антител, что также может служить определенным основанием для постановки диагноза.
При подозрении на сальмонеллез сыворотки вначале титруют с комплексным диагностикумом без цистеина. Если будет выявлено нарастание уровня антител или титр окажется достаточно высоким (не ниже 1:320), то следует перетитровать сыворотки в РПГА с цистеином со всеми групповыми О-диагностикумами (при отрицательном результате бактериологического обследования). Это необходимо не только для уточнения этиологии заболевания, но и потому что РПГА с комплексным диагностикумом недостаточно специфична. При сальмонеллезах и особенно пищевых токсикоинфекциях сальмонеллезной этиологии уже в конце первой недели в сыворотке обычно определяется довольно высокоудельное содержание IgG-антител. Поэтому при обработке такой сыворотки цистеином титр может снижаться не очень резко.
Реакция пассивной гемагглютинации с цистеином может оказаться полезной для постановки правильного диагноза в случаях смешанной инфекции или при выделении двух или нескольких видов возбудителей, этиологическая роль каждого из которых не ясна. При истинной микст-инфекции антитела и особенно цистеиноустойчивые будут нарастать к каждому возбудителю. Если же к какому-то микробу нарастание антител, и в том числе IgG, не будет выявлено, то можно предполагать, что выделение этого микроба носит случайный, транзиторный характер. Транзиторное носительство сальмонелл нередко имеет место у взрослых, т.к. они значительно более устойчивы к заражению, чем дети.
РПГА с цистеином можно использовать с целью установления ретроспективного диагноза, т.к. у переболевших даже субклинической формой заболевания в течение 1 — 2 месяцев в большинстве случаев сохраняется повышенный титр суммарных IgG-антител к соответствующему антигену.
В случае формирования острого и особенно хронического бактерионосительства происходит выраженное нарастание IgG-антител и при этом основное значение имеет не абсолютный титр антител, а удельное содержание в сыворотке цистеиноустойчивых антител. Если обработка цистеином не снижает титр либо снижает его только на одно, максимум два разведения, то это говорит о значительном содержании в сыворотке IgG-антител и у такого человека следует заподозрить острое или хроническое бактерионосительство. Необходимо отметить, что при длительном бактерионосительстве титр О-антител может быть низким (иногда 1:20 — 1:40), но эти антитела практически целиком определяются IgG-антителами. В то же время у хронических носителей тифозных бактерий определяется также сравнительно высокий уровень (в большинстве случаев выше 1:80) Ви-антител, который при обработке цистеином.
Отмеченная закономерность может нарушаться у хронических носителей тифозных бактерий, инвазированных онисторхами. В сыворотках у значительного процента таких лиц относительно невелико удельное содержание IgG О-антител, однако выявляются высокие титры IgG Ви-антител. Это необходимо принимать во внимание при обследовании на бактерионосительство различных контингентов населения, главным образом, на некоторых территориях Обь-Иртышского бассейна, где описторхоз встречается в качестве краевой патологии.
У транзиторных бактерионосителей при относительно невысоком титре антител все они, как правило, принадлежат к IgM и полностью инактивируются цистеином. Если этого не наблюдается и в сыворотке остаются антитела (выше 1:20) после обработки ее цистеином, то у такого лица можно предполагать наличие либо субклинической формы инфекции, либо продолжающееся бактерионосительство. Некоторое повышение уровня IgG-антител может происходить в результате многократной специфической вакцинации, поэтому при анализе результатов реакции следует учитывать прививочный анамнез.
Постановка РПГА с цистеиновой пробой может быть использована с целью контроля возможного прекращения бактерионосительства. Известно, что у бактерионосителей выделение возбудителей может происходить не постоянно, а с более или менее длительными перерывами. У такого лица серологические показатели будут характерными для длительного бактерионосителя. Если же на фоне прекратившегося бактериовыделения значительно снизится титр антител и особенно цистеиноустойчивых IgG, то можно предположить об освобождении организма от возбудителя. Освобождение от бактерионосительства чаще наблюдается при сальмонеллезах, реже — при брюшном тифе.
источник
Возбудитель — Salmonella typhi, грамотрицательная подвижная палочка рода Salmonella семейства Enterobacteriaceae. Бактерии неприхотливы и растут на обычных питательных средах. У S. typhi выделяют термостабильный соматический О-Аг, термолабильный жгутиковый Н-Аг, термолабильный соматический Vi-Aг и др. Бактерии экзотоксинов не образуют. При разрушении микроорганизмов высвобождается эндотоксин, играющий основную роль в патогенезе заболевания. В определённой степени патогенность брюшнотифозных бактерий также определяют «ферменты агрессии» — гиалуронидаза, фибринолизин, лецитиназа, гемолизин, каталаза и др. По чувствительности к типовым бактериофагам выделяют более 100 стабильных фаговаров. Определение фаговара возбудителя — удобный маркёр для выявления эпидемиологических связей между отдельными заболеваниями, выяснения источника и путей передачи возбудителя. В неблагоприятных условиях, например в иммунном организме, бактерии переходят в L-формы. Бактерии умеренно устойчивы во внешней среде — в почве и воде могут сохраняться до 1-5 мес, в испражнениях — до 25 дней, на белье — до 2 нед, на пищевых продуктах — от нескольких дней до недель. Несколько дольше сохраняются в молоке, мясном фарше, овощных салатах, где при температуре выше 18 «С способны размножаться. При нагревании возбудитель быстро погибает, дезинфицирующие растворы в обычных концентрациях действуют на него губительно.
Резервуар и источник инфекции — человек (больной или бактериовыделитель). Опасность больного для окружающих в разные периоды болезни неодинакова. В инкубационном периоде заражённый человек практически не опасен. Опасность больного для окружающих увеличивается по мере развития болезни и достигает максимума на 2-3-й неделе болезни — в период выделения бактерий с испражнениями, мочой и потом; также их можно обнаружить в грудном молоке и носоглотке. Большая часть переболевших освобождается от возбудителя в первые 1 2 нед или в ближайшие 2-3 мес реконвалесценции. Примерно 3-5% остаются носителями на длительный срок, а некоторые — на всю жизнь. Эпидемиологическая опасность хронического носителя определяется его профессией и зависит от соблюдения им правил личной гигиены. Особую опасность представляют носители, имеющие доступ к приготовлению, хранению и реализации пищевых продуктов.
Механизм передачи фекально-оральный, реализуется водным, пищевым и бытовым путями; в районах с повышенным уровнем заболеваемости распространение идёт преимущественно водным путём. Последнее происходит за счёт использования воды, взятой из загрязнённых открытых или технических водоёмов, а также из-за неудовлетворительного санитарно-технического состояния водопроводных и канализационных сооружений. В результате употребления заражённой воды возникают острые и хронические водные вспышки, способные длительно продолжаться и охватывать большие группы населения. К возникновению водных вспышек приводят аварии на водопроводных сетях и сооружениях, перепады давления и нерегулярность подачи воды, сопровождающиеся подсосом инфицированных грунтовых вод через негерметичные отрезки сетей. Из пищевых продуктов наиболее опасны молоко и молочные изделия, кремы, салаты и другие продукты, служащие благоприятной средой для размножения бактерий. Иногда заражение может произойти и через овощи, особенно при их поливе сточными водами или удобрении фекалиями. Бытовой путь передачи возможен при низкой культуре бактерионосителей или больных со стёртой формой болезни. При этом происходит заражение окружающих предметов, а в последующем — заражение пищи.
Дифференциальная диагностика
Брюшной тиф необходимо дифференцировать от заболеваний, сопровождающихся длительной лихорадкой и развитием признаков интоксикации, — сыпного тифа, малярии, бруцеллёза, пневмонии, сепсиса, туберкулёза, лимфогранулематоза и др. В клинической дифференциальной диагностике брюшного тифа следует опираться на такие симптомы, как высокая длительная лихорадка, бледность кожных покровов лица, болезненность и урчание при пальпации в правой подвздошной области, гепатолиенальныи синдром, брадикардию, увеличение в размерах языка, обложенного по центру, появление на 8-9-й день болезни скудной розеолёзной сыпи на животе и нижней части груди, при более тяжёлом течении — развитие тифозного статуса. Постановка правильного диагноза вызывает значительные трудности, особенно при атипичных формах брюшного тифа. Поэтому каждый случай неясной лихорадки длительностью более 3 дней требует проведения соответствующих лабораторных исследований, в том числе выделения возбудителя из крови и фекалий, определения антигенов возбудителя в сыворотке крови и испражнениях. Получение брюшнотифозной гемокультуры — абсолютное подтверждение диагноза брюшного тифа. Обнаружение брюшнотифозных палочек в каловых массах менее информативно.
Лабораторная диагностика
На высоте интоксикации у больных брюшным тифом изменения гемограммы характеризуются лейкопенией, анэозинофилией, относительным лимфоцитозом и умеренным повышением скорости оседания эритроцитов (СОЭ). На первых этапах болезни также можно наблюдать умеренный лейкоцитоз со сдвигом лейкоцитарной формулы влево. В анализе мочи можно обнаружить белок и увеличение количества эритроцитов, а также цилиндры.
Наиболее достоверный метод диагностики брюшного тифа — выделение возбудителя. Для этого проводят посев 10 мл крови на 100 мл среды, содержащей жёлчь (10-20% жёлчный бульон, среда Раппопорта). Выделение гемокультуры наиболее эффективно в первую неделю болезни, однако с диагностической целью исследование проводят во все периоды температурной реакции. Посевы испражнений (копрокультуру) и мочи (уринокультуру) также проводят во все периоды заболевания, особенно на 2-3-й неделе. Вместе с тем необходимо помнить, что брюшнотифозную палочку из кала и мочи можно выделить не только у больных брюшным тифом, но и от бактерионосителей при различных лихорадочных состояниях. Посевы испражнений и мочи выполняют на плотные питательные среды. Помимо бактериологических исследований уже с первых дней болезни можно выявить брюшнотифозный О-Аг в испражнениях или сыворотке крови в РКА, РЛА, а также методами иммунофлюоресцентной микроскопии и ИФА.
Серологическую диагностику (РНГА в парных сыворотках с эритроцитарным брюшнотифозным О-диагностикумом) проводят с конца первой недели заболевания, однако минимальный диагностический титр AT (1:200) впервые можно выявить и в более поздние сроки заболевания (на 3-й неделе болезни). РНГА с эритроцитарным брюшнотифозным Vi-диагностикумом у больных брюшным тифом имеет вспомогательное значение (минимальный диагностический титр 1:40). Чаще эту реакцию используют для отбора лиц, подозрительных на бактерионосительство. При титрах AT 1:80 и выше этим лицам проводят многократное бактериологическое исследование. В настоящее время наибольшее распространение получила РПГА, которая бывает положительной уже на 4-5-й день болезни.
источник
Утверждаю
Начальник Главного управления карантинных инфекций Министерства здравоохранения СССР В.П.Сергиев 29 февраля 1980 года
Методические рекомендации разработаны в лаборатории брюшного тифа и прочих сальмонеллезов Центрального научно-исследовательского института эпидемиологии Министерства здравоохранения СССР (Ю.Я.Тендетник). Рекомендованы к утверждению Лабораторным советом при Главном санитарно-эпидемиологическом управлении Министерства здравоохранения СССР.
С целью улучшения диагностики брюшного тифа, паратифов и других сальмонеллезов, а также при проведении эпидемиологического анализа и выявлении источников инфекции наряду с бактериологическим методом (который является основным) следует применять серологические исследования и, в частности, выявлять в сыворотке крови антитела к соответствующим возбудителям.
В настоящее время недостаточно ограничиваться определением общего титра антител, поскольку последние неоднородны по своим свойствам и относятся к 5 классам иммуноглобулинов — IgM, IgG, IgA, IgD и IgE. Наибольшее диагностическое значение имеют lgM-антитела (с константой седиментации 19S) и IgG-антитела (с константой седиментации 7S). Нормальные (так называемые неспецифические), анамнестические и прививочные антитела к O-антигенам тифозных, паратифозных и др. сальмонеллезных бактерий принадлежат в основном к lgM-антителам. Эти же антитела появляются первыми на самой ранней стадии заболевания, но к концу первой недели болезни начинают заметно нарастать lgG-антитела. Такая же закономерность отмечается и в отношении образования Н-антител, однако их титр достигает максимума позже, чем титр O-антител. При брюшном тифе, кроме O- и H-антител, образуются еще Ви-антитела, основная масса которых в разгар болезни относится к IgG и IgA. У переболевших, не ставших бактерионосителями, уровень как IgG, так и lgM-антител постепенно снижается, но сохраняются в относительно высоком титре в течение нескольких недель, а иногда и больше. При формировании острого и хронического бактерионосительства, как правило, в сыворотках преобладают lgG-антитела, тогда как у транзиторных бактерионосителей определяются практически только lgM-антитела.
Лабораторное оснащение методики. Аппаратура, диагностические препараты, стекло, химические реактивы и др.
1. Термостат любого типа (жидкостный или воздушный) для поддержания температуры 37+/-1,0°С.
2. Баня водяная лабораторная любого типа для поддержания температуры 56+/-1°С.
3. рН-метр любой системы со стеклянными или каломельными электродами для измерения рН раствора в пределах 1-10+/-0,1 рН.
4. Весы лабораторные с погрешностью взвешивания не более 0,001 г по ГОСТ 19491-74. Удобны весы торзионные типа ВТ-500.
5. Шприц типа «Рекорд» (объем 1 мл) непрерывного действия Ш-19, ТУ-64-1-884-72*.
________________
* ТУ, упомянутые здесь и далее по тексту, не приводятся. За дополнительной информацией обратитесь по ссылке. — Примечание изготовителя базы данных.
6. Иглы трубчатые инъекционные к шприцу типа «Рекорд» с коротким срезом N 1060, размер 1,0х60 мм, или N 1090, размер 1,0х90 мм. Допустимо использование игл с отверстием не менее 0,8 мм.
7. Диагностикумы сальмонеллезные «O» эритроцитарные жидкие и сухие, ТУ-42 КВС 14 119-77, Московского научно-исследовательского института эпидемиологии и микробиологии МЗ РСФСР. Допустимо использование аналогичных диагностикумов других институтов.
8. Эритроцитарный Ви-диагностикум, МРТУ 42 N 15-64, Московского научно-исследовательского института эпидемиологии и микробиологии МЗ РСФСР.
9. H-диагностикумы сальмонеллезные эритроцитарные формализированные, ТУ 42 КВС 89-76, Московского научно-исследовательского института вакцин и сывороток им.Мечникова МЗ СССР или Московского научно-исследовательского института эпидемиологии и микробиологии МЗ РСФСР. В случае отсутствия эритроцитарных H-диагностикумов допустимо использование сальмонеллезных H-монодиагностикумов корпускулярных бактериальных, МРТУ 42 N 24-64, Ташкентского научно-исследовательского института вакцин и сывороток или других предприятий.
10. Сыворотки иммунные стандартные с известным титром антител. Приложены к каждой упаковке соответствующего диагностикума.
11. Сыворотка крови нормальная сухая от различных видов лабораторных животных (кролики, крысы, мыши и др.), ТУ 42 КВС 144-78, Московского научно-исследовательского института вакцин и сывороток им.Мечникова МЗ СССР. Допустимо использование любой нормальной сыворотки иного происхождения при условии отсутствия в ней антител к сальмонеллезным O-, Ви- и H-антигенам в титре 1:100.
12. Планшеты пластмассовые с лунками (для иммунологических реакций) из метаметилкрилата Ленинградского завода «Медполимер», ТУ 64-2-278-79. Допустимо использование других планшетов подобного типа.
13. Пипетки стеклянные мерные на 1, 2, 5 и 10 мл по ГОСТ 20292-74.
14. Пробирки стеклянные биологические 15х150 мм по ГОСТ 10515-75. Допустимо использование других пробирок из водостойкого стекла подходящего размера.
15. Пробирки стеклянные, для лекарственных средств 9,5х30 мм и 9,5х40 мм, ТУ 64-2-182-77. Допустимо использование любых других пробирок или флаконов из водостойкого стекла на 2, 3, 4 и 5 мл.
16. Пробки резиновые конусные N 7, 8, 9, 10, 11, 12, 14 по ГОСТ 7852-76.
17. L-цистеин солянокислый или свободный (ч) ФС-42.1048-76 химико-фармацевтического объединения «Дарница», Киев, Мин. мед. пром. Допустимо использование венгерского L-цистеина. Требования к препарату: содержание золы в виде сульфатов не более 0,2%, аммиака — не более 0,05%.
18. Вода дистиллированная по ГОСТ 6709-72.
19. Натрий хлористый (х.ч.) по ГОСТ 4233-77.
20. Натр едкий очищенный по ГОСТ 11078-78.
21. Натрий фосфорнокислый двузамещенный (х.ч.) по ГОСТ 11773-76.
22. Калий фосфорнокислый однозамещенный (х.ч.) по ГОСТ 4198-75.
23. Методы приготовления буферных растворов по ГОСТ 4919.2-77.
24. Бумага индикаторная универсальная для определения рН в пределах 1-10, ТУ 61-09 1181-71. Допустимо использование индикаторной бумаги иного типа или измерение рН раствора цистеина с помощью потенциометра.
Методика постановки реакции гемагглютинации с определением lgG-антител
сывороток некоторыми редуцирующими веществами, и в частности цистеином, тогда как IgM и lgA-антитела инактивируются этими реагентами. Это позволяет с помощью цистеина определить удельное содержание в сыворотке lgG-антител. Рекомендуется использовать L-цистеин как солянокислый, так и «свободный» (ч). Для обработки сывороток готовят ex tempore раствор солянокислого или «свободного» цистеина (15 мг на 1 мл растворителя). При этом солянокислый цистеин растворяют в 0,1 N растворе едкого натра с таким расчетом, чтобы рН готового раствора был равен 7,0-7,2. «Свободный» цистеин сначала растворяют в половинном количестве 0,85% раствора хлористого натрия, затем доводят рН до 7,0-7,2 0,1 N раствором едкого натра и вновь доливают до нужного объема 0,85% раствором хлористого натрия, так как «свободный» цистеин значительно слабее, чем солянокислый сдвигает рН раствора в кислую сторону. Раствор цистеина может храниться не более 30-60 мин, поэтому сначала следует приготовить необходимые разведения сывороток.
Исследуемую сыворотку в разведении 1:5 смешивают с равным объемом раствора цистеина. Объем исследуемой сыворотки и раствора цистеина рассчитывают исходя из числа диагностикумов. Для титрования сыворотки могут использоваться коммерческие эритроцитарные сальмонеллезные O-диагностикумы основных серологических групп (A, B, C1, C2, D и E), комплексный (поливалентный) O-диагностикум, включающий рецепторы антигенов указанных групп (1, 2, 4, 5, 6, 7, 8, 9, 12, 3, 10), эритроцитарный Ви-диагностикум и сальмонеллезные эритроцитарные H-диагностикумы. Применяются также бактериальные H-диагностикумы в реакции агглютинации. При постановке реакции с одним диагностикумом требуется 0,2 мл цельной сыворотки (0,1 мл для обработки цистеином и еще 0,1 мл для титрования без цистеина). Если нужно протитровать IgG и суммарные антитела к 5-6 диагностикумам, достаточно 0,6 мл цельной сыворотки.
Смесь сыворотки с раствором цистеина помещают в пробирки объемом на 2 и 3 мл или такого же объема флакончики и плотно закрывают их резиновыми пробками (лейкопластырем). Объем пробирок (флаконов) должен быть таким, чтобы между содержимым и пробиркой оставалось минимальное (не более 0,2 мл) свободное пространство во избежание инактивации цистеина кислородом воздуха. Пробирки с сыворотками, обработанными цистеином, выдерживают в течение 18-20 часов в термостате при 37°С. В таких же условиях выдерживается вторая часть исследуемой сыворотки без цистеина, разведенная 1:10 0,85% раствором хлористого натрия. На следующий день обе части сыворотки титруют, начиная с разведения 1:20, одними и теми же диагностикумами.
При титровании большого числа сывороток целесообразно использовать пластмассовые планшеты с лунками и шприц непрерывного действия типа «Рекорд», марки Ш-19, в комплект которого входит тройник с клапанами, резиновый шланг с оливой и пружина. Шприц типа «Рекорд» на 1 мл снабжают самодельным ограничителем (отрезок металлической или твердой пластмассовой трубки), надетым на стержень между поршнем и крышкой шприца. Длина ограничителя подбирается с таким расчетом, чтобы в шприц набирался нужный объем жидкости (0,5 мл или 0,25 мл и т.п.). Приложенную к комплекту Ш-19 пружину делят на 2 половины и одну часть надевают на стержень между крышкой шприца и головкой стержня. Один конец шланга с оливой помещается в сосуд с раствором для титрования, а другой подсоединяется к тройнику (марка А), надетому на шприц.
Каждое нажатие пальцем на головку поршня до упора позволяет внести 0,5 мл раствора в лунку, после чего пружина отводит поршень в исходное положение и шприц вновь заполняется 0,5 мл раствора. В первые лунки каждого ряда вносят по 0,5 мл исследуемых сывороток, обработанных и не обработанных цистеином (в разведении 1:10), и тем же шприцем (с ограничителем на 0,5 мл), на головку которого вместо тройника надета изогнутая игла с отверстием диаметром примерно 0,8-1,0 мм, перемешивают 3 раза содержимое первой лунки и переносят 0,5 мл во вторую лунку, а из второй после трехкратного перемешивания — в третью и т.д. Из последней лунки 0,5 мл содержимого выливают и тщательно (не менее 4-5 раз) промывают шприц чистым 0,85% раствором хлористого натрия. Таким образом последовательно разводят до предполагаемого титра исследуемые сыворотки и во все лунки вносят необходимое количество диагностикума (согласно соответствующему наставлению). При отсутствии указанного шприца и пластмассовых планшетов с лунками можно пользоваться мерными пипетками и биологическими пробирками.
В качестве основы для титрования сывороток, обработанных цистеином, необходимо использовать забуференный 0,85% раствор хлористого натрия (фосфатный буфер, рН 7,0-7,2), однако предпочтительнее готовить 0,85% раствор хлористого натрия на нормальной, прогретой при 56°С в течение 30 минут сыворотке (кроличьей, лошадиной, крупного рогатого скота). Нормальную сыворотку добавляют из расчета 1 мл на 100 мл 0,85% раствора хлористого натрия (рН 7,0-7,2) при условии: в принятом разведении нормальной сыворотки отсутствуют антитела к применяемым диагостикумам, что проверяют предварительно для каждой новой серии нормальной сыворотки. Стабильность используемых диагностикумов периодически (1 раз в 2-3 месяца) проверяют титрованием одной серии иммунной сыворотки с известным титром. Такая сыворотка в лиофилизированном состоянии прилагается к диагностикуму и служит рабочим стандартом. Каждый опыт должен сопровождаться контролем диагностикума в растворе для титрования.
После внесения диагностикума пластинки или пробирки осторожно встряхивают для равномерного перемешивания содержимого и помещают либо в термостат при 37°С на 3 часа, либо оставляют на 18-20 часов при комнатной температуре.
Реакция гемагглютинации считается положительной в том случае, если эритроциты полностью агглютинировались и расположены равномерно по дну лунки либо при почти полной агглютинации небольшая часть эритроцитов оседает в центре лунки в виде ровного колечка или пуговки. Иногда при положительной реакции края агглютината в лунках могут слегка сползать и он принимает вид «зонтика». При отрицательном результате агглютинанта нет, все эритроциты оседают на дне в центре в виде пуговки или ровного колечка.
В современных условиях при относительно частом контакте организма человека с сальмонеллами и некоторыми другими бактериями семейства кишечных, а также с их антигенами нарастание IgM и IgG-антител у многих заболевших происходит быстро — по типу вторичного иммунного ответа. Это особенно характерно для взрослых. Поэтому первое взятие сыворотки с целью диагностики заболевания необходимо проводить немедленно после поступления больного в стационар, а второй раз сыворотку можно брать в конце первой — начале второй недели болезни при подозрении на сальмонеллез и в конце второй недели — при подозрении на брюшной тиф и паратифы. Целесообразно исследовать сыворотку и в периоде реконвалесценции, если результаты бактериологического обследования больного оказались отрицательными. При таком подходе к серологическому исследованию, как правило, удается выявить достоверное нарастание титра суммарных антител, т.е. цистеиночувствительные + цистеиноустойчивые, и установить характерную для заболеваний путем обработки сывороток цистеином. Именно эти показатели должны быть основными при постановке серологического диагноза заболевания. Понимание «диагностического» титра антител (особенно суммарных) является весьма условным. Так называемый «диагностический» титр может быть обусловлен профилактической вакцинацией, перенесенным в прошлом (от нескольких месяцев до 3 лет) заболеванием в стертой или субклинической форме или встречей с антигенами (которые могут попадать в организм с загрязненной пищей или водой), даже подвергшимися термической обработке, поскольку некоторые соматические антигены термоустойчивы. Следует учитывать также и то, что для разных районов страны (в связи с особенностями эпидемической ситуации и др.) величина «диагностического» титра будет различной. Она устанавливается эмпирически в результате титрования сывороток от 100-200 здоровых лиц. Большое значение имеет условно-диагностический титр lgG-антител, т.к. их наличие свидетельствует о значительном специфическом антигенном стимуле.
При подозрении на тиф и паратифы сыворотки следует титровать с помощью O-диагностикумов серогрупп А, В и Д, а также H-диагностикумов 1 фазы a, b, d и Ви-диагностикума. Если выявляется четкое нарастание (в 4 раза и более) титра суммарных антител к определенным антигенам и особенно увеличение уровня lgG-антител, устойчивых к цистеину, то это дает веские основания для подтверждения клинического диагноза. Необходимо при этом учитывать, что при паратифе А титры O-антител на протяжении заболевания бывают более низкими, чем при брюшном тифе и паратифе В. В случае позднего поступления больного в стационар (в разгаре болезни) условно-диагностическим титром суммарных O-антител следует считать положительный результат в разведении не ниже 1:640. Минимальным условно-диагностическим титром IgG O- и H-антител считается разведение 1:80, а для Ви-антител — 1:40 (при паратифе А «диагностические» титры могут быть в 2 раза ниже).
В такой ситуации при отсутствии бактериологического подтверждения рекомендуется исследовать сыворотку в периоде поздней реконвалесценции, чтобы уловить снижение общего титра антител и уменьшение удельного содержания цистеиноустоичивых lgG-антител, что также может служить определенным основанием для постановки диагноза.
При подозрении на сальмонеллез сыворотки вначале титруют с комплексным диагностикумом без цистеина. Если будет выявлено нарастание уровня антител или титр окажется достаточно высоким (не ниже 1:320), то следует перетитровать сыворотки в РПГА с цистеином со всеми групповыми O-диагностикумами (при отрицательном результате бактериологического обследования). Это необходимо не только для уточнения этиологии заболевания, но и потому что РПГА с комплексным диагностикумом недостаточно специфична. При сальмонеллезах и особенно пищевых токсикоинфекциях сальмонеллезной этиологии уже в конце первой недели в сыворотке обычно определяется довольно высокоудельное содержание lgG-антител. Поэтому при обработке такой сыворотки цистеином титр может снижаться не очень резко.
Реакция пассивной гемагглютинации с цистеином может оказаться полезной для постановки правильного диагноза в случаях смешанной инфекции или при выделении двух или нескольких видов возбудителей, этиологическая роль каждого из которых не ясна. При истинной микст-инфекции антитела и особенно цистеиноустойчивые будут нарастать к каждому возбудителю. Если же к какому-то микробу нарастание антител, и в том числе IgG, не будет выявлено, то можно предполагать, что выделение этого микроба носит случайный, транзиторный характер. Транзиторное носительство сальмонелл нередко имеет место у взрослых, т.к. они значительно более устойчивы к заражению, чем дети.
РПГА с цистеином можно использовать с целью установления ретроспективного диагноза, т.к. у переболевших даже субклинической формой заболевания в течение 1-2 месяцев в большинстве случаев сохраняется повышенный титр суммарных lgG-антител к соответствующему антигену.
В случае формирования острого и особенно хронического бактерионосительства происходит выраженное нарастание lgG-антител и при этом основное значение имеет не абсолютный титр антител, а удельное содержание в сыворотке цистеиноустойчивых антител. Если обработка цистеином не снижает титр либо снижает его только на одно, максимум два разведения, то это говорит о значительном содержании в сыворотке lgG-антител и у такого человека следует заподозрить острое или хроническое бактерионосительство. Необходимо отметить, что при длительном бактерионосительстве титр О-антител может быть низким (иногда 1:20-1:40), но эти антитела практически целиком определяются IgG-антителами. В то же время у хронических носителей тифозных бактерий определяется также сравнительно высокий уровень (в большинстве случаев выше 1:80) Ви-антител, который при обработке цистеином.
Отмеченная закономерность может нарушаться у хронических носителей тифозных бактерий, инвазированных онисторхами. В сыворотках у значительного процента таких лиц относительно невелико удельное содержание IgG О-антител, однако выявляются высокие титры IgG Ви-антител. Это необходимо принимать во внимание при обследовании на бактерионосительство различных контингентов населения, главным образом, на некоторых территориях Обь-Иртышского бассейна, где описторхоз встречается в качестве краевой патологии.
У транзиторных бактерионосителей при относительно невысоком титре антител все они, как правило, принадлежат к IgM и полностью инактивируются цистеином. Если этого не наблюдается и в сыворотке остаются антитела (выше 1:20) после обработки ее цистеином, то у такого лица можно предполагать наличие либо субклинической формы инфекции, либо продолжающееся бактерионосительство. Некоторое повышение уровня lgG-антител может происходить в результате многократной специфической вакцинации, поэтому при анализе результатов реакции следует учитывать прививочный анамнез.
Постановка РПГА с цистеиновой пробой может быть использована с целью контроля возможного прекращения бактерионосительства. Известно, что у бактерионосителей выделение возбудителей может происходить не постоянно, а с более или менее длительными перерывами. У такого лица серологические показатели будут характерными для длительного бактерионосителя. Если же на фоне прекратившегося бактериовыделения значительно снизится титр антител и особенно цистеиноустойчивых IgG, то можно предположить об освобождении организма от возбудителя. Освобождение от бактерионосительства чаще наблюдается при сальмонеллезах, реже — при брюшном тифе.
Электронный текст документа
подготовлен АО «Кодекс» и сверен по:
Ознакомиться с документом вы можете, заказав бесплатную демонстрацию систем «Кодекс» и «Техэксперт».
источник