Возбудители брюшного тифа, паратифов
Возбудителя брюшного тифа (S. typhi) выявил впервые немецкий гистолог Эберт в 1880 г., увидевший его при микроскопии гистологических препаратов – срезов селезенки, периферических лимфоузлов и пейеровых бляшек, взятых у умерших от тифа больных. В 1884 г. Гаффки получил чистую культуру возбудителя. В этом же году А. Брион и Х. Кайзер описали возбудителя паратифа А (S. paratyphi A), а Г. Шоттмюллер – возбудителя паратифа В (S. paratyphi В). Этих сальмонелл выделили в чистой культуре и изучили Ашар и Бедсон в 1896 г.
Родовое название связано с именем американского ветеринарного врача Д. Сальмона, который в 1885 г. выделил возбудителя сальмонеллезов (S. choleraesuis) от больных свиней. В 1888 г. Гертнер выделил S. enteritidis из мяса и селезенки коров, погибших от острой пищевой инфекции. В 1890 г. Леффлер, 1893 г. С.С. Мережковский и 1900 г. Даниш обнаружили другого возбудителя S. typhimurium, вызвавшего аналогичные заболевания у человека и у мышей.
В 1934 г. Ф. Кауфман и П. Уайт разработали классификацию сальмонелл по антигенной структуре.
(вызывают заболевания у человека и животных)
S. typhi (палочка Эберта-Гаффки)
S. paratyphi A (палочка Бриона-Кайзера)
S. paratyphi В (палочка Шоттмюллера)
Однако в большинстве учебных пособий и справочников для удобства используется исторически сложившаяся таксономия, рассматривающая серовары, как виды (например, S . typhi , вместо S . enterica подвид enterica серовар Typhi )
Морфология и тинкториальные свойства.
Мелкие грамотрицательные палочки с закругленными концами размером 0,7-1,5?2-5 мкм, в мазках располагаются беспорядочно, подвижны (перетрихи), имеют пили I и II типов, S . typhi – микрокапсулу, спор не образуют.
Факультативные анаэробы, хемоорганогетеротрофы. Не требовательны к условиям культивирования: оптимальная температура роста 370С, значение рН 6,8-7,2, длительность культивирования – 24-48 часа. Хорошо растут на простых питательных средах (МПБ, МПА). В МПБ наблюдается рост в виде диффузного помутнения с последующим образованием осадка. На МПА образуют колонии в S — (средних размеров, гладкие, блестящие, полупрозрачные с голубоватым оттенком) и R -форме, S . paratyphi В и S . enteritidis по краю колоний формируют слизистый валик. В качестве накопительных сред используют желчный и селенитовый бульон. На дифференциально- диагностических средах Эндо, Левина и Плоскирева образуют бесцветные колонии (не ферментируют лактозу). На висмут-сульфитном агаре – колонии черного цвета с металлическим блеском, окруженные черным ободком прокрашенной среды.
Сальмонеллы обладают выраженной ферментативной активностью. Оксидазоотрицательны и каталазоположительны. Реакция Фогеса-Проскауэра отрицательная. Сахаролитическая активность: не расщепляют лактозу и сахарозу; глюкозу, маннит, мальтозу и другие сахара разлагают до кислоты и газа (исключение, S . typhi – до кислоты), по способности разлагать ксилозу и арабинозу различают 4 типа: К+А+; К-А-; К+А-; К-А+. Протеолитические свойства: не образуют индол, желатин не разжижают, образуют H 2 S (исключение, S . paratyphi A ).
Антигенная структура сальмонелл – сложная, имеются О-, Н-, Vi -, М-антигены.
* О – соматический антиген, липополисахарид клеточной стенки, термостабильный, (выдерживает кипячение в течение 2,5 часов, автоклавирование при 1200 С – 30 мин.), чувствительны к формальдегиду, но устойчив к спирту, групповой – согласно классификации Кауфмана-Уайта, семейство делится на 67 серогрупп (А, В, С, Д…). О-АГ состоит из R -ядра и боковой S -цепи, к которой присоединяются сахара – рецепторы (обозначаются цифрами). Общность конечного сахара (по химической природе является 3,6-дидезоксигексозой) является основанием для объединения в серогруппу. Некоторые группы имеют общие О-АГ, но каждая группа содержит один основной антиген: в группе А – 2, в группе В – 4, в группе С – 7, Д – 9…
* Н – жгутиковый антиген, белок флагеллин, термолабильный (разрушается при нагревании до 75-100С, а также под действием соляной кислоты, спирта, протеолитических ферментов), типовой (более 250 сероваров, расположены в алфавитном порядке в таблице Кауфмана-Уайта). У Н-АГ сальмонелл различают 2 фазы: I (специфическая) – различна у серотипов, входящих в одну группу, обозначается строчными латинскими буквами; II (неспецифическая) – содержат в своем составе общие для всей группы компоненты, обозначается арабскими цифрами. Если у серовара присутствуют обе фазы Н-АГ, то его называют двухфазным, если одна – монофазным.
* Vi -АГ – поверхностный полисахаридный антиген S . typhi , являющийся разновидностью К-АГ, термолабильный (разрушается при кипячении за 10 минут), чувствительный к соляной кислоте и спирту, встречается только у вирулентных сальмонелл, препятствует агглютинации О-антисыворотками, является рецептором для бактериофагов.
* М-АГ – слизистый, водонерастворимый, разрушается под действием кислот и спиртов.
* эндотоксин – липополисахарид клеточной стенки, высвобождается при массовой гибели возбудителей, играет основную роль в патогенезе брюшного тифа, оказывая пирогенное и токсическое действие;
* возбудители сальмонеллезов выделят экзотоксины – термолабильный белковый энтеротоксин, сходный с холерогеном и LT -токсином E . coli (увеличивают в клетках эпителия тонкого кишечника содержание цАМФ, что приводит к повышенному выходу воды из клеток и развитию диареи) + цитотоксическое действие, вызывая гибель энтероцитов.
2. Ферменты патогенности: гиалуронидаза, фибринолизин, лецитиназа, муциназа, протеаза, супероксиддисмутаза (инактивирует суперактивные радикалы О2, что придает устойчивость к фагоцитозу).
3. Структурные и химические компоненты клетки:
* белки наружной мембраны – инвазины (обеспечивающие инвазию слизистой и резистентность к фагоцитозу, позволяющую сальмонеллам сохраняться и размножаться внутри фагоцитов);
Резистентность у сальмонелл – достаточно высокая. Выдерживают рН в диапозоне 4-9, в водоемах, сточных водах, почве сохраняют жизнеспособность до 3 месяца, в комнатной пыли – от 80 до 550 дней. Хорошо переносят низкие температуры: во льду сохраняются более 60 дней, в замороженном мясе – 6-13 месяцев (в толще мяса могут сохраняться и после тепловой обработки), размножается в мясном фарше при +50С, в яйцах – до 13 месяцев (при хранении яиц в холодильнике могут проникать через неповрежденную скорлупу и размножаться в желтке), в колбасе – 2-4 месяца, в хлебе – до 3-х месяцев, на овощах и фруктах – 5-10 дней. Хуже выдерживают высокую температуру: при 560 С выдерживают 40-60 минут, при 700 С погибают через 10 минут, при 1000 С – моментально. Чувствительны к дезрастворам в рабочей концентрации (5% фенол, 3% хлорамин, 3% лизол вызывают гибель бактерий через 2-3 минуты) и антибиотикам.
Брюшной тиф (название болезни дал Гиппократ, происходит от греч. typos – туман, спутанное сознание) – острое антропонозное инфекционное заболевание, характеризующееся поражением лимфоидного аппарата тонкого кишечника, бактериемией, выраженной лихорадкой, интоксикацией и розеолезной сыпью. Паратифы А и В сходны по характеру и клиническим проявлениям с брюшным тифом, но протекают более легко.
Сальмонеллезы – группа полиэтиологичных острых зооантропонозных кишечных инфекций, протекающих по типу гастроэнтеритов у взрослых и токсико-септических инфекций у детей.
Источник инфекции: больные и бактерионосители.
Механизм передачи: фекально-оральный (пути: пищевой, водный, контактно-бытовой). Брюшной тиф и паратиф А распространяются чаще водным путем (употребление воды из неглубоких загрязненных водоемов, технических водопроводов, в случаях прорыва канализационных вод). При паратифе В преобладает пищевой путь (заражение чаще происходит через молоко, молочные продукты, кремы, овощные салаты). Бытовой путь реализуется, как правило, через бактерионосителей.
Патогенез и клинические особенности брюшного тифа и паратифов А и В .
1. Стадия внедрения возбудителя: сальмонеллы попадают в организм через рот и преодолев барьеры неспецифической защиты организма, проникают в тонкий кишечник, где происходит их адгезия к энтероцитам за счет пилей I типа.
2. Стадия поражения лимфоидной ткани: поражают пейеровы бляшки тонкого кишечника, в лимфатических фолликулах тонкой кишки сальмонеллы фагоцитируются макрофагами, с которыми проникают сначала в лимфоузлы, затем через грудной проток и в кровь.
3. Бактериемия (конец инкубационного периода): с током крови макрофаги вместе с поглощенными сальмонеллами циркулируют по организму (микроорганизмы могут даже в них размножаться).
4. Интоксикация: под воздействием бактерицидных факторов крови сальмонеллы погибают и при этом высвобождается эндотоксин, обусловливая лихорадку и сильнейшую интоксикацию, которая сохраняется на протяжение всего заболевания. (соответствует периоду выраженных клинических проявлений заболевания, температура тела достигает 39-400С и держится от 4 до 8 недель).
5. Стадия паренхиматозной диффузии: макрофаги с сальмонеллами циркулируют по организму и после гибели фагоцитов микробы могут попасть в различные органы: костный мозг, селезенку, печень, желчный пузырь, кожа и т.д. (воспаление, образование гранулем).
6. Выделительно-аллергическая стадия: вместе с желчью возбудители снова попадают в тонкий кишечник, при повторном контакте с сенсибилизированной лимфоидной тканью развивается гиперчувствительность немедленного типа (феномен Артюса), что приводит к некрозу пейеровых бляшек и образованию язв (кишечные кровотечения, прободение кишечника). По мере накопления антител организм постепенно освобождается от возбудителя – они выделяются со слюной, потом, испражнениями, желчью и мочой.
Инкубационный период – 10-14 дней. Клиника брюшного тифа, паратифов А и В характеризуется циклическим течением и проявляется лихорадкой (повышение температуры тела до 39-400С), интоксикацией, появлением розеолезной сыпи, гепатолиенальным синдромом,нарушениями со стороны нервной (бред, галлюцинации) и сердечно-сосудистой (падение АД, коллапс…) систем. Выздоровление не всегда совпадает с освобождением организма от возбудителей, этот процесс затягивается; 5 % переболевших становятся бактерионосителями.
Патогенез и клинические особенности сальмонеллезов .
Возбудители попадают в организм человека с обсемененными пищевыми продуктами. В желудке происходит частичная гибель сальмонелл. Воротами инфекции являются клетки слизистой тонкого кишечника. Здесь сальмонеллы внедряются между ворсинками, колонизируют и повреждают их. Это вызывает умеренное воспаление слизистой оболочки. Эндотоксин, выделяющийся при разрушении сальмонелл, обуславливает интоксикацию. Вырабатываемый сальмонеллами экзотоксин (энтеротоксин) вызывает диарею и рвоту, нарушение водно-солевого обмена и обезвоживание организма. Он обладает также цитотоксическим действием, вызывая гибель энтероцитов. Сальмонеллы проникают в подлежащие ткани слизистой оболочки, транспортируются через нее в макрофаги и могут поступать в лимфу и кровь, вызывая бактериемию и генерализацию инфекционного процесса.
Короткий инкубационный период – 12-24 часа. Начала заболевания – острое: озноб, повышение температуры до 390С, интоксикация (головная боль, слабость, тошнота), боли в животе, диспептические расстройства (рвота, понос), признаки обезвоживания организма, падение АД. Заболевание протекает обычно в течение 3-5 дней и заканчивается выздоровлением. При генерализованных формах сальмонеллез протекает более тяжело и длительно. Как субклиническую форму сальмонеллеза рассматривают бактерионосительство (острое – до 3 месяцев, хроническое – более 3 месяцев).
Постинфекционный иммунитет при брюшном тифе и паратифах – гуморальный, напряженный, длительный (не менее 15-20 лет, часто пожизненный). Образуются антитела к О-, Н-, Vi-антигенам:
* Первыми к концу 1-й недели заболевания появляются антитела к О-АГ, достигая максимума к периоду разгара (14-15 дней), а затем исчезают.
* Антитела к Н-АГ появляются к концу 2-й недели, достигая максимума в период реконвалесценции и длительно сохраняясь в организме после перенесенного заболевания.
* Антитела к Vi-АГ обнаруживаются у бактерионосителей брюшного тифа.
Постинфекционный иммунитет при сальмонеллезах – гуморальный и клеточный, типоспецифический, ненапряженный и недлительный, опосредован SIgA.
Микробиологические исследования при брюшном тифе и паратифе
Исследуемый материал: выбор материала для исследования при брюшном тифе и паратифах определяется стадией заболевания (инкубационный период – испражнения, продромальный период, 1-я неделя заболевания – кровь на посев, разгар заболевания и период реконвалесценции, с конца 2-ой недели – моча, испражнения, желчь, соскоб из розеол, костный мозг…, кровь на серодиагностику), при сальмонеллезах – испражнения, рвотные массы, промывные воды желудка, пищевые продукты, кровь.
1. Бактериоскопический метод.
2. Бактериологичекий метод (основной).
* Реакция Видаля (развернутая РА с О- и Н-антигенами);
* РНГА с эритроцитарными О-, Н-, Vi-диагностикумами;
4. Молекулярно-биологический метод (ПЦР, ДНК-зонды).
5. Аллергологический метод (кожно-аллергическая проба с эбертином).
Специфическая профилактика проводится по эпидпоказаниям:
— Вакцина ТАБТе – химическая сорбированная вакцина (содержит полные антигены брюшнотифозные, паратифозные А и В, столбнячный анатоксин);
— Брюшнотифозная спиртовая вакцина, обогащенная Vi- антигеном;
Неспецифическая профилактика : ранняя диагностика и изоляция больных, дезинфекция в очаге инфекции, выявление бактерионосителей, соблюдение санитарного режима в детских учреждениях, предприятиях питания, санитарно-бактериологический контроль за работой систем централизованного и нецентрализованного водоснабжения.
Лечение : ХТП и антибиотики; при сальмонеллезах применяется, в основном, патогенетическая терапия, направленная на нормализацию ВЭБ (антибиотики назначают только при генерализованных формах); спецефическое лечение – брюшнотифозные и сальмонеллезные бактериофаги.
источник
Возбудители кишечных инфекций
Общая характеристика семейства Enterobacteriaceae
Острые бактериальные кишечные инфекции – диареи – наиболее распространённые инфекции. Их возбудителями часто являются представители семейства Enterobacteriaceae – оно объединяет бактерии, которым присущи следующие признаки:
1. Короткие неспорообразующие палочки с закруглинными концами;
2. Подвижные (перитрихии) или неподвижные, не образующие или образующие капсулу;
4. Ферментация глюкозы и ряд других углеводов;
5. Непостоянство протеолитических свойств;
6. Факультативные анаэробы в большинстве;
7. Растут на обычных питательных средах и ДДС (Эндо, Левина, Плоскирева);
8. Место обитания – кишечный тракт;
9. Фекально-оральный механизм передачи;
12. Восстанавливают нитраты в нитриты;
14. Могут образовывать ацетоин при ферментации глюкозы (реакция Фогеса-Проскауэра).
Семейство насчитывает более 30 родов и более 100 видов. Наиболее важными для человека являются:
Для дифференцировки родов используют в основном биохимические признаки, для классификации внутри родов и видов изучают антигенное строение (О-, Н- и К- антигены).
Микробиология брюшного тифа
Брюшной тиф – тяжелое инфекционное заболевание с глубокой общей интоксикацией, бактериемией и поражением лимфатического аппарата тонкого кишечника. Интоксикация проявляется сильной головной болью, помрачением сознания и бредом. Брюшной тиф как самостоятельную единицу выделил русский врач А.Г. Пятницкий в 1822 г.
Возбудитель брюшного тифа – Salmonellla typhi – был обнаружен в 1880 году К. Эбертом, а выделен в 1884 г. в чистой культуре К. Гаффки. Вскоре выделены и изучены возбудители паратифов А и В – S. paratyphi A и S. paratyphi B.
Короткие грамотрицательные палочки с закруглинными концами, длиной 1-3,5 мкм и диаметром 0,5-0,8 мкм. Спор не образует, может образовывать микрокапсулу. Подвижные – перитрихии.
Сальмонеллы – факультативные анаэробы. Температурный оптимум – 37˚С, не требовательны к питательным средам. Рост на бульоне сопровождается помутнением и возможен осадок, на МПА – образуют круглые, гладкие полупрозрачные колонии.
На среде Эндо – бледнорозовые гладкие колонии, на висмут-сульфит агаре – черные колонии. В случае диссоциации могут образовывать R- типа колонии. Элективной средой является желчь или желчный бульон (среда Раппорт – желчный бульон, глюкоза, индикатор Андреда, поплавок для улавливания газа) – рост сопровождается помутнением и изменением цвета среды (покраснение).
Для возбудителей брюшного тифа и паратифов характерно:
· Проба с метиленовым красным положительна
· Восстанавливают нитраты в нитриты
· Salmonellla typhi ферментирует глюкозу и другие углеводы только до кислоты
· S. paratyphi A и S. paratyphi B ферментируют углеводы до кислоты и газа
· Salmonellla typhi по способности ферментировать ксилозу и арабинозу подразделяется на 4 типа (1 тип – ферментация ксилозы, 2 тип – не ферментирует ксилозу и арабинозу, 3 тип – ферментирует ксилозу и арабинозу, 4 тип – ферментация арабинозы)
Сальмонеллы имеют О- и Н- антигены. По О-антигену они подразделяются на 50 серогрупп, а по Н-антигену на серотипы. Специфичность О-антигена определяется полисахаридом ЛПС. Н- антиген имеет две фазы: I фаза – специфическая и включает более 80 вариантов, II фаза – неспецифическая и включает 9 вариантов.
Также есть поверхностный антиген вирулентности – Vi-антиген. Количественное содержание Vi-антиген сольно варьируется, поэтому выделяют по Ф. Кауффману 3 группы: 1 – чистые Vi-формы, 2- малые Vi-формы и 3 – промежуточные Vi-формы.
О-, Н- и Vi-антигены имеют выраженные иммуногенные свойства.
Сальмонеллы также могут иметь К-антиген.
Для серологической классификации сальмонелл принята классификация по Кауффману-Уайту, для идентификации сальмонелл применяют диагностические адсорбированные моно – поливалентные О- и Н- сыворотки. Также культуры сальмонелл тифа и паратифа можно подвергать фаготипированию, так как этот признак является стабильным и имеет эпидемиологическое значение.
Возбудители брюшного тифа и паратифов во внешней среде (вода, почва, пыль) сохраняются от нескольких дней до нескольких месяцев. В проточной воде могут выживать до 10 дней, в застойной – до 4 недель, на овощах и фруктах – 5-10 дней, на посуде – до 2 недель, в масле и сыре – до 3 месяцев, во льду – до 3 месяцев. Нагревание при 60˚С убивает через 30 мин., кипячение – мгновенно. Обычные химические дезинфектанты (хлор) убивают сальмонелл через несколько минут.
1. Vi-антиген – адгезия, проникновение, антифагоцитарная активность.
2. Эндотоксин – обладает высокой токсичностью.
3. Ферменты агрессии – ДНК-аза, гиалуронидаза, фибринолизин и т.п. (встречается редко).
Источник – больной или бактерионоситель, могу быть и животные (в том числе и птица).
Механизм передачи – фекально-оральный (вода, пища, молоко), возможен контактно-бытовой через предметы личного пользования. Восприимчивость высокая.
Инкубационный период – 7-25 дней. В патогенезе выделяют стадии:
1. Стадия вторжения – проникает в тонкий кишечник через рот.
2. Стадия инвазии – через лимфатические пути проникают в лимфоидные образования подслизистой оболочки тонкого кишечника (пейеровы бляшки и солитарные фолликулы) и, размножаясь в них, вызывают лимфангоит и лимфаденит (брюшнотифозные гранулы).
3. Бактериемия – выход возбудителя в кровоток, начинается в конце инкубационного периода и продолжается в течение всей болезни.
4. Стадия интоксикации вследствие распада бактерий и высвобождение эндотоксина.
5. Стадия паренхиматозной диффузии – из крови сальмонеллы поглощаются макрофагами и разносится по всему организму. Возбудитель накапливается в желчных ходах печени, в желчном пузыре, где повторно размножаются. Также возбудитель обнаруживается в селезенке, лимфатических узлах, костном мозге, коже, почках и мочевыводящих путях и других органах.
6. Выделительно-аллергическая стадия – начинается процесс освобождения от возбудителя через кишечник, потовые, молочные и слюнные железы, мочевыделительную систему, печень и желчный пузырь. Выделяющиеся из желчного пузыря сальмонеллы опять поступают в тонкий кишечник, откуда часть с испражнениями, а часть вновь вторгается в лимфатические узлы. Вторичное внедрение в уже сенсибилизированные узлы вызывает гиперергическую реакцию в виде некроза и образования язв, что опасно прободением стенки кишечника, внутреннего кровотечения и развитием перитонита.
7. Стадия выздоровления – заживление язв, очищение от некротических налетов, восстановление функций организма.
Клинически инфекция характеризуется следующими симптомами:
1. Постепенное повышение температуры до 40-42˚С и длительная волнообразная лихорадка.
2. Сильнейшая интоксикация и диарея.
3. Розеолёзная сыпь на коже живота, груди и спины в следствие местных воспалительных процессов в поверхностных слоях кожи.
4. Сильная головная боль, помрачение сознания и бред.
Исходами заболевания могут быть – выздоровление, хроническое носительство (5%) и смерть.
Прочный, продолжительный, повторные заболевания бывают редко. Иммунитет обусловлен антителами к О-, Н- и Vi-антигенам, клетками иммунной памяти и активностью фагоцитов.
Основные методы – бактериологический и серологический.
Материал для исследования:
ü Кровь (гемокультура) – 1 неделя.
ü Испражнения (копрокультура) – с 2 и 3 недели.
ü Моча (уринокультура) – с конца 2 недели.
ü Желчь (биликультура) – с 2 недели.
ü Пунктат костного мозга (миелокультура) – с 1,2 недели.
ü Экссудат розеол (розеолокультура) – с 2,3 недели.
1 этап: кровь засевают на среду Рапопорт в соотношении 1:10 (на 10 мл среды 1 мл крови) и инкубируют при 37˚С до 8 дней.
2 этап: учет результатов в ср. Рапопорт (помутнение, осадок, покраснение среды, образование газа — S. paratyphi A и S. paratyphi B, без образования газа — Salmonellla typhi) и пересев на среду Эндо или висму-сульфит агар. Инкубируют при 37˚С , 24 часа.
3 этап: учет результатов на ДДС. На среде Эндо – бледнорозовые гладкие колонии, на висмут-сульфит агаре – черные колонии. Изучение морфологических и тинкториальных свойств колоний. Пробная реакция агглютинации на стекле с поливалентной сальмонеллезной сывороткой. Пересев подозрительных колоний на среду Ресселя (глюкоза и лактоза) или Клиглера для выделения чистой культуры.
4 этап: идентификация чистой культуры с изучением морфологических, тинкториальных и биохимических свойств (см. выше). Сероидентификация с диагностическими моносыворотками Salmonellla typhi, S. paratyphi A и S. paratyphi B. Проведение фаготипирования со специфическими сальмонеллезными бактериофагами. Антибиотикочувствительность выделенного возбудителя.
Выделение копрокультуры, уринокультуры и биликультуры:
Предварительно засевают материал на среды обогащения (селенитовый бульон в соотношении 1:5), а затем со среды обогащения пересевают на ДДС — Эндо или висму-сульфит агар – с целью выделения изолированных колоний и получения чистой культуры на среде Ресселя. Схема изучения и идентификации аналогична как при выделении гемокультуры.
Материал – сыворотка больного с конца 1 недели болезни. Используют реакцию Видаля с раздельными О- и Н- диагностикумами сальмонеллы тифа, паратифозными А и В диагностикумами.
Реакция по механизму относится к развернутой реакции агглютинации в пробирках. Первоначально делают базовое разведение сыворотки больного с физиологическим расвором 1:50 (0,1 мл сыворотки и 4,9 мл физ.р-ра). Затем основные разведения – 1:100, 1:200, 1:400, 1:800, 1:1600 в объеме 1 мл физиологического раствора. Таким образом необходимо сделать 4 ряда разведений сыворотки больного для соответсвующего диагностикума. Инкубируем пробирки 2 часа при 37˚С и ещё 18 часов при комнатной температуре. Учет результатов производим по степени агглютинации, определяя титр сыворотки больного к опредиленному диагностикуму. Минимально диагностический титр 1:200.
Раньше всего появляются антитела к О-антигену, но титр их снижается после выздоровления (инфекционный Видаль). Н-антитела появляются позднее и сохраняются после болезни и прививок годами (анамнестический и вакцинальный Видаль).
Для определения антигенов в крови и испражнениях больных могут быть использованы РСК, РПГА, ИФА с антительными диагностикумами. Для ускоренной диагностики можно использовать ДНК-зондирование.
Материал – желчь, моча, испражнения, сыворотка человека.
· Бактериологический для выявления копрокультуры, уринокультуры и биликультуры (см. выше).
· Серологический – РПГА с эритроцитарными О-, Н- и Vi – диагностикумами для обнаружения специфических антител.
· Аллергическая проба с Vi-тифином, который дает местную реакцию в виде покраснения и припухлости в течение 20-30 минут, что говорит о наличии Vi-антител брюшного тифа у человека.
· Антибиотикотерапия (левомицетин, ампициллин, тетрациклины).
· Симптоматическая и патогенетическая терапия.
· Вакцинация в очагах инфекции (химическая сорбированная брюшнотифозная моновакцина, TABte – тифо-паратифозно-столбнячная вакцина).
· Противоэпидемиологические и санитарно-гигиенические мероприятия – выявление, изоляция и лечение больных и бактерионосителей; введение карантина по эпидемиологическим показаниям, проведение мероприятий по бактериологическому контролю и дезинфекции окружающей среды, воды, пищи и различных объектов в очаге инфекции; наблюдение за контактными лицами.
Дата добавления: 2015-12-16 | Просмотры: 1568 | Нарушение авторских прав
источник
• Микробиологическая диагностика брюшного тифа и паратифов
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: исходя из особенностей патогенеза брюшного тифа, на 1-й неделе заболевания, в период бактериемии, возбудителей выделяют из крови (получение гемокультуры), со 2-й недели заболевания — из испражнений (получение копрокультуры), мочи или желчи.
Бактериологическое исследование(схема 13.2.1).
Получение гемокультуры. В 1-й день из локтевой вены больного берут 5—10 мл крови и засевают в колбу с 50—100 мл селективной среды Раппопорт, содержащей желчный бульон (для подавления роста других бактерий), глюкозу, индикатор Андреде и поплавок для обнаружения газа. Указанные соотношения крови и среды необходимы для подавления бактерицидного действия белков крови. Посевы инкубируют при 37 «С в течение 18—20 ч. На 2-й день при росте сальмонелл наблюдается помутнение и изменение цвета среды. При росте паратифозных бактерий (биовары paratyphi А, Си schottmuelleri) наряду с указанными изменениями появляются пузырьки газа в поплавке. Для ускорения ответа из среды Раппопорт делают мазки и препараты «висячая» капля. При наличии чистой культуры грамотрицательных подвижных палочек и изменении цвета среды (или наличии газа) дают первый предварительный ответ. Затем культуру из среды Раппопорт пересевают в пробирку со средой Ресселя, полагая при этом, что из крови выделена чистая культура и можно сразу приступить к ее идентификации. Одновременно со среды Раппопорт делают посевы на среду Эндо для получения изолированных колоний с целью проверки чистоты выделенной культуры.
На 3-й день отмечают ферментацию глюкозы на среде Ресселя и ставят ориентировочную реакцию агглютинации на стекле. На основании полученных данных дают второй предварительный ответ. Для дальнейшего исследования отбирают несколько бесцветных колоний со среды Эндо и пересевают их в среду Ресселя или скошенный питательный агар (для контроля полученных результатов). Чистую культуру пересевают на среды «пестрого» ряда и серотипируют в реакции агглютинации на стекле со смесью групповых сывороток, а затем с
адсорбированными монорецепторными О- и Н-сальмонеллез-ными сыворотками. Окончательный диагноз устанавливают на основании биохимических (табл. 13.2.1) и антигенных свойств.
Таблица 13.2.1. Биохимические свойства сальмонелл — возбудителей брюшного тифа и паратифов
| Биовар S.enterica | Ферментация | Образование | |||||
| лактозы | глюкозы | мальтозы | сахарозы | ман-нита | H2S | NH3 | индола |
Paratyphi А — КГ КГ — КГ — —
Schottmuelleri — КГ КГ — КГ + +
Условные обозначения: К — образование кислоты; КГ — образование кислоты и газа; (+) — обнаружение признака; (—) — отсутствие признака.
Биохимические признаки (развернутый «пестрый» ряд) позволяют дифференцировать сальмонеллы от схожих сними энтеробактерий: Citrobacter, Hafnia (табл. 13.2.2).
Таблица 13.2.2. Дифференциация сальмонелл и других энтеробакте рий по биохимическим признакам
| Род | Лизин- декар- бокси- лаза | Ферментация углеводов | р- Галак-този-даза | ||
| дуль-цита | сорбита | ксилозы | рам-нозы | салицина | 4% лактозы |
Citrobacter — К(-) К К К К(±) К(±) К
Hafnia + — — К К К(+) — К
Условные обозначения: (+) — положительная реакция; (—) — отрицательная реакция; ± — вариабельная реакция; К — образование кислоты; К(—) — образование кислоты (редко); К(±) — образование кислоты (вариабельно).
Выделенную чистую культуру бактерий используют для определения чувствительности к антимикробным препаратам.
Фаготипирование. С помощью набора стандартных Vi-фагов определяют до 78 фаготипов S.enterica биовара typhi. При этом необходимым условием является наличие в культуре FZ-антигена. Культуры S.enterica биовара paratyphi В (schottmuelleri) дифференцируются на11 фаготипов и подтипов.
Получение копрокультуры. Испражнения засевают на одну из дифференциально-диагностических сред (Эндо или Левина) или элективные среды обогащения (Мюллера, селени-
товая или висмут-сульфит агар). Для посева петлю фекалий вносят в пробирку с изотоническим раствором хлорида натрия и готовят суспензию. После оседания крупных комочков суспензию петлей наносят на поверхность агаровой среды — на одну половину чашки. Материал тщательно растирают шпателем по одной, а затем по другой половине чашки для получения изолированных колоний. Посевы инкубируют при 37 °С в течение 18—20 ч. На 2-й день изучают характер колоний, выросших на чашках (рис. 13.2.1; на вклейке), пересевают 2—3 бесцветные колонии (со среды Эндо или Левина) или колонии черного цвета (висмут-сульфит агар) на среду Ресселя и в пробирки со скошенным питательным агаром. При отсутствии подозрительных колоний на чашках делают высевы из среды Мюллера или селенитовой среды на чашки со средой Эндо для получения изолированных колоний. Для ускорения ответа ставят ориентировочную реакцию агглютинации на стекле с материалом, взятым из бесцветной колонии. Далее поступают так же, как и при идентификации гемокультуры.
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования.Молеку-лярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз.
Серодиагностика. Влабораторной практике широко применяют развернутую реакцию агглютинации Видаля, основанную на обнаружении в сыворотке крови людей антител — агглютининов, которые появляются в конце 1-й — начале 2-й недели заболевания. Реакцию ставят одновременно с четырьмя антигенами: О- и Н-брюшнотифозными, А- и В-паратифозными диагностикумами. Брюшнотифозные монодиагностикумы применяют для установления стадии болезни, так как содержание О- и Н-антител в разные ее периоды неодинаково. О-антитела появляются на 1-й неделе, накапливаются в разгар заболевания и исчезают к моменту выздоровления. Н-антитела появляются в разгар заболевания, накапливаются к концу заболевания и сохраняются у переболевших в течение длительного времени. У людей, вакцинированных против брюшного тифа и парати-фов, также наблюдается положительная реакция Видаля, причем в довольно высоком титре, поэтому «инфекционный Ви-даль» удается отличить от «прививочного» только по нарастанию титра агглютининов у больных в процессе заболевания. Реакцию Видаля ставят в четырех рядах пробирок по 7 пробирок в каждом ряду, из которых 5 опытных и 2 контрольные. Для контроля каждого диагностикума в пробирки вносят по 1 мл изотонического раствора хлорида натрия, в который добавляют 2 капли диагностикума. В контрольной пробирке с
1 мл сыворотки (без диагностикума) не должно быть хлопьев. При спонтанной агглютинации реакция не учитывается. Диагностический титр реакции Видаля равен 1:200. Для серологического исследования реконвалесцентов и выявления бактерионосителей широко используют реакцию непрямой И-гемаг-глютинации, с помощью которой в сыворотке крови людей определяют присутствие антител к К/-антигену. В качестве антигена используют эритроцитарный Р?-диагностикум, представляющий собой взвесь эритроцитов человека 1(0) группы, обработанных формалином и сенсибилизированных Fz’-антиге-ном S.enterica биовара typhi. Готовят разведения испытуемой сыворотки от 1:10 до 1:1280. При положительной реакции эритроциты покрывают дно пробирки в виде диска с зазубренными краями, а надосадочная жидкость остается прозрачной. При отрицательной реакции, так же как и в контроле, эритроциты осаждаются на дно пробирки и имеют виддиска с ровными краями («пуговки»). Диагностическое значение имеет титр пассивной Й-гемагглютинации, начиная с 1:40 и выше. Всех лиц, сыворотка крови у которых дает положительный результат в РНГА с эритроцитарным F/f-диагностикумом, рассматривают как подозрительных на носительство S.enterica биовара typhi и подвергают многократному бактериологическому обследованию.
• Микробиологическая диагностика сальмонеллезов
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: испражнения, при генерализованной форме — кровь.
МЕТОДЫ ДИАГНОСТИКИ: микробиологическая диагностика сальмонеллезов принципиально не отличается от диагностики брюшного тифа и паратифов. Серодиагностика не применяется по причине большого числа сероваров возбудителей.
• Микробиологическая диагностика кишечного иерсиниоза
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: испражнения, при генерализованной форме — кровь, моча, спинномозговая жидкость.
МЕТОДЫДИАГНОСТИКИ:
Бактериологическое исследование.Посев материала на дифференциально-диагностические (среда Эндо, Мак-Конки, СБТС-агар с желчью и бромтимоловым синим) и селективные (CIN-arap с антибиотиками цефсулодином и новобиоцином) плотные среды или жидкие среды обогащения (буферно-казе-иново-дрожжевой бульон, 1 %, пептонная вода с рН 7,6—7,8). Посевы инкубируют при 25 «С в течение 24—48 ч. Идентификация чистой культуры осуществляется на основании морфологии, подвижности, тинкториальных свойств (грамотрица-
тельные палочки с закругленными концами и характерным биполярным окрашиванием, неспорообразующие, перитрихи), культуральных, биохимических признаков.
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования.Молеку-лярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР.В случае обнаружения соответствующих молекул можно поставить предварительный диагноз.
Серодиагностика.Диагностическое значение имеет обнаружение антител к поверхностным антигенам возбудителей наиболее распространенных серотипов (03, 04, 05, 06, 08, 09) в РА. Положительной считается РА в титре не менее 1:160. Разработаны также ИФА-тесты.
• Микробиологическая диагностика кишечного дисбактериоза
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: фекалии. МЕТОДЫ ДИАГНОСТИКИ:
Бактериоскопическое исследование.Имеет ориентировочное значение. При резко выраженном дисбактериозе в мазках преобладают микроорганизмы определенных видов (например, дрожжеподобные грибы, стафилококки и др.) на фоне существенного уменьшения грамотрицательной микрофлоры.
Бактериологическое исследование.Проводится количественное исследование состава микрофлоры кишечника. Для этого из исследуемого материала готовят разведения Ю -2 , 10 -4 , Ю -6 и т.д. Первичные посевы по 0,1 мл каждого разведения производят параллельно на несколько питательных сред (Эндо, кровяной агар, ЖСА, агар Сабуро и др.) и инкубируют при 37 °С. Подсчитывают число выросших колоний и определяют число КОЕ в 1 г материала. Проводят отсев 2—3 колоний каждого вида для выделения и идентификации чистых культур микроорганизмов.
Дляобнаружения анаэробных Bifidobacterium spp. делают мерные посевы материала в разведениях 10″ 7 и выше в пробирки с 13—15 мл модифицированной среды Блаурокка, в состав которой входит печеночный бульон, пептон — 1 %, лактоза — 1 %, хлорид натрия — 0,5 %, цистин — 0,01 %, агар-агар — 0,75%, твин-80 — 0,1 %. При росте Bifidobacterium spp. через 24—48 ч происходит помутнение всей среды с образованием тяжей или отдельных колоний. Готовят мазки и окрашивают по методу Грама. Выделение чистых культур Bifidobacterium spp. является весьма трудоемким и практически необязательным. При необходимости идентификацию представителей рода осуществляют по биохимическим свойствам.
Для оценки результатов бактериологического исследования
сопоставляют полученные данные с количественным содержанием микроорганизмов в норме. Ориентировочные критерии нормальной микрофлоры толстой кишки представлены в табл. 13.2.3.
Таблица 13.2.3. Критерии нормы кишечной флоры
Патогенные микробы сем. Enterobacteriaceae О
Общее количество E.coli, млн/г 300—400
E.coli со слабовыраженными ферментативными
свойствами, % До 10
E.coli с гемолитическими свойствами, % Нет
Энтеробактерии (лактозоотрицательные и лактозополо
жительные): Hafnia, Aerobacter, Citrobacter, Klebsiella,
Serratia, % До 5
Гемолитический стафилококк по отношению ко
всем кокковым формам, % Нет
Bifidobacterium spp. (рост при посеве разведения) 10 и выше
Бактерии рода Proteus Нет
При кишечном дисбактериозе происходит значительное снижение облигатной анаэробной микрофлоры, и в первую очередь Bifidobacterium spp., а также увеличение аэробных видов, в частности E.coli, содержание которых может превышать 10 11 микробных клеток в 1 г испражнений. Увеличивается частота обнаружения штаммов E.coli со слабой ферментацией лактозы и имеющих гемолитические свойства (до 30—40 %), гемолитических и негемолитических стафилококков, бактерий рода Proteus, грибов рода Candida (до 15—16 %). У лиц с дис-бактериозами более часто обнаруживают лактозоотрицательные и лактозоположительные энтеробактерии, относящиеся к родам Hafnia, Aerobacter, Citrobacter. Для микроорганизмов, в норме отсутствующих в испражнениях или имеющихся в небольшом количестве, показателем дисбактериоза будет содержание их 10 5 —10 6 и выше КОЕ в 1 г материала (Proteus spp., Klebsiella pneumoniae, Pseudomonas aeruginosa, Staphylococcus aureus, Candida spp.). Для окончательного заключения о кишечном дисбактериозе важное значение имеет повторное его выявление в динамике обследования больного.
• Диагностические, профилактические и лечебные препараты
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Да какие ж вы математики, если запаролиться нормально не можете. 8271 — 

193.124.117.139 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник
Изобретение относится к медицине, может быть использовано при бактериологическом исследовании крови на гемокультуру сальмонелл. Среда содержит агар и натрий углекислый, желчь бычью, питательный бульон из рыбы, маннит, феноловый красный. Среда обладает высоким накопительным эффектом и обеспечивает четкую дифференциацию паратифозных бактерий от тифозных по признаку газообразования. 1 табл.
Изобретение относится к медицине, а именно к клинической микробиологии, и может быть использовано при бактериологическом исследовании крови на гемокультуру.
Метод получения гемокультуры является наиболее ранним и надежным методом бактериологической диагностики сальмонелл брюшного тифа и паратифов.
Известны среды для выделения гемокультуры сальмонелл: желчный бульон, бульон с 1% глюкозой, стерильная дистиллированная вода (1). Недостатком желчного бульона является то, что он не позволяет дифференцировать сальмонеллы по признаку газо- и кислотообразования, так как в его составе отсутствует индикатор и углевод. Глюкозный бульон обладает низким накопительным эффектом, так как не подавляет бактерицидные свойства крови. Дистиллированная вода не обладает накопительным эффектом ввиду отсутствия питательных веществ, ей присущи также и все другие указанные выше недостатки.
Наиболее близким решением задачи того же назначения по совокупности признаков и достигаемому эффекту является среда Рапопорт, предназначенная для выделения и накопления гемокультуры сальмонелл (4). Среда содержит в качестве источника азота бульон мясопептонный или Хоттингера, в качестве источника углерода — глюкозу, в качестве компонента, препятствующего свертыванию крови и подавляющего ее бактерицидное действие, — желчь, в качестве индикатора кислотообразования — индикатор Андреде.
К причинам, препятствующим достижению указанного ниже технического результата при использовании известной среды, принятой за прототип, являются слабые накопительные и дифференцирующие свойства среды, что вызывает необходимость инкубации посевов в течение 6-10 суток (2, 3). По этой причине удлиняются сроки постановки диагноза.
Задача предлагаемого изобретения — повышение накопительных и дифференцирующих свойств среды.
Указанный технический результат при осуществлении изобретения достигается тем, что предлагаемая среда дополнительно содержит агар и натрий углекислый, в качестве источника азота содержит питательный бульон из рыбы, в качестве источника углерода — маннит, в качестве индикатора кислотообразования — феноловый красный при следующем соотношении компонентов, г/л: Питательный бульон из рыбы — 10 — 20 Желчь бычья — 10 — 20 Маннит — 10 -20 Агар — 1,0 — 2,0 Феноловый красный — 0,03 — 0,05 Натрий углекислый — 0,2 — 0,4 Вода дистиллированная — До 1 л Внесение в среду дополнительного агара, обладающего высокой сорбционной способностью, нейтрализует продукты метаболизма бактерий и предохраняет клетки от их токсического действия, а высокая питательность рыбного бульона способствует повышению накопительных свойств среды.
Введение в предлагаемую среду маннита вместо глюкозы и дополнительно натрия углекислого обеспечивает более интенсивное образование бактериями газа, а агар способствует удерживанию пузырьков газа на поверхности и в толще среды, что позволяет провести четкую дифференциацию паратифозных бактерий, продуцирующих газ, от тифозных, не обладающих этим признаком.
Использование в среде индикатора фенолового красного, обладающего высокой чувствительностью к изменению pH среды, происходящего в результате сбраживания маннита сальмонеллами, позволяет провести визуальную оценку изменения цветной реакции среды.
Среду получают следующим образом.
Пример 1. В 0,5 л дистиллированной воды последовательно растворяют 10 г питательного бульона из рыбы (ФС 3505-98), 10 г сухой бычьей желчи, 10 г маннита, 1 г агара, 0,2 г натрия углекислого, 0,03 г фенолового красного, объем смеси доводят дистиллированной водой до 1 л воды. Смесь нагревают до полного расплавления агара, разливают во флаконы (по 100 мл) и стерилизуют при 115 o C в течение 20 мин. Контроль качества среды осуществляют путем посева во флаконы тест-штаммов S.typhi Н901, S.paratyphi А и В из разведения 10 -6 (100 клеток). После инкубации посевов в термостате при 37 o C в течение 18-24 ч отмечают наличие роста (помутнение среды), а также, газо- и кислотообразование. Одновременно осуществляют высев из каждого флакона по 0,1 мл взвеси на чашки с питательным агаром. Через 18-24 ч инкубации посевов в термостате при 37 o C осуществляют подсчет сформировавшихся колоний и определяют количество микробных клеток в 1 мл среды (накопительный эффект).
Качество среды оценивают также визуально по наличию газа и по изменению цвета среды.
Пример 2. Отличается от примера 1 тем, что в 0,5 л дистиллированной воды последовательно растворяют 15 г питательного бульона из рыбы, 15 г сухой желчи, 15 г маннита, 1,5 г агара, 0,3 г натрия углекислого, 0,04 г индикатора фенолового красного, объем смеси доводят дистиллированной водой до 1 л. Далее согласно примеру 1.
Пример 3. Отличается от примера 1,2 тем, что в 0,5 л дистиллированной воды последовательно растворяют 20 г питательного бульона из рыбы, 20 г сухой желчи, 20 г маннита, 2,0 г агара, 0,4 г натрия углекислого, 0,05 г индикатора фенолового красного, объем смеси доводят дистиллированной водой до 1 л. Далее согласно примеру 1.
Результаты бактериологического контроля предлагаемой и известной сред представлены в таблице.
Данные таблицы свидетельствуют о заметном превосходстве предлагаемой среды перед известной. Так, накопительный эффект предлагаемой среды более чем 100 раз превосходит известную среду, что делает возможным выявление сальмонелл при меньшем их исходном количестве в исследованном материале (крови).
Дифференцирующие свойства по признаку газообразования более выражены на предлагаемой среде.
Указанные преимущества предлагаемой среды повышают эффективность диагностики тифо-паратифозной инфекции при исследовании крови на гемокультуру.
Источники информации 1. Справочник по микробиологическим и вирусологическим методам исследования. Под ред. М.О. Биргера. М.: Медицина, 1982, стр. 5.
2. Ф. К. Черкес, Л.Б. Богоявленская, Н.А. Бельская. Микробиология. М.: Медицина, 1986, стр. 286.
3. Энтеробактерии. Руководство. Под ред. В.И. Покровского. М.: Медицина, 1985, стр. 31.
4. Там же, стр. 262 (прототип).
Питательная среда для выделения гемокультуры сальмонелл брюшного тифа и паратифов, содержащая источник азота, источник углерода, желчь бычью, индикатор, дистиллированную воду, отличающаяся тем, что она дополнительно содержит агар и натрий углекислый, в качестве источника азота содержит питательный бульон из рыбы, в качестве источника углерода — маннит, в качестве индикатора кислотообразования — феноловый красный при следующем соотношении компонентов, г/л:
Питательный бульон из рыбы — 10 — 20
Желчь бычья — 10 — 20
Маннит — 10 — 20
Агар — 1,0 — 2,0
Феноловый красный — 0,03 — 0,05
Натрий углекислый — 0,2 — 0,4
Вода дистиллированная — До 1 л
TK4A — Поправки к публикациям сведений об изобретениях в бюллетенях «Изобретения (заявки и патенты)» и «Изобретения. Полезные модели»
Напечатано: Адрес для переписки: 367025, г. Махачкала, ул. Леваневского, 24, НПО “Питательные среды”
Следует читать: Адрес для переписки: 119021, Москва, Зубовский б-р, 4, ФГУП “НПО “Микроген”, патентно-лицензионный отдел
Номер и год публикации бюллетеня: 31-2001
источник
Сайт предоставляет справочную информацию исключительно для ознакомления. Диагностику и лечение заболеваний нужно проходить под наблюдением специалиста. У всех препаратов имеются противопоказания. Консультация специалиста обязательна!
Брюшной тиф относится к заболеваниям, уровень распространенности которых во многом зависит от социально-экономических условий. Так, в прошлом вспышки этой болезни приходились на период войн, экономического кризиса и других социальных бедствий.
С учетом статистических данных Всемирной Организации Здравоохранения, все страны мира в зависимости от распространенности брюшного тифа условно делятся на несколько групп. В первую группу входит Канада, Бельгия, Швеция и другие страны с высоким уровнем экономического развития. В этих регионах на 100 000 человек приходится не больше 1 ежегодного случая этой инфекции. К последней группе относятся такие страны как Чили, Колумбия, Перу. Ежегодно в этих странах регистрируется более 30 случаев заболевания на 100 000 человек.
На территории Российской Федерации с 2007 года число случаев брюшного тифа значительно уменьшилось. Если с 2003 по 2006 год ежегодное количество пациентов варьировало от 150 до 180, то с 2007 по 2013 год этот показатель не превышал 80 человек. В 2014 году было зарегистрировано 14 больных (13 взрослых и 1 ребенок).
Возбудителем брюшного тифа является Salmonella typhi – подвижная палочка со сложным антигенным строением. Это довольно устойчивая во внешней среде бактерия, которая сохраняется в течение многих месяцев в водоемах, почве, овощах и фруктах, а также в молочных продуктах (в них сальмонеллы могут длительное время размножаться). Бактерии можно убить 96-процентным этиловым спиртом или 3-процентным раствором хлорамина. Основной характеристикой сальмонелл является сложная антигенная структура. Она представлена соматическим и жгутиковым антигеном.
Сальмонеллы продуцируют и выделяют сильный эндотоксин, который и определяет клиническую картину заболевания.
К антигенной структуре сальмонелл относятся:
- О-соматический антиген, представлен липосахаридным, устойчивым к действию высоких температур комплексом;
- Н-жгутиковый антиген, быстро разрушающийся под действием высоких температур.
Бактерии брюшного тифа способны к L-трансформации, то есть могут переходить в хроническую форму. При этом процессе бактерии как бы засыпают, но сохраняют свои патогенные свойства. Через некоторое время, когда иммунные силы человека снижаются, они вновь активируются. Этим объясняется возможность длительного персистирования (нахождения) бактерий в организме.
Брюшной тиф относится к инфекциям с фекально-оральным механизмом передачи, что означает, что проникновение патогенных бактерий в организм происходит преимущественно через рот. Заражение может осуществляться пищевым или водным путем. В почве или воде сальмонеллы сохраняются длительное время, что и делает этот путь заражения наиболее частым. Контактный или бытовой путь заражения встречается исключительно редко, в основном у детей. Это может происходить при непосредственном контакте с источником инфекции (например, ребенок может взять в рот игрушку, которая была заражена сальмонеллами).
Попадая через ротовую полость в организм человека, сальмонеллы далее мигрируют в кишечник. Известно, что внедрение возбудителя происходит в подвздошной кишке, которая является отделом тонкого кишечника. Изначально бактерии начинают паразитировать в скоплениях лимфатической ткани подвздошной кишки. Потом вместе с током лимфы они проникают уже в мезентериальные лимфатические узлы. Здесь они также начинают интенсивно размножаться, а достигнув определенной концентрации, проникают в кровь. Находясь в лимфатических узлах, сальмонеллы не только растут и размножаются в них, но и запускают развитие воспалительного процесса. Период времени с момента попадания бактерий в организм и до их выхода в кровь называется периодом инкубации. После его окончания появляются первые симптомы заболевания. Известно, что для возникновения заболевания необходимо, чтобы в желудочно-кишечный тракт попало не менее 10 миллионов микробных клеток. В кишечном тракте их концентрация может достигнуть одного миллиарда.
Попадая в кровь, сальмонеллы приводят к развитию бактериемии. Бактериемией называется циркуляции в крови (которая в норме стерильна) бактерий. Этот процесс совпадает с появлением первых симптомов брюшного тифа и окончанием периода инкубации. Чем массивнее бактериемия, тем сильнее и выраженнее симптомы заболевания.
Патогенезом называется весь комплекс механизмов, необходимых для развития болезни. При брюшном тифе патогенез реализуется на нескольких этапах.
Этапами патогенеза брюшного тифа являются:
- проникновение сальмонелл в желудочно-кишечный тракт вместе с источником заражения (едой, водой);
- внедрение бактерий в слизистую подвздошной кишки;
- размножение сальмонелл в солитарных фолликулах и пейеровых бляшках, откуда они мигрируют в мезентериальные лимфатические узлы;
- развитие воспаления в мезентериальных лимфатических узлах и увеличение концентрации сальмонелл в них;
- выход бактерий в кровь и развитие бактериемии;
- распространение с током крови бактерий по всем органам и тканям;
- формирование очагов инфекции в селезенке, печени и других органах.
Важным моментом в патогенезе брюшного тифа является бактериемия. Она бывает первичной и вторичной. Первичная бактериемия – это, когда сальмонеллы впервые из лимфатических узлов попадают в кровь. Однако когда бактерии попадают в кровь, они гибнут вследствие ее бактерицидного действия. Погибая, они выделяют эндотоксин, который обладает нейротропным действием. Таким образом, часть бактерий, находящихся в кровеносном русле, постоянно погибает и выделяет эндотоксин. Чтобы продлить циркуляцию сальмонелл, из внутренних органов в кровь вновь начинают мигрировать бактерии. Процесс выхода сальмонелл в кровь уже из внутренних органов называется вторичной бактериемией.
Таким образом, развивается порочный круг – бактерии выходят в кровь, где они погибают и выделяют эндотоксин, а им на смену поступают новые сальмонеллы из внутренних органов и лимфатических узлов. В то же время, эндотоксин, обладая сильнейшим нейротропным эффектом, определяет клиническую картину брюшного тифа.
Эффектами эндотоксина сальмонелл являются:
- нейротоксическое действие с поражением центральной нервной системы и развитием токсической энцефалопатии;
- поражение нервных окончаний и вегетативных ганглий, что приводит к развитию язв на слизистой кишечника;
- кардиотоксическое действие, которое проявляется в дистрофических изменениях сердца, что в конечном итоге приводит к развитию токсического миокардита;
- нарушение тонуса периферических сосудов, приводящее к падению артериального давления и развитию коллапса;
- развитие инфекционно-токсического шока, что сопровождается нарушением водно-электролитного баланса;
- поражение почек и развитие синдрома «шоковая почка».
Все эти эффекты приводят к развитию многочисленных симптомов и обуславливают разнообразную клиническую картину.
Источником сальмонеллы тифа для здорового человека в большинстве случаев является бактерионоситель. Носителем называют того, кто практически оставаясь здоровым, не проявляя никаких признаков болезни выделяет в окружающую среду патогенные бактерии. Выделение может продолжаться от нескольких недель до нескольких десятков лет. Данный феномен может объясняться несколькими причинами. В первую очередь, это может быть бактерионоситель-реконвалесцент, то есть выздоравливающий после перенесенного заболевания человек. В период выздоровления бактерионосительство может быть как кратковременным, так и длительным. Кратковременное носительство наблюдается при дизентерии или при дифтерии (от 3 до 4 месяцев). Что касается брюшного тифа, то в данном случае носительство затягивается до 10 лет.
Отдельной категорией бактерионосительства являются иммунные носители. Это те лица, которые ранее были привиты.
Источником инфекции также могут быть больные с атипичными формами брюшного тифа. В этом случае заболевание протекает без классических симптомов и поэтому не диагностируется вовремя. Люди с такими формами брюшного тифа длительное время лечатся амбулаторно (то есть на дому) и остаются не изолированными от членов семьи. В этом случае, заражение может происходить при употреблении зараженной пищи, воды. Большую опасность представляют собой молочные продукты, так как в них бактерии могут не только длительное время сохраняться, но и размножаться.
Восприимчивость населения к брюшному тифу очень высока. В очагах, где регистрируется вспышка брюшного тифа, могут заболевать до 50 – 60 процентов от общего населения.

К периодам (этапам) заболевания брюшного тифа относятся:
- инкубационный период;
- начальный период;
- период разгара заболевания;
- период угасания основных симптомов;
- период выздоровления.
Инкубационный период – это период с момента проникновения сальмонелл в организм человека до момента, когда появляются первые симптомы. При брюшном тифе период инкубации, как правило, длится от 9 до 14 дней. Максимально он может затягиваться до 25 дней. За это время попавшие в организм сальмонеллы активно размножаются в слизистой подвздошной кишки и лимфатических узлах. В тот момент, когда бактерии выходят в кровь, инкубационный период заканчивается, и появляются первые признаки заболевания.
Длительность этого периода зависит от концентрации изначально попавших в организм микробов и от пути заражения. При пищевом заражении инкубационный период короткий — от 7 до 9 дней, а заболевание отличается высокой тяжестью. Водный путь заражения характеризуется более длительным периодом инкубации.
Период угасания основных симптомов начинается с момента снижения температуры, очищения языка, нормализации стула. Все проявления общей интоксикации – головная боль, слабость, разбитость – уходят. Температура тела начинает снижаться, но все еще не доходит до нормы.
Несмотря на редукцию симптомов, этот период болезни является очень опасным. Именно в этот момент болезнь может заново проявить себя, то есть возможен рецидив брюшного тифа. Поэтому в период угасания основных клинических симптомов пациент продолжает оставаться в стационаре под постоянным наблюдением.
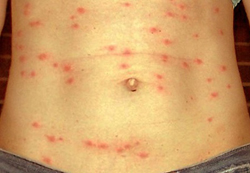
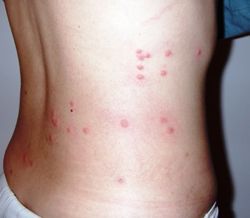
Симптомами брюшного тифа являются:
- лихорадка;
- сыпь;
- кишечное кровотечение;
- поражение внутренних органов.
Специфическим проявлением брюшного тифа является сыпь. Она обусловлена нарушением проницаемости кровеносных сосудов и пропитыванием эпидермиса элементами крови. При брюшном тифе сыпь, как правило, розеолезная, а элементом такой сыпи является розеола. Розеола – это округлое красное пятнышко, размером от 1 до 5 миллиметров. Она не шелушится и не создает зуд, а потому не причиняет беспокойства пациенту. Однако, несмотря на это, сам период высыпания сопровождается резким поднятием температуры тела и ухудшением состояния пациента. Сознание пациента еще больше затуманивается, и он становится сонным, вялым, апатичным.
При брюшном тифе сыпь появляется на 8 – 9 день от начала заболевания. Она локализуется на верхних отделах живота и грудной клетки. Иногда элементы сыпи могут выступать над уровнем кожи и приобретать четкие границы. Чаще всего сыпь необильная и держится от 3 до 5 дней. Она может исчезнуть уже через один — два дня, но потом вновь появится. При тяжелом течении заболевания сыпь приобретает петехиально-геморрагический характер. Элементы сыпи в данном случае пропитываются кровью, что говорит о неблагоприятном прогнозе.
В редких случаях характерная для брюшного тифа сыпь может отсутствовать. Отсутствие сыпи на теле пациента не должно исключать диагноз брюшного тифа.
При брюшном тифе из-за специфического поражения сальмонеллами желудочно-кишечного тракта выявляются признаки энтерита. На начальных стадиях отмечается задержка стула, однако уже во время стадии развернутых клинических проявлений присутствует стул энтерического характера (то есть понос). У некоторых же больных остаются запоры.
Живот больного брюшным тифом вздут, при пальпации болезненный. В умеренных и тяжелых случаях развивается парез кишечника, для которого характерно полное отсутствие перистальтизма. При этом газы и кишечное содержимое скапливаются в просвете кишечника, делая живот напряженным и болезненным.
В результате специфического воздействия эндотоксина сальмонелл на нервные окончания в слизистой кишечника развиваются трофические и сосудистые изменения. Они, в свою очередь, приводят к нарушению питания слизистого слоя кишечника и развитию трофических язв. Трофические язвы – это те, которые развиваются вследствие нарушенного питания (трофики) слизистой оболочки. В своем развитии язвы проходят несколько этапов.
Этапами развития язв являются:
- первая неделя – увеличение лимфатических фолликулов слизистой кишечника;
- вторая неделя – некроз (омертвение) увеличенных образований;
- третья неделя – отторжение некротических (омертвевших) масс и формирование на их месте небольших углублений, то есть язв;
- четвертая неделя – стадия чистых язв;
- пятая неделя – стадия заживления язв.
Все эти стадии могут следовать одна за другой без развития последствий для слизистой оболочки кишечного тракта. Однако, при формировании обширных и глубоких язв течение брюшного тифа осложняется кишечным кровотечением. Происходит это вследствие перфорации (прободения) язвы слизистой. В этом случае целостность оболочек кишечника нарушается, а вместе с ними и тех кровеносных сосудов, которые в них заложены. Нарушение целостности кровеносных сосудов приводит к излитию крови в просвет кишечника, что и является причиной кишечного кровотечения.
Кишечное кровотечение при брюшном тифе, как правило, встречается на 3 – 4 недели от начала заболевания. Неотъемлемым симптомом перфорации кишечной язвы является боль. Пациент предъявляет жалобы на внезапно появившуюся боль острого характера.
Часто боли локализуются внизу животу справа, но могут быть и разлитыми. Болевой синдром сопровождается выраженным напряжением мышц живота, учащенным дыханием и падением артериального давления. Симптомы перфорации язвы ярко выражены при умеренных формах брюшного тифа. Объясняется это тем, что сознание пациента в этом случае не сильно затуманено, и болевая чувствительность сохраняется. Если же кишечное кровотечение начинается на фоне высокой температуры и затуманенного сознания пациента, то клиника его очень стертая.
При осмотре выявляется выраженное защитное напряжение мышц живота. Живот плотный болезненный, движения брюшной стенки во время акта дыхания еле заметны или вовсе отсутствуют. Появляются признаки раздражения брюшины, такие как симптом Щеткина-Блюмберга.
После того как бактерии брюшного тифа выходят в кровь, они разносятся с током крови по всему организму к различным органам и системам. Так, вместе с током крови они попадают в печень, селезенку, почки, сердце.
Поражение сердца
Эндотоксин сальмонелл приводит к дистрофическим изменениям в сердце с развитием токсического миокардита. Термин «миокардит» означает, что воспалительным процессом охвачен мышечный слой сердца. Это приводит к тому, что сердце перестает выполнять свои основные функции. В норме основной функцией сердца является «функция насоса», которая обеспечивает кровоснабжение по всему организму. Из-за поражения мышечного слоя сердце перестает эффективно сокращаться и качать кровь. Сокращения становятся слабыми, глухими, что объясняет брадикардию (редкие сердечные сокращения), артериальную гипотонию (снижение артериального давления). При обследовании пациента сердечные тоны глухие, слабые, артериальное давление низкое, пульс в пределах 50 ударов в минуту.
Следствием поражения сердца, является гипоксия или же кислородное голодание, нарушение водно-электролитного баланса, гиповолемия (уменьшение объема циркулирующей крови).
Поражение почек и легких
На фоне гиповолемии развивается синдром «шоковой почки» и «шокового легкого». Шоковая почка – это состояние, при котором нарушаются все функции почки — фильтрация, секреция и выделения. Диурез (суточный объем мочи) при этом осложнении резко снижается, вплоть до анурии. Вследствие нарушенной выделительной функции в организме начинают накапливаться продукты обмена – креатинин, мочевина. Это еще больше отягощает течение заболевания и обуславливает развитие инфекционно-токсического шока. Лечение шоковой почки должно быть экстренным и включать меры по восстановлению диуреза, выведению токсических продуктов обмена.
Еще одним следствием гиповолемии является шоковое легкое. При этом синдроме в альвеолах легких скапливается большое количество жидкости. Таким образом, легкие заполняются не воздухом, а водой, что лежит в основе отека легких. Пациенту становится трудно дышать, нарастает одышка.
Брюшной тиф часто путают с сыпным тифом, что является неверным. Сыпной тиф – это острое инфекционное заболевание, которое вызывается бактериями рода риккетсий. В отличие от брюшного тифа это заболевание не относится к кишечным инфекциям. Для сыпного тифа характерно преимущественное поражение нервной и сердечно-сосудистой системы. Передается данная инфекция, в основном через, вшей, чаще всего платяных и реже головных. Заражение происходит через укусы этих насекомых. Сами же вши заражаются от больных людей. Таким образом, платяные вши являются переносчиками заразы.
После того как вошь укусила больного человека, она может прожить от 30 до 45 дней. Укус вши является очень болезненным, из-за чего человек начинает болезненно расчесывать место укуса. Расчесывая укус, он втирает фекалии вши в кожу, посредством чего и происходит заражение. Далее риккетсии проникают в кровоток и разносятся кровью по всему организму. Мишенью для риккетсий являются эндотелиальные клетки, то есть структурные элементы сосудистой стенки. Развиваясь внутри сосудистой стенки, риккетсии разрушают ее, что приводит к деструкции кровеносных сосудов. Для сыпного тифа характерен феномен васкулита, то есть поражение эндотелиальной стенки сосудов. Это и обуславливает развитие в клинической картине заболевания таких симптомов как кровоизлияния в кожные покровы и в слизистые, увеличение селезенки, снижение артериального давления.
Еще одной отличительной особенностью сыпного тифа является поражение нервной системы. Сознание пациента спутанное, иногда могут развиваться признаки менингизма. Крайне тяжелым проявлением сыпного тифа является тифозный статус. Во время него у пациента отмечается психомоторное возбуждение, расстройства памяти, прогрессирует бессонница. Если же пациент засыпает, то ему сняться кошмарные сновидения. Иногда может развиваться бред, галлюцинации и другие психотические симптомы.
В эту категорию входят те последствия, которые характерны только для брюшного тифа. Наибольшим значением среди специфических последствий этого заболевания обладает инфекционно-токсический шок. Развивается такое состояние в разгар заболевания по причине массового поступления в кровь токсинов, которые выделяют брюшнотифозные бактерии. Эти токсины провоцируют спазм сосудов, в результате чего циркуляция крови нарушается.
Также токсины способствуют усиленному выбросу в кровь адреналина и других гормонов, которые усиливают сосудистый спазм. Кровь перестает выполнять свою транспортную функцию, что приводит к ишемии тканей (недостаточному кровоснабжению тканей) и к метаболическому ацидозу (повышенному содержанию в крови кислых продуктов). Все это становится причиной дегенеративных (разрушительных) изменений органов и тканей, отеков и других патологических состояний, которые могут привести к летальному исходу. Начинается инфекционно-токсический шок с увеличения температуры тела и развивается в несколько этапов.
Этапами инфекционно-токсического шока являются:
- Ранний. Сознание пациента сохраняется ясным, может наблюдаться тревога, двигательное беспокойство, отек лица и верхней половины туловища. Дыхание при этом учащенное, артериальное давление волнообразно повышается и снижается. У детей ранний этап обычно сопровождается рвотой, поносом, болями в животе (в верхней части).
- Выраженный. Тревожность и общее возбуждение первого этапа сменяется апатичным состоянием, двигательной заторможенностью. Кожные покровы пациента становятся бледными, холодными и влажными. Со временем возможно появление на коже кровоизлияний. Конечности приобретают синеватый оттенок. Температура и артериальное давление снижается, дыхание и пульс становятся слабыми. Резко уменьшается объем мочи. В этот период развиваются различные патологии со стороны почек, дыхательной системы.
- Декомпенсированный. Артериальное давление и температура тела продолжают падать. Пациента мучают судороги, возможна потеря сознания или кома. Кожа приобретает выраженный синий оттенок. Мочеиспускание отсутствует. Начинают проявляться симптомы дисфункции со стороны всех органов.
В эту группу входят заболевания, которые могут выступать в роли последствий не только брюшного тифа, но и других болезней. Брюшнотифозные бактерии кроме кишечника могут поражать и другие органы, провоцируя воспалительные процессы. Ситуация усложняется, когда к первичному воспалению присоединяется вторичная бактериальная инфекция.
К неспецифическим последствиям брюшного тифа относятся:
- со стороны дыхательной системы – пневмония (воспаление легочной ткани);
- со стороны сосудов – тромбофлебит (воспаление вен);
- со стороны сердца – миокардит (воспаление сердечной мышцы);
- со стороны почек – пиелит (воспаление в почечной лоханке), пиелонефрит (воспаление почечной ткани);
- со стороны нервной системы – периферический неврит (воспаление нервов), менингоэнцефалит (воспаление головного мозга и, в некоторых случаях, спинного мозга с последующим параличом);
- со стороны опорно-двигательного аппарата – артрит (воспаление суставов), хондрит (воспаление хрящевой ткани), периостит (воспаление надкостницы);
- со стороны мочеполовых органов – цистит (воспаление мочевого пузыря), простатит (воспаление простаты).
Основными симптомами, наличие которых вызывает подозрение на брюшной тиф, являются:
- сухость и бледность кожных покровов;
- повышенная температура;
- изменения языка – его увеличение, сухость и покрытие по центру налетом;
- появление красноватой сыпи на теле;
- диспепсические расстройства;
- проявления интоксикационного синдрома.
Когда у пациента наблюдаются подобные симптомы в течение 5 – 6 дней, необходимо сдать лабораторные анализы на брюшной тиф и пройти ряд диагностических исследований, посредством которых выявляется возбудитель заболевания.
Анализы на брюшной тиф назначаются как с целью выявления возбудителя болезни, так и для определения степени тяжести заболевания и контроля эффективности лечения.
К анализам, которые назначаются при диагностике брюшного тифа, относятся:
- общеклинические анализы;
- бактериологические анализы (посевы);
- серологические анализы.
Результаты общеклинических анализов указывают на присутствие воспалительного процесса в организме, на степень дегидратации и состояние организма больного в целом.
Бактериологические исследования помогают обнаружить самого возбудителя брюшного тифа в биологических жидкостях организма. К серологическим исследованиям прибегают с целью определения в организме человека антигенов возбудителя брюшного тифа. Серологические анализы особенно важны при диагностике бактерионосительства.
- реакция Видаля;
- реакция непрямой гемагглютинации;
- реакции флюоресцирующих антител.
Общеклинические анализы при брюшном тифе
Общеклинические анализы при брюшном тифе назначаются с момента обращения больного к врачу. Изменения в анализах не являются специфическими для данного заболевания, однако они помогают определить состояние организма больного в целом. Основными анализами являются гемограмма и общий анализ мочи.
Возможными изменениями клинического анализа крови при брюшном тифе являются:
- умеренное повышение лейкоцитов (белых клеток крови);
- лейкопения (уменьшение числа лейкоцитов);
- отсутствие эозинофилов (подвида лейкоцитов);
- умеренное повышение числа лимфоцитов (подвида безъядерных лейкоцитов);
- умеренное ускорение оседания эритроцитов.
Число лейкоцитов может быть повышенным только в первые дни заболевания. На протяжении последующей недели болезни их уровень резко падает. Лейкопения сохраняется на весь период выраженной клинической картины брюшного тифа.
Возможными изменениями в общем анализе мочи при брюшном тифе являются:
- присутствие белка;
- высокий уровень эритроцитов (красных клеток крови);
- высокий уровень цилиндров.
Ранняя специфическая диагностика брюшного тифа начинается с бактериологических исследований на основе посевов. В качестве материала для посева выступают различные биологические жидкости организма.
К биологическим жидкостям, которые используют для посева при брюшном тифе, относятся:
- кровь;
- моча;
- каловые массы;
- содержимое двенадцатиперстной кишки (желчь);
- грудное молоко.
Возбудителя брюшного тифа можно также обнаружить при бактериологическом исследовании розеол и костного мозга.
Для постановки диагноза забор биологических жидкостей должен проводиться до начала этиотропной терапии.
Посев крови
При ранней диагностике брюшного тифа чаще всего прибегают к посеву крови, в которой возбудитель легко обнаруживается даже в период инкубации. Лучше всего выполнять забор крови в период повышения температуры тела. В случае начала антибактериальной терапии кровь берется непосредственно перед тем как вводится следующая доза препарата. До 20 миллилитров крови засеваются на специальные жидкие питательные среды. Наиболее часто используемой средой для посева крови при брюшном тифе является среда Раппопорта, состоящая из бульона на основе желчи с добавлением глюкозы и специального красителя. Питательную среду с кровью помещают на 10 дней в инкубатор с температурой в 37 градусов Цельсия. Лаборанты проверяют посевы каждый день на наличие признаков роста бактериальных колоний – помутнение жидкости, изменение ее окраски. Если по окончании десяти дней рост отсутствует, результат анализа отрицательный. Если обнаруживаются признаки роста колоний, производят высевы на плотные среды в чашках Петри. Новые посевы вновь инкубируют при 37 градусах Цельсия в течение суток. В итоге на поверхности плотной среды разрастаются бактериальные колонии, которые подлежат идентификации при помощи ряда биохимических тестов. Параллельно с этим определяется также чувствительность бактерий к различным антибактериальным препаратам. Окончательные результаты гемокультуры получают через четверо суток.
Посев мочи
Исследование мочи на выявление возбудителя брюшного тифа можно проводить на протяжении всего периода болезни. Учитывая тот факт, что возбудитель выделяется с мочой непостоянно и кратковременно, посевы мочи следует повторять каждые 5 – 7 дней. Собранная моча должна быть доставлена в лабораторию для засева не позже двух часов с момента забора. Чем дольше хранится материал, тем больше шансов отмирания возбудителя или роста других бактерий. Урокультура получается тем же путем засева и инкубации, как и гемокультура.
Посев каловых масс
Посевы каловых масс для диагностики брюшного тифа выполняют, начиная со второй недели болезни. Забор испражнений производится при помощи стерильного шпателя, проволочной петли или ложечки. Для перевозки материала используется стерильный контейнер. В лаборатории готовится копрокультура путем посева кала на плотные питательные среды и инкубации при 37 градусах Цельсия в течение 18 – 24 часов.
Серологические анализы при диагностике брюшного тифа выявляют в крови больного особые антигены и антитела. Существует несколько основных антигенов, которые обнаруживаются при исследовании крови пациента.
Основными антигенами, которые обнаруживаются в крови больного при брюшном тифе, являются:
- О-антиген;
- Н-антиген;
- Vi-антиген.
О-антигены и Vi-антигены представлены частицами оболочек возбудителя, а Н-антигены являются структурными элементами жгутиков.
В качестве антител выступают особые белки, которые вырабатываются иммунной системой человека для нейтрализации антигенов возбудителя. Высокие уровни антител указывают на формирование стойкого иммунитета к возбудителю, что наблюдается в период выздоровления либо при бактерионосительстве. Антигены и антитела определяются в крови больного с помощью особых серологических реакций.
К реакциям серологического обследования на брюшной тиф относятся:
- реакция Видаля;
- реакция непрямой гемагглютинации;
- реакции флюоресцирующих антител.
Серологическую диагностику брюшного тифа проводят не раньше второй недели болезни.
Реакцией Видаля называется реакция прямой агглютинации (склеивания), которая позволяет определить присутствие О-антигена в сыворотке больного. Данная реакция широко применяется при диагностике брюшного тифа, однако она не является специфической, давая ложноположительные результаты за счет распознавания других видов сальмонелл. Для реакции Видаля необходимо 2 – 3 миллилитра венозной крови – обычно из локтевой вены. Кровь оставляют на некоторое время в пробирке до ее полного свертывания. Стерильным шприцем отсасывается образовавшаяся на поверхности сыворотка и помещается в другую пробирку. Реакция агглютинации состоит в поэтапном разведении сыворотки больного до соотношения 1 к 800 и добавлении специального диагностикума (антитела к искомым антигенам).
Этапами реакции Видаля являются:
- наполнение ряда пробирок по 1 миллилитру физиологического раствора;
- добавление 1 миллилитра сыворотки в первую пробирку и получение разведения 1 к 50;
- отсос пипеткой из первой пробирки 1 миллилитра и добавление его во вторую пробирку – получается разведение 1 к 100;
- повтор манипуляций до получения растворов в соотношении 1 к 800;
- добавление специального диагностикума в каждую пробирку;
- двухчасовая инкубация при 37 градусов Цельсия;
- последующее содержание пробирок при комнатной температуре в течение суток.
Реакция агглютинации проявляется в виде образования небольшого осадка на дне пробирки. Реакция Видаля является положительной, если агглютинация присутствует в пробирке с разведением 1 к 200 и более. Положительный результат может указывать не только на присутствие болезни, но и на возможное носительство. Для дифференциации этих состояний реакция повторяется через 5 – 6 дней. Если агглютинация появляется в пробирках с высокими титрами антител, это указывает на наличие болезни. У бактерионосителей титры антител не меняются при повторных исследованиях.
Реакция непрямой гемагглютинации
Реакция непрямой гемагглютинации является более специфической и чувствительной для диагностики брюшного тифа. С ее помощью определяются все три основных антигена возбудителя. В качестве диагностикума выступают эритроциты, сенсибилизированные к антигенам сальмонеллы. Методика выполнения реакции схожа с техникой реакции Видаля, однако разведения начинаются с 1 к 10. Гемагглютинация проявляется в виде образования осадка красного цвета на дне пробирки, похожего на перевернутый зонтик. Положительной считается реакция, при которой осадок образовался в пробирке с разведением 1 к 40 и более. При последующих анализах через 5 и 10 дней титры антител увеличиваются в 2 – 3 раза, особенно О-антител. Повышение титра Vi- и Н-антител наблюдается у больных в период выздоровления. Их уровень также может быть высок у носителей.
Реакции флюоресцирующих антител
С первых дней болезни возбудителя можно опознать при помощи реакций флюоресцирующих антител. Эти реакции заключаются в обнаружении антигенов возбудителя при помощи антител, отмеченных флюоресцирующими веществами. В биологический диагностический материал (кровь, кал, моча) добавляют «маркированные» антитела и изучают его при помощи специальных микроскопов. Когда антитело связывается с антигеном возбудителя, в микроскопе видно свечение. Предварительные результаты реакций готовы в течение одного часа, а окончательные – через 10 – 20 часов. Реакции флюоресцирующих антител достаточно специфичны и высокочувствительны, однако используются редко в диагностике брюшного тифа.
источник