Серологический тест, использующийся в диагностике брюшного тифа.
Брюшной тиф — острая циклически протекающая кишечная антропонозная инфекция, вызываемая бактериями Salmonella typhi (Salmonella enterica серотип typhi), с алиментарным путем передачи (фекально-оральный), характеризующаяся лихорадкой, явлениями общей интоксикации с развитием тифозного статуса, розеолезными высыпаниями на коже, гепато- и спленомегалией и специфическим поражением лимфатической системы нижнего отдела тонкой кишки.
Возбудитель — Salmonella enterica серовар Typhi из семейства Enterobacteriaceae рода Salmonella, подвижная грамотрицательная палочка с закругленными концами, хорошо окрашиваемая всеми анилиновыми красителями. Вырабатывает эндотоксин, патогенный только для человека. Не образует споры.
Резервуар и источники возбудителя: человек, больной или носитель (транзиторный, острый или хронический).
Механизм передачи возбудителя фекально-оральный. Путь передачи — преимущественно водный, но возможны пищевой и бытовой пути передачи.
Естественная восприимчивость людей высокая, хотя клинические проявления заболевания могут варьировать от стертых до тяжело протекающих форм. Перенесенное заболевание оставляет стойкий иммунитет.
Инкубационный период — от 7 дней до 23 дней, в среднем 2 нед. Возбудитель — рот — кишечник — пейеровы бляшки и солитарные фолликулы (лимфаденит и лимфангит) — кровяное русло — бактериемия — первые клинические проявления. Циркулирующие в крови микроорганизмы частично погибают — высвобождается эндотоксин, обусловливающий интоксикационный синдром, а при массивной эндотоксемии — инфекционно-токсический шок.
Начальный период (время от момента появления лихорадки до установления ее постоянного типа) — продолжается 4-7 дней и характеризуется нарастающими симптомами интоксикации. Бледность кожи, слабость, головная боль, снижение аппетита, брадикардия. Обложенность языка белым налетом, запоры, метеоризм, поносы.
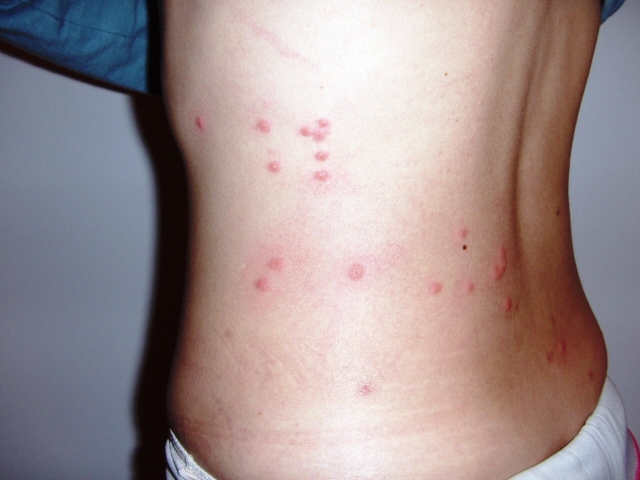
Период разгара — 9-10 дней. Температура тела держится постоянно на высоком уровне. Симптомы интоксикации резко выражены. Больные заторможены, негативны к окружающему. При осмотре на бледном фоне кожи можно обнаружить бледно-розовые единичные элементы сыпи — розеолы, слегка выступающие над поверхностью кожи, исчезающие при надавливании, располагающиеся на коже верхних отделов живота, нижних отделов грудной клетки, боковых поверхностях туловища, сгибательных поверхностях верхних конечностей. Отмечаются глухость тонов сердца, брадикардия, гипотония. Язык обложен коричневатым налетом, с отпечатками зубов по краям. Живот вздут, имеется склонность к запорам. Увеличивается печень и селезенка. Тифозный статус — резкая заторможенность, нарушение сознания, бред, галлюцинации. Другим проявлением тяжести болезни является инфекционно-токсический шок.
Период разрешения болезни. Температура падает критически или ускоренным лизисом, уменьшается интоксикация — появляется аппетит, нормализуется сон, постепенно исчезает слабость, улучшается самочувствие.
В период реконвалесценции у 3-10 % больных может наступить рецидив болезни. Предвестниками рецидива являются субфебрилитет, отсутствие нормализации размеров печени и селезенки, сниженный аппетит, продолжающаяся слабость, недомогание. Рецидив сопровождается теми же клиническими проявлениями, что и основная болезнь, но протекает менее продолжительно.
Брюшной тиф может протекать в легкой, среднетяжелой и тяжелой формах. Выделяют атипичные формы болезни — абортивные и стертые.
В настоящее время в клинической картине брюшного тифа произошли большие изменения. Это связано с повсеместным применением антибиотиков, а также с иммунопрофилактикой. Вследствие этого стали преобладать стертые и абортивные формы заболевания. Лихорадка может длиться до 5-7 дней (иногда 2-3 дня). Чаще встречается острое начало (без продромального периода — в 60-80% случаев). Что касается картины крови, то в 50% случаев сохраняется нормоцитоз, эозинофилы в норме. Серологические реакции на брюшной тиф могут быть отрицательными в течение всей болезни.
Лабораторная диагностика прежде всего заключается в бактериологическом исследовании крови, кала, мочи, желчи. Метод гемокультуры можно использовать с первых дней заболевания и до конца лихорадочного периода, желательно до начала лечения. Для этого 5-10 мл крови из локтевой вены у постели больного засевают на 20 % желчный бульон или среду Рапопорта, мясопептонный бульон с 1 % глюкозы, либо даже в стерильную дистиллированную воду. Объем среды — 50-100 мл. Соотношение материала и среды должно быть 1:10. Кал, мочу, дуоденальное содержимое исследуют со 2-й недели от начала заболевания, засевая на среды Плоскирева, Левина, Мюллера и др. Предварительный результат этих исследований получают через 2 дня, окончательный — через 4 дня.
Для выявления брюшной тифозной палочки в фекалиях, моче, дуоденальном содержимом используют РИФ с меченными сыворотками к О- и Vi-антигенам. Предварительный ответ может быть получен в течение 1 ч, окончательный — через 5-20 ч.
Из серологических методов используют РА (Видаля) и РПГА с цистеином. Реакцию Видаля ставят с Н- и О-антигенами с 7-9-го дня заболевания повторяют на 3-4-й неделе для определения нарастания титра (от 1:200 до 1:400-1:800-1:1600). Последнее имеет значение для исключения положительного результата реакции, который может быть обусловлен предшествовавшей иммунизации против брюшного тифа. Ответ может быть получен через 18-20 ч. При постановке РПГА учет результатов проводят после инкубирования пластин при 37° С в течение 1,5-2 ч и повторно — через 24 ч нахождения при комнатной температуре. Положительный считается реакция в титре 1:40 и выше.
- В комплексе с микробиологическими тестами в целях диагностики брюшного тифа (дифференциальная диагностика гастроэнтеритов у детей; лихорадка неясной этиологии с относительной брадикардией, болезненность живота, потеря аппетита, общее недомогание у взрослых).
- Диспансерное наблюдение пациентов, перенесших брюшной тиф.
- Выявление носителей инфекции, санитарно-эпидемиологические исследования.
Единицы измерения: тест полуколичественный, единицы измерения – титры. При отсутствии антител выдаётся ответ «отрицательно», при их обнаружении – «положительно» с приведением конечного титра.
Диагностические значения титров:
- возраст старше 1 года: с комплексным сальмонеллёзным диагностикумом – 1:200, Vi-диагностикумом – 1:40, О9-диагностикумом — 1:200;
- дети до 1 года: с комплексным сальмонеллёзным диагностикумом – 1:100, Vi-диагностикум – 1:20, О9-диагностикум — 1:100.
Положительно:
- острая инфекция;
- перенесённая в прошлом инфекция;
- хроническое носительство;
- редко – ложноположительные результаты вследствие перекрёстных реакций (в т. ч. другие виды сальмонелл).
Отрицательно:
- отсутствие инфекции;
- ранняя стадия заболевания;
- отдалённые сроки после выздоровления.
источник
Диагностический серологический анализ по выявлению в сыворотке крови антител к Vi-антигенам возбудителя брюшного тифа предназначен для подтверждения либо отрицания факта носительства.
| Сроки выполнения | 7-8 дней |
| Синонимы (rus) | Серологический анализ на Vi-антитела возбудителя брюшного тифа в сыворотке крови |
| Cинонимы (eng) | Indirect hemagglutination assay for Salmonella typhi Vi antibodies |
| Метод анализа | Реакция непрямой гемагглютинации (РНГА) |
| Подготовка к исследованию | Анализ проводится утром, натощак. С последнего приема пищи должно пройти не менее 8 часов. |
| Исключить прием алкоголя не менее чем за 24 часа до взятия биоматериала. | |
| Не рекомендуется сдавать кровь на серологию после флюорографии, рентгена, физиотерапевтических процедур. | |
| Биоматериал и способы его взятия | Венозная кровь |
Брюшной тиф относится к острым инфекционным кишечным заболеваниям. Для него характерны циклическое течение с системным поражением органов кишечника, ЦНС, печени, лимфатической системы; общая интоксикация организма, устойчивая бактериемия, при которой в крови обнаруживается присутствие бактерий. Источником инфекции являются больные, переболевшие бактерионосители.
Возбудитель брюшного тифа — сальмонелла Salmonella typhi, относится к кишечным бактериям.
Антигенная система возбудителя представлена антигенами O, H, Vi.
Антиген Vi является антигеном вирулентности, формирующим устойчивость возбудителя брюшнотифозной сальмонеллы к защитным реакциям организма. Наличие антител к Vi-антигенам Salmonella typhi при проведении серологического исследования образцов крови служит маркером бактерионосительства.
Выявление антител к эритроцитарным Vi-антигенам осуществляют с помощью серологической реакции непрямой гемагглютинации, РНГА , с применением специальных диагностикумов.
Метод РНГА:
- основан на способности взаимодействия антител сыворотки крови и антигенов, которые фиксированы на эритроцитах (эритроцитарный диагностикум); результатом реакции является агрегация эритроцитов с последующим осаждением, агглютинация;
- по характеру осадка эритроцитов судят о наличии антител (характерный «зонтик»), либо об их отсутствии (осадок в виде «точки»);
- является полуколичественным; для проведения реакции используют разведения сыворотки крови для выявления диагностического титра;
- минимальным диагностическим титром при проведении реакции является показатель 1:40;
- повышение диагностической ценности реакции наблюдается при использовании повторного анализа (метод парных сывороток);
- реакция высокочувствительна и специфична, может быть использована на пятый-седьмой дни заболевания.
Результаты анализа могут быть положительными или отрицательными.
Положительный ответ:
- выявление в крови антител к Vi-антигенам брюшнотифозного возбудителя (минимальное значение диагностического титра 1:40) рассматривается как указание на факт бактерионосительства и на необходимость повторного тестирования;
- в ответе фиксируется значение титра;
- может свидетельствовать о протекании острой инфекции, о перенесенном в прошлом заболевании, о проведенной вакцинации;
- в редких случаях может быть ложноположительным вследствие перекрестной реакции.
Отрицательный ответ выдается в случае, если антитела не выявлены. Подобная ситуация возможна как при отсутствии инфицирования брюшнотифозным возбудителем, так и на ранних сроках заболевания.
Проведение данного исследования имеет особую важность для предотвращения случаев распространения брюшного тифа бактерионосителями.
анализы Вопрос: Доктор назначила ребенку: 1. Анализ крови на органические и аминокислоты методом тандемной масспектрометрии 2. Анализ мочи на органические и аминокислоты методом газовой спектрометрии (разовая порция). Мы можем сделать такие анализы в вашей лаборатории в Адлере? стоимость и сроки, а так же как подготовиться к анализу написшите, пожалуйста.
Ответ: Здравствуйте! Да, Вы можете сдать кровь и мочу на исследование в Адлере. Комплексное определение концентрации ненасыщенных жирных кислот семейства Омега-6 в крови методом тандемной масс-спектрометрии — 8250 руб. Срок выполнения до 10 рабочих дней. Комплексное определение концентрации на аминокислоты в крови (32 показателя) — 8140 руб., 10 р.дней., Комплексное определение содержания органических кислот в моче — 5000 руб., 10 р. дней. Сдавать утром после 8 часового ночного голодания.
Какой анализ крови нужно сдать Вопрос: Добрый день,хотел бы у вас уточнить один вопрос.Был на приеме у невролога, т.к. в последнее время немеет лобная часть головы,он установил диагноз,прописал лекарства и сказал,что надо бы сделать общий анализ крови для проверки.Какой-то отдельный анализ крови надо еще делать или хватит только общего?
Ответ: Здравствуйте! Если доктор Вам назначил общий анализ крови, значит его следует выполнить. Общий клинический анализ крови является комплексным исследованием, который поможет врачу провести скрининг. Данный анализ отражает текущее состояние человека и дает такие показатели крови, как эритроциты, гемоглобин, лейкоциты, лейкоцитарная формула и еще до 18 показателей.
источник
Антитела к Vi-антигену возбудителя брюшного тифа (S. typhi) – это специфические белки-иммуноглобулины, вырабатываемые иммунной системой в ответ на инфицирование возбудителем брюшного тифа и участвующие в реакциях иммунной защиты организма.
Анти-Vi-антитела, возбудитель брюшного тифа.
Синонимы английские
Anti-Salmonella typhi Vi, Anti-Salmonella typhi Vi antibodies, Anti-Vi antibodies, Antibodies to the Vi capsule of Salmonella Typhi.
Реакция непрямой гемагглютинации (РНГА).
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Брюшной тиф – это острое инфекционное заболевание с фекально-оральным путем передачи, возбудителем которого является Salmonella typhi. Инкубационный период длится в среднем 9-14 дней. Заболевание начинается постепенно с общего недомогания, бессонницы и головной боли, затем к ним присоединяются лихорадка, симптомы поражения центральной нервной системы в виде заторможенности, нарушений сознания и бреда, а также нарушения стула и характерная сыпь в области живота и грудной клетки. Источник инфекции – болеющие брюшным тифом и бактерионосители S. typhi. Бактерионосительство может быть острым, хроническим или транзиторным.
Наряду с другими антигенами возбудитель брюшного тифа содержит Vi-антиген, который обеспечивает устойчивость возбудителя к фагоцитозу (способности специализированных клеток организма, фагоцитов, поглощать и переваривать чужеродные частицы, в том числе и микроорганизмы), способствует хронизации инфекции и брюшнотифозному бактерионосительству.
Для чего используется исследование?
- Для выявления бактеpионосителей, в том числе сpеди pаботников пищевых пpедпpиятий.
- Чтобы оценить эффективность вакцинации против брюшного тифа.
Когда назначается исследование?
- Когда необходимо выявить бактеpионосителей среди сотрудников пищевых пpедпpиятий пpи их поступлении на pаботу.
- Если нужно определить эффективность вакцинации – через 7 дней после введения вакцины.
- При обследовании лиц, контактировавших с больными брюшным тифом или носителями S. typhi.
Референсные значения: отрицательно.
Обнаружение антител к Vi-антигену S. typhi дает основание подозревать хроническое носительство брюшнотифозных бактерий или развитие иммунной реакции на вакцинацию против брюшного тифа. Отсутствие антител свидетельствует о том, что возбудителя брюшного тифа нет, или о низкой эффективности вакцинации.
Причины положительного результата:
- брюшнотифозное бактерионосительство,
- вакцинация против брюшного тифа в течение последних 3 лет.
Причины отрицательного результата:
- отсутствие иммунитета к S. typhi в связи с тем, что нет инфицирования возбудителем (если вакцинация от брюшного тифа не проводилась),
- отсутствие иммунного ответа или слабый иммунный ответ к возбудителю брюшного тифа вследствие нарушений в иммунной системе.
Что может влиять на результат?
- Возможен ложноположительный результат вследствие перекрестной реакции с другими возбудителями из рода Salmonella, в том числе и с возбудителями паратифов А, B и C.
- Проведение антибактериальной терапии.
- Переболевшие брюшным тифом относительно устойчивы к повторному заражению S. Typhi, за исключением случаев массивного поступления возбудителя в организм.
- Возможно проведение вакцинации пpотив брюшного тифа по специальным показаниям. Защитный титр антител достигается через 2-3 недели после введения вакцины и сохраняется в течение 3 лет.
Кто назначает исследование?
Инфекционист, терапевт, врач общей практики, гастроэнтеролог.
источник
• Микробиологическая диагностика брюшного тифа и паратифов
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: исходя из особенностей патогенеза брюшного тифа, на 1-й неделе заболевания, в период бактериемии, возбудителей выделяют из крови (получение гемокультуры), со 2-й недели заболевания — из испражнений (получение копрокультуры), мочи или желчи.
Бактериологическое исследование(схема 13.2.1).
Получение гемокультуры. В 1-й день из локтевой вены больного берут 5—10 мл крови и засевают в колбу с 50—100 мл селективной среды Раппопорт, содержащей желчный бульон (для подавления роста других бактерий), глюкозу, индикатор Андреде и поплавок для обнаружения газа. Указанные соотношения крови и среды необходимы для подавления бактерицидного действия белков крови. Посевы инкубируют при 37 «С в течение 18—20 ч. На 2-й день при росте сальмонелл наблюдается помутнение и изменение цвета среды. При росте паратифозных бактерий (биовары paratyphi А, Си schottmuelleri) наряду с указанными изменениями появляются пузырьки газа в поплавке. Для ускорения ответа из среды Раппопорт делают мазки и препараты «висячая» капля. При наличии чистой культуры грамотрицательных подвижных палочек и изменении цвета среды (или наличии газа) дают первый предварительный ответ. Затем культуру из среды Раппопорт пересевают в пробирку со средой Ресселя, полагая при этом, что из крови выделена чистая культура и можно сразу приступить к ее идентификации. Одновременно со среды Раппопорт делают посевы на среду Эндо для получения изолированных колоний с целью проверки чистоты выделенной культуры.
На 3-й день отмечают ферментацию глюкозы на среде Ресселя и ставят ориентировочную реакцию агглютинации на стекле. На основании полученных данных дают второй предварительный ответ. Для дальнейшего исследования отбирают несколько бесцветных колоний со среды Эндо и пересевают их в среду Ресселя или скошенный питательный агар (для контроля полученных результатов). Чистую культуру пересевают на среды «пестрого» ряда и серотипируют в реакции агглютинации на стекле со смесью групповых сывороток, а затем с
адсорбированными монорецепторными О- и Н-сальмонеллез-ными сыворотками. Окончательный диагноз устанавливают на основании биохимических (табл. 13.2.1) и антигенных свойств.
Таблица 13.2.1. Биохимические свойства сальмонелл — возбудителей брюшного тифа и паратифов
| Биовар S.enterica | Ферментация | Образование | |||||
| лактозы | глюкозы | мальтозы | сахарозы | ман-нита | H2S | NH3 | индола |
Paratyphi А — КГ КГ — КГ — —
Schottmuelleri — КГ КГ — КГ + +
Условные обозначения: К — образование кислоты; КГ — образование кислоты и газа; (+) — обнаружение признака; (—) — отсутствие признака.
Биохимические признаки (развернутый «пестрый» ряд) позволяют дифференцировать сальмонеллы от схожих сними энтеробактерий: Citrobacter, Hafnia (табл. 13.2.2).
Таблица 13.2.2. Дифференциация сальмонелл и других энтеробакте рий по биохимическим признакам
| Род | Лизин- декар- бокси- лаза | Ферментация углеводов | р- Галак-този-даза | ||
| дуль-цита | сорбита | ксилозы | рам-нозы | салицина | 4% лактозы |
Citrobacter — К(-) К К К К(±) К(±) К
Hafnia + — — К К К(+) — К
Условные обозначения: (+) — положительная реакция; (—) — отрицательная реакция; ± — вариабельная реакция; К — образование кислоты; К(—) — образование кислоты (редко); К(±) — образование кислоты (вариабельно).
Выделенную чистую культуру бактерий используют для определения чувствительности к антимикробным препаратам.
Фаготипирование. С помощью набора стандартных Vi-фагов определяют до 78 фаготипов S.enterica биовара typhi. При этом необходимым условием является наличие в культуре FZ-антигена. Культуры S.enterica биовара paratyphi В (schottmuelleri) дифференцируются на11 фаготипов и подтипов.
Получение копрокультуры. Испражнения засевают на одну из дифференциально-диагностических сред (Эндо или Левина) или элективные среды обогащения (Мюллера, селени-
товая или висмут-сульфит агар). Для посева петлю фекалий вносят в пробирку с изотоническим раствором хлорида натрия и готовят суспензию. После оседания крупных комочков суспензию петлей наносят на поверхность агаровой среды — на одну половину чашки. Материал тщательно растирают шпателем по одной, а затем по другой половине чашки для получения изолированных колоний. Посевы инкубируют при 37 °С в течение 18—20 ч. На 2-й день изучают характер колоний, выросших на чашках (рис. 13.2.1; на вклейке), пересевают 2—3 бесцветные колонии (со среды Эндо или Левина) или колонии черного цвета (висмут-сульфит агар) на среду Ресселя и в пробирки со скошенным питательным агаром. При отсутствии подозрительных колоний на чашках делают высевы из среды Мюллера или селенитовой среды на чашки со средой Эндо для получения изолированных колоний. Для ускорения ответа ставят ориентировочную реакцию агглютинации на стекле с материалом, взятым из бесцветной колонии. Далее поступают так же, как и при идентификации гемокультуры.
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования.Молеку-лярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз.
Серодиагностика. Влабораторной практике широко применяют развернутую реакцию агглютинации Видаля, основанную на обнаружении в сыворотке крови людей антител — агглютининов, которые появляются в конце 1-й — начале 2-й недели заболевания. Реакцию ставят одновременно с четырьмя антигенами: О- и Н-брюшнотифозными, А- и В-паратифозными диагностикумами. Брюшнотифозные монодиагностикумы применяют для установления стадии болезни, так как содержание О- и Н-антител в разные ее периоды неодинаково. О-антитела появляются на 1-й неделе, накапливаются в разгар заболевания и исчезают к моменту выздоровления. Н-антитела появляются в разгар заболевания, накапливаются к концу заболевания и сохраняются у переболевших в течение длительного времени. У людей, вакцинированных против брюшного тифа и парати-фов, также наблюдается положительная реакция Видаля, причем в довольно высоком титре, поэтому «инфекционный Ви-даль» удается отличить от «прививочного» только по нарастанию титра агглютининов у больных в процессе заболевания. Реакцию Видаля ставят в четырех рядах пробирок по 7 пробирок в каждом ряду, из которых 5 опытных и 2 контрольные. Для контроля каждого диагностикума в пробирки вносят по 1 мл изотонического раствора хлорида натрия, в который добавляют 2 капли диагностикума. В контрольной пробирке с
1 мл сыворотки (без диагностикума) не должно быть хлопьев. При спонтанной агглютинации реакция не учитывается. Диагностический титр реакции Видаля равен 1:200. Для серологического исследования реконвалесцентов и выявления бактерионосителей широко используют реакцию непрямой И-гемаг-глютинации, с помощью которой в сыворотке крови людей определяют присутствие антител к К/-антигену. В качестве антигена используют эритроцитарный Р?-диагностикум, представляющий собой взвесь эритроцитов человека 1(0) группы, обработанных формалином и сенсибилизированных Fz’-антиге-ном S.enterica биовара typhi. Готовят разведения испытуемой сыворотки от 1:10 до 1:1280. При положительной реакции эритроциты покрывают дно пробирки в виде диска с зазубренными краями, а надосадочная жидкость остается прозрачной. При отрицательной реакции, так же как и в контроле, эритроциты осаждаются на дно пробирки и имеют виддиска с ровными краями («пуговки»). Диагностическое значение имеет титр пассивной Й-гемагглютинации, начиная с 1:40 и выше. Всех лиц, сыворотка крови у которых дает положительный результат в РНГА с эритроцитарным F/f-диагностикумом, рассматривают как подозрительных на носительство S.enterica биовара typhi и подвергают многократному бактериологическому обследованию.
• Микробиологическая диагностика сальмонеллезов
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: испражнения, при генерализованной форме — кровь.
МЕТОДЫ ДИАГНОСТИКИ: микробиологическая диагностика сальмонеллезов принципиально не отличается от диагностики брюшного тифа и паратифов. Серодиагностика не применяется по причине большого числа сероваров возбудителей.
• Микробиологическая диагностика кишечного иерсиниоза
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: испражнения, при генерализованной форме — кровь, моча, спинномозговая жидкость.
МЕТОДЫДИАГНОСТИКИ:
Бактериологическое исследование.Посев материала на дифференциально-диагностические (среда Эндо, Мак-Конки, СБТС-агар с желчью и бромтимоловым синим) и селективные (CIN-arap с антибиотиками цефсулодином и новобиоцином) плотные среды или жидкие среды обогащения (буферно-казе-иново-дрожжевой бульон, 1 %, пептонная вода с рН 7,6—7,8). Посевы инкубируют при 25 «С в течение 24—48 ч. Идентификация чистой культуры осуществляется на основании морфологии, подвижности, тинкториальных свойств (грамотрица-
тельные палочки с закругленными концами и характерным биполярным окрашиванием, неспорообразующие, перитрихи), культуральных, биохимических признаков.
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования.Молеку-лярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР.В случае обнаружения соответствующих молекул можно поставить предварительный диагноз.
Серодиагностика.Диагностическое значение имеет обнаружение антител к поверхностным антигенам возбудителей наиболее распространенных серотипов (03, 04, 05, 06, 08, 09) в РА. Положительной считается РА в титре не менее 1:160. Разработаны также ИФА-тесты.
• Микробиологическая диагностика кишечного дисбактериоза
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: фекалии. МЕТОДЫ ДИАГНОСТИКИ:
Бактериоскопическое исследование.Имеет ориентировочное значение. При резко выраженном дисбактериозе в мазках преобладают микроорганизмы определенных видов (например, дрожжеподобные грибы, стафилококки и др.) на фоне существенного уменьшения грамотрицательной микрофлоры.
Бактериологическое исследование.Проводится количественное исследование состава микрофлоры кишечника. Для этого из исследуемого материала готовят разведения Ю -2 , 10 -4 , Ю -6 и т.д. Первичные посевы по 0,1 мл каждого разведения производят параллельно на несколько питательных сред (Эндо, кровяной агар, ЖСА, агар Сабуро и др.) и инкубируют при 37 °С. Подсчитывают число выросших колоний и определяют число КОЕ в 1 г материала. Проводят отсев 2—3 колоний каждого вида для выделения и идентификации чистых культур микроорганизмов.
Дляобнаружения анаэробных Bifidobacterium spp. делают мерные посевы материала в разведениях 10″ 7 и выше в пробирки с 13—15 мл модифицированной среды Блаурокка, в состав которой входит печеночный бульон, пептон — 1 %, лактоза — 1 %, хлорид натрия — 0,5 %, цистин — 0,01 %, агар-агар — 0,75%, твин-80 — 0,1 %. При росте Bifidobacterium spp. через 24—48 ч происходит помутнение всей среды с образованием тяжей или отдельных колоний. Готовят мазки и окрашивают по методу Грама. Выделение чистых культур Bifidobacterium spp. является весьма трудоемким и практически необязательным. При необходимости идентификацию представителей рода осуществляют по биохимическим свойствам.
Для оценки результатов бактериологического исследования
сопоставляют полученные данные с количественным содержанием микроорганизмов в норме. Ориентировочные критерии нормальной микрофлоры толстой кишки представлены в табл. 13.2.3.
Таблица 13.2.3. Критерии нормы кишечной флоры
Патогенные микробы сем. Enterobacteriaceae О
Общее количество E.coli, млн/г 300—400
E.coli со слабовыраженными ферментативными
свойствами, % До 10
E.coli с гемолитическими свойствами, % Нет
Энтеробактерии (лактозоотрицательные и лактозополо
жительные): Hafnia, Aerobacter, Citrobacter, Klebsiella,
Serratia, % До 5
Гемолитический стафилококк по отношению ко
всем кокковым формам, % Нет
Bifidobacterium spp. (рост при посеве разведения) 10 и выше
Бактерии рода Proteus Нет
При кишечном дисбактериозе происходит значительное снижение облигатной анаэробной микрофлоры, и в первую очередь Bifidobacterium spp., а также увеличение аэробных видов, в частности E.coli, содержание которых может превышать 10 11 микробных клеток в 1 г испражнений. Увеличивается частота обнаружения штаммов E.coli со слабой ферментацией лактозы и имеющих гемолитические свойства (до 30—40 %), гемолитических и негемолитических стафилококков, бактерий рода Proteus, грибов рода Candida (до 15—16 %). У лиц с дис-бактериозами более часто обнаруживают лактозоотрицательные и лактозоположительные энтеробактерии, относящиеся к родам Hafnia, Aerobacter, Citrobacter. Для микроорганизмов, в норме отсутствующих в испражнениях или имеющихся в небольшом количестве, показателем дисбактериоза будет содержание их 10 5 —10 6 и выше КОЕ в 1 г материала (Proteus spp., Klebsiella pneumoniae, Pseudomonas aeruginosa, Staphylococcus aureus, Candida spp.). Для окончательного заключения о кишечном дисбактериозе важное значение имеет повторное его выявление в динамике обследования больного.
• Диагностические, профилактические и лечебные препараты
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: На стипендию можно купить что-нибудь, но не больше. 8763 — 

193.124.117.139 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
источник
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Диагностический титр антител к сальмонеллам в сыворотке крови при РПГА — 1:200 (1:100 у детей до 1 года) и выше; при реакции агглютинации (реакция Видаля) — 1:40 (1:20 у детей до 1 года) и выше.
Описано более 2200 серологических вариантов сальмонелл, из них у человека — более 700. Наиболее часто встречают следующие сальмонеллы: Salmonella typhimurium, Salmonella heidelberg, Salmonella enteritidis, Salmonella anatum, Salmonella derby, Salmonella london, Salmonella panama, Salmonella newport. Ежегодно 20-35% изолятов приходится на Salmonella typhimurium.
Бактериологическое исследование крови, кала и мочи — основной метод диагностики сальмонеллёзной инфекции. Посевы крови дают положительный результат на протяжении первых 10 дней лихорадки или при наличии рецидива у 90% пациентов, менее чем у 30% — после 3 нед течения заболевания. Положительную культуру при посеве кала получают на протяжении от 10 дней до 4-5 нед менее чем в 50% случаев. Обнаружение сальмонелл в кале через 4 мес после перенесённого заболевания и позже (встречают у 3% пациентов), свидетельствует о бактерионосительстве. При посевах мочи положительные результаты получают на протяжении 2-3 нед у 25% пациентов, даже если культура крови негативна. Антигенная структура сальмонелл сложна. Она содержит О- и Н-антигены:
- О-антиген связан с соматической субстанцией клетки, термостабилен, один из его компонентов — Vi-антиген;
- Н-антиген имеет жгутиковый аппарат, термолабилен.
Различия в строении О-антигена позволили выделить серологические группы сальмонелл: А, В, С, D, Е и др. На основании различий в строении Н-антигена внутри каждой группы установлены серологические варианты. Среди серологических методов диагностики до последнего времени широко применяли реакцию Видаля, в последние годы она постепенно утрачивает своё значение.
На основании антигенной структуры, присущей различным видам сальмонелл, разработаны О- и Н-монодиагностикумы, позволяющие установить серологический вариант сальмонелл. Первоначально исследуют сыворотку в РПГА с комплексным препаратом эритроцитарного сальмонеллёзного диагностикума, содержащего О-антиген. Далее при наличии агглютинации с комплексным диагностикумом РПГА ставят с препаратами групп А (1, 2, 12), В (1, 4, 12), С1 (6, 7), С2 (6, 8), Д (1, 9, 12) и Е (3, 10). В табл. 8-5 представлена антигенная характеристика сальмонелл, на основании которой осуществляют диагностику серологических вариантов сальмонелл.
Антигенная характеристика сальмонелл
Жгутиковые — Н (специфические)
Титр антител к Н-антигену в сыворотке крови больных с сальмонеллёзами очень вариабелен, может давать неспецифическую реакцию с другими инфекциями; поэтому его определение мало полезно для диагностики сальмонеллезе.
Vi-антитела в инфекционном процессе не придают диагностического и прогностического значения. Иначе обстоит дело с выявлением Vi-антител у бактерионосителей. Большая резистентность содержащих Vi-антиген сальмонелл к защитным механизмам человека обусловливает более длительное носительство этих форм (Vi-форм) сальмонелл, вследствие чего в крови таких пациентов обнаруживают Vi-антитела. Vi-антитела — прямое доказательство носительства.
В настоящее время для выявления антител к сальмонеллам (к О-антигену) наиболее широко используют РПГА и ИФА, они более чувствительны по сравнению с реакцией Видаля и дают положительные результаты с 5-го дня заболевания (реакция Видаля — на 7-8-й день). Антитела у больных брюшным тифом, паратифом или другими серологическими типами сальмонелл появляются в крови уже к 4-му дню болезни и резко нарастают к 8-10-му дню. Их количество ещё более увеличивается на 2-3-й неделе заболевания. У взрослых и старших детей РПГА даёт подтверждение диагноза сальмонеллёза в 80-95% случаев уже в конце первой недели заболевания. У детей первого года жизни (особенно до 6 мес) РПГА с сальмонеллёзным диагностикумом оказывается отрицательной на протяжении всего заболевания. В первые месяцы после выздоровления исследование антител к сальмонеллам может служить для целей ретроспективной диагностики. Однако необходимо учитывать индивидуальные отклонения от нормального цикла иммуногенеза и изложенной динамики изменения титра антител. В ослабленном организме со сниженной реактивностью слабо и медленно синтезируются антитела. Интеркуррентные заболевания также могут задержать их формирование. Раннее лечение хлорамфениколом или ампициллином может привести к снижению титра антител или их отсутствию. Поэтому титр антител менее 1:200 не позволяет исключить заболевание, чрезвычайно важно исследовать титр антител в динамике — в начале заболевания и через 10-14 сут. Нарастание титра антител через 10-14 сут не менее чем в 4 раза при исследовании парных сывороток свидетельствует об инфекционном процессе.
При использовании реакции Видаля диагностически значимым считают титр от ≥ 1 : 40 до ≥ 1 : 160 в зависимости от географической области и лаборатории. При использовании точки разделения 1:160 для диагностики инфекции чувствительность метода составляет 46%, специфичность — 98%; 1:80 даёт чувствительность 66%, специфичность — 94%; при 1:40 чувствительность — 90%, специфичность — 85%.

источник
Возбудитель — Salmonella typhi, грамотрицательная подвижная палочка рода Salmonella семейства Enterobacteriaceae. Бактерии неприхотливы и растут на обычных питательных средах. У S. typhi выделяют термостабильный соматический О-Аг, термолабильный жгутиковый Н-Аг, термолабильный соматический Vi-Aг и др. Бактерии экзотоксинов не образуют. При разрушении микроорганизмов высвобождается эндотоксин, играющий основную роль в патогенезе заболевания. В определённой степени патогенность брюшнотифозных бактерий также определяют «ферменты агрессии» — гиалуронидаза, фибринолизин, лецитиназа, гемолизин, каталаза и др. По чувствительности к типовым бактериофагам выделяют более 100 стабильных фаговаров. Определение фаговара возбудителя — удобный маркёр для выявления эпидемиологических связей между отдельными заболеваниями, выяснения источника и путей передачи возбудителя. В неблагоприятных условиях, например в иммунном организме, бактерии переходят в L-формы. Бактерии умеренно устойчивы во внешней среде — в почве и воде могут сохраняться до 1-5 мес, в испражнениях — до 25 дней, на белье — до 2 нед, на пищевых продуктах — от нескольких дней до недель. Несколько дольше сохраняются в молоке, мясном фарше, овощных салатах, где при температуре выше 18 «С способны размножаться. При нагревании возбудитель быстро погибает, дезинфицирующие растворы в обычных концентрациях действуют на него губительно.
Резервуар и источник инфекции — человек (больной или бактериовыделитель). Опасность больного для окружающих в разные периоды болезни неодинакова. В инкубационном периоде заражённый человек практически не опасен. Опасность больного для окружающих увеличивается по мере развития болезни и достигает максимума на 2-3-й неделе болезни — в период выделения бактерий с испражнениями, мочой и потом; также их можно обнаружить в грудном молоке и носоглотке. Большая часть переболевших освобождается от возбудителя в первые 1 2 нед или в ближайшие 2-3 мес реконвалесценции. Примерно 3-5% остаются носителями на длительный срок, а некоторые — на всю жизнь. Эпидемиологическая опасность хронического носителя определяется его профессией и зависит от соблюдения им правил личной гигиены. Особую опасность представляют носители, имеющие доступ к приготовлению, хранению и реализации пищевых продуктов.
Механизм передачи фекально-оральный, реализуется водным, пищевым и бытовым путями; в районах с повышенным уровнем заболеваемости распространение идёт преимущественно водным путём. Последнее происходит за счёт использования воды, взятой из загрязнённых открытых или технических водоёмов, а также из-за неудовлетворительного санитарно-технического состояния водопроводных и канализационных сооружений. В результате употребления заражённой воды возникают острые и хронические водные вспышки, способные длительно продолжаться и охватывать большие группы населения. К возникновению водных вспышек приводят аварии на водопроводных сетях и сооружениях, перепады давления и нерегулярность подачи воды, сопровождающиеся подсосом инфицированных грунтовых вод через негерметичные отрезки сетей. Из пищевых продуктов наиболее опасны молоко и молочные изделия, кремы, салаты и другие продукты, служащие благоприятной средой для размножения бактерий. Иногда заражение может произойти и через овощи, особенно при их поливе сточными водами или удобрении фекалиями. Бытовой путь передачи возможен при низкой культуре бактерионосителей или больных со стёртой формой болезни. При этом происходит заражение окружающих предметов, а в последующем — заражение пищи.
Дифференциальная диагностика
Брюшной тиф необходимо дифференцировать от заболеваний, сопровождающихся длительной лихорадкой и развитием признаков интоксикации, — сыпного тифа, малярии, бруцеллёза, пневмонии, сепсиса, туберкулёза, лимфогранулематоза и др. В клинической дифференциальной диагностике брюшного тифа следует опираться на такие симптомы, как высокая длительная лихорадка, бледность кожных покровов лица, болезненность и урчание при пальпации в правой подвздошной области, гепатолиенальныи синдром, брадикардию, увеличение в размерах языка, обложенного по центру, появление на 8-9-й день болезни скудной розеолёзной сыпи на животе и нижней части груди, при более тяжёлом течении — развитие тифозного статуса. Постановка правильного диагноза вызывает значительные трудности, особенно при атипичных формах брюшного тифа. Поэтому каждый случай неясной лихорадки длительностью более 3 дней требует проведения соответствующих лабораторных исследований, в том числе выделения возбудителя из крови и фекалий, определения антигенов возбудителя в сыворотке крови и испражнениях. Получение брюшнотифозной гемокультуры — абсолютное подтверждение диагноза брюшного тифа. Обнаружение брюшнотифозных палочек в каловых массах менее информативно.
Лабораторная диагностика
На высоте интоксикации у больных брюшным тифом изменения гемограммы характеризуются лейкопенией, анэозинофилией, относительным лимфоцитозом и умеренным повышением скорости оседания эритроцитов (СОЭ). На первых этапах болезни также можно наблюдать умеренный лейкоцитоз со сдвигом лейкоцитарной формулы влево. В анализе мочи можно обнаружить белок и увеличение количества эритроцитов, а также цилиндры.
Наиболее достоверный метод диагностики брюшного тифа — выделение возбудителя. Для этого проводят посев 10 мл крови на 100 мл среды, содержащей жёлчь (10-20% жёлчный бульон, среда Раппопорта). Выделение гемокультуры наиболее эффективно в первую неделю болезни, однако с диагностической целью исследование проводят во все периоды температурной реакции. Посевы испражнений (копрокультуру) и мочи (уринокультуру) также проводят во все периоды заболевания, особенно на 2-3-й неделе. Вместе с тем необходимо помнить, что брюшнотифозную палочку из кала и мочи можно выделить не только у больных брюшным тифом, но и от бактерионосителей при различных лихорадочных состояниях. Посевы испражнений и мочи выполняют на плотные питательные среды. Помимо бактериологических исследований уже с первых дней болезни можно выявить брюшнотифозный О-Аг в испражнениях или сыворотке крови в РКА, РЛА, а также методами иммунофлюоресцентной микроскопии и ИФА.
Серологическую диагностику (РНГА в парных сыворотках с эритроцитарным брюшнотифозным О-диагностикумом) проводят с конца первой недели заболевания, однако минимальный диагностический титр AT (1:200) впервые можно выявить и в более поздние сроки заболевания (на 3-й неделе болезни). РНГА с эритроцитарным брюшнотифозным Vi-диагностикумом у больных брюшным тифом имеет вспомогательное значение (минимальный диагностический титр 1:40). Чаще эту реакцию используют для отбора лиц, подозрительных на бактерионосительство. При титрах AT 1:80 и выше этим лицам проводят многократное бактериологическое исследование. В настоящее время наибольшее распространение получила РПГА, которая бывает положительной уже на 4-5-й день болезни.
источник
Используют бактериологический и серологические методы, которые проводят с учетом периода инфекционного процесса.
Материалом для выделения являются кровь (гемокультура), испражнения (копрокультура), моча (уринокультура), дуоденальное содержимое, желчь (биликультура), соскоб розеол, костный мозг.
В бактериологическом исследовании ранним методом является выделение возбудителя из крови (гемокультура) в период бактериемии (первая неделя заболевания).
Кровь засевают в желчный бульон или среду Рапопорт в соотношении 1:10 (чтобы уменьшить бактерицидные свойства белков крови). На 2-й день проводят пересев на среду Эндо или Левина, или висмут-сульфит агар. Подозрительные (прозрачные или черные в зависимости от сред) колонии пересевают на скошенный агар или одну из комбинированных сред (Олькеницкого, Ресселя, Клиглера). На этих средах для первичной идентификации определяют ферментацию глюкозы, способность к газообразованию, выделение сероводорода, отсутствие уреазы.
Одновременно изучают морфологию и тинкториальные свойства.
Определяют биохимические свойства. Бактерии тифо-паратифозной группы не разлагают сахарозу, лактозу, не образуют индол.
При выделении культур, имеющих характерные для сальмонелл ферментативные свойства, изучают их антигенную структуру в реакции агглютинации на стекле с О- и Н-диагностическими антисыворотками, определяют чувствительность к антибиотикам, проводят фаготипирование.
Для серологической диагностики брюшного тифа и паратифов с 5-7 дня заболевания в основном используется РПГА с О- и Н-эритроцитарными диагностикумами. Положительной считается реакция в титре 1:160 и выше. При исследовании в РПГА титр антител в динамике заболевания нарастает.
Возможно применение реакции агглютинации Видаля с О- и Н-монодиагностикумами к конкретным возбудителям (положительный титр реакции – 1:200 и выше). Серологический диагноз имеет ретроспективный характер.
Для выявления бактерионосителей используют РПГА с эритроцитарным Vi-диагностикумом (титр реакции – 1:40). Исследуют били- и копрокультуру. Проводят фаготипирование с Vi-1 антигеном.
При эпидемических вспышках брюшного тифа для экспресс-диагностики с целью выявления АГ в крови, костном мозге и другом материале применяют РИФ и ИФА.
Лечение брюшного тифа
Этиотропную терапию проводят сразу после установления клинического диагноза. Для лечения используют фторхинолоны. При устойчивости к ним применяют цефалоспорины III поколения, азитромицин.
Левомицетин и ко-тримоксазол в настоящее время используют реже из-за распространения полирезистентных штаммов. Патогенетическое лечение включает инфузионно-дезинтоксикационную терапию.
Профилактика
Проводятся санитарно-гигиенические и противоэпидемические мероприятия, направленные на обезвреживание источников инфекции, пресечение путей передачи, повышение невосприимчивости организма.
Для специфической иммунопрофилактики брюшного тифа разработано 3 типа вакцин. Применяют инактивированные вакцины (эффективность 50-70%), разработана живая аттенуированная вакцина из штамма Ту21а (оказывает большее протективное действие, находится на стадии клинических испытаний). Эффективной является полисахаридная вакцина из Vi-антигена S. typhi(например, Вианвак пр-ва Российской Федерации), применяется по эпидпоказаниям, протективный эффект сохраняется до 2-х лет.
Сальмонеллезы
Сальмонеллезы – группа полиэтиологичных острых инфекционных болезней человека, животных и птиц, характеризующаяся преимущественным поражением желудочно-кишечного тракта, диареей и бактериемией.
Наиболее частой клинической формой сальмонеллезной инфекции является сальмонеллезный гастроэнтерит. Основные возбудители гастроэнтерита: S. Enteritidis, S .Choleraesuis, S .Anatum, S .Derby, хотя заболевания могут вызываться и многими другими вариантами бактерий.
Значительно более тяжелой формой является генерализованная сальмонеллезная инфекция – септицемия. Ее ведущим возбудителем является S. Typhimurium.
Большинство возбудителей выделяют у различных животных (основной резервуар) и человека.
Источником заражения человека чаще всего являются домашние птицы (50%), особенно куры и утки, а также их яйца (сальмонеллы могут проникать через скорлупу внутрь). Носительство сальмонелл выявлено у домашнего скота, собак, кошек, грызунов, у многих диких животных и птиц. Инфицированные животные выделяют бактерии с мочой и калом, молоком, слюной, загрязняя окружающую среду.
Основной путь передачи сальмонелл – пищевой. Заболевания возникают у человека в связи с употреблением мясных продуктов (говядина, свинина – до 20% случаев, мясо птицы), яиц, реже – рыбы, овощей, фруктов, моллюсков, раков, крабов.
Мясо может инфицироваться эндогенно при жизни животного во время его болезни, а также экзогенно в процессе транспортировки, переработки, хранения. Иногда продукты питания инфицируются при неправильной их кулинарной обработке, приготовлении пищи.
При несоблюдении санитарно-гигиенических норм может возникнуть контактно-бытовой путь передачи, который характерен для внутрибольничных вспышек сальмонеллеза. Такие вспышки отмечены в родовспомогательных учреждениях, хирургических, детских и других стационарах. При госпитальных сальмонеллезах чаще выделяется S. typhimurium иS. Haifa. В Республике Беларусь сальмонеллезные инфекции составляют более 50% от всех случаев госпитальных инфекций
Возбудители госпитальных сальмонеллезов отличаются высокой полирезистентностью к химиотерапевтическим препаратам и антибиотикам.
Наиболее восприимчивы к сальмонеллезу дети в возрасте до 1 года и лица с различными иммунодефицитами.
Инкубационный период болезни – от 2-6 часов до 2-3 суток (в среднем составляет 7-24 часа).
Патогенез сальмонеллезов определяется факторами вирулентности возбудителей. Среди них наиболее важную роль играют инвазивные белки III типа секреции.
Некоторые из белков инвазии обеспечивают проникновение сальмонелл внутрь эпителиальных клеток кишечника, их выживание внутри вакуолей. Кроме того, они стимулируют выброс провоспалительных цитокинов и хемокинов из пораженных клеток, апоптоз макрофагов.
Внутри макрофагов бактерии не только размножаются, но и частично погибают с освобождением эндотоксина, поражающего нервно-сосудистый аппарат кишечника и повышающего проницаемость клеточных мембран.
В течение 1 часа от проникновения сальмонелл внутрь клеток развивается выраженная нейтрофильная инфильтрация стенки кишечника. Кишечное воспаление сопровождается выходом белка из пораженных энтероцитов, усилением секреции хлоридов с развитием профузной диареи.
Часть сальмонелл может продуцировать энтеротоксин, который через повышение содержания цАМФ в энтероцитах стимулирует экскрецию хлоридов, что усугубляет диарею.
В большинстве случаев на этой стадии инфекционный процесс может завершиться (гастроинтестинальная форма).
В тяжелых случаях возникает бактериемия и генерализация инфекции, что приводит к септицемии.
Эта форма сальмонеллеза наиболее характерна для S. Typhimurium и S. Enteritidis. Ее развитие обусловлено белками вирулентности, которые кодируются островом патогенности SPI-2. Данные белки подавляют фагоцитоз, что обеспечивает выживание и размножение бактерий внутри фагоцитов, их проникновение в кровь и паренхиматозные органы.
В результате сальмонеллы могут вызывать дистрофические изменения в пораженных органах (селезенка, печень) с формированием вторичных гнойных очагов.
Обычно болезнь заканчивается выздоровлением, однако септические формы инфекции могут приводить у летальным исходам.
Постинфекционный иммунитет непродолжительный, нестойкий, типоспецифический. В сыворотке больных и реконвалесцентов обнаруживаются агглютинины, преципитины, бактериолизины и другие антитела. Заболевание, вызванное одним сероваром, не создает иммунитета к другим, а перенесенная инфекция не исключает реинфекцию.
Дата добавления: 2015-11-05 ; просмотров: 3265 | Нарушение авторских прав
источник
Брюшной тиф – это острое инфекционное заболевание, которое вызывается брюшнотифозной палочкой . Путь передачи – алиментарный, механизм – фекально-оральный. Возбудитель вызывает бактериемию (большое количество брюшнотифозной палочки в крови), высокую интоксикацию, поражает лимфатический аппарат тонкого кишечника, печень и селезенку (органы увеличены в размерах). Диагностический анализ на брюшной тиф первые дни болезни затруднен. Это связано с тем, что инфекционный процесс может протекать в атипичной или скрытой форме. Поэтому при любом виде лихорадки, независимо от ее интенсивности, диагностику на брюшной тиф делают 5 дней подряд.

При умеренном охлаждении, например, в холодильнике, микроорганизм в молочных продуктах не только сохраняется, но и способен к размножению в течение месяца. Высокие температуры губительно воздействуют на возбудителя. При кипячении тифозная палочка погибает моментально. Если нагреть воду до 60°C, то микроорганизм погибнет через 4-5 минут. Под действием прямых солнечных лучей он также теряет жизнеспособность.
Тифозная палочка очень чувствительна к химическим дезинфицирующим веществам. При воздействии хлорамина, сулемы, лизола она обеззараживается за несколько минут .
Тифозная палочка имеет сложную антигенную структуру. Но для диагностических целей используют только два антигенных комплекса: О-антиген (термостабильный соматический) и Vi-антиген (термолабильный жгутиковый). Патогенный микроорганизм способен образовывать L-формы, которые способствуют развитию бактериального носительства и рецидивов брюшного тифа.

Отличительные признаки брюшного тифа:
- острое начало болезни только в 1/3 случаев;
- нарушение сна, слабость и головная боль нарастают постепенно;
- кожа становится бледной и сухой;
- заторможенность реакций;
- интоксикация организма прогрессирует постепенно ;
- температура тела поднимается медленно, но переносится больными тяжело, при этом пациенты не потеют, кожа остается сухой;
- сердцебиение замедляется, незначительно снижается артериальное давление, при аускультации тоны сердца приглушены;
- появляется мягкий влажный кашель, который переходит в ранний бронхит;
- живот вздут, слышны урчания, которые локализуются в правом подреберье (область печени).

Для выделения возбудителя взятую у пациента кровь засеивают на специальную питательную среду – мясопептонный бульон.
Для исследования сдают венозную кровь из локтевой вены в количестве 10-15 мл все пациенты с высокой температурой. В некоторых случаях при подозрении на брюшной тиф посев крови могут проводить при нормальной температуре у больного. Кровь засевается сразу же после взятия и отправляется в лабораторию.
Сколько делается анализ? Предварительные данные можно получить через двое суток . Окончательный результат известен на 4-5 сутки. Чтобы подтвердить диагноз, исследование на гемокультуру проводят 2-3 раза.
Чтобы повысить качество посева и роста микроорганизма, за 20 минут до забора крови пациенту вводят адреналин. Посев крови должен проводиться до начала антибактериальной терапии, в противном случае результаты анализа будут недостоверными.
Серологические исследования – это специфические методы диагностики для выявления возбудителя. Их цель – обнаружение антител в сыворотке крови . При брюшном тифе антитела вырабатываются на 6-8 день заболевания.

РНГА на брюшной тиф проводится в комплексной диагностике с другими тестами, при поиске источников заражения в случае вспышки заболевания. Подготовка к исследованию:
- крови берут из локтевой вены;
- взятие материала должно производиться натощак;
- интервал между последним приемом пищи и сдачей крови не менее 8 часов.
РНГА брюшнотифозной диагностики обнаруживает Vi- и О-антитела. Для положительного результата минимальные диагностические титры должны составлять для Vi-антител – 1:80, для О-антител – 1:200 .

РПГА-тест на антитела при брюшном тифе становится положительным к концу второй недели болезни . Для достоверности результатов анализ крови на брюшной тиф повторяют через 5 дней. Если инфекция носит острый характер, то титры растут.
Кровь для РПГА на брюшной тиф берут утром натощак из локтевой вены. Положительные диагностические значения титров для Vi-антител – 1:40, для О-антител – 1:200 .
В диагностических целях могут быть использованы другие серологические методы:
- ИФМ – иммунофлюоресцентная микроскопия;
- ИФА – иммуноферментный анализ;
- реакция коагглютинации.

- лейкопения – лейкоциты в крови ниже нормы;
- анэозинофилия – отсутствие одного из вида лейкоцитов – эозинофилов;
- относительный лимфоцитоз – свидетельствует о снижении сопротивляемости организма;
- повышенное или умеренное СОЭ (скорость оседания эритроцитов);
- нейтрофильный лейкоцитоз – аномально высокое количество нейтрофилов – лейкоциты, которые вырабатываются иммунной системой в ответ на острый воспалительный процесс, при брюшном тифе – это бактериемия;
- тромбоцитопения – снижение количества тромбоцитов, отвечающих за свертываемость крови.
Общий анализ крови берут при поступлении больного в стационар, а также несколько раз во время лечения .

- За 3-4 часа до взятия кала нужно принять 30 г магнезиальной соли, чтобы каловые массы сделать более мягкими.
- Материал для исследования нужно брать только из жидкой части.
- Если в кале обнаруживаются примеси крови, гноя, слизи, их обязательно собрать для анализа.
- Количество кала – 10-15 г, набирают деревянным или пластиковым стерильным шпателем и помещают в банку с широким горлом.
Лучше посев производить сразу же у постели больного . Если нет возможности немедленно доставить его в лабораторию, то кал вносят в специальный консервант.

- провести тщательный туалет наружных половых органов;
- у тяжелобольных мочу собирают с помощью катетера;
- необходимое количество мочи – 40-50 мл.
Мочу доставляют в лабораторию. Для посева используют осадок . Чтобы его получить, материал центрифугируют, а затем засевают на плотные питательные среды.
Чтобы получить порцию желчи для анализа, больному делают дуоденальное зондирование . Для лучшего отхождения желчи пациенту в двенадцатиперстную кишку через зонд вводят раствор магнезии объемом 40-50 мл. В пробирки собирают три порции – А, В, С, каждая объемом 5-10 мл.

Анализ на брюшной тиф с положительным результатом подтверждает наличие инфекции в организме. Отрицательные показатели говорят об отсутствии болезни или ее раннем периоде . Если результаты анализов ложноположительные, это может свидетельствовать о перекрестной реакции с другими инфекциями. Недостоверный ответ также может быть при приеме антибактериальных препаратов.
Иммунологическая диагностика инфекционных заболеваний основана на выявлении антител в организме пациента к возбудителю инфекции методами серологических исследований. В основе всех серологических реакций лежит взаимодействие антигена и антитела с образованием иммунных комплексов, которые можно обнаружить в тестах in vitro.
Серологические реакции применяются в двух направлениях.
1. Обнаружение с диагностической целью антител в сыворотке крови обследуемого. В этом случае из двух компонентов реакции (антитела, антиген) неизвестным является сыворотка крови. Постановка реакции проводится с заведомо известными антигенами (диагностикумами). Положительный результат реакции свидетельствует о наличии в крови антител, гомологичных применяемому антигену; отрицательный результат указывает на отсутствие таковых. Достоверные результаты получают при исследовании “парных” сывороток крови больного, взятой в первые дни болезни и через разные промежутки времени от начала заболевания. В этом случае удается наблюдать динамику нарастания антител. При вирусных инфекциях лишь четырехкратное и большее повышение титра антител во второй сыворотке имеет диагностическое значение.
2. Установление родовой, видовой и типовой принадлежности микроба или вируса. В этом случае неизвестным компонентом реакции является антиген. Для этой цели используются диагностические иммунные сыворотки, полученные от животных после вакцинации соответствующими антигенами. Это серологическая идентификация микроорганизмов.
При инфекционных заболеваниях серологические исследования для обнаружения специфических антител являются более доступным методом лабораторной диагностики, чем бактериологическое выявление возбудителя. В ряде случаев серологические исследования являются единственным методом диагностики инфекционных заболеваний.
Серологические реакции протекают in vitro в две фазы:
специфическая — фаза взаимодействия, в которой происходит комплементарное соединение активных центров антител и эпитопов антигена. Обычно эта фаза длится несколько секунд или минут;
неспецифическая — фаза проявления, характеризуется внешними признаками образования иммунных комплексов. Эта фаза может развиваться от нескольких минут до нескольких часов.
Реакции антиген-антитело в системе in vitro могут сопровождаться возникновением нескольких феноменов — агглютинации, преципитации, лизиса. Внешние проявления реакции зависят от физико-химических свойств антигена (размеры частиц, физическое состояние), класса и вида антител (полные и неполные), а также условий опыта (консистенция среды, концентрация солей, рН, температура).
Поливалентность антигенов и антител обеспечивает возникновение видимых невооруженным глазом агрегатов. Это происходит в соответствии с теорией образования сетей, согласно которой к образовавшемуся комплексу антиген-антитело последовательно присоединяются другие молекулы антител и антигена, реагируя со свободными детерминантами и антидетерминантами. В результате формируются сетевые структуры, которые превращаются в агрегаты, выпадающие в осадок. Характер и выраженность реакции зависят от количественного соотношения антигенов и антител. Наиболее интенсивно реакции проявляются в том случае, если реагенты находятся в эквивалентном соотношении. Агрегаты, способные выпадать в осадок, образуются при соединении антигенов с полными антителами. Неполные антитела (моновалентные) не вызывают образования сетевых структур и крупных агрегатов. Для выявления таких антител используются специальные методы, основанные на использовании антииммуноглобулинов. Серологические реакции, благодаря высокой специфичности и чувствительности, применяют для выявления и количественного определения антигенов и антител. Количество иммунореагентов в реакциях выражают титром — максимальным разведением сыворотки или антигена, при котором еще наблюдается реакция. Чувствительность используемых серологических методов приведена в таблице.
Чувствительность методов серологических реакций.
Реакция связывания комплемента
Краткая характеристика серологических методов исследования.
Реакция агглютинации (РА). В этой реакции принимают участие антигены в виде частиц (микробные клетки, эритроциты и другие корпускулярные антигены), которые склеиваются антителами и выпадают в осадок. В зависимости от вида используемого иммунодиагностикума различают реакцию микробной агглютинации, гемагглютинации, латексагглютинации, коаглютинации и т.д. Для диагностики инфекционных заболеваний реакцию агглютинации проводят в двух направлениях: определяют вид выделенного от больного микроба-возбудителя с помощью диагностической агглютинирующей сыворотки (серологическая идентификация микроба) и обнаруживают специфические антитела в сыворотке больного, используя стандартный микробный диагностикум (серодиагностика заболевания, постановка серологического диагноза). Различают прямую и непрямую реакции агглютинации.
Реакция прямой агглютинации микробов. В этой реакции антитела (агглютинины) непосредственно агглютинируют корпускулярные антигены (агглютиногены). Обычно используется взвесь инактивированных микроорганизмов. Для определения вида микроорганизмов используют специальные диагностические агглютинирующие сыворотки, полученные путем гипериммунизации лабораторных животных взвесью бактерий. Титром такой сыворотки является ее наибольшее разведение, при котором наблюдается отчетливая агглютинация соответствующего антигена. Развернутую РА проводят в пробирках или лунках пластин. Диагностическую сыворотку разводят до титра и вносят одинаковые количества антигена. При положительной реакции на дне пробирки (лунки) образуется рыхлый осадок в виде «зонтика», при отрицательном — осадок в виде «пуговицы». Для определения антител в сыворотке больного (серологический диагноз) используют стандартный микробный диагностикум, содержащий взвесь известных микробов или их антигенов.
Реакция прямой агглютинации клеток. Используется для определения групп крови. Применяются стандартные сыворотки крови доноров, содержащие известные анти-А или анти-В антитела. Реакцию ставят на стекле или пластинах. При наличии на эритроцитах А (2-ая группа крови), В (3-я группа крови) антигенов или обоих антигенов А и В (4-ая группа крови) соответствующие сыворотки агглютинируют эритроциты (сыворотка анти-А агглютирует эритроциты 2-ой и 4-ой групп).
Реакция непрямой (пассивной) агглютинации . Для получения феномена агглютинации антиген предварительно адсорбируют на корпускулярном носителе, которым служат инертные частицы (латекс, целлюлоза, полистирол и др.) или клетки (эритроциты барана, 1(0)-группы крови человека). В реакции непрямой гемагглютинации (РНГА) в качестве носителя используют эритроциты. Нагруженные антигеном эритроциты склеиваются в присутствии специфических антител к данному антигену и выпадают в осадок. Если нагрузить эритроциты антителами, то их можно применять для выявления антигенов. Реакция непрямой гемагглютинации используется для определения в сыворотке больного антител к сальмонеллам, шигеллам,Yersinia pseudotuberculosis, Aspergillus fumigatus, Candida albicans. РНГА применяется для выявления антител к Tr. pallidum при лабораторной диагностике сифилиса.
Прямая и непрямая антииммуноглобулиновые реакции Кумбса . Используются для выявления «неполных» (неагглютинирующих) антител, которые образуются при различных заболеваниях: резус конфликте, аутоиммунных заболеваниях. Для постановки этих реакций необходима антиглобулиновая сыворотка, которую получают путем иммунизации кролика глобулинами человека. Такая сыворотка содержит полные (бивалентные) антитела-антииммуноглобулины. Прямая реакция: к отмытым эритроцитам крови больного добавляют антииммуноглобулиновую сыворотку. Если на эритроцитах есть неполные антитела (гемолитическая анемия, резус конфликт), то они агрегируются. Непрямая реакция выявляет свободные антиэритроцитарные антитела в сыворотке крови больного. К сыворотке крови больного добавляют отмытые эритроциты донора 0(1) группы крови. Смесь инкубируют при 37 градусах Цельсия в течение 30 минут и отмывают эритроциты. Затем к ним добавляют антииммуноглобулиновую сыворотку. Если в сыворотке больного были неполные антиэритроцитарные антитела, то наступает агглютинация.
Реакция связывания комплемента (РСК) . В РСК помимо антигена и антител принимает участие третий компонент — комплемент, который способен связываться с комплексом антиген-антитело. Образование комплексов антиген-антитело и фиксация комплемента не сопровождаются видимыми изменениями. Для обнаружения связывания комплемента используют дополнительную индикаторную гемолитичесчкую систему (эритроциты барана, обработанные гемолитической антисывороткой). В присутствии комплемента (сыворотки морской свинки) происходит лизис эритроцитов. Если в опытной системе образовались комплексы антиген-антитело, которые связывают комплемент, то лизис эритроцитов в индикаторной системе не произойдет (реакция положительная). РСК используется при определении антител к вирусу Коксаки, при лабораторной диагностике сифилиса — реакция Вассермана.
Реакция лизиса. Сущность реакции состоит в том, что при взаимодействии специфических антител с антигенами клеток (эритроцитов, бактерий), на их поверхности образуется комплекс, который активирует комплемент по классическому пути, вследствие этого происходит лизис этих клеток. Эта реакция используется при типировании антигенов системы HLA на лимфоцитах. К типируемым лимфоцитам добавляют антисыворотки против различных HLA-антигенов, затем их отмывают и добавляют комплемент. Присутствие соответствующего антигена приводит к лизису лимфоцитов.
Реакция иммунофлюоресценции. Прямой метод иммунофлуоресценции (по Кунсу) основан на взаимодействии антител, меченных флуорохромом с антигеном, который нахо-дится на клетке, в клетке или тканях. В качестве флуорохрома часто используют флуоресцеинизотиоцианат (ФИТЦ). Этот краситель дает зеленое свечение в ультрафеолетовых лучах, а тетраметилродаминизотиоцианат (ТРИТЦ) — оранжево-красное свечение. Прямой метод одноэтапный: на фиксированный мазок клеток с антигеном наносят диагностическую сыворотку с мечеными антителами, инкубируют, отмывают и учитывают свечение в люминесцентном микроскопе. Непрямой метод иммунофлуоресценции заключается в том, что антиген обрабатывают обычной диагностической сывороткой, а для обнаружения образовавшегося комплекса антиген-антитело используют антисыворотку, меченную флуорохромом. Непрямой метод позволяет обнаруживать различные комплексы антиген-антитело с помощью одной меченной антиглобулиновой сыворотки. Метод иммунной флуоресценции применяют для идентификации бактерий, вирусов, клеточных рецепторов и антигенов.
Иммуноферментный анализ (ИФА). В методах иммуноферментного анализа используют иммунореагенты, меченные ферментами. Наиболее широко используется твердофазный ИФА. В качестве твердой фазы используют полистироловые или поливиниловые планшеты или шарики, на которых адсорбированы антигены или антитела. Для выявления антител известный антиген адсорбируют в лунках полистироловой пластины. Затем вносят исследуемую сыворотку, в которой хотят обнаружить антитела к данному антигену. После инкубации лунки промывают для удаления несвязавшихся белков и вносят в них антииммуноглобулиновые антитела, меченые ферментом. После инкубации и отмывания в лунки добавляют специфичный для фермента субстрат и хромоген для регистрации конечных продуктов расщепления субстрата. О наличии и количестве антител судят по изменению цвета и интенсивности окраски раствора. Методы ИФА обладают высокой чувствительностью и специфичностью и получили наиболее широкое распространение среди иммунологических методов клинико-лабораторной диагностики.
Радиоиммунологический анализ. Принцип радиоиммунологического анализа (РИА) основан на выявлении комплекса антиген-антитело, в котором один из иммунореагентов был мечен радиоактивным изотопом. Обычно используют изотопы йода (I-125 и I-131). Учет реакции проводят по убыванию или по возрастанию радиоактивности (в зависимости от методики РИА) с помощью специальных счетчиков ионизирующего излучения. Метод высокочувствителен, но постепенно вытесняется иммуноферментным анализом, учитывая не безопасность работы с радиоактивными изотопами и необходимость в сложном регистрирующем оборудовании.
Иммуноблотинг. Вариант ИФА, повышающий чувствительность метода при изучении гетерогенной смеси антигенов. Смесь антигенов подвергают дискэлектрофорезу в полиакриламидном геле в присутствии додецилсульфата натрия. Полученные таким образом индивидуальные полосы антигенов переносят на нитроцеллюлозные полоски с помощью специального аппарата для переноса. В дальнейшем ход реакции сводится к гетерогенному не конкретному ИФА. Нитроцеллюлозные полоски с перенесенными на них антигенами обрабатывают испытуемой сывороткой. Имеющиеся в ней антитела связываются с индивидуальными антигенами, представленными в виде отдельных полос. Связавшиеся антитела проявляют при обработке конъюгатом фермента с антителами к иммуноглобулинам человека. На последнем этапе определяют активность фермента. Таким образом, можно определить против каких антигенов смеси направлены антитела сыворотки больного. На основе реакции иммуноблотинга созданы диагностические наборы для определения в сыворотке больного антител к вирусу гепатита С и ВИЧ-1-2.
Гибридизационный анализ (ГА). Проводится определение нуклеиновых кислот по связыванию с ДНК- и РНК- зондами. Метод ГА основан на отжиге одноцепочечного фрагмента нуклеиновой кислоты на комплиментарный ему участок другой молекулы анализируемой нуклеиновой кислоты с образованием двух цепочечной гибридной молекулы. Зонд может быть получен либо химическим синтезом олигонуклеотидов. Либо с помощью синтеза ДНК на одной из нитей детектируемой ДНК с помощью фермента ДНК-поли-меразы (для РНК с помощью РНК-зависимой ДНК-полимеразы). Полученная копия может быть встроена в плазмиду и затем размножена в составе каких-либо бактерий. Зонд должен иметь репортерную группу, выявляемую ферментативно или физическим методом. В настоящее время в медицинской практике успешно применяются ДНК-зонды, в которых в качестве репортерных групп используют биотин, дегоксигенин, комплексы платины и др. Введение меток может производиться с помощью химических, физических, фотохимических и ферментативных реакций. В частности при амплификации. Также разнообразны методы детекции образовавшегося гибрида нуклеиновых кислот: с помощью хромогенных и хемилюминесцентных субстратов высокоактивных ферментов (пероксидаза, щелочная фосфатаза), люминесценции и др. На основе нерадиоизотопного ГА созданы диагностикумы для выделения вируса папилломы, герпеса, хламидий и уреаплазмы.
Полимеразная цепная реакция (ПЦР). ПЦР — это метод умножения числа копий нуклеиновых кислот (амплификация) in vitro. Перед проведением реакции из биологического материала выделяют ДНК или РНК возбудителя инфекционного заболевания или ДНК генома клеток человека. Полимеразная цепная реакция проводится с использованием двух или более олигонуклеотидных праймеров («затравки»), фланкирующих участок ДНК (РНК), специфический для определяемого участка генома. Процесс амплификации заключается в повторяющихся циклах температурной денатурации ДНК, отжига праймеров с комплементарными последовательностями и последующей достройки полинуклеотидных цепей с этих праймеров ДНК-полимеразой. Праймеры ориентированы таким образом, что синтез с помощью полимеразы протекает только между ними, удваивая количество копий этого участка ДНК в каждом последующем цикле. Как правило, проводится не менее 30 последовательных циклов реакции. Амплифицированный учасок именуют «ампликоном». В результате реакции происходит экспоненциальное увеличение количества копий специфического фрагмента. При амплификации используется термостабильная ДНК-полимераза, выделенная из бактерий Thermus aquaticus (Taq), живущих в горячих источниках.
Иммуноферментный метод диагностики сифилиса . Из всех серологических методов диагностики сифилиса ИФА метод является наиболее чувствительным (свыше 95%) и специфичным (100%). При использовании метода ИФА выявляются антитела класса IgM и IgG. Антитела класса IgM имеют важное значение для диагностики первичного, вторичного и врожденного сифилиса. Выявление антител к иммуноглобулинам класса М говорит о наличии у больного первичного, вторичного или врожденного сифилиса. В процессе лечения уровень антител класса IgM у больного снижается. По его уровню можно следить за эффективностью проводимого лечения. После успешного лечения уровень антител класса IgM снижается до отрицательных результатов. Антитела класса IgG появляются в острый период заболевания и могут сохранять у вылечившихся пациентов до 20 лет и более. При использовании ИФА метода сифилис диагносцируется в более ранние сроки, чем при использовании РВ. Согласно приказа Минздравмедпрома РФ №286 от 7 декабря 1993 года “О совершенствовании контроля за заболеваниями, передаваемыми половым путем” в качестве специфического теста для подтверждения сифилиса, вместо реакции иммобилизации бледных трепонем и РИФ рекомендуется использовать иммуноферментный анализ.
Серологическая диагностика вирусных инфекций .
Диагностика цитомегаловирусной инфекции . Возбудитель цитомегаловирусной инфекции принадлежит к семейству Herpes-viridae (герпесвирус человека 5), подсемейству бета, роду Cytomegalovirus (CMV — ЦМВ). Как и другие вирусы этого семейства ЦМВ способен вызывать персистентную и латентную инфекцию и реактивироваться в условиях ослабления иммунитета. ЦМВ распространен повсеместно. От 0,5% до 2,5% новорожденных детей инфицируются им в период внутриутробного развития, 10% из них погибают в течение года. Инфицирование плода может вызвать нарушение функциональных механизмов дифференцировки клеток и тканей органов. 10-60% детей заражаются при прохождении через родовые пути и в первые 6 месяцев жизни через грудное молоко.
В серологической диагностике ЦМВ инфекции используется много реакций, однако по-настоящему полезны те из них, которые могут выявить антитела, относящиеся к классам иммуноглобулинов М и G. Наличие антител IgM свидетельствует о свежем инфицировании или реактивации латентной и персистентной инфекции. Однако, повышение антител класса IgM может не выявляться в течение первых 4 недель после начала заболевания. В то же время до 2 лет после выздоровления титры могут оставаться высокими. В связи с этим однократное определение уровня антител IgM бесполезно при оценке остроты инфекции. Важно наблюдать за динамикой изменения уровня антител IgM (нарастание их уровня или снижение). Наличие антител IgM у беременных является показанием для кордоцентеза и исследования крови плода на наличие антител IgM. При наличии антител IgM он считается инфицированным.
Известно, что 15-20% вирусных гепатитов обусловлено поражением печени ЦМВ. Кроме того, продукты IE-генов ЦМВ способны трансактивировать экспрессию Hbs- и Cor-антигенов вирусного гепатита В. Поэтому, возможно, ЦМВ играет этиологическую роль в возникновении карцином печени. Установлена связь ЦМВ-инфекции с развитием сахарного диабета. ЦМВ поражает многие типы клеток крови и может персистировать в моноцитах, макрофагах, мегакариоцитах, что в ряде случаев приводит к тромбоцитопении.
Группой наибольшего риска для ЦМВ-инфекции являются лица с искусственной или естественной иммуносупрессией — ВИЧ-инфицированные, реципиенты органов, тканей, клеток, онкологические больные. При оценке результатов выявления антител IgM следует учитывать, что наличие циркулирующих ревма-тоидных факторов может привести к ложноположительным результатам исследования. Антитела IgG появляются в период реконвалесценции и у переболевших сохраняются до 10 лет. Частота выявления антител класса IgG может достигать 100% среди различных групп населения.
Диагностика герпетической инфекции. Герпесвирусы человека типа 1 (HSV-1) и типа 2 (HSV-2) характеризуются эффективным разрушением зараженных клеток, относительно коротким репродуктивным циклом и способностью пребывать в латентной форме в ганглиях нервной системы. Ранее считалось, что HSV-1 вызывает преимущественно назолабильный герпес, а HSV-2 — генитальный. В настоящее время установлено, что оба возбудителя вызывают герпетические поражения и той, и другой локализации. Генерализованный герпес чаще вызывает HSV-2. Основным методом диагностики герпетической инфекции в настоящее время является серологический метод — выявление антител к вирусу герпеса простого типа 1 и 2 в сыворотке.
Антитела к вирусу простого герпеса обнаруживают у 80-90% взрослых людей. В развитых странах западной Европы генитальный герпес встречается в 7 раз чаще, чем сифилис и занимает второе место среди инфекций, передающихся половым путем после трихомониаза. Однократное определение уровня антител к вирусу герпеса простого типа 1 и 2 в сыворотке бесполезно при оценке остроты инфекции. Важно наблюдать за динамикой изменения уровня антител (нарастание их уровня или снижение). При острой инфекции или реактивации вируса выявляется нарастание уровня антител к вирусу герпеса простого типа 1 и 2. Пик титров антител к вирусу герпеса простого типа 1 и 2 в крови отмечается через 4-6 недель после развития клинической картины заболевания. Реинфекция у лиц с существующими до этого антителами не вызывает существенного изменения в титре антител даже при выраженной клинической картине.
Диагностика кори . Возбудитель кори — Рolinosa morbillarum относится к классу РНК-вирусов. Заболевают корью чаще дети дошкольного возрастта. Однако лица, не болевшие корью, остаются высоко восприимчивыми к ней в течение всей жизни и могут заболеть в любом возрасте. Заболеваемость корью выше в холодные периоды года (с ноября по март); через каждые 2-4 года наблюдаются подъемы заболеваемости. Для лабораторной диагностики кори используются РНГА, РСК и метод иммуноферментного анализа, определение антител IgМ и IgG к вирусу кори в сыворотке. Серологические методы исследования применяются для подтверждения диагноза, особенно стертых, атипичных форм. Наиболее часто используется РТГА и РСК. Поскольку в этих реакциях учитывается нарастание титра антител в парных сыворотках, то специфическая диагностика является ретроспективной. Первую пробу крови берут не позже 3-го дня периода высыпаний, вторую спустя 10-14 дней. Диагноз считается верифицированным только при нарастании титра антител в 4 раза и более. При применении метода иммуноферментного анализа выявляются антитела классов IgM и IgG. Антитела IgM появляются в острый период инфекции (пик к 10-му дню) и могут сохраняться до 2 лет (обычно исчезают к 90-му дню). Наибольшая вероятность выявления антител IgM отмечается в период высыпаний. Определение антител IgM применяется для диагностики острого периода коревой инфекции. Ложноположительные реакции можно получить при хроническом активном гепатите, СКВ, инфекционном мононуклеозе. Антитела IgG появляются в период реконвалесценции и у переболевших сохраняются до 10 лет. Появление антител IgG в конце острого периода заболевания является прогностически благоприятным признаком. Определение антител IgG применяется для диагностики кори и оценки напряженности противокоревого иммунитета.
Диагностика вирусного паротита . Возбудитель эпидемического паротита относится к миксовирусам. Эпидемическим паротитом чаще болеют дети 3-10 лет. В распространении инфекции большое значение имеют бессимптомные формы эпидемического паротита. Частота этих форм составляет 21,8-88% по отношению к общему числу инфицированных. Основным методом лабораторной диагностики эпидемического паротита является определение антител классов IgМ к вирусу паротита в сыворотке. Дети до 2 лет болеют эпидемическим паротитом редко, но затем заболеваемость возрастает и достигает пика к 5-9 годам. Диагностика эпидемического паротита основывается на клинической картине заболевания. Серологическое подтверждение острой инфекции может быть получено с помощью иммуноферментного метода, позволяющего определять антитела класса IgM. Антитела IgM появляются в острый период инфекции (в первые дни заболевания) и сохраняются до 2 лет (Казанцев А.П., 1988).
Диагностика ветряной оспы . Ветряная оспа и опоясывающий герпес — инфекционные болезни, вызываемые одним и тем же вирусом. Восприимчивость к ветряной оспе является всеобщей, но главным образом поражаются дети от 6 месяцев до 7 лет. В типичных случаях заболевания, т.е. у большинства больных, диагностика заболевания основана на клинических данных. Для лабораторного подтвержедения диагноза используется иммунноферментный метод определения антител IgМ к вирусу ветряной оспы в сыворотке. Верифицировать диагноз можно, используя метод иммуноферментного анализа, с помощью которого выявляются антитела класса IgM. Антитела IgM появляются в острый период инфекции и сохраняются до 2 лет.
Диагностика Т-клеточного лейкоза . HTLV I и HTLV II (human T-lymphotropic virus) относятся к группе ретровирусов. Вирус HTLV I обнаруживается у больных Т-клеточным лейкозом, а вирус HTLV II у больных так называемым волосатоклеточным лейкозом. Обе формы лейкоза характеризуются злокачественной трансформацией Т-лимфоцитов. Т-клеточный лейкоз встречается спорадически в Европе и Северной Америке, эндемическая форма обнаружена в южной части Японии и странах Карибского моря. Инфекция HTLV протекает как лихорадочное заболевание с обратимым процессом Т-клеточной пролиферации, лишь дополнительные транслокации приводят к злокачественной пролиферации. Вирус HTLV I повышает риск появления транслокаций. Выявление антител к вирусу Т-клеточного лейкоза помогает клиницисту в установлении этиологических причин лихорадки неясного генеза. У больных антитела появляются в конце острого периода заболевания, но выявляются не у всех больных. Различают две основные формы клеток при Т-клеточном лейкозе: клетки хелперы/индукторы (маркер CD4) или супрессоры/цитотоксические клетки (маркер CD8). Хелперный тип протекает как агрессивный лейкоз с высоким лейкоцитозом и относительно короткой продолжительностью жизни. Если клетки, в основном, несут маркер CD8, прогноз заболевания несколько более благоприятный (Лысенко А.Я., 1995). Современные эпидемиологические исследования показали смешанное присуствие обоих вирусов (HTLV I и HTLVII) среди различных групп населения, относящихся к группам высокого риска (использующие частые внутривенные введения лекарств и пациенты после трансфузий). Для выявления антител к вирусам HTLV I и HTLV II используются иммуноферментные наборы, которые имеют высокую чувствительность и специфичность. Исследование является скрининговым, и для подтверждения первично выявленных положительных результатов необходимо подтверждение — проведение иммуноблотинга. НTLV вирус может быть возбудителем следующих заболеваний: — острые и хронические лейкозы, острый и хронический лимфолейкозы, Т-клеточная лимфома, синдром Сезари, волосатоклеточный лейкоз, лимфоаденопатии, лимфопролиферативные заболевания.
Диагностика краснухи. Возбудитель краснухи относится к РНК-вирусам. Заболевание широко распространено во всех странах. Для серологической диагностики используется РТГА и ИФА. Точный диагноз краснухи можно установить только посредством выделения и идентификации вируса, либо на основании изменений титров специфических антител. Специфические антитела в реакции торможения гемаглютинации можно обнаружить на 2-й день после появления высыпаний, причем количество их увеличивается в течение последующих 10-21 дней. Для диагностики краснухи используются также иммуноферментный метод на выявление специфических антител классов IgM и IgG. Динамика выявления антител при использовании иммуноферментного метода соответствует результатам реакции торможения гемаглютинации. Антитела IgM появляются в острый период инфекции. Наличие специфических антител класса IgM свидетельствует о недавно произошедшем заражении краснухой (в пределах 2 месяцев), однако в некоторых случаях они могут сохраняться до 1 года. На первом году жизни у детей с врожденной краснухой часто обнаруживают специфические антитела класса IgM, они могут исчезнуть на 3-м или 4-м году жизни. Однократные титры, даже > 256, не могут считаться показателем свежей инфекции, поэтому титр антител класса IgM следует смотреть в динамике. Определение антител класса IgM используется для диагностики острого периода заболевания. Антитела IgG появляются в период реконвалесценции и у переболевших сохраняются до 10 лет и более. Определение антител класса IgG используется для оценки напряженности поствакцинального иммунитета и определения инфекции в анамнезе.
Диагностика гриппа . Возбудители гриппа относятся к семейству ортомиксовирусов, включающих 3 рода вирусов гриппа: А, В, С. Вирусы гриппа содержат РНК, наружную оболочку, в которой размещены 2 антигена — гемагглютинин и нейрамидиназа, способные менять свои свойства, особенно у вируса типа А. Точная идентификация возбудителя заболевания проводится посредством РСК или методом иммуноферментного анализа. При РСК исследование проводят в начале заболевания и через 5-7 дней, диагностическим считается нарастание титра антител не менее чем в 4 раза при исследовании парных сывороток. По сравнению с РСК метод иммуноферментного анализа отличается большей чувствительностью. Как и при РСК, для использования в диагностических целях иммуноферментного анализа требуется сравнение уровня антител в пробах сыворотки, полученных от больных в начале и в конце заболевания.
Диагностика парагриппа . Известно 4 типа вирусов парагриппа: 1, 2, 3, 4, все они относятся к РНК-вирусам. Выделение вируса во внешнюю среду происходит в течение первой недели заболевания. В межэпидемическое по гриппу время парагриппозные заболевания составляют до 15-30% всех острых респираторных инфекций у взрослых. Точная идентификация возбудителя заболевания проводится посредством РСК или методом иммуноферментного анализа. При РСК исследование проводят в начале заболевания и через 5-7 дней, диагностическим считается нарастание титра антител не менее чем в 4 раза при исследовании парных сывороток. По сравнению с РСК метод иммуноферментного анализа отличается большей чувствительностью. Как и при РСК, для использования в диагностических целях иммуноферментного анализа требуется сравнение уровня антител в пробах сыворотки, полученных от больных в начале и в конце заболевания.
Диагностика аденовирусной инфекции . В настоящее время у человека выделено более 40 серотипов аденовирусов. Аденовирусные заболевания широко распространены как в виде спорадических случаев, так и в виде вспышек. Аденовирусными инфекциями чаще всего болеют младенцы и дети. Среди острых респираторных заболеваний в меж-эпидемическое время удельный вес аденовирусных инфекций колеблется от 3 до 20%, во время вспышек — может доходить до 80-90% (Матков-ский В.С., Казанцев А.П., 1970).
Точная идентификация возбудителя заболевания проводится посредством РСК или методом иммуноферментного анализа. При РСК исследование проводят в начале заболевания и через 5-7 дней, диагностическим считается нарастание титра антител не менее чем в 4 раза при исследовании парных сывороток. По сравнению с РСК метод иммуноферментного анализа отличается большей чувствительностью. Как и при РСК, для использования в диагностических целях иммуноферментного анализа требуется сравнение уровня антител в пробах сыворотки, полученных от больных в начале и в конце заболевания.
Диагностика респираторно-синтициальной инфекции . Респираторно-синтициальный вирус относится к парамиксовирусам. Заболевание характеризуется преимущест-венным поражением органов дыхания (бронхиты, пневмонии). Респираторно-синтициальный вирус является важнейшим возбудителем респираторных заболеваний у детей младшего возраста и частой причиной патологии нижних отделов дыхательных путей у младенцев. Точная идентификация возбудителя заболевания проводится посредством РСК или методом иммуноферментного анализа. При РСК исследование проводят в начале заболевания и через 5-7 дней, диагностическим считается нарастание титра антител не менее чем в 4 раза при исследовании парных сывороток, но этот метод исследования менее чувствителен у детей в возрасте до 4 месяцев. По сравнению с РСК метод иммуноферментного анализа отличается большей чувствительностью при выявлении уровня подъема антител у новорожденных. Как и при РСК, для использования в диагностических целях иммуноферментного анализа требуется сравнение уровня антител в пробах сыворотки, полученных от больных в начале и в конце заболевания. Повышенные значения уровня антител при однократном исследовании могут указывать на ранее перенесенную инфекцию. Повторная инфекция сопровождается повышением уровня антител при исследовании в динамике.
Диагностика инфекционного мононуклеоза . Вирус Эпштейн-Барра — вирус из группы герпеса, обладает тропизмом к В-лимфоцитам, длительно персистирует в клетках хозяина в виде латентной инфекции. Вирус Эпштейн-Барра вызывает заболевание — инфекионный мононуклеоз. Он широко распространен во всем мире. С вирусом Эпштейн-Барра связывают этиологию и лимфомы Беркитта. Лабораторные исследования, в зависимости от применяемых методов, позволяют выявить антитела различного класса.
Из серологических методов диагностики заболевания наиболее распространена реакция Пауля-Буннеля, направленная на выявление гетерофильных антител в сыворотке. Диагностический титр — 1:32 и выше. Антитела к эритроцитам барана называются геторофильными антителами, которые можно обнаружить у 50% детей и 90-95% подростков и взрослых с мононуклеозом. Если исследование проводится в первую неделю заболевания, то у 10-15% пациентов с мононуклеозом результаты исследования могут быть отрицательными. Поэтому, если клиническая картина заболевания сходна с таковой при инфекционном мононуклеозе, то исследование на наличие гетерофильных антител следует повторить на 2-й или 3-й неделе заболевания. Уровень гетерофильных антител снижается по окончании острого периода инфекционного процесса, однако их титр можно определить в течение 9 месяцев после появления клинических симптомов. На смену методу определения антител к эритроцитам барана с титрованием в пробирке пришел метод “одного пятна”, который является более чувствительным и специфичным. Если гетерофильные антитела не выявляются, а клиническая картина заболевания соответствует инфек-ционному мононуклеозу, необходимо исследовать сыворотку крови на специфические антитела классов IgM и IgG в ИФА. Диагностическим критерием первичной инфекции является обнаружение антител класса IgM, представляющих собой антитела к антигену вирусного капсида. Антитела класса IgM появляются в острой стадии заболевания и исчезают через 1-3 месяца. Практически у всех пациентов с клиническими проявлениями заболевания имеются антитела, относящиеся к IgG (также антитела к капсидному антигену вируса), которые сохраняются пожизненно. Вследствие этого антитела класса IgG целесообразно использовать главным образом в качестве критерия подверженности инфицированию вирусом Эпштейн-Барра, но нельзя применять для диагностики первичной инфекции.
Диагностика инфекций, вызываемых стрептококками A,B,C,D,F,G. Стрептококки относятся к самым распространенным возбудителям бактериальных инфекций у человека. На основании антигенных различий большая часть стрептококков, выделенных от человека, относятся к группам A,B,C,D,F,G. Стрептококки группы А имеют исключительно важное значение, поскольку часто вызывают инфекционные заболевания у человека и играют существенную роль в развитии ревматизма и гломерулонефрита. Стрептококки группы В часто гнездятся в женских половых путях и на слизистых оболочках глотки и прямой кишки. Стрептококки групп С и G представляют собой комменсалы, но они способны вызывать фарингиты. Стрептококки группы D часто служат причиной инфекции мочевых путей у больных с их структурными аномалиями и более чем в 10% случаев относятся к этиологическим факторам при бактериальном эндокардите.
Ведущее место в диагностике заболеваний, вызываемых стрептококком, отводится бактериологическим методам. Серологическая диагностика направлена на выявление титра антител в сыворотке больного. Диагностическим считается нарастание титра антител через 10-14 суток не менее чем в 4 раза при исследовании парных сывороток. Однократное исследование диагностического значения не имеет, так как практически у 100% взрослых в сыворотке определяются антитела к стрептококкам. Маркер острой стрептококковой инфекции — антитела против стрептококкового гемолизина-О (АСЛО). Уровень повышается в острый период инфекции (7-14 день) и снижается в период реконвалесценции и вы-здоровления. В клинической практике используется для наблюдения за динамикой ревматического процесса. Титр АСЛО повышается у 80-85% больных с ревматической лихорадкой. Диагностическое значение имеет стойкое значительное повышение активности АСЛО. К 3-й неделе заболевания ревматизмом титр значительно повышается, достигая максимума к 6-7 неделе. При благоприятном течении процесса к 4-8 месяцу активность АСЛО снижается до нормы. Под влиянием проводимой терапии эти сроки могут сократиться. Отсутствие снижения активности антистрептолизина-О к 6 месяцу заболевания позволяет предположить возможность рецидива. Стойкое и длительное повышение активности после ангины может быть предвестником ревматического процесса. В 10-15% случаев ревматизма повышения активности АСЛО не определяется.
Повышение АСЛО находят у некоторых больных с ревматоидным артритом, однако уровень повышения АСЛО при этом заболевании ниже, чем при ревматизме. При выделении b -гемолитических стрептококков группы А повышенные титры АСЛО выявляются у 40-50% бактерионосителей. Повышение уровня АСЛО характерно для: ревматизма, острой стрептококковой инфекции: ангины, скарлатины, пиодер-мии, гнойных воспалительных процессов, хронического тонзиллита, острого нефрита, гломерулонефрита.
Диагностика инфекций, вызываемых стафилококками . Стафилококк является одним из наиболее часто встречающихся микробов. У человека стафилококк чаще всего вызывает гнойные заболевания и осложнения при соматических и хирургических заболеваниях. Ведущее место в диагностике заболеваний, вызываемых стафилококком отводится бактериологическим методам. Серологическая диагностика направлена на выявление титра антител в сыворотке больного. Диагностическим считается нарастание титра антител через 7-10 суток при исследовании парных сывороток. Однократное исследование диагностического значения не имеет, так как практически у 100% взрослых в сыворотке определяются антитела к стафилококкам.
Диагностика инфекций, вызываемых пневмококками . Пневмококк (Streptococcus pneumoniae) чаще всего встречается как возбудитель пневмонии, у маленьких детей он может вызывать менингит, а у взрослых изредка вызывает сепсис. Лабораторная диагнос-тика пневмококковых инфекций складывается, в основном, из бактериоскопического и бактериологического исследований, серологическая диагностика играет вспомогательную роль. Серологическая диагностика направлена на выявление титра антикапсулярных антител в сыворотке больного. Диагностическим считается нарастание титра антител через 7-10 суток при исследовании парных сывороток.
Диагностика инфекций, вызываемых гемофильной палочкой . Палочка инфлюэнцы инфицирует только людей и локализуется, прежде всего, в верхних дыхательных путях. За последние 30-45 лет заболеваемость системными формами инфекции, вызываемой палочкой инфлюэнцы типа b, увеличилась в 4 раза, причем чаще стали распознаваться случаи поражения у взрослых. Выделение палочки инфлюэнцы при бактериологических посевах из носоглотки диагностического значения не имеет ввиду широкого распространения носительства палочки среди здоровых людей (у 90%). Для диагностики исследуются кровь, моча, жидкость из плевры, суставов, спинномозговая жидкость и др. Определение антител к гемофильной палочке в сыворотке является ретроспективным методом диагностики заболевания, так как необходимо исследовать сыворотку в первую неделю заболевания и через 10-14 суток. Диагностическим считается нарастание титра антител через 10-14 суток не менее чем в 4 раза при исследовании парных сывороток.
Диагностика менингококковой инфекции . Возбудителем менингококковой инфекции является грамотрицательный диплококк Neisseria meningitis. Выделяют 5 серологических типов менингококка — A,B,C,D,E. В период эпидемий преобладает тип А, во внеэпидемический период — тип В. В диагностике менингококковой инфекции главное место отводится бактериологическому методу исследования. Однако, культивирование менигококков и выделение их в чистой культуре удается лишь у 30-40% больных. В связи с этим для диагностики используются серологические методы, наиболее чувствительны и информативны из них — РНГА и иммуноферментный методы. Исследуется сыворотка крови больного на 1-3 день от начала заболевания и на 7-10 день. Диагностическим считается нарастание титра антител через 7-10 суток не менее чем в 4 раза.
Диагностика бруцеллеза . Возбудитель бруцеллеза — бруцеллы — мелкие неподвижные грамотрицательные бактерии. При постановке диагноза бруцеллеза полученные клинико-эпидемиологические данные должны быть подтверждены лабораторно. С этой целью используются бактериологический, биологический и серологический методы исследования.
Реакция Хеддельсона на стекле используется для полуколичественного определения антител к возбудителю бруцеллеза и является ориентировочным тестом. Самым надежным серологическим тестом определения антител к возбудителю бруцеллеза в сыворотке является реакция агглютинации Райта, посредством которой определяют уровень антител, реагирующих, главным образом, с липополисахаридными антигенами бруцелл. Увеличение титров антител в 4 и более раз в пробах сыворотки крови, полученных с интервалом 1-4 недели, позволяет идентифицировать этиологический фактор заболевания. У большинства больных повышение титров специфических антител отмечается на 3-5-й день от начала заболевания, а на 3-й неделе фактически у всех происходит сероконверсия. Достоверным считается титр антител не менее 1:200 с последующим его нарастанием. Причиной ложноположительных результатов может служить проведение кожной пробы на бруцеллез, вакцинация против холеры, а также инфекции, вызванные холерным вибрионом, иерсиниями.
Агглютинирующие антитела IgG можно определить в реакции агглютинации путем экстрагирования с 2-меркаптоэтанолом. Антитела IgG появляются на 2-3-й неделе от начала заболевания, титры их достигают максимума примерно через 8 недель и сохраняются весь период активной инфекции, благодаря чему они свидетельствуют о продолжающемся активном инфекционном процессе. На фоне проводимого лечения титры антител IgG быстро снижаются и в течение года приближаются к нулю. В случае рецидивов уровень антител IgG снова повышается. Наличие однократного повышения титра антител IgG > 1: 160 является надежным объективным указанием на текущую или недавно имевшую место инфекцию и необходимость проведения лечения. После проведенного лечения и выписки больного из стационара рекомендуется проведение серологических исследований в течение первого года через 1,2,3,6,9,12 месяцев, а в течение второго года — ежеквартально.
Диагностика сальмонелезной инфекции . Описано более 2200 серологических вариантов сальмонелл, из них у человека более 700. Наиболее часто встречаются следующие сальмонеллы: S.typhimurium, S.heidelberg, S.enteritidis, S.anatum, S.derby, S.london, S.panama, S.newport. Ежегодно 20-35% изолятов приходится на S.typhimurium (Пак С.Г. с соавт., 1988).
Антигенная структура сальмонелл сложна. Она содержит О- и Н-антигены. О-антиген связан с соматической субстанцией клетки, термостабилен, одним из его компонентов является Vi-антиген; Н-антиген обладает жгутиковым аппаратом, термолабилен. Различия в строении О-антигенов позволили выделить серологические группы сальмонелл: А,В,С,D,Е и др. На основании различий в строении Н-антигенов внутри каждой группы установлены серологические варианты. В лабораторной диагностике сальмонеллезной инфекции испольуются бактериологические и серологические методы диагностики. Среди серологических методов диагностики до последнего времени широко применялась реакция Видаля, которая в последние годы постепенно утрачивает свое значение.
В настоящее время для выявления антител к сальмонеллам наиболее широко используются РПГА и иммуноферментный метод, которые более чувствительны и дают положительные результаты с 5-го дня заболевания (реакция Видаля на 7-8 день). Антитела у больных брюшным тифом, паратифом или другими серологическими типами сальмонелл появляются в крови уже к 4-му дню болезни и резко нарастают к 8-10-му дню. Количество их еще более увеличивается на 2-3-й неделе заболевания (Пак С.Г. с соавт., 1988). В первые месяцы после выздоровления исследование на антитела к сальмонеллам может служить и для целей ретроспективного диагноза. Необходимо, однако, учитывать индивидуальные отклонения от нормального цикла иммуногенеза и изложенной динамики изменения титра антител. В ослабленном организме со сниженной реактивностью слабо и медленно вырабатываются антитела. Интеркурентные заболевания также могут задержать их формирование. Таким образом, титр антител менее 1:200 не позволяет исключить заболевание, поэтому чрезвычайно важно исследовать титр антител в динамике в начале заболевания и через 10-14 суток. Нарастание титра антител через 10-14 суток не менее чем в 4 раза при исследовании парных сывороток свидетельствует об инфекционном процессе.
На основании антигенной структуры, присущей различным видам сальмонелл, разработаны О- и Н-монодиагностикумы, которые позволяют установить серологический вариант сальмонелл. Первоначально исследуется сыворотка в РПГА с комплексным препаратом диагностикума эритроцитарного сальмонелезного-О. Далее, при наличии агглютинации с комплексным диагностикумом, РПГА ставят с препаратами групп А (1,2,12), В (1,4,12), С1 (6,7), С2 (6,8), Д (1,9,12) и Е (3,10). В таблице представлена антигенная характеристика сальмонелл, на основании которой и осуществляется диагностика серологических вариантов сальмонелл.
Антигенная характеристика сальмонел.
Vi-антителам в инфекционном процессе не придают диагностического и прогностического значения. Иначе обстоит дело с выявлением Vi-антител у бактерионосителей. Большая резистентность содержащих Vi-антиген носителей к защитным механизмам человека обуславливает более длительное носительство этих форм (Vi-форм) тифозных палочек, вследствие чего в крови носителей обнаруживаются Vi-антитела. Vi-антитела являются прямым доказательством носительства брюшнотифозных бактерий.
Диагностика туберкулеза . Возбудитель туберкулеза — Mycobacterium tuberculosis. Туберкулез широко распространенная инфекция. Основным методом ее диагностики является бактериологическое исследование. Однако, микобактерии очень медленно растут на питальных средах, и для получения даже предварительного ответа при бактериологическом исследовании требутся 3 недели, что очень не устраивает клиницистов. В таких случаях до получения ответа результатов бактериологического исследования используют серологические методы диагностики и метод цепной полимеразной реакции.
Определение антител к возбудителю туберкулеза в сыворотке является новым и очень перспективным методом серологической диагностики туберкулеза. Применяемый в настоящее время бактериологический метод выделения микобактерий туберкулеза, требует значительных временных затрат (от 4 до 8 недель) и весьма эффективен, в основном, при легочных формах туберкулеза. Использование серологических методов диагностики, в частности иммуноферментного метода, позволяет значительно сократить время лабораторного подтверждения клинического диагноза, активно применять его для диагностики внелегочных форм туберкулеза, и особенно ценен он для диагностики туберкулеза у детей (трудности со сбором мокроты, множественные рентгенологические исследования). Диагностическим считается нарастание титра антител через 10-14 суток не менее чем в 4 раза.
Диагностика дифтерии. Возбудитель дифтерии Corynebacterium diphtheriae, был выделен в чистом виде Леффлером в 1884 году. Corynebacterium diphtheriae отличается полиморфизмом. В последние годы отмечается резкий рост заболеваемости дифтерией. Диагностика дифтерии основывается на клинических и эпидемиологических данных. Для подтверждения диагноза используют бактериологический метод исследования, направленный на выявление этиологического фактора — палочки Леффлера. Возбудители дифтерии могут быть выделены через 8-12 часов, в том случае, если больной не принимал противобактериальных препаратов. Однако, следует учитывать, что при лечении антибиотиками, особенно пенициллином или эритромицином, до взятия материала на бактериологическое исследование, роста бактерий можно не получить в течении 5 дней, либо роста не бывает совсем. В этих случаях используются серологические методы диагностики, которые играют все более важную роль.
Из серологических методов используют реакцию непрямой гемагглютинации и иммуноферментного анализа. Определяют уровень антител в начале заболевания (1-3 день) и через 7-10 суток, диагностическим считается нарастание титра антител не менее чем в 4 раза. РНГА отличается высокой чувствительностью и специфичностью. В последние годы на смену РНГА приходит метод ИФА, обладающий еще большей чувствительностью и специфичностью. При выявлении контингента для проведения вакцинации определяют уровень антител до вакцинации, и если уровень антител отсутствует или низок, этим пациентам показано проведение вакцинации, об ее эффективности судят по нарастанию уровня антител после вакцинации. Главной целью активной иммунизации является выработка специфического иммунитета. Анатоксин служит непреодолимым барьером для дифтерийного токсина и защищает организм от интоксикации. При подборе контингента для вакцинации необходимо учитывать, что в большинстве случаев дифтерия развивается только у лиц, не имеющих антитоксина или с низкими его концентрациями — менее 0,03 АЕ/мл.
Диагностика коклюша . Возбудитель коклюша Bordetella pertussis — короткая палочка с закругленными концами, грамотрицательна, неподвижна. Чаще болеют дети до 5 лет, у взрослых болезнь нередко протекает атипично. Основной метод лабораторной диагностики — бактериологический, серологические методы диагностики непригодны для ранней диагностики коклюша. Для обнаружения антител к Bordetella pertussis в сыворотке используется реакция прямой гемагглютинации (РПГА). При исследовании в парных сыворотках для подтверждения диагноза необходимо получить нарастание титра антител в 4 раза и более (кровь на исследование берут с интервалом в 10-14 дней). Поэтому этот метод пригоден только для нужд ретроспективной диагностики.
Диагностика легионеллезной пневмонии . Legionella pneumophila — бактерии палочковидной формы, грамотрицательные. Легионелез — острая инфекционная болезнь, обусловленная различными видами легионелл, характеризуется лихорадкой, интоксикацией, пневмонией, и в ряде случаев поражением ЦНС, почек. Нередко развивается у больных СПИДом. Для подтверждения диагноза ис-пользуются серологические методы диагностики.
Антитела в сыворотке крови к легионелле пневмонии появляются с 6-7 дня болезни, титр их нарастает ко 2-3 неделе заболевания. Диагностическим считается нарастание титра антител в 4 раза и более, а при однократном исследовании — высокий уровень содержания специфических антител (титры не менее 1:128).
Диагностика иерсиниоза. Возбудитель иерсиниоза — грамотрицательный микроорганизм Yersinia enterocolitica. По антигенной структуре различают более 50 сероваров иерсиний. Наибольшее значение в патологии человека имеют серовары 03, 05, 07, 08, 09 (Сомов Г.П. с соавт., 1990). Yersinia enterocolitica — возбудитель кишечного иерсиниоза, которому свойственны преимущественное поражение желудочно-кишечного тракта. Поскольку бактериологическая диагностика иерсиниозов трудоемкая, длительная и не всегда завершается выделением возбудителя, главная роль в лабораторной диагностике принадлежит серологическим методам. Серологическая диагностика имеет большое значение для подтверждения не только клинического диагноза, но и определения этиологической роли выделенных иерсиний. Исследуются сыворотки, взятые в начале (1-3 день от начала заболевания) и повторно на 7-10 день. Диагностическим считается нарастание титра антител через 7-10 суток не менее чем в 4 раза при исследовании парных сывороток. Характерно значительное нарастание титра антител на 3-4-й неделе и снижение их уровня после 5-й недели заболевания. Наиболее часто выявляются антитела к иерсинии энтероколитика 03 и 09.
Диагностика псевдотуберкулеза . Возбудитель псевдотуберкулеза — Yersinia pseudotuberculosis, грамотрицательная палочка, относится к семейству энтеробактерий. Заболевание характеризуется общей интоксикацией, скарлатиноподобной сыпью, поражением желудочно-кишечного тракта и суставов. Серологический метод является основным методом лабораторной диагностики псевдотуберкулеза. Определение антител к возбудителю псевдотуберкулеза в сыворотке является ретроспективным методом диагностики псевдотуберкулеза. Исследуются парные сыворотки больного. Для выявления специфических антител кровь на исследование берут в начале заболевания и через 7-10 суток после первичного исследования. Диагностическим признаком псевдотуберкулеза является нарастание титра антител через 7-10 суток не менее чем в 4 раза. РНГА является высокоспецифичным методом и дает положительные результаты более чем у 80% больных (Сомов Г.П. с соавт., 1990). Антитела с помощью РНГА выявляются уже в первую неделю заболевания.
Диагностика хеликобактериоза . Возбудитель хеликобактериоза Helicobacter pylori — грамотрицательная палочка, чаще всего имеющий S-образную форму. Helicobacter pylori встречается в среднем у 87% больных язвенной болезнью и 75% больных острыми гастритами (Браунвальд Е., 1993). После проникновения бактерий в желудок происходит его адгезия к клеткам желудочного эпителия в области межклеточных промежутков. Последнее обусловлено хемотаксисом бактерий к местам выхода мочевины и гемина, которые используются для жизнедеятельности микробов. Расщепляемая уреазой бактерий мочевина превращается в аммиак и углекислый газ, которые создают вокруг колоний микробов защитный слой, предохраняющий их от неблагоприятного рН желудочного сока. В настоящее время предложен ряд механизмов, объясняющих действие Helicobacter pylori на слизистую оболочку. Во-первых, аммиак, получаемый в результате разложения мочевины уреазой, вырабатываемой бактериями, обладает способностью прямо или косвенно разрушать эпителиальный барьер. Во-вторых, бактерии Helicobacter pylori обладают способностью продуцировать цитопатические токсины. В третьих, бактерии способны продуцировать протеиназу и ферменты, разрушающие слизистуют оболочку желудка. В четвертых, бактерии снижают гидрофобную емкость эпителиального слоя, что связано с действием липаз продуцируемых бактериями.
Жизнедеятельность хеликобактеров связана исключительно лишь с эпителием желудочного типа. Поэтому патология двенадцатиперстной кишки (или других отделов кишечника и пищевода), обусловленная Helicobacter pylori возможна лишь при наличии желудочной дисплазии в двенадцатиперстной кишке (или других отделах желудочно-кишечного тракта).
Для диагностики Helicobacter pylori используются следующие методы диагностики.
а) обнаружение бактерий в мазках отпечатках;
б) выделение культуры Helicobacter pylori.
2. Серологические: РСК, РНГА, иммуноферментный анализ.
3. Морфологические: выявление хеликобактеров в биоптате при окраске по Рома-новскому-Гимзе, по Граму и др.
а) уреазный тест с биоптатами;
б) анализ выдыхаемого воздуха (аэротест, при котором в выдыхаемом воздухе определяется содержание аммиака, или проводится более сложный анализ содержания в выдыхаемом воздухе количества С 13 и С 14 после принятия пациентом внутрь мочевины, предварительно меченой указанными изотопами).
5. Полимеразная цепная реакция
Уреазный тест основан на способности бактерий Helicobacter pylori выделять большое количество уреазы. Полученный при фиброгастроскопии биоптат погружают в полужидкую среду желтого цвета, где содержится мочевина и вещество-индикатор рН, которой в щелочной среде, возникающей при расщеплении мочевины уреазой бактерий (при их наличии в биоптате), дает красное окрашивание.
Из серологических методов определения антител в крови к Helicobacter pylori наибольшей чувствительностью обладает иммуноферментный метод. Он обладает высокой чувствительностью и специфичностью, в отличие от уреазного, при котором велика вероятность получения ложноположительных результатов вследствие возможности обсеменения биопта другими видами бактерий, обладающих уреазной активностью. Определение антител к Helicobacter pylori является хорошим методов контроля за эффективностью проведенного лечения. Уровень антител определяется перед началом курса лечения и через 1-1,5 месяца после его окончания. Исчезновение антител в крови больного говорит об успешном лечении заболевания.
Заболевания вызываемые Chlamidia trachomatis.
Трахома. Хронический кератоконьюктивит, который начинается с острых воспалительных изменений коньюнктивы и роговицы и приводит к образованию рубцов и слепоте.
В соскобах с конъюнктивы методом флюоресценции определяют хламидийные антигены в эпителиальных клетках. Чаще их обнаруживают на ранних стадиях заболевания в верхней части конъюнктивы.
Генитальные хламидии и конъюнктивит. Частота обнаружения хламидий у мужчин с негонококковым уретритом составляет 30-50%. Инфицированность женщин, имеющих первую беременность достигает 5-20%, делающих аборт — 3-18%. Среди больных, имеющих признаки цервицита, хламидийная инфекция выявляется в 20-40%; сальпингит — в 20-70%; инфекцию мочевых путей — в 5-10%. У больных со смешанной урогенитальной инфекцией хламидиоз в сочетании с гонореей наблюдается в 23,5%, с трихомониазом — в 39,5%, с го-нореей и трихомониазом в 36,8% (Делекторский В.В. с соавт., 1996). В последние годы ин-фекция нередко ассоциирована с микоплазменной и уреаплазменной инфекцией, гарднереллезом. По данным различных авторов 6-7% детей уже при рождении оказываются инфицированными хламидиями. Иммунологические типы Chlamidia trachomatis D-К являются возбудителями заболеваний, передаваемых половым путем, при которых могут развиваться и инфекционные поражения глаз (коньюнктивиты). У мужчин Chlamidia trachomatis явля-ются возбудителями негонококковых уретритов, эпидидимитов, простатитов, проктитов, болезни Рейтера. У женщин Chlamidia trachomatis вызывает цервициты, сальпингиты, воспалительные заболевания органов малого таза, перигепатит, уретрит. В результате у мужчин и у женщин может развиваться бесплодие. Считается, что около 80% трубного бесплодия вызвано хламидиями. При любой локализации инфекции может развиваться соответствующая симптоматика заболевания. В то же время болезнь может протекать бессимптомно (примерно 50% случаев у женщин), но передаваться половым путем партнерам (Козлова В.И., Пухнер А.Ф., 1995).
Поражения дыхательных путей, вызываемых Chlamidia trachomatis . У взрослых, больных хламидийным конъюнктивитом, нередко появляются симптомы поражения верхних дыхательных путей (фарингит, ринит, отит и др.), которые развиваются, по-видимому, в результате распространения хламидийной инфекции через слезноносовой канал. Развития пневмонии у взрослых обычно не наблюдается. У новорожденных, заразившихся от матерей, через 2-12 недель после родов могут развиваться поражения респираторной системы вплоть до пневмонии.
Венерическая лимфогранулема . Эта форма хламидиоза распространена в тропических и умеренных зонах. Для нее характерно развитие гнойного пахового лимфаденита. Возбудителями являются Chlamidia trachomatis иммунологических типов L1-L3.
Синдром Рейтера . Для синдрома Рейтера характерна классическая триада: уретрит, коньюнктивит и артрит. При данном синдроме хламидии могут быть обнаружены в синовиальной жидкости. Наблюдается возрастание титра антител классов IgА, IgМ, IgG в ходе развития активной инфекции суставов.
Эндокардиты. Клинически протекают молниеносно со значительным поражением клапанов аорты.
Первым и самым ответственным этапом при диагностике инфекционного процесса, является забор материала у пациента.
1. Методика забора материала из уретры у мужчин:
Пациент не должен мочиться за 1 час до забора материала;
Ввести маленький капроновый тампон в уретру на 2-4 см, повернуть тампон на
Сразу же после забора материала поместить тампон на предметное стекло и вращая
тампон по кругу, равномерно распределить материал по поверхности предметного
2. Методика забора материала из цервикального канала с использованием цитощеточки:
Удалить ватой или тампоном слизь;
Ввести щеточку в цервикальный канал и повернуть ее на 360 0 вынуть, не касаясь
Поместить щеточку на предметное стекло и вращая по кругу, равномерно распре-
делить материал по поверхности предметного стекла;
Высушить мазок на воздухе и доставить в лабораторию.
3.Методика приготовления мазков с конъюнктивы:
Нанести местный анестетик на один или оба глаза;
Используя малый тампон, осторожно протереть им внутреннюю поверхность ниж-
него, а затем верхнего века, при заборе материала с обоих глаз вначале протирают
Во время острой хламидийной инфекции и вскоре после нее наблюдается повышение титра антител IgА, IgМ и IgG к хламидия трахоматис в крови. Инфици-рованный Chlamidia trachomatis организм обычно продуцирует антитела, однако эти антитела имеют слабое защитное действие: обычно возбудители персистируют даже при наличии высоких титров антител. Раннее интенсивное лечение может угнетать синтез антител. Вследствие относительно большой “антигенной массы” хламидий при генитальных инфекциях сывороточные антитела IgG обнаруживаются довольно часто и в высоких титрах. Так, у детей с хламидийной пневмонией они могут очень высокими — 1:2000 — 1:4000. Антитела класса IgМ выявляются в острый период инфекции, наличие антител IgМ свидетельствует об активности хламидиоза. Немного позже появляются антитела класса IgG. Выявление антител класса IgА свидетельствует о выраженном аутоаллергическом процессе у больного и наиболее часто определяется у больных с синдромом Рейтера. Наличие антител класса IgА говорит о тяжелом течении заболевания у пациента. Определение уровня антител к хламидиям в крови необходимо проводить в динамике, оценка результатов исследований, основанная на однократном исследовании, ненадежна.
Новорожденные и их матери обследуются в 1-3 сутки после родов и в случае отрицательного результата при наличии клинической картины заболевания — повторно на 5-7 и 10-14 сутки. Отсутствие у новорожденных антихламидийных антител не означает отсутствие хламидийной инфекции.
Определение антител к хламидия трахоматис в крови является вспомогательным тестом диагностики хламидиоза, так как из-за низкой иммуногенности у 50% больных хламидиозом антитела не обнаруживаются.
Экспресс-диагностика урогенитального хламидиоза.
Метод основан на выявлении антигенов хламидия трахоматис в соскобах из уретры, цервикального канала и конъюнктивы методом иммуноферментного анализа с визуальной оценкой результата. Данный метод основан на наличии у хламидий родоспецифического липополисахаридного антигена. Этот метод позволяет проводить быстрый скрининг возбу-дителя, однако окончательный диагноз устанавливается при помощи метода флюоресцирующих антител или ПЦР. Результаты исследования выражаются в виде положительного или отрицательного ответа. Чтобы получить удовлетворительные результаты исследования, необходимо соблюдать определенные правила: материал должен быть правильно взят (соскоб) и своевременно доставлен в лабораторию (в течение 2-х часов).
Определение хламидия трахоматис в материале методом флюоресцирующих антител.
Принцип метода заключается в использовании моноклональных антител, меченных флюоресци-рующим изотиоцианатом против главного белка внешней мембраны хламидий, имеющегося во всех сероварах Chlamidia trachomatis, а также у элементарных и ретикулярных телец. Чувствительность данного метода достигает 95%, а применение моноклональных антител обуславливает высокую специфичность.
Количественное определение антигена хламидия трахоматис в материале иммуноферментным методом.
Данный метод исследования дополняет спектр других методов диагностики хламидиоза и позволяет диагностировать до 15 серотипов хламидий. ИФА метод используется для количественного определения антигена хламидий в эндоцервикальном, уретральном и ректальном отделяемом, а также в моче, в глазном отделяемом больных с целью диагностики заболевания. Специфичность данного метода составляет 97%, чувствительность — 92%, что является сравнимым с методом полимеразной цепной реакции (99,8% и 94,6% соответственно). Вместе с тем, этот метод является менее трудоемким. Метод основан на прямом определении образовавшегося иммунокомплекса антитело-липосахаридный антиген хламидии. В качестве антител используются кроличьи антихламидия антитела.
Диагностика микоплазменной инфекции . В настоящее время описано несколько штаммов микоплазм. Микоплазмы — группа весьма разнообразных и характерных по морфологии бактерий размером 150-200 нм. Они не имеют плотной клеточной стенки и покрыты трехслойной цитоплазматической мембраной. Микоплазмы грамотрицательны и обладают крайне низкой чувствительностью к большинству красителей. Микоплазмы можно подразделить в зависимости от вызываемых ими патологических процессов у человека на 6 групп:
1. Микоплазмы — возбудители респираторный заболеваний, основной возбудитель Mycoplasma pneumoniaе.
2. Микоплазмы, связанные с заболеваниями мочеполового тракта, основные возбудители Mycoplasma hominis тип I, реже Mycoplasma hominis тип II и Ureaplasma urealitica.
3. Микоплазмы — возбудители ревматоидных процессов.
4. Микоплазмы — возбудители сложных воспалительных синдромов.
5. Микоплазмы, связанные с разнообразными по их локализации воспалительными процессами.
6. Микоплазмы — условные сапрофиты, встречающиеся в выделениях практически здоровых людей.
Диагностика микоплазменной пневмонии .
Mycoplasma pneumoniae является возбудителем заболеваний респираторного тракта человека, паразатируя на клеточных мембранах. Удельный вес респираторных микоплазмозов, в общей группе респираторных заболеваний, колеблется для разных групп населения от 35 до 40%. Микоплазменные пневмонии составляют 10-17% случаев от общего числа пневмоний. С интервалами в несколько лет могут развиваться эпидемии пневмонии, вызываемой М. pneumonia, и при этом частота случаев развития заболевания может вдвое превышать ее обычный уровень. Лабораторная диагностика заболевания осуществляется бактериологическими и серологическими методами.
Правила забора материала для исследования.
Клинический материал (лаважная жидкость, мазки из носоглотки и пр.) получают с помощью ватных тампонов, полученный материал наносят тонким слоем на поверхность чистого обезжиренного предметного стекла, подсушивают на воздухе и фиксируют.
Выявление антигенов Mycoplasma pneumoniae в материале методом прямой иммунофлюоресценции.
Полученный мазок с материалом от больного обрабатывают поликлональными антителами к цитоплазматической мембране Mycoplasma pneumoniae, меченных ФИТЦ. При просмотре препарата в люминисцентном микроскопе в результате произошедшей реакции антиген-антител определяется зеленая флюоресценция микоплазм. Положительная оценка результатов исследования предполагает выявление в препарате не менее 10 ярко-зеленых гранул, четко выявляющихся на красноватом фоне препарата. При получении меньшего количества светящихся гранул в препарате и отсуствие в препарате эпителиальных клеток исследование рекомендуется повторить. Если количество эпителиальных клеток в препарате достаточно, а количество светящихся гранул менее 10, выдается отрицательный результат. Серологическая диагностика основана на выявлении титра антител к микоплазме пневмонии в сыворотке. Кровь на исследования берут в первые дни болезни — до 6-го дня и спустя 10-14 дней, диагностическим считается нарастание титра антител в 4 раза и более. Максимальное увеличение титра антител достигается через 4 недели заболевания. Однако, интерпретация результатов серологического исследования требует определенной осторожности, так как вследствие активации поликлональных В-клеток могут появиться “неспецифические антитела”; другие возбудители инфекционных заболеваний, включая цитомегаловирус, вирусы Эпштейн-Барра и кори, могут вызывать развитие сходных эффектов, что затрудняет оценку результатов исследования.
Диагностика микоплазменной инфекции урогениталий .
Микоплазменные инфекции урогениталий в настоящее время занимают ведущее место среди инфекций, передающихся половым путем. Она часто сочетается с гонококками, трихомонадами и условно патогенными микроорганизмами. Проведенные бактериологические исследования показали, что микоплазмоз выделяется в виде моноинфекции у 12,8% больных, в сочетании с одним микроорганизмом у 76,5% и в сочетании с 2-3 видами уретральной микрофлоры — у 10,7% больных (Козлова В.И., Пухнер А.Ф., 1995). Факторами, обуславливающими патогенность микоплазм, являются способность их прикрепляться к различным клеткам (эпителию, лейкоцитам, сперматозоидам) и оказывать токсическое и деструктивное действие. Обследование на микоплазмоз должно проводиться у всех мужчин, женщин и детей, обратившихся к врачу по поводу воспалительных заболеваний мочеполовых органов, а также у всех половых контактеров или предпологаемых источников заражения микоплазмозом и у лиц с клиническими подозрениями на наличие заболевания. Необходимо учитывать, что характерной особенностью микоплазменной инфекции является существование латентной формы и микоплазмоносительство в мочеполовых органах у мужчин и женщин.
Диагноз урогенитального микоплазмоза основывается на данных анамнеза, клинического обследования и результатах лабораторных исследований. Диагноз во всех случаях должен быть подтвержден выделением микоплазм в культуре (бактериологический метод). В последние годы наибольшее распространение в лабораторной диагностике микоплазмоза урогениталий нашли серологические методы — РСК и РНГА, позволяющие выявить нарастание титров антител в крови в процессе болезни при исследовании парных сывороток; метод иммунофлюоресценции, позволяющий идентифицировать микоплазмы в различном материале, взятом от больных, а также метод ПЦР, который обладает наиболее высокой чувствительностью и специфичностью.
Правила забора материала для исследования.
Клинический материал берется с доступных исследованию слизистых оболочек (уретра, цервикс, влагалище) с помощью ватных тампонов, ложки Фолькмана и других инструментов, полученный материал наносят тонким слоем на поверхность чистого обезжиренного предметного стекла, подсушивают на воздухе и фиксируют.
Выявление антигенов Mycoplasma hominis в материале методом прямой иммунофлюоресценции.
Mycoplasma hominis вызывает острые и хронические воспалительные заболевания урогенитального тракта, послеродовую лихорадку и сепсис, септические и спонтанные аборты. Mycoplasma hominis обнаруживается методом прямой иммунофлюоресценции при воспалительных заболеваниях урогениталий по данным разных авторов в 15-90% случаев.
Полученный мазок с материалом от больного обрабатывают поликлональными антителами к цитоплазматической мембране Mycoplasma hominis, меченных ФИТЦ. При просмотре препарата в люминисцентном микроскопе, в результате произошедшей реакции антиген-антитело, определяется зеленая флюоресценция микоплазм. Положительная оценка результатов исследования предполагает выявление в препарате не менее 10 ярко-зеленых гранул, четко выявляющихся на красноватом фоне препарата. При получении меньшего количества светящихся гранул в препарате и отсуствие в препарате эпителиальных клеток, исследование рекомендуется повторить. Если количество эпителиальных клеток в препарате достаточно, а количество светящихся гранул менее 10, выдается отрицательный результат.
Выявление антигенов Ureaplasma urealitica в материале методом прямой иммунофлюоресценции.
Ureaplasma urealitica относится к виду микоплазм. Название “уреаплазмы” происходит от способ-ности этого вида микоплазм продуцировать фермент уреазу, расщепляющий мочевину с образованием углекислого газа и аммиака. Ureaplasma urealitica вызывает воспалительные заболевания урогенитального тракта и может являться причиной развития бесплодия как у мужчин, так и женщин. У мужчин Ureaplasma urealitica вызывает простатит и оказывает влияние на сперматогенез, что приводит к снижению фертильности. Бесплодие женщин обусловлено воспалительными процессами гениталий. Забор материала на исследование, его проведение и оценка результатов аналогична диагностике Mycoplasma hominis.
Диагностика гонореи. Гонококки вызывают гнойное воспаление половых путей — гонорею. Трудность их обнаружения заключается в их слабой жизнеспособности, которая не позволяет широко пользоваться бактериологическим методом. В последние годы наибольшее распространение нашли серологические методы диагностики. Они дают положительные результаты исследования не только при острых формах заболевания, но, что наиболее важно, в случаях затяжных и хронических процессов, а также при осложнененной гонорее и при отдаленных метастазах.
Экспресс-диагностика гонореи в отделяемом материале из уретры .
Метод основан на выявлении антигенов нейсерий в соскобах из уретры, цервикального канала и конъюнктивы методом иммуноферментного анализа с визуальной оценкой результата. Данный метод основан на наличии у нейсерий родоспецифического липополисахаридного антигена. Этот метод позволяет проводить быстрый скрининг возбудителя. Результаты исследования выдаются в виде положительного или отрицательного ответа. Чтобы получить удовлетворительные результаты исследования, необходимо соблюдать определенные правила: материал должен быть правильно взят (соскоб) и своевременно доставлен в лабораторию (в течение 2-х часов).
Тест используется для диагностики гонококковой инфекции при заболеваниях: уретрит, простатит, вагинит, цервицит, аднексит.
Серологическая диагностика инфекций, вызываемых простейшими .
Диагностика амебиаза . Возбудитель амебиаза — Entamoeba hystolitica, существует в трех формах: тканевой (forma magna), просветной (forma minuta) и цистной (forma cystica). Заболевание встречается повсеместно. Во многих районах здоровые носители составляют 14-20% всего населения. Диагноз кишечного амебиаза устанавливается на основании обнаружения возбудителя в фекалиях или тканях. Диагностика внекишечного амебиаза затруднена. В таких случаях ведущее место в диагностике заболевания занимают серологические методы исследования. Самым чувствительным из имеющихся методов является РНГА и иммуноферментный метод. Антитела к амебе хистолитика в сыворотке выявляются почти у всех больных с амебным абсцессом печени и у значительного большинства лиц с острой амебной дизентерией. Диагностическим считается нарастание титра антител через 10-14 суток не менее чем в 4 раза. Антитела обычно не определяются у бессимптомных цистовыделителей, что свидетельствует о том, что для продукции антител требуется внедрение возбудителя в ткани. Повышенный титр антител может сохраняться в течение нескольких месяцев или лет после полного выздоровления.
Диагностика эхинококкоза . Эхинококкоз — это тканевой гельминтоз, вызываемый личиночными стадиями Echinococcus granulosus или E.multilocularis, различающихся морфологически и биологически. У человека Е.granulosus вызывает образование кист, главным образом в печени и легких, в то время как E.multilocularis вызывает образование многокамерных (альвеолярных) очагов поражения, обладающих способностью к инвазивному росту в прилегающих тканях. Диагностика заболевания представляет определенные трудности. Если при разрыве эхинококковой кисты или истечении из нее жидкости развивается анафилактическая реакция с эозинофилией и повышением содержания IgE, это позволяет заподозрить эхинококкоз. Однако, эозинофилия отмечается менее чем в 25% случаев. Для диагностики эхинококкоза разработаны серологические методы диагностики: РНГА, РСК, реакция латекс-агглютинации с антигеном из жидкости эхинококковых пузырей. Однако использование этих методов ограничено тем, что у многих носителей эхинококковых кист иммунный ответ не развивается и антитела в крови не образуются. РНГА дает положительные результаты у 90% больных с кистами в печени и только у 50-60% больных с поражением легких. После хирургического удаления кист определение антител к эхинококку в сыворотке используется для контроля за радикальностью проведенной операции. Исчезновение антител через 2-3 месяца после операции говорит о радикальности удаления кисты, снижение уровня антител и последующий рост их уровня в послеоперационном периоде свидетельствует о рецидиве кисты.
Серологическая диагностика грибковых инфекций.
Диагностика аспергиллеза . Возбудителем аспергиллеза являются условно-патогенные плесневые грибы рода Aspergillus. Заболевание характеризуется преобладанием поражения органов бронхо-легочной системы. При серологическом исследовании антитела класса IgG к антигенам Aspergillus выявляются в сыворотке крови большинства инфицированных и практически у всех больных, в легких которых при рентгенологическом исследовании обнаружен грибковый “шар” (около 90% случаев). Тест имеет 100% специфичность. Важно исследовать уровень антител в динамике. Для заболевания характерно нарастание титра антител.
Диагностика кандидоза . Чаще всего кандидоз вызывается Candida albicans. Candida albicans — овальные, размножающиеся почкованием и спорообразованием дрожжеподобные грибы. В норме кандида — представители резидентной микрофлоры слизистых оболочек, пищеварительного канала и женских мочеполовых органов. Кандидоз чаще всего регистрируется у больных с ослабленным иммунитетом. Диагностика поверхностного кадидоза основана на обнаружении элементов гриба в окрашенном мазке. При висцеральных формах кандидомикоза большое диагностическое значение имеют серологические иссле-дования. Используется РСК и иммуноферментный метод. Антитела обнаруживаются иммуноферментным методом более чем у 90% больных уже в первые 2 недели заболевания и у переболевших сохраняются до 5 лет. Для подтверждения диагноза важно следить за динамикой уровня антител, 4-х кратный подьем между титрами антител в острой и реконвалесцентной стадиии позволяет предпологать этиологию заболевания, 4-х кратное снижение их уровня в процессе лечения является показателем успешной терапии заболевания. Серологическая диагностика при поверхностном кандидомикозе неэффективна, только тяжелые формы поражения кожи и слизистых оболочек сопровождаются повышением уровня антител. Определение антигена Candida albicans в сыворотке применяется для непосредственного выявления кандидозного антигена в крови больных с инвазивным кандидозом. Этот тест более специфичен, чем выявление антител. Величина > 2 нг сывороточного кандидозного антигена при ИФА предпологает инвазивный кандидоз. Чувствительность метода у онкологических больных составляет 65-70% при специфичности 100% (Тиц У., 1997). Для выявления антигена кандидоза в сыворотке исследование рекомендуется проводить не реже 2-х раз в неделю.
Реакция непрямой (пассивной) гемагглютинации (РНГА, РПГА)
1) для обнаружения полисахаридов, белков, экстрактов бактерий и других высокодисперстных веществ, риккетсий и вирусов, комплексы которых с агглютининами в обычных РА увидеть не удается,
2) для выявления антител в сыворотках больных к этим высокодисперстным веществам и мельчайшим микроорганизмам.
Под непрямой, или пассивной, агглютинацией понимают реакцию, в которой антитела взаимодействуют с антигенами, предварительно адсорбированными на инертных частицах (латекс, целлюлоза, полистерол, оксид бария и др. или эритроциты барана, I(0)-группы крови человека)
В реакции пассивной гемагглютинации (РПГА) в качестве носителя используют эритроциты . Нагруженные антигеном эритроциты склеиваются в присутствии специфических антител к данному антигену и выпадают в осадок. Сенсибилизированные антигеном эритроциты используют в РПГА как эритроцитарный диагностикум для обнаружения антител (серодиагностика). Если нагрузить эритроциты антителами (эритроцитарный антительный диагностикум), то можно применять для выявления антигенов.
Рис. 3. Схема РПГА: эритроциты (1), нагруженные антигеном (3), связываются специфическими антителами (4).
Постановка . В лунках полистироловых планшетов готовят ряд последовательных разведений сыворотки. В предпоследнюю лунку вносят — 0,5 мл заведомо положительной сыворотки и в последнюю 0,5 мл физиологического раствора (контроли). Затем во все лунки добавляют по 0,1 мл разведенного эритроцитарного диагностикума, встряхивают и помещают в термостат на 2 ч.
Учет . В положительном случае эритроциты оседают на дне лунки в виде ровного слоя клеток со складчатым или зазубренным краем (перевернутый зонтик), в отрицательном — оседают в виде пуговки или колечка.
Учет результатов РНГА, поставленной с целью обнаружения ботулотоксина.
Возбудитель ботулизма — Clostridium botulinum вырабатывает токсины семи сероваров (А, B, C, D, E, F, G), однако чаще других встречаются серовары А, В, Е. Все токсины отличаются по антигенным свойствам и могут быть дифференцированы в реакциях типоспецифическими сыворотками. Для этой цели можно поставить реакцию пассивной (непрямой) гемагглютинации с сывороткой больного, в которой предполагается наличие токсина, и эритроцитами, нагруженными антителами антитоксических противоботулинических сывороток типов А, В, Е. Контролем служит нормальная сыворотка.
Рис. 3. Постановка и результат РНГА.
Учет. В положительном случае эритроциты оседают на дне лунки в виде ровного слоя клеток со складчатым или зазубренным краем (перевернутый зонтик), в отрицательном — оседают в виде пуговки или колечка.
Вывод: В сыворотке больного обнаружен ботулотоксин тип Е.
Реакция торможения гемагглютинации (РТГА).
Рис. 8. Реакция торможения гемагглютинации (РТГА) (схема).
Принцип реакции основан на способности АТ связывать различные вирусы и нейтрализовать их, лишая возможности агглютинировать эритроциты. Визуально этот эффект и проявляется в «торможении» гемагглютинации. РТГА применяют при диагностике вирусных инфекций для выявления специфических антигемагглютининов и идентификации различных вирусов по их гемагглютининам, проявляющим свойства Аг.
Типирование вируса проводят в реакции РТГА с набором типоспецифических сывороток. Результаты реакции учитывают по отсутствию гемагглютинации. Подтипы вируса типа А с антигенами H0N1, H1N1, H2N2, H3N2 и другие могут быть дифференцированы в РТГА с набором гомологичных типоспецифических сывороток
Рис. 9. Результаты РТГА при типировании вируса гриппа
Условные обозначения: — торможение гемагглютинации (пуговка) ; — гемагглютинация (зонтик).
Выводы: Исследуемый материал содержит вирус гриппа тип А с антигеном H3N2
Реакции преципитации (РП) основаны на фенoмене образования видимого осадка (преципитата) или общего помутнения среды после взаимодействия растворимых либо находящихся в коллоидном дисперсном состоянии Аг с АТ. РП ставят в специальных узких пробирках. В качестве реагентов используют гипериммунные преципитирующие сыворотки с высокими титрами АТ к гомологичным Аг. РП позволяет быстро (в течение нескольких секунд) выявлять незначительные количества Аг (можно выявить антиген в таких малых количествах, которые не обнаруживаются химическим путем). Они очень чувствительны, и их применяют для тонкого иммунохимического анализа, выявляющего отдельные компоненты в смеси антигена.
Рис. 5. Схемы реакций преципитации в пробирке (А) и агаре (Б).
Реакция кольцепреципитации Асколи
Постановка . В узкую пробирку диаметром 0,5 см с неразведенной преципитирующей сывороткой в количестве 0,3-0,5 мл, держа ее в наклонном положении, пастеровской пипеткой медленно по стенке наслаивается такой же объем антигена. Пробирку осторожно, чтобы не смешать жидкости, ставят вертикально. При правильном наслоении преципитиногена на сыворотку четко обозначается граница между двумя слоями жидкости. Постановка реакции обязательно сопровождается контролями сыворотки и антигена.
Учет . Результаты реакции учитывают в зависимости от вида антигена и антител через 5-10 мин, 1-2 ч или через 20-24 ч. В случае положительной реакции в пробирке на границе между сывороткой и исследуемым экстрактом появляется преципитат в виде кольца белого цвета.
Рис. 4. Реакция кольцепреципитации.
Определение токсигенности коринебактерий дифтерии в реакции преципитации в агаре.
Эта издавна используемая реакция преципитации, предложенная для определения токсичности коринебактерий дифтерии, ставится на фосфатно-пептонном агаре в чашке Петри. Вдоль ее посередине помещают полоску стерильной фильтровальной бумаги, смоченной антитоксической сывороткой. После подсушивания на расстоянии 1 см от края полоски бляшками диаметром 10 мм подсевают выделенные культуры. В одной чашке можно сеять от 3 до 10 культур, одна из которых, контрольная, должна быть заведомо токсигенной. Посевы помещают в термостат.
Учет реакций проводят через 24-48-72 ч. Если культура токсигенная, на некотором расстоянии от полоски бумаги возникают линии преципитата, совпадающие с линиями преципитата контрольной культуры. Они имеют вид «стрел-усиков», которые хорошо видны в проходящем свете.
Рис. 5. Реакция преципитации в агаре.
Реакции нейтрализации (РН) основаны на способности АТ связывать различные возбудители или их метаболиты, лишая тем самым их возможности реализовать свои биологические свойства (иными словами, АТ нейтрализуют возбудителей). На практике РН применяют для выявления вирусов и различных токсинов. В определенной степени к ним же относят реакции торможения вирусиндуцированной гемагглютинации и иммобилизации.
Реакция нейтрализации вирусов
В сыворотки крови переболевших лиц циркулируют антитела, нейтрализующие вирусы. Их наличие выявляют смешиванием культуры возбудителей с сывороткой с последующим введение лабораторному животному или заражением культуры клеток. На эффективность нейтрализации указывает выживание животного либо отсутствие гибели клеток в культурах.
РЕАКЦИЯ СВЯЗЫВАНИЯ КОМПЛЕМЕНТА (РСК)
РСК широко используют для лабораторной диагностики венерических болезней, риккетсиозов, вирусных инфекций. Реакция протекает в две фазы. Первая фаза — взаимодействие антигена и антител при обязательном участии комплемента.
Вторая — выявление результатов реакции при помощи индикаторной гемолитической системы (эритроциты барана и гемолитическая сыворотка). Разрушение эритроцитов гемолитической сывороткой происходит только в случае присоединения комплемента к гемолитической системе. Если же комплемент адсорбировался ранее на комплексе антиген-антитело, то гемолиз эритроцитов не наступает.
При наличии в исследуемой сыворотке антител, комплементарных антигену, образующийся комплекс антиген-антитело связывает (адсорбирует) на себе комплемент. При добавлении гемолитической системы гемолиза не происходит (задержка гемолиза), т.к. весь комплемент израсходован на специфическую связь комплекса антиген-антитело, а эритроциты остались неизменными.
При отсутствии в сыворотке антител, комплементарных антигену, специфический комплекс антиген-антитело не образуется и комплемент остается не связанным. Поэтому при добавлении гемолитической системы комплемент присоединяется к ней. Результатом реакции в данном случае будет гемолиз эритроцитов — в пробирках образуется так называемая «лаковая» кровь.
Рис. 6. Схема РСК: а — индикаторная система (эритроциты барана и антитела к ним) в присутствии комплемента определяется в виде гемолиза; б — с сывороткой больного диагностикум (Аг) образует иммунные комплексы и активирует комплемент, результат — задержка гемолиза; в — в сыворотке здорового человека антител нет, комплемент активируется индикаторной системой, результат — гемолиз.
Рис. 1. Схема реакции связывания комплемента.
Рис. 2. Постановка и результат РСК.
Выводы: В исследуемой сыворотке выявлены антитела.
РСК позволяет выявить антитела к любому штамму одного и того же серотипа вируса. Диагностическое значение имеет четырехкратное увеличение титра антител в парных сыворотках (в период эпидемии гриппа) и двукратное нарастание в сыворотках крови больных при характерной клинической картине.
РЕАКЦИИ С ПРИМЕНЕНИЕМ МЕЧЕННЫХ АТ И Аг
Реакции с использованием меченных антител и антигенов составляют основу методов экспресс-диагностики инфекционных заболеваний, так как выявляют минимальное содержание Аг и АТ в исследуемых образцах. В качестве меток могут быть использованы различные ферменты, красители флюорохромы и изотопы.
Реакция иммунофлюоресценции (РИФ)
Данный метод является экспрессным и высокочувствительным. Существуют две его разновидности.
При прямом методе к исследуемой взвеси микробов, фиксированной на стекле, добавляют сыворотку, меченную флуорохромом. Образующийся комплекс антиген-антитело при освещении ультрафиолетовыми (сине-фиолетовыми) лучами дает ярко-зеленое свечение.
При непрямом РИФ используют обычные диагностические сыворотки против какого-либо вида микробов. Добавление этой сыворотки к испытуемой взвеси микробов вызывает образование комплекса антиген-антитело. Этот комплекс выявляется с помощью универсальной флюоресцирующей сыворотки, содержащей антитела к гаммаглобулиновой фракции крови того вида животного, от которого была получена диагностическая сыворотка.
Светящийся комплекс выявляют при люминесцентной микроскопии.
Рис. 7. Реакция иммунофлюоресценции (схема).
Рис. 4. Пневмококки, выявленные РИФ (люминесцентная микроскопия).
Иммуноферментный анализ (ИФА)
В основе иммуноферментного анализа лежит известная иммунная реакция антигена и антитела. Один из этих реагентов является определяемым веществом, а другой — узнающим, обладающим известной стандартной специфичностью (избирательностью) по отношению к определяемому веществу.
Для выявления образовавшихся иммунных комплексов (антиген-антитело) используется фермен т, которым предварительно метится узнающий компонент (антиген или антитело). Сам фермент, естественно, не виден, поэтому визуализация присутствия вещества, определяемого методом ИФА, достигается применением посредника —хромогена . Это особое химическое соединение, которое хорошо растворимо в воде, и раствор которого бесцветен. Превращение бесцветного хромогена в цветное вещество хромофор происходит под действием фермента, для которого хромоген является субстратом.
Рис. 8. Иммуноферментный анализ (схема).
Рис. 5. Иммуноферментный анализ (ИФА) (схема).
Рис. 6. Результат ИФА. Желтый цвет раствора в лунке является положительным результатом.
Диагностический серологический анализ по выявлению в сыворотке крови антител к Vi-антигенам возбудителя брюшного тифа предназначен для подтверждения либо отрицания факта носительства.
| Сроки выполнения | 7-8 дней |
| Синонимы (rus) | Серологический анализ на Vi-антитела возбудителя брюшного тифа в сыворотке крови |
| Cинонимы (eng) | Indirect hemagglutination assay for Salmonella typhi Vi antibodies |
| Метод анализа | Реакция непрямой гемагглютинации (РНГА) |
| Подготовка к исследованию | Анализ проводится утром, натощак. С последнего приема пищи должно пройти не менее 8 часов. |
| Исключить прием алкоголя не менее чем за 24 часа до взятия биоматериала. | |
| Не рекомендуется сдавать кровь на серологию после флюорографии, рентгена, физиотерапевтических процедур. | |
| Биоматериал и способы его взятия | Венозная кровь |
Брюшной тиф относится к острым инфекционным кишечным заболеваниям. Для него характерны циклическое течение с системным поражением органов кишечника, ЦНС, печени, лимфатической системы; общая интоксикация организма, устойчивая бактериемия, при которой в крови обнаруживается присутствие бактерий. Источником инфекции являются больные, переболевшие бактерионосители.
Возбудитель брюшного тифа — сальмонелла Salmonella typhi , относится к кишечным бактериям.
Антигенная система возбудителя представлена антигенами O, H, Vi.
Антиген Vi является антигеном вирулентности , формирующим устойчивость возбудителя брюшнотифозной сальмонеллы к защитным реакциям организма. Наличие антител к Vi-антигенам Salmonella typhi при проведении серологического исследования образцов крови служит маркером бактерионосительства.
Выявление антител к эритроцитарным Vi-антигенам осуществляют с помощью серологической реакции непрямой гемагглютинации, РНГА , с применением специальных диагностикумов.
- основан на способности взаимодействия антител сыворотки крови и антигенов, которые фиксированы на эритроцитах (эритроцитарный диагностикум); результатом реакции является агрегация эритроцитов с последующим осаждением, агглютинация;
- по характеру осадка эритроцитов судят о наличии антител (характерный «зонтик»), либо об их отсутствии (осадок в виде «точки»);
- является полуколичественным; для проведения реакции используют разведения сыворотки крови для выявления диагностического титра;
- минимальным диагностическим титром при проведении реакции является показатель 1:40;
- повышение диагностической ценности реакции наблюдается при использовании повторного анализа (метод парных сывороток);
- реакция высокочувствительна и специфична, может быть использована на пятый-седьмой дни заболевания.
Основное предназначение исследования — выявление бактерионосительства брюшнотифозной сальмонеллы.
Результаты анализа могут быть положительными или отрицательными.
- выявление в крови антител к Vi-антигенам брюшнотифозного возбудителя (минимальное значение диагностического титра 1:40) рассматривается как указание на факт бактерионосительства и на необходимость повторного тестирования;
- в ответе фиксируется значение титра;
- может свидетельствовать о протекании острой инфекции, о перенесенном в прошлом заболевании, о проведенной вакцинации;
- в редких случаях может быть ложноположительным вследствие перекрестной реакции.
Отрицательный ответ выдается в случае, если антитела не выявлены. Подобная ситуация возможна как при отсутствии инфицирования брюшнотифозным возбудителем, так и на ранних сроках заболевания.
Проведение данного исследования имеет особую важность для предотвращения случаев распространения брюшного тифа бактерионосителями.
Срок проведения анализа: 7-8 дней
посев мокроты Вопрос: Здравствуйте!Мне необходимо сдать посев мокроты расширенный с антибиотикограммой!Но,я принимаю эриспириус-Средство с бронхолитическим и противовоспалительным действием. Не повлияет это на результаты анализа? Спасибо.
Непосредственно по вашему вопросу на счет принимаемого препарата Эриспирус:
Данный препарат обладает противовосполительным и бронхорасширяющим действием. В нем отсутствуют антибактериальные вещества. По этому на микробное содержание в мокроте данный препарат окажет минимальное воздействие. При этом принятие данного препарата может помочь в сборе мокроты если затруднено её отхождение.
Туалет ротовой полости обязателен. Это уменьшит контаминацию (заражение) мокроты микрофлорой полости рта.
Правила забора биоматериала мокроты на микробиологическое исследование прилагаю ниже:
Если мокрота отделяется плохо, накануне пациенту рекомендуют принять отхаркивающее средство. Допускается предварительная ингаляция теплым физиологическим или содовым раствором (улучшит отхождение мокроты).
Сроки доставки мокроты в лабораторию не должны превышать 1,5 — 2 часов от момента ее получения В крайнем случае допускается хранение образца мокроты в холодильнике, но не более 6 часов.
Сбор вместо мокроты слюны и(или) носоглоточного отделяемого
Анализ на посев мокроты Вопрос: Здравствуйте! Я хочу сдать посев мокроты, откашляться получается только раз в день и вечером, а утром приехать в лабораторию не успеваю, могу только после обеда! Сколько модно хранить мокроту в банке и до скольких могу приехать в лабораторию, чтобы результаты были верными? Спасибо!
- Исследуют свободно откашливаемую мокроту (лучше во время приступа кашля), полученную утром и натощак. Пациент предварительно должен почистить зубы, десны, язык, слизистую оболочку щек зубной щеткой и хорошо прополоскать рот кипяченой водой.
- Если мокрота отделяется плохо, накануне пациенту рекомендуют принять отхаркивающее средство. Допускается предварительная ингаляция теплым физиологическим или содовым раствором.
- Пробу мокроты, полученную в результате глубокого кашля, собирают в специальный стерильный (лучше одноразовый) контейнер с завинчивающейся крышкой.
- Сроки доставки мокроты в лабораторию не должны превышать 1,5 — 2 часов от момента ее получения. В крайнем случае допускается хранение образца мокроты в холодильнике, но не более 6 часов.
- Сбор вместо мокроты слюны и(или) носоглоточного отделяемого.
- Позднюю доставку пробы в лабораторию, так как это ведет к гибели основных возбудителей, а также изменению истинного соотношения микрофлоры бронхиального секрета за счет размножения бактерий-контаминантов
Оптимальным является забор отделяемого зева (методом мазка) сразу после гигиенического туалета полости рта и непосредственно перед сбором мокроты.
Вы можете прийти к нам в лабораторию по адресу: Адлер, ул. Старонасыпная 22, 2-й этаж, здание Офис ПЛАЗА. Здесь Вы получите специальный контейнер с транспортной средой, в которой мокрота может храниться до 24 ч. при комнатной температуре. Прошу заранее согласовать ваш приход за специальной транспортной средой!
По вашему вопросу Вы можете позвонить по номеру указанном ниже.
С уважением зав. бактериологическим отделом «Медицинской Лаборатории «ОПТИМУМ» Махмудова Мадина Ахмедовна тел. 8-965-481-21-42.
Серологический анализ крови представляет собой способ лабораторного исследования определенных антигенов или антител (специфических белков ) в сыворотке крови пациента, основанный на иммунных реакциях организма. Данный метод применяется при инфекционных заболеваний для выявления наличия антител в крови больного к определенному виду или бактерий , а также для определения групповой принадлежности крови.
Исследуемый материал:
В первую очередь для проведения серологического анализа используют биологический материал, собранный от пациента:
- сыворотка крови
- слюна
- фекальные массы
В некоторых случаях исследуется материал, выделенный из определённых объектов окружающей среды:
- почва
Методика проведения анализа или забора крови:
Данный анализ не требует специальной подготовки пациента. Забор крови проводится утром натощак и, производится в процедурных кабинетах лечебных учреждений, согласно общепринятым гематологическим методикам. Для серологического исследования забор крови производится двумя методами: венозную кровь забирают из локтевой вены пациента, а капиллярную кровь – из безымянного пальца. Кровь помещают в стерильные герметичные пробирки.
Особенности транспортировки крови и хранения сыворотки: 
Для чего используют серологические исследования?
Серологические методы лабораторной диагностики используются для выявления таких заболеваний как эхинококкоз, трихинеллёз, токсокароз, описторхоз, цистицеркоз, токсоплазмоз , амебиаз, лямблиоз , для определения эффективности проведённого курса лечения и, наконец, для обнаружения повторного заболевания после полного выздоровления пациента.
Основные методы серологической диагностики:
1. Реакция иммунофлюоресценции (РИФ)
Данная реакция является непрямым вариантом серологического исследования, то есть, производится она в два этапа. На первом этапе производят выявление необходимого антитела в циркулирующем комплексе антиген – антитело с помощью антиглобулина, схожего по своей структуре с белками иммунной сыворотки. Выявление искомого антитела возможно также при изучении заранее приготовленного антигенного препарата под люминесцентным микроскопом, без использования антиглобулинов.
Иммунофлюоресцентная реакция – очень трудоёмкий процесс, требующий от специалиста немало времени и ответственности. Начинается реакция с подготовки растворов, затем сыворотки и их контрольные образцы подвергаются титрованию (процесс, позволяющий определить содержание определённого вещества путём постепенного смешивания исследуемого раствора с контролируемым количеством реагента ). Подготовленные ранее разведения и их контрольные образцы аккуратно наносятся на предметные стёкла с антигеном. Потом препараты подвергаются инкубации, затем следует их отмывание и высушивание на воздухе. На стёкла с антигеном тонким слоем наносится антисыворотка, после этого производится вторичная инкубация препаратов и, вся предыдущая цепь действий повторяется, завершаясь высушиванием препарата. В результате препарат на предметном стекле подвергается обработке глицерином и исследуется в люминесцентном микроскопе.
Результаты проведённой реакции оцениваются по четырёх бальной шкале, которая характеризуется интенсивностью поверхностного жёлто-зелёного свечения клеток антигенов:
+ очень слабое свечение клетки, заметное только на её периферии
++ слабое свечение периферии клетки, но с явно заметным зелёным оттенком
+++/++++ яркое свечение зелёного цвета периферии клетки
Титром реакции считается такое разведение сыворотки, где не менее 50 % клеток антигена проявляют чёткое поверхностное свечение, то есть результат реакции +++ или ++++ . Значение тира реакции от 1/80 до 1/100.
Интенсивность реакции зависит от количества осаждённых эритроцитов на дне образованных лунок:
– отрицательная реакция, которая характеризуется осаждением эритроцитов на дно лунок в виде небольшого колечка с гладкими краями или «пуговки»
+ слабая интенсивность, для данной реакции характерны небольшие одиночные отложения на дне лунки. Неагглютинированные эритроциты образовывают «маленькое колечко» в центре лунки
++ средняя интенсивность, ей свойственно образование на дне лунки «широкого плотного кольца» из неагглютинированных эритроцитов
+++ интенсивная реакция, агглютинированные эритроциты образуют так называемые «зонтики», в центре которых, явно видны кольца, образованные осевшими неагглютинированными эритроцитами
++++ резко интенсивная реакция, в которой агглютинируются все эритроциты и, образуя «зонтики», выстилают дно лунок.
Титром данной реакции считают последнее разведение сыворотки, при котором выявляется явная агглютинация эритроцитов не менее +++ , то есть при интенсивной или резко интенсивной реакции.
Достоверность и качество методов серологической диагностики зависят от организации проведённого внутреннего и внешнего лабораторного контроля, состоящих из нескольких независимых процедур, предназначенных для оценки качества результатов проведённого анализа.
источник