Бруцеллез – бактериальная инфекционно-аллергическая болезнь, относящаяся к группе зоонозов и занимающая особое положение среди других инфекционных болезней из-за своеобразия возбудителя. Этиопатогенетические особенности бруцеллеза определяют большую склонность заболевания к хроническому течению с длительной персистенцией патогена. Фактор времени не играет абсолютной роли в определении формы или стадии болезни, так острый процесс может развиваться на фоне латентного бруцеллеза, а хроническое течение может развиваться с самого начала болезни. Как правило, после консультации инфекциониста для исключения возможного бруцеллеза кровь пациента тестируют только в реакциях Хеддельсона и Райта, обладающих, по информации ряда авторов, невысокой чувствительностью (35–64 %). Из современных серологических методов диагностики бруцеллеза иммуноферментный анализ (ИФА) является наиболее доступным и распространенным [2, 3, 4]. Явные преимущества этого теста – простота и быстрота выполнения, высокая чувствительность, стабильность реагентов, возможность количественного учета реакции, обработка большого количества проб, автоматизация процесса и объективность инструментального учета результатов [5]. Метод иммуноферментного анализа находится в постоянном развитии. С одной стороны, расширяется число объектов исследования, с другой – углубляются и совершенствуются методы самого анализа [7]. Специфичность и чувствительность ИФА зависит от качества используемых иммунореагентов и оптимизации постановки теста.
Целью настоящей работы стало изучение возможности выявления антител в сыворотках крови людей при хроническом течении бруцеллеза в иммуноферментном анализе.
Проведя анализ полученных результатов, нами была сконструирована экспериментальная тест-система диагностическая для выявления специфических антител в сыворотках крови больных острым и хроническим бруцеллезом в непрямом методе постановки иммуноферментного анализа (нИФА).
В качестве сенсибилизирующего агента был апробирован поливалентный бруцеллезный водорастворимый антиген (Аг-в/р), извлеченный по методу Е. Н. Афанасьева из смеси бакмасс Brucella (B.)abortus19ABB. melitensisRev-1, B. suis61, обеззараженных охлажденным до минус 20 оС ацетоном [1].
Для получения кроличьей сыворотки против Ig G человека проводили гипериммунизацию по схеме, разработанной И. С. Тюменцевой с соавторами [6]. Схема основана на подборе оптимальной комбинации интактных и полимеризованных Ig G, выделенных из нормальной сыворотки крови человека, а также иммуномодуляторов тималина и циклофосфана. В качестве доноров антивидовых IgG были взяты кролики породы «Шиншилла», массой 3–3,5 кг. Гипериммунизацию проводили с соблюдением видоидентичности антигенов и вида продуцентов, используя IgG, выделенные из нормальной сыворотки крови человека, и иммуномодуляторы тималин и циклофосфан.
Конъюгацию кроличьих Ат против Ig G человека с индикаторным ферментом – пероксидазой хрена (ПХ) (тип VI-А, Rz:
3.0 с активностью 1550 units/mg (Sigma)) проводили по методу перйодатного окисления по P. K. Nakane, A. Kawaoi (1974) в модификации M. B. Wilson, P. K. Nakane (1978).
Результаты ИФА регистрировали с помощью фотометра «Multiskan FC», измеряя оптическую плотность (ОП), используя фильтр с длиной волны 450 нм. По результатам ОП рассчитывали значение критической оптической плотности (ОПкрит.) по формуле 1:
где ОПсрК- – среднее значение ОП для отрицательного контрольного образца.
Для интерпретации результатов исследования применяли коэффициент позитивности (КП):
При КП tкрит., изменения признака статистически значимы (р
источник
1 ИНСТИТУТ ЭКСПЕРИМЕНТАЛЬНОЙ ВЕТЕРИНАРИИ СИБИРИ И ДАЛЬНЕГО ВОСТОКА ( ИЭВСиДВ) ВСЕРОССИЙСКИЙ НАУЧНО-ИССЛЕДОВАТЕЛЬСКИЙ ИНСТИТУТ БРУЦЕЛЛЕЗА И ТУБЕРКУЛЕЗА ЖИВОТНЫХ ВНИИБТЖ) ООО НПФ «Сиббиотест» ООО «Сибитек» ЭКСПРЕСС-ДИАГНОСТИКА БРУЦЕЛЛЕЗА ЖИВОТНЫХ С ИСПОЛЬЗОВАНИЕМ ИФА МЕТОДИЧЕСКОЕ ПОСОБИЕ Новосибирск 2014
2 ИНСТИТУТ ЭКСПЕРИМЕНТАЛЬНОЙ ВЕТЕРИНАРИИ СИБИРИ И ДАЛЬНЕГО ВОСТОКА ( ИЭВСиДВ) ВСЕРОССИЙСКИЙ НАУЧНО-ИССЛЕДОВАТЕЛЬСКИЙ ИНСТИТУТ БРУЦЕЛЛЕЗА И ТУБЕРКУЛЕЗА ЖИВОТНЫХ ВНИИБТЖ) ООО НПФ «Сиббиотест» ООО «Сибитек» ЭКСПРЕСС-ДИАГНОСТИКА БРУЦЕЛЛЕЗА ЖИВОТНЫХ С ИСПОЛЬЗОВАНИЕМ ИФА МЕТОДИЧЕСКОЕ ПОСОБИЕ Новосибирск
3 УДК: УДК 619: :42 Экспресс-диагностика бруцеллеза животных с использованием ИФА: Метод. пособие / ИЭВСиДВ, ВНИИБТЖ, ООО НПФ «Сиббиотест», ООО «Сибитек» Новосибирск c. Приведены материалы по теоретическому, экспериментальному и практическому обоснованию массового применения экспресс-диагностики бруцеллеза животных с использованием ИФА, методика постановки ИФА с новой диагностической тест-системой, разработанной ИЭВСиДВ и ГНУ ВНИИБТЖ совместно с ООО НПФ «Сиббиотест», результаты ее испытания. Методическое пособие рассчитано на научных и практических ветеринарных специалистов в области животноводства, эпизоотологов, специалистов ветеринарных лабораторий, а также студентов ветеринарных ВУЗов. Методическое пособие подготовили: Димов С.К., Димова А.С., Сизов А.А., Стеблева Г.М., Куренская Н.И., Мельников Д.П., Сизов Д.А., Аракелян П.К. Материалы рассмотрены и утверждены ученым советом ИЭВСиДВ (протокол 4 от 19 ноября 2014 г.) и подсекцией «Инфекционная патология животных в регионе Сибири и Дальнего Востока» Отделения ветеринарной медицины Россельхозакадемии (протокол 3 от 19 ноября 2014г.) Рецензент: доктор ветеринарных наук, профессор В.В. Храмцов 3
4 1. ТЕОРЕТИЧЕСКОЕ ОБОСНОВАНИЕ ЭКСПРЕСС-ДИАГНОСТИКИ БРУЦЕЛЛЕЗА ЖИВОТНЫХ С ИСПОЛЬЗОВАНИЕМ ИФА В нашей стране до настоящего времени официально признанным обязательным диагностическим комплексом при бруцеллезе животных являются реакция агглютинации (РА) и реакция связывания комплемента (РСК) с единым бруцеллезным диагностикумом, изготовленным из типичных бруцелл в S-форме. Однако он не обладает свойствами способа экспресс-диагностики, так как на его постановку уходит более суток. Кроме того, он имеет такие существенные недостатки, как большая трудоемкость, субъективная оценка результатов диагностики, невозможность стандартизации проведения диагностики. Известны и другие диагностические тесты. Например, к способам экспресс-диагностики бруцеллеза животных относят РБП и РНГА [1-3]. На постановку РБП (роз бенгал проба пластинчатая цветная реакция агглютинации) уходит несколько минут, однако с ее помощью нет гарантированной возможности количественно оценить наличие антител [2]. Показания РНГА (реакции непрямой гемагглютинации), регламентированной в РФ в качестве способа экспресс-диагностики бруцеллеза животных, практически полностью поглощают показания РА и РСК [3]. Однако, у данного способа большая трудоемкость, достаточно большое время (6 часов) для первичной постановки реакции, субъективная оценка результатов, отсутствие стандартизации и автоматизации проведения диагностики. Уже давно известен наиболее чувствительный и обеспечивающий автоматизированные постановку и учет реакций способ диагностики бруцеллеза животных на основе различных вариантов ИФА (иммуноферментного анализа) [4-5]. Однако, в связи с использованием у животных противобруцеллезных вакцин, из-за высокой диагностической чувствительности он до сих пор не нашел в нашей стране широкого применения. Кроме того, в большинстве предлагаемых на его основе диагностических тест-систем существует ряд других сложностей, связанных, в частности, с изготовлением антигена, сложностью и длительностью постановки реакции, отсутствием универсального ферментного конъюгата для исследования сывороток крови разных видов животных и т.п. 2. РАЗРАБОТКА НОВОЙ ДИАГНОСТИЧЕСКОЙ ТЕСТ-СИСТЕМЫ ИФА, ЭКСПЕРИМЕНТАЛЬНОЕ И ПРАКТИЧЕСКОЕ ОБОСНОВАНИЕ ЕЕ ЭФФЕКТИВНОСТИ ПРИ БРУЦЕЛЛЕЗЕ ЖИВОТНЫХ Целью наших исследований явилась разработка диагностической скрининговой тест-системы ИФА, пригодной для практического использования в качестве массового экспресс-метода диагностики бруцеллеза у животных, в том числе иммунизированных против указанной болезни. 4
5 В процессе реализации цели исследований было испытано много различных вариантов диагностической тест-системы ИФА, отличающихся использованием различных антигенов, конъюгатов, техникой постановки реакции и т.п. В результате выбор остановился на самом оптимальном из них, который и был подвергнут дальнейшему изучению. С учетом поставленной задачи разработать универсальную и простую в применении скрининговую тест-систему ИФА для экспресс-диагностики бруцеллеза животных, основанной на выявлении специфических антител к типичным бруцеллам, в качестве антигена, сорбированного на поверхность полистирольных планшет, использовали препарат, изготовленный только из типичных бруцелл, находящихся в стабильной S-форме, полученный следующим образом. Жидкую суточную культуру B. abortus 19 разливали по 1 мл в пробирки типа «Эппендорф» центрифугировали в течение 15 минут при 5 тыс. об./мин. Супернатант удаляли, а осадок ресуспендировали в 0,15 М растворе хлористого натрия (NaCl), добавляя по 1 мл в каждую пробирку с осадком. Пробирки помещали в водяную баню при 85 градусах С и инкубировали в течение 15 минут, после чего охлаждали в ледяной бане в течение 5 минут. Охлажденные пробирки центрифугировали в течение 15 минут при 15 тыс. об./мин. Супернатант, содержащий антигены, сливали в стеклянный стакан, перемешивали, определяли концентрацию белка. Для сорбции использовали раствор антигена с концентрацией белка 10 мкг/мл, для чего требуемое количество раствора антигена растворяли в необходимом количестве карбонатно-бикарбонатного буфера. Для обеспечения возможности универсального использования при исследовании сывороток крови различных видов животных применяли конъюгат на основе существующего рекомбинантного белка G [6], позволяющий без потери чувствительности и специфичности тестировать сыворотки крови крупного и мелкого рогатого скота, лошадей, свиней, верблюдов, кроликов, в отличие от используемого в ближайшем прототипе конъюгата на основе моноклональных антител против иммуноглобулинов конкретно одного вида животных. Для этого при приготовлении такого конъюгата использовали метод периодатного окисления [7]. Коммерческий препарат пероксидазы хрена (POD) смешивали с раствором периодата натрия, инкубировали в течение 20 минут, после чего белок осаждали насыщенным раствором сульфата аммония. Осадок отделяли центрифугированием, растворяли в карбонатно-бикарбонатном буфере. К образовавшемуся раствору активированной пероксидазы добавляли коммерческий препарат рекомбинантного белка G, инкубировали при температуре 37 градусов С [8]. Синтезированный конъюгат осаждали насыщенным раствором сульфата аммония, отделяли центрифугированием, растворяли в буфере, определяли рабочий титр, после чего использовали в иммуноферментной диагностике. В процессе разработки новой тест-системы ИФА удалось также добиться максимальной простоты ее использования и сокращения сроков учета реакций до 1,5-2 часов. 5
6 Разработанную тест-систему ИФА испытали на крупном и мелком рогатом скоте. Учет реакций осуществлялся автоматизированно с использованием оборудования, официально аттестованного для применения в РФ. При исследовании на бруцеллез сывороток крови от крупного рогатого скота благополучных стад, как не подвергавшегося, так и подвергавшего иммунизации против указанной болезни вакциной из слабоагглютиногенного штамма B. abortus 82 (в регламентированные сроки после нее 6 мес.) все исследованные пробы (по 100 проб в каждой категории) показали отрицательный результат как по комплексу серологических реакций (РНГА, РА + РСК), так и в ИФА. При исследовании на бруцеллез сывороток крови от крупного рогатого скота неблагополучных стад, не подвергавшегося вакцинации, в РНГА из 5 исследуемых проб реагировали все 5 проб в титрах МЕ, в комплексе РА + РСК только 4 (РА 3 с титрами МЕ; РСК 1 с титром 1:5). В ИФА из 5 исследуемых сывороток крови показали положительный результат все 5 проб (показатели оптической плотности 1,362 2,063), что свидетельствует о полном соответствии показаний ИФА показаниям РНГА и диагностическому комплексу РА + РСК и большей диагностической чувствительности ИФА по сравнению с указанными реакциями в отношении выявления антител к бруцеллам (в данном случае «полевым»). При исследовании на бруцеллез сывороток крови от крупного рогатого скота неблагополучных стад, иммунизированного живой слабоагглютиногенной вакциной из штамма 82 (через 6 мес. после нее) в РНГА из 14 исследуемых проб реагировало 10 проб в титрах МЕ (все 10 проб реагировали и в диагностическом комплексе РА + РСК: титры МЕ и 1:5 1:80 соответственно). В ИФА из 14 исследуемых сывороток крови показали положительный результат 10 проб с показателями оптической плотности 1,147 1,995 (все совпали с результатами РНГА и РА + РСК), сомнительный 3 пробы с показателями оптической плотности 0,688 0,802 (в РНГА и РА + РСК они были отрицательными). Это свидетельствует о полном соответствии показаний ИФА показаниям РНГА и диагностическому комплексу РА + РСК и большей диагностической чувствительности ИФА по сравнению с указанными реакциями в отношении выявления антител к бруцеллам. При исследовании на бруцеллез сывороток крови от мелкого рогатого скота благополучных стад, как не подвергавшегося, так и подвергавшего иммунизации против указанной болезни вакциной из аглютиногенного штамма B. abortus 19 конъюнктивально в дозе 4 млрд м.к. (в регламентированные сроки после нее, т.е. 4 мес.) все исследованные пробы (по 50 проб в каждой категории) показали отрицательный результат как по комплексу официальных серологических реакций (РНГА, РА + РСК), так и в ИФА. При исследовании на бруцеллез сывороток крови от мелкого рогатого скота неблагополучных стад, не подвергавшегося вакцинации, в РНГА из 5 исследуемых проб реагировали все 5 проб в титрах МЕ (все совпали с показаниями комплекса РА + РСК с титрами МЕ и 1:5 1:10 соответственно). 6
7 В ИФА с новой тест-системой из 5 исследуемых сывороток крови показали положительный результат все 5 проб с показателями оптической плотности 2,488 2,719. Это свидетельствует о полном соответствии показаний ИФА показаниям РНГА и диагностическому комплексу РА + РСК и большей диагностической чувствительности ИФА по сравнению с указанными реакциями в отношении выявления антител к бруцеллам (в данном случае «полевым»). При исследовании на бруцеллез сывороток крови от мелкого рогатого скота неблагополучных стад, иммунизированного живой агглютиногенной вакциной из штамма 19 конъюнктивально в дозе 4 млрд м.к. (в регламентированные сроки после нее), в РНГА из 6 исследуемых проб реагировали все 6 проб в титрах МЕ (все совпали с показаниями комплекса РА + РСК с титрами МЕ и 1:5-1:80 соответственно). В ИФА с новой тест-системой из 6 исследуемых сывороток крови показали положительный результат все 6 проб с показателями оптической плотности 1,151 2,427. Это свидетельствует о полном соответствии показаний ИФА показаниям РНГА и диагностическому комплексу РА+РСК и большей диагностической чувствительности ИФА по сравнению с указанными реакциями в отношении выявления антител к бруцеллам. При исследовании 20 проб сывороток крови крупного рогатого скота параллельно с РА, РСК, РНГА в новой тест-системе ИФА, в сравнении с тест-системой производства ФГУП «Курская биофабрика фирма Биок» были получены следующие результаты. Из 10 исследованных проб сывороток крови животных благополучных стад при использовании тест-системы ФГУП «Курская биофабрика фирма Биок» положительно реагирующих не выявлено. Сомнительно реагировало 2 пробы (в том числе из числа невакцинированных 0, из числа вакцинированных 2). При использовании предлагаемой нами тест-системы из этих же 10 исследованных проб сывороток крови животных благополучных стад все пробы реагировали отрицательно. Результаты РА, РСК и РНГА во всех случаях были отрицательными. Из 10 исследованных проб сывороток крови животных неблагополучных стад при использовании тест-системы ФГУП «Курская биофабрика фирма Биок» положительно реагировало 7 проб (в том числе из числа невакцинированных 4, из числа вакцинированных 3); сомнительно 1 (1/0 соответственно) отрицательно 2 (0/2 соответственно). При использовании предлагаемой нами тестсистемы из этих же 10 исследованных проб сывороток крови животных неблагополучных стад положительно реагировало 9 проб (в том числе из числа невакцинированных 5, из числа вакцинированных 4); сомнительно 0, отрицательно 1(из числа вакцинированных). В этих же 9 пробах получены положительные и сомнительные результаты РА, РСК и РНГА в разных сочетаниях. Отрицательный результат ИФА в одной пробе совпал с отрицательными результатами РА, РСК и РНГА. Таким образом, предложенная нами тест-система по специфичности показаний и диагностической эффективности при бруцеллезе крупного рогатого скота не уступила тест-системе производства ФГУП «Курская биофабрика 7
8 фирма Биок», имея при этом преимущества в чувствительности, простоте постановки, учета и интерпретации реакций, а также во времени, затрачиваемом на исследования и учет реакций. В условиях Томской областной ветеринарной лаборатории были проведены комплексные серологические исследования на бруцеллез (РА и РСК с официальным диагностикумом, ИФА с разработанной тест-системой) 502 проб сывороток крови крупного рогатого скота, иммунизированного против бруцеллеза живыми вакцинами из штаммов 75/79-АВ и 82, из благополучных по бруцеллезу хозяйств различных районов области. При этом с положительными и сомнительными реакциями с помощью комплекса РА + РСК было выявлено 58 проб 11,5 % из числа исследованных, с помощью ИФА 68 13,5 % (показания ИФА полностью совпали с показаниями РА + РСК; дополнительно к РА + РСК выявлено 10 проб 2 % из числа исследованных). Во всех 68 пробах с положительными и сомнительными реакциями в РА + РСК и/или ИФА был получен отрицательный результат в РИД с О-ПС антигеном, что свидетельствует об отсутствии в обследуемых стадах эпизоотически опасных в отношении бруцеллеза животных. Поствакцинальную природу реакций подтвердили положительные результаты РСК с R-антигеном, превосходящие по титрам РСК с S-антигеном. Полученные результаты позволили внедрить в практику скрининговых исследований на бруцеллез не только в областной, но и 7 районных ветеринарных лабораториях, что в значительной мере упростило массовую диагностику этой болезни в масштабах области, так как к помощи громоздкого комплекса РА + РСК и дополнительных дифференциальных методов приходится прибегать лишь в случаях выявления положительных или сомнительных показаний РА и/или РСК. Таким образом, новая тест-система ИФА позволяет осуществлять диагностику бруцеллеза многих видов животных, в том числе крупного и мелкого рогатого скота, даже в условиях использования живых слабоагглютиногенных и агглютиногенных противобруцеллезных вакцин, при этом поглощает показания РНГА, относящейся к способам экспресс-диагностики, а также официального классического диагностического комплекса РА + РСК, не уступает им по специфичности, и превосходит их по диагностической активности. 3. МЕТОДИКА ПОСТАНОВКИ ИФА С НОВОЙ ДИАГНОСТИЧЕСКОЙ ТЕСТ-СИСТЕМОЙ, РАЗРАБОТАННОЙ ГНУ ИЭВСиДВ И ГНУ ВНИИБТЖ СОВМЕСТНО С ООО НПФ «СИББИОТЕСТ» Набор диагностический для выявления индивидуальных специфических антител класса G к бактериям рода Brucella в сыворотке (плазме) крови животных иммуноферментным методом (ИФА) включает следующие компоненты: 1 полистироловый 96-луночный планшет с адсорбированной в лунках планшета смесью специфических антигенов Brucella один; 8
9 2 фосфатно-солевой буферный раствор с твином (ФСБ-Т) прозрачная, слегка опалесцирующая, бесцветная жидкость, 26 мл 1 флакон; 3 разводящий буферный раствор для сывороток (РБР-С) прозрачная опалесцирующая жидкость фиолетового цвета, 12 мл 1 флакон; 4 раствор конъюгата, конъюгированного с пероксидазой хрена (РКг- G) прозрачная опалесцирующая жидкость красного цвета 1 флакон, 12 мл; 5 положительный контрольный образец (К+) инактивированная сыворотка крови животных, содержащая специфические антитела класса G к бруцеллам, красного цвета, 1,5 мл 1 флакон; 6 отрицательный контрольный образец (К-) инактивированная сыворотка крови животных, не содержащая специфических антител к бруцеллёзу прозрачная, слегка опалесцирующая, жидкость желтого цвета, 2,5 мл 1 флакон; 7 хромоген тетраметилбензидин субстрат (ТМБ субстрат) бесцветная или светло-желтого цвета жидкость, 12 мл 1 флакон; 8 стоп-реагент прозрачная бесцветная жидкость, 6 мл 1 флакон. Принцип метода: Бактериальный антиген, адсорбированный в лунках планшета, связывается со специфическими антителами, присутствующими в сыворотке крови, в результате чего формируется комплекс антиген-антитело. Полученный иммунный комплекс выявляется конъюгатом, фермент которого, после добавления субстрата, вызывает разложение субстрат-индикаторного раствора и образование растворимого окрашенного продукта. При этом интенсивность окраски раствора в лунке пропорциональна содержанию антител в исследуемом материале. Для исследования в ИФА необходимы индивидуальные сыворотки крови животных в объеме 0,3 3,0 мл. Сыворотки можно хранить при температуре 4 C не более 3 суток или при температуре минус 20 C в течение 5 50 суток. Для постановки ИФА необходимы одно- и многоканальные автоматические микропипетки разных объемов со сменными наконечниками, мерная лабораторная посуда, одноразовые ванночки для компонентов реакции, дистиллированная вода, спектрофотометр (ридер) с фильтром на 450 нм. Перед началом работы планшеты и все компоненты набора выдерживают минут при комнатной температуре. Неиспользованные реагенты убирают в холодильник (2 8 C) сразу же после проведения исследования. Приготовление рабочих растворов реагентов: ФСБ-Т концентрированный раствор буфера (флакон 1) разводят в 25 раз дистиллированной водой и тщательно перемешивают. Для этого содержимое одного флакона концентрата (26 мл) переносят в мерную колбу и доводят объём до 650 мл дистиллированной водой. Если в концентрате присутствуют кристаллы, то его перед разведением нагревают и тщательно взбалтывают. В случае использования одного или нескольких стрипов планшета в чистый флакон отобрать необходимое для данного исследования количество составных частей ФСБ-Т в соответствии с таблицей: 9
10 Объем, мл Составные части Концентрат ФСБ-Т, мл Вода дистиллированная, мл Количество используемых стрипов Допускается хранить неиспользованный рабочий раствор ФСБ-Т в течение 5 суток в холодильнике (2 8 C). Все остальные компоненты набора готовы к употреблению. Окисляющие агенты, ионы металлов, моющие средства на посуде могут разлагать ТМБ. Во избежание ложных результатов необходимо тщательно отмывать посуду раствором кислоты серной 1 моль/л или кислоты соляной 1 моль/л с последующей отмывкой водой дистиллированной. Проведение анализа: Для исследования сывороток крови в ИФА отбирают необходимое количество стрипов, нумеруют их в соответствии с описью исследуемых проб водостойким маркером из-за возможного выпадения из рамки-держателя во время тестирования. Оставшиеся стрипы хранят в полиэтиленовом пакете с влагопоглотителем, при температуре 4 0 С. Для внесения контрольных сывороток можно использовать любые лунки планшета. Для этого в лунку внести по 100 мкл К+ (флакон 4), в две другие лунки планшета по 100 мкл К- (флакон 5). В остальные лунки планшета внести по 80 мкл РБР-С (флакон 2). При постановке ИФА на одном стрипе допускается использовать для К- и К+ по одной лунке. В остальные лунки планшета с РБР-С внести по 20 мкл исследуемых сывороток. Раствор перемешать пять раз пипетированием, не касаясь дна лунки. Цвет РБР-С должен измениться: происходит незначительное просветление раствора. После внесения проб сывороток планшет помещают в пластиковый пакет или накрывают крышкой и инкубируют 30 мин при 37 C. После инкубации лунки освобождают от содержимого резким встряхиванием и пять раз промывают рабочим раствором ФСБ-Т, каждый раз полностью заполняя лунки буфером, и, выждав определенное время (от 30 сек до 1 минуты), вытряхивают содержимое. Во время обработки большого количества планшетов можно оставлять их с промывочным раствором до 5-10 минут. Затем планшет подсушивают постукиванием по сложенной в несколько слоев фильтровальной бумаге. Во все используемые лунки микропанели вносят по 100 мкл раствора конъюгата (флакон 3); планшет помещают в пластиковый пакет или накрывают крышкой и выдерживают 30 мин при 37 C. После повторной инкубации проводят процедуру промывания лунок рабочим раствором ФСБ-Т по описанной выше методике. После промывки во все используемые лунки микропанели вносят по 100 мкл раствора субстрата (флакон 6) и выдерживают 30 минут при 37 C в темноте. По истечению указанного 10
11 времени реакцию останавливают добавлением в каждую используемую лунку по 50 мкл стоп-раствора (флакон 7). Оценка результатов реакции: Результаты ИФА регистрируют на спектрофотометре. Оптическую плотность (ОП) измеряют при длине волны 450 нм. Нулевой уровень («бланк») задают по воздуху. Результаты учитывают только в том случае, если в лунках с К- среднее значение ОП (ОПК-) не более 0,2, в лунках с К+ среднее значение ОП (ОПК+) не менее 1,0. Рассчитывают ОПкрит. по формуле: ОПкрит. = ОПК-(ср.) + 0,2, где ОПК-(ср.) среднее значение ОП (ОПК-) по двум лункам. Если значение оптической плотности исследуемого образца не превышает 0,3 то результат анализа считают отрицательным (IgG к бруцелле не определены). Если значение оптической плотности исследуемого образца попадает в интервал от 0,3 до 0,9 то результат анализа сомнительный. Рекомендуется повторить исследование такой сыворотки, а в случае повторного сомнительного результата провести исследование сыворотки, полученной из крови, взятой от данного животного повторно через дней. Если значение оптической плотности исследуемого образца превышает 0,9 то результат анализа положительный. Интерпретация результатов анализа При выявлении в благополучных по бруцеллезу стадах крупного рогатого скота, не иммунизированного против бруцеллеза или иммунизированного неагглютиногенными противобруцеллезными вакцинами, или не ранее чем через 6 месяцев после иммунизации слабоагглютиногенными бруцеллезными вакцинами, животных, исследованных с положительным и сомнительным результатами ИФА, сыворотки крови последних подвергают дополнительным исследованиям комплексом серологических реакций (РА, РСК, РНГА со стандартными антигенами; РИД с О-ПС антигеном), по результатам которых осуществляют интерпретацию полученных результатов, в необходимых случаях в целях их дифференциальной эпизоотической оценки привлекая метод исследования парных сывороток (одновременное исследование сохраненных в холодильнике сывороток и сывороток крови, взятой от этих же животных через дней, ИФА и комплексом серологических реакций со стандартными антигенами), бактериологическое исследование биоматериала от реагирующих животных, другие специальные методы, в том числе на базе НИУ. При выявлении в неблагополучных по бруцеллезу стадах крупного рогатого скота, не иммунизированного против бруцеллеза или иммунизированного неагглютиногенными бруцеллезными вакцинами, или не ранее чем через 6 месяцев после иммунизации слабоагглютиногенными бруцеллезными вакцинами, животных с положительным результатом ИФА их считают больными бруцеллезом. 11
12 При выявлении в неблагополучных по бруцеллезу стадах крупного рогатого скота, не иммунизированного против бруцеллеза или иммунизированного неагглютиногенными бруцеллезными вакцинами, или не ранее чем через 6 месяцев после иммунизации слабоагглютиногенными бруцеллезными вакцинами, животных с сомнительным результатом ИФА рекомендуется повторить исследование в ИФА сывороток крови от этих животных, а в случае повторного сомнительного результата провести исследование сыворотки, полученной из крови, взятой от данного животного повторно через дней. При исследовании сывороток крови мелкого рогатого скота на бруцеллез в ИФА интерпретация получаемых результатов в случае отсутствия вакцинации против бруцеллеза аналогично таковой у крупного рогатого скота. Что касается интерпретации результатов в случае вакцинации против бруцеллеза, ее возможность доказана к настоящему времени в случае иммунизации мелкого рогатого скота вакциной из агглютиногенного штамма B. abortus 19 в дозе 4 млрд. м.к. конъюнктивально (через 4 мес. и более). 4. ВОЗМОЖНЫЕ ОШИБКИ ПРИ ПОСТАНОВКЕ ИФА И ПУТИ ИХ НЕДОПУЩЕНИЯ Основные причины появления погрешностей на данном этапе могут носить как объективный, биологический, так и субъективный характер, связанный с допущением лабораторных ошибок. 1. Плохая организация работы в лаборатории является фактором, приводящим к увеличению числа случайных ошибок, допускаемых персоналом при проведении анализа (неправильный отбор проб, ошибочное внесение компонентов не в те лунки, пролив реагентов и их загрязнение, несоблюдение рекомендуемых временных интервалов и т.п. и условий хранения исследуемых образцов и Наборов реагентов). Лабораторное помещение должно соответствовать требованиям, изложенным в соответствующих ведомственных инструкциях, а также быть приспособленным для проведения лабораторного микроанализа. Последнее подразумевает, в том числе, отсутствие общей загроможденности, наличие достаточного количества места для проведения анализа, а также оптимальное расположение приборов и лабораторного оборудования. Специфическим и очень важным требованием для проведения иммуноферментного, а также любого иммунохимического анализа, является оптимальная температура в помещении ( С). Следствием работы при более низкой (высокой) температуре может быть значительное изменение регистрируемой оптической плотности растворов в лунках, ухудшение чувствительности метода, сокращение диапазона определяемых концентраций и, как следствие, получение искаженных результатов анализа. Существует несколько механизмов изменения аналитических характеристик Наборов реагентов в зависимости от температуры, при которой проводится 12
13 эксперимент: нарушение иммунохимического равновесия, изменение скорости развития окраски, подсыхание растворов и образование солево-белкового «ободка» на внутренней поверхности лунок планшета при высокой температуре и низкой влажности воздуха в помещении и др. Попытки скорректировать влияние температуры на результаты анализа путем изменения времени инкубации далеко не всегда бывают успешными, особенно если состав калибровочных проб, контрольной сыворотки и исследуемых образцов имеет значительные различия. Поэтому единственно правильным решением будет проведение инкубации в термостате, установленном на рекомендуемую температуру (+37 0 С). Наличие хорошей вытяжной вентиляции является важным условием при работе с иммуноферментным набором, так как в его состав входят вещества (ТМБ, растворы кислот, антибиотики, а также аэрозоли используемых реагентов), представляющие определенную опасность для лабораторного персонала. 2. Ошибки, связанные с лабораторным оборудованием. При использовании нестандартизованного лабораторного оборудования, а именно, дозирующих устройств, термостатов, спектрофотометров, могут появляться ошибки, имеющие систематический или случайный характер. Дозаторы. Неправильное дозирование растворов при проведении микроанализа критическим образом сказывается на полученных результатах. Поэтому не реже одного раза в месяц (лучше еженедельно) необходимо проводить проверку работы дозаторов на точность и сходимость результатов пипетирования, например, весовым методом. Допустимая погрешность пипеток не должна превышать 5%. Промывающее устройство для планшет. Распространенным источником получения ошибочных результатов является плохая работа промывающего устройства, которая заключается в неравномерном заполнении лунок отмывочным раствором и/или его неполном удалении. Наиболее частой причиной нарушения работы автоматического или ручного промывающего устройства является засорение одного из его каналов кристаллами солей буферного раствора, или другими крупными взвешенными частицами. Возникающая при этом недостаточная промывка, т.е. неполное удаление непрореагировавших компонентов (особенно конъюгата) приводит к увеличению сигнала в определенном ряду лунок (или в одной и той же лунке при использовании 96-канального промывателя) на разных планшетах. Несмотря на кажущуюся простоту выявления такой ошибки, необходимо исключить возможность появления аналогичной картины, связанной с неисправностью промывающего устройства. Иногда нарушается подача/аспирация растворов из-за засорения внутреннего канала промывающего устройства между иглами. Это приводит к частичному переносу реагентов из одной лунки в другую. При этом в лунках, соседних по ряду с сильноокрашенными образцами, также будет наблюдаться повышенная оптическая плотность, снижающаяся по мере удаления от исходной лунки. Желательно, чтобы в процессе про- 13
14 мывки лунки полностью заполнялись раствором. Это способствует более полному удалению следов сыворотки и конъюгата с их внутренних боковых поверхностей. Засорение входного фильтра, пророст в шлангах и другие причины, препятствующие свободному передвижению жидкости, также приводят к сбоям в работе промывающих устройств. Поэтому необходимо ежедневно визуально контролировать качество (однородность) заполнения лунок и удаления растворов. В конце рабочего дня необходимо тщательно промыть устройство дистиллированной водой. Это предотвратит кристаллизацию солей в каналах промывателя и снизит вероятность пророста в подающих и выпускных шлангах. Спектрофотометр. Одной из распространенных причин получения неправильных результатов является измерение оптической плотности без достаточного предварительного прогрева прибора. При этом его погрешность будет значительно превышать допустимую. Ввиду конструктивных особенностей некоторых спектрофотометров точность измерения может заметно снижаться при оптической плотности свыше 2,5-3,0 о.е. Качество работы спектрофотометра можно оценить путем повторного измерения оптической плотности лунок в одном и том же планшете. При проведении повторного измерения желательно развернуть планшет на 180 градусов. Допустимым является отклонение результатов измерения оптической плотности в одной и той же лунке, не превышающее 2%. Следует иметь в виду, что изменение оптической плотности содержимого лунок может быть вызвано наличием капель, царапин, отпечатков пальцев и других загрязнений на дне лунок. Поэтому перед проведением регистрации результатов их следует аккуратно протереть мягкой сухой безворсовой салфеткой. Для получения адекватных результатов следует использовать только тот светофильтр, который обеспечивает необходимую длину волны считывания, так как ее изменение приводит к резкому снижению регистрируемой оптической плотности. Термостат. При использовании термостата необходимо контролировать температуру на верхней и нижней его полке с помощью дополнительного контрольного термометра. Для исключения подсыхания лунок во время длительной инкубации рекомендуется использовать влажную камеру, или заклеивать лунки специальной бумагой для заклеивания планшет. Наиболее предпочтительным является использование термостата, совмещенного с устройством для встряхивания планшет термостатируемого шейкера, так как его использование позволяет легко добиться стандартизации условий инкубирования проб. Однако следует заметить, что при слишком интенсивном встряхивании может происходить десорбция иммобилизованных на планшете реагентов, а также выплескивание растворов из лунок; при недостаточном перемешивании, а также при инкубации без встряхивания будет наблюдаться заметное снижение оптической плотности, а в некоторых Наборах возможно получение ложных результатов. Следует иметь в виду, что продление времени инкубации далеко не всегда может компенсировать отсутствие встряхивания. Автоматический анализатор. В крупных лабораториях, выполняющих значительное количество исследований, часто используются автоматические ИФА-анализаторы, которые позволяют значительно сократить трудозатраты на 14
15 исполнение анализа. В состав таких автоматов входят узлы, обеспечивающие проведение всех стадий анализа, т.е. предварительное разведение исследуемых образцов, внесение реагентов, инкубацию, отмывку и спектрофотометрию лунок. Появление систематических проблем при автоматизированном проведении того или иного вида анализа и исчезающих при ручном его исполнении, может быть связано со сбоями в работе одного из узлов анализатора (дозирующего устройства, блоков отмывки лунок и встряхивания планшет, спектрофотометра или термостата). Такие погрешности, относящиеся к разряду технических, достаточно легко выявить и устранить. Лабораторная посуда. Посуда для приготовления рабочих растворов реагентов должна быть тщательно вымыта. Особенно это касается растворов субстрата и конъюгата, так как даже следовые загрязнения синтетическими моющими средствами и окисляющими реагентами могут сказаться на результатах анализа. Рекомендуется выделить и промаркировать отдельную посуду, дозаторы и использовать одноразовые наконечники для работы с растворами конъюгата и субстрата (ТМБ). Фильтровальная бумага, на которой простукивают планшет для удаления мелких капель отмывочного раствора, должна использоваться однократно. 3. Ошибки при подготовке образцов к анализу. Размораживание. Если исследуемые образцы поступают в лабораторию в замороженном виде, их необходимо разморозить при комнатной температуре ( С) и тщательно перемешать для разрушения градиента концентрации сывороточных компонентов, образующегося при размораживании. Следует иметь в виду, что неполное перемешивание размороженных проб является очень частым источником ошибок. Центрифугирование. Перед проведением анализа необходимо визуально убедиться в гомогенности используемых образцов сыворотки (плазмы) крови. Основные источники ошибок при проведении иммуноферментного анализа. Присутствие в исследуемом образце сыворотки (плазмы) крови сгустков фибрина, осадка или взвешенных частиц может помешать точному отбору пробы дозатором. В таких случаях необходимо провести центрифугирование пробы и отобрать супернатант для исследования. Образцы сыворотки (плазмы) крови с признаками микробиологического пророста (неприятный запах, плесневые вкрапления, комковатый осадок и мутность) для анализа использовать нельзя изза произошедшего в них ряда серьезных биохимических изменений. 4. Ошибки при подготовке компонентов Набора к работе. Предлагаемый диагностический набор является наиболее удобным для потребителя, поскольку основные компоненты набора полностью готовы к использованию Для подготовки к анализу требуется лишь развести необходимое количество промывающего фосфатно-солевого буферного раствора (ФСБТ). Особую роль в этом 15
16 играет качество дистиллированной воды, используемой для его разведения. Например, приготовление отмывочного раствора на воде с примесью хлора и имеющей рн около 4,0 может приводить к десорбции иммобилизованных антител или антигена, снижать сигнал и увеличивать вариабельность результатов, т.е. ухудшать аналитические параметры Набора реагентов. С этой проблемой наиболее часто приходится сталкиваться осенью и весной, что связано с ухудшением качества водопроводной воды. Дистиллированную или деионизованную воду, используемую для приготовления реагентов, нельзя хранить в металлических емкостях, так как загрязнение раствора субстрата ионами металла может привести к его порче. При длительном стоянии дистиллированной воды может наблюдаться образование бактериального осадка на дне и стенках емкостей, используемых для ее хранения. Поэтому желательно готовить свежие порции дистиллята каждые 2-3 дня. Для предотвращения пророста воды нельзя использовать азид натрия и другие консерванты. Температура реагентов. В Инструкции по применению Набора реагентов указано, что перед проведением анализа все компоненты Набора, а также используемые разбавители должны быть прогреты до комнатной температуры ( С). Внесение в лунки планшета холодных реагентов с очень большой вероятностью приведет к получению неадекватных результатов из-за нарушения процесса установления равновесия в системе. Раствор субстрата тетраметилбензидина (ТМБ). При хранении на свету, а также при контаминации раствора субстрата тетраметилбензидина (ТМБ) окислителями и ионами металлов может наблюдаться его самопроизвольное окрашивание в голубой и синий цвета. Такой реагент нельзя использовать для проведения анализа из-за повышения фона, снижения чувствительности и диапазона определяемых концентраций аналита. Раствор субстрата тетраметилбензидина (ТМБ) после вскрытия флаконов следует хранить при температуре С в течение всего срока годности Набора. Планшет с иммобилизованным антигеном. Основной причиной порчи лунок с иммобилизованным антигеном является повышенная влажность. Поэтому оставшиеся неиспользованными стрипы необходимо тщательно заклеить бумагой для заклеивания планшета и хранить в оригинальной упаковке при температуре ( С) в течение всего срока годности Набора. Стабильность вскрытого Набора. Дробное использование Наборов со стрипированными планшетами является допустимой процедурой при их рутинном использовании. Тем не менее, следует иметь в виду, что реальный срок годности вскрытых Наборов неизбежно снижается. При дробном использовании Набора для проведения 4-5 циклов определений значительно возрастает вероятность случайной порчи входящих в него реагентов (пророст и испарение калибровочных проб и контрольной сыворотки, контаминация конъюгата, изменение связывающей способности лунок под действием влаги и т.д.), которую производитель просто не состоянии предусмотреть и предотвратить. Типичной проблемой в таких случаях становится также нехватка реагентов, особенно контроль- 16
17 ной положительной сыворотки. Поэтому в каждой лаборатории желательно экспериментально уточнить возможность дробного использования того или иного Набора, а также сократить до разумного минимума количество циклов повторных определений с использованием вскрытых Наборов. Для обеспечения стабильности подготовленных к работе компонентов и исключения их перекрестного загрязнения следует соблюдать определенные меры предосторожности, а именно, использовать новые одноразовые наконечники, сократить пребывание реагентов на рабочем столе на свету, при комнатной температуре, особенно в открытых флаконах, а также строго соблюдать рекомендуемые условия их дальнейшего хранения. Срок годности Набора. Использование Наборов с истекшим сроком годности является достаточно частым нарушением, встречающимся в отечественных лабораториях. Однако следует иметь в виду, что в этом случае изготовитель не может гарантировать сохранение качества своей продукции и достоверность получаемых заказчиком результатов. Замораживание компонентов. Случайное замерзание конъюгата при транспортировке или при хранении Набора приводит к резкому снижению его ферментативной активности и падению сигнала. В то же время, однократное замораживание калибровочных проб и контрольной сыворотки нередко является допустимой, а иногда и рекомендуемой процедурой, используемой для продления срока их хранения, что в обязательном порядке оговаривается в Инструкции по применению Набора. Выпадение солей из концентрата промывочного раствора (ФСБТ) является обратимым процессом и обычно не отражается на качестве данного реагента. 5. Ошибки при проведении анализа. Случайные ошибки при внесении компонентов в лунки планшета. При проведении анализа могут наблюдаться случайные ошибки, допускаемые оператором (использование реагентов, не входящих в состав данного Набора, нарушение последовательности внесения реагента, дозирование неправильных объемов, двойное внесение реагента или образца в одну лунку, отсутствие нужного реагента или образца в лунке и т.п.). Такие ошибки не носят систематического характера и не воспроизводятся в последующих экспериментах. Для того чтобы свести к минимуму количество случайных ошибок, необходимо визуально контролировать процесс внесения реагентов. При обнаружении ошибок испорченные лунки нельзя опорожнять и использовать заново. Их следует забраковать и провести анализ повторно. Необходимая точность внесения реагентов обеспечивается использованием стандартизованных и поверенных дозаторов, а также достаточным практическим опытом лабораторного персонала. Результаты анализа, их точность и воспроизводимость не должны зависеть от того, кто из операторов выполняет анализ в данный день. При использовании одноканального дозатора следует использовать новый наконечник для каждого 17
18 образца, а при использовании многоканального дозатора новые наконечники для каждого реагента. Перерывы в процессе внесения реагентов. Все работы по внесению реагентов в лунки должны проводиться ритмично и без больших перерывов. Например, если калибровочные пробы находятся уже в лунках, а анализируемые образцы еще не готовы, или вносятся партиями через определенные промежутки времени, то продолжительность инкубации для разных проб будет различной. Это приведет к изменению параметров связывания и искажению результатов. Желательно, чтобы время заполнения планшета каждым из последующих реагентов было максимально коротким (не более 2 минут) и примерно одинаковым. Нельзя оставлять незаполненными реагентами лунки в перерывах между различными стадиями анализа. Даже незначительное их высушивание, которое к тому же происходит в таких условиях неравномерно, может привести к неконтролируемому снижению сигнала. При вынужденных перерывах в работе можно на некоторое время положить планшет вверх дном на смоченный водой лист фильтровальной бумаги. Отмывка лунок планшета. Оптимизация процесса отмывки лунок планшета является очень важным условием для получения воспроизводимых результатов. При использовании промывающего устройства следует иметь в виду, что слишком сильный вакуум при аспирации может подсушивать лунки, повреждать белковое покрытие и вызывать инактивацию фермента, а слишком слабый оставлять в них капельки жидкости. При любом способе отмывки необходимо визуально контролировать равномерность заполнения лунок и полноту удаления отмывочного раствора. Удаление остаточных капель жидкости является необходимой процедурой, которую проводят постукиванием перевернутого планшета по расстеленному листу фильтровальной бумаги. Слишком долгое пребывание отмывочного раствора в лунках, а также увеличение количества циклов отмывки может приводить к падению сигнала и повышению вариабельности результатов. Стадия инкубации с раствором субстрата тетраметилбензидина (ТМБ). При проведении этой стадии необходимо строго соблюдать температурные и временные интервалы, рекомендованные производителем Набора реагентов. Категорически нельзя сокращать продолжительность инкубации для уменьшения количества ложноположительных результатов, так как при этом невозможно выявить и устранить истинную причину их появления. Кроме того, это приводит к возрастанию числа ложноотрицательных результатов. Инкубация с раствором субстрата тетраметилбензидина (ТМБ) должна проводиться в темноте для того, чтобы избежать краевых эффектов на планшете. Регистрация результатов. Последней стадией анализа является регистрация результатов, т.е. приборный этап. Измерение оптической плотности растворов в лунках должна проводиться своевременно, т.е. не позднее, чем через 15 минут после внесения стоп-реагента. Это связано с тем, что реакция окисления хромогена после внесения кислоты до конца не останавливается, а оптическая плотность растворов в лунках продолжает возрастать. 18
19 Таким образом, контролируемыми параметрами аналитического лабораторного этапа являются: дозирование реагентов, процессы, связанные с проведением реакции (перемешивание, термостатирование, продолжительность инкубации и т.д.), а также стадия регистрации и математической обработки результатов. Рекламации. Как уже было сказано выше, основная часть проблем при работе с Наборами реагентов, связана с ошибками, возникающими на долабораторном и аналитическом этапах. Тем не менее, иногда в лабораторию могут поступать Наборы реагентов, которые изменили свои свойства в процессе их доставки потребителям. Эта проблема характерна для отдаленных регионов, куда продукция поступает с нарушением температурных и временных условий транспортировки (замерзание и оттаивание реагентов или нагревание их до недопустимо высокой температуры и др.). Иногда встречаются нарушения в комплектации Набора, а также повреждение его внешней/внутренней упаковки и флаконов с реагентами. Все это является поводом для оформления рекламации на Набор. Для того чтобы технологи фирмы могли провести анализ причин получения неудовлетворительных результатов, желательно, чтобы при оформлении рекламации заказчик предоставил распечатку с полученными данными и сохранил остатки Набора. После рассмотрения полученных материалов производитель принимает решение о замене Набора, или дает заказчику необходимые рекомендации по методике проведения анализа. 5. ЗАКЛЮЧЕНИЕ Разработанная тест-система ИФА перспективна для применения в качестве скрининговой при массовых исследованиях животных на бруцеллез, обеспечивая возможность прибегать к классическим методам исследований РА и РСК лишь при переисследовании проб сывороток крови животных с положительными и сомнительными результатами ИФА. Ее использование позволяет значительно сэкономить время, затрачиваемое на проведение исследований, учет и интерпретацию полученных результатов, упростить и повысить объективность и воспроизводимость этих процессов за счет их инструментального обеспечения; а также обеспечить высокую безопасность (за счет исключения прямого контакта с антигеном, автоматического пипетирования проб и др.). 19
20 6. Список литературы 1. Косилов И.А., Аракелян П.К., Димов С.К., Хлыстунов А.Г. Бруцеллез сельскохозяйственных животных / Под ред. И.А. Косилова. Новосибирск, с. 2. Каликин И.Н., Дегтяренко Л.В., Карлова М.Ю., Скляров О.Д. Усовершенствование серологической экспресс-диагностики бруцеллеза животных // Сибирский вестник сельскохозяйственной науки г. С ). 3. Хаиров С.Г. РНГА в диагностике бруцеллеза крупного рогатого скота / Вестник ветеринарии Т С ; Ромахов Б.Н., Малышева Л.А., Руденко В.П. Испытание РНГА с эритроцитарным антигеном для диагностики бруцеллеза крупного рогатого скота и овец // Ветеринарная патология С ). 4. Патент РФ от г. Способ диагностики бруцеллеза / авторы Богаутдинов З.Ф., Вылегжанина Е.С. Кузьмина В.Б., Астахова Т.С., Ниязов У.Э., Шумилов К.В. 5. Патент РФ от г. Способ постановки диагностической реакции при бруцеллезе/авторы Игнатов П.Е., Федоров А.И., Мельниченко Л.П. 6. Патент РФ : от Рекомбинантный IgG-связывающий g-белок стрептококка группы g. / авторы Гупалова Т. В., Тотолян А.А. 7. Nacane Р. К., Kawaoi A. Peroxidase labeled antibody a new methods of conjugation. J. Histochem. Cytochem., 1974, 22, Егоров А. М., Осипов А. П., Дзантиев Б. Б., Гаврилова Е. М. Теория и практика иммуноферментного анализа / 1991, Москва: Высшая школа. 20
21 СОДЕРЖАНИЕ Стр. 1. ТЕОРЕТИЧЕСКОЕ ОБОСНОВАНИЕ ЭКСПРЕСС-ДИА- ГНОСТИКИ БРУЦЕЛЛЕЗА ЖИВОТНЫХ С ИСПОЛЬЗО- 4 ВАНИЕМ ИФА 2. РАЗРАБОТКА НОВОЙ ДИАГНОСТИЧЕСКОЙ ТЕСТ-СИ- СТЕМЫ ИФА, ЭКСПЕРИМЕНТАЛЬНОЕ И ПРАКТИЧЕ- СКОЕ ОБОСНОВАНИЕ ЕЕ ЭФФЕКТИВНОСТИ ПРИ 4-8 БРУЦЕЛЛЕЗЕ ЖИВОТНЫХ 3. МЕТОДИКА ПОСТАНОВКИ ИФА С НОВОЙ ДИАГНО- СТИЧЕСКОЙ ТЕСТ-СИСТЕМОЙ, РАЗРАБОТАННОЙ ГНУ ИЭВСиДВ И ГНУ ВНИИБТЖ СОВМЕСТНО С ООО 8-12 НПФ «СИББИОТЕСТ» 4. ВОЗМОЖНЫЕ ОШИБКИ ПРИ ПОСТАНОВКЕ ИФА И ПУТИ ИХ НЕДОПУЩЕНИЯ ЗАКЛЮЧЕНИЕ СПИСОК ЛИТЕРАТУРЫ 20 21
22 ООО «Сибитек» выпускает ветеринарные диагностические иммуноферментные наборы (ИФА): «Бруцелла -IgG-антитела КРС ИФА» (Декларация о соответствии. рег. РОСС RU.ФВ01.Д02485, дата регистрации г.), «Лептоспира -IgG-антитела ИФА ВЕТ» (Декларация о соответствии. рег. РОСС RU.ФВ01.Д02489, дата регистрации г.), «Листерия -IgG-антитела ИФА ВЕТ» (Декларация о соответствии. рег. РОСС RU.ФВ01.Д02486, дата регистрации г.), «Йерсиния -IgG-антитела ИФА ВЕТ» (Декларация о соответствии. рег. РОСС RU.ФВ01.Д02487, дата регистрации г.), «Хламидия -IgG-антитела ИФА ВЕТ» (Декларация о соответствии. рег. РОСС RU.ФВ01.Д02488, дата регистрации г.), для диагностики сельскохозяйственных животных на заболеваемость бруцеллезом, лептоспирозом, листериозом, йерсиниозом и хламидиозом. Форма поставки наборов: 96 определений (1 планшет=8х12), 192 определения (2 планшета=8х12х2). Информацию о текущих ценах на наборы можно найти на сайте Конкурентные преимущества нашего набора: Удобство использования: Растворы готовы к работе, не требуют предварительного разведения; После внесения образца сыворотки меняется цвет раствора в лунке планшета, что позволяет не сбиться во время проведения анализа; Реакция ведется при стандартизованной температуре 37 ⁰С, что позволяет нивелировать температурные колебания в рабочей зоне. Экономичность: Одновременно можно проводить анализ сразу на несколько инфекций на одной плашке так, как планшет разборный (12 стрипов по 8 лунок); На постановку анализа требуется от 1 часа 30 минут до 2 часов 30 минут, в зависимости от инфекции на которую проводится анализ; Можно проводить анализ такого количества сывороток, которое необходимо, не используя всю плашку сразу, поскольку планшет разборный , Новосибирская область, Новосибирский район, р.п. Кольцово, ул. Технопарковая, дом 1, офис 225 Тел. 8(383) , Сайт: 22
источник
Приложение 4 (справочное). Диагностические препараты, тест-системы, выпускаемые для лабораторной диагностики бруцеллеза
Диагностические препараты, тест-системы, выпускаемые для лабораторной диагностики бруцеллеза*
Зарегистрированные препараты и тест-системы
Аллерген бруцеллезный жидкий (Бруцеллин), раствор для внутрикожного введения
ФСП 42-0504-7375-06 РУ N ЛС-002 624 до 29.12.11 г.
Филиал ФГУП НПО «Микроген» МЗ РФ «Омское предприятие по производству бакпрепаратов»
Бруцелла тест для выявления антител против бруцелл с помощью реакции агглютинации (Райта) и реакции агглютинации (Хеддельсона)
ФСП 42-0180-4778-03 РУ N 003 617/01
ФГБУ НИИЭМ им. Н.Ф. Гамалеи Минздравсоцразвития РФ (филиал «Медгамал»)
123098, г. Москва, ул. Гамалеи, 18
Диагностикум бруцеллезный жидкий для реакции агглютинации, суспензия для диагностических целей
ФСП 42-01804778-03 РУ N 003 617/01 ФСП 42-0397-5668-04 ТУ 8830-001-01 897 080-2007 РУ N ФСР 2008/03141
ФГБУ НИИЭМ им. Н.Ф. Гамалеи Минздравсоцразвития РФ (филиал «Медгамал»)
123098, г. Москва, ул. Гамалеи, 18
Веб-сайт: www.medgamal.ru ФКУЗ
Ставропольский НИПЧИ Роспотребнадзора,
355035, г. Ставрополь, ул. Советская, 13-15
Иммуноглобулины диагностические флуоресцирующие бруцеллезные сухие, лиофилизат для диагностических целей
ФСП 42-0180-5315-04 РУ N ЛС-000 252
ФГБУ НИИЭМ им. Н.Ф. Гамалеи Минздравсоцразвития РФ (филиал «Медгамал»)
123098, г. Москва, ул. Гамалеи, 18
ПЦР-тест-система для выявления ДНК Brucella melitensis «Bru»
ТУ 9398-001-73 867 468-2005 РУ N ФС 012а-2005/3203-06
ООО «Лаборатория Изоген», г. Москва
Тест-система для выявления ДНК Brucella ssp. методом полимеразной цепной реакции (Ген-Бру)
ТУ 8895-008-01898109-2007 РУ N ФСР 2007/0099
410005, г. Саратов, ул. Университетская, д.46
Набор реагентов. Бактериофаги диагностические бруцеллезные жидкие (Тб, Wb, Bk, Fi)
ТУ 9386-001-01897080-2008 РУ N ФСР 2009/05200
ФКУЗ Ставропольский НИПЧИ Роспотребнадзора,
355035, г. Ставрополь, ул. Советская, 13-15
Набор реагентов Ампли-Сенс для выявления ДНК бактерий рода бруцелла методом ПЦР
Сертификат N 09 0400 V/ITC
ФБУН » ЦНИИ эпидемиологии» Роспотребнадзора,
11123, г. Москва, ул. Новогиреевская, 3а
Набор реагентов тест-система диагностическая для выявления возбудителя бруцеллеза в иммуноферментном анализе (ИФА) («ИФА- Бру-СтавНИПЧИ»)
ФКУЗ Ставропольский НИПЧИ Роспотребнадзора,
355035, г. Ставрополь, ул. Советская, 13-15
Незарегистрированные и разрабатываемые препараты и тест-системы
Сыворотка бруцеллезная диагностическая поливалентная жидкая для реакции агглютинации
ФКУЗ Иркутский НИПЧИ Сибири и Дальнего Востока
64047, г. Иркутск, ул. Трилиссера,78
ФКУЗ Ставропольский НИПЧИ Роспотребнадзора,
355035, г. Ставрополь, ул. Советская, 13-15
Сыворотки бруцеллезные диагностические моноспецифические anti-abortus и anti-militensis адсорбированные жидкие для реакции агглютинации
ФКУЗ Ставропольский НИПЧИ Роспотребнадзора,
355035, г. Ставрополь, ул. Советская, 13-15
Диагностикум эритроцитарный бруцеллезный антигенный жидкий, набор диагностический
ФКУЗ Ставропольский НИПЧИ Роспотребнадзора,
355035, г. Ставрополь, ул. Советская, 13-15
Диагностикум латексный бруцеллезный антигенный жидкий для РАЛ
ФГБУ НИИЭМ им. Н.Ф. Гамалеи Минздравсоцразвития РФ (филиал «Медгамал»)
123098, г. Москва, ул. Гамалеи, 18
Тест-системы иммуноферментные пероксидазные для определения возбудителя бруцеллеза и выявления бруцеллезных антител
Диагностикум бруцеллезный сухой для РКоА
344064, г. Ростов-на-Дону, ул. Волоколамская, 1/99
Иммуноферментная тест-система для обнаружения антигенов возбудителя бруцеллеза
ФКУЗ Иркутский НИПЧИ Сибири и Дальнего Востока
64047, г. Иркутск, ул. Трилиссера,78
Тест-система с использованием частиц коллоидных металлов (золото, серебро) для дот-иммуноанализа противобруцеллезных антител
Тест-система с использованием частиц коллоидных металлов (золото, серебро) для обнаружения антигенов бруцелл в дот-иммуноанализе
Диагностикум бруцеллезный цветной сухой для микроагглютинации (МРА), реакции агглютинации (РА) пробирочной и ускоренной на стекле
Диагностическая агглютинирующая сыворотка против бруцелл в L-форме
* — из практического руководства «Лабораторная диагностика опасных инфекционных болезней». М., 2009.
Откройте актуальную версию документа прямо сейчас или получите полный доступ к системе ГАРАНТ на 3 дня бесплатно!
Если вы являетесь пользователем интернет-версии системы ГАРАНТ, вы можете открыть этот документ прямо сейчас или запросить по Горячей линии в системе.
© ООО «НПП «ГАРАНТ-СЕРВИС», 2019. Система ГАРАНТ выпускается с 1990 года. Компания «Гарант» и ее партнеры являются участниками Российской ассоциации правовой информации ГАРАНТ.
источник
Предлагаемое изобретение относится к области ветеринарной биотехнологии, в частности к разработке способов диагностики бруцеллеза животных, и может быть использовано в ветеринарии.
Высокой чувствительностью и специфичностью при выявлении антител к возбудителям бруцеллеза обладают способы на основе принципа иммуноферментного анализа (ИФА).
Известен способ получения бруцеллезного антигена, используемый для диагностики бруцеллеза, который включает культивирование бруцелл, отмывание микробных клеток, обработку их фенолом [Григорьева Г.И., Игнатов П.Е., Федоров А.И. Способ получения антигенов из бактерий рода Brucella. А.с. №1631786. СССР. 1988.].
Однако антиген, полученный известным способом, используется только для постановки реакции агглютинации, с помощью которой обнаруживают специфические антитела в сыворотке больных бруцеллезом животных и людей.
Известен способ получения бруцеллезного антигена, включающий выращивание бруцелл, отмывку микробных клеток, обработку их ацетоном, эфиром, высушивание в вакуум-эксикаторе, экстракцию трихлоруксусной кислотой (ТХУ), высушивание, обработку щелочью, осаждение ацетоном, высушивание. Антиген, полученный данным способом, используют для выявления гемагглютининов в сыворотках больных бруцеллезом людей и животных [Григорьева Г.И., Игнатов П.Е., Федоров А.И. Способ получения антигенов из бактерий рода Brucella. А.с. №1631786. СССР. 1988].
Однако бруцеллезный антиген, полученный по данному способу, имеет недостатки при его получении: низкий выход антигена; сложная технология; использование большого количества токсических и взрывоопасных веществ (ацетона, эфира); время обработки биомассы составляет несколько суток.
Известен способ диагностики бруцеллеза методом непрямого иммуноферментного анализа характеризующийся высокой специфичностью и чувствительностью. Способ заключается в последовательной инкубации в лунках планшета компонентов тест-системы и анализируемого материала по следующей схеме: сенсибилизацию лунок планшетов для микротитрования очищенным ЛПС бруцеллезным антигеном; внесение и инкубацию контрольных и анализируемых образцов; внесение и инкубацию видоспецифических антител, меченных ферментом. После каждой стадии проведения анализа проводят отмывание лунок планшетов от несвязавшихся реагентов. т.е. происходит внесение субстрата ферментативной реакции. [Ж. J.Virol.Meth. — 1983 — v.6. — 19-29].
Учет результатов реакции проводят по величине оптической плотности анализируемых образцов.
При проведении сравнительных исследований 1000 сывороток крови крупного рогатого скота методами РДП и ИФА было выявлено: РДП+/ ИФА+540; РДП-/ИФА- 431; ИФА+/РДП- 29; ИФА-/РДП+0 (Ж. J.Virol. Meth. — 1983 — v.6. — 19-29).
Однако существуют ограничения, не позволяющие проведение достоверной диагностики, так возбудители, вызывающие заболевание, присутствуют в природе в S и R формах, которые отличаются между собой по строению и как следствие этого обладают разным антигенным составом. Это обстоятельство затрудняет диагностику, так как большинство существующих тест-систем способны выявлять антитела, образовавшиеся только при иммунном ответе на S формы возбудителя. Кроме того, для профилактики бруцеллеза в неблагополучных и угрожаемых районах широко применяется вакцинация. Вырабатываемые в организме поствакцинальные антитела, очень трудно дифференцировать от антител, вырабатываемых организмом в ответ на внедрение патогенного штамма возбудителя, что значительно усложняет работу по проведению оздоровительных мероприятий.
Задачей изобретения является разработка повышение чувствительности способа диагностики бруцеллеза животных, расширение его функциональных возможностей, т.е. возможность применения способа с целью выявлять и дифференцировать антитела к S и R формам бруцелл в сыворотках крови или молоке любых восприимчивых животных и человека.
На поверхности твердофазного носителя иммобилизуют S-ЛПС и R-ЛПС бруцеллезный антиген в 2 этапа, первый из которых — неспецифическая адсорбция моноклональных антител мыши к S-ЛПС и R-ЛПС бруцеллезным антигенам и второй — специфическое иммунологическое связывание S-ЛПС и R-ЛПС антигенов с моноклональными антителами мыши к этим антигенам. Далее вносят и инкубируют испытуемый материал вместе с ферментно мечеными моноклональными антителами. После проведения этапа инкубации отмывают несвязавшиеся реагенты. Добавляют субстрат ферментативной реакции для выявления связавшихся антител и определяют наличие антител по величине оптической плотности испытуемых образцов по сравнению с контролем.
Для осуществления способа используют тест-систему, в которую входят: сенсибилизированный S-ЛПС и R-ЛПС бруцеллезным антигеном планшет для микротитрования; меченные пероксидазой моноклональные антитела против S-ЛПС и R-ЛПС; контрольные положительные и отрицательные образцы сыворотки крови и молока.
Кроме того, используют субстратную смесь перекиси водорода и хромогена (донор протонов), разбавители компонентов реакции и раствор для промывки планшетов.
Получение компонентов тест-системы.
Для изготовления сенсибилизированного бруцеллезными антигенами твердофазного носителя используют моноклональные антитела 2Н2 и 2Н8 против S и R ЛПС бруцеллезных антигенов.
Моноклональные антитела к S-ЛПС бруцеллезному антигену продуцируют клетки штамма гибридомной линии клеток 2Н2.
Клетки штамма в дозе 2-10×10 6 клеток/мышь в 0,5 мл фосфатно-солевого буфера вводят в брюшную полость линейных мышей BALB/c, которым предварительно за 7 суток ввели 0,3 мл пристана. На 10-14 сутки получают асцитическую жидкость, титр специфических моноклональных антител к S-ЛПС антигену в которой составил в ИФА 1:640-1:5120. Препарат моноклональных антител получают из асцитической жидкости трехкратным осаждением раствором сульфата аммония 50% насыщения с последующим диализом против фосфатно-солевого буферного раствора, рН 7,2-7,4 и определяют концентрацию белка и активность антител.
Моноклональные антитела к R-ЛПС бруцеллезному антигену продуцируют клетки штамма гибридомной линии клеток 2Н8.
Клетки штамма в дозе 2-10×10 6 клеток/мышь в 0,5 мл фосфатно-солевого буфера вводят в брюшную полость линейных мышей BALB/c, которым предварительно за 7 суток ввели 0,3 мл пристана. На 10-14 сутки получают асцитическую жидкость, титр специфических моноклональных антител к R-ЛПС антигену в которой составил в ИФА 1:640-1:5120. Препарат моноклональных антител получают из асцитической жидкости трехкратным осаждением раствором сульфата аммония 50% насыщения с последующим диализом против фосфатно-солевого буферного раствора, рН 7,2-7,4 и определяют концентрацию белка и активность антител.
Бруцеллы вакцинного штамма В. abortus 19 выращивают в течение 48 ч, смывают микробные клетки нейтральным физиологическим раствором (НФР), центрифугируют, промывают трехкратно осадок с помощью НФР при центрифугировании, ресуспендируют осадок до получения суспензии, содержащей 200 млрд. м. кл. в 1 мл, добавляют равный объем 0.5% раствора фенола и автоклавируют в режиме 1 атмосфера 121°С в течении часа. Используют для изготовления сенсибилизированного антигеном твердофазного носителя.
Бруцеллы вакцинного штамма В. abortus 17/100 выращивают в течение 48 ч, смывают микробные клетки нейтральным физиологическим раствором (НФР), центрифугируют, промывают трехкратно осадок с помощью НФР при центрифугировании, ресуспендируют осадок до получения суспензии, содержащей 200 млрд. м. кл. в 1 мл, добавляют равный объем 0.5% раствора фенола и автоклавируют в режиме 1 атмосфера 121°С в течение часа. Используют для изготовления сенсибилизированного антигеном твердофазного носителя.
Контроль специфичности и активности антигена осуществляют в реакции диффузионной преципитации (РДП) после концентрирования в 10-100 раз. Антиген должен образовывать полосу преципитации с контрольной стандартной антисывороткой, идентичную полосе преципитации, образованной контрольным стандартным антигеном и контрольной стандартной антисывороткой. Активность S и R ЛПС бруцеллезных антигенов должна быть не ниже, чем 1:16-1:64.
Изготовление сенсибилизированного S и R-ЛПС бруцеллезными антигенами твердофазного носителя проводят в 2 этапа.
1 этап. Препараты моноклональных антител 2Н2 и 2Н8 к S и R-ЛПС бруцеллезным антигенам разбавляют фосфатно-солевым буферным раствором рН 7,2-7,4 до концентрации белка 5 мкг/мл и вносят порядно в 96-луночные планшеты для микротитрования по 100 мкл в каждую лунку. В нечетные ряды вносят антитела 2Н2, в четные ряды антитела 2Н8. Инкубируют в течение 16 часов при 2-8°С, отмывают от несвязавшихся антител промывочным раствором.
2 этап. В лунки панели вносят по 100 мкл S и R-ЛПС бруцеллезных антигенов. В нечетные ряды вносят S-ЛПС бруцеллезный антиген, в четные ряды вносят R-ЛПС бруцеллезный антиген. Инкубируют в течение 3 часов при температуре 37°С, отмывают от несвязавшихся антител промывочным раствором. Подсушивают планшет на воздухе при комнатной температуре (18-22°С) в течение 16 час. Упаковывают герметически в ламинированную фольгу или полиэтилен, удаляя излишки воздуха.
Изготовление контрольных сывороток.
Контрольными положительными сыворотками служат сыворотки крови кролика иммунизированных нативными бруцеллами из штаммов В. abortus 19 (S положительная сыворотка) и В. abortus KB 17/100 (R положительная сыворотка). Контрольные положительные сыворотки оттитрованы. Контрольными отрицательными сыворотками крови служат сборные сыворотки крови полученные не менее, чем от 10 коров отрицательно реагирующих в РА и РИД с бруцеллезным антигеном из благополучного по бруцеллезу району.
Положительное контрольное молоко получают добавлением положительных кроличьих сывороток в молоко не менее, чем от 10 коров отрицательно реагирующих в РА и РИД с бруцеллезным антигеном из благополучного по бруцеллезу району.
Изготовление меченных пероксидазой моноклональных антител (конъюгатов) против S и R-ЛПС бруцеллезных антигенов проводят с использованием штаммов гибридомных линий клеток 2Н2 и 2Н8. Клетки штаммов линии 2Н2 и 2Н8 в дозе 2-10×10 6 клеток на мышь в 0,5 мл фосфатно-солевого буфера вводят в брюшную полость линейных мышей BALB/c, которым предварительно за 7 суток ввели 0,3 мл пристана. На 10-14 сутки получали асцитическую жидкость с активностью моноклональных антител в ИФА 1:640-1:5120, из которой затем выделяют антитела трехкратным осаждением раствором сульфата аммония 50% от насыщения с последующим диализом против 0,01 М натрий-карбонатного буфера, рН 9,5. Содержание антител в препарате (по белку) составило 10-12 мг/мл. Связывание антител с пероксидазой из корней хрена проводят методом, разработанным Wilson, Nakane, после активации фермента перйодатом натрия (4). Полученный конъюгат титровали методом иммуноферментного анализа. Активность полученного конъюгата в иммуноферментном анализе для выявления S и R-ЛПС антигенов адсорбированных в лунках планшета 1:5000-1:30000.
Проведение иммуноферментного анализа для выявления антител к S и R-ЛПС бруцеллезным антигенам состоит в следующем.
В планшеты для микротитрования, сенсибилизированные ЛПС бруцеллезным антигеном, вносят по 0,1 мл конъюгатов анти-S-ЛПС и анти-R-ЛПС. Анти-S-ЛПС конъюгат вносят в нечетные ряды, анти-R-ЛПС конъюгат в четные ряды планшета, затем в лунки вносят по 0,01 мл контрольных и исследуемых образцов сыворотки крови, содержимое лунок тщательно перемешивают, планшет накрывают крышкой и инкубируют при 37°С в течение 1 часа. Затем содержимое лунок удаляют и четырежды промывают промывочным раствором. Далее вносят в каждую лунку по 0,1 мл субстратной смеси, содержащей хромоген и перекись водорода и оставляют при температуре 18-22°С на 5-10 мин в защищенном от прямых солнечных лучей месте. Измеряют оптическую плотность раствора в лунках. Тест считают достоверным, если:
— значение оптической плотности положительного контроля не превышает 0,3;
— отношение между величинами оптической плотности положительного и отрицательного контроля N/Р не менее 1,5.
Реакцию считают положительной, если оптическая плотность раствора в лунке испытуемой равно или меньше оптической плотности раствора в лунке отрицательного контроля.
Осуществление способа диагностики отражено в конкретных примерах.
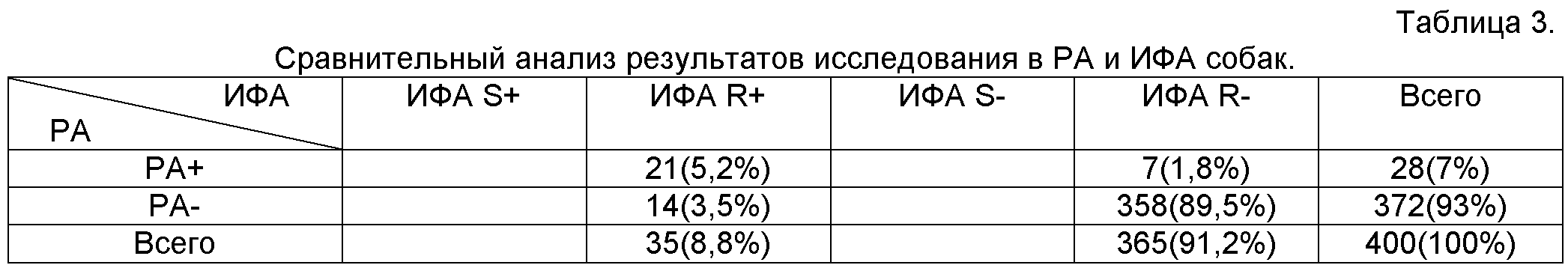
Пример 1. Изготовление тест-системы и оценка достоверности теста для определения антител к бруцеллезным антигенам в сыворотках крови. Изготовление тест-системы и проведение анализа с контрольными сыворотками, как описано выше. Установку нуля фотометра осуществляют против пустого планшета той же серии, которая была использована для изготовления тест-системы.
Результаты проведения измерений приведены в таблице 1. Полученные в результате измерений значения оптической плотности составляют: для холостой пробы — менее 0,05 (0,02-0,04); для отрицательной контрольной сыворотки 1,750-2,200; для положительной контрольной сыворотки 0,3.
Пример 2. Сравнение чувствительности и специфичности серологических способов диагностики бруцеллеза — РА и ИФА. Тест-систему для выявления инфицированного крупного рогатого скота методом конкурентного иммуноферментного анализа готовили, как описано выше, с использованием S и R-ЛПС бруцеллезного антигена на основе штаммов В.abortus шт.19 (S-форма) и КВ-17/100(К-форма). Проводили параллельное исследование 347 сывороток крови крупного рогатого скота из неблагополучного по бруцеллезу хозяйства №1 (закрытого типа) в данной тест-системе и реакции диффузионной преципитации. Результаты исследования приведены в таблице 2. Совпадение результатов (РА+/ИФА+и РА-/ИФА-) отмечено в 87,5% случаев, несовпадение (РА+/ИФА- и РА-/ИФА+) — в 14,5% случаев. В ИФА было выявлено 40 (13% от числа исследованных) положительных проб, отрицательных в РА. Пять проб (1,5% от числа исследованных), положительных в РА, дали отрицательный результат в ИФА. Все положительные в ИФА сыворотки реагировали с S-бруцеллезным антигеном, так как возбудитель бруцеллеза крупного рогатого скота присутствует в природе в S-форме. Как видно из таблицы, предложенный способ является более чувствительным, по сравнению с РА. Пример 3. Чувствительность и специфичность иммуноферментного анализа с использованием моноклональных антител для исследования сывороток крови собак. Тест-систему для выявления бруцеллоносителей методом конкурентного иммуноферментного анализа готовили, как описано выше. В качестве антигена использовали препараты, на основе штаммов B.abortus шт.19 (S-форма) и КВ-17/100(R-форма). Проводили параллельное исследование 400 сывороток крови собак, доставленных из ветеринарных клиник. Совпадение результатов (РА+/ИФА+; РА-/ИФА-) отмечали в 365 или 91,2%, несовпадение (РА+/ИФА-; РА-/ИФА+) — в 5,3% случаев. Семь положительных по результатам РА пробы прореагировали отрицательно в ИФА (1,8%). В ИФА было выявлено 21 (5,2%) положительная проба, тогда как в РА- 14 (3,5%). Все положительные в ИФА сыворотки реагировали с R-бруцеллезным антигеном, так как возбудитель бруцеллеза собак присутствует в природе в R-форме. Из таблицы 3 видно, что по чувствительности метод иммуноферментного анализа превосходил РА и не уступал ей по специфичности. Эти результаты свидетельствуют о том, что по чувствительности предложенный способ значительно превосходит РА и приближается к прямому диагностическому тесту — полимеразной цепной реакции (ПЦР). Приведенные примеры свидетельствуют о высокой специфичности и чувствительности предложенного способа диагностики бруцеллеза путем выявления носителей возбудителя болезни методом конкурентного иммуно-ферментного анализа, независимо от способа получения антигена. Предложенный способ диагностики бруцеллеза, методом конкурентного иммуноферментного анализа, характеризуется следующими полезными свойствами: обладает высокими чувствительностью и специфичностью вследствие использования при изготовлении тест-системы двух моноклональных антител к повторяющимся антигенным эпитопам; возможность исследования в одной тест-системе различных видов животных; дифференциация циркулирующей в организме формы (S или R) возбудителя заболевания; является методом экспресс-диагностики, позволяющим получить результаты анализа в течение 1,5 часов; включает объективную оценку результатов и поддается автоматизации; позволяет использовать в качестве материала для исследования не только сыворотку крови, но и молоко, что выгодно экономически и снижает риск распространения инфекции при взятии крови. Способ диагностики бруцеллеза с одновременной дифференциацией возбудителя методом иммуноферментного анализа найдет применение в ветеринарии, что: позволит повысить эффективность оздоровительных мероприятий, сократить сроки оздоровления неблагополучных по бруцеллезу животноводческих хозяйств, выявлять инфицированных собак, находящихся в непосредственном контакте с людьми и в итоге — снизить заболеваемость человека бруцеллезом. Способ дифференциальной диагностики бруцеллеза, предусматривающий использование антигенов S- и R-форм для выявления антител в испытуемом материале с последующим определением наличия антител, отличающийся тем, что на поверхность твердофазного носителя иммобилизуют S-ЛПС и R-ЛПС бруцеллезные антигены в два этапа, где первый этап предусматривает неспецифическую адсорбцию моноклональных антител мыши к S-ЛПС и R-ЛПС бруцеллезным антигенам, и второй — специфическое иммунологическое связывание S-ЛПС и R-ЛПС антигенов с моноклональными антителами мыши к этим антигенам, далее вносят и инкубируют испытуемый материал вместе с меченными ферментом моноклональными антителами, после инкубации отмывают несвязавшиеся реагенты, добавляют субстрат ферментативной реакции для выявления связавшихся антител и определяют наличие антител к бруцеллезным антигенам по величине оптической плотности испытуемых образцов по сравнению с контролем. источник |