Вирус Бешенства. Уличный и фиксированный вирусы бешенства. Патогенность, диагностика, антирабические прививки
Возбудитель болезни — РНК-содержащий вирус, относящийся к роду Lissavirus семейства Rabdoviridae. Как и другие рабдовирусы, он имеет пулевидную форму. Длина вирионов — 180 нм, диаметр — 75 — 80 нм. Вирус удается культивировать в развивающихся куриных и утиных эмбрионах, в культурах некоторых клеток. Штаммы возбудителя бешенства, циркулирующие в природе (уличный вирус), патогенны для всех теплокровных животных. В наиболее высоких титрах вирус накапливается в центральной нервной системе зараженных животных, особенно в аммониевых рогах и коре больших полушарий головного мозга, в мозжечке и продолговатом мозге. Высокий титр возбудителя бешенства и в слюнных и слезных железах. Различают «дикий» (уличный) и «фиксированный» вирусы бешенства. Уличный вирус бешенства циркулирует в естественных условиях и характеризуется высокой патогенностью для людей и животных, образует в мозговых клетках специфические тельца Бабеша — Негри. «Фиксированный» вирус был получен Л. Пастером путем многоразового интрацеребрального пассажа вируса уличного бешенства через организм кролей, вследствие чего вирус потерял свою вирулентность для человека и животных, а также способность образовывать в мозге тельца Бабеша — Негри. Фиксированный вирус используется как исходный материал для изготовления антирабических вакцин. Все 7 серотипов полевых штаммов вируса бешенства, которые были изолированы от людей, животных и грызунов в Центральной Европе, от летающих мышей в Нигерии, от африканских землероек, а также от комаров и москитов в Нигерии и Судане, от коней в Нигерии, имеют широкую антигенную вариабельность и родственные связи в иммунобиологическом отношении, а прививка животных антирабической вакциной из пастеровского штамма создает иммунитет против вируса бешенства, выделенного в разных частях мира.
Реакции преципитации (РП) предложены Краусом (1897) и основаны на феномене образования видимого осадка (преципитата) или общего помутнения среды после взаимодействия растворимых либо находящихся в коллоидном дисперсном состоянии Аг с AT. РП ставят в специальных узких пробирках. В качестве реагентов используют гипериммунные преципитирующие сыворотки с высокими титрами AT к гомологичным Аг. При постановке РП разводят не сыворотку, а Аг. Реакционная среда должна содержать электролиты (физиологический раствор) и иметь нейтральный рН. РП позволяет быстро (в течение нескольких секунд) выявлять незначительные количества Аг. Они очень чувствительны, и их применяют для тонкого иммунохимического анализа, выявляющего отдельные компоненты в смеси Аг. Метод имеет несколько разновидностей (рис. 10-16). Реакция кольцепреципитации: На слой антисыворотки наслаивают жидкость, содержащую растворимый Аг, и через несколько секунд наблюдают образование кольца преципитата. Цели: индикация, идентефикация, титрование антиген или антитела. Сущность: АГ и АТ движутся на встречу друг к другу и при специфичности в месте соединяются в комплекс АГ+АТ в виде светлой полосы.
Сем. Тогавирусов (вирусная диарея крупного рогатого скота)
(Togaviridae), семейство вирусов, состоящее из родов Alphavirus, Flavivirus, Rubivirus и Pestivirus. Вирусы содержат однонитчатую РНК с мол. м. 3—4 X 106 дальтон, линейной формы, к-рая является инфекционной. Вирионы диам. 50—70 нм (альфавирусы), 40—50 нм (флявивирусы), 70 нм (рубивирусы), 40 нм (пестивирусы). Для капсида альфавирусов свойствен икосаэдральный тип симметрии. Сборка вирионов происходит в цитоплазме клеток на мембранных структурах. У флявивирусов в составе вириона имеются 3 структурных белка, у альфавирусов 2—3. При репликации в клетках вирусы обоих родов индуцируют образование РНК-зависимой РНК-полимеразы. Вирусы чувствительны к действию жирорастворителей. Этиология. Возбудитель болезни — сферич. РНК-содержащий вирус рода Pestivirus сем. Togaviridae. Величина вирусных частиц 30—40 нм. Вирус может годами сохраняться при t ниже 20°С, в культуральной жидкости не теряет биол. активность до 1 года, в крови, лимфатич. узлах, селезёнке и др. патол. материале — до 6 мес. При t 25 °С в течение 1 сут вирус практически не снижает биол. активности, при t 37 °С погибает через 5 сут. Вирус чувствителен к эфиру, хлороформу, трипсину и дезоксихолату натрия. Эпизоотология. В естеств. условиях В. д. к. р. с. болеют кр. рог. скот, буйволы, олени и косули. Наиболее восприимчивы животные в возрасте от 6 мес до 2 лет. Источник возбудителя инфекции — больные животные.
48.Сплит-вакцины, методы получения.
Сплит-вакцины или расщеплённые (Ваксигрип, Бегривак, Флюарикс) содержат разрушенные инактивированные вирионы вируса гриппа — в её состав входят все вирионные белки вируса, не только поверхностные, но и внутренние антигены. За счёт высокой очистки в ней отсутствуют вирусные липиды и белки куриного эмбриона. Сплит-вакцины или расщеплённые (Ваксигрип, Бегривак, Флюарикс) содержат разрушенные инактивированные вирионы вируса гриппа — в её состав входят все вирионные белки вируса, не только поверхностные, но и внутренние антигены. За счёт высокой очистки в ней отсутствуют вирусные липиды и белки куриного эмбриона. Преимущество сплит-вакцин в том, что они содержат как наружные, так и внутренние антигены вируса гриппа, при этом они избавлены от самого главного недостатка цельновирионных вакцин – наличия токсинов. Сплит-вакцины можно применять с 6-месячного возраста, они рекомендованы для предотвращения гриппа у беременных женщин. Наличие открытых для иммунной системы внутренних антигенов вируса гриппа (нуклеокапсида и матриксного белка) делает сплит-вакцины уникальными. Они защищают не только от ежегодных мутаций вируса гриппа, но частично и от всех возможных разновидностей вируса, поскольку внутренние антигены подвержены лишь незначительным мутациям. По сути дела, сплит-вакцины представляют собой «золотую середину» в профилактике гриппа, поскольку по уровню побочных реакций аналогичны субъединичным вакцинам, а по иммунологической эффективности – цельновирионным. Профилактическая эффективность вакцин этого класса колеблется в интервале от 75 до 96%. Классическим примером препаратов этого класса является французская вакцина Ваксигрип, компании Санофи Пастер (подразделения СанофиАвентис), которая присутствует на рынке Европы уже более 60 лет. Вслед за этой вакциной, другие производители также наладили выпуск сплит-вакцин. В России на сегодняшний день, сплит-вакцины не выпускаются отечественными производителями, а лишь переупаковываются из импортируемого сырья (Бегривак). В 2009 году китайский производитель зарегистрировал свою вакцину Флюваксин.
Дата добавления: 2018-02-28 ; просмотров: 695 ; ЗАКАЗАТЬ РАБОТУ
источник
«Безопасность работы с производственными штаммами фиксированного вируса бешенства. Методические указания. МУ 3.3.1.1099-02»
Документ по состоянию на август 2014 г.
Утверждаю
Главный государственный
санитарный врач
Российской Федерации,
Первый заместитель
Министра здравоохранения
Российской Федерации
Г.Г.ОНИЩЕНКО
15 января 2002 года
Дата введения —
1 апреля 2002 года
1. Разработаны Российским научно-исследовательским институтом «Микроб» Министерства здравоохранения Российской Федерации (д.м.н. И.А. Дятловым, к.м.н. А.К. Никифоровым, к.м.н. С.А. Ереминым); Государственным НИИ стандартизации и контроля медицинских биологических препаратов им. Л.А. Тарасевича Министерства здравоохранения Российской Федерации (д.м.н. А.А. Мовсесянцем, к.м.н. Н.А. Озерецковским, н.с. Г.Б. Агеенко).
2. Рекомендованы к утверждению комиссией по государственному санитарно-эпидемиологическому нормированию при Минздраве России (прот. N 10 от 13 декабря 2001 г.).
3. Утверждены Главным государственным санитарным врачом Российской Федерации — Первым заместителем Министра здравоохранения Российской Федерации Г.Г. Онищенко 15 января 2002 года. Введены в действие 1 апреля 2002 года.
1.1. Настоящие Методические указания разработаны в соответствии с Федеральным законом «О санитарно-эпидемиологическом благополучии населения» от 30 марта 1999 г. N 52-ФЗ, «Положением о государственном санитарно-эпидемиологическом нормировании» и санитарными правилами «Безопасность работы с микроорганизмами III — IV групп патогенности и гельминтами. СП 1.2.731-99».
1.2. Требования настоящих Методических указаний обязательны для органов и учреждений здравоохранения субъектов Российской Федерации.
В настоящих Методических указаниях использованы ссылки на следующие нормативные документы:
2.1. Федеральный закон «О санитарно-эпидемиологическом благополучии населения» N 52-ФЗ от 30 марта 1999 г.
2.2. Санитарные правила «Безопасность работы с микроорганизмами III — IV групп патогенности и гельминтами. СП 1.2.731-99».
2.3. Санитарные правила «Порядок учета, хранения, передачи и транспортирования микроорганизмов I — IV групп патогенности. СП 1.2.036-95».
2.4. Санитарные правила «Общие требования по профилактике инфекционных и паразитарных заболеваний. СП 3.1/3.2.558-96».
2.5. Санитарные правила по устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев), утв. Минздравом СССР от 6 апреля 1973 г. N 1045-73.
2.6. Строительные нормы и правила «Общественные здания и сооружения». СНиП 2.08.02-89 и «Пособие по проектированию учреждений здравоохранения» в 5 томах. Т. 1, 3, 5. Госгражданстрой. М., 1989.
2.7. ОСТ-42-21-2-85 «Стерилизация и дезинфекция изделий медицинского назначения. Методы, средства. Режимы».
2.8. Приказ «Об утверждении временных перечней вредных, опасных веществ и производственных факторов, а также работ, при выполнении которых проводятся предварительные и периодические медицинские осмотры», утв. Минздравмедпромом и Госкомсанэпиднадзором России от 05.10.95 N 280/88.
2.9. «Инструкция по эксплуатации и контролю эффективности вентиляционных устройств на объектах здравоохранения», утв. Минздравом СССР от 20 марта 1975 г.
2.10. «Методические рекомендации по проектированию вирусологических лабораторий», утв. Минздравом СССР от 28 декабря 1990 г. N 15-6/51.
2.11. «Методические указания по применению бактерицидных ламп для обеззараживания воздуха и поверхностей в помещениях», утв. Минздравмедпромом России от 28.02.95 N 11-16/03-06.
2.12. «Методические указания по контролю работы паровых и воздушных стерилизаторов», утв. Минздравом СССР от 28 февраля 1991 г. N 15/6-5.
2.13. «Правила техники безопасности, производственной санитарии и санитарно-противоэпидемического режима для предприятий по производству бактерийных и вирусных препаратов», утв. Минздравом СССР от 30 августа 1979 г.
2.14. Методы лабораторных исследований по бешенству. ВОЗ. Женева, 1975.
Авария — нештатная ситуация, при которой создается реальная или потенциальная возможность выделения патогенного агента в воздух производственной зоны, окружающую среду или заражение персонала.
Биологическая безопасность — система медико-биологических, организационных и инженерно-технических мероприятий и средств, направленных на защиту работающего персонала, населения и окружающей среды от воздействия патогенных биологических агентов.
Бокс биологической безопасности — конструкция, используемая для физической изоляции (удержания и контролируемого удаления из рабочей зоны) микроорганизмов с целью предотвращения возможности заражения персонала и контаминации воздуха рабочей зоны и окружающей среды.
Боксированное помещение (бокс) — изолированное помещение с тамбуром (предбоксником).
Лаборатория — структурное подразделение, выполняющее экспериментальные и (или) производственные работы с патогенными биологическими агентами.
«Заразная» зона — помещение или группа помещений лаборатории, где осуществляются манипуляции с производственными штаммами фиксированного вируса бешенства.
«Чистая» зона — помещение или группа помещений лаборатории, где не проводятся манипуляции с производственными штаммами фиксированного вируса бешенства.
Производственная работа — работа по производству медицинских иммунобиологических препаратов с использованием производственных штаммов фиксированного вируса бешенства.
Фиксированный вирус бешенства — аттенуированный штамм вируса бешенства, полученный путем длительного пассирования через головной мозг кролика. Производственные штаммы фиксированного вируса бешенства хранятся в ГИСК им. Л.А. Тарасевича и выдаются один раз в год учреждениям, имеющим право на работу с микроорганизмами III — IV группы патогенности.
Например, штаммы фиксированного вируса бешенства «Москва» и «CVS».
СИЗ — средства индивидуальной защиты.
Работа с производственными штаммами фиксированного вируса бешенства может проводиться в лабораториях, имеющих разрешение, выданное в установленном порядке Главным государственным санитарным врачом субъекта Российской Федерации сроком на 5 лет. Оно утрачивает силу при передислокации или перепланировке лаборатории, а также может быть аннулировано при нарушениях требований биологической безопасности.
Комитет экспертов ВОЗ (1972) рекомендовал следующие требования к производственным штаммам фиксированного вируса бешенства:
— тщательная регистрация истории пассажей;
— проведение в производстве не более 10 пассажей с момента последнего контроля его биологических свойств;
— минимальная патогенная активность для лабораторных животных при экстраневральном введении;
— антигенная специфичность и иммуногенная активность;
— изучение свойств производственного штамма фиксированного вируса бешенства после каждых 10 пассажей.
Фиксированный вирус бешенства должен иметь следующие основные признаки:
— короткий инкубационный период (4 — 5 дней);
— большую патогенность для кроликов при интрацеребральном заражении;
— значительное ослабление способности образовывать тельца Негри;
— вызывать паралитическую форму бешенства без явлений возбуждения;
— высокую тропность к ЦНС и низкую тропность к внутренним органам.
4.3.1. Лаборатории, работающие с производственными штаммами фиксированного вируса бешенства, должны располагаться в отдельно стоящем здании или изолированной части здания с отдельным входом.
4.3.2. Лаборатория должна быть обеспечена водопроводом, канализацией, электричеством, отоплением и вентиляцией. Все помещения лаборатории должны иметь естественное и искусственное освещение в зависимости от вида работ в соответствии с требованиями действующих нормативных документов.
4.3.3. Помещения лаборатории должны быть разделены на «заразную» и «чистую» зоны. Планировочные решения и размещение оборудования должны обеспечивать поточность продвижения производственных штаммов фиксированного вируса бешенства и выполнение требований настоящей инструкции.
4.3.4. Лаборатория должна иметь набор рабочих комнат и других помещений, включая душевую комнату, в соответствии с производственной мощностью и номенклатурой выполняемых технологических операций.
4.3.5. Внутренняя отделка помещений должна быть выполнена в соответствии с функциональным назначением. Поверхность пола, стен, потолка в лабораторных помещениях «заразной» зоны должна быть гладкой, без щелей, легко обрабатываемой, устойчивой к действию моющих и дезинфицирующих средств, полы не должны быть скользкими.
4.3.6. Окна и двери помещений «заразной» зоны лаборатории должны быть герметичными.
4.3.7. Имеющаяся вытяжная вентиляция из «заразной» зоны лаборатории должна быть изолирована от других вентиляционных систем и оборудована фильтрами тонкой очистки воздуха. При использовании боксов биологической безопасности II класса, снабженных системой вытяжной вентиляции с фильтрами тонкой очистки типа «Лайк», система вытяжной вентиляции может быть использована без установки фильтров.
4.3.8. Разрешается установка кондиционеров в рабочих комнатах и боксах. Во время работы с производственными штаммами фиксированного вируса бешенства кондиционеры должны быть отключены.
4.3.9. Лабораторная мебель в «заразной» зоне должна иметь покрытие, устойчивое к действию моющих и дезинфицирующих средств. Поверхность столов не должна иметь швов и трещин.
4.3.10. Ширина проходов к рабочим местам или между двумя рядами выступающего оборудования должна быть не менее 1,5 м (с учетом выступающих конструкций).
4.3.11. Помещения, где проводится работа с производственными штаммами фиксированного вируса бешенства, должны быть оборудованы бактерицидными лампами в соответствии с «Методическими указаниями по применению бактерицидных ламп для обеззараживания воздуха и поверхностей в помещениях». Лампы включают после проведения влажной уборки. Вход в помещение разрешается только после проветривания не менее 30 мин. (при применении безозоновых бактерицидных ламп проветривания не требуется). Необходимо вести учет времени работы каждой лампы с отметкой в журнале.
4.3.12. При ориентации окон на юг необходимо предусмотреть защиту рабочих столов от попадания прямого солнечного света путем использования светозащитных пленок, жалюзи из материала, устойчивого к дезинфектантам.
4.3.13. Помещения лабораторий должны быть непроницаемы для грызунов и насекомых.
4.3.14. Лаборатория должна быть обеспечена средствами пожаротушения.
4.4.1. Работу с производственными штаммами фиксированного вируса бешенства выполняют специалисты с высшим и средним специальным образованием, прошедшие специальную подготовку.
4.4.2. Персонал допускается к работе с производственными штаммами фиксированного вируса бешенства после проведения инструктажа по соблюдению требований биологической безопасности. Последующие инструктажи проводят не реже 1 раза в год, с записями в соответствующих журналах.
4.4.3. Приборы, оборудование и средства измерений, используемые в работе лаборатории, должны быть аттестованы, технически исправны, подвергаться метрологическому контролю в установленные сроки, иметь технический паспорт. На каждый прибор (установку) должны быть разработаны правила (инструкция) по их эксплуатации с учетом требований биологической безопасности.
4.4.4. В лаборатории должны использоваться дезинфицирующие средства, допущенные к применению (3%-ный хлорамин). Срок хранения готового раствора не должен превышать 15 суток.
4.4.5. В помещениях «заразной» зоны лаборатории проводятся:
— работа с животными (заражение, вскрытие);
— содержание инфицированных животных;
— дезинтеграция, гомогенизация мозговых тканей и другие операции с вероятным образованием аэрозоля;
— заражение культуры клеток;
— приготовление взвесей и суспензий;
— работа с лиофилизированными производственными штаммами фиксированного вируса бешенства.
4.4.6. Во время работы двери рабочих комнат должны быть закрыты. Перед работой включается вентиляция «на отток». Выход из рабочей комнаты во время проведения работы запрещается.
4.4.7. Заражение животных осуществляется не менее чем двумя сотрудниками.
4.4.8. При пипетировании необходимо пользоваться резиновыми грушами или автоматическими устройствами.
4.4.9. Перед использованием посуда, пипетки, оборудование, шприцы и т.д. должны быть проверены на целостность и исправность.
4.4.10. Ампулы с лиофилизированными производственными штаммами фиксированного вируса бешенства вскрывают стерильно над подносом или лотком с марлевой салфеткой, пропитанной дезинфицирующим раствором. Верхний конец ампулы нагревают над пламенем горелки, снимают парафин, затем кусочком стерильной ваты, смоченным в стерильной воде, осторожно прикасаются к оттянутому концу ампулы для образования трещины. Той же влажной ватой обводят вокруг носика ампулы. После образования круговой (или не полностью круговой) трещины конец ампулы накрывают марлевой салфеткой или ватой и обламывают пинцетом.
4.4.11. После вскрытия ампулы в нее добавляют 1,0 мл стерильной дистиллированной воды и осторожно встряхивают. Полученную суспензию, содержащую фиксированный вирус бешенства, используют для заражения лабораторных животных.
4.4.12. Для внутримозгового заражения кролика его надежно фиксируют на специальном станке или дают легкий наркоз (2 — 2,5 мл раствора Рометара внутримышечно за 20 — 30 мин. до заражения). Затем аккуратно выстригают шерсть в зоне предполагаемого введения, обрабатывают 70%-ным раствором этанола и 5%-ным раствором йода и с помощью стерильного шприца емкостью 2 мл и иглы размером N 20 (10 x 0,90) вводят 0,25 мл суспензии фиксированного вируса бешенства штамм. Прокол делают приблизительно на середине линии, условно соединяющей наружный угол глаза и ухо. При заражении крупных кроликов можно пользоваться шилом из нержавеющей стали или троакаром. Явные признаки паралича появляются у кроликов на 4 день после инокуляции; в редких случаях они развиваются до 7 дня. Извлечение мозга производят у животного только после развития полной картины паралича, характерного для фиксированного вируса бешенства. К числу первых симптомов экспериментального бешенства относятся: повышение температуры тела, пугливость и расширение зрачков. Затем появляются менингеальные явления, парезы, начинающиеся обычно с задних конечностей, быстро прогрессирующие параличи, захватывающие все конечности, шейную и затылочную мускулатуру.
4.4.13. Больных кроликов с картиной полного паралича, но с еще сохранившимся дыханием забивают путем тотального обескровливания. Головной мозг используется для изготовления рабического антигена. После декапитации производят снятие шкурки, отделяют позвоночник вместе со спинным мозгом, которые подвергают автоклавированию (2,0 кГс/кв. см (0,2 МПа), 132 +/- 2 °C), как заразный материал.
4.4.14. Для извлечения головного мозга животное укладывают на секционный лоток животом вниз так, чтобы голова оказалась на краю стола. С помощью пинцета, скальпеля и ножниц отделяют голову от туловища. Затем скальпируют кожу головы, удаляя уши и верхние веки. Обнаженную поверхность черепа смачивают 70%-ным спиртом и помещают в кристаллизатор. Кристаллизатор переносят в стерильный бокс для приготовления антигена. Перед вскрытием черепа его двухкратно обрабатывают 70%-ным этиловым спиртом. Затем череп кролика закрепляют в специальное приспособление (прилож. 1 — не приводится), обеспечивающее надежную фиксацию головы животного. Удерживая секционный нож в левой руке, правой рукой с помощью молотка вскрывают черепную коробку четырьмя прямоугольными разрезами. Сначала следует сделать разрез по линии, соединяющей середины глаз, затем разрез в теменной области, а затем соединить эти два разреза перпендикулярными разрубами. Затем, отложив в сторону секционный нож и молоток, с помощью пинцета и ножниц высвобождают твердую мозговую оболочку и переднюю часть мозга отделяют на уровне обонятельной доли; пересекают продолговатый мозг позади мозжечка, приподнимают мозг, пересекают перекрест зрительных нервов и затем переносят его на стерильную чашку Петри для взвешивания.
4.4.15. Для приготовления антигена головной мозг после взвешивания помещают в стерильную ступку или гомогенизатор и измельчают. К измельченному мозгу добавляют дистиллированную воду, содержащую 0,5% фенола, до получения 10%-ной мозговой суспензии. Суспензию мозга фильтруют через тройной слой марли. Стерильность мозговой суспензии проверяют посевом на сахарный бульон, мясопептонный агар и мясопептонный бульон с 0,1% агара и кусочками мяса. Посевы выдерживаются при 37 °C в течение 5 сут. Разрешается для иммунизации лошадей-продуцентов использовать стерильный антиген, сохранившийся при температуре 4 °C не более 14 сут.
4.4.16. Для приготовления исходных культур фиксированного вируса бешенства головной мозг кролика помещают в стерильную ступку или гомогенизатор и измельчают. К измельченному мозгу добавляют дистиллированную воду до получения 10% мозговой суспензии. Стерильность мозговой суспензии проверяют посевом на сахарный бульон, мясопептонный агар и мясопептонный бульон с 0,1% агара и кусочками мяса. Мозговую взвесь разливают стерильно по аликвотам объемом 4 — 5 мл и замораживают при температуре не выше минус 18 °C. Оптимальной температурой для хранения штаммов фиксированного вируса бешенства является минус 70 °C. Для заражения достают одну аликвоту из морозильника и помещают в холодильник на 4 °C на 18 — 20 ч. После оттаивания осторожно пастеровской пипеткой отбирают среднюю фазу мозговой суспензии, содержащую максимальное количество вируса.
4.4.18. Правила вскрытия мышей. Мышей забивают в состоянии выраженных терминальных симптомов бешенства хлороформом. Труп мыши фиксируют на дощечке спиной кверху. Для этого необходимо две булавки — одной прикалывают основание хвоста, другой — кончик морды. Можно пользоваться и тремя булавками, чтобы фиксировать передние лапы и хвост. После обработки спиртом кожу головы и шеи отпрепаровывают с помощью ножниц и пинцета, открывая череп. Череп зажимают в глазницах хирургическим пинцетом, изогнутыми ножницами отделяют крышку черепа, обнажая мозг. С помощью тех же изогнутых ножниц извлекают мозг и переносят в стерильную чашку Петри, которую заранее взвешивают. Производят взвешивание чашки Петри с мозговой тканью. Затем мозг переносят в стерильную ступку, где с помощью стерильного пестика приготавливают 10%-ную мозговую взвесь с добавлением дистиллированной воды. Взвесь разливают по аликвотам и хранят при температуре не ниже минус 18 °C. Оптимальной температурой для хранения штаммов фиксированного вируса бешенства является минус 70 °C.
4.4.19. По окончании работы все объекты с производственными штаммами фиксированного вируса бешенства должны быть убраны в хранилища (холодильники, термостаты, шкафы и т.д.); в обязательном порядке проводится дезинфекция рабочих поверхностей столов 3%-ным раствором хлорамина.
4.4.20. Использованные пипетки полностью (вертикально) погружаются в дезинфицирующий раствор (3%-ный хлорамин), избегая образования в каналах пузырьков воздуха. Длительность дезинфекции 60 мин.
4.4.21. Использованная посуда, твердые отходы из «заразной» зоны лаборатории должны собираться в закрывающиеся емкости и передаваться в автоклавную или дезинфицироваться на месте. Слив необеззараженных жидкостей в канализационную сеть запрещается.
4.4.22. Перенос производственных штаммов фиксированного вируса бешенства и использованной посуды для обеззараживания должен осуществляться в закрытых емкостях, исключающих инфицирование персонала во время транспортирования. После завершения работы помещение «заразной» зоны лаборатории запирается и опечатывается. Опечатывание и снятие печатей производят сотрудники лаборатории, имеющие разрешение руководителя лаборатории (подразделения).
4.4.23. Иммунизацию лошадей-продуцентов осуществляют согласно регламенту производства «Иммуноглобулина антирабического жидкого из сыворотки крови лошади».
4.4.24. Правила введения антигена. Введение антигена лошади производится в специально оборудованном помещении (операционной). Сотрудники, осуществляющие инъекцию антигена, одеты в противочумный костюм 3-типа с резиновыми перчатками. Для введения антигена используют прибор для массовых прививок ПМП-1, который соединяется посредством силиконового шланга с иглой и флаконом с антигеном. Вся инъекционная система соединяется герметично. Место введения антигена предварительно обрабатывают 70%-ным раствором спирта. Иглу вводят подкожно и под небольшим давлением медленно вводят антиген. После инъекции вентилем перекрывают подачу антигена, кожу на месте введения иглы зажимают кровоостанавливающим пинцетом на 1 мин. Пинцет снимают, место инъекции обрабатывают тампоном, смоченным 70%-ным раствором спирта, и накладывают тампон с коллодием или фурапластом с перхлорвинилом. После использования вся инъекционная система подвергается кипячению в течение 30 мин. в 2%-ном содовом растворе. В процессе гипериммунизации постоянно следят за общим состоянием и температурной реакцией продуцентов. В случае повышения температуры очередную инъекцию антигена производят после ее снижения до нормы.
4.4.25. Хранение производственных штаммов фиксированного вируса бешенства осуществляется в помещениях заразной зоны. Хранение, учет, передача, транспортирование и уничтожение производственных штаммов фиксированного вируса бешенства проводятся в соответствии с требованиями СП 1.2.036-95.
4.4.26. Прием посетителей разрешается только в специально отведенных местах в «чистой» зоне лаборатории.
4.4.27. Вынос из лаборатории оборудования, лабораторной или хозяйственной посуды, инструментов и др. производится только после их дезинфекции и с разрешения ее руководителя.
4.4.28. В «заразной» зоне лаборатории запрещается:
— оставлять после окончания работы на рабочих местах посуду с производственными штаммами фиксированного вируса бешенства «Москва» и «CVS»;
— пипетировать ртом, переливать жидкий инфекционный материал через край сосуда (пробирки, колбы, флакона);
— хранить верхнюю одежду, головные уборы, обувь, зонты, хозяйственные сумки, косметику и т.п., а также продукты питания;
— оставлять без надзора рабочее место во время выполнения любого вида работ с производственными штаммами фиксированного вируса бешенства;
— сливать жидкие отходы (инфицированные жидкости, исследуемый материал и т.д.) в канализацию без предварительного обеззараживания.
4.4.29. Допускается в одном и том же помещении проведение экспериментальных и производственных работ с производственными штаммами фиксированного вируса бешенства. Экспериментальная и производственная работа должны быть разнесены по времени. Экспериментальный материал должен храниться отдельно от производственного в специально отведенном для него холодильнике или термостате.
4.4.30. Все сотрудники, работающие с производственными штаммами фиксированного вируса бешенства, должны находиться на диспансерном наблюдении. Периодические медицинские осмотры проводятся в соответствии с действующими приказами (N 280/88 — Минздравмедпром и Госкомсанэпиднадзор России).
4.5.1. Сотрудники лаборатории должны быть обеспечены медицинскими халатами, пижамами (комбинезонами), шапочками, сменной обувью и другими средствами индивидуальной защиты в зависимости от характера выполняемых работ и в соответствии с действующими нормами.
4.5.2. Рабочая одежда и обувь должны быть индивидуальными, соответствовать размерам работающих и храниться отдельно от личной одежды.
4.5.3. При проведении исследований в боксированных помещениях производится смена медицинского халата на противочумный или хирургический, доходящий до нижней трети голени. Дополнительно используются резиновые перчатки, тапочки и, при необходимости, респираторы (маски). Операции, требующие вскрытия черепа и позвоночника, необходимо проводить в резиновых перчатках, защитных очках и в противочумных халатах. Необходимо также надевать резиновые или прочные полиэтиленовые фартуки, которые легко дезинфицировать или уничтожить.
4.5.4. Смена рабочей одежды должна проводиться по мере загрязнения, но не реже 1 раза в неделю.
4.5.5. Перед сдачей в стирку защитная одежда должна быть обеззаражена замачиванием в растворе 1%-ного хлорамина.
4.6.1. Дезинфекцию различных объектов при работе с производственными штаммами фиксированного вируса бешенства проводят в соответствии с характером объекта, подлежащего обеззараживанию.
Примечание. В случае аварии залить зараженные поверхности одним из перечисленных выше растворов на 2 ч.
Методы и средства обеззараживания определяются в каждом отдельном случае в зависимости от характера обеззараживаемого материала.
4.6.2. В лаборатории должен храниться минимум недельный запас дезинфицирующих средств.
4.6.3. Вновь поступающие на склад серии дезинфицирующих средств необходимо контролировать на содержание действующего вещества.
4.6.4. Дезинфицирующие растворы готовит лаборант или дезинфектор. На емкости с дезинфицирующим раствором должно быть указано его название, концентрация и дата приготовления.
4.6.5. Перенос материала для обеззараживания внутри подразделения производится в специальных емкостях (баках, ведрах, биксах с крышками).
4.6.6. Текущая уборка помещений проводится ежедневно влажным способом после окончания рабочего дня: в «чистой» зоне лаборатории — с применением моющих средств, в «заразной» зоне — с применением 1%-ного раствора хлорамина.
4.6.7. Уборочный инвентарь должен быть промаркирован отдельно для «чистой» и «заразной» зон. Перенос его из зоны в зону не допускается.
4.6.8. В боксовых помещениях должна проводиться еженедельная генеральная уборка с применением 1%-ного раствора хлорамина путем протирания поверхности мебели, приборов, аппаратов, а также стен (на высоту до 2 м). После влажной уборки включают бактерицидные лампы на 30 мин.
4.6.9. Стеклянные поверхности бактерицидных ламп следует протирать ветошью, смоченной 70%-ным спиртом, не реже 1 раза в неделю.
4.7.1. Содержание кроликов, зараженных производственными штаммами фиксированного вируса бешенства, можно проводить в клетках открытого типа.
4.7.2. После убоя животного клетки протираются 3%-ным раствором хлорамина.
4.7.3. В виварии осуществляется учет движения животных в специальном журнале с указанием даты заражения, наименования штамма, заражающей дозы, способа аппликации, номера животного.
4.7.4. Клетки с зараженными животными маркируются специальными карточками, на которых указывают дату заражения, наименование штамма, заражающую дозу, способ аппликации, номер животного.
5.1. При авариях с производственными штаммами фиксированного вируса бешенства работу немедленно прекращают, ставят в известность руководителя лаборатории или лицо, его заменяющее, и принимают следующие меры:
— все открытые части тела моют мылом или обрабатывают 70%-ным спиртом;
— при попадании инфекционного материала на слизистые оболочки их немедленно обрабатывают: глаза — 1%-ным раствором борной кислоты, несколькими каплями 1%-ного раствора азотно-кислого серебра или струей воды; в нос закапывают, а рот и горло прополаскивают 0,05%-ным раствором марганцовокислого калия или 1%-ным раствором борной кислоты.
5.2. При аварии, связанной с ранением или другим повреждением кожных покровов, перчатки обрабатываются дезраствором, снимаются, из ранки выдавливается кровь, руки обрабатываются 70%-ным спиртом, затем моются водой с мылом, ранка смазывается раствором йода.
5.3. При авариях с ранением или попаданием вирусосодержащей жидкости на слизистые оболочки необходимо проведение профилактической вакцинации (3-кратная вакцинация КОКАВ на 0, 7, 21 день).
5.4. Проводится обеззараживание места аварии. По окончании работ защитная одежда замачивается в дезинфицирующем растворе. Все сотрудники, находившиеся в зоне аварии, должны принять душ.
5.5. О происшедшей аварии и проведенных мероприятиях руководитель лаборатории направляет докладную записку на имя руководителя организации и председателя комиссии по контролю за соблюдением требований биологической безопасности, в которой указывает час и дату происшедшей аварии, ее характер, перечисляет сотрудников, находившихся на месте аварии, в т.ч. лиц, проводивших дезинфекционные мероприятия, а также принятые меры.
5.6. В лабораториях для ликвидации последствий аварии, а также профилактики возможного поражения персонала необходимо иметь: аптечку для оказания экстренной медицинской помощи, запас дезинфицирующих средств, СИЗ, емкости для замачивания СИЗ. В аптечке экстренной помощи должны находиться: 70%-ный этиловый спирт, раствор йода, сухие навески марганцовокислого калия, азотно-кислого серебра и борной кислоты, которые в случае аварии можно растворить в мерном объеме дистиллированной воды, стерильная дистиллированная вода, глазные пипетки, ножницы, перевязочные средства, бактерицидный пластырь. Ответственным за комплектование аптечки экстренной медицинской помощи является руководитель подразделения.
5.7. В лаборатории должен быть журнал регистрации аварий, где отмечается: дата, время, место, характер аварии, фамилия, имя и отчество лиц, находившихся непосредственно в зоне ее воздействия, а также проведенные мероприятия.
6.1. Санитарно-эпидемиологический надзор за выполнением требований настоящих Методических указаний в подразделениях, работающих с производственными штаммами фиксированного вируса бешенства, осуществляют территориальные центры Госсанэпиднадзора.
6.2. В организации, работающей с производственными штаммами фиксированного вируса бешенства, создается комиссия по контролю за соблюдением требований биологической безопасности. Деятельность комиссии определяется Положением (прилож. 7.8 СП 1.2.731-99).
6.3. Текущий контроль за выполнением требований настоящих Методических указаний осуществляется руководителем лаборатории или лицом, назначенным приказом по учреждению.
источник
Бешенство(rabies)- острая инфекция из группы зоонозов, вызываемая вирусами из семейства рабдовирусов и протекающее с тяжелым поражением нервной системы и заканчивающееся, как правило, смертельным исходом. История Еще Аристотель обращал внимание на распространение бешенства среди собак. Цельс в I в. н.э. указывал на частые заболевания собак и других животных. Он заметил и другие факты: заболевания бешенством людей, возможность передачи болезни со слюной животного в момент укуса. В 1271 году описана крупная эпизоотия бешенства среди собак и волков в Германии, в 1500 году в Бельгии и Испании. В 1590 году Отмечена эпизоотия бешенства среди волков. Изучение бешенства в 19 веке тесно связано с достижениями Пастера, Мечникова, Гамалеи. В 1885 г. Л. Пастер получил и с успехом использовал вакцину для спасения людей, укушенных бешеными животными. Вирусная природа болезни доказана в 1903 г. П. Ремленже, который произвел фильтрование заразного материала через бактериальные фильтры. XIX Таксономия Возбудитель бешенства РНК-содержащий вирус Neuroryctes rab /> Вирион бешенства в препаратах инфицированного мозга и культур ткани под электронным микроскопом имеет пулевидную форму с одним плоским и одним закругленным концом. Имеет спиральный нуклеокапсид, окруженный белково-липидной оболочкой с поверхностными выступами. Диаметр вириона 75-80 нм, длина 180 нм. Геном – однонитчатая РНК с молекулярной массой 3,5-4,6 106. Вирионы содержат 5 структурных белков и РНК-зависимую полимеразу. В поперечных срезах вириона бешенства виден центральный стержень, окруженный плотной оболочкой. Для морфогенеза вируса бешенства характерно первоначальное формирование матрикса; филаментозной субстании в цитоплазме инфицированных клеток. В последующем из матрикса образуется нуклеокапсид вириона. Виды бешенства Существование вируса бешенства за счет различных животных и на различных территориях привело к тому, что он оказался неоднороден: у отдельных представителей имеются различия по вирулентности, по характеру вызываемого инфекционного процесса и патологоанатомических изменений. В антигенном отношении популяция вируса более или менее однотипна, хотя некоторые различия у разных вирусов теперь обнаружены. В частности, оказалось, что пастеровский вакцинный фиксированный штамм (PV-11) по антигенной структуре полноценнее, универсальнее многих выделяемых сейчас от человека и животных. Различают следующие варианты вируса бешенства: Типичный (уличный) вирус бешенства, в популяции которого обнаружены в свою очередь определенные различия. В частности, лисьи штаммы отличаются по патогенности. Патологоанатомические изменения в мозгу при бешенстве, которое вызывается укусом лисицы, отличаются тем, что тельца Бабеша—Негри встречаются существенно реже, изменения в ЦНС носят более диффузный характер в виде очень мелких бесструктурных плазматических включений. Вирус африканского собачьего бешенства. Этот вирус слабопатогенен для лабораторных животных. Заболевания людей, вызванные этим вирусом, или не встречаются вовсе, или они чрезвычайно редки. Вирус дикования — болезни собак и песцов в северных тундровых районах. Человек болеет очень редко — описано заболевание одной девочки на Аляске. Имеются наблюдения о развитии в результате лабораторного заражения медленной нейроинфекции, закончившейся смертью. Вирус американского бешенства летучих мышей — наиболее существенно отличающийся от основного вируса типичного бешенства. Среди вирусов, выделяемых от летучих мышей, встречается несколько разновидностей. По современным представлениям все названные вирусы относятся к одному виду — вирусу Neuroryetes. Известен еще один вариант вируса бешенства — фиксированный, полученный Пастером при адаптации уличного вируса в организме кролика в измененных условиях заражения. Вирус бешенства патогенен для человека и всех видов теплокровных животных, а также птиц, но степень восприимчивости к вирусу бешенства у разных видов животных различна. Согласно экспериментальным данным наибольшей чувствительностью к вирусу бешенства обладают лисицы, среди лабораторных животных – сирийский хомяк.Фиксированный вирус не выделяется со слюной и не может быть передан во время укуса. Механизм вирусной персистенции в клеточных культурах связывается с образованием и накоплением Ди-частиц. Проникновение вируса в клетки происходит путем адсорбционного эндоцитоза — вирионы выявляются в виде включений, окруженных мембраной, адсорбированных на микротрубочках и в составе лизосом. Нейрон, инфицированный вирусом бешенства. Видны вирусы в цитоплазме нейрона Штаммы вируса бешенства циркулирующие в различных географических зонах мира, обладают рядом общих биологических и антигенных характеристик (вариабельность инкубационного периода, поражения пи переферическом введении ЦНС, выделением вируса со слюной, тождественной антигенной структурой.) Наряду с этим установлено существование естественных биовариантов вируса бешенства. Биоварианты вируса бешенства различаются по степени патогенности при внемозговом заражении, распределению в органах зараженных животных, способности формировать включения. Вирусы подобные возбудителю бешенства, имеют частичное антигенное с ним родство, а также сходный тип репродукции, но отличаются по комплексу биологических характеристик. Химический состав Очистка и концентрация культурального вируса позволили изучить химическую структуру и биологическую активность субвирусных компонентов. В состав вириона бешенства входят: РНК(1%), белки(72%), липиды(24%), углеводы(1%). Белки вириона бешенства представлены 4 высокомолекулярными и 1 низкомолекулярным полипептидами. Нуклеокапсид вириона содержит 96% белка, представляет собой однонитчатую правовращающуюся спираль РНК длиной 1 мкм и наружным диаметром 15-16 нм, окруженную оболочкой. Состоящей из гликопротеина и глюколипидов. Нуклеокапсид вириона бешенства обладает константой седиминтации 200S, плавучей плотностью 1,32 г/см 3 , молекулярным весом 1,5 Ч 10 8 дальтонов и константу седиментации 45S. Свойства Вирус бешенства обладает антигенным, имунногенными и гемагглютинирующим свойствами, однако биологическая и антигенная активность различных субвирусных структур неодинакова. Белки оболочки обладают выраженной иммуногенной активностью, в то время как белки «ядра» вириона мало иммуногены. Гликопротеин оболочки вириона обладает гемагглютинирующей активностью. Очищенная вирусная РНК, нуклеокапсид и вирусные компоненты «ядра» вириона не инфекциозны, что может быть связано с отсутствием в их составе гликопротеина оболочки, необходимого для адсорбции вируса на поверхности клетки. В составе вириона бешенства обнаружены собственные ферментные системы: протеинкиназа, ДНК-полимераза. Синтез вириона происходит как в веществе матрикса, так и в окружающих его интрацитоплазматических мембранах. В цитоплазме нейронов зрелые вирионы освобождаются путем почкования от поверхности филаментозного матрикса. В культуре клеток зрелые вирионы отпочковываются от клеточной поверхности. Размножение вируса вызывает в аммоновом роге головного мозга и среднем мозге поражение сосудов с образованием в цитоплазме нейронов специфических включений – телец Бабеша-Негри. Выделяется со слюной. Размножение вируса бешенства in vivo и in vitro, сопровождается фрмированием специфических включений – телец Бабеша-Негри. Тельца Бабеша-Негри размером 0,5-25 мкм расположены в цитоплазме нейронов, имеют округлую, овальную, реже веретенообразную форму, базофильную внутреннюю структуру, окрашивающуюся кислыми красителями в рубиновый цвет. При цитохимическом исследовании телец установлено, что они содержат РНК. Электронномикроскопическое исследование телец выявило, что их эозинофильная основа соответствует специфическому филаментозному матриксу инфицированных клеток, а внутренние базофильные структуры состоят из вирусных нуклеокапсидов, связанных с компонентами клеток. Степень формирования телец Бабеша-Негри при заражении различных штаммов вируса бешенства определяется численностью локальных очагов вирусного синтеза в цитоплазме инфицированных клеток . Резистентность Устойчивость вируса бешенства невелика. Некоторые детергенты вызывают распад вирионов. Вирус устойчив к фенолу, антибиотикам. Разрушается кислотами, щелочами, нагреванием (при 56°С инактивируется в течение 15 мин, при кипячении — за 2 мин. Чувствителен к ультрафиолетовым и прямым солнечным лучам, к этанолу к высушиванию. Быстро инактивируется сулемой (1:1000), лизолом (1-2%), карболовой кислотой (3-5%), хлорамином (2-3%). Вирус хорошо сохраняется лишь при низкой температуре и после вакуумного высушивания и в замороженном состоянии. Эпидемиология Бешенство типичный зооноз, от человека к человеку вирус передается крайне редко. Источником заражения являются инфицированные животные (лисы, волки, собаки, кошки, летучие мыши, грызуны, лошади, мелкий и крупный рогатый скот). Заражение человека происходит при укусе или ослюнении животным поврежденной кожи или слизистой оболочки. Вирус выделяется во внешнюю среду со слюной инфицированного животного или человека. Описаны случаи заболевания людей в результате укусов внешне здоровым животным, продолжающим оставаться таковым в течение длительного времени. В последние годы доказано, что помимо контактного возможны аэрогенный, алиментарный и трансплацентарный пути передачи вируса. Не исключается передача вируса от человека к человеку. Описаны несколько случаев заражения людей в результате операции по пересадке роговой оболочки глаза.Различают эпизоотии бешенства природного и городского типов. Естественными являются природные эпизоотии бешенства, поддерживаемые дикими плотоядными животными из семейства собачьих, кошачьих и рукокрылых. В городских очагах источником бешенства являются домашние животные. Заразными считаются животные за 3-10 дней до появления признаков болезни и далее в течение всего периода заболевания. Часто больных бешенством животных можно отличить по обильному слюно-и слезотечению, а также при наблюдении признаков водобоязни. Заражение человека происходит при укусе «бешеным» животным Анализ заболевания показывает, что 53,5% заболевших бешенством в нашей стране вовремя не обратились за медпомощью и не получили антирабические прививки. Локализация укуса имеет решающее значение в частоте заболеваемости. Среди заболевших 67% были укушены в верхние конечности, 12% в нижние, 1,9% в туловище. В настоящее время вызывает опасения серьезный рост заболеваемости бешенством среди животных и людей. возрастает количество безнадзорных собак и кошек и неудовлетворительно осуществляется их отлов и изоляция. До сих пор не приняты правовые акты, регламентирующие правила содержания домашних животных. Только за 2009 число тех, кто пострадал от животных с диагнозом бешенство, составило более шести тысяч человек. Патологическая анатомия У людей погибших от бешенства, выявляется отек и набухание головного и спинного мозга с выраженной гиперемией, сопровождающейся петихиальными кровоизливаниями. Однако воспалительные процессы в тканях мозга часто являются ограниченными. Микроскопически воспалительный процесс обнаруживают в тройничных нервах, гассеровых узлах, межпозвоночных и верхних шейных симпатических ганглиях и в сером веществе головного мозга. В периферических нервах отмечают лимфоидные и моноцитарные инфильтраты, локализующиеся около расширенных сосудов. Вокруг гибнущих или распавшихся ганглиозных клеток возникает гиперплазия олигодендроглиальных элементов, в результате чего образуются так называемые узелки бешенства. Они, однако, не являются специфичными для бешенства, так как для бешенства так как встречаются и при других заболеваниях(энцефалит) Характерными для бешенства считают появление цитоплазматических включений-телец Бабеша-Негри, которые чаще всего обнаруживаются в клетках гипокампа и в грушевидных нейроцитах мозжечка. Во внутренних органах особых изменений не возникает. Слюнные железы иногда увеличиваются. В них обнаруживаются периваскулярные инфильтраты. Отмечается полнокровие и некоторая раздутость легких. Селезенка не увеличена. Патогенез Вирус бешенства попадает в организм человека при укусе либо ослюнении бешеным животным через рану или микроповреждения кожи, реже слизистой оболочки. Далее вирус бешенства распространяется по нервным стволам центростремительно, достигает центральной нервной системы, а затем опять-таки по ходу нервных стволов центробежно направляется на периферию, поражая практически всю нервную систему. Таким же периневральным путем вирус попадает в слюнные железы, выделяясь со слюной больного. Нейрогенное распространение вируса доказывается опытами с перевязкой нервных стволов, которая предупреждает развитие болезни. Тем же методом доказывается центробежное распространение вируса во второй фазе болезни. Скорость распространения вируса по нервным стволам составляет около 3 мм/ч. Одна из гипотез объясняет распространение вируса бешенства по аксоплазме периферических нервов к ЦНС влиянием электромагнитного поля организма на отрицательно заряженные вирионы [Аnnаl N., 1984]. В опытах на мышах удается достичь лечебного эффекта, подвергая животных воздействию электрического поля, создающегося путем фиксации отрицательного электрода на голове, а положительного — на лапке. При обратном расположении электродов наблюдается стимуляция инфекции. Нельзя отрицать также роль гематогенного и лимфогенного пути распространения вируса в организме. Интересно, что последовательность аминокислот гликопротеида вируса бешенства аналогична с нейротоксином змеиного яда, избирательно связывающимся с ацетилхолиновыми рецепторами. Возможно, этим обусловливается нейтротропность вируса бешенства, а связыванием его со специфическими нейротрансмиттерными рецепторами или другими молекулами нейронов объясняется развитие аутоиммунных реакций и селективное поражение некоторых групп нейронов. Размножаясь в нервной ткани (головной и спинной мозг, симпатические ганглии, нервные узлы надпочечников и слюнных желез), вирус вызывает в ней характерные изменения (отек, кровоизлияния, дегенеративные и некротические изменения нервных клеток). Разрушение нейронов наблюдается в коре большого мозга и мозжечка, в зрительном бугре, подбугорной области, в черном веществе, ядрах черепных нервов, в среднем мозге, базальных ганглиях и в мосту мозга. Однако максимальные изменения имеются в продолговатом мозге, особенно в области дна IV желудочка. Вокруг участков пораженных клеток появляются лимфоцитарные инфильтраты (рабические узелки). В цитоплазме клеток пораженного мозга (чаще в нейронах аммонова рога) образуются оксифильные включения (тельца Бабеша-Негри), представляющие собой места продукции и накопления вирионов бешенства. Клиническая картина Инкубационный период (период от укуса до начала заболевания) в среднем составляет 30-50 дней, хотя может длится 10-90 дней, в редких случаях — более 1 года. Причем чем дальше место укуса от головы, тем больше инкубационный период. Во время инкубационного периода самочувствие у укушенных не страдает. Особую опасность представляют собой укусы в голову и руки. Дольше всего длится инкубационный период при укусе ноги. Выделяют 3 стадии болезни: I — начальную, II — возбуждения, III — паралитическую. Первая стадия начинается с общего недомогания, головной боли, небольшого повышения температуры тела, мышечных болей, сухости во рту, снижения аппетита, болей в горле, сухого кашля, может быть тошнота и рвота. В месте укуса появляются неприятные ощущения — жжение, покраснение, тянущие боли, зуд, повышенная чувствительность. Больной подавлен, замкнут, отказывается от еды, у него возникает необъяснимый страх, тоска, тревога, депрессия, реже — повышенная раздражительность. Характерны также бессонница, кошмары, обонятельные и зрительные галлюцинации. Через 1-3 дня у больного бешенством наступает вторая стадия — возбуждения. Появляется беспокойство, тревога, и, самое характерное для этой стадии, приступы водобоязни. При попытке питья, а вскоре даже при виде и звуке льющейся воды, появляется чувство ужаса и спазмы мышц глотки и гортани. Дыхание становиться шумным, сопровождается болью и судорогами. На этой стадии заболевания человек становится раздражительным, возбудимым, очень агрессивным, «бешеным». Во время приступов больные кричат и мечутся, могут ломать мебель, проявляя нечеловеческую силу, кидаться на людей. Отмечается повышенное пото— и слюноотделение, больному сложно проглотить слюну и он постоянно ее сплевывает. Этот период обычно длится 2-3 дня. Далее наступает третья стадия заболевания, для начала которой характерно успокоение — исчезает страх, приступы водобоязни, возникает надежда на выздоровление. После этого повышается температура тела свыше 40-42°С, наступает паралич конечностей, нарушения сознания, судороги. Смерть наступает от паралича дыхания или остановки сердца. Таким образом, продолжительность заболевания редко превышает неделю. Иногда заболевание без предвестников сразу начинается со стадии возбуждения или появления параличей. У детей бешенство характеризуется более коротким инкубационным периодом. Приступы гидрофобии и резкого возбуждения могут отсутствовать. Заболевание проявляется депрессией, сонливостью, развитием параличей и коллапса. Смерть может наступить через сутки после начала болезни. В качестве вариантов течения выделяют бульбарные, паралитические (типа Ландри), менингоэнцефалитические и мозжечковые формы болезни. 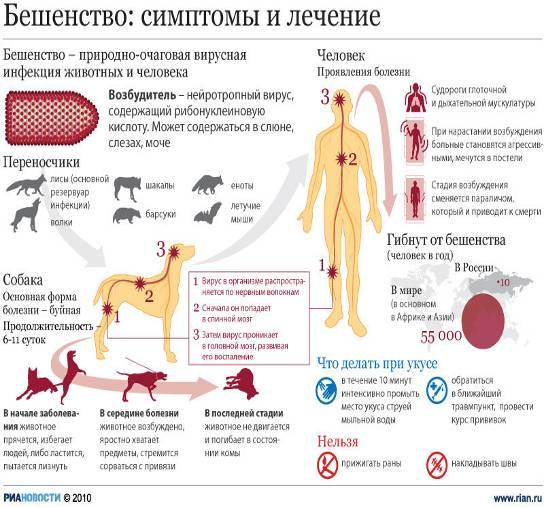
Предупреждение бродяжничества собак и кошек, профилактическая иммунизация домашних животных, тщательная первичная обработка укушенных ран. Для успешной борьбы с бешенством диких животных необходимо «изъятие» восприимчивых животных из популяции. Это можно осуществить путем контроля популяции животных и путем оральной иммунизации Людям, укушенным бешеными или неизвестными животными, местную обработку раны необходимо проводить немедленно или как можно раньше после укуса или повреждения; рану обильно промывают водой с мылом (или детергентом) и обрабатывают 40-70 градусным спиртом или настойкой йода, при наличии показаний вводят антирабический иммуноглобулин вглубь раны и в мягкие ткани вокруг неё.
1. Сухие антирабические вакцины типа Ферми и КАВ применяют для активной иммунизации по условным и безусловным показаниям. Показания к проведению прививок, доза вакцины и длительность курса иммунизации определяются врачами, получившими специальную подготовку. 2. Антирабический иммуноглобулин из сыворотки лошади применяют с целью создания немедленного пассивного иммунитета. Вакцины, используемые в настоящее время, как правило, вводятся 6 раз: инъекции делаются в день обращения к врачу (0 день), а затем на 3, 7, 14, 30 и 90 дни. Если за укусившим животным удалось установить наблюдение, и в течение 10 суток после укуса оно осталось здоровым, то дальнейшие инъекции прекращают. Во время вакцинации и в течение 6 месяцев после последней прививки запрещено употребление алкоголя. В период вакцинации также необходимо ограничить употребление в пищу продуктов, способных вызвать у пациента аллергическую реакцию.
Для продолжения скачивания необходимо пройти капчу:
Сервис бесплатной оценки стоимости работы
- Заполните заявку. Специалисты рассчитают стоимость вашей работы
- Расчет стоимости придет на почту и по СМС
Прямо сейчас на почту придет автоматическое письмо-подтверждение с информацией о заявке.
источник