Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Спинальный субдуральный и эпидуральный абсцесс — это скопление гноя в субдуральном или эпидуральном пространстве, которое вызывает механическую компрессию спинного мозга.
Спинальный субдуральныи и эпидуральный абсцесс обычно возникает в грудном и поясничном регионах. Обычно можно выявить очаг инфицирования. Он может быть на отдалении (например, эндокардит, фурункул, дентальный абсцесс) или рядом (например, остеомиелит позвоночника, пролежни, ретроперитонеальный абсцесс). Может возникнуть спонтанно, распространяется гематогенно, часто является следствием инфекции мочевыводящего тракта, которая распространяется в эпидуральное пространство через сплетение Батсона. Чаше всего эпидуральный абснесс возникает после инструментального воздействия на спинной мозг, включая хирургические операции и эпидуральные невральные блокады. В литературе указывают на то, что введение стероидов в эпидуральное пространство приводит к иммуносупрессии и увеличению случаев эпидуральных абсцессов. Несмотря на теоретическую вероятность, статистические данные (учитывая, что тысячи эпидуральных инъекций проводятся в США ежедневно) оставляют это мнением под вопросом. Примерно в 1/3 случаев, причина не может быть установлена. Наиболее часто спинальный субдуральный и эпидуральный абсцесс вызывается золотистым стафилококком, за ним следуют кишечная палочка и смешанная анаэробная флора. Редко причиной может быть туберкулезный абсцесс грудного отдела (болезнь Потта). Может возникнуть в любом участке позвоночника и черепа.
Симптомы начинаются с локальной или радикулярной боли в спине, болезненности при перкуссии, которые постепенно ставятся более выраженными Обычно присутствует лихорадка Может развиваться компрессия спинного мозга, корешков конского хвоста, вызывающая парез нижних конечностей (синдром конского хвоста). Неврологический дефицит может прогрессировать в течение часов и дней. Субфебрильная температура и общие симптомы, включающие недомогание и отсутствие аппетита, прогрессируют до выраженного сепсиса с лихорадкой на высоких цифрах, ригидности и озноба. В этот момент у пациента появляется моторный, сенсорный дефицит, симптомы поражения мочевого пузыря и кишечника как результат сдавления нервов. По мере распространения абсцесса происходит нарушение кровоснабжения пораженного участка спинного мозга, что приводит к ишемии и при отсутствии лечения — к инфаркту и необратимому неврологическому дефициту.
Диагноз клинически подтверждается болью в спине, усиливающейся в лежачем положении, парезом ног, дисфункцией прямой кишки и мочевого пузыря, особенно при сочетании с лихорадкой и инфекцией. Диагностируется посредством МРТ. Необходимо изучение бактериальной культуры из крови и воспалительных очагов. Поясничная пункция противопоказана, так как может вызвать вклинение абсцесса с усилением компрессии спинного мозга. Рутинная рентгенография показана, но она выявляет остеомиелит только у 1/3 пациентов.
Всем пациентам с подозрением на эпидуральный абсцесс необходимо провести лабораторные анализы, включая общий анализ крови, СОЭ, биохимию крови. Также у всех пациентов с пред положительным эпидуральным абсцессом необходим забор культуры крови и мочи для немедленного начала проведения антибиотикотерапии, пока не закончено обследование. Необходимо окрашивание по Грамму и получение культуры, но не стоит задерживать лечение антибиотиками до получения этих результатов.
Обязательно быстрое начало лечения для предотвращения таких последствий как необратимые неврологические дефициты или смерть. Лечение эпидурального абсцесса имеет две цели: лечение инфекции антибиотиками и дренаж абсцесса для уменьшения сдавления невральных структур. Так как большинство случаев эпидурального абсцесса вызваны золотистым стафилококком, лечение антибиотиками, такими как ванкомицин, воздействующий на стафилококковую инфекцию, следует начать немедленно после забора культуры крови и мочи. Антибиотикотерапия может быть коррегирована с учетом полученных результатов культуры и чувствительности. Как уже упоминалось, не следует отсрочивать начало антибиотикотерапии до получения окончательного диагноза, если эпидуральный абсцесс рассматривается в качестве дифференциального диагноза.
Назначение только антибиотиков редко бывает эффективно, даже если диагноз был поставлен в начале заболевания; для эффективного выздоровления требуется дренаж абсцесса. Дренаж эпидурального абсцесса обычно проводится путем декомпрессионной ламинэктомии и эвакуации содержимого. В последнее время хирурги-рентгенологи добились успеха в дренировании эпидурального абсцесса чрезкожно, используя дренажные катетеры под контролем КТ и МРТ. Серии КТ и МРТ полезны в последующем при разрешении процесса; сканирование необходимо повторять немедленно при первых признаках ухудшения неврологического статуса больного.

источник
• следует подозревать у пациента с болью в спине, ↑ Т и болезненностью позвоночника
• основные факторы риска: диабет, в/в злоупотребление наркотиками, хроническая почечная недостаточность, алкоголизм
• может приводить к значительной миелопатии, иногда с резким ухудшением
• часто наблюдаются лихорадка, профузное потоотделение, сильный озноб
• классический вариант с кожным фурункулом встречается только в ≈15% случаев
Хотя следующие временные классификации спинального эпидурального абсцесса (СЭА) используются, но корреляция с истинной продолжительностью инфекционного процесса является неопределенной:
• острый (продолжительность , чем при остром СЭА): грануляционная ткань в эпидуральном пространстве. Может существовать в течение нескольких мес
СЭА часто наблюдается на фоне остеомиелита позвоночника (в одной серии из 40 случаев СЭА остеомиелит позвоночника наблюдался во всех случаях переднего СЭА, в 85% окутывающего СЭА и ни в одном случае заднего СЭА) и межпозвокового дисцита.
Частота: в начале 70-х гг. частота была 0,2-1,2 случая на 10.000 госпитализаций/год. Средний возраст составил 57,5±16,6 лет.
Наиболее частая локализация, указываемая в литературе, — грудной уровень (≈50%), затем поясничный (35%), затем шейный (15%). В серии из 39 пациентов в 82% случаев была задняя локализация и в 18% — передняя.
Клинические проявления
Обычно проявляется очень сильной болью в позвоночнике, болезненностью при перкуссии. Наблюдаются радикулярные симптомы, к которым затем присоединяются симптомы дистального поражения СМ, часто начинающиеся с нарушений функций мочевого пузыря или кишечника, вздутия живота, мышечной слабости, которая затем может прогрессировать до пара- или тетраплегии. Средний срок от возникновения боли до появления корешковых симптомов – 3 д; от корешковых симптомов до возникновения мышечной слабости – 4,5 д; от слабости до параплегии – 24 ч.
Часто наблюдаются лихорадка, профузное потоотделение и сильный озноб. Фурункул удается обнаружить только в 15% случаев.
Может наблюдаться энцефалопатия средней или тяжелой степени, что может привести к задержке постановки диагноза. Могут быть положительные менингеальные симптомы.
В случае послеоперационного СЭА помимо местной боли может быть min кол-во симптомов (напр., отсутствие лейкоцитоза, лихорадки и т.д.).
Патофизиология нарушений функций спинного мозга
Хотя некоторые симптомы со стороны СМ могут быть обусловлены его прямой компрессией (включая случаи с коллапсом тела позвонка), обнаруживается она далеко не всегда. Предполагается, что определенную роль могут иметь сосудистые механизмы; описаны различные варианты артериальной и венозной патологии (в одной серии аутопсийных наблюдений было показано незначительное нарушение артериального кровоснабжения, но значительная венозная компрессия и тромбозы, тромбофлебит эпидуральных вен и самого СМ, с возможным распространением на мягкую мозговую оболочку.
Подозрение на СЭА должно возникать в случаях боли в спине, лихорадки и болезненности позвоночника.
1. менингит
2. острый поперечный миелит (паралич обычно наступает быстрее, данные рентгенологического обследования в норме)
3. выпадение межпозвонкового диска
4. опухоль СМ
5. послеоперационный СЭА может выглядеть как псевдоменингоцеле
• гематогенное распространение является наиболее частым (в 26-50% случаев) или непосредственно в эпидуральное пространство или в позвонок с последующим распространением в него. Упоминаемые источники:
A. кожная инфекция (наиболее частая причина): фурункул удается обнаружить в 15% случаев
B. парентеральная инфекция, особенно при в/в злоупотреблении наркотиками
C. бактериальный эндокардит
D. мочевая инфекция
E. дыхательная инфекция (включая отит среднего уха, синуситы и пневмонию)
F. зубной и глоточный абсцессы
• прямое распространение из:
A. пролежня
B. абсцесса поясничной мышцы: большая поясничная мышца прикрепляется к поперечным отросткам, телам позвонков (ТП) и межпозвонковым дискам, начиная с нижнего края тела Т12 и до верхней части тела L5
C. при проникающей травме, включая раны брюшной полости, раны шеи
D. глоточной инфекции
E. медиастенита
F. околопочечного абсцесса в результате пиелонефрита
• после операций на позвоночнике (у 3 из 8 таких пациентов уже до операции были установлены следующие источники инфицирования: периодонт, мочеиспускательный тракт и артерио-венозная фистула)
A. открытые операции: особенно поясничная дискэктомия (частота ≈0,67%)
B. закрытые вмешательства: напр., установка эпидурального катетера для спинальной эпидуральной анестезии, ЛП и т.д.
• в анамнезе часто имеется указание на недавнюю травму спины (вплоть до 30%)
• в некоторых сериях источник инфицирования не удалось установить вплоть до 50% случаев
В серии из 40 больных в 65% случаев имелись сопутствующие хронические заболевания, которые сопровождались нарушениями иммунитета. Среди них: сахарный диабет – 32%, в/в злоупотребление наркотиками – 18%, ХПН – 12%, алкоголизм – 10%, рак, повторные мочевые инфекции, болезнь Потта, положительная реакция на ВИЧ – у 1-2 больных.
Наиболее надежным способом определения возбудителей являются посевы, взятые во время операции. Эти посевы могут быть отрицательными (вероятно чаще в тех случаях, когда пациенты до операции получали АБ), но в этих случаях положительными могут быть посевы крови. Негативные результаты могут наблюдаться в 29-50% случаев.
1. золотистый стафилококк: наиболее частый возбудитель (высевается в >50% случаев), вероятно в результате того, что он чаще вызывает образование абсцессов, его распространенности, способности заражать как здоровых людей, так и лиц с нарушениями иммунитета (эти факты позволяют объяснить, почему во многих случаях СЭА возникает в результате первичного кожного очага)
2. аэробный и анаэробные стрептококки: второй наиболее частый вид возбудителя
8. хронические инфекции:
A. наиболее частой является ТБ. Хотя он стал менее распространенным в США, все равно на его долю приходится 25% случаев СЭА; обычно он сочетается с остеомиелитом позвоночника (болезнь Потта)
B. грибковая: криптококкоз, аспергиллез, бруцеллез
C. паразитарная: эхинококкоз
9. множественные возбудители в ≈10% случаев
10. анаэробы высеваются в ≈8% случаев
Развернутый анализ крови: при остром СЭА часто наблюдается лейкоцитоз (в среднем кол-во лейкоцитов =16.700/мм3), при хроническом кол-во лейкоцитов часто нормальное (в среднем =9.800/мм3).
СОЭ: в большинстве случаев повышена, обычно >30.
ЛП: производится с осторожностью в подозрительных случаях на уровне, отдаленном от клинически подозреваемого (для проведения миелографии может потребоваться пункция промежутка С1-2) с постоянной аспирацией для обнаружения гноя по мере продвижения к дуральному мешку (опасность распространения инфекции в САП). При обнаружении гноя следует сразу же остановиться, послать жидкость на посев и прекратить процедуру. Кол-во белка и лейкоцитов в ЦСЖ обычно повышены, кол-во глюкозы нормальное (показатель параменингеальной инфекции). В 5 из 19 случаев был получен рост тех же организмом, что и в абсцессе.
Посев крови: в некоторых случаях может быть полезен для определения возбудителя.
Анализы анэргии: (напр., при паротите или кандидамикозе) для оценки состояния иммунной системы
Краниограммы: обычно нормальные, за исключением случаев остеомиелита прилежащих ТП (чаще при инфекционных процессах, локализующихся впереди ТМО); проверьте есть ли литические очаги, деминерализация, фестончатость костных пластинок (для появления этих изменений может потребоваться 4-6 нед).
МРТ: метод выбора. Исключает необходимость ЛП, чувствительность соответствует чувствительности КТ-миелографии, позволяет дифференцировать другие состояния (особенно поперечный миелит и инфаркт СМ) лучше, чем КТ-миелография. Типичные признаки: в режиме Т1 → гипо- или изотензивное эпидуральное объемное образование; остеомиелит позвоночника проявляется в виде понижения сигнала в кости; в режиме Т2 → эпидуральное объемное образование высокой интенсивности, которое часто накапливает КВ (гадолиниум). Могут наблюдаться 3 типа КУ: 1)плотное, гомогенное, 2)негомогенное с разбросанными областями, не накапливающими КВ, 3)тонкий ободок периферического КУ. В острой фазе, когда абсцесс состоит из одного гноя с небольшим кол-вом грануляционной ткани, КУ может быть min. Остеомиелит позвоночника дает повышение сигнала в кости, сопутствующий дисцит вызывает ↑ сигнала в диске и исчезновение внутриядерного расщепления. При бесконтрасной МРТ в некоторых случаях можно не обнаружить СЭА, использование гадолиниума несколько повышает чувствительность исследования.
Миелография: обычно выявляются признаки экстрадуральной компрессии (напр., «вид кисточки» в случае полного блока). В случае полного блока для определения его верхнего уровня требуется С1-2 пункция (если только на КТ после миелографии не будет видно КВ выше очага поражения). См. предосторожности, касающиеся проведения ЛП.
КТ: есть описание обнаружения газа внутри позвоночного канала на обычных КТ. КТ может быть особенно информативна после миелографии.
В тех случаях, когда неврологические нарушения отсутствуют до появления деформации позвоночника возможно проведение иммобилизации (при инфекции в шейном отделе с помощью головного обруча и грудного корсета, для остальных отделов с помошью грудного-поясничного-крестцового корсета) и АБ. Некоторые авторы рекомендуют оперативную эвакуацию очага в сочетании с АБ в качестве метода выбора на основании сообщений о том, что в случаях только АБ лечения (даже соответствующими имеющейся у больного флоре АБ) возможно развитие быстрого и необратимого ухудшения у пациентов, не имевших неврологического дефицита. Рекомендуется применять консервативное лечение у следующих больных:
1. с повышенными факторами риска для хирургического лечения
2. при большой продолжительности зоны поражения спинномозгового канала
3. полным параличом >3 д
4. при отсутствии выраженного неврологического дефицита (NB: это положение спорно)
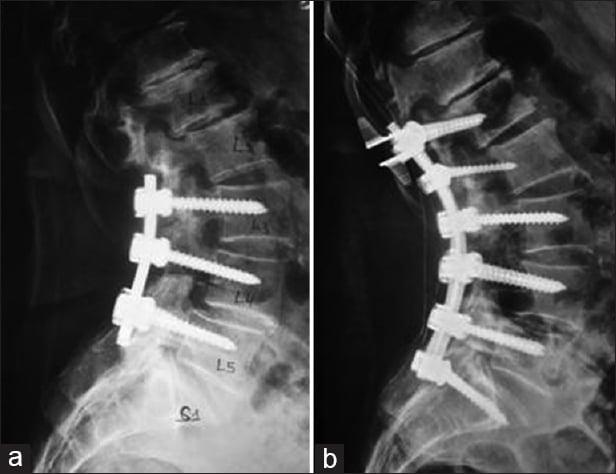
Целями являются установление диагноза и возбудителя, удаление гноя и грануляционной ткани, при необходимости костная стабилизация. В большинстве случаев СЭА располагается кзади от дурального мешка, поэтому для доступа к нему требуется обширная ламинэктомия. В случае заднего расположения СЭА и при отсутствии признаков остеомиелита позвоночника после проведения простой ламинэктомии и АБ терапии нестабильности обычно не наступает. Рану закрывают ограниченными проволочными швами. В тех случаях, когда имелась только грануляционная ткань и не было гноя, оставление дренажа не требуется. При повторной инфекции может потребоваться реоперация и установка приточно-отточной промывной системы.
У пациентов с остеомиелитом позвоночника после проведения ламинэктомии может развиться нестабильность позвоночника, особенно если имеется существенная деструкция кости. Поэтому при передних СЭА, который обычно наблюдается на фоне остеомиелита (болезнь Потта), всегда, когда это возможно, показан задне-боковой внеполостной доступ (у ослабленных больных следует избегать трансабдоминального или трансторакального доступов) с удалением нежизнеспособной кости с последующей задней инструментальной фиксацией. В случае болезни Потта в качестве распорки можно использовать трансплантат, взятый у пациента (ребро или мальберцовая кость), с небольшим риском его инфицирования.
Если возбудитель и источник СЭА неизвестны, то наиболее вероятен золотистый стафилококк. Эмпирические АБ:
1. цефалоспорин-3, напр., цефотаксим (Claforan®)
И
2. ванкомицин: пока не будет исключен МУЗС. После его исключения можно перейти на синтетический пенициллин (напр., нафциллин или оксациллин)
И
3. рифамипин РО
АБ меняют в зависимости от результатов посевов или обнаружения источника [напр., у лиц, злоупотребляющих в/в наркотиками, чаще встречаются Грам(-) организмы].
При СЭА после 3-4 нед лечения в/в АБ обычно достаточно 4 нед курса РО АБ. При сопутствующем остеомиелите позвоночника в/в курс должен составлять 6-8 нед (хотя некоторые авторы отмечают, что гистологически остеомиелит имеется практически во всех случаях, даже если его не удается обнаружить рентгенологически; поэтому лечение в обеих группах должно быть одинаковым). Повторные анализы СОЭ также могут влиять на продолжительность лечения (при отсутствии снижения СОЭ следует предполагать повторную инфекцию). Во время лечения АБ требуется иммобилизация в течение по крайней мере 6 нед.
Летальные исходы наблюдаются в 18-23% случаев (возможно чаще у пожилых больных и с парализацией до операции). Улучшение выраженного неврологического дефицита наблюдается редко, даже если операция производится в течение 6-12 ч после его возникновения. Обратное развитие парализации сакральных сегментов СМ, существующей более нескольких часов, наблюдается редко (исключение: 50% восстановление при болезни Потта). Смертность обычно обусловлена первичным очагом инфекции или осложнениями параплегии (напр., ТЭЛА).
источник
Инфекционные заболевания позвоночника могут иметь совершенно разную природу и возникать, как спонтанно образованным самостоятельным очагом, или же как осложнение уже имеющегося заболевания. К счастью, инфекции позвоночника встречаются довольно редко, особенно в развитых странах.
Тем не менее, во всех случаях это – серьезное заболевание, угрожающее здоровью и жизни больного, которое необходимо правильно лечить.
Есть определённые предпосылки, которые несут в себе риск инфицирования позвоночника и развития инфекции в его структурах.
- Имеющие избыточный вес, страдающие ожирением.
- Лица с сахарным диабетом, с другой эндокринной патологией.
- Люди с неправильным питанием, недоеданием.
- Имеющие вредные привычки – курение, наркомания, алкоголизм.
- Лица, страдающие артритом.
- Перенесшие операции или какие-либо манипуляции в области позвоночника, люмбальные пункции.
- Хирургические вмешательства вследствие других заболеваний. Особенно, если впоследствии отмечались воспаления или инфицирование хирургических ран.
- Люди, перенесшие трансплантацию органов.
- С состоянием иммунодефицита – СПИД, состояние после радиологического лечения или химиотерапии при онкологии.
- Лица, страдающие онкологическими заболеваниями.
- Перенесшие инвазивные урологические процедуры.
- Имеющие какие-либо воспалительные или инфекционные заболевания (особенно туберкулез, сифилис).
Чаще всего возбудителем инфекционных поражений позвоночника является золотистый стафилококк (Staphylococcusaureus). В последнее время специалисты отмечают рост инфекций позвоночника под воздействием грамотрицательных бактерий, из которых наиболее часто при данном заболевании выделяется синегнойная палочка (Pseudomonas).
Инфекционный процесс, возникающий в тканях позвоночника или около него, очень часто «маскируется» под другие заболевания, поэтому важность своевременной и правильной диагностики трудно переоценить.
Симптомы инфекции позвоночника могут иметь отношения к различным её видам, но всё же есть различия, которые зависят от конкретной инфекции.
-
Сильные и постоянные боли в области спины. Особенно, когда они возникают сами по себе, а не как последствие травм или ушибов области позвоночника. Однако стоит помнить, что очень часто боли при инфекции позвоночника отсутствуют или носят непродолжительный, стертый характер.
- Повышения температуры может не быть (лихорадка бывает лишь у 25% заболевших), но в некоторых случаях держится температура до 37,5 градусов без симптомов ОРВИ, простуды. При остром инфекционном процессе температура тела может повышаться до 39-40 градусов.
- Общее недомогание, вялость, сонливость, слабость.
- Иногда отмечается ригидность шейного отдела позвоночника.
- Симптомы интоксикации встречаются лишь в некоторых случаях.
- Признаки воспаления ран после операции, истечение серозного или гнойного содержимого из них.
- Покраснение отдельных участков кожи над позвоночником.
- Утрата чувствительности на отдельных участках тела, ощущение онемения, мурашек в руках и ногах.
- В запущенных случаях больной может потерять контроль над дефекацией и мочеиспусканием.
- Без лечения и при быстром прогрессировании заболевания могут возникать судороги и параличи.
Как видно из списка симптомов, признаков, с точностью указывающих именно на инфекционный процесс в позвоночнике, нет. Именно поэтому как можно раньше необходима точная диагностика, позволяющая выявить природу возникших стертых симптомов.
При воспалении и инфекционном поражении позвоночника в большинстве случаев будет повышена СОЭ. Лейкоцитоз в начале болезни отмечается только у 30% заболевших.
- Посев крови на определение возбудителя.
- Лабораторное исследование тканей, содержимого из ран, абсцессов, взятых при помощи биопсии или пункций, на предмет выявления возбудителя заболевания.
Рентгенография показывает обычно сужение промежутков между позвонками, участки повреждения костной ткани – эрозия, деструкция (которые, однако, могут не присутствовать в самом начале заболевания, а появятся гораздо позже)
При помощи МРТ можно точно диагностировать заболевание и определить область, который затронут патологическим процессом.
Этот метод используется сейчас реже, чем МРТ. Однако к нему прибегают, когда у больного отмечаются очень сильные боли в спине, и из-за них МРТ проводить проблематично.
Итак, наиболее результативными диагностическими мерами являются анализ крови на реакцию оседания эритроцитов (СОЭ) и МРТ позвоночника.
Это – инфекционно-воспалительное поражение диска между позвонками. Чаще всего диагностируется у пациентов детского возраста.
Причина дисцита в подавляющем большинстве случаев остается не выявленной, но большинство специалистов утверждают всё-таки об инфекционной природе заболевания.
- Частым спутником дисцита является боль в спине. Маленькие дети могут отказываться ходить и двигаться. На диагностических мероприятиях ребенок откажется сгибаться или наклоняться из-за сильной боли.
- Тем не менее, температура тела при дисците очень часто остается в пределах нормы, не замечается также лихорадка или признаки интоксикации.
- На рентгенограмме дисцит проявит себя расширением тканей позвоночника. В боковой проекции может быть заметна эрозия концевых пластин на смежных позвонках.
- Как правило, СОЭ в анализе крови будет увеличено.
- Компьютерная томография или МРТ позволят выявить точную локализацию поражения.
- Биопсия для выявления возбудителя заболевания выполняется, если известно, что больной употреблял наркотики внутривенно, или же если заболевание возникло после хирургических или медицинских манипуляций. В других случаях чаще всего возбудитель – золотистый стафилококк.
- Большинство специалистов сходятся во мнении, что в лечении этого заболевания необходима иммобилизация. Как правило, выполняют гипсовую иммобилизацию.
- Необходима также терапия антибиотиками.
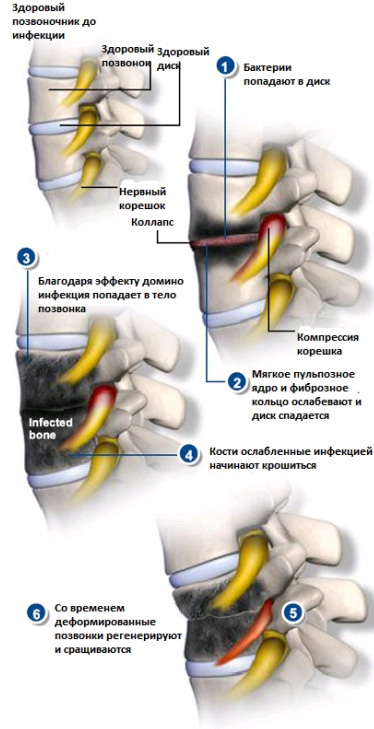
Инфекционное поражение при данном заболевании затрагивает костные ткани позвонков. Возбудителями остеомиелита позвоночника могут быть и грибки, и бактерии – в этих случаях говорят о бактериальном или пиогенном остеомиелите.
В ряде случаев остеомиелит позвоночника вторичен, когда это — последствия других инфекционных процессов в организме больного, при которых возбудитель заносится в ткани позвоночника гематогенным путем. Как правило, нарастание симптомов очень длительно по времени – от начала заболевания до его диагностирования проходит иногда от 3 до 8 месяцев.
- Остеомиелит позвоночника почти всегда сопровождается болями в спине, часто – очень сильными. Со временем боль увеличивает интенсивность и становится постоянной, не проходит даже в состоянии покоя, в положении лежа.
- Как правило, остеомиелит позвоночника проявляется повышением температуры тела.
- В анализе крови можно увидеть повышение СОЭ и лейкоцитоз.
- При прогрессировании заболевания у больного может развиться нарушение мочеиспускания.
Неврологические симптомы при остиомиелите позвоночника возникают, когда в значительной степени оказываются пораженными костные ткани позвонков, с их распадом и деструкцией.
Возбудителем остиомиелита позвоночника чаще всего является золотистый стафилококк.
Лечение остиомиелита позвоночника:
- Длительный период интенсивной терапии антибиотиками. Как правило, в течении полутора месяцев больному вводят антибиотики внутривенно, а затем в течение следующих полутора месяцев – перорально.
- При туберкулезном поражении и при некоторых других инфекциях позвоночника для лечения остеомиелита иногда требуется оперативное вмешательство.
Это – гнойный воспалительный процесс в пространстве над твердой оболочкой спинного мозга. Гнойные массы могут инкапсулироваться и сдавливать нервные корешки. Кроме этого, возникает и расплавление самих нервных структур и окружающих тканей, что приводит к необратимым последствиям, выпадению некоторых функций, напрямую угрожает здоровью и жизни больного.
В самом начале заболевания симптомы могут быть незначительные. Может появляться покалывание в месте воспаления или в конечностях по ходу нервных корешков, слабость.
Для того, чтобы заподозрить эпидуральный абсцесс, специалист должен осмотреть спину и определить, нет ли асимметрии, отека, местных выпячиваний, очаговых покраснений кожи. Специалист должен проверить также неврологический статус больного.
- У больного берут образец крови для определения СОЭ (при эпидуральном абсцессе этот показатель будет увеличен), а также для посева – на определение возбудителя.
- МРТ покажет наличие компрессии участков спинного мозга, жидкости в паравертебральном пространстве, остеомиелита и участков разрушения котных тканей, если они имеются. При эпидуральном абсцессе МРТ является самым результативным и точным методом диагностики.
- Операция по всткрытию абсцесса и удалению пораженных тканей, если у больного появился стойкий неврологический статус, а боли не купируются даже сильными обезболивающими средствами.
- Дренирование раны.
- Антибиотикотерапия.
При операциях на позвоночнике сегодня всё чаще используют жесткие металлические фиксаторы, обеспечивающие иммобилизацию позвоночного столба в послеоперационный период и более быстрое сращение поврежденных костных тканей.
Но фиксаторы – это, по сути, импланты, которые для организма чужеродны. Очень часто происходит инфицирование зон, где установлены фиксаторы, даже несмотря на антибиотикотерапию.
Инфицирование позвоночника и тяжесть протекания этого осложнения зависят от состояния человека, наличия у него других заболеваний.
Симптомами послеоперационной инфекции являются появление болей в зоне выполненной операции, выделения из хирургических ран, припухлость и покраснение тканей в месте операции, образование гематом или абсцессов.
На возникшее инфекционное поражение организм больного может ответить повышением температуры – от субфебрильной до очень высокой, слабостью, симптомами интоксикации.
- Повышенный показатель СОЭ, лейкоцитоз в анализе крови.
Лечение послеоперационного инфицирования позвоночника:
- Проводят диагностическое оперативное вмешательство для визуализации процесса, с одновременной санацией хирургической раны.
- Хирургическое дренирование раны.
- Введение антибиотиков в рану.
- Терапия антибиотиками широкого спектра действия.
Наиболее часто послеоперационное инфицирование позвоночника бывает вызвано золотистым стафилококком.
Очень часто туберкулезное инфицирование позвоночника протекает скрыто у больного туберкулезом. Заражение происходит из первичного очага в мочеполовой системе или легких.
Туберкулезное поражение позвоночника проявляется вначале незначительными, со временем усиливающимися болями в зоне воспаления. Иногда от начала инфицирования до точной постановки диагноза может пройти несколько месяцев.
Чаще всего туберкулезное инфицирование поражает грудной отдел позвоночника, затем распространяясь на пояснично-крестцовый или шейно-грудной отделы.
Клиническая картина и неврологический статус при туберкулезном инфицировании позвоночника не отличается от любого другого инфекционного поражения.
От других поражений позвоночника, вызванных инфекцией, туберкулезный спондилит отличается наличием нестабильности позвоночника и смещением позвонков, это обусловлено поражением связок и задних элементов позвонков. При запущенном заболевании у больного появляется так называемая триада Потта: абсцесс на позвоночнике, горб в грудном отделе вследствие сильного искривления позвоночного столба, потеря чувствительности, или частичный или полный паралич верхних, нижних конечностей ниже зоны поражения.
Диагностика основывается на:
- Изучении анамнеза – наличие туберкулеза у больного.
- Как правило, анализ крови при туберкулезном спондилите не показателен – обычно СОЭ не более 30.
- Рентгенография поможет визуализировать очаги воспаления на передних углах тел соседних позвонков, скопление жидкости в паравертебральном пространстве с отслойкой передней продольной связки, изменения в тканях дужек позвонков, мягких тканях вокруг позвоночного столба.
- МРТ или КТ поможет выявить точную локализацию очага воспаления или абсцесс.
- Прежде всего, против возбудителя – этиотропная терапия.
- Противовоспалительная терапия, витаминотерапия.
- При абсцессах, большом натеке с компрессией спинного мозга и нервных корешков – хирургическое лечение.
Заражение происходит от употребления в пищу продуктов от зараженных животных или от контакта в ними. Инкубационный период может быть до 2 месяцев, после чего у больного возникают лихорадка, повышение температуры тела, кожные высыпания.
Заболевание поражает опорно-двигательный аппарат, в результате чего возникают множественные очаги нагноений в мышцах, суставах, связках, в том числе и в позвоночнике.
Симптомы заболевания могут начинаться появлением болей в пояснице и крестце, усиливающимися при любой нагрузке, при вставании, ходьбе, прыжках.
- Изучение анамнеза – наличие бруцеллеза у больного, подтвержденное лабораторными исследованиями.
- Для определения зоны повреждения позвоночника выполняются рентгенография, МРТ или КТ.
- Антибиотикотерапия.
- Противовоспалительная терапия, обезболивающие препараты.
- Лечебная физкультура.
- Санаторно-курортное лечение в периоде реабилитации.

источник
• следует подозревать у пациента с болью в спине, ↑ Т и болезненностью позвоночника
• основные факторы риска: диабет, в/в злоупотребление наркотиками, хроническая почечная недостаточность, алкоголизм
• может приводить к значительной миелопатии, иногда с резким ухудшением
• часто наблюдаются лихорадка, профузное потоотделение, сильный озноб
• классический вариант с кожным фурункулом встречается только в ≈15% случаев
Хотя следующие временные классификации спинального эпидурального абсцесса (СЭА) используются, но корреляция с истинной продолжительностью инфекционного процесса является неопределенной:
• острый (продолжительность , чем при остром СЭА): грануляционная ткань в эпидуральном пространстве. Может существовать в течение нескольких мес
СЭА часто наблюдается на фоне остеомиелита позвоночника (в одной серии из 40 случаев СЭА остеомиелит позвоночника наблюдался во всех случаях переднего СЭА, в 85% окутывающего СЭА и ни в одном случае заднего СЭА) и межпозвокового дисцита.
Частота: в начале 70-х гг. частота была 0,2-1,2 случая на 10.000 госпитализаций/год. Средний возраст составил 57,5±16,6 лет.
Наиболее частая локализация, указываемая в литературе, — грудной уровень (≈50%), затем поясничный (35%), затем шейный (15%). В серии из 39 пациентов в 82% случаев была задняя локализация и в 18% — передняя.
Клинические проявления
Обычно проявляется очень сильной болью в позвоночнике, болезненностью при перкуссии. Наблюдаются радикулярные симптомы, к которым затем присоединяются симптомы дистального поражения СМ, часто начинающиеся с нарушений функций мочевого пузыря или кишечника, вздутия живота, мышечной слабости, которая затем может прогрессировать до пара- или тетраплегии. Средний срок от возникновения боли до появления корешковых симптомов – 3 д; от корешковых симптомов до возникновения мышечной слабости – 4,5 д; от слабости до параплегии – 24 ч.
Часто наблюдаются лихорадка, профузное потоотделение и сильный озноб. Фурункул удается обнаружить только в 15% случаев.
Может наблюдаться энцефалопатия средней или тяжелой степени, что может привести к задержке постановки диагноза. Могут быть положительные менингеальные симптомы.
В случае послеоперационного СЭА помимо местной боли может быть min кол-во симптомов (напр., отсутствие лейкоцитоза, лихорадки и т.д.).
Патофизиология нарушений функций спинного мозга
Хотя некоторые симптомы со стороны СМ могут быть обусловлены его прямой компрессией (включая случаи с коллапсом тела позвонка), обнаруживается она далеко не всегда. Предполагается, что определенную роль могут иметь сосудистые механизмы; описаны различные варианты артериальной и венозной патологии (в одной серии аутопсийных наблюдений было показано незначительное нарушение артериального кровоснабжения, но значительная венозная компрессия и тромбозы, тромбофлебит эпидуральных вен и самого СМ, с возможным распространением на мягкую мозговую оболочку.
Подозрение на СЭА должно возникать в случаях боли в спине, лихорадки и болезненности позвоночника.
1. менингит
2. острый поперечный миелит (паралич обычно наступает быстрее, данные рентгенологического обследования в норме)
3. выпадение межпозвонкового диска
4. опухоль СМ
5. послеоперационный СЭА может выглядеть как псевдоменингоцеле
• гематогенное распространение является наиболее частым (в 26-50% случаев) или непосредственно в эпидуральное пространство или в позвонок с последующим распространением в него. Упоминаемые источники:
A. кожная инфекция (наиболее частая причина): фурункул удается обнаружить в 15% случаев
B. парентеральная инфекция, особенно при в/в злоупотреблении наркотиками
C. бактериальный эндокардит
D. мочевая инфекция
E. дыхательная инфекция (включая отит среднего уха, синуситы и пневмонию)
F. зубной и глоточный абсцессы
• прямое распространение из:
A. пролежня
B. абсцесса поясничной мышцы: большая поясничная мышца прикрепляется к поперечным отросткам, телам позвонков (ТП) и межпозвонковым дискам, начиная с нижнего края тела Т12 и до верхней части тела L5
C. при проникающей травме, включая раны брюшной полости, раны шеи
D. глоточной инфекции
E. медиастенита
F. околопочечного абсцесса в результате пиелонефрита
• после операций на позвоночнике (у 3 из 8 таких пациентов уже до операции были установлены следующие источники инфицирования: периодонт, мочеиспускательный тракт и артерио-венозная фистула)
A. открытые операции: особенно поясничная дискэктомия (частота ≈0,67%)
B. закрытые вмешательства: напр., установка эпидурального катетера для спинальной эпидуральной анестезии, ЛП и т.д.
• в анамнезе часто имеется указание на недавнюю травму спины (вплоть до 30%)
• в некоторых сериях источник инфицирования не удалось установить вплоть до 50% случаев
В серии из 40 больных в 65% случаев имелись сопутствующие хронические заболевания, которые сопровождались нарушениями иммунитета. Среди них: сахарный диабет – 32%, в/в злоупотребление наркотиками – 18%, ХПН – 12%, алкоголизм – 10%, рак, повторные мочевые инфекции, болезнь Потта, положительная реакция на ВИЧ – у 1-2 больных.
Наиболее надежным способом определения возбудителей являются посевы, взятые во время операции. Эти посевы могут быть отрицательными (вероятно чаще в тех случаях, когда пациенты до операции получали АБ), но в этих случаях положительными могут быть посевы крови. Негативные результаты могут наблюдаться в 29-50% случаев.
1. золотистый стафилококк: наиболее частый возбудитель (высевается в >50% случаев), вероятно в результате того, что он чаще вызывает образование абсцессов, его распространенности, способности заражать как здоровых людей, так и лиц с нарушениями иммунитета (эти факты позволяют объяснить, почему во многих случаях СЭА возникает в результате первичного кожного очага)
2. аэробный и анаэробные стрептококки: второй наиболее частый вид возбудителя
8. хронические инфекции:
A. наиболее частой является ТБ. Хотя он стал менее распространенным в США, все равно на его долю приходится 25% случаев СЭА; обычно он сочетается с остеомиелитом позвоночника (болезнь Потта)
B. грибковая: криптококкоз, аспергиллез, бруцеллез
C. паразитарная: эхинококкоз
9. множественные возбудители в ≈10% случаев
10. анаэробы высеваются в ≈8% случаев
Развернутый анализ крови: при остром СЭА часто наблюдается лейкоцитоз (в среднем кол-во лейкоцитов =16.700/мм3), при хроническом кол-во лейкоцитов часто нормальное (в среднем =9.800/мм3).
СОЭ: в большинстве случаев повышена, обычно >30.
ЛП: производится с осторожностью в подозрительных случаях на уровне, отдаленном от клинически подозреваемого (для проведения миелографии может потребоваться пункция промежутка С1-2) с постоянной аспирацией для обнаружения гноя по мере продвижения к дуральному мешку (опасность распространения инфекции в САП). При обнаружении гноя следует сразу же остановиться, послать жидкость на посев и прекратить процедуру. Кол-во белка и лейкоцитов в ЦСЖ обычно повышены, кол-во глюкозы нормальное (показатель параменингеальной инфекции). В 5 из 19 случаев был получен рост тех же организмом, что и в абсцессе.
Посев крови: в некоторых случаях может быть полезен для определения возбудителя.
Анализы анэргии: (напр., при паротите или кандидамикозе) для оценки состояния иммунной системы
Краниограммы: обычно нормальные, за исключением случаев остеомиелита прилежащих ТП (чаще при инфекционных процессах, локализующихся впереди ТМО); проверьте есть ли литические очаги, деминерализация, фестончатость костных пластинок (для появления этих изменений может потребоваться 4-6 нед).
МРТ: метод выбора. Исключает необходимость ЛП, чувствительность соответствует чувствительности КТ-миелографии, позволяет дифференцировать другие состояния (особенно поперечный миелит и инфаркт СМ) лучше, чем КТ-миелография. Типичные признаки: в режиме Т1 → гипо- или изотензивное эпидуральное объемное образование; остеомиелит позвоночника проявляется в виде понижения сигнала в кости; в режиме Т2 → эпидуральное объемное образование высокой интенсивности, которое часто накапливает КВ (гадолиниум). Могут наблюдаться 3 типа КУ: 1)плотное, гомогенное, 2)негомогенное с разбросанными областями, не накапливающими КВ, 3)тонкий ободок периферического КУ. В острой фазе, когда абсцесс состоит из одного гноя с небольшим кол-вом грануляционной ткани, КУ может быть min. Остеомиелит позвоночника дает повышение сигнала в кости, сопутствующий дисцит вызывает ↑ сигнала в диске и исчезновение внутриядерного расщепления. При бесконтрасной МРТ в некоторых случаях можно не обнаружить СЭА, использование гадолиниума несколько повышает чувствительность исследования.
Миелография: обычно выявляются признаки экстрадуральной компрессии (напр., «вид кисточки» в случае полного блока). В случае полного блока для определения его верхнего уровня требуется С1-2 пункция (если только на КТ после миелографии не будет видно КВ выше очага поражения). См. предосторожности, касающиеся проведения ЛП.
КТ: есть описание обнаружения газа внутри позвоночного канала на обычных КТ. КТ может быть особенно информативна после миелографии.
В тех случаях, когда неврологические нарушения отсутствуют до появления деформации позвоночника возможно проведение иммобилизации (при инфекции в шейном отделе с помощью головного обруча и грудного корсета, для остальных отделов с помошью грудного-поясничного-крестцового корсета) и АБ. Некоторые авторы рекомендуют оперативную эвакуацию очага в сочетании с АБ в качестве метода выбора на основании сообщений о том, что в случаях только АБ лечения (даже соответствующими имеющейся у больного флоре АБ) возможно развитие быстрого и необратимого ухудшения у пациентов, не имевших неврологического дефицита. Рекомендуется применять консервативное лечение у следующих больных:
1. с повышенными факторами риска для хирургического лечения
2. при большой продолжительности зоны поражения спинномозгового канала
3. полным параличом >3 д
4. при отсутствии выраженного неврологического дефицита (NB: это положение спорно)
Целями являются установление диагноза и возбудителя, удаление гноя и грануляционной ткани, при необходимости костная стабилизация. В большинстве случаев СЭА располагается кзади от дурального мешка, поэтому для доступа к нему требуется обширная ламинэктомия. В случае заднего расположения СЭА и при отсутствии признаков остеомиелита позвоночника после проведения простой ламинэктомии и АБ терапии нестабильности обычно не наступает. Рану закрывают ограниченными проволочными швами. В тех случаях, когда имелась только грануляционная ткань и не было гноя, оставление дренажа не требуется. При повторной инфекции может потребоваться реоперация и установка приточно-отточной промывной системы.
У пациентов с остеомиелитом позвоночника после проведения ламинэктомии может развиться нестабильность позвоночника, особенно если имеется существенная деструкция кости. Поэтому при передних СЭА, который обычно наблюдается на фоне остеомиелита (болезнь Потта), всегда, когда это возможно, показан задне-боковой внеполостной доступ (у ослабленных больных следует избегать трансабдоминального или трансторакального доступов) с удалением нежизнеспособной кости с последующей задней инструментальной фиксацией. В случае болезни Потта в качестве распорки можно использовать трансплантат, взятый у пациента (ребро или мальберцовая кость), с небольшим риском его инфицирования.
Если возбудитель и источник СЭА неизвестны, то наиболее вероятен золотистый стафилококк. Эмпирические АБ:
1. цефалоспорин-3, напр., цефотаксим (Claforan®)
И
2. ванкомицин: пока не будет исключен МУЗС. После его исключения можно перейти на синтетический пенициллин (напр., нафциллин или оксациллин)
И
3. рифамипин РО
АБ меняют в зависимости от результатов посевов или обнаружения источника [напр., у лиц, злоупотребляющих в/в наркотиками, чаще встречаются Грам(-) организмы].
При СЭА после 3-4 нед лечения в/в АБ обычно достаточно 4 нед курса РО АБ. При сопутствующем остеомиелите позвоночника в/в курс должен составлять 6-8 нед (хотя некоторые авторы отмечают, что гистологически остеомиелит имеется практически во всех случаях, даже если его не удается обнаружить рентгенологически; поэтому лечение в обеих группах должно быть одинаковым). Повторные анализы СОЭ также могут влиять на продолжительность лечения (при отсутствии снижения СОЭ следует предполагать повторную инфекцию). Во время лечения АБ требуется иммобилизация в течение по крайней мере 6 нед.
Летальные исходы наблюдаются в 18-23% случаев (возможно чаще у пожилых больных и с парализацией до операции). Улучшение выраженного неврологического дефицита наблюдается редко, даже если операция производится в течение 6-12 ч после его возникновения. Обратное развитие парализации сакральных сегментов СМ, существующей более нескольких часов, наблюдается редко (исключение: 50% восстановление при болезни Потта). Смертность обычно обусловлена первичным очагом инфекции или осложнениями параплегии (напр., ТЭЛА).
источник
Осложнения в виде местных инфекционных и нагноительных процессов после операций на спине в общей структуре всех вмешательств занимают от 1% до 8%. Среди хирургических манипуляций на позвоночнике, связанных с установкой имплантатов, металлоконструкций, частота подобного рода воспалительных реакций существенно выше (6%-20%). Инфекционно-гнойный постхирургический патогенез способен негативно сказаться на окончательном исходе примененной тактики хирургической коррекции позвоночника, даже если она была выполнена безукоризненно.
Хороший спокойный шов после операции.
Несмотря на огромные достижения спинальной нейрохирургии в сфере интра-, постоперационного инфекционного контроля, инфекции и гнойные воспаления все еще остаются лидерами среди всех возможных осложнений. К развитию неблагополучного патогенеза могут подтолкнуть разные факторы: от специфики организма пациента до предоперационных, операционных и послеоперационных нарушений.
Инфекции, воспаления гнойного характера в проекции хирургического поля могут быть поверхностными и глубокими, ранними и поздними. При этом каждый тип требует экстренной медицинской помощи, направленной на усиленное искоренение патогенной среды. Интенсивные лечебные меры необходимы не только для увеличения вероятности наступления позитивного функционального исхода в отношении прооперированного отдела спины. Их ценность заключается также в недопущении развития и распространения сепсиса по организму, который ставит под большую угрозу жизнь человека.
Чем обширнее вмешательство, тем выше вероятность осложнений.
Инфекционное осложнение (ИО) – проблема достаточно серьезная, не всегда легко решаемая, поэтому о ней должен быть ознакомлен каждый пациент, независимо от того, есть она у него или нет. Как говорится: предупрежден – вооружен. Далее подробно проинформируем об осложнениях инфекционного, гнойного характера после операций на спине: после удаления м/п грыжи, протезирования диска, резекции новообразований, вмешательств с использованием металлоконструкций, др. Обязательно ознакомим и с тем, как в такой ситуации специалисты лечат пациентов.
Инфекционные и гнойные реакции в области хирургического вмешательства принято классифицировать на 2 основных вида:
- поверхностные (надфасциальные) – инфицирование затрагивает исключительно кожные поверхности и подкожно-жировой слой в месте разреза;
- глубокие – инфекция проникает глубже, поражая фасциальные, мышечные структуры (запущенные случаи приводят к инфицированию костных тканей).
Поверхностное инфицирование раневого участка образуется не позже первого месяца с момента проведенной операции, возбудителем обычно является стафилококк. Глубинное развитие пагубной микрофлоры больше ассоциировано с отдаленными сроками, и, как правило, появляется в течение 3 или более месяцев после сеанса хирургии.
Один из примеров открывшегося шва.
Первыми специфическими проявлениями диссеминации патогенных микроорганизмов в пределах операционного поля являются:
- покраснение тканей вокруг шва;
- уплотнение;
- болезненные ощущения.
Независимо от вида патогенного агента, об активизированном воспалительном процессе в зоне, имеющей причастность к оперативному вмешательству, можно судить также по наличию одного или нескольких симптомов:
- выделение серозной, серозно-гнойной жидкости из поверхностных тканей разреза;
- ограниченная тканевая отечность;
- локализированная болезненность, которая имеет тенденцию к нарастанию;
- локальная гиперемия кожных покровов с повышением местной температуры;
- гнойное отделяемое из глубины операционной раны, наличие фистул;
- самопроизвольное расхождение шва с разъединением краев раны, если добавочно присутствуют болевой синдром и/или гипертермия организма (общая температура тела до 38 или более градусов).
Воспаление на спине в месте хирургического доступа и вокруг него не всегда свидетельствует об инфекционном осложнении. Отечность, болевые признаки, покраснение практически всегда проявляются сразу после операции как естественная реакция организма на операционную агрессию. И такая симптоматика может быть вариантом нормы, но с условием, что через 3-5 дней эти три признака после миниинвазивной хирургии (без применения имплантов) ликвидировались. Когда речь идет об обширной открытой операции с фиксацией металлоконструкций или протезов, нормальным считается динамичное сокращение выраженности воспаления травмированных тканей в ранний период, окончательное избавление от него максимум на 7-10 сутки.
Согласно рекомендательным предупреждениям специалистов по хирургическому лечению патологий позвоночника, факторы риска инфекционно-гнойных последствий классифицируют на несколько условных групп.
- Последствия, обусловленные состоянием пациента.
- Изначально по основному диагнозу тяжелое клиническое состояние больного, поступившего в стационар.
- Сопутствующие болезни и состояния, которые понижают сопротивляемость организма к патогенам или мешают нормальной регенерации ран:
-
- сахарный диабет;
- иммунодепрессия;
- ожирение;
- дерматозы;
- онкология;
- пожилой возраст;
- младенческий возраст.
- Наличие активного инфекционно-бактериального, гноеродного очага в совершенно любой части организма (кариес зубов, инфекции мочеполовой системы, горла/носа, пр.).
- Дооперационные факторы риска.
- Продолжительный срок госпитализации до операции на спине. Установлено, что чем больше больной находится в больничных условиях, тем выше риски возникновения нозокомиальной (внутрибольничной) инфекции.
- Отсутствие антибиотикотерапии или неадекватная ее схема назначения на этапе предоперационной подготовки пациента, особенно у ослабленных пациентов.
- Некачественная дезинфекция кожных покровов антисептическими средствами перед началом хирургической процедуры.
- Интраоперационные причины.
- Низкая степень «чистоты» операционной раны. На практике, «чистые» операции гораздо реже провоцируют осложнение, чем условно «чистые» или «грязные». Наиболее рискованными вмешательствами на позвоночнике являются те, которые изначально выполнялись по поводу абсцессов, например, вследствие спондилита.
- Нарушение реализации технических приемов выбранного оперативного вмешательства.
- Несоблюдение норм асептики и антисептики в операционной:
- неадекватное наблюдение за раневой зоной от начала и до конца операции;
- халатное отношение хирургов и медбригады к стерильности рабочей одежды, использованию повязок на лицо, т. д.;
- наличие штаммов метициллинрезистентного золотистого стафилококка среди членов медперсонала;
- неограниченное перемещение медиков оперирующей бригады внутри хирургического зала и/или за его пределы;
- недостаточно хорошая вентиляция воздуха в помещении;
- неидеальная стерилизация хирургического инструментария и других окружающих предметов и материалов, которые задействованы в ходе процедуры.
- Обширная травматизация мягких тканей (вынужденная или случайная), технически многосложная и длительная операция.
- Грубые ранения сосудов, мышечных волокон хирургическим инструментом, возникшая необходимость в переливании крови.
- Операционный дренаж, он может поспособствовать миграции патогенных бактерий из кожи в рану. Во многих случаях без него обойтись нельзя. Поэтому дренирование должно проводиться строго ограниченно по времени, а дренажные системы (предпочтительнее закрытого всасывающего типа) требуют очень аккуратного обращения.
Базисный принцип лечения, одинаково распространяющийся на всех больных с подобным осложнением, основывается на фундаментальной санации раны и интенсивной антибиотикотерапии. Однако шаблонов в приемах оказания медицинской помощи здесь не может быть, лечебная программа разрабатывается индивидуально и только на основании характера, тяжести послеоперационного последствия. После диагностической оценки пораженной области могут быть применены разные стратегические подходы с возможной компоновкой:
- хирургическое вскрытие гнойного очага с эвакуацией патологического содержимого раны и удалением очагов некроза;
- очистка от гноеродного компонента, промывание раны струей антибактериального раствора, внутрираневое введение антибиотика;
- использование ультразвуковой/лазерной кавитации гнойной полости;
- применение способов VAC-терапии на базе вакуум-систем;
- рыхлый марлево-антисептический тампонаж и проточно-промывное дренирование раны;
- установка специальных систем всасывающего и/или ирригационного типа;
- в случае глубокой инфекции чаще рекомендовано снятие вживленных имплантов диска, металлических конструкций, эндофиксаторов, чтобы произвести максимально полную санацию и эррадикацию очагов инфекции. В единичных случаях сразу допускается замена извлеченного инструментария/имплантов на новые изделия.
Местное лечение с использованием выше перечисленных методик, как правило, включает иммобилизацию пациента. Локально мероприятия продолжаются обычно от 5 дней до 14 суток. Однако при генерализированном патогенном процессе, незначительном прогрессе лечения их могут продлить на месяц или дольше.
Бактериальный посев на выявление патогена.
Следующая обязательная лечебная мера – общее антибактериальное медикаментозное пособие. Оно подбирается с учетом результатов выполненного бактериологического посева и чувствительности конкретного возбудителя к антибиотикам. Общая антибактериальная терапия (в основном инъекционная) в среднем назначается на 6-8 недель. К пероральному приему антибиотиков при данном последствии медики настроены скептически, не считая такой способ надежным.
В комплексе с антибиотикотерапией неотъемлемо должны присутствовать детоксикационные, иммунокорректирующие, симптоматические методы лечения. Грамотно разработанный алгоритм борьбы с развившейся инфекционно-воспалительной, гноеродной средой позволяет в подавляющем количестве случаев прийти к положительному прогнозу.
Профилактические меры нацелены на выявление и учет всех возможных провокационных факторов, которые могут вызвать осложнение. Исходя из этого, на протяжении всего периоперационного периода должны в полном объеме обеспечиваться адекватные действия со стороны медперсонала и пациента. Только так реально исключить или максимально обезопасить человека от местной инфекционной атаки. Перечислим ведущие принципы профилактики ИО в хирургии позвоночного столба.
- Предоперационная комплексная (расширенная) диагностика организма, включая бактериологические обследования мочи, крови. Важно также пройти стоматологический осмотр, обследования у ЛОРа, сдать БАК-посев ротовой полости. При обнаружении высоких диагностических титров инфекций в организме перед операцией нужно пройти специфическое целенаправленное лечение.
- На дооперационном этапе обеспечение должной терапии всех декомпенсированных хронических заболеваний, являющихся потенциальными «усилителями» незаживления и инфицирования операционных ран. Особенного внимания требуют диабетики и больные с аутоиммунными нарушениями в течение всего периоперационного срока! Оперировать разрешено только при достижении стойкой компенсации хронической болезни.
- Прохождение вмешательства исключительно в клиниках высокого уровня, где четко следуют всем нейрохирургическим канонам – от подготовки пациента, четкого соблюдения технологии операций и антисептических норм до безупречного обеспечения реабилитационного ухода.
- Профилактическое использование внутривенных антибиотиков при всех видах операции, будь то резекция межпозвоночной грыжи, новообразования или устранение нестабильности, искривления позвоночника посредством имплантатов или трансплантатов (накануне, интраоперационно, в послеоперационный период).
- По возвращении домой безукоризненное соблюдение предоставленных врачом рекомендаций по уходу, обработке области послеоперационного разреза.
- Неукоснительно придерживаться всех схем лечебного, физического режима после операции.
- При первых симптомах болезненного дискомфорта в районе операционного доступа (боли, жжения, отечности, покраснения, гипертермии и т. п.) незамедлительно показаться лечащему врачу.
Запомните, что инфекционные осложнения на начальной стадии легче остановить и устранить, чем запущенные его формы, причем в ряде случаев безоперационно. И, безусловно, не допустить отторжения имплантов, расшатывания, смещения, поломки, миграции по анатомическим просторам чужеродного тела. Ранняя диагностика, своевременное лечение ИО – основополагающие критерии благополучного исхода, менее тяжелого и длительного восстановления после перенесенной спинальной хирургии.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4335387/
https://www.aans.org/Patients/Neurosurgical-Conditions-and-Treatments/Spinal-Infections
https://cyberleninka.ru/article/v/diagnostika-implant-assotsiirovannyh-infektsiy-v-ortopedii-s-pozitsii-dokazatelnoy-meditsinyисточник

 Сильные и постоянные боли в области спины. Особенно, когда они возникают сами по себе, а не как последствие травм или ушибов области позвоночника. Однако стоит помнить, что очень часто боли при инфекции позвоночника отсутствуют или носят непродолжительный, стертый характер.
Сильные и постоянные боли в области спины. Особенно, когда они возникают сами по себе, а не как последствие травм или ушибов области позвоночника. Однако стоит помнить, что очень часто боли при инфекции позвоночника отсутствуют или носят непродолжительный, стертый характер.