*Импакт фактор за 2017 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
НИИ нейрохирургии им. акад. Н.Н. Бурденко РАМН, Москва
Абсцесс головного мозга (АМ) представляет собой ограниченное капсулой скопление гноя в паренхиме мозга. Развивается чаще всего в результате проникновения в мозговую ткань бактерий, грибов или простейших микроорганизмов.
Несмотря на появление сильнодействующих антибактериальных средств и достижения микробиологической и радиологической диагностики, заболеваемость АМ сохраняется на сравнительно стабильном уровне. Соотношение мужчин и женщин составляет 2:1 при том, что средний возраст заболевших 35 – 45 лет. В 25% случаев АМ развивается у детей и подростков моложе 15 лет. До 2-х лет встречается редко (последствие менингита, вызванного Citrobacter diversus или другой грамотрицательной флорой). Максимальные пики развития АМ после среднего отита, как правило, приходятся на детский возраст и после 40 лет, тогда как абсцессы после синуситов чаще встречаются в возрасте от 10 до 30 лет. В то же время АМ являются основным видом внутричерепных инфекций у больных с ВИЧ. Так, распространенность токсоплазмозного энцефалита среди больных ВИЧ составляет от 2,6 до 30,8%.
До широкого применения антибиотиков основными возбудителями АМ являлись золотистый стафилококк, стрептококки и коли-бактерии, а у 50% больных возбудитель вообще не определялся. Совершенствование диагностических методов привело к уменьшению числа “стерильных” абсцессов и выявило роль анаэробных бактерий в развитии АМ.
В настоящее время считают, что 30–60% АМ являются результатом смешанной инфекции. При этом аэробные бактерии выделяют в 61% случаев, а анаэробы – в 32%. Половину всех аэробных культур составляют аэробные или микроаэрофильные стрептококки, выделяемые у 70% больных с АМ. К наиболее часто выделяемым стрептококкам относят принадлежащие к группе Streptococcus intermedius (Streptococcus anginosus, Streptococcus constellatus, Streptococcus milleri и др.).
S. Aureus выделен у 15% больных, в большинстве – это люди с черепно-мозговой травмой (ЧМТ) или перенесшие нейрохирургическую операцию.
Аэробные грамотрицательные бациллы (Proteus sp., E. coli, Klebsiella sp., Enterobacter sp. и P. aeruginosa) были выделены у 23–33% больных; 5–10% случаев составляют виды Haemophilus, в основном Haemophilus aphrophilus.
Анаэробные культуры чаще всего выделяют при АМ у больных с инфекцией легких и хроническими отитами, к ним относятся Bacteroides sp. (включая Bacteroides fragilis), Fusobacterium sp., Prevotella sp., анаэробные стрептококки и Clostridium sp.
Локализация и источник образования АМ позволяют предположить вероятного возбудителя процесса. Например, синусит чаще вызывается представителем группы S. intermedius и является источником АМ, локализующегося в лобной доле мозга, при этом сфеноидальные синуситы чаще вызывают АМ. При хроническом синусите одновременно выявляют нескольких возбудителей в соотношении аэробов к анаэробам, равным 1:1,5. Стафилококки, как правило, являются возбудителями посттравматических и послеоперационных АМ.
Абсцесс височной доли чаще развивается как осложнение среднего отита и обусловлен смешанной инфекцией. Возбудителями острых средних отитов, осложненных развитием АМ, являются S. pneumoniae, H. influenzae и Moraxella catarrhalis. Другие стрептококки, грамотрицательные анаэробы (включая P. aeruginosa, анаэробные кокки и Bacteroides sp.), являются основными возбудителями хронических средних отитов и связанных с ними АМ у 33% больных.
В 85–95% случаев мозжечковые АМ обусловлены мастоидитами. У 10% больных АМ являются одонтогенными. Однако и у больных с “криптогенным” АМ часто выявляют периапикальные абсцессы.
Следует отметить, что пневмококки, менингококки и H. influenzae редко выделяют из АМ, даже при гнойных менингитах. Диагноз пневмококкового АМ требует немедленного обследования больного на наличие предрасполагающего фактора – вируса иммунодефицита.
У больных со сниженным иммунитетом возбудителями АМ могут стать грибы, а Toxoplasma gondii типична для АМ у больных СПИДом. При нейтропениях чаще выделяют аэробные грамотрицательные бактерии, Candida sp., Aspergillus sp. или zygomycosis. В 50% случаев АМ, развивающиеся после пересадки костного мозга, обусловлены Aspergillus sp. и сопровождаются высоким уровнем летальности. У больных с нарушениями клеточного иммунитета возбудителями АМ являются T. gondii, Nocardia asteroides, L. monocytogenes, Myco-bacterium sp. или Cryptococcus neoformans.
Обзор литературы за прошедшие полвека показал, что в 45% случаев развитие АМ было обусловлено контактным распространением (отиты или синуситы). При этом в последние 10 лет отмечается снижение числа отогенных АМ, связанное с применением современных антимикробных средств. Контактное распространение инфекции происходит в основном по одному из двух главных механизмов: при прямом распространении через зону, прилегающую к остеиту или остеомиелиту, или при ретроградном распространении по эмиссарным венам.
Бактериальный менингит у взрослых редко осложняется АМ, тогда как у новорожденных развитие АМ может осложнить течение грамотрицательного менингита, обусловленного Citrobacter или Proteus sp.
Гематогенный путь развития АМ типичен для 25% больных с этой патологией, особенно, когда источником являются легочные инфекционные заболевания.
Для гематогенного АМ характерны:
• локализация в бассейне средней мозговой артерии;
• локализация на границе серого и белого вещества мозга;
• плохое образование капсулы;
• высокий уровень летальности;
Если в докомпьютерный период множественные АМ встречались всего у 1–15% больных, с появлением КТ такой диагноз ставится в 10–50% случаев.
Предрасполагающими факторами для развития АМ являются хронические легочные инфекции (абсцессы, бронхоэктазы и эмпиема), остеомиелиты, холециститы, желудочно-кишечные инфекции и/или инфекционные процессы в малом тазе. Реже АМ встречается при осложнениях таких заболеваний, как бактериальные эндокардиты, наследственная геморрагическая телеангиэктазия (болезнь Рандю–Вебера–Ослера), врожденные пороки сердца.
Гнойно-воспалительные осложнения плановых нейрохирургических операций составляют 0,6–1,7%, и 10% из них – АМ. При проникающей ЧМТ АМ образуются значительно чаще, а фактором риска являются огнестрельное поражение мозга и проникновение в мозг костных отломков и поверхностных тканей.
Экспериментальные данные показывают высокую резистентность мозговой ткани к инфекции, поэтому образование АМ требует наличия в той или иной степени поврежденного участка головного мозга.
Полицитемия и гипоксия, которые встречаются у больных с врожденными пороками сердца и при наследственной геморрагической телеангиэктазии, повышают вязкость крови и снижают скорость кровотока в капиллярах мозга. Это приводит к появлению микроинфарктов или участков со сниженной оксигенацией, которые могут стать очагом последующей инфекции.
На экспериментальной модели было показано, что гистопатологическая картина АМ складывается из 4 стадий.
1. Ранний церебрит (неинкапсулированный очаг инфекционного поражения мозга) – плохо отграниченный очаг с диффузным воспалением, перифокальным отеком и деструкцией вещества мозга. Формируется в течение 1–3 сут после внутримозговой инокуляции.
2. Поздний церебрит – центральная часть очага нагнаивается и некротизируется с формированием полости, заполненной полужидким гноем. По периферии скапливаются фибробласты (4–9 сут).
3. Начало образования глиозной капсулы – увеличение слоя фибробластов с ободком неоваскуляризации и реактивным астроцитозом (10–13 сут).
4. Формирование глиозной капсулы – уплотнение капсулы с реактивным коллагеном (более 2 нед).
Необходимо отметить, что сроки развития и степень выраженности перечисленных стадий могут варьировать в зависимости от возбудителя, пути распространения и т.д. Так, например, при контактном распространении капсула абсцесса представляет собой более прочное и четкое образование, чем при гематогенном.
Таким образом, формирование АМ проходит от стадии церебрита до стадии четкого отграничения некротического фокуса. Степень выраженности последней стадии зависит от конкретного возбудителя, иммунного статуса больного и степени гипоксии в данном участке мозговой ткани.
Клиника АМ может варьировать от вялотекущей до молниеносной. Очаговые симптомы поражения головного мозга связаны с гибелью мозговой ткани и выпадением функции в зоне локализации абсцесса. Токсины гнойного воспаления обладают тропизмом к нейронам, вызывая их необратимые дистрофические изменения и гибель. Поэтому в большинстве случаев АМ проявляется очаговыми неврологическими нарушениями, а не симптомами системной инфекции.
В целом клиническая картина неспецифична, зависит от вирулентности микроорганизма, иммунного статуса больного, локализации абсцесса(ов), наличия или отсутствия сопутствующего менингита или вентрикулита. Лишь у части больных отмечается классическая триада, включающая лихорадку, головную боль и очаговые неврологические нарушения. Головная боль – наиболее частый клинический симптом – встречается у 70% больных. Лихорадка – только у 50% взрослых больных и 80% детей. Очаговые неврологические нарушения проявляются у 50% больных и включают как двигательные нарушения, так и нарушения со стороны черепно-мозговых нервов.
При абсцессе полушария мозжечка отмечают нистагм, атаксию, рвоту и дисметрию, а при абсцессе лобной доли – головную боль, сонливость и нарушения сознания, наряду с двигательными и речевыми нарушениями.
Эпилептические припадки (в основном генерализованные) возникают у 25–45% больных. Тошнота и рвота нередко манифестируют как проявления внутричерепной гипертензии (ВЧГ). Менингеальные симптомы доминируют у 25% больных. Абсцессы в области турецкого седла могут вызывать симптомы, характерные для поражения гипофиза: головную боль, дефекты полей зрения, эндокринные нарушения.
В связи с этим дифференциальный диагноз АМ проводят с опухолевым поражением, хроническим менингитом, хронической субдуральной гематомой и вирусным энцефалитом.
Обычные исследования крови и мочи, как правило, бесполезны в диагностике АМ. Лейкоцитоз встречается только у 40% больных. Концентрация С-реактивного белка может помочь только в дифференциальной диагностике АМ и опухолей мозга.
Люмбальная пункция при АМ опасна (риск вклинения составляет более 20%), а возбудитель в спинномозговой жидкости (СМЖ) обнаруживается редко. Исследование СМЖ позволяет исключить бактериальный менингит, хотя диагноз последнего может подтверждаться одной лишь совокупностью клинических симптомов.
Наиболее точными диагностическими методами в настоящее время являются компьютерная томография (КТ) и магнитно-резонансная томография (МРТ). КТ позволяет в 95% случаев установить локализацию абсцесса, определить наличие отека мозга, гидроцефалии и/или смещения срединных структур. АМ во время КТ выглядит как круглый очаг низкой плотности, окруженный тонким, с повышенным накоплением контраста, обычно ровным кольцом. Ограничения метода КТ обусловлены тем, что злокачественная опухоль или инфаркт мозга, окруженные ободком неоваскуляризации, на КТ выглядят сходно. В то же время только у 40–60% больных с АМ, получающих глюкокортикоидную терапию, на КТ обнаруживают характерное, накапливающее контраст кольцо. Рентгеновские методы используют и для обнаружения очагов инфекции – источников АМ, для чего на КТ внимательно исследуют сосцевидные отростки и придаточные пазухи, проводят рентгенографию грудной клетки.
Данные об использовании МРТ в диагностике АМ в настоящее время продолжают накапливаться. По оценкам специалистов, МРТ – такой же чувствительный метод, как и КТ, а в некоторых случаях даже превосходит его (выявление АМ на стадии церебрита).
Лечение АМ проводится комплексно и включает в себя медикаментозные (консервативные) и хирургические меры. Выбор оптимальных из них определяется гистопатологической стадией АМ по данным КТ (МРТ) исследования. На стадии церебрита эффективно медикаментозное лечение, а нейрохирургическое вмешательство не показано, тогда как при уже сформировавшемся абсцессе с плотной капсулой консервативная тактика не приносит успеха (см. врезку).
Медикаментозное лечение включает: антибиотикотерапию, противоотечную терапию, противосудорожные средства.
Антибиотикотерапия – основа медикаментозного лечения (рис. 1).
В течение последних четырех десятилетий наиболее распространенной схемой лечения было сочетание пенициллина G, 20–24 МЕ/сут внутривенно и хлорамфеникола 1–1,5 г/сут внутривенно (каждые 6 ч). Пенициллин был включен в схему, так как он активен против стрептококков (включая группу S. Intermedius) и большинства анаэробных бактерий, выделяемых у больных с АМ; эффективен при лечении АМ на экспериментальных моделях и значительно снизил смертность от АМ, начиная с 40-х годов.
Хлорамфеникол широко использовали в прошлом благодаря его способности хорошо растворяться в жировой ткани (концентрация в головном мозге нередко превышала концентрацию в плазме), а также активности против анаэробных бактерий, включая B. fragilis.
В настоящее время цефотаксим (Цефабол) в дозе 3 г внутривенно каждые 8 ч является приемлемым заменителем пенициллина, а вместо хлорамфеникола все чаще используется метронидазол.
Антибиотикотерапию начинают в предоперационном периоде (не позднее чем за 2 нед до операции). Общая продолжительность лечения составляет 6–8 нед, но не менее 4 нед после операции. Полученный в результате операции гной окрашивают по Граму и производят посевы на среды для выявления аэробных и анаэробных бактерий и грибов и определения их чувствительности к антибиотикам. Нет исследований, достоверно подтверждающих положительное влияние на исход заболевания введения антибиотиков внутрь абсцесса интраоперационно. Следует учитывать, что на стадии церебрита гематоэнцефалический барьер (ГЭБ) остается сохранным, поэтому приоритет отдается препаратам, которые хорошо проникают через него. Именно поэтому препаратом выбора является меропенем, а не имипенем, из-за его избирательной проницаемости через ГЭБ.
Вопрос о применении кортикостероидов с целью уменьшения отека в лечении АМ до сих пор остается спорным. Экспериментально доказано, что кортикостероиды ухудшают проникновение в абсцесс антибиотиков, препятствуют образованию капсулы абсцесса, а также снижают накопление контраста на КТ, что создает ложное впечатление о размерах и состоянии АМ в динамике. В исследованиях на животных использование кортикостероидов не оказало влияния на смертность от АМ, но нет и доказательств того, что они способствуют генерализации инфекции.
При внутричерепной гипертензии и угрозе дислокационного синдрома применяют маннитол (1–1,5 г/кг внутривенно в виде болюса в течение 20–30 мин).
Противосудорожные средства (например, фенитоин) показаны при наличии судорожных проявлений.
К наиболее эффективным методам хирургического лечения АМ в настоящее время относятся: дренирование абсцесса с помощью пункционной аспирации и полное удаление абсцесса.
Пункционную аспирацию целесообразно применять на начальных этапах лечения (одновременно с проведением антибиотикотерапии), особенно в стадии церебрита, при стабильном неврологическом состоянии больного, а также в случае глубокого расположения абсцесса (метод выбора) или при множественных абсцессах. Интраоперационное УЗИ и стереотаксическая биопсия под контролем КТ сделали безопасной аспирацию абсцесса практически в любой зоне мозга. Последующее лечение зависит как от клинических, так и от радиологических исследований. Ухудшение неврологического состояния, наличие воздуха в полости абсцесса или отсутствие изменений размеров абсцесса в динамике на КТ являются показаниями к немедленному хирургическому вмешательству (аспирация или удаление).
Удаление абсцесса позволяет устранить опасность рецидива АМ. Удаление абсцесса целесообразно проводить при поверхностных, легко доступных абсцессах с хорошо сформированной, плотной капсулой, а также в случае, если аспирация и/или антибиотикотерапия оказались неэффективными. После тотального, без нарушения целостности капсулы, удаления абсцесса (особенно при его поверхностном расположении), продолжительность антибиотикотерапии можно сократить до 3 сут.
Хорошее контрастирование на КТ при излеченном АМ может сохраняться от 4–10 нед до 6–9 мес. Примером может служить следующее наблюдение.
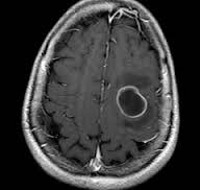
Больной З., в начале августа 1999 г. в течение 1 нед перенес ангину. Работу не прекращал, лечился самостоятельно. Через 2 нед, внезапно появилась слабость в правой руке и ноге, которая самостоятельно регрессировала спустя несколько часов и, вновь развившись через 2 дня, носила нарастающий характер, сопровождаясь быстрой утомляемостью, чувством недомогания. После госпитализации отмечено развитие приступа судорог в правой руке и ноге без потери сознания. На компьютерных томограммах в левой затылочной области определялась кольцевидной формы зона повышенной плотности с неровными, бугристыми контурами, негомогенной структурой размером 32 х 22 мм, окруженная зоной отека (рис. 2 а).
Обращали внимание отсутствие признаков ВЧГ, правосторонняя гомонимная гемианопсия, правосторонний гемипарез (сила – 2 балла), патологические рефлексы, гемигипестезия. Изменений со стороны внутренних органов выявлено не было, анализы крови и мочи в пределах нормы. С диагнозом объемное образование левой затылочной доли больному произведена операция, во время которой субкортикально на глубине около 5 мм обнаружен абсцесс с тонкой капсулой, разорвавшейся при попытке его удаления. В предварительно обложенную ватными тампонами операционную рану излилось около 15 мл густой желто-зеленой жидкости со зловонным запахом. Абсцесс был удален полностью вместе с капсулой. Образовавшаяся полость обработана 1%-ным раствором диоксидина. Бактериоскопия содержимого полости абсцесса выявила большое количество скоплений кокков. В послеоперационном периоде на фоне проводимого лечения отмечался полный регресс неврологической симптоматики: восстановилась сила в правой руке и ноге до 5 баллов, чувствительность правой ноги не нарушена, поля зрения в норме.
На контрольных томограммах спустя 2 нед (рис. 2, б) и 8 нед (рис. 2, в) после операции отмечена динамика послеоперационных изменений в виде небольшой зоны понижения плотности в левой затылочной доле.
До недавнего времени летальность от АМ оставалась на относительно стабильном уровне и составляла примерно 40–60% независимо от использования антибиотиков. И только с внедрением в практику такого метода, как КТ (МРТ), удалось снизить ее до 10% (по некоторым данным, до 11–20%). Примерно у 30–55% больных после выздоровления остается стойкий неврологический дефицит, в 29% случаев сохраняется гемипарез, а более чем у 70% выживших больных впоследствии отмечаются эпилептические припадки.
Наиболее предпочтительной остается тактика лечения, предупреждающая развитие АМ. Она включает в себя раннюю диагностику и эффективную антибиотикотерапию инфекционного заболевания, являющегося вероятным источником образования АМ. Сюда же можно отнести и применение антимикробных средств с целью профилактики хирургических инфекций. Терапия, направленная на улучшение кровоснабжения и оксигенации мозговой ткани, также является эффективной и показана для предупреждения АМ. Сочетание признаков системного воспаления с появлением оболочечной симптоматики, тем более с присоединением симтомов ВЧГ или(и) очагового поражения головного мозга, являются обязательным показанием для срочного КТ (МРТ) обследования больного с целью исключения АМ. При постановке диагноза АМ агрессивная медикаментозно-хирургическая тактика способна обеспечить успех лечения.
Список литературы Вы можете найти на сайте http://www.rmj.ru
Цефабол (торговое название)
Цефамабол (торговое название)
1. Яковлев С.В., Яковлев В.П.: Современная антибактериальная терапия в таблицах. Consilium Medicum 1999; 1(1): 18–36.
2. Chun C.H., Johnson J.D., Hofstetter M., Raff M.J.: Brain abscess. A study of 45 consecutive cases: Medicine (Baltimore) 1986 Nov; 65 (6): 415–31.
3. Ciurea V., Stoica F., Vasilescu G., Nuteanu L.: Neurosurgical management of brain abscesses in children: Acta Neuropathologica: 1998; 46: 3.
4. Dolan R.W., Chowdhury K.: Diagnosis and treatment of intracranial complications of paranasal sinus infections: J Oral Maxillofac Surg 1995 Sep; 53(9): 1080–7.
5. Hagensee M.E. et al.: Brain abscess following marrow transplantation: Experience at the Fred Hutchinson Cancer Research Center, 1984-1992. Clin Infect Dis, 1994; 19: 402.
6. Haimes A.B., Zimmerman R.D., Morgello S, et al.: MRimaging of brain abscesses. AJR Reviews MRI of brain abscesses and its differential diagnosis.1989; 152: 1073.
7. Levy R.M.: Brain abscess and subdural empyema. Curr Opin Neurol 1994; 7: 223.
8. Maniglia A.J., Goodwin W.J., Arnold J.E., et al.: Intracranial abscesses secondary to nasal, sinus, and orbital infections in adults and children. Arch Otolaryngol Head Neck Surg Association of sinus disease with brain abscesses is reviewed. 1989; 115: 1424.
9. Ostermann S., Schmal F.: Epidural hematoma with secondary penetration into the middle ear. An uncommon differential diagnosis of otogenic brain abscess: Acta Neuropathologica: 1999; 9: 3.
10. Patel K.S., Marks P.V.: Management of focal intracranial infections: Is medical treatment better than surgery? Discussion of the issue of nonsurgical management. J Neurol Neurosurg Psychiatry 1990; 53: 472.
11. Rosenfeld E.A., Bowley A.H.: Infectious complications of sinusitis, other than meningitis in children: 12 year review. Clin Infect Dis 1994; 18: 750.
12. Seydoux C.H., Francioli P.: Bacterial brain abscesses: Factors influencing mortality and sequel. Clin Infect Dis 1992; 15: 394.
13. Sjolin J et al: Treatment of brain abscess with cefotaxime and metronidazole: Prospective study of 15 consecutive patients. Clin Infect Dis 1993; 17: 857.
14. Stephens D.S., Farley M.M.: Pathogenetic events during infection of the human nasal pharynx with Neisseria meningitidis and Haemophilus influenzae. Rev Infect Dis 1991; 13: 22.
15. Takeshita M., Kagawa M., Izawa M., Takakura K.: Current Treatment Strategies and Factors influencing Outcome in Patients with Bacterial Brain Abscess: Acta Neuropathologica 1998; 12: 140.
16. Wispelwey B., Scheld W.M.: Brain abscess, in Infections of the Central Nervous System, 2d ed, WM Scheld et al (eds). New York, Lippincott-Raven, 1997; 463–94.
17. Yang S.Y., Zhao C.S.: Review of 140 patients with brain abscess. Surg Neurol Clinical features, bacteriology, imaging, and treatment discussed. 1993; 39: 290.
| Приложения к статье |
| Источники и факторы риска АМ 1. При контактном распространении: • отит и мастоидит (абсцессы височной доли и мозжечка); • синусит (абсцесс лобной доли); 2. При гематогенном распространении: • у взрослых: инфекционные заболевания легких (абсцессы, бронхоэктазы, эмпиема); • у детей: врожденные пороки сердца со сбросом крови справа налево (у 4–7% детей с этой патологией); • легочные артериовенозные фистулы, наследственная геморрагическая телеангиэктазия (у 5% больных с этой врожденной патологией); • бактериальный эндокардит (редко); • бактериемия, связанная с внечерепными очагами инфекции, в т. ч. при стоматологических и иных манипуляциях. В 15–20% случаев источник АМ выявить не удается. |
| Максимально эффективной медикаментозная терапия может быть в следующих случаях: 1. Лечение начато в стадии церебрита. 2. Абсцесс имеет небольшие (0,8–2,5 см) размеры. 3. Продолжительность симптомов не превышает 2 нед. 4. Отмечается явное клиническое улучшение в течение 1 нед после начала лечения. Консервативное лечение применяется: 1. При множественных или недоступных для хирургического вмешательства абсцессах. 2. При сопутствующем менингоэнцефалите. 3. При высоком риске хирургического вмешательства. источник Абсцесс мозга — локальное инфекционно-воспалительное поражение мозговой ткани с ее последующим расплавлением и образованием полости, заполненной гнойным содержимым. Специфических признаков данное заболевание не имеет. Оно проявляется интоксикационным синдромом, общемозговыми симптомами и очаговым поражением мозгового вещества. Абсцесс головного мозга представляет собой вторичную патологию, осложняющую течение основного заболевания. Первичный очаг инфекции обычно располагается за пределами ЦНС. Патогенные микроорганизмы проникают в головной мозг различными путями: контактным, гематогенным, прямым. Заболевание нередко становится результатом травматического или органического поражения мозга. Абсцесс мозга – серьезная болезнь, которая в настоящее время регистрируется довольно редко. Обычно болеют дети из бедных семей, ВИЧ-инфицированные лица, а также больные, длительно получающие лучевую или химиотерапию. Абсцесс головного мозга встречается преимущественно у мужчин в возрасте 30-45 лет.
Абсцесс мозга бывает субдуральным, эпидуральным и внутримозговым. Эта классификация основана на расположении абсцесса в черепной коробке относительно твердой мозговой оболочки. По структуре выделяют 2 типа абсцесса:
Основной причиной абсцесса мозга является бактериальная инфекция:
Для того, чтобы сформировался абсцесс, необходимо соблюдение двух условий: наличие патогенного микроба и снижение общей резистентности организма человека. Формирование абсцесса – длительный процесс, состоящий из последовательных стадий, сменяющих друг друга. Стадии развития заболевания: стадии развития заболевания Ранний церебрит – инфекционное воспаление мозговой ткани, которое разрешается спонтанно или под влиянием антибиотиков. Эта стадия длится трое суток и характеризуется отсутствием границы между здоровыми тканями мозга и пораженными, наличием периваскулярных инфильтратов и токсического поражения нейронов. Заболевание начинается остро и проявляется признаками интоксикационного синдрома, очаговых и общемозговых симптомов. У больных повышается температура тела, возникает головная боль, озноб, гипергидроз, бледность кожи, слабость, отсутствие аппетита, сухость во рту, в крови – лейкоцитоз, увеличение СОЭ. Это признаки выраженной интоксикации. К общемозговым относятся следующие симптомы:
Очаговая неврологическая симптоматика позволяет диагностировать патологию, основываясь на ее клинических признаках. Клиника абсцесса мозга определяется местом его расположения:
Возможно появление клинических признаков, связанных с инсультом и отеком мозга. Близкое расположение абсцесса к мозговым оболочкам проявляется менингеальными симптомами и знаками — ригидностью затылочных мышц, позой легавой собаки, повышенной чувствительностью к прикосновениям. Осложнениями абсцесса головного мозга являются: вклинение гнойника, его прорыв в желудочки мозга, рецидивы, вторичное инфицирование послеоперационной раны, воспаление костей черепа — остеомиелит, возникновение повторяющихся эпилептических припадков. Клинически эти процессы проявляются параличами и парезами, потерей зрения и слуха, нарушением памяти, снижением интеллекта и прочими дисфункциями центральной нервной системы. Диагностика абсцесса мозга начинается с осмотра и выслушивания жалоб больного. На основании данных анамнеза и определенных симптомов заболевания специалисты могут поставить предварительный диагноз. Важное значение имеют очаговые неврологические и общемозговые признаки, острое начало патологии, развитие внутричерепной гипертензии, наличие в организме очагов хронической инфекции. Дополнительные диагностические методы, подтверждающие или опровергающие предполагаемый диагноз: КТ головного мозга — доступный и высокочувствительный метод. Без контрастирования он определяет лишь зону пониженной плотности. Структура патологического очага становится четкой только под воздействием рентгеноконтрастного вещества.
В зависимости от стадии болезни, места локализации гнойника и его размера проводят консервативную или хирургическую терапию. Консервативную терапию проводят на начальной стадии патологии, а также когда размер гнойника не превышает трех сантиметров в диаметре.
После стабилизации общего состояния больного гнойник вскрывают и дренируют. Гнойную полость орошают антибактериальным раствором. После операции больной некоторое время находится в реанимационном отделении, а затем его переводят в палату на неврологическую койку. После подобного оперативного вмешательства требуется длительный реабилитационный период. Показания к операции:
Мероприятия, позволяющие предотвратить формирование абсцесса в головном мозге:
Абсцесс головного мозга – серьезная патология, возникающая на фоне имеющихся в организме заболеваний. Чтобы своевременно обнаружить недуг и незамедлительно начать лечение, необходимо знать первые клинические симптомы и уметь применять дополнительные методы исследования. Ранняя и адекватная терапия способна снизить риск развития опасных для жизни осложнений и сделать отрицательные последствия для организма минимальными. источник Абсцесс головного мозга – это локальное образование инфекционной природы, представляющее собой скопление гноя, изолированного от здоровых тканей мозга твердой соединительно-тканной капсулой. Составляет не более 1-2% от всех внутричерепных образований. Может встречаться в любом возрасте, но наиболее часто возникает у людей за 40. Болеют чаще мужчины.
Период связан с неинкапсулированным очагом инфекции, т. е. воспалительный очаг еще не ограничивается четко ограничения от здорового вещества мозга. При гистологическом исследовании на этом этапе можно обнаружить возбудителя, окруженного зоной периваскулярной инфильтрации (скопление различных клеток по типу нейтрофилов и моноцитов). Поздний церебрит (4–9 сутки) Постепенное распространение воспаления на соседние участки и появление некроза в центре инфекционного очага (начало формирования небольшой гнойной полости в центре). По краям воспаления начинается скопление фибробластов и макрофагов. Участок поражения утрачивает сосудистую сеть в связи с выраженным отеком. Стадия раннего формирования капсулы (10–13 сутки) Уменьшение воспалительного процесса и значительное увеличение количества фибробластов на границе. Четкое отсутствие васкуляризации в зоне поражения. Созревание коллагена и формирование зачатка фиброзной капсулы. Стадия позднего формирования капсулы (14 сутки и более) Окончательное формирование капсулы и постепенный регресс признаков воспаления. К этому моменту абсцесс имеет полностью сформированный вид (слои представлены изнутри наружу): некротический центр, периферическая зона воспалительных клеток и фибробластов, коллагеновая капсула, новая сосудистая сеть, область реактивного глиоза с отеком. Выраженность проявлений болезни имеет четкую зависимость не только от типа возбудителя, но и от состояния иммунной системы человека. Абсцесс головного мозга является инфекционным заболеванием, к основным причинам его возникновения относятся:
Предрасполагающими факторами являются:
Во всех случаях рассматриваемая патология выступает как осложнение инфекционных процессов в организме, т. е. вторична. В случае появления абсцесса как самостоятельного заболевания (идиопатическая форма) показан курс диагностических мероприятий для исключения онкологических процессов. Далеко не все патогенные организмы способны проходить через гематоэнцефалический барьер и попадать в полость мозга. Основные возбудители, способные проникнуть через гематоэнцефалический барьер и вызвать образование очага в головном мозге, представлены в таблице. Стрептококки аэробные и анаэробные, золотистый стафилококк, протей, клебсиелла, энтеробактерии, листерия. источник Принципы минимально инвазивной нейрохирургии составляют основу хирургической тактики лечения ПА. Анализ данных Института нейрохирургии позволил выработать дифференцированным показания к хирургическому лечению ПА. Абсолютное показанием к оперативному вмешательству является пребывание больных в фазах клинической декомпенсации с КТ-МРТ признаками масс-эффекта, сопровождаемого дислокационными проявлениями. В фазах клинической компенсации и субкомпенсации при небольших размерах абсцесса и отсутствии дислокационной симптоматики, наличии недостаточно сформированной капсулы, глубинно расположенных и множественных абсцессах — показания к хирургии являются относительными. При стабильном компенсированном состоянии или положительной динамике в условиях несформированных абсцессов проводится консервативная терапия. В основу стратегии хирургического лечения посттравматических абсцессов заложены принципы безопасности и малоинвазивности метода. Приоритет принадлежит пункционному опорожнению и дренированию ПА. Наличие отграничительной капсулы и жидкостное содержание абсцессов по данным КТ-МРТ является оптимальными для применения данного метода в любой клинической фазе заболевания и во всех возрастных группах больных. Использование прямых радикальных методов удаления ПА вместе с капсулой должно быть ограничено ситуациями наличия инородных тел в полости абсцесса, их локализацией связанной с па-раназальными синусами, сопутствующими остеомиелитами, а также при невозможности дренирования (многокамерные абсцессы, уплотнение и кальцификация капсулы и их содержимого и т.д.). Четкая визуализация ПА с наличием сформированной капсулы по данным КТ-МРТ, их жидкостное содержимое являются основными показаниями для проведения пункционного опорожнения и дренирования (рис. 21-5). Пункционный метод хирургии осуществляется с наложением фрезевого отверстия в проекции ПА (по данным КТ-МРТ), вскрытия ТМО, коагуляции места интрацеребрального введения катетера и последовательного проведения его в направлении абсцесса. По мере достижения капсулы абсцесса, как правило, отмечается пружинящее сопротивление, после преодоления которого катетер проникает в его полость. После удаления проводника по катетеру поступающее гнойное содержимое направляется на микробиологическое исследование и определение чувствительности микрофлоры к антибактериальным препаратам. Последовательно осуществляется удаление содержимого абсцесса с промыванием его полости растворами антисептиков (р-ры фурациллина и диоксидина). Послеоперационное дренирование осуществляется с использованием активных (асп и рацио иные дренажные системы типа Редона и Джексона-Пратта) и пассивных (периодическое промывание полостей) методов аспирации. Средние сроки дренирования составляют 2—3 сут. Рис. 21-5. Стереотаксическая пункция посттравматического абсцесса с использованием стсреотаксического аппарата Riechert-Mundinger. При глубинно расположенных абсцессах, особенно небольшого диаметра (до 2,0 см), показана стереотаксическая навигация при их пункции с предварительными КТ расчетами (рис. 21-6). Тотальное удаление ПА показано при наличии инородных тел в их полостях, сопряжения их локализации с придаточными пазухами носа и остеомиелитом костей черепа, а также в ситуациях связанных с невозможностью дренирования (многокамерные абсцессы, уплотнение и кальцификация капсулы и их содержимого и т.д.) (рис. 21-7). Техника удаления посттравматических абсцессов головного мозга проводится по общепринятым принципам. После проведения этапа трепанации, твердая мозговая оболочка вскрывается овальным или крестообразным разрезом. В проекции локализации абсцесса (данные КТ-МРТ) проводится его пункция. По достижению абсцесса и получению гнойного содержимого (забор для микробиологического изучения) проводится частичное его опорожнение с промыванием полости растворами антисептиков. По мере опорожнения абсцесса проводится щадящая энцефалотомия по направлению пункционного канала до достижения капсулы абсцесса. Выделение последней тщательно контролируется во избежания ее повреждения и попадания содержимого в рану. Последовательные этапы хирургии проводятся с использованием операционного микроскопа и микрохирургического инструментария. После удаления капсулы, гемостаза, образовавшаяся полость обрабатывается растворами антисептиков и дренируется. Твердая мозговая оболочка ушивается, костный лоскут фиксируется и проводится послойное ушивание раны. В послеоперационном периоде проводится антибактериальная терапия с учетом чувствительности микрофлоры. Рис. 21-6. Пункционное дренирование посттравм этического абсцесса левой заднелобно-теменной области: 1. КТ спустя месяц после тяжелой ЧМТ (резекционная трепанация с удалением внутримозговой гематоты левой лобной доли); 2. 4 сутки после пунк-иионного дренирования; 3. 20 сутки после операции, гиподенсивная зона в области удаленного абсцесса. Рис. 21-7. Тотальное удаление посттравматического абсцесса левой лобной доли (1. До операции; 2. Спустя 2,5 недели после операции). Различные осложнения в раннем послеоперационном периоде после пункционного дренирования и тотального удаления посттравматических абсцессов часты и отмечаются у трети больных. Послеоперационные интракраниальные осложнения, по данным Института нейрохирургии, наблюдаются у пятой части больных с ПА. Наиболее частым видом из них гнойно-воспалительные осложнения (менингоэнцефалит, вентрикулит). Клиническая картина этих осложнений типична и характеризуется развитием менингеального симпто-мокомплекса на фоне гипертермии, с ликворологическими изменениями — наличием цитоза в ликворе преимущественно нейтрофильного характера. Консервативное антибактериальное лечение осложнений лечение проводится с учетом результатов микробиологических исследований (посевы ликвора) и чувствительности микрофлоры. Внечерепные осложнения наблюдаются реже, характер и развитие их зависят от преморбидного состояния больных, возраста, клинической фазы и ряда других факторов. Тщательный анамнез и учет соматического состояния позволяет корригировать и снизить количество возможных экстракраниальных осложнений Летальные исходы при хирургическом лечение посттравматических абсцессов колеблются в широких пределах от 0 до 34 % и более. Летальность по мнению ряда авторов, находится в зависимости от исходного состояния больных и, в первую очередь, от угнетения сознания. В наблюдениях Института нейрохирургии летальность при хирургическом лечение ПА составила 10 %. Основными причинами летальных исходов явилось сочетание экстра и интракраниальных факторов Показаниями для проведения консервативного лечения ПА являются малые их размеры (до 2,0 см в диаметре), небольшие сроки после ЧМТ, недостаточно сформированная капсула абсцессов по данным КГ (рис. 21-8). Консервативное лечение включает длительное применение антибактериальных препаратов широкого спектра действия (1 — 1,5 месяца), воздействующих на грамм-положительную и грамм-отрицательную флору (сочетание цефалоспоринов с аминогликозидами), а также использование кортикостероидов (дексазон 8 — 24 мг/сутки). Роль последних в лечение ПТА до конца не определена. При их применении наблюдается снижение перифокального отека, ответной выработки лейкоцитов, замедление инкапсуляции и улучшение условий проникновение антибиотиков, одновременно отмечается снижение контрастирования капсулы на КТ. Использование кортикостероидов показано в случаях, когда ПА сопровождаются выраженным перифокальным отеком. Проведение консервативного лечения требует постоянного динамического КТ контроля. Данные литературы свидетельствуют о сохраняющихся высоких цифрах летальности при лечении ПА (16, 55, 73, 81, 94, 106). Тенденция улучшения исходов связывается с использованием малоинвазивных и в ряде случаев консервативных методов лечения, о чем свидетельствуют результаты Института нейрохирургии. Детальное рассмотрение качества жизни, структуры летальных исходов выявляет преимущества малоинвазивного метода хирургии ПА. Более тяжелое предоперационное состояние, обусловленное менингоэнцефалитом, сопровождается достоверной разницей в исходах — в виде снижения частоты грубой инвалидизации после операции при дренировании по сравненинию с тотальным удалением абсцессов. Интракраниальные причины летальных исходов и их сочетание с экстракраниальными значительно реже присутствуют при пункционном методе хирургического лечения. Исходы консервативного лечения ПА (хорошее восстановление у трети больных, отсутствие летальных исходов) позволяют расширить показания к его применению при небольших размерах абсцессов, малых сроках после ЧМТ в условиях недостаточно сформированных капсул по данным КТ. В катамнезе увеличение хороших исходов чаше наблюдается у больных после пункционного дренирования. Таким образом, малоинвазивная хирургия (по исходам лечения абсцессов в ближайшем и отдаленном периодах) лежит в основе современного подхода к лечению ПА. Посттравматические абсцессы остаются наиболее сложными и опасными видами гнойно-воспалительных осложнений ЧМТ, о чем свидетельствуют наблюдения Института нейрохирургии и данные литературы. Анализ факторов риска развития абсцессов выявил, что основными из них являются характер ЧМТ (открытые проникающие травмы головы (р К ушибам головного мозга относят возникшие в результате травмы очаговые макроструктурные повреждения его вещества. В большинстве случаев являются осложнением гипертонической болезни и атеросклероза. Реже обусловливаются болезнями клапанного аппарата сердца, инфарктом миокарда, выраженными аномалиями сосудов мозга, геморрагическим синдромом и артериитами. Выделяют ишемический и геморрагический инсульты, а также п. источник Абсцесс головного мозга — это ограниченное скопление гноя в полости черепа. Различают три вида абсцессов: внутримозговые, субдуральные и эпидуральные. Симптомы абсцесса головного мозга зависят от его месторасположения и размеров. Они не являются специфичными и могут составлять клинику любого объемного образования. Диагностируется абсцесс головного мозга по данным КТ или МРТ головного мозга. При абсцессах небольшого размера подлежат консервативному лечению. Абсцессы, расположенные вблизи желудочков головного мозга, а также вызывающие резкий подъем внутричерепного давления, требуют хирургического вмешательства, при невозможности его проведения — стереотаксической пункции абсцесса. Абсцесс головного мозга — это ограниченное скопление гноя в полости черепа. Различают три вида абсцессов: внутримозговые (скопление гноя в веществе мозга); субдуральные (расположенные под твердой мозговой оболочкой); эпидуральные (локализованные над твердой мозговой оболочкой). Основными путями проникновения инфекции в полость черепа являются: гематогенный; открытая проникающая черепно-мозговая травма; гнойно-воспалительные процессы в придаточных пазухах носа, среднем и внутреннем ухе; инфицирование раны после нейрохирургических вмешательств. Причиной образования гематогенных абсцессов головного мозга чаще всего являются воспалительные процессы в легких (бронхоэктатическая болезнь, эмпиема плевры, хроническая пневмония, абсцесс легкого). В таких случаях бактериальным эмболом становится фрагмент инфицированного тромба (из сосуда на периферии воспалительного очага), который попадет в большой круг кровообращения и потоком крови разносится в сосуды мозга, где и фиксируется в мелких сосудах (прекапилляре, капилляре или артериоле). Незначительную роль в патогенезе абсцессов могут играть хронический (или острый) бактериальный эндокардит, инфекции ЖКТ и сепсис. В случае открытой проникающей черепно-мозговой травмы абсцесс мозга развивается вследствие прямого попадания инфекции в полость черепа. В мирное время доля таких абсцессов составляет 15-20%. В условиях боевых действий она возрастает в разы (минно-взрывные ранения, огнестрельные ранения). При гнойно-воспалительных процессах в придаточных пазухах носа (синусит), среднем и внутреннем ухе возможны два пути распространения инфекции: ретроградный — по синусам твердой мозговой оболочки и мозговым венам; и непосредственное проникновение инфекции через твердую оболочку мозга. Во втором случае отграниченный очаг воспаления первоначально формируется в мозговых оболочках, а затем — в прилежащем отделе мозга. Абсцессы мозга, формирующиеся на фоне интракраниальных инфекционных осложнений после нейрохирургических вмешательств (вентрикулиты, менингиты), возникают, как правило, у тяжелых, ослабленных больных. Среди выделенных возбудителей гематогенных абсцессов головного мозга преобладают стрептококки, часто в ассоциации с бактериотидами (Bacteroides spp.). Для гематогенных и отогенных абсцессов характерны Enterobacteriaceae (в том числе Proteus vulgaris). При открытой проникающей черепно-мозговой травме в патогенезе абсцесса мозга преобладают стафилококки (St. aureus), реже Enterobacteriaceae. При различных иммунодефицитных состояниях (иммунодепрессивная терапия после трансплантации органов и тканей, ВИЧ-инфекция) из посева содержимого абсцесса головного мозга выделяют Aspergillus fumigatus. Однако идентифицировать возбудителя инфекции в содержимом абсцесса мозга довольно часто не представляется возможным, так как в 25-30 % случаев посевы содержимого абсцесса оказываются стерильными. Формирование абсцесса мозга проходит в несколько этапов.
На сегодняшний день патогномоничная симптоматика не выявлена. Клиническая картина при абсцессах головного мозга схожа с клинической картиной объемного образования, когда клинические симптомы могут варьироваться от головной боли до тяжелейших общемозговых симптомов, сопряженных с угнетением сознания и выраженными очаговыми симптомами поражения головного мозга. В некоторых случаях первым проявлением болезни становится эпилептиформный припадок. Могут наблюдаться менингеальные симптомы (при субдуральных процессах, эмпиеме). Эпидуральные абсцессы головного мозга зачастую ассоциируются с остеомиелитом костей черепа. Наблюдается прогредиентное нарастание симптоматики. Для диагностирования абсцесса головного мозга огромное значение имеет тщательный сбор анамнеза (наличие очагов гнойной инфекции, острое инфекционное начало). Наличие воспалительного процесса, сопряженного с появлением и усугублением неврологических симптомов — основание для дополнительного нейровизуализационного обследования. Точность диагностирования с помощью КТ головного мозга зависит от стадии формирования абсцесса. На ранних стадиях заболевания диагностика затруднена. На этапе раннего энцефалита (1-3 сутки) КТ определяет зону сниженной плотности неправильной формы. Введенное контрастное вещество накапливается неравномерно, преимущественно периферических отделах очага, реже в центре. На более поздних этапах энцефалита контуры очага приобретают ровные округлые очертания. Контрастное вещество распределяется равномерно, по всей периферии очага; плотность центральной зоны очага при этом не меняется. Однако на повторной КТ (через 30-40 минут) определяется диффузия контраста в центр капсулы, а также наличие его и в периферической зоне, что не характерно для злокачественных новообразований. Инкапсулированный абсцесс мозга на КТ имеет вид округлого объемного образования с четкими ровными контурами повышенной плотности (фиброзная капсула). В центре капсулы зона пониженной плотности (гной), по периферии видна зона отека. Введенное контрастное вещество накапливается в виде кольца (по контуру фиброзной капсулы) с небольшой прилежащей зоной глиоза. На повторной КТ (через 30-40 минут) контрастное вещество не определяется. При исследовании результатов компьютерной томографии следует учесть, что противовоспалительные препараты (глюкокортикостероиды, салицилаты) в значительной степени влияют на скопление контраста в энцефалитическом очаге. МРТ головного мозга — более точный метод диагностирования. При проведении МРТ на первых стадиях формирования абсцесса мозга (1-9 сутки) энцефалитический очаг выглядит: на Т1-взвешенных изображениях — гипоинтенсивным, на Т2-взвешенных изображениях — гиперинтенсивным. МРТ на поздней (капсулированной) стадии абсцесса головного мозга: на Т1-взвешенных изображениях абсцесс выглядит, как зона пониженного сигнала в центре и на периферии (в зоне отека), а по контуру капсулы сигнал гиперинтенсивный. На Т2-взвешенных изображениях центр абсцесса изо- или гипоинтенсивный, в периферической зоне (зоне отека) гиперинтенсивный. Контур капсулы четко очерчен. Дифференциальная диагностика абсцесса головного мозга должна проводиться с первичными глиальными и метастатическими опухолями полушарий мозга. При сомнениях в диагнозе следует проводить МЗ-спектроскопия. В таком случае дифференциация будет основываться на различном содержании аминокислот и лактата в опухолях и абсцессах головного мозга. Иные способы диагностики и дифференциальной диагностики абсцесса головного мозга малоинформативны. Увеличение СОЭ, повышенное содержание С-реактивного белка в крови, лейкоцитоз, лихорадка — симптомокомплекс практически любых воспалительных процессов, включая внутричерепные. Бакпосевы крови при абсцессах головного мозга в 80-90% стерильны. На энцефалитической стадии абсцесса (анамнез – до 2 недель), а также в случае небольшого абсцесса головного мозга (до 3 см в диаметре) рекомендовано консервативное лечение, основой которого должна стать эмпирическая антибактериальная терапия. В некоторых случаях возможно проведение стереотаксической биопсии в целях окончательной верификации диагноза и выделения возбудителя. Абсцессы, вызывающие дислокацию мозга и повышение внутричерепного давления, а также локализованные в зоне желудочковой системы (попадание гноя в желудочковую систему зачастую приводит к летальным исходам) — абсолютные показания к хирургическому вмешательству. Травматические абсцессы головного мозга, расположенные в зоне инородного тела также подлежат хирургическому лечению, так как данный воспалительный процесс не поддается консервативному лечению. Несмотря на неблагоприятный прогноз, грибковые абсцессы также являются абсолютным показанием к хирургическому вмешательству. Противопоказанием к хирургическому лечению являются абсцессы мозга, расположенные в жизненно важных и глубинных структурах (зрительный бугор, ствол мозга, подкорковые ядра). В таких случаях возможно проведение стереотаксического метода лечения: пункция абсцесса мозга и его опорожнение с последующим промыванием полости и введением антибактериальных препаратов. Возможно как однократное, так и многократное (через установленный на несколько суток катетер) промывание полости. Тяжелые соматические заболевания не являются абсолютным противопоказанием к проведению хирургического лечения, так как стереотаксическая операция может проводиться и под местной анестезией. Абсолютным противопоказанием к проведению операции может быть только крайне тяжелое состояние пациента (терминальная кома), так как в таких случаях любое оперативное вмешательство противопоказано. Целью эмпирической (в отсутствии посева или при невозможности выделения возбудителя) антибактериальной терапии является покрытие максимально возможного спектра возбудителей. В случае абсцесса головного мозга без черепно-мозговой травмы или нейрохирургического вмешательства в анамнезе показан следующий алгоритм лечения: ванкомицин; цефалоспорины III поколения (цефотаксим, цефтриаксон, цефиксим); метронидазол. В случае посттравматического абсцесса головного мозга метронидазол заменяют на рифампицин. Возбудителем абсцесса головного мозга у пациентов с иммунодефицитными состояниями (кроме ВИЧ) чаще всего является Cryptococcus neoformans, реже Сandida spp или Aspergillius spp. Поэтому в данных случаях назначают амфоретицин В или липосомальный амфоретицин В. В случае исчезновение абсцесса (по данным нейровиуализационных исследований) назначают флуконазол в течение 10 недель, впоследствии дозу уменьшают вдвое и оставляют в качестве поддерживающей. У пациентов с ВИЧ возбудителем абсцесса головного мозга чаще всего является Toxoplasma gondii, поэтому эмпирическое лечение таких пациентов должно включать в себя сульфадиазин с пириметамином. После выделения возбудителя из посева лечение необходимо изменить, учитывая антибиотикограмму. В случае стерильного посева следует продолжить эмпирическую антибактериальную терапию. Продолжительность интенсивной антибактериальной терапии — не менее 6 недель, после этого рекомендуется сменить антибиотики на пероральные и продолжить лечение еще 6 недель. Назначение глюкокортикоидов оправдано только в случае адекватной антибактериальной терапии, так как только при положительном прогнозе глюкокортикоиды могут вызвать уменьшение выраженности и обратное развитие капсулы абсцесса головного мозга. В иных случаях их применение может вызвать распространение воспалительного процесса за пределы первичного очага. Основными методами хирургического лечения внутримозговых абсцессов являются простое или приточно-отточное дренирование. Их суть заключается в установке в полость абсцесса катетера, через который осуществляется эвакуация гноя с последующим введением антибактериальных препаратов. Возможна установка второго катетера меньшего диаметра (на несколько суток), через который проводится инфузия раствора для промывания (чаще всего, 0,9 % раствора хлорида натрия). Дренирование абсцесса необходимо сопровождать антибактериальной терапией (сначала эмпирической, далее — с учетом чувствительности к антибиотикам выделенного патогена). Стереотаксическая аспирация содержимого абсцесса без установки дренажа — альтернативный метод хирургического лечения абсцесса головного мозга. Главные его преимущества — снисходительные требования к квалификации медперсонала (для контроля над функционированием приточно-отточной системы необходимы пристальное внимание и специальные знания) и меньший риск вторичного инфицирования. Однако в 70% использования данного метода возникает необходимость повторных аспираций. В случае множественных абсцессов головного мозга необходимо в первую очередь дренировать очаг, наиболее опасный в отношении осложнений (прорыв гноя в желудочковую систему, дислокация мозга), а также наиболее значимый в клинической картине. В случае эмпиемы или субдурального абсцесса головного мозга применяют дренирование, не используя приточно-отточную систему. В прогнозировании абсцессов головного мозга большое значение имеет возможность выделить возбудителя из посева и определить его чувствительность к антибиотикам, только в этом случае возможно проведение адекватной патогенетической терапии. Кроме этого, исход заболевания зависит от количества абсцессов, реактивности организма, адекватности и своевременности лечебных мероприятий. Процент летальных исходов при абсцессах головного мозга — 10%, инвалидизации — 50%. Почти у трети выживших пациентов последствием заболевания становится эпилептический синдром. При субдуральных эмпиемах прогнозы менее благоприятны из-за отсутствия границ гнойного очага, так это свидетельствует высокой вирулентности возбудителя, либо о минимальной сопротивляемости пациента. Летальность в таких случаях — до 50%. Грибковые эмпиемы в сочетании с иммунодефицитными состояниями в большинстве случаев (до 95%) приводят к летальному исходу. Эпидуральные эмпиемы и абсцессы головного мозга обычно имеют благоприятный прогноз. Проникновение инфекции через неповрежденную твердую мозговую оболочку практически исключено. Санация остеомиелитического очага позволяет устранить эпидуральную эмпиему. Своевременное и адекватное лечение первичных гнойных процессов, а также полноценная первичная обработка ран при ЧМТ позволяют в значительной степени снизить возможность развития абсцесса головного мозга. источник |
 Согласно этиологической классификации выделяют следующие виды абсцесса головного мозга:
Согласно этиологической классификации выделяют следующие виды абсцесса головного мозга: Антибактериальная терапия — использование антибиотиков широкого спектра действия из группы цефалоспоринов, макролидов, фторхинолонов, защищенных пенициллинов, противогрибковых препаратов. Больным назначают «Цефтриаксон», «Метронидазол», «Ванкомицин», «Левомицетин», «Амфотерицин», «Флуконазол». После получения результатов анализа на чувствительность выделенного микроба к антибиотикам лечение необходимо подкорректировать.
Антибактериальная терапия — использование антибиотиков широкого спектра действия из группы цефалоспоринов, макролидов, фторхинолонов, защищенных пенициллинов, противогрибковых препаратов. Больным назначают «Цефтриаксон», «Метронидазол», «Ванкомицин», «Левомицетин», «Амфотерицин», «Флуконазол». После получения результатов анализа на чувствительность выделенного микроба к антибиотикам лечение необходимо подкорректировать.