Оптимальное лечение абсцесса головного мозга — сочетание антибактериальной терапии и хирургического вмешательства. При подозрении на абсцесс незамедлительно проводят КТ или МРТ . Каждая стадия абсцесса характеризуется особыми признаками на КТ, и поэтому данные КТ определяют тактику лечения. В 1971 г. было показано, что раннее назначение антибиотиков может привести к разрешению церебрита без хирургического вмешательства и предотвратить формирование инкапсулированного абсцесса. Сообщалось и об успешном консервативном лечении инкапсулированных абсцессов. Однако анализ этих случаев показал, что они характеризуются следующими особенностями: диагностика и наблюдение за течением заболевания осуществлялись с помощью КТ; аспирационная биопсия и гистологическое исследование не проводились; высокие дозы антибиотиков назначали длительно (например, более 8 нед); доказательства инкапсуляции, как правило, отсутствовали.
Сегодня на основании экспериментов на животных и четко установленных КТ-признаков разных стадий абсцесса можно утверждать, что на самом деле происходило излечение абсцесса на стадии церебрита .
В большинстве случаев успешное лечение абсцесса головного мозга невозможно без тесного взаимодействия невропатологов и нейрохирургов. Рекомендации по антибактериальной терапии абсцесса головного мозга основаны как на микробиологических данных, так и на исследованиях на животных и человеке, определивших особенности проникновения антибиотиков в вещество мозга и внутрь абсцесса. К сожалению, проспективные рандомизированные исследования, позволяющие выбрать наиболее эффективный антибиотик, отсутствуют. Если на КТ выявлен церебрит и состояние больного стабильно, то назначают антибиотики и наблюдают больного. В начале 60-х гг. при абсцессе головного мозга у взрослых стали назначать бензилпенициллин (20-24 млн ед/сут в/в) в сочетании с хлорамфениколом (1-1,5 г в/в каждые 6 ч). Бензилпенициллин остается основой терапии по следующим причинам: он очень эффективен в отношении стрептококков (в том числе комплекса Streptococcus intermedius ), которые часто вызывают абсцессы мозга при прямом распространении инфекции или заболеваниях легких; он эффективен в отношении большинства анаэробных возбудителей абсцесса головного мозга; его высокая эффективность доказана на животных; с началом использования пенициллина в 40-х гг. смертность от абсцесса головного мозга существенно снизилась.
Вместо бензилпенициллина можно назначать цефотаксим в высоких дозах (например, 3 г в/в каждые 8 ч) в сочетании с препаратом, активным в отношении анаэробной микрофлоры (например, метронидазолом ). Применение в прошлом хлорамфеникола было продиктовано его хорошей жирорастворимостью, благодаря которой его концентрация в головном мозге часто превышала таковую в плазме, а также высокой активностью в отношении анаэробных бактерий, включая Bacteroides fragilis . В последние годы вместо хлорамфеникола почти всегда назначают метронидазол : он обладает бактерицидным действием в отношении Bacteroides fragilis ( хлорамфеникол — бактериостатическим); он хорошо проникает внутрь абсцесса; концентрация метронидазола в абсцессе, в отличие от ряда других антимикробных средств, не снижается на фоне глюкокортикоидов; в исследованиях на экспериментальных абсцессах брюшной полости показано, что в гное хлорамфеникол теряет активность в результате деацетилирования; последние ретроспективные исследования показали, что метронидазол снижает летальность при абсцессе головного мозга. Видимо, при лечении метронидазолом летальность ниже и выздоровление наступает быстрее, чем при лечении хлорамфениколом, но проспективных, рандомизированных сравнительных испытаний этих препаратов не проводилось.
Как бы то ни было, метронидазол и другие препараты, активные в отношении анаэробной микрофлоры (например, ампициллин/сульбактам ) показаны при абсцессе головного мозга, возникшем на фоне среднего отита , мастоидита или абсцесса легкого . Метронидазол всегда сочетают с другими антимикробными препаратами.
Возбудителем абсцесса мозга на фоне фронтита или этмоидита редко бывает Bacteroides fragilis , поэтому в таких случаях часто нет необходимости добавлять к бензилпенициллину препараты, действующие на анаэробную микрофлору. Однако эмпирическая терапия до получения результатов бактериологического исследования должна включать по крайней мере два препарата. При подозрении на стафилококковую этиологию (например, после черепно-мозговой травмы или нейрохирургического вмешательства) назначают нафциллин или оксациллин (1,5- 2 г в/в каждые 4 ч). При аллергии к пенициллинам или выделении метициллиноустойчивых штаммов назначают ванкомицин . В Европе широко используют фузидиевую кислоту ; в США она не применяется.
Отогенные абсцессы часто бывают обусловлены аэробными грамотрицательными палочками , поэтому до получения результатов бактериологического исследования дополнительно назначают цефалоспорины третьего поколения или триметоприм/сульфаметоксазол . Поскольку возбудителем хронического среднего отита часто бывает Pseudomonas aeruginosa , препаратом выбора в таких случаях является цефтазидим . По последним данным, цефотаксим эффективен и в отношении стрептококков , поэтому в стандартных схемах им заменяют бензилпенициллин , сочетая его, например, с метронидазолом .
Остается неясным, целесообразно ли введение антибиотиков в полость абсцесса во время аспирации.
Нередко назначают глюкокортикоиды , но единого мнения в этом отношении нет. Глюкокортикоиды затрудняют проникновение антибиотиков в головной мозг, уменьшают образование коллагена и глии и тем самым препятствуют инкапсуляции абсцесса. Кроме того, они уменьшают контрастность ободка повышенной плотности из-за уменьшения перифокального отека. В экспериментах на животных глюкокортикоиды не снижали летальность при абсцессе головного мозга. Показанием для назначения глюкокортикоидов при абсцессе мозга служит доказанное или предполагаемое повышение ВЧД . При этом желателен мониторинг ВЧД. При его повышении применяют также маннитол и ИВЛ в режиме гипервентиляции. Кроме того, при подозрении на абсцесс мозга профилактически назначают противосудорожные средства .
источник
Как бы ни называли сопровождаемое некрозом и расплавлением тканей воспаление – нарывом, гнойником или абсцессом – воспалительный процесс и нагноение в 99% случаев вызваны бактериальной инфекцией, справиться с которой помогают антибиотики при абсцессе.
Воспаление в виде абсцесса – ограниченной пиогенной мембраной полости, содержащей гнойный экссудат – результат местной защитной реакции организма: тканевые макрофаги и лейкоцитарные нейтрофилы устремляются к месту заражения и поглощают бактерии, но при этом погибают и вместе с отмершими клетками образуют гной.
Главной причиной образования таких очагов воспаления считаются грамположительные факультативно анаэробные бактерии рода Staphylococcus spp., в первую очередь, золотистый стафилококк (Staphylococcus aureus). Однако очень часто к образованию пиогенного абсцесса причастно сразу несколько разновидностей бактерий – грамположительных и грамположительных, аэробных и анаэробных.
И антибиотики при гнойных абсцессах применяются при выявлении в гнойном содержимом: Staphylococcus epidermidis, Streptococcus pyogenes, Streptococcus pneumoniae, Pseudomonas aeruginosa (синегнойной палочки), Escherichia coli (кишечной палочки), Klebsiella pneumoniae, Proteus mirabilis.
Показания к применению антибактериальных средств при абсцессах горла, окологлоточного пространства и легкого, а также одонтогенных нагноений обусловлены и наиболее вероятным присутствием таких анаэробных бактерий и бактероидов, как Peptostreptococcus spp., Clostridium perfringens, Clostridium septicume, Prevotella melaninogenica, Bacteroides fragilis и Bacteroides oralis.

Цефотаксим и Цефоперазон выпускаются в форме порошка (во флаконах) для приготовления раствора, используемого для парентерального введения.
Форма выпуска Клиндамицина: капсулы (по 75, 150 и 300 мг), 15% раствора фосфата (в ампулах по 2, 4 и 6 мл); гранул (во флаконах) – для приготовления сиропа для детей.
Джозамицин – таблетки и суспензия, Доксициклин – капсулы.
Амоксиклав: таблетки (250 и 500 мг), порошок для приготовления суспензии для приема внутрь и порошок для приготовления инъекционного раствора.
Корреляция назначаемого препарата и локализации гнойного очага минимальна, а вот определение конкретного возбудителя имеет решающее значение. Антибиотики при абсцессе легкого должны назначаться с учетом того, что в развитии абсцедирующей пневмонии главную роль играет Staphylococcus aureus, поэтому эффективнее всего с ним будут бороться циклоспориновые антибиотики III поколения и линкозамиды.
Кроме них, антибиотики при абсцессе мягких тканей могут включать препараты группы макролидов.
Антибиотики при абсцессе ягодицы не применяются, когда воспаление возникло в месте инъекции и при этом бактериальная инфекция отсутствует, то есть абсцесс является асептическим (а его лечат кортикостероидами). Но в остальных случаях после вскрытия гнойника и его дренирования используют антибиотики, как правило, пенициллиновые производные.
Препараты для этиологического лечения паратонзиллярного абсцесса, то есть антибиотики при абсцессе горла должны проявлять активность в отношении Staphylococcus aureus, Streptococcus pyogenes, Klebsiella spp., Proteus spp., Escherichia coli. Это могут быть как пенициллиновые антибиотики с расширенным спектром воздействия, так и макролиды. А вот антибиотики группы тетрациклина и аминогликозиды при гнойниках в горле вряд ли помогут.
Антибактериальная терапия ретрофарингеального абсцесса, то есть лечение заглоточного абсцесса антибиотиками проводится с учетом инфекции, типичной для этого заболевания: стафилококков, пептострептококков и бактероидов. И в данном случае максимальный эффект будет от цефалоспоринов и комбинации пенициллинов с клавулановой кислотой.
К развитию одонтогенных абсцессов (пародонтального или периапикального), как правило, причастна Pseudomonas aeruginosa (синегнойная палочка) и анаэробы. Поэтому, назначая антибиотики при абсцессе зуба, врачи должны иметь в виду, что на анаэробные бактерии не действует аминогликозиды, а P. aeruginosa проявляет резистентность не только к аминогликозидам, но и к пенициллиновым бета-лактамам.
В данном обзоре представлены названия антибактериальных препаратов, которые чаще всего применяются в лечении абсцессов:
- цефалоспориновые антибиотики III поколения Цефотаксим, Цефоперазон (Церазон, Цефобоцид, Медоцеф, Цеперон и др. торговые названия);
- антибиотики группы линкозамидов Клиндамицин (Клиндацин, Клинимицин, Клеоцин, Далацин), Линкомицин;
- макролид Джозамицин (Вильпрафен);
- тетрациклиновый антибиотик широкого спектра действия Доксициклин (Вибрамицин, Доксацин, Доксилин, Новациклин, Медомицин);
- Амоксиклав (Амоксил, Аугментин, Ко-амоксиклав, Клавамокс) из группы пенициллиновых бета-лактамов.

Все цефалоспорины, в том числе Цефотаксим и Цефоперазон, уничтожают микроорганизмы, блокируя ферменты бактерий, необходимые для выработки углеводных компонентов стенок их клеток – мукопептидов (пептидогликанов). Таким образом, клетки бактерий лишаются наружной защиты и погибают. Аналогична фармакодинамика Амоксиклава, защищенного от бета-лактамаз бактерий клавулановой кислотой.
В основе действия линкозамидов (Клиндамицина), макролидов (Джозамицина), а также тетрациклинов (Доксициклина и других усовершенствованных препаратов данной группы) лежит их способность связываться с молекулами РНК (цитоплазматическими рибосомами) на мембранах бактерий – с нуклеотидными субъединицами 30S, 50S или 70S. В результате происходит замедление и практически полное прекращение биосинтеза белков в бактериальных клетках. В первом случае препараты действуют как бактериостатики, во втором – бактерицидно.

После введения в мышцу или в/в Цефотаксим и Цефоперазон попадают в системный кровоток с достижением максимальной концентрации – соответственно, через полчаса и пять минут (и сохраняется в течение 12-ти часов после однократного применения); связывание с протеинами плазмы не превышает 40%. Из организма цефалоспорины выводятся почками и кишечником с Т1/2 – 60-90 минут.
Биологическая доступность Клиндамицина доходит до 90%, и препарат попадает во все ткани и жидкости организма, а его наивысший уровень в крови отмечается в среднем через два часа после парентерального введения и максимум через час после приема внутрь.
Метаболизм препарата происходит в печени; элиминация через кишечник и почки; период полувыведения длится от двух до трех часов.
Фармакокинетика Джозамицина характеризуется быстрым всасыванием в желудке, высокой степенью проникновения и накоплением в мягких тканях, коже и подкожной клетчатке, небных миндалинах и легких; максимальная концентрация отмечается в среднем через 1,5 часа после приема таблеток или суспензии. При этом с белками плазмы крови связывается не более 15% активного вещества препарата. Расщепляется Джозамицин ферментами печени, а элиминируется с калом и мочой.
Быстро абсорбируется и антибиотик Доксициклин, 90% которого связывается с протеинами плазмы; через два часа после перорального приема концентрация препарата максимальная. Выведение через кишечник, Т1/2 может составлять 15-25 часов
Амоксиклав, состоящий из амоксициллин и клавулановой кислоты, достигает максимального уровня в крови через час – при любом способе применения; связывание амоксициллина с белками крови – до 20%, клавулановой кислоты – до 30%. Препарат проникает и накапливается в гайморовой полости, среднем ухе, легких, плевре и тканях внутренних половых органов. Метаболизм клавулановой кислоты происходит в печени, а продукты ее расщепления выводятся почками, кишечником и легкими. Почти 70% амоксициллина экскретируется почками в нерасщепленном виде.

источник
В настоящем разделе рассматриваются основные инфекции ЦНС бактериальной этиологии: менингиты, абсцесс головного мозга, субдуральная эмпиема и эпидуральный абсцесс.
Бактериальный менингит — воспаление мозговых оболочек, острое или хроническое, проявляющееся характерными клиническими симптомами и плеоцитозом СМЖ.
Заболеваемость бактериальным менингитом составляет в среднем около 3 случаев на 100 тыс. населения. В более чем 80% случаев бактериальные менингиты вызываются N.meningitidis, S.pneumoniae и H.influenzae.
В России N.meningitidis является причиной около 60% случаев бактериальных менингитов, S.pneumoniae — 30% и H.influenzae — 10%. Необходимо отметить, что в развитых странах после внедрения широкомасштабной вакцинации против H.influenzae типа B, заболеваемость бактериальным менингитом данной этиологии снизилась более чем на 90%.
Кроме того, бактериальный менингит может вызываться другими микроорганизмами (листериями, стрептококками группы B, энтеробактериями, S.aureus, и др.).
Возбудителями бактериального менингита могут быть спирохеты: при болезни Лайма у 10-15% пациентов в первые 2 нед после инфицирования имеется менингеальный синдром. В целом этиология во многом определяется возрастом и преморбидным фоном пациентов (табл. 2).
| Предрасполагающий фактор | Вероятные возбудители |
|---|---|
| Возраст | |
| 0-4 нед | S.agalactiae, E.coli, L.monocytogenes, K. pneumoniae, Enterococcus spp., Salmonella spp. |
| 4-12 нед | E.coli, L.monocytogenes, H.influenzae, S.pneumoniae, N.meningitidis |
| 3 мес-5 лет | H.influenzae, S.pneumoniae, N.meningitidis |
| 5-50 лет | S.pneumoniae, N.meningitidis |
| > 50 лет | S.pneumoniae, N.meningitidis, L.monocytogenes, Enterobacteriaceae |
| Иммуносупрессия | S.pneumoniae, N.meningitidis, L.monocytogenes, Enterobacteriaceae, P.aeruginosa |
| Перелом основания черепа | S.pneumoniae, H.influenzae, S.pyogenes |
| Травмы головы, нейрохирургические операции и краниотомия | S.aureus, S.epidermidis, Enterobacteriaceae, P.aeruginosa |
| Цереброспинальное шунтирование | S.epidermidis, S.aureus, Enterobacteriaceae, P.aeruginosa, P.acnes |
| Сепсис | S.aureus, Enterocococcus spp., Enterobacteriaceae, P.aeruginosa, S.pneumoniae |
Бактериальный менингит может возникать в стационаре после нейрохирургических или оториноларингологических операций, в этом случае в этиологии важную роль играет грамотрицательная (до 40%) и грамположительная флора (до 30%). Нозокомиальная флора, как правило, характеризуется высокой резистентностью и летальность при такой этиологии достигает 23-28%.
Успех лечения острого бактериального менингита зависит от целого ряда факторов и, в первую очередь, от своевременности и правильности назначения АМП. При выборе антибиотиков нужно помнить, что не все они хорошо проникают через ГЭБ (табл. 2).
Антимикробная терапия должна быть начата немедленно после постановки предварительного диагноза. Важно, чтобы люмбальная пункция и забор материала (СМЖ, кровь) для микробиологического исследования выполнялись до введения антибиотиков.
Выбор АМП проводится по результатам обследования, в том числе предварительной идентификации возбудителя после окраски мазков СМЖ по Граму и серологических экспресс-тестов.
Если быстрые методы диагностики не позволяют предварительно идентифицировать возбудителя, или по каким-либо причинам происходит задержка с выполнением люмбальной пункции, то антибактериальная терапия назначается эмпирически. Выбор АМП в данной ситуации диктуется необходимостью перекрыть весь спектр наиболее вероятных возбудителей (табл. 3).
| Предрасполагающий фактор | Препарат |
|---|---|
| Возраст | |
| 0-4 нед | Ампициллин + цефотаксим, ампициллин + гентамицин |
| 4-12 нед | Ампициллин + цефотаксим или цефтриаксон |
| 3 мес-5 лет | Цефотаксим или цефтриаксон + ампициллин + хлорамфеникол |
| 5-50 лет | Цефотаксим или цефтриаксон (+ ампициллин при подозрении на листерии), бензилпенициллин, хлорамфеникол |
| Старше 50 лет | Ампициллин + цефотаксим или цефтриаксон |
| Иммуносупрессия | Ванкомицин + ампициллин + цефтазидим |
| Перелом основания черепа | Цефотаксим или цефтриаксон |
| Травмы головы, состояния после нейрохирургических операций | Оксациллин + цефтазидим, ванкомицин + цефтазидим |
| Цереброспинальное шунтирование | Оксациллин + цефтазидим, ванкомицин + цефтазидим |
Антимикробная терапия может быть изменена при выделении возбудителя и получении результатов чувствительности (табл. 4).
| Возбудитель | Препараты выбора | Альтернативные препараты |
|---|---|---|
| H.influenzae β-лактамаза (-) |
Цефотаксим или цефтриаксон
Цефотаксим, цефтриаксон, цефепим,
хлорамфеникол
Цефепим, хлорамфеникол, азтреонам,
фторхинолоны
МПК пенициллина 2,0 мг/л
Бензилпенициллин или ампициллин
Цефотаксим или цефтриаксон
Ванкомицин + цефотаксим или цефтриаксон (+ рифампицин)
Цефотаксим, цефтриаксон, хлорамфеникол, ванкомицин
Меропенем, ванкомицин (+ рифампицин)
Меропенем
MSSA
MRSA
Оксациллин
Ванкомицин
Ванкомицин
Рифампицин, ко-тримоксазол
T.pallidum
B.burgdorferi
Бензилпенициллин
Цефтриаксон или цефотаксим
Цефтриаксон, доксициклин
Бензилпенициллин, доксициклин
При лечении используются максимальные дозы антибиотиков, что особенно важно при применении АМП, плохо проникающих через ГЭБ, поэтому необходимо строго придерживаться принятых рекомендаций (табл. 5). Особое внимание необходимо при назначении антибиотиков детям (табл. 6).
| Препарат | Суточная доза, в/в | Интервалы между введениями, ч |
|---|---|---|
| Азтреонам | 6-8 г | 6-8 |
| Амикацин | 15-20 мг/кг | 12 |
| Ампициллин | 12 г | 4 |
| Бензилпенициллин | 18-24 млн ЕД | 4 |
| Ванкомицин | 2 г | 6-12 |
| Гентамицин | 5 мг/кг | 8 |
| Ко-тримоксазол | 10-20 мг/кг (по триметоприму) | 6-12 |
| Меропенем | 6 г | 8 |
| Метронидазол | 1,5-2 г | 8 |
| Оксациллин | 9-12 г | 4 |
| Рифампицин | 0,6 г | 24 |
| Тобрамицин | 5 мг/кг | 8 |
| Хлорамфеникол | 4 г | 6 |
| Цефотаксим | 12 г | 6 |
| Цефтазидим | 6 г | 8 |
| Цефтриаксон | 4 г | 12-24 |
| Ципрофлоксацин | 1,2 г | 12 |
| Препарат | Суточная доза (интервал между введениями, ч) | ||
|---|---|---|---|
| Новорожденные (0-7 дней) | Новорожденные (8-28 дней) | Дети | |
| Амикацин | 15-20 мг/кг (12) | 20-30 мг/кг (8) | 20-30 мг/кг (8) |
| Ампициллин | 100-150 мг/кг (8-12) | 150-200 мг/кг (6-8) | 200-300 мг/кг (6) |
| Бензилпенициллин | 100-150 тыс. ЕД/кг (8-12) | 200 тыс. ЕД/кг (6-8) | 250-300 тыс. ЕД/кг (4-6) |
| Ванкомицин | 20 мг/кг (12) | 30-40 мг/кг (8) | 50-60 мг/кг (6) |
| Гентамицин | 5 мг/кг (12) | 7,5 мг/кг (8) | 7,5 мг/кг (8) |
| Ко-тримоксазол | 10-20 мг/кг (6-12) | ||
| Тобрамицин | 5 мг/кг (12) | 7,5 мг/кг (8) | 7,5 мг/кг (8) |
| Хлорамфеникол | 25 мг/кг (24) | 50 мг/кг (12-24) | 75-100 мг/кг (6) |
| Цефепим | 50 мг/кг (8) | ||
| Цефотаксим | 100 мг/кг (12) | 150-200 мг/кг (6-8) | 100 мг/кг (6-8) |
| Цефтазидим | 60 мг/кг (12) | 90 мг/кг (8) | 125-150 мг/кг (8) |
| Цефтриаксон | 80-100 мг/кг (12-24) | ||
* A.R. Tunkel, W.M. Scheld. Acute meningitis. In: Principles and practice of infectious diseases, 5 th Edition. Edited by: G.L. Mandell, J.E. Bennett, R. Dolin. Churchill Livingstone, 2000; p. 980
Основным путем введения АМП является в/в. По показаниям (вторичный бактериальный менингит на фоне сепсиса, особенно полимикробного, гнойные осложнения черепно-мозговых травм и операций и др.) можно сочетать в/в и эндолюмбальное введение (табл. 7). Эндолюмбально вводятся только АМП, плохо проникающие в СМЖ (аминогликозиды, ванкомицин). Препараты могут быть использваны в виде моно- или комбинированной терапии. Показанием для смены АМП является отсутствие положительной клинико-лабораторной динамики состояния пациента или появление признаков нежелательного действия препарата.
| Препарат | Доза |
|---|---|
| Гентамицин | 4-8 мг 1 раз в сутки |
| Тобрамицин | 4-8 мг 1 раз в сутки |
| Амикацин | 4-20мг 1 раз в сутки |
| Ванкомицин | 4-10 мг 1 раз в сутки |
Помимо соблюдения разовых и суточных доз АМП, при бактериальном менингите важна длительность их назначения.
Для лечения менингита, вызыванного спирохетами, используются препараты, имеющие соответствующий спектр активности (табл. 4).
В ряде инфекций, характеризующихся хроническим течением, возможно распространение процесса на оболочки мозга. В этом случае может возникать менингеальный синдром и изменяется состав СМЖ.
С точки зрения осложнений хронических инфекций наибольшую опасность представляет туберкулезный менингит. Несвоевременно начатое лечение этого менингита часто приводит к неблагоприятному исходу. Появление диагностических систем на основе ПЦР существенно сократило продолжительность обследования и значительно повысило эффективность лечения.
Поражение мозговых оболочек может наблюдаться и при других инфекциях: бруцеллезе, цистицеркозе, сифилисе, боррелиозе, кокцидиоидозе, гистоплазмозе, криптококкозе и др.
Лечение этого менингита определяется основным заболеванием. Очень часто выяснить этиологию процесса представляется практически невозможным. В этом случае наряду с продолжением поиска возбудителя используют так называемое пробное эмпирическое лечение. Так, например, при подозрении на туберкулезный менингит назначаются противотуберкулезные препараты и при появлении клинического улучшения курс терапии доводят до конца. При подозрении на кандидозную природу используется пробное лечение флюконазолом.
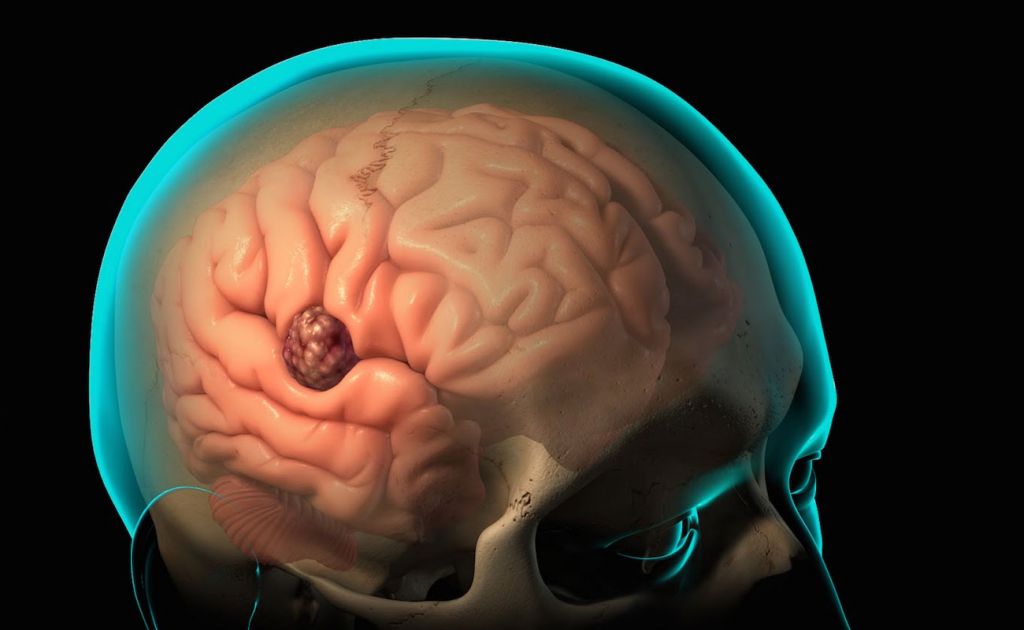
Абсцесс головного мозга — ограниченное капсулой скопление мозгового детрита, лейкоцитов, гноя и бактерий.
Этиологической причиной абсцесса головного мозга могут быть бактерии, грибы, простейшие и гельминты. Из бактериальных возбудителей наиболее частыми являются зеленящие стрептококки (S.anginosus, S.constellatus и S.intermedius), которые встречаются в 70% случаев. В 30-60% им сопутствуют другие бактерии. S.aureus высевается у 10-15% больных, часто в монокультуре, особенно при черепно-мозговой травме, инфекционном эндокардите. Анаэробы выделяются в 40-100%, причем в 20-40% это бактероиды или превотеллы. Энтеробактерии встречаются в 23-33% случаев, особенно часто при отогенном инфицировании или у больных с иммунологическими нарушениями.
При использовании иммуносупрессивной терапии, антибиотиков широкого спектра действия, кортикостероидов повышается риск развития абсцесса головного мозга грибковой этиологии. Как и при менингите, этиология абсцесса головного мозга зависит от преморбидного фона (табл. 8).
| Предрасполагающий фактор | Вероятные возбудители |
|---|---|
| Средний отит или мастоидит | Streptococcus spp., Bacteroides spp., Prevotella spp., Enterobacteriaceae |
| Синусит (лобной и клиновидной кости) | Streptococcus spp., Bacteroides spp., Enterobacteriaceae, S.aureus, H.influenzae |
| Одонтогенный сепсис | Fusobacterium spp., Prevotella spp., Bacteroides spp., Streptococcus spp. |
| Проникающая ЧМТ, нейрохирургические операции | S.aureus, Streptococcus spp., Enterobacteriaceae, Clostridium spp. |
| Абсцесс, эмпиема легких, бронхоэктатическая болезнь | Fusobacterium spp., Actinomyces spp., Bacteroides spp., Prevotella spp., Streptococcus spp., Nocardia spp. |
| Бактериальный эндокардит | S.aureus, Streptococcus spp. |
| Врожденные пороки сердца | Streptococcus spp., Haemophilus spp. |
| Нейтропения | Enterobacteriaceae, Aspergillus spp., Candida spp. |
| После трансплантации | Aspergillus spp., Candida spp., Enterobacteriaceae, Nocardia spp., T.gondii |
| ВИЧ-инфекция | T.gondii, Nocardia spp., Mycobacterium spp., L.monocytogenes, Cryptococcus spp. |
Данное заболевание требует наряду с хирургическим лечением применения АМП. До выяснения этиологии процесса антибактериальные средства назначаются эмпирически (табл. 9). После идентификации возбудителя может потребоваться смена антибиотиков. При лечении абсцесса головного мозга так же, как и при остром менингите, используются максимальные дозы препаратов (табл. 6).
| Предрасполагающий фактор | Препарат |
|---|---|
| Средний отит или мастоидит | Цефалоспорины III-IV поколения* + метронидазол |
| Синусит | Цефалоспорины III-IV поколения* + метронидазол + ванкомицин (при подозрении на присутствие MRSA) |
| Одонтогенный сепсис | Пенициллин + метронидазол |
| Проникающая ЧМТ, нейрохирургические операции | Ванкомицин + цефалоспорины III-IV поколения* |
| Абсцесс, эмпиема легких, бронхоэктатическая болезнь | Пенициллин + метронидазол + ко-тримоксазол |
| Бактериальный эндокардит | Ванкомицин + аминогликозид |
| Врожденные пороки сердца | Цефалоспорины III-IV поколения* |
| Причина не известна | Цефалоспорины III-IV поколения* + метронидазол + ванкомицин |
Субдуральная эмпиема — скопление гноя в субдуральном пространстве, в большинстве случаев являющееся следствием проникновения инфекции через эмиссарные вены. Наиболее часто возникает как осложнение синусита, отита, мастоидита, черепно-мозговой травмы, после хирургических вмешательств на черепе.
При субдуральной эмпиеме в 35% случаев выделяются стрептококки, в 17% — стафилококки. Другие микроорганизмы (S.pneumoniae, H.influenzae, энтеробактерии) обнаруживаются у 17% больных. Почти в 100% случаев в гнойном очаге присутствуют анаэробы, чаще всего бактероиды. При снижении иммунитета, особенно при ВИЧ-инфекции, субдуральную эмпиему могут вызывать сальмонеллы, грибы рода Candida, ассоциации микроорганизмов.
При лечении субдуральной эмпиемы параллельно с хирургическими методами назначаются АМП. Эмпирическая терапия сходна с таковой при абсцессе головного мозга (табл. 9). После идентификации возбудителя терапию либо продолжают, либо изменяют с учетом этиологии.
Эпидуральный абсцесс — инфекционный процесс, развивающийся между костями черепа и наружным листком твердой мозговой оболочки, может сопровождаться остеомиелитом. Вследствие того, что возбудитель легко проникает через твердую мозговую оболочку вдоль эмиссарных вен, эпидуральному абсцессу часто сопутствует субдуральная эмпиема.
Наиболее частой причиной возникновения эпидурального абсцесса являются синусит, мастоидит или трепанация черепа. Этиология сходна с таковой при субдуральной эмпиеме.
Как при абсцессе головного мозга.
У новорожденных детей возбудителями чаще являются стрептококки группы В, энтеробактерии и листерии. В связи с тем, что цефотаксим неактивен в отношении листерий, одновременно с ним детям применяют ампициллин, либо ампициллин в сочетании с аминогликозидами (обычно с гентамицином). Детям противопоказано использование ко-тримоксазола в первые 2 мес, фторхинолонов — до 16 лет. Цефепим разрешен для применения с 2-месячного возраста.
У детей по сравнению со взрослыми расширены показания к назначению при гнойных менингитах глюкокортикоидов, которые достоверно снижают летальность и частоту осложнений при менингите, вызванном H.Influenzae типа B. Применяют дексаметазон по 0,15 мг/кг каждые 6 ч в течение 2 сут. Первую дозу дексаметазона следует вводить в/в за 15 мин до первого введения АМП.
При выборе АМП у беременных необходимо учитывать его безопасность для плода: не рекомендуется использовать фторхинолоны в течение всего периода беременности, ко-тримоксазол противопоказан в I и III триместре. Аминогликозиды и ванкомицин допустимо применять только по жизненным показаниям. Основными препаратами являются пенициллины или цефалоспорины III поколения (цефотаксим).
Обязательна госпитализация пациентки с изоляцией от ребенка и с прекращением кормления грудью.
У людей пожилого возраста функция почек нередко снижена, что требует особой осторожности при использовании аминогликозидов. Следует помнить, что у таких пациентов выведение ванкомицина замедлено (период полувыведения составляет 7,5 дней). Отмечается также большая частота НР при применении ко-тримоксазола.
источник
Абсцесс головного мозга (АГМ) – это очаговое поражение высшего отдела ЦНС со скоплением гноя в мозговом веществе, ограниченным капсулой. Гнойный компонент образуется в результате попадания в структуры головного мозга бактерий, грибковой инфекции, простейших микроорганизмов.
Распространенными возбудителями абсцесса являются такие формы патогенных агентов, как стафилококки, стрептококки, менингококки, протеи, эшерихия коли и др. Зачастую диагностируется одновременно две и более бактерии, а также комбинация анаэробных и аэробных инфекций. При этом абсцесс может быть одиночным и множественным. Проникновение в мозговые ткани гноеродного источника происходит контактным, травматическим, гематогенным путем.
Гнойное поражение мозга – явление достаточно редкое, но опасное. На 100 тыс. человек, госпитализированных в неврологический стационар, приходится 1 случай с данной патологией. Опасность прогрессирующего абсцесса состоит в развитии тяжелых осложнений: угнетение функций ЦНС, судорожные припадки, гидроцефалия (водянка головного мозга), воспаление костных вместилищ мозга и пр. Определяются очень высокие риски инвалидности и смертности.
Несмотря на факт широкого внедрения бактерицидных препаратов мощного действия, успехи микробиологической и тепловизионной диагностики, медико-статистический показатель уровня заболеваемости остается относительно константным.
- Патология может развиться на любом этапе жизни, но согласно статистике, средний возраст пациентов составляет от 35 до 45 лет.
- Распространенность случаев абсцесса головного мозга среди мужского и женского населения идет в соотношении 2:1. То есть, мужчины в 2 раза чаще подвержены заболеванию, чем женщины.
- Из 100% больных около 25% составляют дети и подростки, не достигшие 15 лет. Заболеваемость у малышей до двух лет на практике встречается крайне редко, преимущественно на фоне перенесенного менингита с грамположительной флорой.
- На почве перенесенного отита среднего уха болезнь достигает пика развития у детей и взрослых старше 40 лет.
- Последствия различных форм синуситов в виде АГМ в основном наблюдаются у людей 10-30 лет.
- Абсцессы головного мозга – преобладающий вид внутричерепных инфекционных процессов у ВИЧ-инфицированных больных. При ВИЧ чаще всего его возбудителем является токсоплазма (до 30% случаев).
К сожалению, вероятность летального исхода не исключена: смерть по причине АГМ наступает у 10% пациентов. Патология может угрожать и инвалидизацией, которая возникает у 50% больных, даже после лечения. У 1/3 оставшихся в живых пациентов, последствием АГМ становится эпилептический синдром.
Благоприятную почву для внедрения инфекции в мозг создает снижение иммунитета в сочетании с наличием патогенного источника в организме. На фоне угнетенной иммунной системы получить осложнение в виде внутричерепного абсцесса возможно даже от ангины, гайморита или отита. Акцентируем, острые воспаления среднего или внутреннего уха и придаточных пазух носа в 45% случаев являются виновниками абсцессов ГМ. Кроме того, часто источниками заражения выступают:
- хронические инфекции легких – бронхоэктатическая болезнь, пиоторакс, абсцедирующая пневмония;
- остеомиелит костей;
- холецистит;
- инфекционные патологии ЖКТ;
- инфекции органов малого таза.
Несколько реже причинными факторами являются осложнения следующих патологий:
- бактериальный эндокардит;
- наследственный геморрагический ангиоматоз;
- ВПС – врожденные пороки сердца;
- бактериальный менингит (традиционно осложняется абсцессом у детей, у взрослых в основном нет).
Также абсцессы головного мозга могут образоваться из-за развившегося гнойного осложнения после плановой нейрохирургической операции или тяжелой ЧМТ. Как правило, их обуславливает ауреус стафилококк. Постоперационные последствия составляют примерно 0,5%-1,5% в общей структуре абсцессов головного мозга. При пенетрирующих черепно-мозговых травмах, то есть при открытых ранениях черепа с нарушением целостности твердой мозговой оболочки, риск инфицирования с развитием гнойно-септического патогенеза крайне высокий.
Заражение мозга гноеродными бациллами может осуществляться по одному из механизмов:
- контактным путем – прямой перенос инфицированного материала через область, примыкающую к остеиту/остеомиелиту, или ретроградный через вены-эмиссарии (н-р, при ЛОР-инфекциях остеомиелитах челюсти и др.);
- гематогенным (метастатическим) путем – диссеминация возбудителя происходит через кровеносное русло из отдаленной (первичной) зоны локализации инфекции (как вариант, при эндокардитах, легочных поражениях, урогенитальных, кишечных инфекциях и т. д.);
- травматическим способом – заражение нервной ткани при непосредственном взаимодействии раневой поверхности с внешней средой (это – местное посттравматическое и послехирургическое инфицирование).
Особенно стоит подчеркнуть, что в значительной мере подвержены такой болезни ослабленные люди, имеющие сложные диагнозы: сахарный диабет, рак, наркомания, СПИД.
Патогистология заболевания складывается из отдельных 4 этапов, или стадий. Итак, что же происходит в тканях головного мозга, когда в них вселяется и активизируется коварный патоген?
- Первый этап – ранняя инфильтрация. В течение первых 3 суток после попадания болезнетворного агента формируется слабо отграниченный диффузный очаг воспаления с деструкцией мозговой ткани и отечностью вокруг.
- Второй этап – поздний церебрит. Центр очагового воспаления на 4-9 день претерпевает нагноение и некротизацию, что сопровождается образованием полости. Полость заполняет полужидкий гнойный экссудат. По внешней части скапливаются фибропласты.
- Третья стадия – зарождение глиозной капсулы. С 10-13 суток начинается закладываться защитная капсула абсцесса. Так, отмечается интенсификация роста слоя фибропластов, окаймленного ободком неоваскуляризации. Вместе с этим отмечается реактивный астрорцитоз.
- Последний этап (4 ст.) – окончательное формирование капсулы. Капсулярная составляющая вокруг заполненной гнойной полости полноценно уплотняется (в этом принимает участие реактивный коллаген). Некротический фокус приобретает четкие очертания.
Дальнейшие процессы на последнем этапе зависят от вирулентности болезнетворной флоры, пути распространения, иммунного статуса пациента, уровня гипоксии пораженных мозговых структур. Правильность диагностических и лечебных мероприятий не в меньшей мере повлияет на степень прогрессии АГМ. Регрессировать болезнь самостоятельно, как правило, не может. Без адекватной терапии в подавляющем большинстве внутренний объем абсцесса увеличивается, не исключается и появление новых по периферии капсулы инфицированных участков.
Клинические признаки абсцесса головного мозга могут быть выражены по-разному – от жуткой головной боли до целого симптомокомплекса церебральных расстройств. Поле концентрации болевого синдрома в голове напрямую связано с локализацией гнойника. Но, заметим, локальные признаки могут быть не столь выраженными, а то и вообще отсутствовать. Подобное стечение ситуации препятствует своевременной диагностике, быстрому принятию специализированных мер терапии, от скорости которых зависит прогноз исхода. Симптоматика, которая должна послужить стимулом для немедленного обращения к врачу:
- интенсивные головные боли, они преимущественно бывают распирающего, давящего, пульсирующего характера в определенном месте (часто обостряются по утрам);
- лихорадочные явления с интоксикацией – озноб, гипертермия тела, тошнота, рвота, головокружения, упадок сил;
- гиперестезии различного вида – неприятные ощущения при прикосновении к коже, ползание мурашек и покалывание, непереносимость яркого света и шума;
- расстройство остроты зрения, проптоз глаза, отечность века, отек лица;
- нарушения со стороны органов слуха в виде ощущения звуков в ушах, снижения или обострения звукового восприятия;
- симптом Кернинга – невозможность разгибания нижней конечности из согнутого положения под углом 90 градусов в ТБС и коленном суставе;
- симптом Брудзинского – при пассивном сгибании одной ноги противоположная нога рефлекторно сгибается или при пассивном приведении головы вперед конечности невольно сгибаются;
- резкие болевые феномены по ходу тройничного и затылочного нерва, при надавливании на наружную стенку слухового прохода или на область скуловой кости;
- ригидность шейных мышц, затрудняющих опускание головы к груди и ее запрокидывание кзади;
- необъяснимые мышечные боли в конечностях, судороги, эпилептические припадки;
- нарушение сердечного и дыхательного ритма (брадикардия, рефлекс Кушинга), повышение систолического (верхнего) давления;
- нарастающее угнетение сознания с возможным падением в обморок, проблемы с координацией, заторможенность мозговой деятельности.
Каждый должен понимать, что подобные симптомы – не норма для организма, тем более, если они имеют тенденцию к повторению. Поэтому, чем недоволноваться и получить инвалидизирующие осложнения или подвергнуть себя смертельному риску, лучше лишний раз поволноваться и пройти дифференциальную диагностику. Если болезнь подтвердится, неотложно требуется квалифицированная медицинская помощь.
Подозревая заболевание, больного подвергают тщательным обследованиям для опровержения или установления факта его наличия на аргументированных основаниях. Необходимо учесть, что в позднем периоде клиническая картина сходна с клиникой опухолей головного мозга. Огромную роль в диагностике играет принцип дифференцирования. Он базируется на данных анамнеза об инфекционно-воспалительных заболеваниях пациента и применении методов визуализационного исследования.
Компьютерная томография с контрастом – основополагающий метод, позволяющий отличить гнойный патогенез в мозговых тканях от внутричерепных новообразований, установить точное место локализации, размер, вид и множественность очага, перифокальные признаки. В качестве вспомогательных приемов диагностики для уточнения диагноза применяются:
- магниторезонансное исследование;
- эхоэнцефалография;
- церебральная ангиография;
- абсцессография.
Пациенту выписывают направления на общие лабораторные анализы, которые являются обязательной частью любой программы диагностики. Но, как обозначают специалисты, лабораторные тесты, в отличие от нейровизуализационных способов, ключевой роли не играют в постановке диагноза. Например, СОЭ, высокие значения С-реактивного белка, повышенное содержание лейкоцитов характеризуют множество состояний организма, связанных с воспалениями и инфекциями. То есть, это не конкретизированные, а общеинфекционные показатели. Более того, посевы на бактериемию в доминирующем количестве (почти у 90% пациентов) в итоге оказываются стерильными.
Данная патология относится к проблеме нейрохирургического профиля, почти всегда ее лечат хирургическим путем. Обязательно оперативное вмешательство должно сочетаться с антибиотикотерапией. Нейрохирурги в зависимости от тяжести медицинской проблемы, показаний и противопоказаний применяют 3 способа хирургического устранения мозгового абсцесса.
- Простое приточно-отточное дренирование гнойной полости. Хирургическое вмешательство подразумевает выведение гноя через установленное в капсулу катетерное устройство. Процедура проводится под местной анестезией. После откачивания патологической жидкости, промывания полости физраствором выполняется введение бактерицидных лекарств. Лечение может продолжаться несколько суток, поэтому дренажные элементы не убираются до завершения терапии.
- Стереотаксическая биопсия внутримозговых абсцессов. Оперативное вмешательство осуществляется по аналогии с малоинвазивной процедурой дренирования. Но в данном случае используется пункционный метод. Полость очага пунктируют, промывают раствором антисептика и/или антибиотиком в жидкой форме определенной концентрации. Процедура подходит людям с глубоко расположенным патогенезом или пациентам в критичном состоянии, нуждающимся в экстренной лечебной помощи. Пункционная аспирация может также выступать частью подготовки к открытой операции.
- Классическая открытая операция удаления гнойного образования. Это – радикальная операция под контролем интраоперационного микроскопа, включающая «выпиливание» костного лоскута в проекции области нагноения, рассечение твердой мозговой оболочки. Сеанс проходит под общим наркозом. Через созданный доступ гнойную каверну частично опорожняют от патологической субстанции. Далее выполняется щадящая энцефалотомия с последующим выделением и резекцией капсулы. После капсулотомии и проведенного гемостаза операционное поле промывают антисептиком и дренируют. Твердую мозговую оболочку ушивают, черепной дефект закрывают костным лоскутом, последний фиксируется. Рассеченные кожные покровы сопоставляются и послойно ушиваются.
Консервативная инъекционная, пероральная антибиотикотерапия в усиленном и продолжительном режиме уместна сугубо в начале развития инфекционного процесса, когда прошло не более 14 суток. При этом размеры очага не должны превышать 2 см в диаметре, максимум 3 см, а проблемный участок не должен иметь признаков формирования капсулы.
На практике, все же специалисты чаще имеют дело уже с запущенной болезнью, имеющей отграничительную капсулу. Безоперационный подход здесь нецелесообразен, с проблемой борются исключительно при помощи выше озвученных оперативных вмешательств.
Нейрохирургию мозга – технически сложнейшее вмешательство на самом уязвимом органе ЦНС – следует доверять проверенным специалистам высокого уровня. Россия имеет незавидные позиции в данном направлении. Увы. Предпочтительнее оперироваться за границей, в клиниках, безупречно оснащенных передовыми кадрами (нейрохирургами, анестезиологами, реабилитологами и пр.), высокотехнологичным оборудованием для диагностики и хирургии. Это позволит вам рассчитывать на минимизацию вероятности развития интра- и послеоперационных последствий: остеомиелита черепных костей, эпилепсии, гидроцефалии, мозговой гематомы, парализации тела и т. д.
Центральный Военный Госпиталь г.Прага.
Отличная нейрохирургическая база, что подтверждают мировые эксперты и отзывы пациентов, находится в Чехии. Чешские медучреждения признаны передовыми по оказанию оперативной помощи больным с разными поражениями нервной системы, включая операции по поводу абсцессов головного мозга любой локализации и тяжести.
В Чехии все услуги хирургии – это продуманные инновационные тактики, которые предполагают безопасный доступ, комфортное и безболезненное перенесение манипуляций, быструю реабилитацию и восстановление качества жизни до уровня здорового человека. Стоят здесь процедуры на мозге головы в 2 раза меньше, чем в Германии или Израиле, и это при не менее качественном исполнении лечебного процесса.
https://www.ncbi.nlm.nih.gov/books/NBK441841/
https://www.medicalnewstoday.com/articles/185619.php
https://cyberleninka.ru/article/v/abstsessy-golovnogo-mozga
https://cyberleninka.ru/article/v/abstsessy-golovnogo-mozga-epidemiologiya-etiologiya-patogenez-gistopatologiya-obzor-literatury
источник
В лечении абсцессов головного мозга имеются два основных направления – консервативная терапия и оперативное лечение. Выбор метода лечения абсцесса мозга зависит от вида, стадии развития заболевания, сопутствующих осложнений.
На начальных стадиях развития рассматриваемого заболевания, а именно – в стадии энцефалита (2-3 недели от начала заболевания) показано консервативное лечение, в частности – терапия антибиотиками.
Направление терапии может быть определено бактериологическим лабораторным анализом гноя (посредством пункции), а также стереотаксической биопсией.
Лекарственные препараты, применяемые для лечения абсцессов головного мозга:
- Антибиотики группы цефалоспоринов III поколения — цефтриаксон, цефотаксим, цефиксим.
- Ванкомицин.
- Метронидазол (или, при абсцессе вследствие травмы головы – рифампицин).
- При абсцессе головного мозга у больного с состоянием иммунодефицита часто назначают амфоретицинВ или липосомальныйамфоретицин В, дальше – флуконазол.
- У ВИЧ-инфицированных больных возбудителем абсцесса головного мозга чаще всего является токсоплазма, поэтому таким пациентам назначаются сульфадиазин, пириметамин.
Антибиотикотерапия выполняется в интенсивном режиме в течение полутора 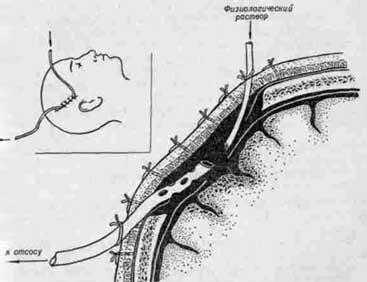
Глюкокортикоиды в терапии абсцесса головного мозга назначаются осторожно, и только в случае адекватной терапии с хорошими результатами, иначе эти препараты могут вызвать дальнейшее распространение инфицирования на другие участки мозга, нарушение капсулы абсцесса.
Оперативное лечение абсцесса головного мозга выполняется только в случае уже сформировавшегося абсцесса, имеющего капсулу, по результатам диагностики.
- Абсцесс ГМ, который находится в желудочковой зоне мозга.
- Абсцесс, являющийся причиной гипертензии мозга.
- Абсцесс ГМ, являющийся последствием проникающей открытой травмы, и расположенный вокруг инородного предмета.
- Абсцесс ГМ грибковой природы.
- Наличие инородного тела в веществе мозга.
- Отсутствие возможности дренировать абсцесс – показания для открытой операции.
- Несформировавшийся абсцесс ГМ на начальных стадиях заболевания (при начальном энцефалите).
- Расположение абсцесса в структурахГМ, которые являются жизненно важными – например, в стволе мозга, зрительном бугре, ядрах подкорки. В некоторых подобных случаях сохраняется возможность выполнения стереотаксического метода – то есть, пункции полости абсцесса с промыванием и введением лекарственных препаратов.
- Терминальная кома, крайне тяжелое состояние больного.
- Очень глубокое расположение абсцесса, когда не избежать опасных последствий.
- Несколько абсцессов ГМ одновременно, не подлежащие оперативному лечению.
Существует три основных метода оперативного лечения абсцесса головного мозга — приточно-отточное дренирование, стереотаксическая аспирация и удаление абсцесса классическим методом со вскрытием черепной коробки и оболочек мозга.
Выбор метода оперативного лечения зависит от вида и степени формирования абсцесса, а также от места его локализации и общего состояния больного.
- Осуществление простого приточно-отточного дренирования.
- Данное оперативное вмешательство чаще всего выполняют под местной анестезией тканей в месте установки дренажей, потому что вещество головного мозга к боли нечувствительно.
- В капсулу абсцесса вводится катетер, через который выполняется откачивания гноя из полости и дальнейшее введение лекарственных препаратов.
- Иногда, для наилучшего промывания капсулы абсцесса, вводят два дренажа, один из которых – для вливания лекарственного препарата (чаще всего –раствор хлорида натрия), другой – для аспирации содержимого.
- Катетер для дренирования может быть установлен на несколько дней, для повторных промываний полости абсцесса.
Дренирование абсцесса ГМ всегда сопровождается интенсивной консервативной терапией.
- Стереотаксическая аспирация гноя из полости абсцесса.
Выполняется так же, как и дренирование абсцесса, но – без установки катетера в полость.
- Открытая операция по удалению абсцесса головного мозга.
- Пациента вводят в общий наркоз. (Иногда операция может быть выполнена при местной анестезии – например, при небольшом разрезе). Голова пациента должна быть обрита в зоне доступа к абсцессу.
- Разрезаются мягкие ткани – кожа, мышцы — в зоне операции, разводятся в стороны расширителями. Снимается надкостница, покрывающая кость черепа.
- Хирургический доступ в кости черепа в большинстве случаев выполняют сверлом для хирургической трепанации. Твердая оболочка ГМ рассекается крестообразно.
- В полость абсцесса вводятся хирургические инструменты для аспирации гноя и удаления абсцесса вместе с капсулой. Производятся хирургические манипуляции.
- Хирургическую рану ушивают в обратном порядке, иногда оставляют катетер для аспирации гноя из раны и введения лекарственных средств.
Исход рассматриваемого заболевания зависит от многих факторов, прежде всего – от своевременности лечения и адекватности лечебных мероприятий, реактивности организма больного, от стадии, вида, количества абсцессов, сопутствующих заболеваний.
При абсцессах головного мозга:
- Летальный исход – в 10% случаев.
- Инвалидность – в 50% случаев.
- Сохраняющийся эпилептический статус – в 35% случаев у всех выживших больных.
- Субдуральные абсцессы, а также абсцессы грибковой природы, имеют больший процент летальности – от 50% до 95%.
При отсутствии осложнений послеоперационный период отмечается положительной динамикой в состоянии больного. Пациент и в послеоперационном периоде получает лечение антибиотиками.

источник
*Импакт фактор за 2017 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
НИИ нейрохирургии им. акад. Н.Н. Бурденко РАМН, Москва
Абсцесс головного мозга (АМ) представляет собой ограниченное капсулой скопление гноя в паренхиме мозга. Развивается чаще всего в результате проникновения в мозговую ткань бактерий, грибов или простейших микроорганизмов.
Несмотря на появление сильнодействующих антибактериальных средств и достижения микробиологической и радиологической диагностики, заболеваемость АМ сохраняется на сравнительно стабильном уровне. Соотношение мужчин и женщин составляет 2:1 при том, что средний возраст заболевших 35 – 45 лет. В 25% случаев АМ развивается у детей и подростков моложе 15 лет. До 2-х лет встречается редко (последствие менингита, вызванного Citrobacter diversus или другой грамотрицательной флорой). Максимальные пики развития АМ после среднего отита, как правило, приходятся на детский возраст и после 40 лет, тогда как абсцессы после синуситов чаще встречаются в возрасте от 10 до 30 лет. В то же время АМ являются основным видом внутричерепных инфекций у больных с ВИЧ. Так, распространенность токсоплазмозного энцефалита среди больных ВИЧ составляет от 2,6 до 30,8%.
До широкого применения антибиотиков основными возбудителями АМ являлись золотистый стафилококк, стрептококки и коли-бактерии, а у 50% больных возбудитель вообще не определялся. Совершенствование диагностических методов привело к уменьшению числа “стерильных” абсцессов и выявило роль анаэробных бактерий в развитии АМ.
В настоящее время считают, что 30–60% АМ являются результатом смешанной инфекции. При этом аэробные бактерии выделяют в 61% случаев, а анаэробы – в 32%. Половину всех аэробных культур составляют аэробные или микроаэрофильные стрептококки, выделяемые у 70% больных с АМ. К наиболее часто выделяемым стрептококкам относят принадлежащие к группе Streptococcus intermedius (Streptococcus anginosus, Streptococcus constellatus, Streptococcus milleri и др.).
S. Aureus выделен у 15% больных, в большинстве – это люди с черепно-мозговой травмой (ЧМТ) или перенесшие нейрохирургическую операцию.
Аэробные грамотрицательные бациллы (Proteus sp., E. coli, Klebsiella sp., Enterobacter sp. и P. aeruginosa) были выделены у 23–33% больных; 5–10% случаев составляют виды Haemophilus, в основном Haemophilus aphrophilus.
Анаэробные культуры чаще всего выделяют при АМ у больных с инфекцией легких и хроническими отитами, к ним относятся Bacteroides sp. (включая Bacteroides fragilis), Fusobacterium sp., Prevotella sp., анаэробные стрептококки и Clostridium sp.
Локализация и источник образования АМ позволяют предположить вероятного возбудителя процесса. Например, синусит чаще вызывается представителем группы S. intermedius и является источником АМ, локализующегося в лобной доле мозга, при этом сфеноидальные синуситы чаще вызывают АМ. При хроническом синусите одновременно выявляют нескольких возбудителей в соотношении аэробов к анаэробам, равным 1:1,5. Стафилококки, как правило, являются возбудителями посттравматических и послеоперационных АМ.
Абсцесс височной доли чаще развивается как осложнение среднего отита и обусловлен смешанной инфекцией. Возбудителями острых средних отитов, осложненных развитием АМ, являются S. pneumoniae, H. influenzae и Moraxella catarrhalis. Другие стрептококки, грамотрицательные анаэробы (включая P. aeruginosa, анаэробные кокки и Bacteroides sp.), являются основными возбудителями хронических средних отитов и связанных с ними АМ у 33% больных.
В 85–95% случаев мозжечковые АМ обусловлены мастоидитами. У 10% больных АМ являются одонтогенными. Однако и у больных с “криптогенным” АМ часто выявляют периапикальные абсцессы.
Следует отметить, что пневмококки, менингококки и H. influenzae редко выделяют из АМ, даже при гнойных менингитах. Диагноз пневмококкового АМ требует немедленного обследования больного на наличие предрасполагающего фактора – вируса иммунодефицита.
У больных со сниженным иммунитетом возбудителями АМ могут стать грибы, а Toxoplasma gondii типична для АМ у больных СПИДом. При нейтропениях чаще выделяют аэробные грамотрицательные бактерии, Candida sp., Aspergillus sp. или zygomycosis. В 50% случаев АМ, развивающиеся после пересадки костного мозга, обусловлены Aspergillus sp. и сопровождаются высоким уровнем летальности. У больных с нарушениями клеточного иммунитета возбудителями АМ являются T. gondii, Nocardia asteroides, L. monocytogenes, Myco-bacterium sp. или Cryptococcus neoformans.
Обзор литературы за прошедшие полвека показал, что в 45% случаев развитие АМ было обусловлено контактным распространением (отиты или синуситы). При этом в последние 10 лет отмечается снижение числа отогенных АМ, связанное с применением современных антимикробных средств. Контактное распространение инфекции происходит в основном по одному из двух главных механизмов: при прямом распространении через зону, прилегающую к остеиту или остеомиелиту, или при ретроградном распространении по эмиссарным венам.
Бактериальный менингит у взрослых редко осложняется АМ, тогда как у новорожденных развитие АМ может осложнить течение грамотрицательного менингита, обусловленного Citrobacter или Proteus sp.
Гематогенный путь развития АМ типичен для 25% больных с этой патологией, особенно, когда источником являются легочные инфекционные заболевания.
Для гематогенного АМ характерны:
• локализация в бассейне средней мозговой артерии;
• локализация на границе серого и белого вещества мозга;
• плохое образование капсулы;
• высокий уровень летальности;
Если в докомпьютерный период множественные АМ встречались всего у 1–15% больных, с появлением КТ такой диагноз ставится в 10–50% случаев.
Предрасполагающими факторами для развития АМ являются хронические легочные инфекции (абсцессы, бронхоэктазы и эмпиема), остеомиелиты, холециститы, желудочно-кишечные инфекции и/или инфекционные процессы в малом тазе. Реже АМ встречается при осложнениях таких заболеваний, как бактериальные эндокардиты, наследственная геморрагическая телеангиэктазия (болезнь Рандю–Вебера–Ослера), врожденные пороки сердца.
Гнойно-воспалительные осложнения плановых нейрохирургических операций составляют 0,6–1,7%, и 10% из них – АМ. При проникающей ЧМТ АМ образуются значительно чаще, а фактором риска являются огнестрельное поражение мозга и проникновение в мозг костных отломков и поверхностных тканей.
Экспериментальные данные показывают высокую резистентность мозговой ткани к инфекции, поэтому образование АМ требует наличия в той или иной степени поврежденного участка головного мозга.
Полицитемия и гипоксия, которые встречаются у больных с врожденными пороками сердца и при наследственной геморрагической телеангиэктазии, повышают вязкость крови и снижают скорость кровотока в капиллярах мозга. Это приводит к появлению микроинфарктов или участков со сниженной оксигенацией, которые могут стать очагом последующей инфекции.
На экспериментальной модели было показано, что гистопатологическая картина АМ складывается из 4 стадий.
1. Ранний церебрит (неинкапсулированный очаг инфекционного поражения мозга) – плохо отграниченный очаг с диффузным воспалением, перифокальным отеком и деструкцией вещества мозга. Формируется в течение 1–3 сут после внутримозговой инокуляции.
2. Поздний церебрит – центральная часть очага нагнаивается и некротизируется с формированием полости, заполненной полужидким гноем. По периферии скапливаются фибробласты (4–9 сут).
3. Начало образования глиозной капсулы – увеличение слоя фибробластов с ободком неоваскуляризации и реактивным астроцитозом (10–13 сут).
4. Формирование глиозной капсулы – уплотнение капсулы с реактивным коллагеном (более 2 нед).
Необходимо отметить, что сроки развития и степень выраженности перечисленных стадий могут варьировать в зависимости от возбудителя, пути распространения и т.д. Так, например, при контактном распространении капсула абсцесса представляет собой более прочное и четкое образование, чем при гематогенном.
Таким образом, формирование АМ проходит от стадии церебрита до стадии четкого отграничения некротического фокуса. Степень выраженности последней стадии зависит от конкретного возбудителя, иммунного статуса больного и степени гипоксии в данном участке мозговой ткани.
Клиника АМ может варьировать от вялотекущей до молниеносной. Очаговые симптомы поражения головного мозга связаны с гибелью мозговой ткани и выпадением функции в зоне локализации абсцесса. Токсины гнойного воспаления обладают тропизмом к нейронам, вызывая их необратимые дистрофические изменения и гибель. Поэтому в большинстве случаев АМ проявляется очаговыми неврологическими нарушениями, а не симптомами системной инфекции.
В целом клиническая картина неспецифична, зависит от вирулентности микроорганизма, иммунного статуса больного, локализации абсцесса(ов), наличия или отсутствия сопутствующего менингита или вентрикулита. Лишь у части больных отмечается классическая триада, включающая лихорадку, головную боль и очаговые неврологические нарушения. Головная боль – наиболее частый клинический симптом – встречается у 70% больных. Лихорадка – только у 50% взрослых больных и 80% детей. Очаговые неврологические нарушения проявляются у 50% больных и включают как двигательные нарушения, так и нарушения со стороны черепно-мозговых нервов.
При абсцессе полушария мозжечка отмечают нистагм, атаксию, рвоту и дисметрию, а при абсцессе лобной доли – головную боль, сонливость и нарушения сознания, наряду с двигательными и речевыми нарушениями.
Эпилептические припадки (в основном генерализованные) возникают у 25–45% больных. Тошнота и рвота нередко манифестируют как проявления внутричерепной гипертензии (ВЧГ). Менингеальные симптомы доминируют у 25% больных. Абсцессы в области турецкого седла могут вызывать симптомы, характерные для поражения гипофиза: головную боль, дефекты полей зрения, эндокринные нарушения.
В связи с этим дифференциальный диагноз АМ проводят с опухолевым поражением, хроническим менингитом, хронической субдуральной гематомой и вирусным энцефалитом.
Обычные исследования крови и мочи, как правило, бесполезны в диагностике АМ. Лейкоцитоз встречается только у 40% больных. Концентрация С-реактивного белка может помочь только в дифференциальной диагностике АМ и опухолей мозга.
Люмбальная пункция при АМ опасна (риск вклинения составляет более 20%), а возбудитель в спинномозговой жидкости (СМЖ) обнаруживается редко. Исследование СМЖ позволяет исключить бактериальный менингит, хотя диагноз последнего может подтверждаться одной лишь совокупностью клинических симптомов.
Наиболее точными диагностическими методами в настоящее время являются компьютерная томография (КТ) и магнитно-резонансная томография (МРТ). КТ позволяет в 95% случаев установить локализацию абсцесса, определить наличие отека мозга, гидроцефалии и/или смещения срединных структур. АМ во время КТ выглядит как круглый очаг низкой плотности, окруженный тонким, с повышенным накоплением контраста, обычно ровным кольцом. Ограничения метода КТ обусловлены тем, что злокачественная опухоль или инфаркт мозга, окруженные ободком неоваскуляризации, на КТ выглядят сходно. В то же время только у 40–60% больных с АМ, получающих глюкокортикоидную терапию, на КТ обнаруживают характерное, накапливающее контраст кольцо. Рентгеновские методы используют и для обнаружения очагов инфекции – источников АМ, для чего на КТ внимательно исследуют сосцевидные отростки и придаточные пазухи, проводят рентгенографию грудной клетки.
Данные об использовании МРТ в диагностике АМ в настоящее время продолжают накапливаться. По оценкам специалистов, МРТ – такой же чувствительный метод, как и КТ, а в некоторых случаях даже превосходит его (выявление АМ на стадии церебрита).
Лечение АМ проводится комплексно и включает в себя медикаментозные (консервативные) и хирургические меры. Выбор оптимальных из них определяется гистопатологической стадией АМ по данным КТ (МРТ) исследования. На стадии церебрита эффективно медикаментозное лечение, а нейрохирургическое вмешательство не показано, тогда как при уже сформировавшемся абсцессе с плотной капсулой консервативная тактика не приносит успеха (см. врезку).
Медикаментозное лечение включает: антибиотикотерапию, противоотечную терапию, противосудорожные средства.
Антибиотикотерапия – основа медикаментозного лечения (рис. 1).
В течение последних четырех десятилетий наиболее распространенной схемой лечения было сочетание пенициллина G, 20–24 МЕ/сут внутривенно и хлорамфеникола 1–1,5 г/сут внутривенно (каждые 6 ч). Пенициллин был включен в схему, так как он активен против стрептококков (включая группу S. Intermedius) и большинства анаэробных бактерий, выделяемых у больных с АМ; эффективен при лечении АМ на экспериментальных моделях и значительно снизил смертность от АМ, начиная с 40-х годов.
Хлорамфеникол широко использовали в прошлом благодаря его способности хорошо растворяться в жировой ткани (концентрация в головном мозге нередко превышала концентрацию в плазме), а также активности против анаэробных бактерий, включая B. fragilis.
В настоящее время цефотаксим (Цефабол) в дозе 3 г внутривенно каждые 8 ч является приемлемым заменителем пенициллина, а вместо хлорамфеникола все чаще используется метронидазол.
Антибиотикотерапию начинают в предоперационном периоде (не позднее чем за 2 нед до операции). Общая продолжительность лечения составляет 6–8 нед, но не менее 4 нед после операции. Полученный в результате операции гной окрашивают по Граму и производят посевы на среды для выявления аэробных и анаэробных бактерий и грибов и определения их чувствительности к антибиотикам. Нет исследований, достоверно подтверждающих положительное влияние на исход заболевания введения антибиотиков внутрь абсцесса интраоперационно. Следует учитывать, что на стадии церебрита гематоэнцефалический барьер (ГЭБ) остается сохранным, поэтому приоритет отдается препаратам, которые хорошо проникают через него. Именно поэтому препаратом выбора является меропенем, а не имипенем, из-за его избирательной проницаемости через ГЭБ.
Вопрос о применении кортикостероидов с целью уменьшения отека в лечении АМ до сих пор остается спорным. Экспериментально доказано, что кортикостероиды ухудшают проникновение в абсцесс антибиотиков, препятствуют образованию капсулы абсцесса, а также снижают накопление контраста на КТ, что создает ложное впечатление о размерах и состоянии АМ в динамике. В исследованиях на животных использование кортикостероидов не оказало влияния на смертность от АМ, но нет и доказательств того, что они способствуют генерализации инфекции.
При внутричерепной гипертензии и угрозе дислокационного синдрома применяют маннитол (1–1,5 г/кг внутривенно в виде болюса в течение 20–30 мин).
Противосудорожные средства (например, фенитоин) показаны при наличии судорожных проявлений.
К наиболее эффективным методам хирургического лечения АМ в настоящее время относятся: дренирование абсцесса с помощью пункционной аспирации и полное удаление абсцесса.
Пункционную аспирацию целесообразно применять на начальных этапах лечения (одновременно с проведением антибиотикотерапии), особенно в стадии церебрита, при стабильном неврологическом состоянии больного, а также в случае глубокого расположения абсцесса (метод выбора) или при множественных абсцессах. Интраоперационное УЗИ и стереотаксическая биопсия под контролем КТ сделали безопасной аспирацию абсцесса практически в любой зоне мозга. Последующее лечение зависит как от клинических, так и от радиологических исследований. Ухудшение неврологического состояния, наличие воздуха в полости абсцесса или отсутствие изменений размеров абсцесса в динамике на КТ являются показаниями к немедленному хирургическому вмешательству (аспирация или удаление).
Удаление абсцесса позволяет устранить опасность рецидива АМ. Удаление абсцесса целесообразно проводить при поверхностных, легко доступных абсцессах с хорошо сформированной, плотной капсулой, а также в случае, если аспирация и/или антибиотикотерапия оказались неэффективными. После тотального, без нарушения целостности капсулы, удаления абсцесса (особенно при его поверхностном расположении), продолжительность антибиотикотерапии можно сократить до 3 сут.
Хорошее контрастирование на КТ при излеченном АМ может сохраняться от 4–10 нед до 6–9 мес. Примером может служить следующее наблюдение.
Больной З., в начале августа 1999 г. в течение 1 нед перенес ангину. Работу не прекращал, лечился самостоятельно. Через 2 нед, внезапно появилась слабость в правой руке и ноге, которая самостоятельно регрессировала спустя несколько часов и, вновь развившись через 2 дня, носила нарастающий характер, сопровождаясь быстрой утомляемостью, чувством недомогания. После госпитализации отмечено развитие приступа судорог в правой руке и ноге без потери сознания. На компьютерных томограммах в левой затылочной области определялась кольцевидной формы зона повышенной плотности с неровными, бугристыми контурами, негомогенной структурой размером 32 х 22 мм, окруженная зоной отека (рис. 2 а).
Обращали внимание отсутствие признаков ВЧГ, правосторонняя гомонимная гемианопсия, правосторонний гемипарез (сила – 2 балла), патологические рефлексы, гемигипестезия. Изменений со стороны внутренних органов выявлено не было, анализы крови и мочи в пределах нормы. С диагнозом объемное образование левой затылочной доли больному произведена операция, во время которой субкортикально на глубине около 5 мм обнаружен абсцесс с тонкой капсулой, разорвавшейся при попытке его удаления. В предварительно обложенную ватными тампонами операционную рану излилось около 15 мл густой желто-зеленой жидкости со зловонным запахом. Абсцесс был удален полностью вместе с капсулой. Образовавшаяся полость обработана 1%-ным раствором диоксидина. Бактериоскопия содержимого полости абсцесса выявила большое количество скоплений кокков. В послеоперационном периоде на фоне проводимого лечения отмечался полный регресс неврологической симптоматики: восстановилась сила в правой руке и ноге до 5 баллов, чувствительность правой ноги не нарушена, поля зрения в норме.
На контрольных томограммах спустя 2 нед (рис. 2, б) и 8 нед (рис. 2, в) после операции отмечена динамика послеоперационных изменений в виде небольшой зоны понижения плотности в левой затылочной доле.
До недавнего времени летальность от АМ оставалась на относительно стабильном уровне и составляла примерно 40–60% независимо от использования антибиотиков. И только с внедрением в практику такого метода, как КТ (МРТ), удалось снизить ее до 10% (по некоторым данным, до 11–20%). Примерно у 30–55% больных после выздоровления остается стойкий неврологический дефицит, в 29% случаев сохраняется гемипарез, а более чем у 70% выживших больных впоследствии отмечаются эпилептические припадки.
Наиболее предпочтительной остается тактика лечения, предупреждающая развитие АМ. Она включает в себя раннюю диагностику и эффективную антибиотикотерапию инфекционного заболевания, являющегося вероятным источником образования АМ. Сюда же можно отнести и применение антимикробных средств с целью профилактики хирургических инфекций. Терапия, направленная на улучшение кровоснабжения и оксигенации мозговой ткани, также является эффективной и показана для предупреждения АМ. Сочетание признаков системного воспаления с появлением оболочечной симптоматики, тем более с присоединением симтомов ВЧГ или(и) очагового поражения головного мозга, являются обязательным показанием для срочного КТ (МРТ) обследования больного с целью исключения АМ. При постановке диагноза АМ агрессивная медикаментозно-хирургическая тактика способна обеспечить успех лечения.
Список литературы Вы можете найти на сайте http://www.rmj.ru
Цефабол (торговое название)
Цефамабол (торговое название)
1. Яковлев С.В., Яковлев В.П.: Современная антибактериальная терапия в таблицах. Consilium Medicum 1999; 1(1): 18–36.
2. Chun C.H., Johnson J.D., Hofstetter M., Raff M.J.: Brain abscess. A study of 45 consecutive cases: Medicine (Baltimore) 1986 Nov; 65 (6): 415–31.
3. Ciurea V., Stoica F., Vasilescu G., Nuteanu L.: Neurosurgical management of brain abscesses in children: Acta Neuropathologica: 1998; 46: 3.
4. Dolan R.W., Chowdhury K.: Diagnosis and treatment of intracranial complications of paranasal sinus infections: J Oral Maxillofac Surg 1995 Sep; 53(9): 1080–7.
5. Hagensee M.E. et al.: Brain abscess following marrow transplantation: Experience at the Fred Hutchinson Cancer Research Center, 1984-1992. Clin Infect Dis, 1994; 19: 402.
6. Haimes A.B., Zimmerman R.D., Morgello S, et al.: MRimaging of brain abscesses. AJR Reviews MRI of brain abscesses and its differential diagnosis.1989; 152: 1073.
7. Levy R.M.: Brain abscess and subdural empyema. Curr Opin Neurol 1994; 7: 223.
8. Maniglia A.J., Goodwin W.J., Arnold J.E., et al.: Intracranial abscesses secondary to nasal, sinus, and orbital infections in adults and children. Arch Otolaryngol Head Neck Surg Association of sinus disease with brain abscesses is reviewed. 1989; 115: 1424.
9. Ostermann S., Schmal F.: Epidural hematoma with secondary penetration into the middle ear. An uncommon differential diagnosis of otogenic brain abscess: Acta Neuropathologica: 1999; 9: 3.
10. Patel K.S., Marks P.V.: Management of focal intracranial infections: Is medical treatment better than surgery? Discussion of the issue of nonsurgical management. J Neurol Neurosurg Psychiatry 1990; 53: 472.
11. Rosenfeld E.A., Bowley A.H.: Infectious complications of sinusitis, other than meningitis in children: 12 year review. Clin Infect Dis 1994; 18: 750.
12. Seydoux C.H., Francioli P.: Bacterial brain abscesses: Factors influencing mortality and sequel. Clin Infect Dis 1992; 15: 394.
13. Sjolin J et al: Treatment of brain abscess with cefotaxime and metronidazole: Prospective study of 15 consecutive patients. Clin Infect Dis 1993; 17: 857.
14. Stephens D.S., Farley M.M.: Pathogenetic events during infection of the human nasal pharynx with Neisseria meningitidis and Haemophilus influenzae. Rev Infect Dis 1991; 13: 22.
15. Takeshita M., Kagawa M., Izawa M., Takakura K.: Current Treatment Strategies and Factors influencing Outcome in Patients with Bacterial Brain Abscess: Acta Neuropathologica 1998; 12: 140.
16. Wispelwey B., Scheld W.M.: Brain abscess, in Infections of the Central Nervous System, 2d ed, WM Scheld et al (eds). New York, Lippincott-Raven, 1997; 463–94.
17. Yang S.Y., Zhao C.S.: Review of 140 patients with brain abscess. Surg Neurol Clinical features, bacteriology, imaging, and treatment discussed. 1993; 39: 290.
| Приложения к статье |
| Источники и факторы риска АМ 1. При контактном распространении: • отит и мастоидит (абсцессы височной доли и мозжечка); • синусит (абсцесс лобной доли); 2. При гематогенном распространении: • у взрослых: инфекционные заболевания легких (абсцессы, бронхоэктазы, эмпиема); • у детей: врожденные пороки сердца со сбросом крови справа налево (у 4–7% детей с этой патологией); • легочные артериовенозные фистулы, наследственная геморрагическая телеангиэктазия (у 5% больных с этой врожденной патологией); • бактериальный эндокардит (редко); • бактериемия, связанная с внечерепными очагами инфекции, в т. ч. при стоматологических и иных манипуляциях. В 15–20% случаев источник АМ выявить не удается. |
| Максимально эффективной медикаментозная терапия может быть в следующих случаях: 1. Лечение начато в стадии церебрита. 2. Абсцесс имеет небольшие (0,8–2,5 см) размеры. 3. Продолжительность симптомов не превышает 2 нед. 4. Отмечается явное клиническое улучшение в течение 1 нед после начала лечения. Консервативное лечение применяется: 1. При множественных или недоступных для хирургического вмешательства абсцессах. 2. При сопутствующем менингоэнцефалите. 3. При высоком риске хирургического вмешательства. источник |