Оптимальное лечение абсцесса головного мозга — сочетание антибактериальной терапии и хирургического вмешательства. При подозрении на абсцесс незамедлительно проводят КТ или МРТ . Каждая стадия абсцесса характеризуется особыми признаками на КТ, и поэтому данные КТ определяют тактику лечения. В 1971 г. было показано, что раннее назначение антибиотиков может привести к разрешению церебрита без хирургического вмешательства и предотвратить формирование инкапсулированного абсцесса. Сообщалось и об успешном консервативном лечении инкапсулированных абсцессов. Однако анализ этих случаев показал, что они характеризуются следующими особенностями: диагностика и наблюдение за течением заболевания осуществлялись с помощью КТ; аспирационная биопсия и гистологическое исследование не проводились; высокие дозы антибиотиков назначали длительно (например, более 8 нед); доказательства инкапсуляции, как правило, отсутствовали.
Сегодня на основании экспериментов на животных и четко установленных КТ-признаков разных стадий абсцесса можно утверждать, что на самом деле происходило излечение абсцесса на стадии церебрита .
В большинстве случаев успешное лечение абсцесса головного мозга невозможно без тесного взаимодействия невропатологов и нейрохирургов. Рекомендации по антибактериальной терапии абсцесса головного мозга основаны как на микробиологических данных, так и на исследованиях на животных и человеке, определивших особенности проникновения антибиотиков в вещество мозга и внутрь абсцесса. К сожалению, проспективные рандомизированные исследования, позволяющие выбрать наиболее эффективный антибиотик, отсутствуют. Если на КТ выявлен церебрит и состояние больного стабильно, то назначают антибиотики и наблюдают больного. В начале 60-х гг. при абсцессе головного мозга у взрослых стали назначать бензилпенициллин (20-24 млн ед/сут в/в) в сочетании с хлорамфениколом (1-1,5 г в/в каждые 6 ч). Бензилпенициллин остается основой терапии по следующим причинам: он очень эффективен в отношении стрептококков (в том числе комплекса Streptococcus intermedius ), которые часто вызывают абсцессы мозга при прямом распространении инфекции или заболеваниях легких; он эффективен в отношении большинства анаэробных возбудителей абсцесса головного мозга; его высокая эффективность доказана на животных; с началом использования пенициллина в 40-х гг. смертность от абсцесса головного мозга существенно снизилась.
Вместо бензилпенициллина можно назначать цефотаксим в высоких дозах (например, 3 г в/в каждые 8 ч) в сочетании с препаратом, активным в отношении анаэробной микрофлоры (например, метронидазолом ). Применение в прошлом хлорамфеникола было продиктовано его хорошей жирорастворимостью, благодаря которой его концентрация в головном мозге часто превышала таковую в плазме, а также высокой активностью в отношении анаэробных бактерий, включая Bacteroides fragilis . В последние годы вместо хлорамфеникола почти всегда назначают метронидазол : он обладает бактерицидным действием в отношении Bacteroides fragilis ( хлорамфеникол — бактериостатическим); он хорошо проникает внутрь абсцесса; концентрация метронидазола в абсцессе, в отличие от ряда других антимикробных средств, не снижается на фоне глюкокортикоидов; в исследованиях на экспериментальных абсцессах брюшной полости показано, что в гное хлорамфеникол теряет активность в результате деацетилирования; последние ретроспективные исследования показали, что метронидазол снижает летальность при абсцессе головного мозга. Видимо, при лечении метронидазолом летальность ниже и выздоровление наступает быстрее, чем при лечении хлорамфениколом, но проспективных, рандомизированных сравнительных испытаний этих препаратов не проводилось.
Как бы то ни было, метронидазол и другие препараты, активные в отношении анаэробной микрофлоры (например, ампициллин/сульбактам ) показаны при абсцессе головного мозга, возникшем на фоне среднего отита , мастоидита или абсцесса легкого . Метронидазол всегда сочетают с другими антимикробными препаратами.
Возбудителем абсцесса мозга на фоне фронтита или этмоидита редко бывает Bacteroides fragilis , поэтому в таких случаях часто нет необходимости добавлять к бензилпенициллину препараты, действующие на анаэробную микрофлору. Однако эмпирическая терапия до получения результатов бактериологического исследования должна включать по крайней мере два препарата. При подозрении на стафилококковую этиологию (например, после черепно-мозговой травмы или нейрохирургического вмешательства) назначают нафциллин или оксациллин (1,5- 2 г в/в каждые 4 ч). При аллергии к пенициллинам или выделении метициллиноустойчивых штаммов назначают ванкомицин . В Европе широко используют фузидиевую кислоту ; в США она не применяется.
Отогенные абсцессы часто бывают обусловлены аэробными грамотрицательными палочками , поэтому до получения результатов бактериологического исследования дополнительно назначают цефалоспорины третьего поколения или триметоприм/сульфаметоксазол . Поскольку возбудителем хронического среднего отита часто бывает Pseudomonas aeruginosa , препаратом выбора в таких случаях является цефтазидим . По последним данным, цефотаксим эффективен и в отношении стрептококков , поэтому в стандартных схемах им заменяют бензилпенициллин , сочетая его, например, с метронидазолом .
Остается неясным, целесообразно ли введение антибиотиков в полость абсцесса во время аспирации.
Нередко назначают глюкокортикоиды , но единого мнения в этом отношении нет. Глюкокортикоиды затрудняют проникновение антибиотиков в головной мозг, уменьшают образование коллагена и глии и тем самым препятствуют инкапсуляции абсцесса. Кроме того, они уменьшают контрастность ободка повышенной плотности из-за уменьшения перифокального отека. В экспериментах на животных глюкокортикоиды не снижали летальность при абсцессе головного мозга. Показанием для назначения глюкокортикоидов при абсцессе мозга служит доказанное или предполагаемое повышение ВЧД . При этом желателен мониторинг ВЧД. При его повышении применяют также маннитол и ИВЛ в режиме гипервентиляции. Кроме того, при подозрении на абсцесс мозга профилактически назначают противосудорожные средства .
источник
В настоящем разделе рассматриваются основные инфекции ЦНС бактериальной этиологии: менингиты, абсцесс головного мозга, субдуральная эмпиема и эпидуральный абсцесс.
Бактериальный менингит — воспаление мозговых оболочек, острое или хроническое, проявляющееся характерными клиническими симптомами и плеоцитозом СМЖ.
Заболеваемость бактериальным менингитом составляет в среднем около 3 случаев на 100 тыс. населения. В более чем 80% случаев бактериальные менингиты вызываются N.meningitidis, S.pneumoniae и H.influenzae.
В России N.meningitidis является причиной около 60% случаев бактериальных менингитов, S.pneumoniae — 30% и H.influenzae — 10%. Необходимо отметить, что в развитых странах после внедрения широкомасштабной вакцинации против H.influenzae типа B, заболеваемость бактериальным менингитом данной этиологии снизилась более чем на 90%.
Кроме того, бактериальный менингит может вызываться другими микроорганизмами (листериями, стрептококками группы B, энтеробактериями, S.aureus, и др.).
Возбудителями бактериального менингита могут быть спирохеты: при болезни Лайма у 10-15% пациентов в первые 2 нед после инфицирования имеется менингеальный синдром. В целом этиология во многом определяется возрастом и преморбидным фоном пациентов (табл. 2).
| Предрасполагающий фактор | Вероятные возбудители |
|---|---|
| Возраст | |
| 0-4 нед | S.agalactiae, E.coli, L.monocytogenes, K. pneumoniae, Enterococcus spp., Salmonella spp. |
| 4-12 нед | E.coli, L.monocytogenes, H.influenzae, S.pneumoniae, N.meningitidis |
| 3 мес-5 лет | H.influenzae, S.pneumoniae, N.meningitidis |
| 5-50 лет | S.pneumoniae, N.meningitidis |
| > 50 лет | S.pneumoniae, N.meningitidis, L.monocytogenes, Enterobacteriaceae |
| Иммуносупрессия | S.pneumoniae, N.meningitidis, L.monocytogenes, Enterobacteriaceae, P.aeruginosa |
| Перелом основания черепа | S.pneumoniae, H.influenzae, S.pyogenes |
| Травмы головы, нейрохирургические операции и краниотомия | S.aureus, S.epidermidis, Enterobacteriaceae, P.aeruginosa |
| Цереброспинальное шунтирование | S.epidermidis, S.aureus, Enterobacteriaceae, P.aeruginosa, P.acnes |
| Сепсис | S.aureus, Enterocococcus spp., Enterobacteriaceae, P.aeruginosa, S.pneumoniae |
Бактериальный менингит может возникать в стационаре после нейрохирургических или оториноларингологических операций, в этом случае в этиологии важную роль играет грамотрицательная (до 40%) и грамположительная флора (до 30%). Нозокомиальная флора, как правило, характеризуется высокой резистентностью и летальность при такой этиологии достигает 23-28%.
Успех лечения острого бактериального менингита зависит от целого ряда факторов и, в первую очередь, от своевременности и правильности назначения АМП. При выборе антибиотиков нужно помнить, что не все они хорошо проникают через ГЭБ (табл. 2).
Антимикробная терапия должна быть начата немедленно после постановки предварительного диагноза. Важно, чтобы люмбальная пункция и забор материала (СМЖ, кровь) для микробиологического исследования выполнялись до введения антибиотиков.
Выбор АМП проводится по результатам обследования, в том числе предварительной идентификации возбудителя после окраски мазков СМЖ по Граму и серологических экспресс-тестов.
Если быстрые методы диагностики не позволяют предварительно идентифицировать возбудителя, или по каким-либо причинам происходит задержка с выполнением люмбальной пункции, то антибактериальная терапия назначается эмпирически. Выбор АМП в данной ситуации диктуется необходимостью перекрыть весь спектр наиболее вероятных возбудителей (табл. 3).
| Предрасполагающий фактор | Препарат |
|---|---|
| Возраст | |
| 0-4 нед | Ампициллин + цефотаксим, ампициллин + гентамицин |
| 4-12 нед | Ампициллин + цефотаксим или цефтриаксон |
| 3 мес-5 лет | Цефотаксим или цефтриаксон + ампициллин + хлорамфеникол |
| 5-50 лет | Цефотаксим или цефтриаксон (+ ампициллин при подозрении на листерии), бензилпенициллин, хлорамфеникол |
| Старше 50 лет | Ампициллин + цефотаксим или цефтриаксон |
| Иммуносупрессия | Ванкомицин + ампициллин + цефтазидим |
| Перелом основания черепа | Цефотаксим или цефтриаксон |
| Травмы головы, состояния после нейрохирургических операций | Оксациллин + цефтазидим, ванкомицин + цефтазидим |
| Цереброспинальное шунтирование | Оксациллин + цефтазидим, ванкомицин + цефтазидим |
Антимикробная терапия может быть изменена при выделении возбудителя и получении результатов чувствительности (табл. 4).
| Возбудитель | Препараты выбора | Альтернативные препараты |
|---|---|---|
| H.influenzae β-лактамаза (-) |
Цефотаксим или цефтриаксон
Цефотаксим, цефтриаксон, цефепим,
хлорамфеникол
Цефепим, хлорамфеникол, азтреонам,
фторхинолоны
МПК пенициллина 2,0 мг/л
Бензилпенициллин или ампициллин
Цефотаксим или цефтриаксон
Ванкомицин + цефотаксим или цефтриаксон (+ рифампицин)
Цефотаксим, цефтриаксон, хлорамфеникол, ванкомицин
Меропенем, ванкомицин (+ рифампицин)
Меропенем
MSSA
MRSA
Оксациллин
Ванкомицин
Ванкомицин
Рифампицин, ко-тримоксазол
T.pallidum
B.burgdorferi
Бензилпенициллин
Цефтриаксон или цефотаксим
Цефтриаксон, доксициклин
Бензилпенициллин, доксициклин
При лечении используются максимальные дозы антибиотиков, что особенно важно при применении АМП, плохо проникающих через ГЭБ, поэтому необходимо строго придерживаться принятых рекомендаций (табл. 5). Особое внимание необходимо при назначении антибиотиков детям (табл. 6).
| Препарат | Суточная доза, в/в | Интервалы между введениями, ч |
|---|---|---|
| Азтреонам | 6-8 г | 6-8 |
| Амикацин | 15-20 мг/кг | 12 |
| Ампициллин | 12 г | 4 |
| Бензилпенициллин | 18-24 млн ЕД | 4 |
| Ванкомицин | 2 г | 6-12 |
| Гентамицин | 5 мг/кг | 8 |
| Ко-тримоксазол | 10-20 мг/кг (по триметоприму) | 6-12 |
| Меропенем | 6 г | 8 |
| Метронидазол | 1,5-2 г | 8 |
| Оксациллин | 9-12 г | 4 |
| Рифампицин | 0,6 г | 24 |
| Тобрамицин | 5 мг/кг | 8 |
| Хлорамфеникол | 4 г | 6 |
| Цефотаксим | 12 г | 6 |
| Цефтазидим | 6 г | 8 |
| Цефтриаксон | 4 г | 12-24 |
| Ципрофлоксацин | 1,2 г | 12 |
| Препарат | Суточная доза (интервал между введениями, ч) | ||
|---|---|---|---|
| Новорожденные (0-7 дней) | Новорожденные (8-28 дней) | Дети | |
| Амикацин | 15-20 мг/кг (12) | 20-30 мг/кг (8) | 20-30 мг/кг (8) |
| Ампициллин | 100-150 мг/кг (8-12) | 150-200 мг/кг (6-8) | 200-300 мг/кг (6) |
| Бензилпенициллин | 100-150 тыс. ЕД/кг (8-12) | 200 тыс. ЕД/кг (6-8) | 250-300 тыс. ЕД/кг (4-6) |
| Ванкомицин | 20 мг/кг (12) | 30-40 мг/кг (8) | 50-60 мг/кг (6) |
| Гентамицин | 5 мг/кг (12) | 7,5 мг/кг (8) | 7,5 мг/кг (8) |
| Ко-тримоксазол | 10-20 мг/кг (6-12) | ||
| Тобрамицин | 5 мг/кг (12) | 7,5 мг/кг (8) | 7,5 мг/кг (8) |
| Хлорамфеникол | 25 мг/кг (24) | 50 мг/кг (12-24) | 75-100 мг/кг (6) |
| Цефепим | 50 мг/кг (8) | ||
| Цефотаксим | 100 мг/кг (12) | 150-200 мг/кг (6-8) | 100 мг/кг (6-8) |
| Цефтазидим | 60 мг/кг (12) | 90 мг/кг (8) | 125-150 мг/кг (8) |
| Цефтриаксон | 80-100 мг/кг (12-24) | ||
* A.R. Tunkel, W.M. Scheld. Acute meningitis. In: Principles and practice of infectious diseases, 5 th Edition. Edited by: G.L. Mandell, J.E. Bennett, R. Dolin. Churchill Livingstone, 2000; p. 980
Основным путем введения АМП является в/в. По показаниям (вторичный бактериальный менингит на фоне сепсиса, особенно полимикробного, гнойные осложнения черепно-мозговых травм и операций и др.) можно сочетать в/в и эндолюмбальное введение (табл. 7). Эндолюмбально вводятся только АМП, плохо проникающие в СМЖ (аминогликозиды, ванкомицин). Препараты могут быть использваны в виде моно- или комбинированной терапии. Показанием для смены АМП является отсутствие положительной клинико-лабораторной динамики состояния пациента или появление признаков нежелательного действия препарата.
| Препарат | Доза |
|---|---|
| Гентамицин | 4-8 мг 1 раз в сутки |
| Тобрамицин | 4-8 мг 1 раз в сутки |
| Амикацин | 4-20мг 1 раз в сутки |
| Ванкомицин | 4-10 мг 1 раз в сутки |
Помимо соблюдения разовых и суточных доз АМП, при бактериальном менингите важна длительность их назначения.
Для лечения менингита, вызыванного спирохетами, используются препараты, имеющие соответствующий спектр активности (табл. 4).
В ряде инфекций, характеризующихся хроническим течением, возможно распространение процесса на оболочки мозга. В этом случае может возникать менингеальный синдром и изменяется состав СМЖ.
С точки зрения осложнений хронических инфекций наибольшую опасность представляет туберкулезный менингит. Несвоевременно начатое лечение этого менингита часто приводит к неблагоприятному исходу. Появление диагностических систем на основе ПЦР существенно сократило продолжительность обследования и значительно повысило эффективность лечения.
Поражение мозговых оболочек может наблюдаться и при других инфекциях: бруцеллезе, цистицеркозе, сифилисе, боррелиозе, кокцидиоидозе, гистоплазмозе, криптококкозе и др.
Лечение этого менингита определяется основным заболеванием. Очень часто выяснить этиологию процесса представляется практически невозможным. В этом случае наряду с продолжением поиска возбудителя используют так называемое пробное эмпирическое лечение. Так, например, при подозрении на туберкулезный менингит назначаются противотуберкулезные препараты и при появлении клинического улучшения курс терапии доводят до конца. При подозрении на кандидозную природу используется пробное лечение флюконазолом.
Абсцесс головного мозга — ограниченное капсулой скопление мозгового детрита, лейкоцитов, гноя и бактерий.
Этиологической причиной абсцесса головного мозга могут быть бактерии, грибы, простейшие и гельминты. Из бактериальных возбудителей наиболее частыми являются зеленящие стрептококки (S.anginosus, S.constellatus и S.intermedius), которые встречаются в 70% случаев. В 30-60% им сопутствуют другие бактерии. S.aureus высевается у 10-15% больных, часто в монокультуре, особенно при черепно-мозговой травме, инфекционном эндокардите. Анаэробы выделяются в 40-100%, причем в 20-40% это бактероиды или превотеллы. Энтеробактерии встречаются в 23-33% случаев, особенно часто при отогенном инфицировании или у больных с иммунологическими нарушениями.
При использовании иммуносупрессивной терапии, антибиотиков широкого спектра действия, кортикостероидов повышается риск развития абсцесса головного мозга грибковой этиологии. Как и при менингите, этиология абсцесса головного мозга зависит от преморбидного фона (табл. 8).
| Предрасполагающий фактор | Вероятные возбудители |
|---|---|
| Средний отит или мастоидит | Streptococcus spp., Bacteroides spp., Prevotella spp., Enterobacteriaceae |
| Синусит (лобной и клиновидной кости) | Streptococcus spp., Bacteroides spp., Enterobacteriaceae, S.aureus, H.influenzae |
| Одонтогенный сепсис | Fusobacterium spp., Prevotella spp., Bacteroides spp., Streptococcus spp. |
| Проникающая ЧМТ, нейрохирургические операции | S.aureus, Streptococcus spp., Enterobacteriaceae, Clostridium spp. |
| Абсцесс, эмпиема легких, бронхоэктатическая болезнь | Fusobacterium spp., Actinomyces spp., Bacteroides spp., Prevotella spp., Streptococcus spp., Nocardia spp. |
| Бактериальный эндокардит | S.aureus, Streptococcus spp. |
| Врожденные пороки сердца | Streptococcus spp., Haemophilus spp. |
| Нейтропения | Enterobacteriaceae, Aspergillus spp., Candida spp. |
| После трансплантации | Aspergillus spp., Candida spp., Enterobacteriaceae, Nocardia spp., T.gondii |
| ВИЧ-инфекция | T.gondii, Nocardia spp., Mycobacterium spp., L.monocytogenes, Cryptococcus spp. |
Данное заболевание требует наряду с хирургическим лечением применения АМП. До выяснения этиологии процесса антибактериальные средства назначаются эмпирически (табл. 9). После идентификации возбудителя может потребоваться смена антибиотиков. При лечении абсцесса головного мозга так же, как и при остром менингите, используются максимальные дозы препаратов (табл. 6).
| Предрасполагающий фактор | Препарат |
|---|---|
| Средний отит или мастоидит | Цефалоспорины III-IV поколения* + метронидазол |
| Синусит | Цефалоспорины III-IV поколения* + метронидазол + ванкомицин (при подозрении на присутствие MRSA) |
| Одонтогенный сепсис | Пенициллин + метронидазол |
| Проникающая ЧМТ, нейрохирургические операции | Ванкомицин + цефалоспорины III-IV поколения* |
| Абсцесс, эмпиема легких, бронхоэктатическая болезнь | Пенициллин + метронидазол + ко-тримоксазол |
| Бактериальный эндокардит | Ванкомицин + аминогликозид |
| Врожденные пороки сердца | Цефалоспорины III-IV поколения* |
| Причина не известна | Цефалоспорины III-IV поколения* + метронидазол + ванкомицин |
Субдуральная эмпиема — скопление гноя в субдуральном пространстве, в большинстве случаев являющееся следствием проникновения инфекции через эмиссарные вены. Наиболее часто возникает как осложнение синусита, отита, мастоидита, черепно-мозговой травмы, после хирургических вмешательств на черепе.
При субдуральной эмпиеме в 35% случаев выделяются стрептококки, в 17% — стафилококки. Другие микроорганизмы (S.pneumoniae, H.influenzae, энтеробактерии) обнаруживаются у 17% больных. Почти в 100% случаев в гнойном очаге присутствуют анаэробы, чаще всего бактероиды. При снижении иммунитета, особенно при ВИЧ-инфекции, субдуральную эмпиему могут вызывать сальмонеллы, грибы рода Candida, ассоциации микроорганизмов.
При лечении субдуральной эмпиемы параллельно с хирургическими методами назначаются АМП. Эмпирическая терапия сходна с таковой при абсцессе головного мозга (табл. 9). После идентификации возбудителя терапию либо продолжают, либо изменяют с учетом этиологии.
Эпидуральный абсцесс — инфекционный процесс, развивающийся между костями черепа и наружным листком твердой мозговой оболочки, может сопровождаться остеомиелитом. Вследствие того, что возбудитель легко проникает через твердую мозговую оболочку вдоль эмиссарных вен, эпидуральному абсцессу часто сопутствует субдуральная эмпиема.
Наиболее частой причиной возникновения эпидурального абсцесса являются синусит, мастоидит или трепанация черепа. Этиология сходна с таковой при субдуральной эмпиеме.
Как при абсцессе головного мозга.
У новорожденных детей возбудителями чаще являются стрептококки группы В, энтеробактерии и листерии. В связи с тем, что цефотаксим неактивен в отношении листерий, одновременно с ним детям применяют ампициллин, либо ампициллин в сочетании с аминогликозидами (обычно с гентамицином). Детям противопоказано использование ко-тримоксазола в первые 2 мес, фторхинолонов — до 16 лет. Цефепим разрешен для применения с 2-месячного возраста.
У детей по сравнению со взрослыми расширены показания к назначению при гнойных менингитах глюкокортикоидов, которые достоверно снижают летальность и частоту осложнений при менингите, вызванном H.Influenzae типа B. Применяют дексаметазон по 0,15 мг/кг каждые 6 ч в течение 2 сут. Первую дозу дексаметазона следует вводить в/в за 15 мин до первого введения АМП.
При выборе АМП у беременных необходимо учитывать его безопасность для плода: не рекомендуется использовать фторхинолоны в течение всего периода беременности, ко-тримоксазол противопоказан в I и III триместре. Аминогликозиды и ванкомицин допустимо применять только по жизненным показаниям. Основными препаратами являются пенициллины или цефалоспорины III поколения (цефотаксим).
Обязательна госпитализация пациентки с изоляцией от ребенка и с прекращением кормления грудью.
У людей пожилого возраста функция почек нередко снижена, что требует особой осторожности при использовании аминогликозидов. Следует помнить, что у таких пациентов выведение ванкомицина замедлено (период полувыведения составляет 7,5 дней). Отмечается также большая частота НР при применении ко-тримоксазола.
источник
Как бы ни называли сопровождаемое некрозом и расплавлением тканей воспаление – нарывом, гнойником или абсцессом – воспалительный процесс и нагноение в 99% случаев вызваны бактериальной инфекцией, справиться с которой помогают антибиотики при абсцессе.
Воспаление в виде абсцесса – ограниченной пиогенной мембраной полости, содержащей гнойный экссудат – результат местной защитной реакции организма: тканевые макрофаги и лейкоцитарные нейтрофилы устремляются к месту заражения и поглощают бактерии, но при этом погибают и вместе с отмершими клетками образуют гной.
Главной причиной образования таких очагов воспаления считаются грамположительные факультативно анаэробные бактерии рода Staphylococcus spp., в первую очередь, золотистый стафилококк (Staphylococcus aureus). Однако очень часто к образованию пиогенного абсцесса причастно сразу несколько разновидностей бактерий – грамположительных и грамположительных, аэробных и анаэробных.
И антибиотики при гнойных абсцессах применяются при выявлении в гнойном содержимом: Staphylococcus epidermidis, Streptococcus pyogenes, Streptococcus pneumoniae, Pseudomonas aeruginosa (синегнойной палочки), Escherichia coli (кишечной палочки), Klebsiella pneumoniae, Proteus mirabilis.
Показания к применению антибактериальных средств при абсцессах горла, окологлоточного пространства и легкого, а также одонтогенных нагноений обусловлены и наиболее вероятным присутствием таких анаэробных бактерий и бактероидов, как Peptostreptococcus spp., Clostridium perfringens, Clostridium septicume, Prevotella melaninogenica, Bacteroides fragilis и Bacteroides oralis.

Цефотаксим и Цефоперазон выпускаются в форме порошка (во флаконах) для приготовления раствора, используемого для парентерального введения.
Форма выпуска Клиндамицина: капсулы (по 75, 150 и 300 мг), 15% раствора фосфата (в ампулах по 2, 4 и 6 мл); гранул (во флаконах) – для приготовления сиропа для детей.
Джозамицин – таблетки и суспензия, Доксициклин – капсулы.
Амоксиклав: таблетки (250 и 500 мг), порошок для приготовления суспензии для приема внутрь и порошок для приготовления инъекционного раствора.
Корреляция назначаемого препарата и локализации гнойного очага минимальна, а вот определение конкретного возбудителя имеет решающее значение. Антибиотики при абсцессе легкого должны назначаться с учетом того, что в развитии абсцедирующей пневмонии главную роль играет Staphylococcus aureus, поэтому эффективнее всего с ним будут бороться циклоспориновые антибиотики III поколения и линкозамиды.
Кроме них, антибиотики при абсцессе мягких тканей могут включать препараты группы макролидов.
Антибиотики при абсцессе ягодицы не применяются, когда воспаление возникло в месте инъекции и при этом бактериальная инфекция отсутствует, то есть абсцесс является асептическим (а его лечат кортикостероидами). Но в остальных случаях после вскрытия гнойника и его дренирования используют антибиотики, как правило, пенициллиновые производные.
Препараты для этиологического лечения паратонзиллярного абсцесса, то есть антибиотики при абсцессе горла должны проявлять активность в отношении Staphylococcus aureus, Streptococcus pyogenes, Klebsiella spp., Proteus spp., Escherichia coli. Это могут быть как пенициллиновые антибиотики с расширенным спектром воздействия, так и макролиды. А вот антибиотики группы тетрациклина и аминогликозиды при гнойниках в горле вряд ли помогут.
Антибактериальная терапия ретрофарингеального абсцесса, то есть лечение заглоточного абсцесса антибиотиками проводится с учетом инфекции, типичной для этого заболевания: стафилококков, пептострептококков и бактероидов. И в данном случае максимальный эффект будет от цефалоспоринов и комбинации пенициллинов с клавулановой кислотой.
К развитию одонтогенных абсцессов (пародонтального или периапикального), как правило, причастна Pseudomonas aeruginosa (синегнойная палочка) и анаэробы. Поэтому, назначая антибиотики при абсцессе зуба, врачи должны иметь в виду, что на анаэробные бактерии не действует аминогликозиды, а P. aeruginosa проявляет резистентность не только к аминогликозидам, но и к пенициллиновым бета-лактамам.
В данном обзоре представлены названия антибактериальных препаратов, которые чаще всего применяются в лечении абсцессов:
- цефалоспориновые антибиотики III поколения Цефотаксим, Цефоперазон (Церазон, Цефобоцид, Медоцеф, Цеперон и др. торговые названия);
- антибиотики группы линкозамидов Клиндамицин (Клиндацин, Клинимицин, Клеоцин, Далацин), Линкомицин;
- макролид Джозамицин (Вильпрафен);
- тетрациклиновый антибиотик широкого спектра действия Доксициклин (Вибрамицин, Доксацин, Доксилин, Новациклин, Медомицин);
- Амоксиклав (Амоксил, Аугментин, Ко-амоксиклав, Клавамокс) из группы пенициллиновых бета-лактамов.

Все цефалоспорины, в том числе Цефотаксим и Цефоперазон, уничтожают микроорганизмы, блокируя ферменты бактерий, необходимые для выработки углеводных компонентов стенок их клеток – мукопептидов (пептидогликанов). Таким образом, клетки бактерий лишаются наружной защиты и погибают. Аналогична фармакодинамика Амоксиклава, защищенного от бета-лактамаз бактерий клавулановой кислотой.
В основе действия линкозамидов (Клиндамицина), макролидов (Джозамицина), а также тетрациклинов (Доксициклина и других усовершенствованных препаратов данной группы) лежит их способность связываться с молекулами РНК (цитоплазматическими рибосомами) на мембранах бактерий – с нуклеотидными субъединицами 30S, 50S или 70S. В результате происходит замедление и практически полное прекращение биосинтеза белков в бактериальных клетках. В первом случае препараты действуют как бактериостатики, во втором – бактерицидно.

После введения в мышцу или в/в Цефотаксим и Цефоперазон попадают в системный кровоток с достижением максимальной концентрации – соответственно, через полчаса и пять минут (и сохраняется в течение 12-ти часов после однократного применения); связывание с протеинами плазмы не превышает 40%. Из организма цефалоспорины выводятся почками и кишечником с Т1/2 – 60-90 минут.
Биологическая доступность Клиндамицина доходит до 90%, и препарат попадает во все ткани и жидкости организма, а его наивысший уровень в крови отмечается в среднем через два часа после парентерального введения и максимум через час после приема внутрь.
Метаболизм препарата происходит в печени; элиминация через кишечник и почки; период полувыведения длится от двух до трех часов.
Фармакокинетика Джозамицина характеризуется быстрым всасыванием в желудке, высокой степенью проникновения и накоплением в мягких тканях, коже и подкожной клетчатке, небных миндалинах и легких; максимальная концентрация отмечается в среднем через 1,5 часа после приема таблеток или суспензии. При этом с белками плазмы крови связывается не более 15% активного вещества препарата. Расщепляется Джозамицин ферментами печени, а элиминируется с калом и мочой.
Быстро абсорбируется и антибиотик Доксициклин, 90% которого связывается с протеинами плазмы; через два часа после перорального приема концентрация препарата максимальная. Выведение через кишечник, Т1/2 может составлять 15-25 часов
Амоксиклав, состоящий из амоксициллин и клавулановой кислоты, достигает максимального уровня в крови через час – при любом способе применения; связывание амоксициллина с белками крови – до 20%, клавулановой кислоты – до 30%. Препарат проникает и накапливается в гайморовой полости, среднем ухе, легких, плевре и тканях внутренних половых органов. Метаболизм клавулановой кислоты происходит в печени, а продукты ее расщепления выводятся почками, кишечником и легкими. Почти 70% амоксициллина экскретируется почками в нерасщепленном виде.

источник
Абсцесс головного мозга — это ограниченное скопление гноя в полости черепа. Различают три вида абсцессов: внутримозговые, субдуральные и эпидуральные. Симптомы абсцесса головного мозга зависят от его месторасположения и размеров. Они не являются специфичными и могут составлять клинику любого объемного образования. Диагностируется абсцесс головного мозга по данным КТ или МРТ головного мозга. При абсцессах небольшого размера подлежат консервативному лечению. Абсцессы, расположенные вблизи желудочков головного мозга, а также вызывающие резкий подъем внутричерепного давления, требуют хирургического вмешательства, при невозможности его проведения — стереотаксической пункции абсцесса.
Абсцесс головного мозга — это ограниченное скопление гноя в полости черепа. Различают три вида абсцессов: внутримозговые (скопление гноя в веществе мозга); субдуральные (расположенные под твердой мозговой оболочкой); эпидуральные (локализованные над твердой мозговой оболочкой). Основными путями проникновения инфекции в полость черепа являются: гематогенный; открытая проникающая черепно-мозговая травма; гнойно-воспалительные процессы в придаточных пазухах носа, среднем и внутреннем ухе; инфицирование раны после нейрохирургических вмешательств.
Причиной образования гематогенных абсцессов головного мозга чаще всего являются воспалительные процессы в легких (бронхоэктатическая болезнь, эмпиема плевры, хроническая пневмония, абсцесс легкого). В таких случаях бактериальным эмболом становится фрагмент инфицированного тромба (из сосуда на периферии воспалительного очага), который попадет в большой круг кровообращения и потоком крови разносится в сосуды мозга, где и фиксируется в мелких сосудах (прекапилляре, капилляре или артериоле). Незначительную роль в патогенезе абсцессов могут играть хронический (или острый) бактериальный эндокардит, инфекции ЖКТ и сепсис.
В случае открытой проникающей черепно-мозговой травмы абсцесс мозга развивается вследствие прямого попадания инфекции в полость черепа. В мирное время доля таких абсцессов составляет 15-20%. В условиях боевых действий она возрастает в разы (минно-взрывные ранения, огнестрельные ранения).
При гнойно-воспалительных процессах в придаточных пазухах носа (синусит), среднем и внутреннем ухе возможны два пути распространения инфекции: ретроградный — по синусам твердой мозговой оболочки и мозговым венам; и непосредственное проникновение инфекции через твердую оболочку мозга. Во втором случае отграниченный очаг воспаления первоначально формируется в мозговых оболочках, а затем — в прилежащем отделе мозга.
Абсцессы мозга, формирующиеся на фоне интракраниальных инфекционных осложнений после нейрохирургических вмешательств (вентрикулиты, менингиты), возникают, как правило, у тяжелых, ослабленных больных.
Среди выделенных возбудителей гематогенных абсцессов головного мозга преобладают стрептококки, часто в ассоциации с бактериотидами (Bacteroides spp.). Для гематогенных и отогенных абсцессов характерны Enterobacteriaceae (в том числе Proteus vulgaris). При открытой проникающей черепно-мозговой травме в патогенезе абсцесса мозга преобладают стафилококки (St. aureus), реже Enterobacteriaceae. При различных иммунодефицитных состояниях (иммунодепрессивная терапия после трансплантации органов и тканей, ВИЧ-инфекция) из посева содержимого абсцесса головного мозга выделяют Aspergillus fumigatus. Однако идентифицировать возбудителя инфекции в содержимом абсцесса мозга довольно часто не представляется возможным, так как в 25-30 % случаев посевы содержимого абсцесса оказываются стерильными.
Формирование абсцесса мозга проходит в несколько этапов.
- 1-3 сутки. Развивается ограниченное воспаление мозговой ткани — энцефалит (ранний церебрит). На данном этапе воспалительный процесс обратим. Возможно как спонтанное его разрешение, так и под влиянием антибактериальной терапии.
- 4-9 сутки. В результате недостаточных защитных механизмов или в случае неверного лечения воспалительный процесс прогрессирует, в его центре полость, заполненная гноем, способная к увеличению.
- 10-13 сутки. На этой стадии вокруг гнойного очага формируется защитная капсула из соединительной ткани, которая препятствует распространению гнойного процесса.
- Третья неделя. Капсула окончательно уплотняется, вокруг нее формируется зона глиоза. В дальнейшем развитие ситуации зависит от вирулентности флоры, реактивности организма и адекватности лечебно-диагностических мероприятий. Возможно обратное развитие абсцесса мозга, но чаще увеличение его внутреннего объема или образование новых очагов воспаления по периферии капсулы.
На сегодняшний день патогномоничная симптоматика не выявлена. Клиническая картина при абсцессах головного мозга схожа с клинической картиной объемного образования, когда клинические симптомы могут варьироваться от головной боли до тяжелейших общемозговых симптомов, сопряженных с угнетением сознания и выраженными очаговыми симптомами поражения головного мозга. В некоторых случаях первым проявлением болезни становится эпилептиформный припадок. Могут наблюдаться менингеальные симптомы (при субдуральных процессах, эмпиеме). Эпидуральные абсцессы головного мозга зачастую ассоциируются с остеомиелитом костей черепа. Наблюдается прогредиентное нарастание симптоматики.
Для диагностирования абсцесса головного мозга огромное значение имеет тщательный сбор анамнеза (наличие очагов гнойной инфекции, острое инфекционное начало). Наличие воспалительного процесса, сопряженного с появлением и усугублением неврологических симптомов — основание для дополнительного нейровизуализационного обследования.
Точность диагностирования с помощью КТ головного мозга зависит от стадии формирования абсцесса. На ранних стадиях заболевания диагностика затруднена. На этапе раннего энцефалита (1-3 сутки) КТ определяет зону сниженной плотности неправильной формы. Введенное контрастное вещество накапливается неравномерно, преимущественно периферических отделах очага, реже в центре. На более поздних этапах энцефалита контуры очага приобретают ровные округлые очертания. Контрастное вещество распределяется равномерно, по всей периферии очага; плотность центральной зоны очага при этом не меняется. Однако на повторной КТ (через 30-40 минут) определяется диффузия контраста в центр капсулы, а также наличие его и в периферической зоне, что не характерно для злокачественных новообразований.
Инкапсулированный абсцесс мозга на КТ имеет вид округлого объемного образования с четкими ровными контурами повышенной плотности (фиброзная капсула). В центре капсулы зона пониженной плотности (гной), по периферии видна зона отека. Введенное контрастное вещество накапливается в виде кольца (по контуру фиброзной капсулы) с небольшой прилежащей зоной глиоза. На повторной КТ (через 30-40 минут) контрастное вещество не определяется. При исследовании результатов компьютерной томографии следует учесть, что противовоспалительные препараты (глюкокортикостероиды, салицилаты) в значительной степени влияют на скопление контраста в энцефалитическом очаге.
МРТ головного мозга — более точный метод диагностирования. При проведении МРТ на первых стадиях формирования абсцесса мозга (1-9 сутки) энцефалитический очаг выглядит: на Т1-взвешенных изображениях — гипоинтенсивным, на Т2-взвешенных изображениях — гиперинтенсивным. МРТ на поздней (капсулированной) стадии абсцесса головного мозга: на Т1-взвешенных изображениях абсцесс выглядит, как зона пониженного сигнала в центре и на периферии (в зоне отека), а по контуру капсулы сигнал гиперинтенсивный. На Т2-взвешенных изображениях центр абсцесса изо- или гипоинтенсивный, в периферической зоне (зоне отека) гиперинтенсивный. Контур капсулы четко очерчен.
Дифференциальная диагностика абсцесса головного мозга должна проводиться с первичными глиальными и метастатическими опухолями полушарий мозга. При сомнениях в диагнозе следует проводить МЗ-спектроскопия. В таком случае дифференциация будет основываться на различном содержании аминокислот и лактата в опухолях и абсцессах головного мозга.
Иные способы диагностики и дифференциальной диагностики абсцесса головного мозга малоинформативны. Увеличение СОЭ, повышенное содержание С-реактивного белка в крови, лейкоцитоз, лихорадка — симптомокомплекс практически любых воспалительных процессов, включая внутричерепные. Бакпосевы крови при абсцессах головного мозга в 80-90% стерильны.
На энцефалитической стадии абсцесса (анамнез – до 2 недель), а также в случае небольшого абсцесса головного мозга (до 3 см в диаметре) рекомендовано консервативное лечение, основой которого должна стать эмпирическая антибактериальная терапия. В некоторых случаях возможно проведение стереотаксической биопсии в целях окончательной верификации диагноза и выделения возбудителя.
Абсцессы, вызывающие дислокацию мозга и повышение внутричерепного давления, а также локализованные в зоне желудочковой системы (попадание гноя в желудочковую систему зачастую приводит к летальным исходам) — абсолютные показания к хирургическому вмешательству. Травматические абсцессы головного мозга, расположенные в зоне инородного тела также подлежат хирургическому лечению, так как данный воспалительный процесс не поддается консервативному лечению. Несмотря на неблагоприятный прогноз, грибковые абсцессы также являются абсолютным показанием к хирургическому вмешательству.
Противопоказанием к хирургическому лечению являются абсцессы мозга, расположенные в жизненно важных и глубинных структурах (зрительный бугор, ствол мозга, подкорковые ядра). В таких случаях возможно проведение стереотаксического метода лечения: пункция абсцесса мозга и его опорожнение с последующим промыванием полости и введением антибактериальных препаратов. Возможно как однократное, так и многократное (через установленный на несколько суток катетер) промывание полости.
Тяжелые соматические заболевания не являются абсолютным противопоказанием к проведению хирургического лечения, так как стереотаксическая операция может проводиться и под местной анестезией. Абсолютным противопоказанием к проведению операции может быть только крайне тяжелое состояние пациента (терминальная кома), так как в таких случаях любое оперативное вмешательство противопоказано.
Целью эмпирической (в отсутствии посева или при невозможности выделения возбудителя) антибактериальной терапии является покрытие максимально возможного спектра возбудителей. В случае абсцесса головного мозга без черепно-мозговой травмы или нейрохирургического вмешательства в анамнезе показан следующий алгоритм лечения: ванкомицин; цефалоспорины III поколения (цефотаксим, цефтриаксон, цефиксим); метронидазол. В случае посттравматического абсцесса головного мозга метронидазол заменяют на рифампицин.
Возбудителем абсцесса головного мозга у пациентов с иммунодефицитными состояниями (кроме ВИЧ) чаще всего является Cryptococcus neoformans, реже Сandida spp или Aspergillius spp. Поэтому в данных случаях назначают амфоретицин В или липосомальный амфоретицин В. В случае исчезновение абсцесса (по данным нейровиуализационных исследований) назначают флуконазол в течение 10 недель, впоследствии дозу уменьшают вдвое и оставляют в качестве поддерживающей. У пациентов с ВИЧ возбудителем абсцесса головного мозга чаще всего является Toxoplasma gondii, поэтому эмпирическое лечение таких пациентов должно включать в себя сульфадиазин с пириметамином.
После выделения возбудителя из посева лечение необходимо изменить, учитывая антибиотикограмму. В случае стерильного посева следует продолжить эмпирическую антибактериальную терапию. Продолжительность интенсивной антибактериальной терапии — не менее 6 недель, после этого рекомендуется сменить антибиотики на пероральные и продолжить лечение еще 6 недель.
Назначение глюкокортикоидов оправдано только в случае адекватной антибактериальной терапии, так как только при положительном прогнозе глюкокортикоиды могут вызвать уменьшение выраженности и обратное развитие капсулы абсцесса головного мозга. В иных случаях их применение может вызвать распространение воспалительного процесса за пределы первичного очага.
Основными методами хирургического лечения внутримозговых абсцессов являются простое или приточно-отточное дренирование. Их суть заключается в установке в полость абсцесса катетера, через который осуществляется эвакуация гноя с последующим введением антибактериальных препаратов. Возможна установка второго катетера меньшего диаметра (на несколько суток), через который проводится инфузия раствора для промывания (чаще всего, 0,9 % раствора хлорида натрия). Дренирование абсцесса необходимо сопровождать антибактериальной терапией (сначала эмпирической, далее — с учетом чувствительности к антибиотикам выделенного патогена).
Стереотаксическая аспирация содержимого абсцесса без установки дренажа — альтернативный метод хирургического лечения абсцесса головного мозга. Главные его преимущества — снисходительные требования к квалификации медперсонала (для контроля над функционированием приточно-отточной системы необходимы пристальное внимание и специальные знания) и меньший риск вторичного инфицирования. Однако в 70% использования данного метода возникает необходимость повторных аспираций.
В случае множественных абсцессов головного мозга необходимо в первую очередь дренировать очаг, наиболее опасный в отношении осложнений (прорыв гноя в желудочковую систему, дислокация мозга), а также наиболее значимый в клинической картине. В случае эмпиемы или субдурального абсцесса головного мозга применяют дренирование, не используя приточно-отточную систему.
В прогнозировании абсцессов головного мозга большое значение имеет возможность выделить возбудителя из посева и определить его чувствительность к антибиотикам, только в этом случае возможно проведение адекватной патогенетической терапии. Кроме этого, исход заболевания зависит от количества абсцессов, реактивности организма, адекватности и своевременности лечебных мероприятий. Процент летальных исходов при абсцессах головного мозга — 10%, инвалидизации — 50%. Почти у трети выживших пациентов последствием заболевания становится эпилептический синдром.
При субдуральных эмпиемах прогнозы менее благоприятны из-за отсутствия границ гнойного очага, так это свидетельствует высокой вирулентности возбудителя, либо о минимальной сопротивляемости пациента. Летальность в таких случаях — до 50%. Грибковые эмпиемы в сочетании с иммунодефицитными состояниями в большинстве случаев (до 95%) приводят к летальному исходу. Эпидуральные эмпиемы и абсцессы головного мозга обычно имеют благоприятный прогноз. Проникновение инфекции через неповрежденную твердую мозговую оболочку практически исключено. Санация остеомиелитического очага позволяет устранить эпидуральную эмпиему. Своевременное и адекватное лечение первичных гнойных процессов, а также полноценная первичная обработка ран при ЧМТ позволяют в значительной степени снизить возможность развития абсцесса головного мозга.
источник
В лечении абсцессов головного мозга имеются два основных направления – консервативная терапия и оперативное лечение. Выбор метода лечения абсцесса мозга зависит от вида, стадии развития заболевания, сопутствующих осложнений.
На начальных стадиях развития рассматриваемого заболевания, а именно – в стадии энцефалита (2-3 недели от начала заболевания) показано консервативное лечение, в частности – терапия антибиотиками.
Направление терапии может быть определено бактериологическим лабораторным анализом гноя (посредством пункции), а также стереотаксической биопсией.
Лекарственные препараты, применяемые для лечения абсцессов головного мозга:
- Антибиотики группы цефалоспоринов III поколения — цефтриаксон, цефотаксим, цефиксим.
- Ванкомицин.
- Метронидазол (или, при абсцессе вследствие травмы головы – рифампицин).
- При абсцессе головного мозга у больного с состоянием иммунодефицита часто назначают амфоретицинВ или липосомальныйамфоретицин В, дальше – флуконазол.
- У ВИЧ-инфицированных больных возбудителем абсцесса головного мозга чаще всего является токсоплазма, поэтому таким пациентам назначаются сульфадиазин, пириметамин.
Антибиотикотерапия выполняется в интенсивном режиме в течение полутора 
Глюкокортикоиды в терапии абсцесса головного мозга назначаются осторожно, и только в случае адекватной терапии с хорошими результатами, иначе эти препараты могут вызвать дальнейшее распространение инфицирования на другие участки мозга, нарушение капсулы абсцесса.
Оперативное лечение абсцесса головного мозга выполняется только в случае уже сформировавшегося абсцесса, имеющего капсулу, по результатам диагностики.
- Абсцесс ГМ, который находится в желудочковой зоне мозга.
- Абсцесс, являющийся причиной гипертензии мозга.
- Абсцесс ГМ, являющийся последствием проникающей открытой травмы, и расположенный вокруг инородного предмета.
- Абсцесс ГМ грибковой природы.
- Наличие инородного тела в веществе мозга.
- Отсутствие возможности дренировать абсцесс – показания для открытой операции.
- Несформировавшийся абсцесс ГМ на начальных стадиях заболевания (при начальном энцефалите).
- Расположение абсцесса в структурахГМ, которые являются жизненно важными – например, в стволе мозга, зрительном бугре, ядрах подкорки. В некоторых подобных случаях сохраняется возможность выполнения стереотаксического метода – то есть, пункции полости абсцесса с промыванием и введением лекарственных препаратов.
- Терминальная кома, крайне тяжелое состояние больного.
- Очень глубокое расположение абсцесса, когда не избежать опасных последствий.
- Несколько абсцессов ГМ одновременно, не подлежащие оперативному лечению.
Существует три основных метода оперативного лечения абсцесса головного мозга — приточно-отточное дренирование, стереотаксическая аспирация и удаление абсцесса классическим методом со вскрытием черепной коробки и оболочек мозга.
Выбор метода оперативного лечения зависит от вида и степени формирования абсцесса, а также от места его локализации и общего состояния больного.
- Осуществление простого приточно-отточного дренирования.
- Данное оперативное вмешательство чаще всего выполняют под местной анестезией тканей в месте установки дренажей, потому что вещество головного мозга к боли нечувствительно.
- В капсулу абсцесса вводится катетер, через который выполняется откачивания гноя из полости и дальнейшее введение лекарственных препаратов.
- Иногда, для наилучшего промывания капсулы абсцесса, вводят два дренажа, один из которых – для вливания лекарственного препарата (чаще всего –раствор хлорида натрия), другой – для аспирации содержимого.
- Катетер для дренирования может быть установлен на несколько дней, для повторных промываний полости абсцесса.
Дренирование абсцесса ГМ всегда сопровождается интенсивной консервативной терапией.
- Стереотаксическая аспирация гноя из полости абсцесса.
Выполняется так же, как и дренирование абсцесса, но – без установки катетера в полость.
- Открытая операция по удалению абсцесса головного мозга.
- Пациента вводят в общий наркоз. (Иногда операция может быть выполнена при местной анестезии – например, при небольшом разрезе). Голова пациента должна быть обрита в зоне доступа к абсцессу.
- Разрезаются мягкие ткани – кожа, мышцы — в зоне операции, разводятся в стороны расширителями. Снимается надкостница, покрывающая кость черепа.
- Хирургический доступ в кости черепа в большинстве случаев выполняют сверлом для хирургической трепанации. Твердая оболочка ГМ рассекается крестообразно.
- В полость абсцесса вводятся хирургические инструменты для аспирации гноя и удаления абсцесса вместе с капсулой. Производятся хирургические манипуляции.
- Хирургическую рану ушивают в обратном порядке, иногда оставляют катетер для аспирации гноя из раны и введения лекарственных средств.
Исход рассматриваемого заболевания зависит от многих факторов, прежде всего – от своевременности лечения и адекватности лечебных мероприятий, реактивности организма больного, от стадии, вида, количества абсцессов, сопутствующих заболеваний.
При абсцессах головного мозга:
- Летальный исход – в 10% случаев.
- Инвалидность – в 50% случаев.
- Сохраняющийся эпилептический статус – в 35% случаев у всех выживших больных.
- Субдуральные абсцессы, а также абсцессы грибковой природы, имеют больший процент летальности – от 50% до 95%.
При отсутствии осложнений послеоперационный период отмечается положительной динамикой в состоянии больного. Пациент и в послеоперационном периоде получает лечение антибиотиками.

источник
*Импакт фактор за 2017 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
НИИ нейрохирургии им. акад. Н.Н. Бурденко РАМН, Москва
Абсцесс головного мозга (АМ) представляет собой ограниченное капсулой скопление гноя в паренхиме мозга. Развивается чаще всего в результате проникновения в мозговую ткань бактерий, грибов или простейших микроорганизмов.
Несмотря на появление сильнодействующих антибактериальных средств и достижения микробиологической и радиологической диагностики, заболеваемость АМ сохраняется на сравнительно стабильном уровне. Соотношение мужчин и женщин составляет 2:1 при том, что средний возраст заболевших 35 – 45 лет. В 25% случаев АМ развивается у детей и подростков моложе 15 лет. До 2-х лет встречается редко (последствие менингита, вызванного Citrobacter diversus или другой грамотрицательной флорой). Максимальные пики развития АМ после среднего отита, как правило, приходятся на детский возраст и после 40 лет, тогда как абсцессы после синуситов чаще встречаются в возрасте от 10 до 30 лет. В то же время АМ являются основным видом внутричерепных инфекций у больных с ВИЧ. Так, распространенность токсоплазмозного энцефалита среди больных ВИЧ составляет от 2,6 до 30,8%.
До широкого применения антибиотиков основными возбудителями АМ являлись золотистый стафилококк, стрептококки и коли-бактерии, а у 50% больных возбудитель вообще не определялся. Совершенствование диагностических методов привело к уменьшению числа “стерильных” абсцессов и выявило роль анаэробных бактерий в развитии АМ.
В настоящее время считают, что 30–60% АМ являются результатом смешанной инфекции. При этом аэробные бактерии выделяют в 61% случаев, а анаэробы – в 32%. Половину всех аэробных культур составляют аэробные или микроаэрофильные стрептококки, выделяемые у 70% больных с АМ. К наиболее часто выделяемым стрептококкам относят принадлежащие к группе Streptococcus intermedius (Streptococcus anginosus, Streptococcus constellatus, Streptococcus milleri и др.).
S. Aureus выделен у 15% больных, в большинстве – это люди с черепно-мозговой травмой (ЧМТ) или перенесшие нейрохирургическую операцию.
Аэробные грамотрицательные бациллы (Proteus sp., E. coli, Klebsiella sp., Enterobacter sp. и P. aeruginosa) были выделены у 23–33% больных; 5–10% случаев составляют виды Haemophilus, в основном Haemophilus aphrophilus.
Анаэробные культуры чаще всего выделяют при АМ у больных с инфекцией легких и хроническими отитами, к ним относятся Bacteroides sp. (включая Bacteroides fragilis), Fusobacterium sp., Prevotella sp., анаэробные стрептококки и Clostridium sp.
Локализация и источник образования АМ позволяют предположить вероятного возбудителя процесса. Например, синусит чаще вызывается представителем группы S. intermedius и является источником АМ, локализующегося в лобной доле мозга, при этом сфеноидальные синуситы чаще вызывают АМ. При хроническом синусите одновременно выявляют нескольких возбудителей в соотношении аэробов к анаэробам, равным 1:1,5. Стафилококки, как правило, являются возбудителями посттравматических и послеоперационных АМ.
Абсцесс височной доли чаще развивается как осложнение среднего отита и обусловлен смешанной инфекцией. Возбудителями острых средних отитов, осложненных развитием АМ, являются S. pneumoniae, H. influenzae и Moraxella catarrhalis. Другие стрептококки, грамотрицательные анаэробы (включая P. aeruginosa, анаэробные кокки и Bacteroides sp.), являются основными возбудителями хронических средних отитов и связанных с ними АМ у 33% больных.
В 85–95% случаев мозжечковые АМ обусловлены мастоидитами. У 10% больных АМ являются одонтогенными. Однако и у больных с “криптогенным” АМ часто выявляют периапикальные абсцессы.
Следует отметить, что пневмококки, менингококки и H. influenzae редко выделяют из АМ, даже при гнойных менингитах. Диагноз пневмококкового АМ требует немедленного обследования больного на наличие предрасполагающего фактора – вируса иммунодефицита.
У больных со сниженным иммунитетом возбудителями АМ могут стать грибы, а Toxoplasma gondii типична для АМ у больных СПИДом. При нейтропениях чаще выделяют аэробные грамотрицательные бактерии, Candida sp., Aspergillus sp. или zygomycosis. В 50% случаев АМ, развивающиеся после пересадки костного мозга, обусловлены Aspergillus sp. и сопровождаются высоким уровнем летальности. У больных с нарушениями клеточного иммунитета возбудителями АМ являются T. gondii, Nocardia asteroides, L. monocytogenes, Myco-bacterium sp. или Cryptococcus neoformans.
Обзор литературы за прошедшие полвека показал, что в 45% случаев развитие АМ было обусловлено контактным распространением (отиты или синуситы). При этом в последние 10 лет отмечается снижение числа отогенных АМ, связанное с применением современных антимикробных средств. Контактное распространение инфекции происходит в основном по одному из двух главных механизмов: при прямом распространении через зону, прилегающую к остеиту или остеомиелиту, или при ретроградном распространении по эмиссарным венам.
Бактериальный менингит у взрослых редко осложняется АМ, тогда как у новорожденных развитие АМ может осложнить течение грамотрицательного менингита, обусловленного Citrobacter или Proteus sp.
Гематогенный путь развития АМ типичен для 25% больных с этой патологией, особенно, когда источником являются легочные инфекционные заболевания.
Для гематогенного АМ характерны:
• локализация в бассейне средней мозговой артерии;
• локализация на границе серого и белого вещества мозга;
• плохое образование капсулы;
• высокий уровень летальности;
Если в докомпьютерный период множественные АМ встречались всего у 1–15% больных, с появлением КТ такой диагноз ставится в 10–50% случаев.
Предрасполагающими факторами для развития АМ являются хронические легочные инфекции (абсцессы, бронхоэктазы и эмпиема), остеомиелиты, холециститы, желудочно-кишечные инфекции и/или инфекционные процессы в малом тазе. Реже АМ встречается при осложнениях таких заболеваний, как бактериальные эндокардиты, наследственная геморрагическая телеангиэктазия (болезнь Рандю–Вебера–Ослера), врожденные пороки сердца.
Гнойно-воспалительные осложнения плановых нейрохирургических операций составляют 0,6–1,7%, и 10% из них – АМ. При проникающей ЧМТ АМ образуются значительно чаще, а фактором риска являются огнестрельное поражение мозга и проникновение в мозг костных отломков и поверхностных тканей.
Экспериментальные данные показывают высокую резистентность мозговой ткани к инфекции, поэтому образование АМ требует наличия в той или иной степени поврежденного участка головного мозга.
Полицитемия и гипоксия, которые встречаются у больных с врожденными пороками сердца и при наследственной геморрагической телеангиэктазии, повышают вязкость крови и снижают скорость кровотока в капиллярах мозга. Это приводит к появлению микроинфарктов или участков со сниженной оксигенацией, которые могут стать очагом последующей инфекции.
На экспериментальной модели было показано, что гистопатологическая картина АМ складывается из 4 стадий.
1. Ранний церебрит (неинкапсулированный очаг инфекционного поражения мозга) – плохо отграниченный очаг с диффузным воспалением, перифокальным отеком и деструкцией вещества мозга. Формируется в течение 1–3 сут после внутримозговой инокуляции.
2. Поздний церебрит – центральная часть очага нагнаивается и некротизируется с формированием полости, заполненной полужидким гноем. По периферии скапливаются фибробласты (4–9 сут).
3. Начало образования глиозной капсулы – увеличение слоя фибробластов с ободком неоваскуляризации и реактивным астроцитозом (10–13 сут).
4. Формирование глиозной капсулы – уплотнение капсулы с реактивным коллагеном (более 2 нед).
Необходимо отметить, что сроки развития и степень выраженности перечисленных стадий могут варьировать в зависимости от возбудителя, пути распространения и т.д. Так, например, при контактном распространении капсула абсцесса представляет собой более прочное и четкое образование, чем при гематогенном.
Таким образом, формирование АМ проходит от стадии церебрита до стадии четкого отграничения некротического фокуса. Степень выраженности последней стадии зависит от конкретного возбудителя, иммунного статуса больного и степени гипоксии в данном участке мозговой ткани.
Клиника АМ может варьировать от вялотекущей до молниеносной. Очаговые симптомы поражения головного мозга связаны с гибелью мозговой ткани и выпадением функции в зоне локализации абсцесса. Токсины гнойного воспаления обладают тропизмом к нейронам, вызывая их необратимые дистрофические изменения и гибель. Поэтому в большинстве случаев АМ проявляется очаговыми неврологическими нарушениями, а не симптомами системной инфекции.
В целом клиническая картина неспецифична, зависит от вирулентности микроорганизма, иммунного статуса больного, локализации абсцесса(ов), наличия или отсутствия сопутствующего менингита или вентрикулита. Лишь у части больных отмечается классическая триада, включающая лихорадку, головную боль и очаговые неврологические нарушения. Головная боль – наиболее частый клинический симптом – встречается у 70% больных. Лихорадка – только у 50% взрослых больных и 80% детей. Очаговые неврологические нарушения проявляются у 50% больных и включают как двигательные нарушения, так и нарушения со стороны черепно-мозговых нервов.
При абсцессе полушария мозжечка отмечают нистагм, атаксию, рвоту и дисметрию, а при абсцессе лобной доли – головную боль, сонливость и нарушения сознания, наряду с двигательными и речевыми нарушениями.
Эпилептические припадки (в основном генерализованные) возникают у 25–45% больных. Тошнота и рвота нередко манифестируют как проявления внутричерепной гипертензии (ВЧГ). Менингеальные симптомы доминируют у 25% больных. Абсцессы в области турецкого седла могут вызывать симптомы, характерные для поражения гипофиза: головную боль, дефекты полей зрения, эндокринные нарушения.
В связи с этим дифференциальный диагноз АМ проводят с опухолевым поражением, хроническим менингитом, хронической субдуральной гематомой и вирусным энцефалитом.
Обычные исследования крови и мочи, как правило, бесполезны в диагностике АМ. Лейкоцитоз встречается только у 40% больных. Концентрация С-реактивного белка может помочь только в дифференциальной диагностике АМ и опухолей мозга.
Люмбальная пункция при АМ опасна (риск вклинения составляет более 20%), а возбудитель в спинномозговой жидкости (СМЖ) обнаруживается редко. Исследование СМЖ позволяет исключить бактериальный менингит, хотя диагноз последнего может подтверждаться одной лишь совокупностью клинических симптомов.
Наиболее точными диагностическими методами в настоящее время являются компьютерная томография (КТ) и магнитно-резонансная томография (МРТ). КТ позволяет в 95% случаев установить локализацию абсцесса, определить наличие отека мозга, гидроцефалии и/или смещения срединных структур. АМ во время КТ выглядит как круглый очаг низкой плотности, окруженный тонким, с повышенным накоплением контраста, обычно ровным кольцом. Ограничения метода КТ обусловлены тем, что злокачественная опухоль или инфаркт мозга, окруженные ободком неоваскуляризации, на КТ выглядят сходно. В то же время только у 40–60% больных с АМ, получающих глюкокортикоидную терапию, на КТ обнаруживают характерное, накапливающее контраст кольцо. Рентгеновские методы используют и для обнаружения очагов инфекции – источников АМ, для чего на КТ внимательно исследуют сосцевидные отростки и придаточные пазухи, проводят рентгенографию грудной клетки.
Данные об использовании МРТ в диагностике АМ в настоящее время продолжают накапливаться. По оценкам специалистов, МРТ – такой же чувствительный метод, как и КТ, а в некоторых случаях даже превосходит его (выявление АМ на стадии церебрита).
Лечение АМ проводится комплексно и включает в себя медикаментозные (консервативные) и хирургические меры. Выбор оптимальных из них определяется гистопатологической стадией АМ по данным КТ (МРТ) исследования. На стадии церебрита эффективно медикаментозное лечение, а нейрохирургическое вмешательство не показано, тогда как при уже сформировавшемся абсцессе с плотной капсулой консервативная тактика не приносит успеха (см. врезку).
Медикаментозное лечение включает: антибиотикотерапию, противоотечную терапию, противосудорожные средства.
Антибиотикотерапия – основа медикаментозного лечения (рис. 1).
В течение последних четырех десятилетий наиболее распространенной схемой лечения было сочетание пенициллина G, 20–24 МЕ/сут внутривенно и хлорамфеникола 1–1,5 г/сут внутривенно (каждые 6 ч). Пенициллин был включен в схему, так как он активен против стрептококков (включая группу S. Intermedius) и большинства анаэробных бактерий, выделяемых у больных с АМ; эффективен при лечении АМ на экспериментальных моделях и значительно снизил смертность от АМ, начиная с 40-х годов.
Хлорамфеникол широко использовали в прошлом благодаря его способности хорошо растворяться в жировой ткани (концентрация в головном мозге нередко превышала концентрацию в плазме), а также активности против анаэробных бактерий, включая B. fragilis.
В настоящее время цефотаксим (Цефабол) в дозе 3 г внутривенно каждые 8 ч является приемлемым заменителем пенициллина, а вместо хлорамфеникола все чаще используется метронидазол.
Антибиотикотерапию начинают в предоперационном периоде (не позднее чем за 2 нед до операции). Общая продолжительность лечения составляет 6–8 нед, но не менее 4 нед после операции. Полученный в результате операции гной окрашивают по Граму и производят посевы на среды для выявления аэробных и анаэробных бактерий и грибов и определения их чувствительности к антибиотикам. Нет исследований, достоверно подтверждающих положительное влияние на исход заболевания введения антибиотиков внутрь абсцесса интраоперационно. Следует учитывать, что на стадии церебрита гематоэнцефалический барьер (ГЭБ) остается сохранным, поэтому приоритет отдается препаратам, которые хорошо проникают через него. Именно поэтому препаратом выбора является меропенем, а не имипенем, из-за его избирательной проницаемости через ГЭБ.
Вопрос о применении кортикостероидов с целью уменьшения отека в лечении АМ до сих пор остается спорным. Экспериментально доказано, что кортикостероиды ухудшают проникновение в абсцесс антибиотиков, препятствуют образованию капсулы абсцесса, а также снижают накопление контраста на КТ, что создает ложное впечатление о размерах и состоянии АМ в динамике. В исследованиях на животных использование кортикостероидов не оказало влияния на смертность от АМ, но нет и доказательств того, что они способствуют генерализации инфекции.
При внутричерепной гипертензии и угрозе дислокационного синдрома применяют маннитол (1–1,5 г/кг внутривенно в виде болюса в течение 20–30 мин).
Противосудорожные средства (например, фенитоин) показаны при наличии судорожных проявлений.
К наиболее эффективным методам хирургического лечения АМ в настоящее время относятся: дренирование абсцесса с помощью пункционной аспирации и полное удаление абсцесса.
Пункционную аспирацию целесообразно применять на начальных этапах лечения (одновременно с проведением антибиотикотерапии), особенно в стадии церебрита, при стабильном неврологическом состоянии больного, а также в случае глубокого расположения абсцесса (метод выбора) или при множественных абсцессах. Интраоперационное УЗИ и стереотаксическая биопсия под контролем КТ сделали безопасной аспирацию абсцесса практически в любой зоне мозга. Последующее лечение зависит как от клинических, так и от радиологических исследований. Ухудшение неврологического состояния, наличие воздуха в полости абсцесса или отсутствие изменений размеров абсцесса в динамике на КТ являются показаниями к немедленному хирургическому вмешательству (аспирация или удаление).
Удаление абсцесса позволяет устранить опасность рецидива АМ. Удаление абсцесса целесообразно проводить при поверхностных, легко доступных абсцессах с хорошо сформированной, плотной капсулой, а также в случае, если аспирация и/или антибиотикотерапия оказались неэффективными. После тотального, без нарушения целостности капсулы, удаления абсцесса (особенно при его поверхностном расположении), продолжительность антибиотикотерапии можно сократить до 3 сут.
Хорошее контрастирование на КТ при излеченном АМ может сохраняться от 4–10 нед до 6–9 мес. Примером может служить следующее наблюдение.
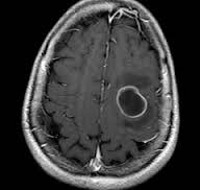
Больной З., в начале августа 1999 г. в течение 1 нед перенес ангину. Работу не прекращал, лечился самостоятельно. Через 2 нед, внезапно появилась слабость в правой руке и ноге, которая самостоятельно регрессировала спустя несколько часов и, вновь развившись через 2 дня, носила нарастающий характер, сопровождаясь быстрой утомляемостью, чувством недомогания. После госпитализации отмечено развитие приступа судорог в правой руке и ноге без потери сознания. На компьютерных томограммах в левой затылочной области определялась кольцевидной формы зона повышенной плотности с неровными, бугристыми контурами, негомогенной структурой размером 32 х 22 мм, окруженная зоной отека (рис. 2 а).
Обращали внимание отсутствие признаков ВЧГ, правосторонняя гомонимная гемианопсия, правосторонний гемипарез (сила – 2 балла), патологические рефлексы, гемигипестезия. Изменений со стороны внутренних органов выявлено не было, анализы крови и мочи в пределах нормы. С диагнозом объемное образование левой затылочной доли больному произведена операция, во время которой субкортикально на глубине около 5 мм обнаружен абсцесс с тонкой капсулой, разорвавшейся при попытке его удаления. В предварительно обложенную ватными тампонами операционную рану излилось около 15 мл густой желто-зеленой жидкости со зловонным запахом. Абсцесс был удален полностью вместе с капсулой. Образовавшаяся полость обработана 1%-ным раствором диоксидина. Бактериоскопия содержимого полости абсцесса выявила большое количество скоплений кокков. В послеоперационном периоде на фоне проводимого лечения отмечался полный регресс неврологической симптоматики: восстановилась сила в правой руке и ноге до 5 баллов, чувствительность правой ноги не нарушена, поля зрения в норме.
На контрольных томограммах спустя 2 нед (рис. 2, б) и 8 нед (рис. 2, в) после операции отмечена динамика послеоперационных изменений в виде небольшой зоны понижения плотности в левой затылочной доле.
До недавнего времени летальность от АМ оставалась на относительно стабильном уровне и составляла примерно 40–60% независимо от использования антибиотиков. И только с внедрением в практику такого метода, как КТ (МРТ), удалось снизить ее до 10% (по некоторым данным, до 11–20%). Примерно у 30–55% больных после выздоровления остается стойкий неврологический дефицит, в 29% случаев сохраняется гемипарез, а более чем у 70% выживших больных впоследствии отмечаются эпилептические припадки.
Наиболее предпочтительной остается тактика лечения, предупреждающая развитие АМ. Она включает в себя раннюю диагностику и эффективную антибиотикотерапию инфекционного заболевания, являющегося вероятным источником образования АМ. Сюда же можно отнести и применение антимикробных средств с целью профилактики хирургических инфекций. Терапия, направленная на улучшение кровоснабжения и оксигенации мозговой ткани, также является эффективной и показана для предупреждения АМ. Сочетание признаков системного воспаления с появлением оболочечной симптоматики, тем более с присоединением симтомов ВЧГ или(и) очагового поражения головного мозга, являются обязательным показанием для срочного КТ (МРТ) обследования больного с целью исключения АМ. При постановке диагноза АМ агрессивная медикаментозно-хирургическая тактика способна обеспечить успех лечения.
Список литературы Вы можете найти на сайте http://www.rmj.ru
Цефабол (торговое название)
Цефамабол (торговое название)
1. Яковлев С.В., Яковлев В.П.: Современная антибактериальная терапия в таблицах. Consilium Medicum 1999; 1(1): 18–36.
2. Chun C.H., Johnson J.D., Hofstetter M., Raff M.J.: Brain abscess. A study of 45 consecutive cases: Medicine (Baltimore) 1986 Nov; 65 (6): 415–31.
3. Ciurea V., Stoica F., Vasilescu G., Nuteanu L.: Neurosurgical management of brain abscesses in children: Acta Neuropathologica: 1998; 46: 3.
4. Dolan R.W., Chowdhury K.: Diagnosis and treatment of intracranial complications of paranasal sinus infections: J Oral Maxillofac Surg 1995 Sep; 53(9): 1080–7.
5. Hagensee M.E. et al.: Brain abscess following marrow transplantation: Experience at the Fred Hutchinson Cancer Research Center, 1984-1992. Clin Infect Dis, 1994; 19: 402.
6. Haimes A.B., Zimmerman R.D., Morgello S, et al.: MRimaging of brain abscesses. AJR Reviews MRI of brain abscesses and its differential diagnosis.1989; 152: 1073.
7. Levy R.M.: Brain abscess and subdural empyema. Curr Opin Neurol 1994; 7: 223.
8. Maniglia A.J., Goodwin W.J., Arnold J.E., et al.: Intracranial abscesses secondary to nasal, sinus, and orbital infections in adults and children. Arch Otolaryngol Head Neck Surg Association of sinus disease with brain abscesses is reviewed. 1989; 115: 1424.
9. Ostermann S., Schmal F.: Epidural hematoma with secondary penetration into the middle ear. An uncommon differential diagnosis of otogenic brain abscess: Acta Neuropathologica: 1999; 9: 3.
10. Patel K.S., Marks P.V.: Management of focal intracranial infections: Is medical treatment better than surgery? Discussion of the issue of nonsurgical management. J Neurol Neurosurg Psychiatry 1990; 53: 472.
11. Rosenfeld E.A., Bowley A.H.: Infectious complications of sinusitis, other than meningitis in children: 12 year review. Clin Infect Dis 1994; 18: 750.
12. Seydoux C.H., Francioli P.: Bacterial brain abscesses: Factors influencing mortality and sequel. Clin Infect Dis 1992; 15: 394.
13. Sjolin J et al: Treatment of brain abscess with cefotaxime and metronidazole: Prospective study of 15 consecutive patients. Clin Infect Dis 1993; 17: 857.
14. Stephens D.S., Farley M.M.: Pathogenetic events during infection of the human nasal pharynx with Neisseria meningitidis and Haemophilus influenzae. Rev Infect Dis 1991; 13: 22.
15. Takeshita M., Kagawa M., Izawa M., Takakura K.: Current Treatment Strategies and Factors influencing Outcome in Patients with Bacterial Brain Abscess: Acta Neuropathologica 1998; 12: 140.
16. Wispelwey B., Scheld W.M.: Brain abscess, in Infections of the Central Nervous System, 2d ed, WM Scheld et al (eds). New York, Lippincott-Raven, 1997; 463–94.
17. Yang S.Y., Zhao C.S.: Review of 140 patients with brain abscess. Surg Neurol Clinical features, bacteriology, imaging, and treatment discussed. 1993; 39: 290.
| Приложения к статье |
| Источники и факторы риска АМ 1. При контактном распространении: • отит и мастоидит (абсцессы височной доли и мозжечка); • синусит (абсцесс лобной доли); 2. При гематогенном распространении: • у взрослых: инфекционные заболевания легких (абсцессы, бронхоэктазы, эмпиема); • у детей: врожденные пороки сердца со сбросом крови справа налево (у 4–7% детей с этой патологией); • легочные артериовенозные фистулы, наследственная геморрагическая телеангиэктазия (у 5% больных с этой врожденной патологией); • бактериальный эндокардит (редко); • бактериемия, связанная с внечерепными очагами инфекции, в т. ч. при стоматологических и иных манипуляциях. В 15–20% случаев источник АМ выявить не удается. |
| Максимально эффективной медикаментозная терапия может быть в следующих случаях: 1. Лечение начато в стадии церебрита. 2. Абсцесс имеет небольшие (0,8–2,5 см) размеры. 3. Продолжительность симптомов не превышает 2 нед. 4. Отмечается явное клиническое улучшение в течение 1 нед после начала лечения. Консервативное лечение применяется: 1. При множественных или недоступных для хирургического вмешательства абсцессах. 2. При сопутствующем менингоэнцефалите. 3. При высоком риске хирургического вмешательства. источник |